治疗异位性皮肤炎的方法与流程
治疗异位性皮肤炎的方法
1.相关申请案
2.本技术主张2019年12月31日申请的第271778号以色列专利申请案的优先权,其内容在此通过引用其整体并入本文中。
3.技术领域及
背景技术:
4.本发明在其一些实施例中是有关异位性皮肤炎的治疗。
5.异位性皮肤炎(atopic dermatitis,ad)是一种复发缓解型慢性湿疹瘙痒皮肤病(remitting-relapsing chronic eczematous pruritic skin disease),是最常见的炎症性皮肤病之一,影响高达20%的儿童及高达10%的成人1。ad的所述病因是多因素的,包括遗传诱因、免疫失调及免疫偏差,主要是th2/th22及一些th1和th17过度表达、皮肤屏障功能缺陷、异常微生物定植(colonization)以及多个环境因素。近20%的所有病例被认为是中度或重度,影响生活质量,并造成心理、社会和经济的负担2。
6.直到最近,异位性皮肤炎的所述治疗阶梯包括使用多种保湿剂和多种局部治疗(主要是多种局部皮质类固醇和多种钙调神经磷酸酶抑制剂(calcineurin inhibitors))、光照疗法及多种免疫抑制剂(例如环孢素a(cyclosporine a)或胺甲叶酸(methotrexate))的干性皮肤护理3。dupilumab是一种抑制il-4及il-13信号传导的全人源单克隆抗体,是第一个也是唯一一个获准用于中度至重度ad的靶向生物治疗。其他多个单克隆抗体以及靶向多种细胞激素的多个小分子(多个janus激酶抑制剂)及涉及ad的多个细胞激素受体下游的多个细胞间信号传导通路2正在研究中。
7.几项研究探讨了微生物群在ad中的所述角色,重点是所述皮肤微生物群,特别是金黄色葡萄球菌
4,5
。然而,最近的证据支持所述肠-皮肤轴的所述重要性,可能是通过肠道微生物的多个抗原和多个代谢物的所述免疫调节和多个免疫活化能力6。根据所述卫生假说,ad与一早期接触多个微生物制剂之间存在一逆关系6。婴儿期肠胃炎以及出生后第一年接触抗生素与儿童ad相关
7,8
。的確,多个ad患者已证实肠道微生物菌丛失调9。此外,益生菌对ad严重程度有一积极影响,改变所述肠道微生物群,并可以传播多个调节t细胞的诱导
10,11
。
8.额外的背景技术包括:
9.第20160317653号美国专利申请案;
10.zeng等人,免疫学研究杂志2019年卷,文章id 1603758。
11.craig等人,兽医医学与科学。2016年5月;2(2):95-105。
技术实现要素:
12.根据本发明的一些实施例的一方面,提供了一种在一有需要的受试者中治疗异位性皮肤炎(atopic dermatitis,ad)的方法,所述方法包含向所述受试者施用一治疗上有效量的至少两个物种的细菌,从而治疗所述异位性皮肤炎,其中所述至少两个物种的所述细菌选自由以下组成的所述群组:sgb_1636普雷沃菌(prevotella)、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌(prevotella_copri)、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626
粪便普雷沃菌、sgb_1613普雷沃菌种(prevotella_sp)_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种(megasphaera_sp)_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科(prevotellaceae)、sgb_6796霍尔德曼氏菌(holdemanella)、sgb_714史密斯甲烷短杆菌(methanobrevibacter smithii)、sgb_6778链型杆菌(catenibacterium)_mitsuokai、sgb_6783链型杆菌种(catenibacteriumsp)_cag_290、sgb_1614普雷沃菌种_cag_732,sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌(megasphaera elsdenii)、sgb_4196反刍梭菌(ruminiclostridium)、sgb_4197反刍梭菌、sgb_5904光冈菌(mitsuokella)_jalaludinii、sgb_4289真杆菌(eubacterium)、sgb_4290真杆菌种(eubacterium_sp)_cag_202、sgb_1891粪居拟杆菌(bacteroides coprocola)、sgb_4936人罗斯氏菌(roseburia hominis)、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌(faecalibacterium_prausnitzii)、sgb_5111梭菌种(clostridium sp)_cag_127、sgb_5803小类杆菌种(dialister sp)_cag_357、sgb_4933直肠真杆菌(eubacterium rectale)、sgb_5113梭菌(clostridium)、sgb_5117规则类球菌(coprococcus eutactus)、sgb_5785考拉杆菌种(phascolarctobacterium_sp)_cag_266、sgb_4938罗斯氏菌种(roseburia_sp)、sgb_5805小类杆菌(dialister)、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌(paraprevotella)_clara、sgb_15265厚壁菌门细菌(firmicutes_bacterium)_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目(clostridiales)_未分类、sgb_15091颤杆菌(oscillibacter)、sgb_15090颤杆菌种(oscillibacter_sp)_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌(akkermansia muciniphila)、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌(blautia)、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌(bacteroides)_faecis、sgb_15028厚壁菌门(firmicutes)_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌(acetanaerobacterium)、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌(bifidobacterium_adolescentis)、sgb_2290理研菌科(rikenellaceae)、sgb_5075解果胶毛螺菌(lachnospira_pectinoschiza)、sgb_2325芽孢杆菌(alistipes indistinctus)、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科(lachnospiraceae)、sgb_4940食葡糖罗斯氏菌(roseburia inulinivorans)、sgb_5045凸腹真杆菌(eubacterium ventriosum)及sgb_9283华德萨特氏菌(sutterella wadsworthensis),其中所述细菌不包含在一粪便微生物移植(faecal microbiota transplantation,fmt)中。
13.根据本发明的一些实施例的一方面,提供了一种使用一治疗上有效量的至少两个物种的细菌于一有需要的受试者中治疗异位性皮肤炎(ad)的用途,其中所述至少两个物种的所述细菌选自由以下组成的所述群组:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌
种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌,其中所述细菌不包含在一粪便微生物移植(fmt)中。
14.根据本发明的一些实施例的一方面,提供了一种在一有需要的受试者中治疗异位性皮肤炎(ad)的方法,所述方法包含向所述受试者施用一治疗上有效量的两个至100个物种之间的细菌,从而治疗所述异位性皮肤炎,其中所述多个物种中的至少两个选自由以下组成的所述群组:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真
杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌。
15.根据本发明的一些实施例的一方面,提供了一种使用一治疗上有效量的两个至100个物种之间的细菌于一有需要的受试者中治疗异位性皮肤炎(ad)的用途,其中所述多个物种中的至少两个选自由以下组成的所述群组:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌。
16.根据本发明的一些实施例的一方面,提供了一种组合物,所述组合物包含一治疗上有效量的两个至100个物种之间的细菌,其中所述多个物种中的至少两个选自由以下组成的所述群组:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪
居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌。
17.根据本发明的一些实施例,所述细菌属于所述普雷沃菌属、霍尔德曼氏菌属及/或巨球型菌属。
18.根据本发明的一些实施例,所述细菌包含在一定义明确的制剂中。
19.根据本发明的一些实施例,所述细菌包含以下中的至少一种:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌;sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1653普雷沃菌;或sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1624普雷沃菌。
20.根据本发明的一些实施例,所述组合物中少于10%的所述细菌属于所述梭菌属。
21.根据本发明的一些实施例,所述组合物中少于10%的所述细菌属于以下所述多个物种:撤丁岛梭菌(clostridium absonum)、阿根廷梭菌(clostridium argentinense)、巴氏梭菌(clostridium baratii)、双酶梭菌(clostridium bifermentans)、肉毒梭菌(clostridium botulinum)、丁酸梭菌(clostridium butyricum)、尸毒梭菌(clostridium cadaveris)、犬梭菌(clostridium camis)、隐藏梭菌(clostridium celatum)、气肿疽梭菌(clostridium chauvoei)、梭状芽孢杆菌(clostridium clostridioforme)、匙形梭菌(clostridium cochlearium)、难辨梭菌(clostridium difficile)、谲诈梭菌(clostridium fallax)、费新尼亚梭菌(clostridium felsineum)、革氏梭菌(clostridium ghonii)、乙二醇梭菌(clostridium glycolicum)、溶血梭菌(clostridium haemolyticum)、极尖蒂西耶菌(clostridium hastiforme)、溶组织梭菌(clostridium histolyticum)、吲哚梭菌(clostridium indolis)、无害芽胞梭菌(clostridium innocuum)、不规则梭菌(clostridium irregulare)、泥渣梭菌(clostridium limosum)、坏名梭菌(clostridium malenominatum)、诺氏梭菌(clostridium novyi)、乳清酸梭菌(clostridium oroticum)、类腐败梭菌(clostridium paraputrificum)、产气荚膜梭菌(clostridium perfringens)、毛状梭菌(clostridium piliforme)、腐化梭菌
(clostridium putrefaciens)、腐败梭菌(clostridium putrificum)、多枝梭菌(clostridium ramosum)、沙丁酸梭菌(clostridium sardiniense)、煎盘梭菌(clostridium sartagoforme)、裂解梭菌(clostridium scindens)、败毒梭菌(clostridium septicum)、索氏梭菌(clostridium sordellii)、楔形梭菌(clostridium sphenoides)、螺状梭菌(clostridium spiroforme)、产芽胞梭菌(clostridium sporogenes)、近端梭菌(clostridium subterminale)、共生梭菌(clostridium symbiosum)、第三梭菌(clostridium tertium)、破伤风梭菌(clostridium tetani)、魏氏梭菌(clostridium welchii)、及/或绒毛梭菌(clostridium villosum)。
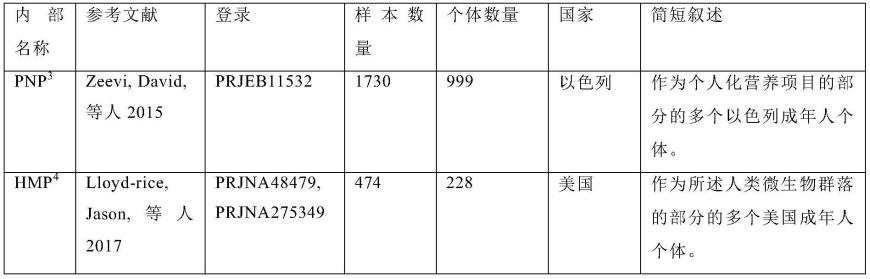
22.根据本发明的一些实施例,所述施用包含口服施用。
23.根据本发明的一些实施例,所述施用包含局部施用。
24.根据本发明的一些实施例,所述细菌被配制用于局部施用。
25.根据本发明的一些实施例,所述细菌是冷冻干燥的或喷雾干燥的。
26.根据本发明的一些实施例,所述受试者是一成年受试者。
27.根据本发明的一些实施例,所述受试者为3-18岁。
28.根据本发明的一些实施例,所述受试者表现出scorad分数》25的中度至重度ad。
29.根据本发明的一些实施例,与使用所述细菌治疗之前的所述受试者的scoard分数相比,所述治疗上有效量的所述细菌导致所述scorad分数降低至少40%。
30.根据本发明的一些实施例,与使用所述细菌治疗之前的所述受试者的scoard分数相比,所述治疗上有效量的所述细菌导致所述scorad分数的一降低,所述降低在使用所述细菌进行第一次循环治疗后维持至少10周。
31.根据本发明的一些实施例,所述治疗上有效量的所述细菌导致所述细菌在所述受试者的所述肠道中定植。
32.根据本发明的一些实施例,所述方法进一步包含使用除所述细菌之外的一抗ad疗法治疗所述受试者。
33.除非另有定义,否则本文使用的所有技术及/或科学术语具有与本发明所属领域的普通技术人员通常理解的相同含义。尽管与本文所述的多种方法及多个材料相似或等效的方法和材料可用于本发明多个实施例的实践或测试,但多个示例性方法及/或材料于下文描述。如有冲突,以专利说明书(包括定义)为准。此外,这些材料、方法和示例仅是说明性的,并不意味着必然是限制性的。
附图说明
34.在此仅通过示例的方式参考所述多个附图描述本发明的一些实施例。现在详细地具体参考所述多个附图,强调所示的多个细节是通过示例的方式并且出于对本发明的多个实施例的说明性讨论的目的。对此,对本领域技术人员而言,结合所述多个附图进行的描述使如何实施本发明的多个实施例变得显而易见。
35.在所述多个附图中:
36.图1是说明根据本发明的一些实施例的一研究设计的一架構。
37.图2a至2c图2a:多个物种的菌株水平的多个相异性。盒形图表示来自两个健康参考种群的多个不同个体之间的多个相异性。多个盒限制表示25和75个分位数,而所述多条
须表示5和95个分位数。多个点是多个后fmt患者样本与其多个各自供体样本之间的多个相异性,按患者着色。多个相异性从底部到所述检测阈值(5e-5,短划线)被剪裁。图2b:多个物种检测到的传播事件数量,按患者着色。图2c:物种-供体传播表。所述最上面一行总结了上述供体指示的每位患者的传播物种数量-“主要供体(次要供体)”。
38.图3是显示多个患者的scorad随研究时间的多个变化的一图表。黑线表示多个可指控患者的所述平均scorad(患者6除外)。多条垂直线表示多个安慰剂治疗和多次fmt。
39.图4是显示长期追踪患者2和11的scorad随时间的多个scorad变化的一图表。多条垂直线表示多个安慰剂治疗和多次fmt。
40.图5a至5b显示了fmt后多个患者的多个肠道细菌菌株的多个变化。图5a:与基线相比,来自患者11的多个样本的多个细菌菌株在fmt后随时间的相异性。灰线表示多个不同的物种(左轴),黑线表示所述平均相异性(右轴)。多条垂直线表示多个安慰剂治疗和多次fmt。多个相异性从底部到所述检测阈值(5e-5,水平灰色短划线)被剪裁。图5b:与(图5a)相同,但将来自患者11的多个样本的多个细菌菌株与供体1的所述样本进行比较,后者的粪便用于患者11的所述fmt。
41.图6显示了多个患者的多个样本在fmt后变得与多个供体样本相似。t-sne(t-随机邻近嵌入法)分析基于具有可用的多个前fmt和后fmt样本(n=8)及多个供体的多个样本(n=3)的多个患者的样本-相异性矩阵,显示多个患者样本向其捐供体集群的转变。多个箭头显示了从多个基线样本(多个方形标记)通过多个安慰剂样本(多个菱形标记)到多个后fmt样本(多个圆形标记)的所述路径。比色表与所述患者的主要供体相匹配。多个空椭圆包含所述供体的多个样本,多个实心椭圆包含患者后fmt的多个样本。
42.图7是显示fmt后多个患者和多个供体的多个细菌菌株的临床改善与相似性之间的相关性的一图表。多个点对应于个别患者的多个样本,通过它们与其供体的相异性(x轴)与所述样本时所述scorad分数从基线的所述降低(y轴)绘制。多个箭头显示了从多个安慰剂样本(多个菱形标记)到多个后fmt样本的所述路径。多个椭圆包含。
43.图8是显示用于多次fmt胶囊的多个供体粪便样本和在所述研究期间从所述多个患者收集的多个粪便样本的一表格,这些样本使用illumina nextseq定序成多个总体基因组读数。
具体实施方式
44.本发明在其一些实施例中是有关异位性皮肤炎的治疗。
45.在详细解释本发明的至少一个实施例之前,应当理解的是,本发明的应用不一定限于以下描述中阐述的或通过所述多个示例举例说明的所述多个细节。本发明能够具有其他多个实施例或能够以各种方式实践或执行。
46.异位性皮肤炎(ad)是一种复发缓解型慢性湿疹瘙痒皮肤病,影响高达20%的儿童及高达10%的成人。它是一种受遗传、免疫、表皮功能异常和多个环境因素影响的多因素疾病。
47.在构思本发明的多个实施例的同时,本案发明人试图识别可用于所述ad治疗的肠道微生物群衍生的多个细菌物种。
48.本案发明人在十名患有中度至重度异位性皮肤炎、对局部和全身治疗反应不足的
成年患者中进行了一项前瞻性、单盲、安慰剂对照的交叉试验先期研究。所有患者接受2次安慰剂粪便移植,然后每隔2周接受来自多个健康供体的4次fmt。在所述研究开始时、每次fmt之前及最后一次fmt后1-8个月,通过所述异位性皮肤炎严重度评分分数(scoring atopic dermatitis score,scorad分数)评估所述ad的严重程度和所述粪便微生物组概况。这项研究的多个结果显示,所述两次安慰剂移植后所述ad的严重程度没有显着变化(scorad增强2.5%
±
22.1%,wilcoxon p》0.85)。在所有四剂fmt后两周,所述scorad分数有一显着降低(59.2%
±
34.9%,wilcoxon p《0.02)。所述干预期间和所述追踪期间的所述最大分数降低甚至更高(84%
±
7%,wilcoxon p《0.008)。对多个患者和多个供体的所述粪便微生物群的总体基因组分析显示,多个细菌菌株从多个供体向多个患者传播,一些供体菌株被传播给所述普雷沃菌属突出的多个患者。在所述研究和追踪期间没有记录到不良事件。
49.因此,建议fmt作为ad的一治疗性干预是安全且有效的,例如所述患有一中度至重度疾病的多个受试者。
50.因此,根据本发明的一方面,提供了一种在一有需要的受试者中治疗异位性皮肤炎(ad)的方法,所述方法包含向所述受试者施用一治疗上有效量的至少两个物种的细菌,从而治疗所述异位性皮肤炎,其中所述至少两个物种的所述细菌选自由以下组成的所述群组:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌,其中所述细菌不包含在一粪便微生物移植(fmt)中。
51.根据本发明的一方面,提供了一种使用一治疗上有效量的至少两个物种的细菌于
一有需要的受试者中治疗异位性皮肤炎(ad)的用途,其中所述至少两个物种的所述细菌选自由以下组成的所述群组:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌,其中所述细菌不包含在一粪便微生物移植(fmt)中。
52.根据本发明的一方面,提供了一种在一有需要的受试者中治疗异位性皮肤炎(ad)的方法,所述方法包含向所述受试者施用一治疗上有效量的两个至100个物种之间的细菌,从而治疗所述异位性皮肤炎,其中所述多个物种中的至少两个选自由以下组成的所述群组:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普
氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌。
53.根据本发明的一方面,提供了一种使用一治疗上有效量的两个至100个物种之间的细菌于一有需要的受试者中治疗异位性皮肤炎(ad)的用途,其中所述多个物种中的至少两个选自由以下组成的所述群组:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌。
54.根据一额外或替代的实施例,提供了一种组合物,所述组合物包含一治疗上有效量的两个至100个物种之间的细菌,其中所述多个物种中的至少两个选自由以下组成的所述群组:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普
雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌。
55.根据本发明的一实施例,所述细菌属于所述普雷沃菌属、霍尔德曼氏菌属及/或巨球型菌属。
56.根据本发明的一实施例,所述细菌包含在一定义明确的制剂中。
57.根据本发明的一实施例,所述细菌包含以下中的至少一种:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌;sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1653普雷沃菌;或sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1624普雷沃菌。
58.根据本发明的一实施例,至少20%、30%或40%的所述施用的细菌属于所述普雷沃菌属,也称为一富含普雷沃菌的组合物。
59.所述治疗的改善可能与粪便材料衍生的细菌直接或间接的有关。
[0060]“直接从一粪便材料中分离”的细菌不是由会导致或旨在导致在获得所述粪便材料后所述种群的复制的任何培养或其他过程产生的(在本文中也称为“fmt”)。
[0061]
根据一具体实施例,所述细菌包含在一定义明确的制剂中。
[0062]
如本文所用,“明确定义的”是指其中所述多种微生物的所述身份是先验已知的一细菌培养物。尽管可能存在一定程度的污染,但这通常不超过所述微生物种群的10%,并且在所述明确定义的制剂中所述其余至少90%的所述多种微生物在施用前是已知的。
[0063]
如本文所用,所述术语“异位性皮肤炎”或“ad”是指以剧烈瘙痒(例如严重瘙痒)、干燥症(例如异常干燥的皮肤)、红斑性结痂皮疹、苔藓化、一受损的皮肤屏障以及鳞状和干
燥的湿疹病变。
[0064]
异位性皮肤炎包括,但不限于由表皮屏障功能异常、过敏(例如对某些食物、花粉、霉菌、尘螨、动物等过敏)、辐射暴露及/或气喘引起,或与表皮屏障功能异常、过敏(例如对某些食物、花粉、霉菌、尘螨、动物等过敏)、辐射暴露及/或气喘相关的ad。在许多情况下,多种慢性ad病变包括多个增厚的皮肤斑块、苔藓化及多个纤维性丘疹。
[0065]
如本文所用,所述术语“受试者”是指一哺乳动物。多种哺乳动物包括,但不限于多种驯养动物(例如乳牛、绵羊、猫、狗和马)、多种灵长类动物(例如人类和非人类灵长类动物例如猴子)、多只兔子及多种啮齿动物(例如小鼠和大鼠)。在某些实施例中,所述受试者是一人类。在一些实施例中,本文中的一“个体”或“患者”或“受试者”是有资格接受治疗且正在经历或已经经历异位性皮肤炎的任何单个人类受试者。
[0066]
根据一具体实施例,所述人类受试者是一成人,即,18岁或以上,例如,大于20、25、30、35、40、45、50、55或60岁。所述受试者可以是一年长者,例如大于65、70、75或80岁的一受试者。
[0067]
根据另一具体实施例,所述人类受试者是小儿科的,即,小于18岁(例如,2-12、12-18、2-11、12-18、2-4、2-6、6-12、12-18、1-4、5-8、9-15岁)。
[0068]
在一些实施例中,所述受试者是一儿童,例如11、10、9、8、7、6、5、4、3、2或1岁或更小的一受试者。所述受试者可以是一婴儿,例如小于1岁的一受试者。
[0069]
所述受试者可以是免疫功能低下的或可以具有一完整的免疫系统(免疫健全的)。
[0070]
在根据本发明的一些实施例进行治疗之前,可以用各种ad的常规或非常规药物/治疗来治疗所述受试者,一些在下文详述。
[0071]
替代地,所述受试者可以是一未经治疗的受试者(例如,至少在根据本发明的一些实施例的所述治疗的所述开始之前的最后6-12个月),因此这样的一受试者也被称为“单纯的”。
[0072]
可使用“hanifin/rajka标准”诊断异位性皮肤炎。hanifin/rajka诊断标准描述于acta derm venereol(stockh)1980;suppl.92:44-7。要确立异位性皮肤炎的一诊断,所述患者需要以下列出的至少3个“基本特征”和3个或多次要特征的所述存在。所述基本特征包括瘙痒、典型的型态和分布,例如弯曲苔藓化或线性、慢性或慢性地复发的皮肤炎,以及特异反应的个人或家族史,例如气喘、过敏性鼻炎、异位性皮肤炎。所述多个次要特征包括干燥症、鱼鳞病、掌纹症或毛角化病、即时(1型)皮肤试验反应性、血清ige升高、发病年龄早、多个皮肤感染倾向(尤其是金黄色葡萄球菌和单纯疱疹)、受损的细胞介导的免疫、非特异性手足皮肤炎倾向、乳头湿疹、唇炎、复发性结膜炎、dennie-morgan眼睑下皱褶、圆锥角膜、前囊下白内障、眼眶变黑、面部苍白/面部红斑、白色糠疹、多个前颈皱襞、出汗时会痒。额外次要标准包括对羊毛和多种脂质溶剂的不耐受、毛囊周围突出、食物不耐受、受多个环境或情绪因素影响的病程、以及白色皮肤划纹症/延发性白斑。
[0073]
异位性皮肤炎的所述严重程度可以通过“rajka/langeland标准”确定,如rajka g和langeland t的acta derm venereol(stockh)1989;144(suppl.):13-4中所述。三个疾病严重程度评估类别从1到3进行评分:i)所述涉及的身体区域的范围,ii)病程,例如在一年或连续病程中超过或少于3个月,以及iii)强度,从轻微瘙痒到严重瘙痒,通常会扰乱夜间睡眠。允许1.5或2.5的分数。总体疾病严重程度由所述三个疾病评估类别的多个个体分数
的总和确定,而所述严重程度由这些分数的总和确定,轻度定义为一总分3-4,中度为一总分4.5-7.5,及重度为一总分8-9。
[0074]
所述术语“异位性皮肤炎疾病严重程度结果测量”或“addsom”是指确定与异位性皮肤炎相关并且可以定量或定性评估的某些征象、症状、特征或参数。示例性多个addsom包括,但不限于“湿疹面积和严重程度指数”(east)、“异位性皮肤炎严重度评分”(scorad)、“研究者总体评估”(iga)、“研究者总体征象评估”(igsa)、rajka/langeland异位性皮肤炎严重程度分数、以及多个患者报告的结果,包括但不限于瘙痒视觉类比量表(作为scorad的部分评估的疾病严重程度的一个方面)、睡眠丧失视觉类比量表(作为scorad的部分评估的疾病严重程度的一个方面)、异位性皮肤炎症状日记(adsd)、异位性皮肤炎影响问卷(adiq)、皮肤病生活质量指数(dlqi)(finlay和khan,clin exper dermatol 1994;19:210)、以及5-d搔痒量表(elman等人,br j dermatol 2010;162(3):587-593)。
[0075]
所述“湿疹面积和严重程度指数”或“east”是在多个临床环境中用于评估所述ad的严重程度和范围的一经过验证的方法,hanifin等人,exp dermatol 2001;10:11-18。四个个别的身体区域由一临床医师或其他医疗专业人员评估:头部和颈部(h&n)、上肢(ul;包括所述外部腋窝和双手)、躯干(包括所述内部腋窝和鼠蹊部)及下肢(ll;包括所述臀部和双脚)。对于每一个身体区域,评估所述受影响的身体表面积(bsa),并为受影响的bsa的百分比(0%-100%)指定0到6的一分数(或可选地0-7,其中0表示没有发疹);每一个区域的平均严重程度(0-3:无、轻度、中度、重度)分别针对四种临床征象中的每一种进行多个半步评级:红斑、硬结丘疹、表皮剥落和苔藓化。为每一个身体区域指定0到12的一总分;基于所述多个个别临床征象的分数(最大值=12)/次、受影响区域分数(最大值=6)/次、所述身体区域指数(h&n
‑‑
0.1、ul
‑‑
0.2、躯干
‑‑
0.3、ll
‑‑
0.4)的所述总和来指定一全身区域分数。基于所述四个身体区域分数中的每一个的总分的所述总和指定一总分(0-72)。
[0076]
所述“研究者总体评估”或“iga”是一种用于多个临床环境的评估方法,用于根据一五点量表确定所述ad的严重程度和临床对治疗的反应。0的一分数(清除)意味着没有异位性皮肤炎的炎症征象,而1的一分数(几乎清除)意味着只有可察觉的红斑和可察觉的丘疹硬结。2、3或4的分数(轻度、中度、重度)是基于红斑、丘疹硬结、渗泌和结痂的所述严重程度。所述“研究者总体征象评估”或“igsa”基于对红斑、水肿、多个苔藓化的斑块或丘疹和表皮剥落的一评估,使用从清除到严重的一病变评估等级。此外,所述评估的病变等级可以根据所述皮肤病变的所述范围和位置升级或降级。
[0077]
所述“异位性皮肤炎严重度评分”或“scorad”是由所述欧洲异位性皮肤炎特别工作组(european task force on atopic dermatitis)开发的ad的所述严重程度的一临床评估(共识报告,dermatology 1993;186:23-31)。对疾病严重程度的三个方面进行评分:(i)受炎症影响的身体区域的所述范围,评分在0-100之间,在所述总分中指定为“a”,(ii)六种临床征象、红斑、水肿/丘疹、渗泌/结痂、表皮剥落、苔藓化和干燥的所述强度,根据严重程度(无、轻度、中度、重度)分别指定0-3的一分数,一总分范围为0-18,在所述总分中指定为“b”,以及(iii)使用多个患者报告结果的两项主观测量,所述瘙痒视觉类比分数(范围从0[无瘙痒]到10[可想象的最严重的瘙痒])和所述睡眠丧失视觉类比分数(范围从0[无睡眠丧失]到10[可想象的最严重的睡眠丧失]),每一个都是过去三天或三夜的所述平均值,在所述总分中指定为“c”。根据所述公式:a/5+(7b/2)+c确定所述总分(0-103)。
[0078]
根据scorad,轻度通常定义为25以下,中度通常定义为25-50,而重度通常定义为50以上。
[0079]
一“物种”可以通过核心基因组亲缘分析和ani的一组合来定义,这为多个细菌物种的描绘提供了一适当的方法,其中多个细菌物种被定义为具有至少95%成对ani的多个基因组的多个分离物的多个单系群。
[0080]
当提到所述多个细菌物种的数量时,它是指多个不同的细菌物种。
[0081]
所述组合物可以包括其他多个微生物,例如酵母、真菌等。
[0082]
本发明的这方面的所述组合物可包含2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20种不同的物种的细菌。
[0083]
根据一具体实施例,所述多种方法及/或多个组合物利用2-100、2-50、2-40、2-30种不同的细菌物种,例如2-50、2-40、2-30、2-20、2-18、2-15、2-12、2-10、2-8、2-5、2-4、2-3、3-20、3-18、3-15、3-12、3-10、3-8、3-5、3-4、4-20、4-18、4-15、4-12、4-10、4-8、4-5、5-20、5-18、5-15、5-12、5-10、5-8、6-20、6-18、6-15、6-12、6-10、6-8、7-20、7-18、7-15、7-12、7-10、7-8、8-20、8-18、8-15、8-12、8-10、9-20、9-18、9-15、9-12、9-10、10-20、10-18、10-15、10-12、11-12、12-15、12-18、12-20、14-16、14-18、14-20或15-20、10-50、12-50、14-50、16-50、18-50、20-50、25-50、30-50、35-50或40-50、10-40、12-40、14-40、16-40、18-40、20-40、25-40、30-40、35-40、10-30、12-30、14-30、16-30、18-30、20-30、25-30。
[0084]
在一个实施例中,所述细菌以一组合物的形式提供(例如,一种组合物,其中所有所述多个菌株组合在一单个组合物中;或更多,其中至少一些菌株以多个不同的组合物提供),由此根据一些实施例,所述组合物是一益生菌组合物。
[0085]
如本文所用,所述片语“益生菌组合物”是指包含多个活的微生物的一组合物,当以足够的量施用时,其赋予所述宿主一健康益处。多个益生菌在施用时通常是活的,根据体内测试以及在使用和储存期间具有活力和可重复性。
[0086]
在一个实施例中,所述组合物的至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%的所述细菌是有活力的。
[0087]
根据本发明的一些实施例,本发明设想用包含所述以下物种中的至少两种的多个组合物进行治疗或设想包含所述以下物种中的至少两种的多个组合物:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_
15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌。
[0088]
根据本发明的一些实施例,本发明设想用包含所述以下物种中的至少三种的多个组合物进行治疗或设想包含所述以下物种中的至少三种的多个组合物:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌。
[0089]
根据本发明的一些实施例,本发明设想用包含所述以下物种中的至少四种的多个组合物进行治疗或设想包含所述以下物种中的至少四种的多个组合物:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612
普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌。
[0090]
根据本发明的一些实施例,本发明设想用包含所述以下物种中的至少五种的多个组合物进行治疗或设想包含所述以下物种中的至少五种的多个组合物:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_
15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌。
[0091]
根据本发明的一些实施例,本发明设想用包含所述以下物种中的所有的多个组合物进行治疗或设想包含所述以下物种中的所有的多个组合物:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌。
[0092]
在一个实施例中,所述组合物包含不超过三种、不超过四种、不超过五种、不超过六种、不超过七种、不超过八种、不超过九种、不超过十种的细菌物种。
[0093]
在一个实施例中,所预期的组合物中至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或甚至99%的所述细菌属于所述普雷沃菌属。
[0094]
在一个实施例中,所述组合物中至少30%、35%、40%、45%、50%、55%、60%、65%或甚至70%的所述细菌属于以下所述物种:
[0095]
sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌;
[0096]
sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1653普雷沃菌;或
[0097]
sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1624普雷沃菌的至少一种。
[0098]
在一个实施例中,所述组合物中至少0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%的所述细菌属于以下所述物种:
[0099]
sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌;
[0100]
sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1653普雷沃菌;或
[0101]
sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1624普雷沃菌的至少一种。
[0102]
根据一具体实施例,本文所述的所述多个治疗及/或所述多个组合物包含少于20%、10%、8%、5%或甚至少于1%的所述梭菌属的细菌。
[0103]
根据一具体实施例,本文所述的所述多个治疗及/或所述多个组合物包含少于20%、10%、8%、5%或甚至少于1%的所述多个细菌种类:撤丁岛梭菌、阿根廷梭菌、巴氏梭菌、双酶梭菌、肉毒梭菌、丁酸梭菌、尸毒梭菌、犬梭菌、隐藏梭菌、气肿疽梭菌、梭状芽孢杆菌、匙形梭菌、难辨梭菌、谲诈梭菌、费新尼亚梭菌、革氏梭菌、乙二醇梭菌、溶血梭菌、极尖蒂西耶菌、溶组织梭菌、吲哚梭菌、无害芽胞梭菌、不规则梭菌、泥渣梭菌、坏名梭菌、诺氏梭菌、乳清酸梭菌、类腐败梭菌、产气荚膜梭菌、毛状梭菌、腐化梭菌、腐败梭菌、多枝梭菌、沙丁酸梭菌、煎盘梭菌、裂解梭菌、败毒梭菌、索氏梭菌、楔形梭菌、螺状梭菌、产芽胞梭菌、近端梭菌、共生梭菌、第三梭菌、破伤风梭菌、魏氏梭菌、及/或绒毛梭菌。
[0104]
本发明的所述多个组合物可以进行ph调节。为了便于施用,它们可以包装成多个单个剂量单位,也可以将每一种细菌物种包装成多个剂量单位。
[0105]
在一些实施例中,可以将所述细菌或包含所述细菌的所述多个组合物冷冻干澡或喷雾干燥并冷冻或在一无菌容器中储存,以便在使用前立即重新悬浮。所述多个细菌组合物可以用无菌水、一弱酸性溶液、凝胶或缓冲液重新悬浮。
[0106]
所述受试者可以在用所述细菌组合物治疗之前用一抗生素治疗。可以提供所述抗生素至少2天、至少3天、至少4天、至少5天、至少6天、至少七天或更长时间。
[0107]
在又一实施例中,本文所述的所述细菌被掺入一医药产品或组合物中。多个医药组合物包含本文所述的一治疗上有效量的的所述细菌(例如组合物)和通常一种或多种医药上可接受的载体或赋形剂(其在下文讨论)。
[0108]
在一些实施方案中,所述医药组合物用于口服、局部、鼻腔、呼吸道、肠胃外、腹膜内、静脉内、动脉内、经皮、舌下、肌肉内、直肠、经颊、眼内、皮下、脂肪内、关节内或鞘内施用。本公开内容涵盖本文所述的所述细菌的多种制剂,在一些实施例中,这些制剂是粉末、片剂、胶囊(例如,在一层或多层中,例如两层或多层中)或以其他方式配制用于口服施用。
[0109]
本发明的所述细菌还可以配制成一直肠组合物,例如一栓剂或含有多个常规栓剂基质如可可脂或其他多种甘油酯的一保留灌肠剂。
[0110]
所述多个组合物可以作为多个医药组合物、多个营养组合物(例如一膳食补充剂)或作为一食品或饮料添加剂提供,如所述美国食品药物管理局(fda)所定义。上述多个组合物的所述剂型没有特别限制。例如,多种液体溶液、多种悬浮液、多种乳液、多种片剂、多种丸剂、多种胶囊、多种缓释制剂、多种粉剂、多种栓剂、多种脂质体、多种微粒、多种微胶囊、多种无菌等渗水性缓冲溶液、多种灌肠剂、多种栓剂等都被认为是多个合适的剂型。
[0111]
所述多个组合物通常包括一种或多种合适的稀释剂、填充剂、盐类、崩解剂、黏结剂、润滑剂、助滑剂、润湿剂、控释基质、着色剂、调味剂、载体、赋形剂、缓冲剂、稳定剂、增溶剂、商业佐剂及/或其他本领域已知的添加剂。
[0112]
可以使用作为一医药载体、赋形剂或介质的任何医药上可接受的(即,本领域已知的无菌且可接受地无毒的)液体、半固体或固体稀释剂。多个示例性稀释剂包括,但不限于聚氧乙烯山梨醇酐单月桂酸酯、硬脂酸镁、磷酸钙、矿物油、可可脂和可可树油、羟基苯甲酸甲酯和羟基苯甲酸丙酯、滑石粉、海藻酸盐、碳水化合物,尤其是甘露醇、α-乳糖、无水乳糖、纤维素、蔗糖、右旋糖、山梨醇、修饰的葡聚糖、阿拉伯树胶及淀粉。
[0113]
多个医药上可接受的填充剂可以包括,例如乳糖、微晶纤维素、磷酸氢钙、磷酸三钙、硫酸钙、右旋糖、甘露醇、及/或蔗糖。盐类,包括三磷酸钙、碳酸镁及氯化钠,也可以用作所述多个医药组合物中的多个填充剂。
[0114]
多个黏结剂可用于将所述组合物保持在一起以形成一硬的片剂。多个示例性黏结剂包括来自多个有机产品的多种材料,例如阿拉伯胶、西黄蓍胶、淀粉及明胶。其他多个合适的黏结剂包括甲基纤维素(mc)、乙基纤维素(ec)及羧甲基纤维素(cmc)。
[0115]
在一些实施例中,一富集的食品进一步包含一生物可利用性增强剂,其作用是增加所述身体对所述可吸收的天然产物的所述吸收。多个生物可利用性增强剂可以是多个天然的或合成的化合物。在一个实施例中,包含本文所述组合物的所述富集的食品进一步包含一种或多种生物可利用性增强剂以增强所述生物活性天然产物的所述生物可利用性。
[0116]
多个天然生物可利用性增强剂包括姜、葛缕子提取物、胡椒提取物及几丁聚糖。姜中的所述多个活性化合物包括6-姜醇及6-姜酚。葛缕子油也可用作一生物可利用性增强剂(第2003/022838号美国专利申请案)。胡椒碱是一种源自胡椒(piper nigrum或piper longum)的化合物,可作为一生物可利用性增强剂(参见第5,744,161号美国专利)。胡椒碱可以所述商品名bioperine
rtm
(sabinsa公司,皮斯卡特维,新泽西州)在市面上购得。在一些实施例中,基于富集的食品的所述总重量,所述多个天然生物可利用性增强剂的以约0.02重量%至约0.6重量%的一含量存在。
[0117]
多个合适的生物可利用性增强剂的多个示例包括,但不限于多种表面活性剂,包括由peg-酯类组成的多种表面活性剂,例如可以下述多个商品名在市面上购得的:gelucire
rtm
、labrafil
rtm
、labrasol
rtm
、lauroglycol
rtm
、pleurol oleique
rtm
(gattefosse公司,帕拉默斯,新泽西州)及capmul
rtm
(abitec公司,哥伦布,俄亥俄州)。
[0118]
所述组合物的所述量和施用方案是基于与所述施用的目的和多个症状的严重程度相关的各种因素,例如人或动物的年龄、性别、体重、多个激素水平或所述人或动物的其他营养需求。还考虑重复的施用以防止多个症状的恶化和任选地使所述受试者保持在一缓解的阶段。
[0119]
一典型的方案可以包括所述组合物的多個剂量。在一个实施例中,每天一次、一周三次、一周两次、一周一次、每两周一次、每月一次、每两个月一次施用所述组合物。所述组合物可以在任何时候施用于一个体。在一些实施例中,所述组合物是在用餐的同时、或在用餐之前或用餐时施用。
[0120]
根据一具体实施例,所述细菌通过局部施用提供。这些组合物包括一医药上可接受的载体,并且任选地包括多个额外的化合物。在一些实施例中,所述医药组合物包括多个
额外的活性及/或非活性材料,以产生一最终产物,其可以是单剂量单位或一多剂量形式。
[0121]
在一些实施例中,所述医药组合物可以包括一缓冲剂、一防腐剂、一稳定剂、一黏结剂、一压实剂、一润滑剂、一分散增强剂及/或一着色剂中的一种或多种。多个合适的缓冲剂的多个非限制性示例包括柠檬酸钠、碳酸镁、碳酸氢镁、碳酸钙和及碳酸氢钙。多个合适的防腐剂的多个非限制性示例包括多个抗氧化剂,例如α-生育酚和抗坏血酸盐、对羟基苯甲酸酯类、氯丁醇及苯酚。多个合适的黏结剂的多个非限制性示例包括蔗糖、淀粉、预糊化淀粉、明胶、聚乙烯吡咯烷酮、纤维素、甲基纤维素、羧甲基纤维素钠、乙基纤维素、聚丙烯醯胺、聚乙烯噁唑烷、聚乙烯醇、c
12-c
18
脂肪酸醇、聚乙二醇、多元醇、醣类、寡醣、及其多个组合。多个合适的润滑剂的多个非限制性示例包括硬脂酸镁、硬脂酸钙、硬脂酸锌、氢化植物油、sterotex、聚氧乙烯单硬脂酸酯、滑石、聚乙二醇、苯甲酸钠、月桂基硫酸钠、月桂基硫酸镁及轻质矿物油。如果使用一种或多种ph缓冲剂并且当一种或多种ph缓冲剂溶解在所述组合物的一水性组分中时,一种或多种ph缓冲剂可以提供5至7的所述范围内的一ph(例如约ph 5.5)。
[0122]
所述医药组合物可以包括其他多种成分,例如维持所述细菌的生长。在一些实施例中,所述医药组合物可以包括一营养素。在一些实施例中,所述组合物包含至少一种碳水化合物。一“碳水化合物”是指多种糖的一糖或聚合物。所述多个术语“醣类”、“多醣”、“碳水化合物”及“寡醣”可以互换使用。大多数碳水化合物是具有许多羟基的醛类或酮类,通常在所述分子的每一个碳原子上都有一个。一碳水化合物可以是单醣、双醣、三醣、寡醣或多醣。最基本的碳水化合物是一单醣,例如葡萄糖、蔗糖、半乳糖、甘露糖、核糖、阿拉伯糖、木糖及果糖。双醣类是两个连接的单糖。示例性的双醣类包括蔗糖、麦芽糖、纤维双糖及乳糖。通常,一寡醣包括三到六个单醣单元(例如棉子糖、水苏糖),而多醣类包括六个或多个单醣单元。示例性多醣类包括淀粉、肝糖及纤维素。多个碳水化合物可以包含多个修饰的醣单元,例如其中一羟基被去除的2'-脱氧核糖、其中一羟基被一氟取代的2'-氟核糖,或n-乙醯葡萄糖胺,葡萄糖的一含氮形式(例如2'-氟核糖、脱氧核糖和己糖)。多个碳水化合物可以以许多不同的形式存在,例如多个构形异构物、多个环状形式、多个无环形式、多个立体异构物、多个互变异构物、多个变旋异构物、及多个同分异构物。
[0123]
在一些实施例中,所述组合物包括至少一种脂质。一“脂质”包括脂肪、油、三酸甘油酯、胆固醇、磷脂、任何形式的脂肪酸,包括游离脂肪酸。脂肪、油及脂肪酸可以是饱和的、不饱和的(顺式或反式)或部分不饱和的(顺式或反式)。在一些实施例中,所述脂质包含至少一种脂肪酸,所述脂肪酸选自月桂酸(12:0)、肉豆蔻酸(14:0)、棕榈酸(16:0)、棕榈油酸(16:1)、十七酸(17:0)、十七碳烯酸(17:1)、硬脂酸(18:0)、油酸(18:1)、亚麻油酸(18:2)、次亚麻油酸(18:3)、十八碳四烯酸(18:4)、花生酸(20:0)、二十烯酸(20:1)、二十碳二烯酸(20:2)、二十碳四烯酸(20:4)、二十碳五烯酸(20:5)(epa)、二十二酸(22:0)、二十二烯酸(22:1)、二十二碳五烯酸(22:5)、二十二碳六烯酸(22:6)(dha)及二十四酸(24:0)。
[0124]
在一些实施例中,所述组合物包含至少一种补充矿物质或矿物质源。多种矿物质的多个示例包括,但不限于:氯、钠、钙、铁、铬、铜、碘、锌、镁、锰、钼、磷、钾和硒。任何前述多种矿物质的任一种的多种合适形式包括多种可溶性矿物盐、多种微溶性矿物盐、多种不溶性矿物盐、多种螯合矿物质、多种矿物质复合物、多种非反应性矿物质,例如多种羰基矿物质、及多种还原矿物质,以及其多种组合。
[0125]
在另外的多个实施例中,所述组合物包含至少一种补充维生素。所述至少一种维生素可以是脂溶性或水溶性维生素。多种合适的维生素包括,但不限于维生素c、维生素a、维生素e、维生素b12、维生素k、核黄素、烟碱酸、维生素d、维生素b6、叶酸、吡哆醇、硫胺素、泛酸及生物素。前述的任一种的多种合适形式是所述维生素的多种盐、所述维生素的多种衍生物、具有与所述维生素相同或相似活性的多种化合物、及所述维生素的多种代谢物。
[0126]
所述多个组合物中可以包括各种其他添加剂。这些包括,但不限于抗多种氧化剂、多种收敛剂、多种香料、多种防腐剂、多种柔软剂、多种色素、多种染色剂、多种润湿剂、多种推进剂及多种防晒剂,以及其他类别的多种材料,其存在可能是医学上或其他方面需要的。任选多种添加剂的多个非限制性示例如下:多种防腐剂,如山梨酸盐;多种溶剂,如异丙醇和丙二醇;多种收敛剂,如薄荷醇和乙醇;多种柔软剂,如聚亚烷基甲基葡萄糖苷;多种润湿剂,如甘油;多种乳化剂,如硬脂酸甘油酯、peg-100硬脂酸酯、聚甘油-3羟基月桂基醚和聚山梨醇酯60;山梨醇和其他多羟基醇,如聚乙二醇;多种防晒剂,如甲氧基肉桂酸辛酯(可以parsol mcx于市面上购得)和丁基甲氧基苯甲醯甲烷(以所述商品名parsol 1789提供);多种抗氧化剂,如抗坏血酸(维生素c)、α-生育酚(维生素e)、β-生育酚、γ-生育酚、δ-生育酚、ε-生育酚、ζ-生育酚、z{回旋()}-生育酚、间生育酚和视黄醇(维生素a);多种精油、多种神经醯胺、多种必需脂肪酸、多种矿物油、多种植物油(例如大豆油、棕榈油、乳木果油的液体级分、葵花油)、多种动物油(例如全氢鲨烯)、多种合成油、多种矽油或多种蜡(例如环甲基矽氧烷和二甲聚矽氧烷)、多种氟化油(通常是全氟聚醚)、多种脂肪醇(例如鲸蜡醇)和多种蜡(例如蜂蜡、巴西棕榈蜡和石蜡);多种肤感调节剂;以及多种增稠剂和多种结构剂,如膨胀粘土和交联的羧基聚亚烷基。
[0127]
其他多种添加剂包括调理所述皮肤(特别是所述角质层中所述皮肤的所述多个上层)并通过延缓其含水量的所述减少及/或保护所述皮肤来保持皮肤柔软的多种材料。这样的多种调和剂和多种保湿剂包括,例如,吡咯羧酸和胺基酸;多种有机抗菌剂,例如2,4,4'-三氯-2-羟基二苯醚(三氯沙)和苯甲酸。进一步的多种添加剂包括多种抗炎剂,如乙醯水杨酸和甘草次酸;多种抗脂溢剂,如视黄酸;多种血管扩张剂,如烟碱酸;多种黑色素生成的抑制剂,如麴酸;及其多种混合物。
[0128]
在其他多个实施例中,所述组合物可以包括多个α-羟酸、多个α-酮酸、多个聚合羟基酸、多个保湿剂、胶原蛋白、海洋提取物及抗氧化剂,如抗坏血酸(维生素c)及/或α-生育酚(维生素e)。可能包括多种防晒剂。另外,可以将诸如多种酶、多种草药、多种植物提取物、多种腺体或动物提取物的多种组分添加到所述组合物中。这些各种添加剂的所述多个量是所述化妆品领域中常规使用的那些,并且范围,例如为所述局部制剂的所述总重量的约0.01%至约20%。
[0129]
所述多个组合物还可以包括多种抗菌剂,以防止储存时腐败,即,抑制多种微生物如多种酵母菌和多种霉菌的生长。采取多种措施不使用影响所述治疗性细菌的多种抗生素。
[0130]
所述多个组合物还可以包含多种刺激缓解添加剂,以最小化或消除由待施用的化学个体或所述组合物的其他多种组分引起的皮肤刺激或皮肤损伤的所述可能性。多种合适的刺激缓解添加剂包括,例如:α-生育酚;多种单胺氧化酶抑制剂,特别是苯醇,如2-苯基-1-乙醇;甘油;水杨酸盐;抗坏血酸盐;多种离子载体,如孟宁素;两亲胺;氯化铵;n-乙醯半
胱氨酸、番椒晶素和氯喹。
[0131]
在某些实施例中可掺入本发明多种制剂并因此与所述活性剂一起局部施用的进一步的多种合适的药理活性剂包括,但不限于以下:改善或消除多个色素性或非色素性的老年斑、角化症和多个皱纹的多个药剂:多种局部麻醉剂和多种镇痛剂;多种皮质类固醇;多种视黄醇;及多种激素。多种局部药理活性剂的一些示例包括阿昔洛韦、双性霉素、洛赫西定、克绿霉唑、克康那唑、亦可那唑、咪可纳唑、甲硝唑、米诺环素、苯妥英、对氨基苯甲酸酯、甲氧基肉桂酸辛酯、水杨酸辛酯、氧苯酮、双氧苯酮、生育酚、乙酸生育酚、匹塞翁锌、苯海拉明、普莫卡因、利度卡因、普罗卡因、克罗他米通、对苯二酚及其单甲基醚和苄基醚、那普洛辛、布洛芬、克热宁、视黄醇、视黄醇棕榈酸酯、乙酸视黄酯、煤焦油、灰黄霉素、雌素二醇、氢化可体松、氢化可体松21-乙酸酯、氢化可体松17-戊酸酯、氢化可体松17-丁酸酯、助孕素、贝他甲皮质醇戊酸酯、贝他甲皮质醇二丙酸酯、曲安奈德、氟洛奈皮质醇、丙酸氯倍他索、米诺地尔、双吡大莫、二苯基乙内醯脲、过氧化苯甲醯、5-氟尿嘧啶、他克莫司及外用类固醇如阿氯米松、安西奈德、倍他米松,氯倍他索,地奈德,地塞米松、地氟松、氟轻松、氟氢缩松、卤倍他索、哈西奈德、氢化可体松及/或曲安奈德。
[0132]
尽管考虑了多种局部制剂,例如配制用于皮肤递送的多种乳膏和多种药膏,但所述多个递送系统可以包括时间释放、延迟释放或持续释放的递送系统。这样的多个系统可以避免所述多个组合物的重复施用,增加所述受试者和所述医师的便利。许多类型的多个释放递送系统对于本领域普通技术人员来说是可用的并且是已知的。多个具体示例包括,但不限于:(a)多个侵蚀系统,如在第4,452,775号、第4,667,014号、第4,748,034号、第5,239,660号、第6,218,371号美国专利中描述的那些,以及(b)多个扩散系统,其中一活性组分以一受控速率从一聚合物中渗透,如在第3,832,253号和第3,854,480号美国专利中描述的。
[0133]
所述递送系统可以包括胶原蛋白、纤维蛋白或一膜提取物,如一基膜提取物,例如其中所述组合物被配制用于施用于所述皮肤。多个合适的基膜提取物包括一具有生物活性的可聚合提取物,所述可聚合提取物含有按重量计约60-85%的层连结蛋白、5-30%的iv型胶原蛋白、1-10%的巢蛋白、1-10%的硫酸肝素蛋白多糖、和1-5%的动蛋白(参见第4,829,000号美国专利,通过引用并入本文,其公开了多个bme组合物以及生产这些组合物的多种方法)。bme在培养时可以支持包括多个上皮细胞在内的各种细胞类型的正常生长和分化。多个基膜提取物在本领域中是众所周知的并且是可市面上购得的。
[0134]
对于所述皮肤的治疗,可以将一治疗上有效量的所述组合物局部施用于所述受影响的区域。本文公开的所述多个药理组合物有助于使用所述细菌于异位性皮肤炎的所述治疗。这样的一组合物可以适合于将所述活性成分递送至任何合适的受试者,例如但不限于一人类受试者,并且可以以本身已知的一方式制造,例如,通过常规的混合、溶解、粒化、乳化、封装、包埋或冻干过程。如上所述,可以使用一种或多种药理上(例如生理上或医药学)可接受的载体以及有助于将所述多个活性化合物加工成多个可药用制剂的多个任选助剂以一常规方式配制多个药理组合物。
[0135]
可以将所述组合物施用于所述皮肤,例如多个病变区域和圆形病变区域,或完整皮肤的多个区域(多个非病变区域)以防止多个病变形成。所述组合物可用于减小病变大小。所述组合物可以每天施用。所述组合物可以每天施用1、2、3、4或5次。所述组合物可以每
隔一天施用一次,或每周施用1、2、3、4、5、6或7次。所述组合物可以每周施用。
[0136]
生产多种局部医药组合物如多种乳膏、多种软膏、多种洗剂、多种喷雾剂和多种无菌水溶液或多种悬浮液的多种方法在本领域中是众所周知的。制备多种局部药物组合物的多种合适方法描述于,例如第wo 95/10999号pct公开本、第wo2012150269号pct公开本、第6,974,585号美国专利及第wo 2006/048747号pct公开本,均以引用方式并入本文。所述组合物可以包括一水性载体,并作为一喷雾剂施用于所述皮肤。
[0137]
任选地,一组合物可以包括一医药上可接受的黏度增强剂及/或成膜剂。一黏度增强剂增加所述制剂的所述黏度以抑制其扩散到所述施用的部位之外。balsam fir(oregon)是与所述细菌一起使用的一医药上可接受的黏度增强剂的一个示例。
[0138]
一成膜剂在干燥时会在所述施用的部位形成一保护膜。所述膜抑制所述活性成分的去除并使其与所述被治疗的部位保持接触。适用于本发明的一成膜剂的一个示例是flexible collodion,usp。如remington所述:the science and practice of pharmacy,第19版(easton,pa.:mack publishing co.,199.5),在第1530页,火棉胶是含有硝酸纤维(pyroxylin,一种硝化纤维素)的乙醚/乙醇溶液,蒸发后会留下一层硝酸纤维。一成膜剂可以另外当作一载体。干燥形成一膜的多种溶液有时称为涂料。正如医药制剂领域所熟知的,多种乳膏是多种黏性液体或多种半固体乳液,可以是水包油或油包水。
[0139]
多种乳膏基质是可水洗的,并且包含一油相、一乳化剂和一水相。所述油相,也称为所述“内”相,通常由凡士林和一脂肪醇如鲸蜡醇或硬脂醇组成。所述水相的体积通常,尽管不是必须,超过所述油相,并且通常含有一润湿剂。一乳膏制剂中的所述乳化剂通常是一非离子、阴离子、阳离子或两性的表面活性剂。
[0140]
多种洗剂是在没有摩擦的情况下施用于所述皮肤表面的多种制剂,并且通常是多种液体或半液体制剂,其中包括所述活性剂的多个颗粒存在于一水或醇基中。多种洗剂通常是多种固体的多种悬浮液,并且优选地包含所述水包油类型的一液体油性乳液。因为易于施用一更流动的组合物,多种洗剂可用于治疗多个大面积的身体区域。通常需要将一洗剂中的所述不溶物细分。
[0141]
多种洗剂通常含有多种悬浮剂以产生更好的多种分散液以及用于将所述活性剂定位和保持与所述皮肤接触的多种化合物,例如甲基纤维素、羧甲基纤维素钠等。
[0142]
多种溶液是通过将一种或多种化学物质(溶质)溶解在一液体中而制备的多种均匀混合物,使得所述溶解的物质的所述多个分子分散在所述溶剂的分子中。所述溶液可以包含其他多种医药上或化妆品上可接受的化学物质以缓冲、稳定或保存所述溶质。用于制备多种局部溶液的多种溶剂的多个常见示例是乙醇、水、丙二醇或任何其他多种可接受的载体。这些可以以任何方式施用,例如将它们喷洒在所述皮肤上,将它们涂在所述皮肤上,或用所述溶液润湿一绷带。
[0143]
多种凝胶是多种半固体、悬浮型系统。多种单相凝胶含有实质上均匀分布在整个所述载体液体中的多个有机大分子,所述载体液体通常是水性的,但也优选地含有一醇,并且任选地含有一油。使用的一些“有机大分子”,特别是多种凝胶剂,是多个交联的丙烯酸聚合物,如所述“卡波姆(carbomer)”家族的多个聚合物,例如以carbopol.rtm于市面上购得的羧基聚亚烷基。同样有用的是多种亲水性聚合物,如聚环氧乙烷、多个聚氧乙烯-聚氧丙烯共聚物和聚乙烯醇;多种纤维素聚合物,如羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤
维素、羟丙基甲基纤维素邻苯二甲酸酯和甲基纤维素;多种胶如西黄蓍胶和三仙胶;海藻酸钠;及明胶。为了制备一均匀的凝胶,可加入多种分散剂如醇或甘油,或可通过研磨、机械混合或搅拌或其多种组合来分散所述凝胶剂。这些凝胶可用于本文公开的所述多种方法。
[0144]
多种软膏也可用于所公开的多种方法中。多种软膏是多种半固体制剂,通常基于凡士林或其他多种凡士林衍生物。如本领域技术人员将理解的,所述待使用的特定软膏基质是一种将提供许多所需特性的软膏基质,例如润肤剂等。一软膏基质通常是惰性的、稳定的、无刺激性和无致敏性。多种软膏基质分为四类:多种油质基质、多种可乳化基质、多种乳液基质、及多种水溶性基质(参见remington:the science and practice of pharmacy,第19版(easton,pa.:mack publishing co.,第1399-1404页),多种油质软膏基质包括,例如,多种植物油、从多个动物中获得的多种脂肪,以及从石油中获得的多种半固体碳氢化合物。多种可乳化软膏基质,也称为多种吸收性软膏基质,几乎没有水或不含水,并且包括,例如硫酸羟基甘油三硬脂酸酯、无水羊毛脂和亲水凡士林。多种乳液软膏基质是多种油包水(w/o)乳液或多种水包油(oav)乳液,并且包括,例如乙醯醇、甘油单硬脂酸酯、羊毛脂和硬脂酸。多种水溶性软膏基质由不同分子量的多个聚乙二醇制备。
[0145]
多种糊剂是其中所述活性剂悬浮在一合适的基质中的多个半固体剂型,并且也是有用的。根据所述基质的所述性质,多种糊剂分为多种脂肪糊剂或由多个单相水凝胶制成的多种糊剂。一脂肪糊剂中的所述基质通常是凡士林或亲水性凡士林等。由多个单相水凝胶制成的多种糊剂通常包含羧甲基纤维素等作为一基质。
[0146]
一局部组合物可以是施用于所述身体表面的任何形式,例如一乳膏、洗剂、喷雾剂、溶液、凝胶、软膏、糊剂、石膏、涂料、生物黏合剂、绷带、喷雾剂、悬浮液等,及/或可以制备一局部组合物以包含多个脂质体、多个微胞及/或多个微球。一局部组合物可以与一闭合的覆盖层组合使用,以便从所述身体表面蒸发的水分在施用于所述身体表面时和之后保持在所述制剂内。
[0147]
可以将一乳膏、洗剂、凝胶、软膏、糊剂等涂抹在所述受影响的表面上。可以以相同的方式施用一溶液,但更典型的是将用一滴管、棉签、喷雾器等施用,并小心地施用到所述多个受影响的区域。所述组合物可以,例如以一局部制剂如一软膏的形式,或作为一敷料或一绷带的一部分,直接施用于所述目标位置。所述组合物可以配制成一单位剂量,用于通过施用于所述皮肤的任何装置进行施用。所述单位剂量可以是所述活性剂在一载体中的一储存器,例如能够在一所需时间段如至少一天或更长时间内黏附到所述皮肤上的一黏合剂载体。
[0148]
所述多个医药组合物可用于异位性皮肤炎的所述治疗。因此,在一些实施例中,施用导致病变大小减小、多个病变的数量减少及/或多个症状的一减轻。这些医药组合物的所述施用可以减少所述被治疗的受试者的所述皮肤中的金黄色葡萄球菌。所述医药组合物的所述施用可以提供增强的所述皮肤的屏障功能,如通过经表皮水分流失所测量的。
[0149]
异位性皮肤炎突然发作,并且可能会有缓解的多个期间。所述局部施用可以减少多次复发,从而减少异位性皮肤炎的多个额外事件的数量、强度或频率。所述局部施用可以增加所述缓解的时间,例如多个事件之间的时间的所述长度。在一些实施例中,在施用后的1、2、3、4、5、6、7、8、9、10、11或12周将不会发生异位性皮肤炎的一额外事件。在一另外的实施例中,在所述局部施用后1、2、3、4、5、6、7、8、9、10、11或12个月将不会发生异位性皮肤炎
的一额外事件。
[0150]
用本发明一些实施例的所述细菌进行的治疗可以与除所述细菌之外的一抗ad疗法组合。
[0151]
多个示例包括,但不限于多个免疫治疗剂、多个抗血管生成剂、多个细胞激素、多个激素、多个抗体、多个多核苷酸、多个光动力治疗剂、多个非类固醇抗炎药物、多个抗组织胺、多个α-肾上腺素促效剂、多个类固醇(例如多个皮质类固醇)、及其任何组合。
[0152]
所述术语“皮质类固醇”包括,但不限于多个局部皮质类固醇。多个示例性的局部皮质类固醇包括曲安奈德,通常以0.1%的一浓度配制在一乳膏中,以及氢化可体松,通常以1%或2.5%的一浓度配制在一乳膏中。某些局部皮质类固醇被认为具有非常高的效力,例如贝他甲皮质醇二丙酸酯、丙酸氯贝皮质醇、二乙酸二氟拉松酯、氟轻松及丙酸氯倍他索。某些局部皮质类固醇被认为是高效的,例如安西奈德、地塞米松、哈西奈德及曲安奈德。某些局部皮质类固醇被认为是中等效力,例如贝他甲皮质醇戊酸酯、氯可托龙特戊酸酯、醋酸氟轻松、氟氢缩松、氟轻松、丙酸氟替卡松、丁酸氢化可体松、戊酸氢化可体松、糠酸莫美他松及泼尼卡酯。某些局部皮质类固醇被认为是低效的,例如丙酸氯米松、地奈德及氢化可体松。“可吸入皮质类固醇”是指适合通过吸入递送的一皮质类固醇。多个示例性的可吸入皮质类固醇是氟替卡松、贝克每松、布地奈德、糠酸莫美他松、环索奈德、氟尼缩松、曲安奈德及任何其他目前可用或将来可用的皮质类固醇。可吸入并与一长效β2-促效剂组合的多种皮质类固醇的多个示例包括,但不限于:布地奈德/福莫特罗及氟替卡松/沙美特罗。
[0153]
本文所述的多个细菌组合物可以包括在管理机构批准的多个套组中,例如一fda批准的套组。
[0154]
根据一具体实施例,与用所述细菌治疗之前的所述受试者的scoard分数相比,所述治疗上有效量的所述细菌导致所述scorad分数的一降低,所述降低在使用所述细菌进行第一次循环治疗后维持至少10周(例如,至少12周、至少14周、至少18周、至少24周、至少26周、至少52周)。
[0155]
根据一具体实施例,所述治疗上有效量的所述细菌导致所述细菌在所述受试者的所述肠道中定植。
[0156]
根据本发明的另一方面,提供了一种分析一细菌治疗是否对治疗一患有ad的受试者有效的方法,所述方法包含:
[0157]
(a)向所述受试者提供上述细菌,例如多个组合物;以及
[0158]
(b)分析所述受试者的所述肠道微生物群中至少一种细菌物种的所述量,所述细菌物种选自由以下组成的所述群组:sgb_1636普雷沃菌、sgb_1654普雷沃菌、sgb_1644粪便普雷沃菌、sgb_1640普雷沃菌、sgb_1638普雷沃菌、sgb_1626粪便普雷沃菌、sgb_1613普雷沃菌种_cag_386、sgb_1653普雷沃菌、sgb_1635普雷沃菌、sgb_1624普雷沃菌、sgb_5858巨球型菌种_bl7、sgb_1677普雷沃菌种_885、sgb_1612普雷沃菌、sgb_1615普雷沃菌种_cag_604、sgb_1617普雷沃菌、sgb_1623普雷沃菌科、sgb_6796霍尔德曼氏菌、sgb_714史密斯甲烷短杆菌、sgb_6778链型杆菌_mitsuokai、sgb_6783链型杆菌种_cag_290、sgb_1614普雷沃菌种_cag_732、sgb_6805霍尔德曼氏菌、sgb_5862埃氏巨球型菌、sgb_4196反刍梭菌、sgb_4197反刍梭菌、sgb_5904光冈菌_jalaludinii、sgb_4289真杆菌、sgb_4290真杆菌种_cag_202、sgb_1891粪居拟杆菌、sgb_4936人罗斯氏菌、sgb_6816霍尔德曼氏菌、sgb_15322普氏
栖粪杆菌、sgb_5111梭菌种_cag_127、sgb_5803小类杆菌种_cag_357、sgb_4933直肠真杆菌、sgb_5113梭菌、sgb_5117规则类球菌、sgb_5785考拉杆菌种_cag_266、sgb_4938罗斯氏菌种、sgb_5805小类杆菌、sgb_5808小类杆菌、sgb_1472普雷沃菌科、sgb_6806霍尔德曼氏菌_biformis、sgb_1798帕拉普氏菌_clara、sgb_15265厚壁菌门细菌_cag_103、sgb_15249厚壁菌门细菌_cag_129、sgb_15109梭菌目_未分类、sgb_15091颤杆菌、sgb_15090颤杆菌种_cag_241、sgb_9226嗜黏蛋白艾克曼氏菌、sgb_5809小类杆菌种_cag_486、sgb_6428梭菌种_cag_594、sgb_6540梭菌种_cag_451、sgb_6422梭菌种_cag_433、sgb_6340梭菌种_cag_269、sgb_6579厚壁菌门细菌_cag_313、sgb_9225艾克曼氏菌、sgb_4261布劳特氏菌、sgb_5089真杆菌种_cag_38、sgb_1860拟杆菌_faecis、sgb_15028厚壁菌门_未分类、sgb_15124梭菌目_未分类、sgb_15254梭菌目_未分类、sgb_15356厌氧发酵产氢细菌、sgb_1704普雷沃菌科、sgb_17244动物双叉乳酸杆菌、sgb_2290理研菌科、sgb_5075解果胶毛螺菌、sgb_2325芽孢杆菌、sgb_1474普雷沃菌科、sgb_4263布劳特氏菌、sgb_4930毛螺菌科、sgb_4940食葡糖罗斯氏菌、sgb_5045凸腹真杆菌及sgb_9283华德萨特氏菌,其中与所述提供之前的所述细菌物种的所述量相比,所述提供之后所述细菌物种的所述量的一增加表示所述组合物对治疗所述受试者是有效的。
[0159]
可以通过确定一个或多个dna序列来分析任何上述公开的物种的所述量。在一些实施例中,一个或多个dna序列包含可用于判别不同微生物类型间的任何dna序列。在某些实施例中,一个或多个dna序列包含多个16s rrna基因序列。在某些实施例中,一个或多个dna序列包含多个18srrna基因序列。在一些实施例中,1、2、3、4、5、10、15、20、25、50、100、1,000、5,000或更多个序列被扩增。
[0160]
多个16s和18s rrna基因序列分别编码多个原核和真核核糖体的多个小亚单位组分。多个rrna基因在区分多个细菌类型方面特别有用,因为尽管这些基因的多个序列在微生物物种之间有所不同,但这些基因具有引子结合的多个高度保守区域。多个保守引子结合区域之间的这种特异性使得许多不同类型细菌的所述多个rrna基因可以用一单套的多个引子扩增,然后通过多个扩增的序列进行区分。
[0161]
在一些实施例中,直接测定一微生物相样本(例如肠道微生物群)的一个或多个dna序列的一水平或一组的多个水平。分离微生物dna的多种方法是本领域众所周知的。多个示例包括,但不限于苯酚-氯仿提取及多种市售套组,包括qiaamp dna stool mini kit(qiagen,瓦伦西亚,加利福尼亚州)。
[0162]
在一些实施例中,一个或多个dna序列的一水平或一组的多个水平通过使用pcr(例如标准pcr、半定量或定量pcr)扩增多个dna序列然后定序来确定。在一些实施例中,一个或多个dna序列的一水平或一组的多个水平通过使用定量pcr扩增多个dna序列来确定。这些和其他基本的dna扩增程序为本领域多个从业人员所熟知,并在ausebel等人(ausubel f m、brent r、kingston r e、moore d、seidman j g、smith j a、struhl k(eds).1998.current protocols in molecular biology.wiley:new york)中描述。
[0163]
在一些实施例中,使用对一种或多种序列特异的多个引子扩增多个dna序列,所述序列将多个个体微生物类型与其他不同微生物类型区分开来。在一些实施例中,使用对多个16s rrna基因序列特异的多个引子扩增多个16srrna基因序列或其多个片段。在一些实施例中,使用对多个18s dna序列特异的多个引子扩增多个18s dna序列。
[0164]
在一些实施例中,使用系统进化芯片(phylochip)技术确定一个或多个16s rrna基因序列的一水平或一组的多个水平。多个系统进化芯片的使用在本领域中是众所周知的并且在hazen等人("deep-sea oil plume enriches indigenous oil-degrading bacteria."science,330,204-208,2010)中描述,其全文以引用方式并入。简而言之,多个16s rrna基因序列是从从一微生物相样本中提取的dna中扩增和标记的。然后将扩增的dna与包含多个微生物16s rrna基因的多个探针的一阵列杂交。然后量化与每一个探针的结合水平,提供对应于所探测的16s rrna基因序列的微生物类型的一样本水平。在一些实施例中,系统进化芯片分析由一商业供应商进行。多个示例包括但不限于second genome公司(旧金山,加利福尼亚州)。
[0165]
在一些实施例中,确定一种或多种类型的细菌的一水平或一组的多个水平包含确定一种或多种微生物rna分子(例如转录物)的一水平或一组的多个水平。定量rna转录物的多个水平的多种方法是本领域众所周知的,并且包括但不限于北方墨点分析(northern analysis)、半定量反转录酶pcr、定量反转录酶pcr及微阵列分析。
[0166]
用于序列确定的多种方法通常是本领域技术人员已知的。多种优选的定序方法是多种下一代定序方法或多种平行高通量定序方法。例如,一细菌基因组序列可以通过使用大规模并行签名定序(massively parallel signature sequencing,mpss)获得。一设想的定序方法的一个示例是焦磷酸定序(pyrosequencing),特别是454焦磷酸定序,例如基于roche 454基因组定序仪。这种方法在一油溶液中扩增多个水滴内的dna,每个水滴都含有一单个dna模板,所述模板附着在一单个涂有引子的珠子上,然后形成一个克隆菌落。焦磷酸定序使用荧光酶产生光以检测添加到所述新生dna中的所述多个个别核苷酸,并且所述组合的数据用于生成多个序列读数。另一个设想的示例是illumina或solexa定序,例如通过使用基于多个可逆染料终止子的illumina基因组分析仪技术。多个dna分子通常附着在一载玻片上的多个引子上并扩增,从而形成多个局部克隆菌落。随后可以一次添加一种类型的核苷酸,并且多个未掺入的核苷酸被洗掉。随后,可以拍摄所述多个荧光标记的核苷酸的多个图像,并从所述dna中化学去除所述染料,从而进行一下一个循环。另一个示例是使用applied biosystems的solid技术,所述技术采用连接的定序。此方法基于使用所有可能的一固定长度的多个寡核苷酸的一库,这些寡核苷酸根据所述定序位置进行标记。这样的多个寡核苷酸被退火和连接。随后,通过dna连接酶对多个匹配序列的所述优先连接通常导致所述位置的所述核苷酸的一信号信息。由于所述dna通常通过乳化pcr扩增,因此所述产生的珠子,每一个都仅包含相同dna分子的多个拷贝,可以沉积在一玻璃载玻片上,从而产生与illumina定序相当的多个数量和多个长度的多个序列。另一种方法基于helicos的heliscope技术,其中多个片段由系链到一阵列的多个polyt寡聚物捕获。在每一个定序循环中,添加聚合酶和多个单个荧光标记的核苷酸并对所述阵列进行成像。随后去除所述荧光标签并重复所述循环。包含在本发明的所述多种方法中的多个定序技术的多个进一步示例是通过杂交定序、使用多个纳米孔的定序、多种基于显微镜的定序技术、微流体sanger定序或多种基于微芯片的定序方法。
[0167]
根据一个实施例,所述定序方法允许量化细菌的所述数量-例如通过深度定序,如illumina深度定序。
[0168]
如本文所用,所述术语“深度定序”是指一种定序方法,其中在所述单次测试中多
次读取所述标的序列。一单次深度定序运行由在同一标的序列上运行的多个定序反应组成,每一个定序反应都会产生独立的序列读数。
[0169]
在一些实施例中,确定一种或多种类型的细菌的一水平或一组的多个水平包含确定一种或多种微生物多肽的一水平或一组的多个水平。量化多个多肽水平的多种方法在本领域中是众所周知的并且包括但不限于西方墨点分析(western analysis)及质谱分析法(mass spectrometry)。
[0170]
如上所述,除了(或代替)分析细菌的所述水平之外,本发明还考虑分析多种微生物产物的所述水平。
[0171]
多种微生物产物的多个示例包括,但不限于多个mrna、多个多肽、多个碳水化合物及多个代谢物。
[0172]
在一些实施例中,测量了至少十种细菌的多个代谢物的所述存在、水平及/或活性。在其他多个实施例中,测量了5至50种细菌的多个代谢物的所述存在、水平及/或活性。在其他多个实施例中,测量了5至20种细菌的多个代谢物的所述存在、水平及/或活性。在其他多个实施例中,测量了5至100种细菌的多个代谢物的所述存在、水平及/或活性。在一些实施例中,测量了100至1000种或更多种的细菌的多个代谢物的所述存在、水平及/或活性。在其他多个实施例中,分析了所述微生物组内所有细菌的多个代谢物的所述存在、水平及/或活性。在其他多个实施例中,测量了所述微生物组内所有细菌的多个代谢物的所述存在、水平及/或活性。
[0173]
如所提及,与所述移植前所述肠道微生物组样本中相同物种的所述量相比,所述移植后所述肠道微生物组样本中至少一种、两种、三种、四种、五种或所有的本公开的物种的所述量的一增加表示所述组合物在治疗所述受试者方面是有效的。在一个实施例中,所述增加是至少增加10%、增加20%、增加30%、增加40%、增加50%或更多。
[0174]
分析可能需要移植后1天、2天、3天、4天、5天、六天、1周、2周、3周、4周、1个月以上、2个月以上、3个月以上、5个月以上、6个月以上。
[0175]
如本文所用,所述术语“约”是指
±
10%。
[0176]
所述多个术语“包含(comprise、comprising)”、“包括(include、including)”、“具有(has、having)”及其多个同源词是指“包括但不限于”。
[0177]
所述术语“由......组成(consisting of)”是指“包括并限于”。
[0178]
所述术语“实质上由......组成(essentially consisting of)”是指所述组合物、方法或结构可以包括额外的多个成分、多个步骤及/或多个部分,但只有当所述额外的多个成分、多个步骤及/或多个部分实质上不改变所要求保护的组合物、方法或结构的所述多个基本特征及多个新特征。
[0179]
如本文所用,所述多个单数形式“一(a、an)”及“所述(the)”包括复数引用,除非上下文另有明确规定。例如,所述术语“一化合物”或“至少一种化合物”可以包括多个化合物,包括其多个混合物。
[0180]
在整个本技术中,本发明的个种实施例可以以一个范围的型式存在。应当理解,以一范围型式的所述描述仅仅是因为方便及简洁,不应理解为对本发明范围的一硬性限制。因此,应当认为一范围的所述描述已经具体公开所有可能的子范围以及所述范围内的多个单独数值。例如,应当认为从1到6的一范围的所述描述已经具体公开多个子范围,例如从1
到3、从1到4、从1到5、从2到4、从2到6、从3到6等,以及所述范围内的多个单独数字,例如1、2、3、4、5及6。此不管范围为何皆适用。
[0181]
无论何时在本文中指示的一数字范围,都意味着包括所述指定范围内的任何引用数字(分数或整数)。所述多个片语一第一指示数字与一第二指示数字“之间的范围”以及“从”一第一指示数字“到”一第二指示数字的“范围”在本文中可互换,并指包括所述第一和第二指示数字,及其之间的所有分数及整数。
[0182]
如本文所用,所述术语“方法(method)”指的是用于完成一特定任务的多种方式(manner)、多种手段(means)、多种技术(technique)及多种程序(procedure),包括但不限于,那些方式、手段、技术及程序,其是已知的,或是从已知的方式、手段、技术及程序很容易地被化学、药理、生物、生化及医学领域从业者所开发。
[0183]
如本文所用,所述术语“治疗(treating)”包括消除、实质上抑制、减缓或逆转一状况的所述进展,实质上改善一状况的临床或美学症状或实质上防止一状况的临床或美学症状的出现。
[0184]
当引用多个特定的序列表时,这种引用应理解为还包括实质上对应于其互补序列的多个序列,包括由例如多个定序错误、多个克隆错误或导致碱基替换的其他多个改变引起的多个微小序列变异、碱基缺失或碱基添加,前提是此类变异的所述频率小于50个核苷酸中的1个,替代地,小于100个核苷酸中的1个,替代地,小于200个核苷酸中的1个,替代地,小于500个核苷酸中的1个,替代地,小于1000个核苷酸中的1个,替代地,小于5,000个核苷酸中的1个,替代地,小于10,000个核苷酸中的1个。
[0185]
应当理解,本发明中的多个特定特征,为清楚起见,在分开的实施例的内文中描述,也可以在单一实施例的组合中提供。相反地,本发明中,为简洁起见,在单一实施例的内文中所描述的各种特征,也可以分开地、或者以任何合适的子组合、或者在适用于本发明的任何其他描述的实施例中提供。在各种实施例的内文中所描述的多个特定特征,并不被认为是那些实施例的必要特征,除非所述实施例没有那些元素就不起作用。
[0186]
如上文所描述和如在所述多个权利要求部分中要求保护的本发明的各种实施例和方面在以下多个示例中找到实验支持。
[0187]
示例
[0188]
现在参考以下多个示例,其与上述的多个叙述一起以一非限制性方式说明本发明的一些实施例。
[0189]
通常,本文所用的所述命名法和本发明使用的所述多个实验室程序包括分子、生化、微生物和重组dna技术。这类技术在文献中得到了详尽的解释。参见,例如,sambrook等人的“分子克隆:实验室手册(molecular cloning:a laboratory manual)”,(1989);“分子生物学中的当前方案(current protocols in molecular biology)”volumes i-iii ausubel,r.m.,ed.(1994);ausubel等人的“分子生物学中的当前方案(current protocols in molecular biology)”,john wiley&sons,baltimore,maryland(1989);perbal的“分子克隆实用指南(apractical guide to molecular cloning)”,john wiley&sons,new york(1988);watson等人的“重组dna(recombinant dna)”,scientific american books,new york;birren等人(eds)的“基因组分析:实验室手册系列(genome analysis:a laboratory manual series)”,vols.1-4,cold spring harbor laboratory press,new york(1998);
美国第4,666,828、4,683,202、4,801,531、5,192,659和5,272,057专利中规定的多种方法;“细胞生物学:实验室手册(cell biology:a laboratory handbook)”,volumes i-iii cellis,j.e.,ed.(1994);“动物细胞培养-基本技术手册(culture of animal cells-a manual of basic technique)”,freshney,wiley-liss,n.y.(1994),third edition;“免疫学中的当前方案(current protocols in immunology)”volumes i-iii coligan j.e.,ed.(1994);stites等人(eds)的“基础和临床免疫学(basic and clinical immunology)”(8th edition),appleton&lange,norwalk,ct(1994);mishell and shiigi(eds)的“细胞免疫学中的选定方法(selected methods in cellular immunology)”,w.h.freeman and co.,new york(1980);多种可用的免疫测定在所述专利和科学文献中被广泛描述,参见,例如,美国第3,791,932、3,839,153、3,850,752、3,850,578、3,853,987、3,867,517、3,879,262、3,901,654、3,935,074、3,984,533、3,996,345、4,034,074、4,098,876、4,879,219、5,011,771和5,281,521号专利;“寡核苷酸合成(oligonucleotide synthesis)”gait,m.j.,ed.(1984);“核酸杂交(nucleic acid hybridization)”hames,b.d.,&higgins s.j.,eds.(1985);“转录和转译(transcription and translation)”hames,b.d.,&higgins s.j.,eds.(1984);“动物细胞培养(animal cell culture)”freshney,r.i.,ed.(1986);“固定化细胞和酶(immobilized cells and enzymes)”irl press,(1986);“分子克隆实用指南(a practical guide to molecular cloning)”perbal,b.,(1984)及“酶学方法(methods in enzymology)”vol.1-317,academic press;“pcr方案:方法和应用指南(pcr protocols:a guide to methods and applications)”,academic press,san diego,ca(1990);marshak等人的“蛋白质纯化和表征策略-实验室课程手册(strategies for protein purification and characterization-a laboratory course manual)”cshl press(1996);所有这些都以引用的方式并入,就好像在此完全阐述一样。本文档通篇提供了其他多个一般参考资料。其中的所述多个程序被认为是本领域公知的并且是为了方便读者而提供的。其中包含的所有信息均以引用方式并入本文。
[0190]
示例1
[0191]
多种方法
[0192]
试验族群。符合条件的多个ad患者在所述特拉维夫(tel aviv)医疗中心的所述皮肤科接受治疗。纳入的多个患者年龄≥18岁,患有中度至重度异位性皮肤炎,定义为一异位性皮肤炎严重度评分(scorad)分数≥25,病程最短3年,局部和全身治疗未能充分控制。关键排除标准包括在所述研究的所述开始前4周内同时存在的另一种活动性皮肤病、妊娠、全身治疗,包括光疗。
[0193]
研究设计和监督。这是一项前瞻性、单盲、安慰剂对照的交叉试验研究,旨在评估fmt治疗中度和重度ad的所述安全性和临床疗效,并评估所述试验族群中fmt后所述粪便微生物群的所述变化。所有患者在基线时都接受了临床ad活动评估,之后他们接受了2剂安慰剂fmt,然后每隔2周接受4次fmt治疗(来自健康的粪便供体)(图1)。每一个患者都接受了来自一单个供体(3个可用的粪便供体之一)的fmt。然而,如果一某个供体的多个粪便捐赠不再可用,则更换粪便供体。在所述研究开始时、每次fmt之前和最后一次fmt后1-8个月,使用所述scorad分数评估ad的所述临床活动、多个不良事件和所述粪便微生物组概况。
[0194]
在所述研究期间,仅允许多个患者使用局部治疗,包括多种润滑剂和多种糖皮质
激素或多种钙调神经磷酸酶抑制剂。
[0195]
所述方案得到了所述特拉维夫医疗中心伦理审查委员会的批准。所有患者均根据赫尔辛基宣言(declaration of helsinki)的所述多个原则提供了书面知情同意书。所述试验没有商业支持。所有本案发明人保证所述数据的所述准确性和完整性,保证所述试验对所述方案的遵守,以及保证多个不良事件的报告。
[0196]
fmt制备和递送。多个志愿供体是年龄在18至50岁之间的健康、未怀孕的成年人,正常体重指数为18.5-24.9kg/m2。他们因任何重大病史或在所述前3个月内使用过任何抗生素而被排除在外。根据所述以色列卫生部指南,多个候选人符合条件,其中包括一体格检查和多个详尽的实验室筛查测试(未显示),包括多个粪便肠道病原体(通过多次培养和pan-pcr测试(biofire diagnostics,肠胃道病原体多标的核酸检测(gastrointestinal panel)))、a型、b型和c型肝炎血清抗体;人类免疫缺乏病毒;htlv和梅毒螺旋体以及腹腔cbc(及符合以色列卫生部指南的额外多种测试)。三名接受所述供体筛选程序的健康志愿者作为所述当前研究的粪便供体。粪便在排便后几分钟内放入一干净的封闭塑料容器中,并在所述特拉维夫医疗中心的粪便库设施中进行处理以制备胶囊化的fmt。胶囊化fmt的所述制备与之前描述的所述程序类似
12
。简而言之,粪便材料用生理盐水(600ml/100g粪便材料)稀释、过滤并在一离心机中浓缩。将所述沉淀物悬浮在作为一细菌冷冻保护剂添加的无菌盐水和甘油(20%)中。然后将此材料移液到多个耐酸胶囊(drcaps,capsugel)中,将其封闭,接着用另外一组的多个胶囊进行二次密封。多个胶囊在-80℃下冷冻保存。多个安慰剂胶囊在视觉上是相同的,并且仅含有稀释的甘油。
[0197]
胶囊化fmt程序:在所述tlvmc的所述细菌治疗诊所连续两天服用两剂的15粒fmt胶囊(共30粒胶囊)。在施用当天,将在-80℃冷冻的多个胶囊从所述冰箱中取出并在置于冰上运送到所述诊所。将十五粒胶囊单独交给所述患者,并且所述患者立即用一些水口服摄入所述胶囊。要求多个患者在服用胶囊前禁食过夜。
[0198]
功效终点。所述研究的主要终点是scorad分数相对于基线的所述总体平均变化,由所述欧洲异位性皮肤炎特别工作组描述和验证,用于评估ad的所述严重程度
13,14
。所述次要终点是多个ad患者fmt的安全性以及临床改善与每一次fmt后2周和最后一次fmt后8周或更长时间所述粪便微生物物种的所述变化的所述关系。
[0199]
粪便微生物分析。为了检查所述临床效果是否可能由多個新的細菌菌株的定植介导,开发了一种稳健且灵敏的方法来计算多個不同总体基因组样本中相同物种的多個細菌菌株之间的成对dna序列相异性(未显示)。用于多個fmt胶囊的多個供体粪便样本和在所述研究期间从所述多個患者收集的多個粪便样本(图8)使用illumina nextseq定序成多个总体基因组读数。基于“基于迭代覆盖的读取分配”(iterative coverage-based read assignment,icra)演算法将多个读数映射到多个参考基因组
15
。堆积由icra映射的多个读数以获得每个检测到的物种的每个位置的变体信息。两个样本之间一给定位置的一特定物种的所述变体的差异被定义为在被比较的所述两个样本中所述检测到的等位基因组之间没有交叉。所述估计的一对样本的物种dna序列相异性是多个不同位置的数量除以被比较的多个位置的总数(cp):
[0200]
[0201]
对于物种s,样本x、y至少为20kbp cp,以及一比较方法d。
[0202]
所述cp截止值表示每个碱基对低于0.00005(=1/20000)个变化的多个相异性可能因cp数量不同而不同。因此,我们将所述最小相异性检测阈值定义为每个碱基对0.00005个变化。
[0203]
将多个不同研究时间点的多个患者-供体相异性与一健康参考族群中的多个宿主内相异性进行比较
16,17
显示,在进行一fmt后,患者与其供体之间的多个相异性异常低(低于5e-5的所述检测阈值),表示多个供体菌株在所述患者体内的传播和定植(图2a)。因此,低于所述定义的检测阈值的多个相异性被称为“多個传播事件”或“菌株共享”。将一对样本的一聚合相异性分數定义为:
[0204][0205]
其中n是样本x与y之间多个共享菌株的数量。
[0206]
统计分析。通过使用所述wilcoxon符号排序检定来计算多个显着性水平,以便在两个匹配样本之间进行比较。根据pearson相关方法计算scorad降低与样本-相异性之间的相关性。两者都是使用scipy.stats python程式包实现的。
[0207]
样本处理。用于多个fmt胶囊的多个供体粪便样本和在所述研究期间从所述多个患者身上收集的多个粪便样本使用illumina nextseq定序成多个总体基因组读数。过滤掉了多个illumina配接器、多个低质量读数和多个人类相关读数。根据zeevi等人2中描述的所述“基于迭代覆盖的读取分配”(icra)演算法,将多个读数映射到多个参考基因组,这些参考基因组是从embl progenomes数据库处理的。过滤掉icra基因组分配概率小于0.99的多个读数。
[0208]
将icra映射的多个读数堆积起来以获得每个位置的变体信息。此步骤为所述样本中检测到的每一个物种产生了一物种等位基因计数矩(species allele counts matrix,sacm)。在每个sacm中,仅保留了至少5倍读取覆盖率的多个位置。覆盖率较低的多个位置从进一步分析中删除,并且称为多个未覆盖位置。所述以下多个步骤仅在具有30%或更多覆盖的多个位置的多个sacm上执行(读取覆盖率》=l倍)。
[0209]
参考群组
[0210]
以下被用作健康参考族群:
[0211]
表1
[0212][0213]
健康参考族群分析。所述健康参考族群数据是通过计算群组间多个成对相异性生成的。为了防止所述多个结果偏向具有多于一个样本的多个个体,对于每个物种和一对个
体,仅保留一个代表性比较。如果有多于一个比较可用,则选择最大化分配给所述多个相应sacm的多个读取的数量的比较。
[0214]
与基线、后安慰剂和供体样本的相异性
[0215]
在许多情况下,可以计算所述多个患者样本与多个基线/后安慰剂/供体样本之间的物种相异性。在这些情况下,为避免偏差并简化所述分析,仅保留最低的相异性以供进一步分析。
[0216]
示例2
[0217]
多次fmt治疗的ad患者的scorad降低
[0218]
共有15个ad患者参加了所述试验。由于无法遵守所述试验方案,四人没有进入所述研究,一个患者在所述试验的所述前两周(安慰剂期)由于疾病恶化决定开始使用一已经批准的药物。另一患者(患者6)通过使用多个灌肠剂违反了所述研究方案,因此可能影响所述肠道微生物群的组成。尽管他的临床症状有所改善,但他并未被纳入所述临床和粪便微生物群分析。最终入组并完成了所述研究的九个患者(5男4女),平均年龄44.6岁(24至68岁)。所述这些患者之一(患者8)未能提供多个粪便样本,因此不包括在所述粪便微生物群分析中。
[0219]
所述研究期间未报告任何不良事件。治疗前,所有9个符合分析条件的患者的所述平均scorad分数为51.2
±
16.2,其中4个患者归类为中度疾病(scorad 25-50),5个患者归类为重度(scorade》50)。入组前,所有患者均接受了稳定的局部疗法以及一种或多种全身治疗(表2);6个患者接受了光疗,2个患者接受了环孢素治疗,5个患者接受了口服普赖松(prednisone)治疗,一个患者在所述试验开始前6周接受了胺甲叶酸和dupilumab的所述负荷剂量的诱导治疗。
[0220]
表2:所述研究期间多个患者的多个特征及其多个scorad分数。
[0221][0222]
多个缩写:fmt-fecal microbial transplantation(粪便微生物移植);yrs-years(岁);f-female(女);m-male(男)
[0223]
在所述试验的所述安慰剂部分的所述结束时(第4周结束),ad严重程度没有显着变化(scorad增强2.5%
±
22.1%,wilcoxon p》0.85)。一个患者表现出31%的改善,四个患者表现出1-11%范围内的改善,其余四个患者的所述疾病的恶化,一平均scorad升高19%(范围3-51%)。
[0224]
开始所述研究的所有9个患者都完成了所述fmt方案。通过所述scorad分数评估的
疾病严重程度在所有患者中迅速改善(图3)。每一次fmt后,与第4周、所述安慰剂期的所述结束和所述fmt治疗期的开始时的所述分数相比,所述平均scorad分数显着降低(分别为53.3%
±
23.1%、62.9%
±
20%、61.2%
±
16.3%和59.2%
±
34.9%)。在所述整个fmt和追踪期间,平均持续18周(范围2-36周),scorad的最大降低甚至更高,平均为84%(上表2)。
[0225]
五个患者在平均持续14周(范围8-22周)的其追踪期间保持所述反应。四个患者在所述多次fmt后或所述追踪期间立即有一复发。有一scorad最大降低85%和87%的两个患者(患者2号和11号)出现一恶化,在最后一次fmt后32周和21周分别表现为所述分数从11分增加到49分以及从8分增加到36.5分。不过,尽管所述病情恶化,他们的scorad仍比基线降低了26.9%和41.6%。两个患者都接受了一额外的单一fmt并经历了疾病改善,所述scorad分数分别降低了80%和40%(图4)。
[0226]
其他两个有一良好初始反应,包括78%和79%的scorad降低的参与者有一快速复发,所述scorad分数升高。第12周的所述第一个(患者8号),从7到40,反映甚至从所述最初的32分开始恶化,以及所述第二个(患者12号)在第10周,从22到29,仍然比所述基线好59%。所述恶化导致转向不同的治疗。
[0227]
尽管有3个不同的健康粪便供体参与了所述研究,但在所述多个接受者之间的反应率方面没有显着差异。应该注意的是,大多数患者接受了来自一供体的所有fmt,然而,由于在某些时间点缺乏可用的多个粪便捐赠,三个患者接受了来自两个供体的多次fmt(上表2)。
[0228]
示例3
[0229]
供体对患者菌株传播和临床效果
[0230]
基于在被比较的所述两个样本中比较它们基因组的所述碱基对相似性,在来自两个不同样本的两个物种之间开发了一菌株箱异性分数(多种方法)。为了检查这种方法是否可以检测菌株传播,计算了多个不同研究时间点之间的多个患者-供体相异性,因为这些可能具有多个传播事件。将多个患者-供体相异性分数与从1200多个健康受试者的一大型参考族群中计算的多个宿主间相异性分数进行比较
16,17
。结果发现,在一fmt后,多个患者与其多个供体之间的许多(270次比较中的138次,51%)相异性异常低(低于所述检测阈值0.00005)的情况。在比较研究健康族群中的多个宿主间相异性时(460万次比较中的5775次,0.13%,图2a)以及在任一基线比较多个患者与其多个供体时(57次比较中的0次,0%)或在两剂安慰剂后(56次比较中的0次,0%),很少发现多个如此低的相异性分数。这些结果显示,低于所述检测阈值的多个相异性分数表示所述多个患者中多个供体菌株的多个传播事件和定植,因此低于所述定义的检测阈值的多个相异性被称为“多个传播事件”或“菌株共享”。
[0231]
总体而言,从多个供体到多个患者检测到48次传播事件,平均每个供体发生6
±
3.4次传播事件,并且在所述8个可获得粪便样本的可指控患者中至少发现了1次传播事件(图2b)。十三种物种被传播给不止一个患者,其中粪便普雷沃菌在所述8个患者的7个中传播(图2c)。
[0232]
将同一患者的多个下一个样本与他们自己进行比较,以从每一个个别患者的观点研究所述肠道微生物组在整个所述研究过程中的多个变化(图3a,未显示)。对于大多数患者,在基线和安慰剂治疗后发现多个菌株之间具有一高度相似性,表示微生物组具有高度
稳定性。相比之下,在所述多次fmt之后,发现了与基线多个菌株的多个高度相异性,表示所述微生物组菌株库的多个传播事件和多个变化。正如预期的那样,当将多个患者与其多个供体进行比较时,揭示了一幅镜像,即所述供体与每一个患者的基线和后安慰剂样本之间存在高度相异性,而所述fmt后相异性较低。总之,这些结果表示,在没有任何治疗(包括安慰剂)的情况下,多个患者的多个细菌菌株随着时间的推移是稳定的,但在fmt之后,一些菌株从多个供体传播并取代了多个患者体内存在的先前菌株(图5b)。
[0233]
作为对所述多个结果的一更全面的看法,基于可以在所述多个样本之间进行比较的所有物种的所述多个相异性分数,在两个样本之间设计了一个聚合相异性分数(多种方法),t-随机邻近嵌入法(t-sne)分析是在所有样本的所述成对相异性矩阵上执行(图6)。这种整体观说明,基线和安慰剂样本随机分布在整个所述空间中,而多个患者的多个后fmt样本聚集在其多个供体样本附近。因此,在fmt治疗后,多个患者的所述微生物组组成中的多个菌株变得与他们的多个供体相似,这表示多个细菌传播事件导致所述组成发生多个巨大转变。
[0234]
对基于所述多个样本的所述相对丰度数据计算的一bray-curtis相异性矩阵进行了一类似的分析(未显示)。在这种情况下,大多数患者的多个fmt后集群随机分布在整个所述空间中,并且不在其供体附近,这表示所述多次fmt的所述影响更多地反映在多个特定菌株的传播上,而不是所述相对丰度的多个变化。
[0235]
最后,我们发现疾病严重程度的所述改善(所述scorad分数的变化)与供体与其多个患者之间的所述样本相异性之间存在一显着相关性(r=0.76,p《4*10-8
,图7)。这些结果说明,从供体到患者的菌株传播的所述程度与多个临床改善之间存在一关联,这表示在ad的所述治疗中,从供体到患者的菌株传播可能存在偶然效应。
[0236]
虽然本发明结合其具体实施例而被描述,显而易见的是,许多替代、修改及变化对于那些本领域的技术人员将是显而易见的。因此,其意在包括落入所附权利要求书的精神和范围内的所有这些替代、修改及变化。
[0237]
在本说明书中提及的所有出版物、专利及专利申请以其整体在此通过引用并入本说明书中,其程度如同各单独的出版物、专利或专利申请被具体及单独地指明而通过引用并入本文中。此外,所引用的或指出的任何参考文献不应被解释为承认这些参考文献可作为本发明的现有技术。本技术中标题部分不应被解释为必要的限制。此外,本技术的任何优先权文件在此通过引用其整体并入本文中。
[0238]
参考文献
[0239]
(在整个申请中引用了其他参考文献)
[0240]
1.kowalska-e,czarnecka m,baran a.欧洲特应性皮炎的流行病学(epidemiology of atopic dermatitis in europe.)j drug assess 2019;8(1):126
–
8。
[0241]
2.renert-yuval y,guttman-yassky e.异位性皮肤炎的新变化(what’s new in atopic dermatitis.)dermatol clin 2019;37(2):205
–
13。
[0242]
3.wollenberg a,barbarot s,bieber t,et al.基于共识的欧洲成人和儿童异位性湿疹(异位性皮肤炎)治疗指南:第一部分(consensus-based european guidelines for treatment of atopic eczema(atopic dermatitis)in adults and children:part i.)j eur acad dermatol venereol 2018;32(5):657
–
82。
[0243]
4.huang jt,abrams m,tlougan b,rademaker a,paller as.治疗异位性皮肤炎中的金黄色葡萄球菌定植降低疾病严重程度(treatment of staphylococcus aureus colonization in atopic dermatitis decreases disease severity.)pediatrics 2009;123(5):e808-14。
[0244]
5.pothmann a,illing t,wiegand c,hartmann aa,elsner p.微生物组和异位性皮肤炎:综述(the microbiome and atopic dermatitis:a review.)am j clin dermatol 2019。
[0245]
6.sz
á
nt
ó
m,d
ó
zsa a,antal d,szab
ó
k,kem
é
ny l,bai p.瞄准肠道-皮肤轴-益生菌作为皮肤病管理的新工具?(targeting the gut-skin axis-probiotics as new tools for skin disorder management?)exp dermatol 2019。
[0246]
7.pan h-h,lue k-h,sun h-l,ku m-s.婴儿期肠胃炎是过敏性疾病的新危险因素(gastroenteritis during infancy is a novel risk factor for allergic disease.)medicine 2019;98(35):e16540。
[0247]
8.foliaki s,pearce n,b,et al.6岁和7岁儿童在婴儿期使用抗生素以及气喘、鼻结膜炎和湿疹症状:儿童第iii期气喘和过敏国际研究。
[0248]
(antibiotic use in infancy and symptoms of asthma,rhinoconjunctivitis,and eczema in children 6and 7years old:international study of asthma and allergies in childhood phase iii.)j allergy clin immunol 2009;124(5):982
–
9。
[0249]
9.reddel s,del chierico f,quagliariello a,et al.受异位性皮肤炎影响的儿童的肠道微生物相概况和益生菌混合物的肠道持久性的评估。(gut microbiota profile in children affected by atopic dermatitis and evaluation of intestinal persistence of a probiotic mixture.)sci rep 2019;9(1):4996。
[0250]
10.petersen ebm,skov l,thyssen jp,jensen p.肠道微生物相在异位性皮肤炎中的作用:系统性回顾。(role of the gut microbiota in atopic dermatitis:a systematic review.)acta derm venereol 2019;99(1):5
–
11。
[0251]
11.lee j,seto d,bielory l.益生菌預防和治療小儿异位性皮肤炎临床试验的統合分析。(meta-analysis of clinical trials of probiotics for prevention and treatment of pediatric atopic dermatitis.)j allergy clin immunol 2008;121(1):116
–
121.e11。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1