组织补偿膜的生成方法和组织补偿膜与流程
本发明涉及医疗材料领域,尤其涉及一种组织补偿膜的生成方法和组织补偿膜。
背景技术:
近年来,肿瘤发病率在不断增长,放射治疗作为肿瘤治疗的三大主要手段,在临床中得到了广泛的应用。随着调强技术的发展,对放疗剂量的精确控制,是现代放疗的核心内容之一。然而,由于用于放疗的各种粒子:光子/电子线/质子/重离子等,均存在剂量建成效应,会引起浅表肿瘤中靶区剂量不足,或皮肤剂量过高等问题。此时通常使用放疗组织补偿物来提高浅表靶区射线的剂量。
目前临床使用比较多的组织补偿物,为具有一定厚度的均匀方形硅胶等效组织补偿物。为解决其问题,已有一些相关技术可以定制化制作组织补偿物,其中,申请号为201610506056.3的专利公开了一种基于3d打印技术的放射治疗组织等效补偿物,其解决了皮肤贴合的问题,但厚度均匀,无法满足人体重要器官需要厚度更大的特殊保护的需求。申请号为201711480439.9的专利公开了一种用于调节放疗靶区剂量的个性化硅胶补偿物及其制备方法,其提出了一种非均匀厚度的定制化组织补偿物的制作方法,将重要器官的外表面外扩,使硅胶表面各处到达正常器官的距离相同,保护正常器官,其制作过程中需提取不同器官的三维信息,制作过程复杂且需要具备一定的医疗知识。申请号为201910143217.0的专利公开了一种3d打印定制化制作硅胶组织补偿物的方法,其在前两个专利的基础上,改进了硅胶倒模的方案,但模型需要医生手动设计。
现有技术中的组织补偿物仍存在以下问题:
1.目前临床最常用的组织补偿物为厚度一定的方形硅胶等效组织补偿物,但由于其形状固定,在使用过程中存在很多缺点,其一,人体体表往往是不规则的曲面,因此组织补偿物和体表之间贴合度不好,空气间隙的存在可显著降低表面剂量,缩小空气间隙,可以改善靶区剂量均匀度,提高放疗精准度,针对不规则体表,临床上通常应用自制的小米面袋、石蜡、湿纱布、凡士林(纱布)等填充间隙,但存在工艺粗糙、适形度差、组织均匀性差、重复性差等缺陷,使得浅表病变的实际放疗剂量存在很大的不确定性,影响疗效;其二,市售的组织补偿材料无法改变其厚度,很难达到临床要求,比如乳腺癌术后辅助放疗患者,可能需要用到3mm-10mm之间不同厚度的组织补偿物;其三,一些特殊情况下的乳腺癌患者,如保乳术后需要行乳腺皮肤照射的患者,还需要特殊的兼具摆位与补偿功能的装置来辅助。
2.近年来,基于3d打印的组织补偿膜,都只是在制作的方法上进行改进,具体的厚度还是需要医生手动勾画,没有采用剂量学的优化算法进行客观的评价。
技术实现要素:
为了解决上述技术问题,本发明公开了一种组织补偿膜的生成方法和组织补偿膜,其采用客观的优化算法和客观的评价指标,替代人工的经验,从而能够根据具体病例生成更好的组织补偿物形状,以为临床患者带来更高的临床受益。
具体地,本发明提供了一种组织补偿膜的生成方法,其包括如下步骤:s1:基于患者影像信息,获得初始的组织补偿膜;s2:使用当前获得的组织补偿膜进行剂量分布优化,以获得最优的计划剂量分布;s3:基于所述计划剂量分布对当前获得的组织补偿膜进行调整,获得调整后的组织补偿膜;s4:执行步骤s2,并判断剂量分布结果是否满足处方要求,若满足则跳转至步骤s5,否则继续执行步骤s3;s5:生成组织补偿膜。
进一步地,步骤s1包括:s10:根据患者影像信息和拟治疗的设备信息,对靶区和危及器官进行外扩,其中,外扩距离等于粒子的建成距离;s11:将外扩后的轮廓与皮肤轮廓进行布尔运算,获得组织补偿膜的初始轮廓;s12:将所获得的组织补偿膜轮廓按照实际使用的组织补偿膜的密度修改ct值。
进一步地,步骤s12包括:s120:对初始轮廓梯度变化较大的区域进行平滑,得到平滑后的轮廓;s121:将经平滑后的组织补偿膜轮廓按照实际使用的组织补偿膜的密度修改ct值。
进一步地,在步骤s2中,基于对靶区和危及器官的剂量贡献来进行剂量分布优化。
进一步地,在步骤s2中,通过设定剂量分布优化目标函数来进行剂量分布优化,所述剂量分布优化目标函数如下:
所述剂量分布优化目标函数如下:
fobj(xk)=α·foar(xk)+β·fptv(xk)
其中,foar(xk)为与所有危及器官有关的目标函数项,fptv(xk)为与所有靶区有关的目标函数项,noar为危及器官的个数,nti为第i个危及器官中的采样点数;ntptv为靶区中的采样点数;当器官中的点剂量违反约束时δj=1,否则δj=0;ωj为第j个点的权重;dj(xk)为第j个点的计算剂量;pj为第j个点的处方剂量;α,β为控制危及器官和靶区的重要性的归一化因子;nray为射束的总个数;ajm为单位强度的第m个射束对第j个点的剂量贡献,整个ajm构成的矩阵称为能量特征矩阵;
进一步地,在步骤s3中,基于步骤s2中获得的计划剂量分布,沿着皮肤法线方向,计算处方剂量线与靶区轮廓的距离,并根据该距离来修改组织补偿膜的厚度。
进一步地,步骤s3包括如下步骤:s30:沿皮肤法线方向,将组织补偿膜、靶区轮廓线和处方剂量线离散成多个网格,将每个离散网格对应的组织补偿膜的厚度记为d;s31:计算每个离散网格的处方剂量线与靶区轮廓线的距离h;s32:更新组织补偿膜的厚度dnew=d+λ*h,其中,λ表示调比因子。
进一步地,在步骤s4中,在执行步骤s2之前,先将获得的组织补偿膜按照实际使用的组织补偿膜的密度修改ct值。
进一步地,在步骤s5中,通过3d打印或者硅胶倒模的方式来生成组织补偿膜。
本发明还提供了一种组织补偿膜,其通过如上所述的方法生成。
附图说明
图1示出了现有技术中的不加组织补偿膜时的剂量分布;
图2示出了现有技术中的加等厚组织补偿膜时的剂量分布;
图3是本发明的组织补偿膜的生成方法的流程图;
图4是利用本发明的不均匀组织补偿膜获得的剂量分布。
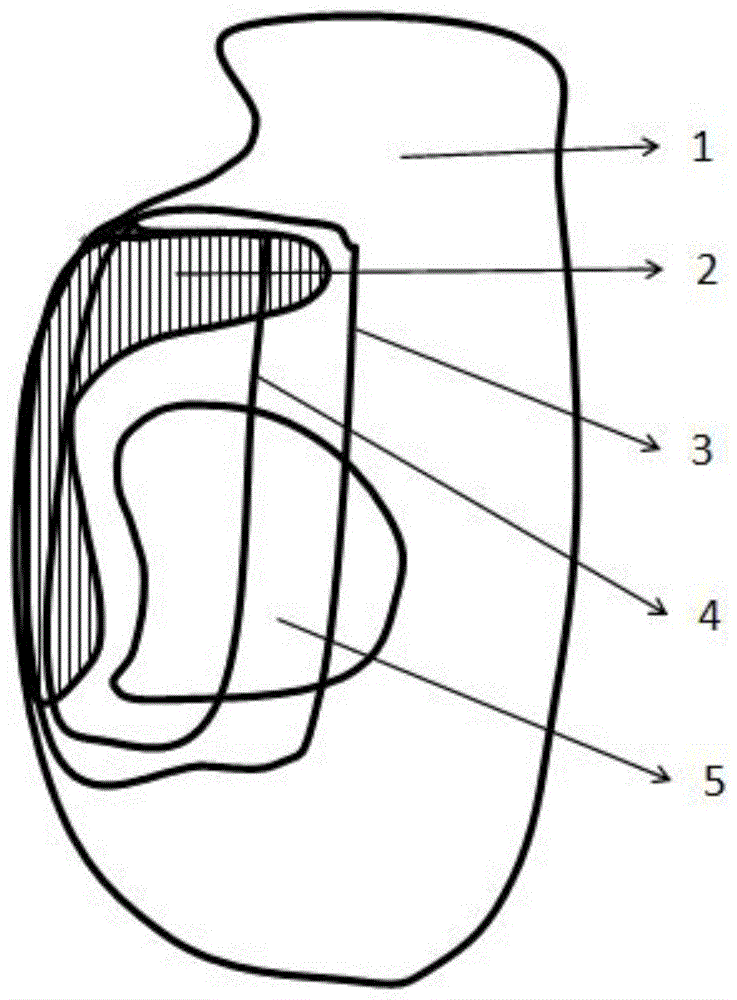
图中标号:1-人体,2-靶区,3-90%剂量线,4–100%剂量线,5–危及器官,6–等厚组织补偿膜,7–不均匀组织补偿膜。
具体实施方式
下面结合具体实施例对本发明的技术方案作进一步的描述,但本发明并不限于这些实施例。
本发明针对目前组织补偿膜在放疗中过于依赖医生主观经验的现状,采用客观的优化算法和客观的评价指标,来替代人工的经验,以能够根据具体病例生成更好的组织补偿膜形状。
参见图3,本发明的组织补偿膜的生成方法包括以下步骤:
s1:基于患者影像信息,获得初始的组织补偿膜;
s2:使用当前获得的组织补偿膜进行剂量分布优化,以获得最优的计划剂量分布;
s3:基于所述计划剂量分布对当前获得的组织补偿膜进行调整,获得调整后的组织补偿膜;
s4:执行步骤s2,并判断剂量分布结果是否满足处方要求,若满足则跳转至步骤s5,否则继续执行步骤s3;
s5:生成组织补偿膜。
具体地,步骤s1可包括:
s10:根据患者影像信息和拟治疗的设备信息,对靶区和危及器官进行外扩,其中,外扩距离等于粒子的建成距离。其中,通过拟治疗的设备信息来确定射线类型(光子线或者电子线)和射线能量大小,以据此确定粒子的建成距离。
s11:将外扩后的轮廓与皮肤轮廓进行布尔运算,减去皮肤的部分,将该部分转换为组织补偿膜的覆盖区域,从而获得组织补偿膜的初始轮廓。
s12:将所获得的组织补偿膜轮廓按照实际使用的组织补偿膜的密度修改ct值,即,修改为实际治疗时组织补偿膜的ct值,组织补偿膜一般会选择密度与组织相近的材料,ct值是ct图像中各组织与x线衰减系数相当的对应值。
进一步地,由于在步骤s11中获得的初始轮廓可能存在一些尖角和断掉的地方,为此需要对初始轮廓进行平滑处理,在这种情况下,上述步骤s12可包括:
s120:对初始轮廓梯度变化较大的区域进行平滑,得到平滑后的轮廓;
s121:将经平滑后的组织补偿膜轮廓按照实际使用的组织补偿膜的密度修改ct值。
通过上述步骤s1,即可获得组织补偿膜的初始解,该初始解用于进行下一步s2的剂量优化。
在进行剂量优化时,一般需要考虑剂量分布对靶区和危及器官的剂量贡献,也即,在步骤s2中,基于对靶区和危及器官的剂量贡献来进行剂量分布优化。
具体地,在步骤s2中,可以通过设定剂量分布优化目标函数来进行剂量分布优化,所述剂量分布优化目标函数如下:
fobj(xk)=α·foar(xk)+β·fptv(xk)
其中,foar(xk)为与所有危及器官有关的目标函数项,fptv(xk)为与所有靶区有关的目标函数项,noar为危及器官的个数,nti为第i个危及器官中的采样点数;ntptv为靶区中的采样点数;当器官中的点剂量违反约束时δj=1,否则δj=0;ωj为第j个点的权重;dj(xk)为第j个点的计算剂量;pj为第j个点的处方剂量;α,β为控制危及器官和靶区的重要性的归一化因子;nray为射束的总个数;ajm为单位强度的第m个射束对第j个点的剂量贡献,整个ajm构成的矩阵称为能量特征矩阵;
通过上述目标函数,对计划进行优化分割,得到最终的计划剂量分布。
在步骤s3中,基于在上述步骤s2中获得的计划剂量分布,沿着皮肤法线方向,计算处方剂量线与靶区轮廓的距离,并根据该距离来修改组织补偿膜的厚度。
具体地,步骤s3可以包括如下步骤:
s30:沿皮肤法线方向,将组织补偿膜、靶区轮廓线和处方剂量线离散成多个网格,将每个离散网格对应的组织补偿膜的厚度记为d,可以理解的,离散网格的具体数量取决于组织补偿膜的面积大小等;
s31:计算每个离散网格的处方剂量线与靶区轮廓线的距离h;
s32:更新组织补偿膜的厚度dnew=d+λ*h,其中,λ表示调比因子,其是算法迭代过程中的经验常数。
在具体的实施例中,在步骤s4中,将步骤s3生成的组织补偿膜,先按照实际使用的组织补偿膜的密度修改ct值,然后执行步骤s2的优化分割,并评估靶区和危及器官的剂量分布是否满足预先给定的剂量约束目标或处方要求。若满足,则跳至步骤s5,若不满足,则继续进行步骤s3的调整。
在具体的实施例中,在步骤s5中,将通过上述步骤得到的满足临床需求的组织补偿膜导出,可以使用任意方式进行生成,例如3d打印或者硅胶倒模的方式。
在本发明的其他实施方式中,还提供了一种组织补偿膜,其通过如上所述的方法生成。
在本发明中,通过采用迭代优化的算法,对组织补偿物的形状及厚度进行优化,解决了传统的均匀组织补偿物对放疗剂量的影响,改进了由靠医生经验设计组织补偿物的方法,使用最终的剂量分布来评估对病人的影响,给病人更好的计划。
参见图4,其示出了利用本发明的不均匀组织补偿膜获得的剂量分布,显然,与图1和图2现有技术中的剂量分布相比,其剂量分布更优,从而能够为病人提供更优的放射治疗计划。
以上所述的仅是本发明的优选实施方式,应当指出,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!