PRPF8表达抑制剂在制备治疗肺癌的药物中的应用
prpf8表达抑制剂在制备治疗肺癌的药物中的应用
技术领域
1.本发明涉及生物技术领域,尤其涉及一种prpf8表达抑制剂在制备治疗肺癌的药物中的应用。
背景技术:
2.肺癌是常见的恶性肿瘤,非小细胞肺癌(nsclc)是肺癌的一种,约占80%
‑
85%,仅次于女性乳腺癌。非小细胞肺癌的治疗方案主要以化疗为主。到目前为止,顺铂仍然是nsclc治疗的最广泛的一线化疗药物。但是,治疗效果并不显著,根本原因是并没有从蛋白产生的源头开始寻找靶基因。
3.prpf8蛋白约280kda,是u5 snrnp剪接体装配动力学的中心。它不仅在rna底物中与5'的分支点和3'剪切位点中的多嘧啶区域形成直接接触。同时也参与了u5和u6snrnas组成。在人类常染色体显性遗传性视网膜炎中发现,prpf8可产生影响剪切体组装和功能的突变,引起局部疾病,导致细胞减少。
4.目前,prpf8在肺癌发生、迁移和侵袭中的功能未见相关报道。
技术实现要素:
5.本发明的目的是提供一种prpf8表达抑制剂在制备治疗肺癌的药物中的应用。
6.本发明prpf8表达抑制剂在制备治疗肺癌的药物中的应用。
7.优选的,所述肺癌为非小细胞肺癌。
8.进一步的,所述prpf8表达抑制剂包括下述至少一种:
9.特异性抑制prpf8表达的化合物;
10.特异性干扰prpf8表达的干扰分子;
11.特异性与prpf8蛋白结合的抗体或配体。
12.prpf8基因敲减试剂,所述prpf8基因敲减试剂为特异性敲减prpf8的基因编辑试剂。
13.进一步的,所述干扰分子为mirna或sirna。
14.进一步的,所述prpf8基因敲减试剂包括一种表达载体,所述表达载体包括一种shrna片段的dna编码序列,所述shrna片段的靶基因为prpf8基因。
15.优选的,所述shrna片段的序列如序列表中seq id no:1所示。
16.优选的,所述表达载体为质粒载体或病毒载体。
17.本发明还提供一种治疗肺癌的药物,包括一种prpf8基因敲减试剂,所述prpf8基因敲减试剂包括一种shrna片段,所述shrna片段的靶基因为prpf8基因。
18.优选的,所述shrna片段的序列如序列表中seq id no:1所示。
19.优选的,所述肺癌为非小细胞肺癌。
20.本发明还提供一种试剂在制备试剂盒中的应用,所述试剂用于定量检测prpf8蛋白表达水平,所述试剂盒用于判断药物治疗肺癌的有效性。
21.优选的,所述肺癌为非小细胞肺癌。
22.本发明的有益效果:
23.人类prpf8的功能缺失突变延迟了剪接体组分对前mrna的组装,并且抑制了9%(5/57)受试基因的剪切,产生功能不同的蛋白,对疾病的发生和肿瘤的生长具有重要的作用。
24.本发明通过在非小细胞肺癌细胞系中敲减prpf8可抑制细胞的生长,抑制细胞克隆形成能力,因此在非小细胞肺癌中prpf8可作为新型的抑制剂,用于临床对非小细胞肺癌的治疗。
25.通过抑制该基因的表达量可抑制非小细胞肺癌的细胞生长,可成为临床上治疗非小细胞肺癌的药物。
附图说明
26.图1为敲降细胞系荧光鉴定结果;
27.图2为prpf8敲降细胞系wb鉴定结果;
28.图3为kegg富集分析结果;
29.图4为a549敲降prpf8细胞生长曲线结果;
30.图5为a549敲降prpf8细胞克隆形成结果;
31.图6为imagej分析图5克隆形成结果;
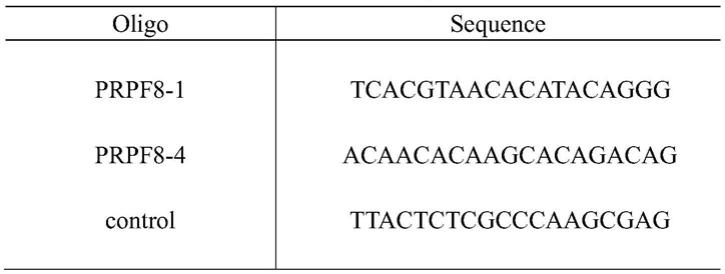
32.图7为mda
‑
mb
‑
468敲降prpf8细胞生长曲线;
33.图8为mda
‑
mb
‑
468敲降prpf8细胞克隆形成结果;
34.图9为imagej分析图8克隆形成结果。
具体实施方式
35.下面对本发明的实施例做详细说明,以下实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方案和具体的操作过程,但本发明的保护范围不限于下述的实施例。
36.实施例1、生物信息学分析prpf8在肺癌中的表达
37.利用数据库对prpf8在肺癌中的表达进行分析,通过kegg等数据库对prpf8进行富集分析,关注肺癌中prpf8调控的通路,分析prpf8在肺癌中的主要作用途径。
38.实施例2、敲降细胞系的建立
39.根据prpf8序列设计合成2条shrna,如下表所示,连入p
‑
gipz和p
‑
tripz载体上(购买自美国addgene生物技术有限公司,usa)。
40.表shrna序列
[0041][0042]
实施例3、慢病毒制备
[0043]
(1)293t细胞接种25cm小瓶,过夜培养后弃培养基,换2.5ml dmem无抗培养基;
[0044]
(2)将质粒ppax2、pmd2、gipz
‑
ctrl;质粒ppax2、pmd2、gipz
‑
prpf8
‑
1;质粒ppax2、pmd2、gipz
‑
prpf8
‑
4混匀后,加入250μl opti
‑
mem培养基,再用250μl opti
‑
mem培养基稀释lipo2000,室温放置5min后,将质粒与lipo2000混合,室温放置20min,加入293t细胞中;
[0045]
(3)5%co2培养18h后换dmem培养基;
[0046]
(4)继续培养48h后回收上清,并用0.45μm滤膜过滤;
[0047]
(5)加入1/3体积的病毒浓缩液(25%peg8000/0.75m nacl),混匀后4℃过夜;
[0048]
(6)然后于4℃、1500g离心45min,弃上清,沉淀用1640培养基溶解,分别得到gipz
‑
ctrl、gipz
‑
prpf8
‑
1、gipz
‑
prpf8
‑
4病毒上清。分装,
‑
80℃保存。
[0049]
实施例4、细胞转染
[0050]
(1)嘌呤浓度的筛选
[0051]
将a549细胞系用胰酶消化3分钟,用培养基重悬成单细胞悬液,调整细胞密度为每孔105个细胞,培养30小时后,换成含嘌呤不同浓度的培养基,终浓度分别为:0.25μg/ml、0.4μg/ml、0.6μg/ml、0.75μg/ml、1.0μg/ml,每隔24h换液一次,连续培养7天,观察到细胞死亡的浓度,即最适嘌呤霉素浓度。
[0052]
(2)病毒转染
[0053]
a549细胞接种6孔板,每孔细胞2
×
105个细胞,过夜培养;24h后弃培养基,用pbs洗一次,加入1.2ml无抗、无血清含polybrene的新鲜培养基;加入gipz
‑
ctrl、gipz
‑
prpf8
‑
1、gipz
‑
prpf8
‑
4病毒上清;32℃2000rpm离心1h;37℃5%co2培养5h后,每孔加入1ml完全培养基;培养24h后弃培养基,加入含puromycin(终浓度0.75μg/ml)新鲜培养基,每三天换液一次;培养5天后收细胞,提rna。
[0054]
实施例5、q
‑
pcr鉴定
[0055]
将细胞接种6孔板,每孔2
×
105个细胞,过夜培养后弃培养基,加入新鲜的含puromycin培养基,每天换液一次,连续3天后收细胞,提取rna反转录成cdna。进行q
‑
pcr。
[0056]
q
‑
pcr反应体系如下:
[0057][0058]
实时定量pcr反应程序:预变性94℃5min,95℃10sec,60℃20sec,72℃10sec,共40个循环。
[0059]
实施例6、细胞增殖检测
[0060]
a549细胞6孔板每孔接种2
×
105个/孔,加入gipz
‑
ctrl、gipz
‑
prpf8
‑
1、gipz
‑
prpf8
‑
4病毒,嘌呤霉素puromycin 0.75μg/ml筛选5天后,收细胞接种96孔板,每孔1
×
104个细胞,每个细胞系设6个重复孔,连续培养7天,每天用cck8试剂盒测od值。
[0061]
实施例7、细胞克隆形成实验
[0062]
a549细胞6孔板每孔接种2
×
105个/孔,加入gipz
‑
ctrl、gipz
‑
prpf8
‑
1、gipz
‑
prpf8
‑
4病毒,嘌呤霉素puromycin筛选5天后,调整细胞数目,6孔板每孔接种500个/孔,每个细胞系3个样本重复,培养7天后,弃培养基,用pbs洗涤细胞2次后,每孔加入1ml甲醇固定细胞20min,弃甲醇pbs洗涤2次,每孔加入1ml 1%结晶紫溶液,室温染色20min后,pbs洗涤2次,ddh2o洗涤一次,凝胶成像系统拍照。
[0063]
为了验证prpf8对肺癌细胞生长的抑制作用是仅限于对肺癌细胞内的作用机制,我们采用同样的方法和同一批制备的病毒侵染乳腺癌mda
‑
mb
‑
468细胞,在乳腺癌细胞中敲降prpf8检测细胞的生长能力。
[0064]
敲降细胞系荧光鉴定结果如图1所示,左侧为tripz
‑
shctrl doxycycline诱导72h;中间为tripz
‑
shprpf8
‑
1 doxycycline诱导72h,右侧为tripz
‑
shprpf8
‑
4 doxycycline诱导72h。prpf8敲降细胞系wb鉴定结果如图2所示。
[0065]
检测结果说明:
[0066]
1、图3为kegg富集分析结果,通过kegg对肺癌中prpf8表达的分析得出,在肺癌中prpf8与多条通路密切相关,其中包括pi3k
‑
akt信号通路、顺铂耐药、小细胞肺癌、同源重组等等,在这些调控通路中pi3k
‑
akt信号通路最为显著,pi3k
‑
akt信号通路是典型的细胞生长调控通路,调节细胞生长通路,因此提示prpf8与肺癌细胞的生长有关。
[0067]
2、为了研究prpf8在非小细胞肺癌中的作用,我们在a549细胞中建立了prpf8敲降细胞系。p
‑
tripz
‑
shprpf8
‑
1、p
‑
tripz
‑
shprpf8
‑
4、p
‑
ripz
‑
shctrl慢病毒转染a549细胞,嘌呤霉素puromycin 0.75μg/ml筛选5天后,收取细胞提rna,qpcr检测a549
‑
tripz
‑
prpf8
‑
1、a549
‑
tripz
‑
prpf8
‑
4、a549
‑
tripz
‑
ctrl细胞系中prpf8mrna表达降低了1.5和1.63倍。
[0068]
3、敲降prpf8抑制a549细胞生长
[0069]
为了验证prpf8在肺癌细胞生长中的作用,我们在a549细胞构建的敲降细胞系中用cck
‑
8试剂盒检测细胞的增殖,用1%结晶紫染色观察细胞的克隆形成能力,结果显示
a549细胞敲降prpf8后,细胞增殖能力受到抑制,a549细胞敲降prpf8后细胞的克隆形成能力下降(p<0.05),凋亡细胞增多,细胞生长变缓慢。
[0070]
a549敲降prpf8细胞生长曲线如图4所示,图4中
■
表示ctrl,
●
表示prpf8
‑
1,
▲
表示prpf8
‑
4。在a549细胞中沉默prpf8显著降低了细胞克隆形成的能力。
[0071]
a549敲降prpf8细胞克隆形成结果如图5所示,在a549细胞中敲降prpf8后细胞克隆形成能力降低。
[0072]
imagej分析克隆形成结果如图6所示,敲降prpf8后shprpf8细胞克隆形成能力显著降低(p<0.05)。
[0073]
4、乳腺癌细胞系中敲降prpf8实验
[0074]
mda
‑
mb
‑
468敲降prpf8细胞生长曲线如图7所示,图7中
◆
表示ctrl,
■
表示prpf8
‑
1,
▲
表示prpf8
‑
4。mda
‑
mb
‑
468敲降prpf8细胞克隆形成结果如图8所示。imagej分析克隆形成结果如图9所示。
[0075]
mda
‑
mb
‑
468乳腺癌细胞系中敲降prpf8后,监测5天细胞生长曲线,结果显示与对照组相比,prpf8敲降组细胞生长无差异(p>0.05),细胞克隆形成试验中,敲降组细胞克隆形成能力降低不显著(p>0.05),因此证明prpf8调控细胞生长的能力是在肺癌中特有的,在其他癌症中不具有同样的调控能力。每种癌症因为发病器官不同,产生的机制不同,癌细胞内的调控途径也不同,因此这种调控具有器官异质性,肿瘤异质性。
[0076]
5、为了进一步证明prpf8在肺癌中调控细胞生长的能力是特有性的,我们利用数据库对乳腺癌中prpf8的表达与富集进行分析,结果发现prpf8与多条通路密切相关,其中prpf8与9条通路具有显著相关性(p
‑
value<0.05),这9条通路涉及核糖体、氧化应激反应、帕金森综合征、心肌收缩、亨延顿综合征、老年痴呆症、p450的代谢以及蛋白酶体等9方面的调控,但与细胞生长调控无关。
[0077]
以上得出的实验结果证实,在非小细胞肺癌中敲除prpf8可抑制癌细胞的生长,因此针对prpf8合成的抑制剂能高效的抑制体内癌细胞的生长,降低肿瘤细胞的生存,是临床有效的治疗药物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程