青春双歧杆菌在衰老延缓方面的应用的制作方法
1.本发明属于生物技术领域,尤其是涉及青春双歧杆菌在衰老延缓方面的应用。
背景技术:
2.随着老年人口的快速增长,老龄化在全球引起了广泛的社会关注。根据预测,到2050年,全球60岁及以上的人口将增加到20亿,占总人口的21%。我国作为全球人口大国,老龄化发展也十分迅速,预计到2100年老年人口将达总人口的31.09%。而老龄化群体普遍伴随着身体健康状况下降,机体对多个系统疾病的抵抗力均下降,与年龄相关疾病的发病率明显上升。因此,个人、家庭和社会将面临沉重的医疗保健负担。目前,除了生活方式调节,仍没有公认的简单、高效、性价比高的延缓衰老的措施。基于这一现状,进行衰老的机制研究并积极寻找延缓衰老的干预措施具有非常重要的意义。
3.严格意义来说,衰老并不是一种疾病,而是整个机体器官的一个过程和状态,其特征是生理功能恶化,细胞功能下降,是病理改变的发展基础。传统的衰老干预措施包括基因改造,生活方式和环境风险控制。近年来,肠道菌群已被证明在多种疾病的发生发展过程中起重要调节作用,作为机体微生物群的最大组成部分,肠道菌群不仅可以直接影响肠道的功能,也可通过脑
‑
肠轴、脑
‑
肝轴、脑
‑
肾轴等复杂的途径调节肠道外器官的生理功能。国内外不同队列的人群研究均证实,不同年龄层的肠道菌群构成和丰度有明显差异。
技术实现要素:
4.本发明第一个目的在于,针对现有技术中存在的不足,提供青春双歧杆菌组合物在生物体衰老延缓方面的应用。
5.在采用上述技术方案的同时,本发明还可以采用或者组合采用如下技术方案:
6.作为本发明的优选技术方案:所述青春双歧杆菌组合物包括青春双歧杆菌和辅料。
7.作为本发明的优选技术方案:所述辅料为pbs缓冲液或者蔗糖溶液和标准玉米粉或者m9缓冲液。
8.本发明的第二个目的在于,针对现有技术中存在的不足,提供青春双歧杆菌在细胞衰老延缓方面的应用。
9.本发明的第三个目的在于,针对现有技术中存在的不足,提供青春双歧杆菌在果蝇内sod
‑
3基因和过氧化氢酶cat基因调节方面的应用。
10.本发明的第四个目的在于,针对现有技术中存在的不足,提供青春双歧杆菌在秀丽隐杆线虫内ctl
‑
2基因调节方面的应用。
11.本发明的第五个目的在于,针对现有技术中存在的不足,提供青春双歧杆菌在小鼠内过氧化氢酶cat基因调节方面的应用。
12.本发明的第六个目的在于,针对现有技术中存在的不足,提供青春双歧杆菌在小鼠内p53基因调节方面的应用。
13.本发明的第七个目的在于,针对现有技术中存在的不足,提供青春双歧杆菌在小鼠的氧化应激代谢物调节方面的应用。
14.本发明的第八个目的在于,针对现有技术中存在的不足,提供青春双歧杆菌在改善小鼠肠道系统增龄方面的应用,尤其是在在改善小鼠肠道系统增龄相关表型方面的应用。
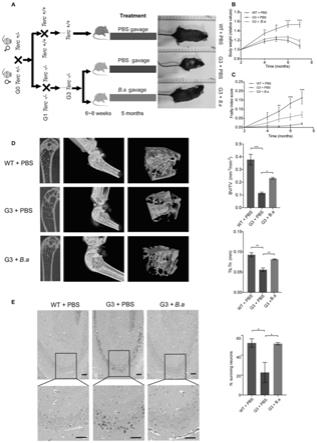
15.本发明的第九个目的在于,针对现有技术中存在的不足,提供青春双歧杆菌在制备生物体养老延缓药物的用途。
16.本发明的还有一个目的在于,针对现有技术中存在的不足,提供过氧化氢酶作为衰老延缓靶点在制备生物体养老延缓药物的用途。
17.本发明提供青春双歧杆菌在衰老延缓方面的应用,通过体内体外实验明确了青春双歧杆菌在细胞衰老延缓方面、果蝇内sod
‑
3基因和过氧化氢酶cat基因调节、秀丽隐杆线虫内ctl
‑
2基因调节、小鼠内过氧化氢酶cat基因调节、小鼠内p53基因调节、小鼠的氧化应激代谢物调节,小鼠的肠道增龄尤其是相关表型相关的改善等方面均具有作用,具有在制备生物体衰老延缓药物的用途以及将过氧化氢酶作为衰老延缓靶点在制备生物体衰老延缓药物的用途的前景。
附图说明
18.图1中:a和b分别为:野生型果蝇w
1118
(a)和canton
‑
s(b)的生存曲线(b.a为添加青春双歧杆菌组;nc为2.5%蔗糖溶液对照组,每组约100只果蝇);
19.c和d分别为:野生型果蝇w
1118
(c)和野生型果蝇canton
‑
s(d)在第30天的爬管能力比较(b.a为添加青春双歧杆菌组;nc为2.5%蔗糖溶液对照组,每组约60只果蝇);
20.数据以均数
±
标准误表示,并进行t检验分析。
**
p<0.01;
***
p<0.001;n.s.,不显著。
21.图2中:a和b分别为:分别饲喂野生型秀丽隐杆线虫n2大肠杆菌op50、大肠杆菌op50和青春双歧杆菌1:1混合或1:2混合的食物后,线虫的生存曲线(a)和平均最长寿命(b),每组150条线虫;
22.c为:野生型秀丽隐杆线虫n2的运动能力量化分析。分别用大肠杆菌op50或大肠杆菌op50和青春双歧杆菌1:1混合物喂养第2天、第8天和第16天进行分析,每组50条线虫;
23.d为:野生型秀丽隐杆线虫n2的运动能力分级,分别用大肠杆菌op50或大肠杆菌op50和青春双歧杆菌1:1混合物喂养第8天和第16天进行分析。a级:代表自发运动或对刺激有剧烈运动反应;b级:除非被刺激不运动或似乎有不协调的动作;c级:在受到刺激时只移动头部和/或尾部;d级:死亡;每组50条线虫;
24.e为:野生型秀丽隐杆线虫n2在热应激下的平均存活时间。分别用大肠杆菌op50或大肠杆菌op50和青春双歧杆菌1:1混合物喂养,在第4天、第8天和第12天进行抗热应激能力分析,每组30条线虫;
25.f和g分别为:肠道脂褐素沉积的自体荧光图像(f)和定量比较(g),其中:每组大于20条线虫;比例尺:100μm。
26.数据以均数
±
标准误表示,并进行t检验分析。
**
p<0.01;
***
p<0.001;n.s.,不显著。
27.图3中:a为:将terc
‑
/
‑
g0小鼠(c57bl/6)交叉杂交产生terc
+/+
(野生型c57bl/6)和terc
‑
/
‑
g1小鼠。将获得的terc
‑
/
‑
g1小鼠进行交叉杂交产生terc
‑
/
‑
g3小鼠,并分为三组进行
进一步研究。将6~8周龄野生型c57bl/6设为对照组(wt+pbs,n=11),灌胃pbs;terc
‑
/
‑
g3小鼠随机分为pbs灌胃组(g3+pbs,n=9)和青春双歧杆菌组(g3+b.a,n=12)。每隔一天灌胃一次,直到7个月大时自然死亡或处死;
28.b和c分别为:体重(b)与虚弱指数(c)相对值曲线;
29.d为:计算机断层扫描(ct)和显微ct重建骨块图。用vgstudiomax软件进行分析骨体积/总体积(bv/tv)和骨小梁厚度(tb.th),n=3;
30.e为:海马ca3区苏木精和伊红染色图。图示各组海马ca3区存活神经元的数量。比例尺,100μm。
31.数据以均数
±
标准误表示,并进行单因素方差分析。
*
p<0.05;
**
p<0.01;
***
p<0.001;
32.****
p<0.0001;n.s.,不显著。
33.图4中:a和b分别为:第4代(p4)和第12代(p12)复制性衰老mefs细胞补充pbs(nc)或青春双歧杆菌(b.a)的衰老相关β
‑
半乳糖苷酶(sa
‑
β
‑
gal)染色(a)和sa
‑
β
‑
gal阳性细胞的相应百分比(b),比例尺:100μm;
34.c和d分别为:野生型mefs添加pbs(nc)、dox诱导性衰老的mefs细胞添加pbs(d
‑
sen)和青春双歧杆菌(d
‑
sen+b.a)的sa
‑
β
‑
gal染色的代表性图像(c)和sa
‑
β
‑
gal阳性细胞的相应百分比(d),比例尺:100μm。数据以均数
±
标准误表示,并进行t检验分析;
*
p<0.05;
**
p<0.01;dox,阿霉素;
35.e为:cat在第4代(p4)和第12代(p12)复制性衰老mefs细胞中的实时定量pcr表达量测定和比较;
36.f为:cat在第4代(p4)和第12代(p12)复制性衰老mefs细胞和dox诱导性衰老mefs细胞(添加pbs(d
‑
sen)或青春双歧杆菌(d
‑
sen+b.a))中的蛋白表达量的免疫印迹实验对比;
37.g为:实时荧光定量pcr检测添加pbs(d
‑
sen)和青春双歧杆菌(d
‑
sen+b.a)的dox诱导的衰老mefs中cat的表达;
38.数据以均数
±
标准误表示,并进行t检验分析。
**
p<0.01;
***
p<0.0001;n.s.,不显著;dox,阿霉素。
39.图5中:a和b分别为:添加青春双歧杆菌(b.a)或2.5%蔗糖溶液(nc)的雄性和雌性果蝇中sod
‑
3和cat的mrna相对表达。
40.数据以均数
±
标准误表示,并进行t检验分析。
**
p<0.01;
***
p<0.0001;n.s.,不显著。
41.图6中:a为:分别用大肠杆菌op50或大肠杆菌op50与青春双歧杆菌1:1混合物喂养线虫后,衰老相关基因mrna水平的的相对表达量;
42.b和c分别为:线虫sod
‑
3突变体(b)和ctl
‑
2突变体(c)与野生型n2的生存曲线比较,其中:每组150条线虫;
43.d为:分别用大肠杆菌op50或大肠杆菌op50与青春双歧杆菌1:1混合物喂养线虫后,野生型线虫n2和线虫ctl
‑
2突变体的平均最长寿命比较;
44.e和f分别为:分别用大肠杆菌op50或大肠杆菌op50与青春双歧杆菌1:1混合物喂养线虫后,野生型线虫n2第10天和第14天mcherry荧光对比ctl
‑
2表达(e)和定量比较(f)。
每组大于20条线虫,比例尺:100μm;
45.g为:分别用大肠杆菌op50或大肠杆菌op50与青春双歧杆菌1:1混合物喂养线虫后,第2天和第8天野生型线虫n2和线虫ctl
‑
2突变体的运动能力量化分析,其中:每组20条线虫;
46.h为:分别用大肠杆菌op50或大肠杆菌op50与青春双歧杆菌1:1混合物喂养线虫后,第4天、第8天和第12天比较野生型线虫n2和线虫ctl
‑
2突变体在热应激下的平均存活时间,每组30条线虫;
47.i和j分别为:分别用大肠杆菌op50或大肠杆菌op50与青春双歧杆菌1:1混合物喂养线虫后,在第14天肠道脂褐素沉积的自体荧光图像(i)和定量比较(j),其中:每组大于20条线虫,比例尺:100μm。
48.数据以均数
±
标准误表示,并进行t检验分析。
*
p<0.05;
**
p<0.01;
****
p<0.0001;n.s.,不显著。
49.图7中:a为:测定并比较7个月龄野生型小鼠(wt+pbs,n=10)、terc
‑
/
‑
g3 pbs灌胃小鼠(g3+pbs,n=6)和terc
‑
/
‑
g3青春双歧杆菌灌胃小鼠(g3+b.a,n=9)小鼠肌肉和大脑匀浆中cat的活性;
50.b为:应用实时定量pcr技术检测3组7月龄小鼠肌肉组织中cat的相对表达;n=10,6,9;
51.c和d分别为:小鼠肌肉(b)和大脑(c)组织cat蛋白表达量的免疫印迹实验对比;
52.e为:cat在海马ca3区、dg区和大脑皮质区的免疫组织化学染色。比例尺:50μm。
53.图8中:三组海马dg区p53免疫组化染色的代表性图像,比例尺,200μm。黑框放大图像显示在下图。比例尺,50μm。wt+pbs表示野生型c57bl/6小鼠灌胃pbs;g3+pbs表示terc
‑
/
‑
g3小鼠灌胃pbs;g3+b.a表示terc
‑
/
‑
g3小鼠灌胃青春双歧杆菌。
54.数据以均数
±
标准误表示,并进行t检验分析。
**
p<0.01;
***
p<0.0001。
55.图9中:a为:terc
‑
/
‑
g3小鼠灌胃pbs(n=7)或青春双歧杆菌(n=9)后肠道代谢物的火山图分析。标记的数据点显示代谢物的丰度相差两倍或更多。红框表示青春双歧杆菌灌胃小鼠粪便中代谢物的富集,蓝框表示pbs灌胃小鼠粪便中代谢物的富集。
56.b为:层次聚类分析热图。蓝色或红色方框表示代谢物丰度的倍数变化小于或大于平均值。g3+pbs表示terc
‑
/
‑
g3小鼠灌胃pbs,n=7;g3+b.a表示terc
‑
/
‑
g3小鼠灌胃青春双歧杆菌,n=9。
57.c为:质量控制(qc)样品正负离子模式下的总离子色谱(tic)图。1,人参皂甙ia;2,胆酸;3,次黄嘌呤;4,4
‑
三甲基氨丁酸;5,肠二醇;6,芹菜甙;7,3
‑
脱羟基肉碱;8,芥酸;9,9,10
‑
dhome;10,波斯菊素;11,大豆苷;12,2
‑
羟基肉桂酸;13,l
‑
苹果酸。青春双歧杆菌灌胃的terc
‑
/
‑
g3小鼠中较高浓度的代谢物标记为红色;在pbs灌胃的terc
‑
/
‑
g3小鼠中,浓度较高的代谢物标记为蓝色。
58.图10中:a为:持续干预7个月龄小鼠小肠形态学改变图;
59.b为:测定并比较持续干预7个月龄小鼠小肠长度(cm);
60.c为:持续干预7个月龄小鼠小肠黏膜层形态变化(绒毛高度,绒毛宽度,隐窝深度)he镜下结构图;
61.d为:持续干预7个月龄小鼠小肠黏膜层形态变化(绒毛高度,绒毛宽度,隐窝深度)
统计图(n=6
‑
9/组);
62.e为:持续干预7个月龄小鼠小肠上皮杯状细胞数量变化(pas染色)镜下结构图;
63.f为:持续干预7个月龄小鼠小肠上皮杯状细胞数量变化(pas染色)统计图(n=6
‑
9/组);
64.g为:持续干预7个月龄小鼠小肠屏障蛋白(zo
‑
1,occlodin,muc2)的免疫荧光表达量(n=6
‑
9/组);
65.h为:持续干预7个月龄小鼠小肠衰老相关分泌表型(sasp)mrna表达量(n=3
‑
4/组);
66.i为:持续干预7个月龄小鼠小肠衰老相关基因(p21,p53)和免疫组化(p21,p53)表达量(n=6
‑
9/组)。
67.wt+pbs表示野生型小鼠灌胃pbs,g3+pbs表示terc
‑
/
‑
g3小鼠灌胃pbs,g3+b.a表示terc
‑
/
‑
g3小鼠灌胃青春双歧杆菌,比例尺:100μm。
68.图11中:a为:持续干预7个月龄小鼠结肠黏膜结构(he染色)及杯状细胞数量(pas染色)变化图,n=6
‑
9/组;
69.b为:持续干预7个月龄小鼠结肠衰老相关基因(p21、p53)的mrna表达量(n=4
‑
7/组);
70.c为:持续干预7个月龄小鼠结肠衰老相关蛋白(p21、p53)的表达量(n=4
‑
7/组);
71.d为:持续干预7个月龄小鼠结肠干细胞相关蛋白(lgr5 ascl2)的表达量(n=4
‑
7/组)。
72.wt+pbs表示野生型小鼠灌胃pbs,g3+pbs表示terc
‑
/
‑
g3小鼠灌胃pbs,g3+b.a表示terc
‑
/
‑
g3小鼠灌胃青春双歧杆菌。
具体实施方式
73.参照附图和具体实施例对本发明作进一步详细地描述。
74.1.本发明考察了青春双歧杆菌(bifidobacterium adolescentis,b.a)组合物在生物体(具体指果蝇、线虫及小鼠等模式生物)延缓衰老方面的应用。
75.1.1爬管是一种运动能力,是表征健康寿命的重要指标。本发明将青春双歧杆菌添加到果蝇的标准食物里面,绘制果蝇的生存曲线并在特定的时间节点检测果蝇的爬管能力。通过一系列试验考察了青春双歧杆菌对果蝇衰老的延缓作用,验证了外源性补充青春双歧杆菌(b.a)可以促进果蝇长寿并改善果蝇的健康寿命指标。在野生型果蝇w
1118
和canton
‑
s中,青春双歧杆菌干预组的中位生存时间、平均寿命和平均最高寿命明显高于对照组,如图1a和1b所示,左侧为雄性果蝇,右侧为雌性果蝇;在第30天,青春双歧杆菌干预组的爬管能力也明显比对照组要更强,如图1c和1d所示。
76.1.2本发明将青春双歧杆菌添加到线虫常规的食物尿嘧啶缺陷型大肠杆菌(e.coli op50)中,绘制线虫的生存曲线并在特定的时间点检测线虫的各项健康寿命指标。通过一系列试验考察了青春双歧杆菌对线虫衰老的延缓作用,验证了外源性补充青春双歧杆菌可以促进线虫长寿并改善线虫的运动能力、抗热应激能力及肠道脂褐素的沉积等健康寿命指标。具体过程如下:分别饲喂野生型秀丽隐杆线虫n2大肠杆菌op50、大肠杆菌op50和青春双歧杆菌1:1混合或1:2混合的食物后,青春双歧杆菌干预组线虫的平均寿命和平均最
长寿命明显高于对照组,如图2a和2b所示;分别用大肠杆菌op50或大肠杆菌op50和青春双歧杆菌1:1混合物喂养野生型秀丽隐杆线虫n2,在第2天、第8天和第16天进行其运动能力量化分析(如图2c所示),在第8天和第16天进行其运动能力分级分析(如图2d所示),在第4天、第8天和第12天进行其抗热应激能力分析(如图2e所示),结果表明,在特定的时间节点,青春双歧杆菌干预组线虫的运动能力、抗热应激能力均比对照组强;此外,肠道脂褐素沉积的自体荧光图像(如图2f所示)和定量比较(如图2g所示)也说明,青春双歧杆菌干预组线虫的肠道脂褐素的沉积明显比对照组少。
77.1.3本发明将青春双歧杆菌添加到小鼠的饮用水里面自由饮用或灌胃,同时设置pbs对照组,绘制小鼠的生存曲线,在固定的时间节点记录小鼠体重以及全身衰老评分的变化。通过一系列试验考察了青春双歧杆菌对小鼠衰老的延缓作用,验证了外源性补充青春双歧杆菌可以改善小鼠衰老评分及衰老指标。方法如下:如图3a所示,将terc
‑
/
‑
g0小鼠(c57bl/6)交叉杂交产生terc+/+(野生型c57bl/6)和terc
‑
/
‑
g1小鼠,将获得的terc
‑
/
‑
g1小鼠进行交叉杂交产生terc
‑
/
‑
g3小鼠,并分为三组进行进一步研究。将6~8周龄野生型c57bl/6设为对照组(wt+pbs,n=11,灌胃pbs),将6~8周龄terc
‑
/
‑
g3小鼠随机分为pbs灌胃组(g3+pbs,n=9)和青春双歧杆菌组(g3+b.a,n=12)。每隔一天灌胃一次,直到7个月大时自然死亡或处死。terc
‑
/
‑
小鼠的体重显著低于野生型terc+/+小鼠的体重,而与对照组相比,青春双歧杆菌组的小鼠体重显著增加,如图3b所示。综合量化老龄小鼠虚弱程度的虚弱指数评分,在野生型和用pbs喂养的terc
‑
/
‑
小鼠之间显示出显著差异,青春双歧杆菌改善terc
‑
/
‑
小鼠与年龄相关的虚弱指数,如图3c所示。对小鼠股骨进行了显微ct扫描和三维重建。与野生型小鼠相比,terc
‑
/
‑
小鼠的骨体积/总体积(bv/tv)和骨小梁厚度(tb.th)显著降低。给terc
‑
/
‑
小鼠灌胃青春双歧杆菌后,上述指标均有明显提高,如图3d所示,说明补充青春双歧杆菌对terc
‑
/
‑
小鼠骨质疏松症有改善作用。通过比较小鼠海马ca3区神经元的形态学变化和存活数量来评估衰老状态(如图3e所示)发现,与对照组相比,terc
‑
/
‑
小鼠的神经元核偏移、胞浆凝聚和核碎裂现象更为明显,青春双歧杆菌灌胃的小鼠神经元存活数量也明显增加。这些结果表明外源性添加青春双歧杆菌可以改善terc
‑
/
‑
早衰鼠的健康寿命。
78.2.本发明考察了青春双歧杆菌在细胞衰老延缓方面的应用。本发明通过体外细胞实验考察了青春双歧杆菌对小鼠胚胎成纤维细胞复制性衰老和阿霉素诱导性衰老的延缓作用。具体方式如下:将青春双歧杆菌分别与复制性衰老和阿霉素诱导性衰老的小鼠成纤维细胞共培养,之后进行衰老相关的β
‑
半乳糖苷酶(sa
‑
β
‑
gal)染色,检测细胞衰老程度。结果表明,青春双歧杆菌能明显降低小鼠成纤维细胞复制性衰老(如图4a和4b所示)和阿霉素诱导性衰老(如图4c和4d所示)的程度,能显著上调两种诱导方式下衰老的小鼠成纤维细胞中过氧化氢酶cat的mrna和蛋白表达水平(如图4e
‑
4g所示),证实外源性补充青春双歧杆菌可以延缓小鼠胚胎成纤维细胞衰老。
79.3.本发明考察了青春双歧杆菌在果蝇体内超氧化物歧化酶sod
‑
3基因和过氧化氢酶cat基因调节方面的应用。为了阐明青春双歧杆菌诱导寿命提高的机制,本发明对果蝇w
1118
中寿命相关基因的表达进行了考察。与对照组相比,添加了青春双歧杆菌的果蝇w
1118
中sod
‑
3和cat的表达显著高于对照组(如图5a和5b所示)。sod
‑
3和cat对青春双歧杆菌(b.a)诱导的果蝇寿命延长和健康改善至关重要。
80.4.本发明考察了秀丽隐杆线虫体内ctl
‑
2基因调节方面的应用。通过筛选衰老相关基因,发现过氧化氢酶(cat)基因在延缓衰老中有重要的作用,过氧化氢酶又称触酶cat,是一类广泛存在于动物、植物、微生物体内的末端氧化酶。触媒作为生物体内的重要物质,最主要的功能就是参与活性氧代谢过程。在环境胁迫等逆境情况下,生物体内自由基增多,细胞膜产生过氧化,导致细胞膜破坏和损伤。cat在减少和阻止羟基自由基形成等方面发挥重要作用。在线虫中cat主要分为三种,ctl
‑
1,ctl
‑
2,ctl
‑
3,即为cat的同源基因。线虫中ctl
‑
2占大部分,本发明通过线虫模型筛选,明确了一种过氧化氢酶(cat)基因作为青春双歧杆菌的靶向基因在延缓生物体衰老的中的重要应用,阐述了青春双歧杆菌在秀丽隐杆线虫体内延缓衰老的机制。方法如下:
81.收集青春双歧杆菌干预组与op50对照组的线虫,提取rna后通过qpcr在mrna水平筛选出青春双歧杆菌干预组高表达的氧化应激相关靶基因sod
‑
3和ctl
‑
2(如图6a所示),。后续进一步在线虫的sod
‑
3和ctl
‑
2突变体上进行青春双歧杆菌干预实验,发现青春双歧杆菌仍能延长sod
‑
3突变体的寿命,而对ctl
‑
2突变体无明显的延长寿命的效应(如图6b和6c所示),同时,青春双歧杆菌能够提高野生型线虫n2的平均最长寿命,而对ctl
‑
2突变体线虫无明显改善,如图6d所示,从而明确了ctl
‑
2的潜在调控作用。
82.构建pctl
‑
2:ctl
‑
2gdna:mcherry质粒,显微注射后通过uv
‑
tmp整合到线虫的基因组中,直观地通过荧光共聚焦显微镜下mcherry的红色荧光反映ctl
‑
2的表达量。结果表明青春双歧杆菌干预组的线虫在第14天ctl
‑
2表达量明显高于对照组,如图6e和6f所示。
83.在线虫ctl
‑
2突变体上进行青春双歧杆菌干预,在特定的时间节点检测干预组和对照组的各项健康寿命相关指标(同1.2)。分别用大肠杆菌op50或大肠杆菌op50和青春双歧杆菌1:1混合物喂养野生型秀丽隐杆线虫n2和ctl
‑
2突变体线虫,在第2天和第8天进行其运动能力量化分析,如图6g所示;在第4天、第8天和第12天进行其抗热应激能力分析,如图6h所示,结果表明在特定的时间节点,青春双歧杆菌干预组可以改善野生型秀丽隐杆线虫n2的运动能力、抗热应激能力;此外,肠道脂褐素沉积的自体荧光图像(如图6i所示)和定量比较(如图6j所示)也说明在野生型秀丽隐杆线虫n2中,青春双歧杆菌干预组线虫的肠道脂褐素的沉积明显比对照组少。但青春双歧杆菌改善健康寿命的效应在ctl
‑
2突变体上全都被阻断了(如图6g
‑
j所示)。以上,明确了ctl
‑
2的潜在调控作用,表明ctl
‑
2在青春双歧杆菌对秀丽隐杆线虫寿命和健康寿命的调控中至关重要。
84.5.本发明考察了青春双歧杆菌在小鼠内过氧化氢酶cat基因调节方面的应用。方法如下:小鼠造模过程同1.3所述,详见文后具体过程。将7个月龄野生型小鼠(wt+pbs,n=10)、terc
‑
/
‑
g3 pbs灌胃小鼠(g3+pbs,n=6)和terc
‑
/
‑
g3青春双歧杆菌灌胃小鼠(g3+b.a,n=9)小鼠处死之后,分别收集各组小鼠的肌肉组织和大脑皮质,通过试剂盒检测过氧化氢酶的活性,并通过qpcr、western blot和免疫组化来检测ctl
‑
2同源基因cat的表达。结果表明补充青春双歧杆菌后terc
‑
/
‑
小鼠肌肉组织和大脑皮质的过氧化氢酶活性都明显增高(如图7a所示),cat基因在mrna和蛋白水平的表达也明显增高(如图7b
‑
7d所示),同时,在海马ca3区、dg区和大脑皮质区,青春双歧杆菌干预后terc
‑
/
‑
小鼠的cat表达也明显增高(如图7e所示)。因此,本发明亦明确了cat基因作为青春双歧杆菌的靶向基因在延缓小鼠衰老的过程中起到了重要的作用,阐述了青春双歧杆菌通过调控cat基因延缓小鼠衰老的机制。
85.6.本发明考察了青春双歧杆菌在小鼠内p53基因调节方面的应用。将三组试验小
鼠(野生型c57bl/6小鼠(灌胃pbs)、terc
‑
/
‑
g3小鼠(灌胃pbs)、terc
‑
/
‑
g3小鼠(灌胃青春双歧杆菌)的海马dg区进行p53免疫组化染色,结果表明,补充青春双歧杆菌可使小鼠脑组织中p53表达下调(如图8所示)。
86.7.本发明考察了青春双歧杆菌在小鼠的氧化应激代谢物调节方面的应用。通过uplc
‑
qe
‑
ms系统对terc
‑
/
‑
g3小鼠灌胃pbs(n=7)及青春双歧杆菌(n=9)后粪便样本进行lc
‑
ms/ms检测,分析两组小鼠肠道代谢产物。结合lc
‑
ms/ms的检测结果对小鼠粪便进行代谢组学分析,描绘火山图(如图9a所示)及层次聚类分析热图(如图9b所示),评估了青春双歧杆菌对氧化应激相关代谢物的影响。图9c展示了小鼠代谢产物的总离子色谱图,由图可见,在青春双歧杆菌灌胃terc
‑
/
‑
衰老小鼠的粪便中,可以提高cat活性的代谢产物含量较高,如芹菜甙和芥酸的含量显著增加,其他一些抗氧化剂,包括人参皂甙ia,2
‑
羟基肉桂酸,大豆苷和l
‑
苹果酸的含量也显著增加;而活性氧的生产者,如次黄嘌呤则相应减少,此外,具有抗衰老潜能的波斯菊素和具有肿瘤抑制活性的肠二醇也大量富集。在对照的pbs灌胃的terc
‑
/
‑
老龄小鼠肠道代谢产物中几种具有促炎性或与心血管疾病相关的代谢物的含量明显提高,包括胆酸、9,10
‑
dhome、3
‑
脱羟基肉碱和4
‑
三甲基氨基丁酸。这些结果表明,青春双歧杆菌通过调节cat和宿主的氧化应激相关代谢物抑制terc
‑
/
‑
小鼠的衰老,从而对寿命和健康产生有益的影响。
87.8.本发明考察了青春双歧杆菌在改善端粒酶敲除小鼠肠道衰老方面的应用。对模型小鼠和对照组持续灌胃至七个月龄,随后取各组小肠样本,通过基因水平和蛋白水平测定衰老相关的指标,发现青春双歧杆菌具有改善小鼠肠道衰老的作用。
88.衰老发生后,衰老细胞中一系列相关分子的表达水平将呈现特征性变化,尤以肿瘤抑制分子网络和细胞周期抑制通路的相关分子为甚。在细胞衰老过程中,p53
‑
p21通路和p16
‑
rb通路是介导大多数细胞衰老现象最主要的信号通路,也是肿瘤抑制分子网络的主要组成部分。p53基因与p21基因在老化细胞中表达量骤增,因此成为检测细胞衰老的重要标志。紧密连接蛋白结构是肠道上皮屏障的结构基础,由多种紧密连接蛋白构成,作为细胞间紧密的结构,可阻止外源的毒素等渗漏到周围组织中,并对穿过上皮层的物质进行调控。研究表明,增龄能够引起肠黏膜屏障蛋白子在结构、分布、数量的改变。鉴于肠黏膜屏障在机体衰老过程中的重要改变,紧密连接蛋白和衰老相关经典基因在增龄相关的肠道衰老表现的差异,本发明围绕以上相关指标,着重考察了青春双歧杆菌对端粒酶敲除小鼠肠道衰老表型的改善作用。
89.既往研究表明,随着年龄的增加,小肠的长度会一定程度降低。本发明收集了测量持续干预7个月龄野生型小鼠(wt+pbs)、terc
‑
/
‑
g3 pbs灌胃小鼠(g3+pbs)和terc
‑
/
‑
g3青春双歧杆菌灌胃小鼠(g3+b.a)的肠道组织(如图10a和10b所示),通过测量小肠的长度,发现在端粒酶敲除的小鼠长度明显缩短,而在青春双歧杆菌干预的实验组,小肠长度缩短的状态有所缓解(如图10b所示)。进一步地,对小肠组织进行固定,包埋,切片,he和pas染色。he染色结果表明,与正常对照组相比,端粒酶敲除小鼠的小肠黏膜层绒毛数量、绒毛长度、,绒毛宽度都显著减少,单位面积的隐窝数量也显著降低(如图10c);pas染色所提示的杯状细胞的数量也显著减少(如图10e)。对比青春双歧杆菌灌胃组小鼠的小肠黏膜,发现青春双歧杆菌可改善肠道衰老过程中黏膜形态的改变,统计结果如图10d和10f所示。肠道的黏膜屏障也是肠道重要的组成成分,通过对石蜡切片进行zo
‑
1,occludin蛋白免疫组化染色,结果
提示,与对照组相比,端粒酶敲除小鼠肠道屏障蛋白显著降低,而在青春双歧杆菌的干预下,屏障相关蛋白表达量显著提高,如图10g所示。另一方面,小鼠肠道内的黏蛋白(muc2)含量在端粒酶敲除小鼠中也显著降低,同样在青春双歧杆菌干预后显著增加。粘蛋白是由杯状细胞分泌的,pas提示的杯状细胞量显著更高,如图10e所示,这也进一步解释了muc2的表达增高的原因。
90.在衰老进程中,长时间的外源的衰老诱导因素(dna损伤,外源性代谢物等)可以协同作用细胞,通过经典p16ink4a/rb、p53/p21通路或其他路径导致细胞衰老。这些可能导致普遍的基因表达变化,进而造成衰老相关生长停滞以及形态学变化。本发明进一步检测了典型相关基因,如图10h和10i所示。和正常对照组比较,端粒酶敲除小鼠衰老相关分泌表型(sasp)典型基因有显著高表达,进一步的免疫组化提示,p21,p53等蛋白水平也显著提高。说明端粒酶敲除小鼠肠道提示明显衰老状态。在经过青春双歧杆菌干预后的端粒酶敲除小鼠组,sasp大部分高表达的因子改善降低,免疫组化及qpcr实验结果也同样提示了p21,p53在转录水平和蛋白水平的显著下降变化趋势,提示青春双歧杆菌可通过降低sasp及衰老相关基因p53,p21等的表达水平,从而发挥改善小鼠肠道衰老的作用。
91.类似地,如图11所示,与正常组相比,端粒酶敲除组小鼠结肠粘膜的形态结构也呈衰老改变,pas染色所代表的杯状细胞含量也显著降低,同样在青春双歧杆菌干预后,结肠黏膜的结构的紊乱得到了改善,杯状细胞的数量也有所提高(图11a)。进一步检测结肠组织衰老相关基因,发现结肠组织中p21和p53的表达水平在端粒酶敲除小鼠中显著上升,提示在端粒酶小鼠结肠确实存在衰老状态,进一步观察青春双歧杆菌干预后p21和p53的免疫组化蛋白水平,发现显著降低,提示青春双歧杆菌可以通过降低结肠衰老相关基因p53,p21的表达改善小鼠肠道衰老的状态,如图11b和c所示。
92.为了进一步探究结肠衰老表型改善的机制,本发明还检测了肠道干细胞相关经典基因lgr5,ascl2的相关改变,如图11d所示。与对照组相比,端粒酶敲除小鼠肠道干细胞的基因表达量都显著性降低,而青春双歧杆菌干预后,结肠干细胞相关基因lgr5,ascl2表达水平有所回升,提示青春双歧杆菌可以通过提高结肠干细胞相关基因的表达,从而发挥改善小鼠肠道衰老的作用,如图11d。
93.具体实验过程如下:
94.rna样品提取
95.取匀浆管,加入1ml的trizol reagent,置冰上预冷。取100mg组织,加入到匀浆管中。匀浆仪充分研磨直至无可见组织块。样本前处理之后,12000rpm离心10min取上清。加入250μl三氯甲烷,颠倒离心管15s,充分混匀,静置3min,4℃下12000rpm离心10min,将400μl上清转移到一新的离心管中。加入0.8倍体积的异丙醇,颠倒混匀。
‑
20℃放置15min。4℃下12000rpm离心10min,管底的白色沉淀即为rna。吸除液体,加入75%乙醇1.5ml洗涤沉淀。4℃下12000rpm离心5min,将液体吸除干净。将离心管置于超净台上吹3min,加入15μl无rna酶的水溶解rna,55℃孵育5min。用nanodrop 2000检测rna浓度及纯度:仪器空白调零后取2.5μl待测rna溶液于检测基座上,放下样品臂,使用电脑上的软件开始吸光值检测。
96.实时定量聚合酶链反应(qrt
‑
pcr)
97.用trizol(美国ambion)提取小鼠、果蝇、线虫和细胞的总rna。用primescriptertase(日本takara)合成cdna。采用sybr
‑
green
‑
mix(日本,takara),在罗氏
lightcycler480(罗氏,曼海姆,德国)pcr仪上行qrt
‑
pcr反应。用2
‑
δδct
法测定mrna的相对表达。引物序列见下表1所示。
98.表1
[0099][0100]
[0101]
在线数据库资源
[0102]
通过python软件(依托restful apis技术),从人类肠道的宏基因组数据库gmrepo获取并分析了3500例不同年龄段健康样本中青春双歧杆菌的相对丰度。
[0103]
青春双歧杆菌与大肠杆菌op50的培养与制备
[0104]
青春双歧杆菌bio
‑
67127(atcc 15703)是从北京biobw生物科技有限公司购买的,在37℃,厌氧混合气(80%n2,10%co2,10%h2)条件下,用改良的强化梭菌培养基(atcc培养基2107)培养。大肠杆菌op50在37℃下,luria bertani(lb)液体培养基中震荡过夜培养。
[0105]
小鼠实验中,将青春双歧杆菌在95℃水浴15分钟热灭活,并调节至终浓度109cfu/ml。隔天对每只小鼠用200μl无菌pbs或经过预处理的青春双歧杆菌进行灌胃。
[0106]
在细胞共培养实验中,将小鼠胚胎成纤维细胞与热灭活的青春双歧杆菌浆以1:100的比例共培养。
[0107]
在果蝇干预实验中,首先将青春双歧杆菌用2.5%蔗糖溶液重悬至10
10
cfu/ml,然后加热灭活。干预组将青春双歧杆菌混悬液与标准玉米粉混合至最终浓度为109cfu/ml,对照组用相同体积的2.5%蔗糖溶液与标准玉米粉混合。
[0108]
在秀丽隐杆线虫衰老干预实验中,将青春双歧杆菌培养液和大肠杆菌op50培养液离心并弃上清,用m9缓冲液清洗沉淀,再离心获得沉淀物并用m9缓冲液重悬调整至最终浓度0.04mg/ml(湿重),最后热灭活。干预组用大肠杆菌op50与青春双歧杆菌混合物喂养,对照组用大肠杆菌op50喂养。
[0109]
果蝇的品系和生长
[0110]
两种野生果蝇品系为w
1118
和canton
‑
s。在25℃,12小时光照/黑暗循环条件下,在标准玉米粉培养基上饲养,培养基参照nutri fly bloomington配方:600ml培养基里面含有3.72g琼脂、35.28g玉米粉、35.28g灭活干酵母、16ml 10%羟苯甲酸甲酯(溶剂为85%乙醇溶液)、36ml果汁、2.9ml 99%丙酸。
[0111]
秀丽隐杆线虫的品系与同步化
[0112]
野生型秀丽隐杆线虫n2以及突变体线虫sod
‑
3(tm760),ctl
‑
2(ok1137)由caenorhabditis genetics center(cgc)购得。干预前,将线虫挑于含有e.coli op50的线虫生长培养基(ngm)中。将处于产卵期的雌雄同体线虫在次氯酸钠溶液中漂白,以获得受精卵。在含有e.coli op50的ngm平板上培养线虫受精卵直到发育至l4期,完成同步化。
[0113]
寿命测定
[0114]
寿命测定法:同一批果蝇羽化后4~6天完成发育交配,之后将果蝇转移至空培养管饥饿2小时,按性别区分后随机分配到干预组或对照组。每20只果蝇被分装到一个小管里,每2到3天转移到新的小管里,同时记录死亡果蝇的数量,每组每次实验使用大约100只果蝇(5管)。
[0115]
在秀丽隐杆线虫实验中,l4期(第0天)的线虫在含e.coli op50的ngm平板中培养至成虫,然后转移到op50或混合菌液的平板中。将150条线虫分布在10个平板(15条线虫/平板)中,并在20℃条件下培养。隔天转移到新的平板上,同时记录其存活、死亡、剔除数目。
[0116]
存活率计算为存活果蝇或线虫占其总数的百分比。逃离至平板壁和盖上而干死的或者钻入琼脂中的线虫,传管过程中丢失的果蝇应从统计数据中剔除。寿命实验至少进行了三次。
[0117]
果蝇爬管试验
[0118]
将三管30日龄果蝇(每管约15至20只)分别转移到由两个空管垂直连接的三个管中。轻轻拍打到底部后,测量10秒钟内爬行距离超过8厘米标记的果蝇只数,以计算爬升指数(与试管中的总数相比),每组实验重复3次。
[0119]
线虫运动能力的评估
[0120]
将1200条按上述同步化之后的成虫转移到20个对照板和20个干预板上,20℃条件下培养并且隔天进行转板。线虫的运动能力评估可以通过两个指标反映,移动速度和移动轨迹。分别在第2,8和16天,各组随机挑选50条线虫,记录其30s内的爬过的正弦波数。移动轨迹分析的标准为:自发运动,不需要触碰刺激,记为a;必须受到触碰刺激才运动,记为b;受到触碰刺激后只摆动头尾,记为c;完全不动记为d。
[0121]
线虫急性热应激试验
[0122]
在第4、8和12天,各组随机挑选30条线虫,从20℃转移到37℃,并每两小时测定其反应,统计死亡数目,然后计算平均存活时间。每组实验重复3次。
[0123]
线虫荧光显微镜试验
[0124]
线虫按前述方法同步化和培养。在第10天和/或第14天,分别用自体荧光和mcherry红色荧光定量检测肠道中脂褐素的积累和ctl
‑
2的表达。具体方法如下:随机挑选虫子,用m9缓冲液洗涤两次。然后将其放在1%的琼脂糖凝胶上,200mm叠氮化钠诱导麻醉,在蓝色激发光(405~488nm)或红色激发光(559~585nm)下用倒置激光扫描共聚焦显微镜(olympus ix81
‑
fv1000,tokyo,japan)拍摄。荧光强度用imagej软件(national institutes of health,bethesda,md,usa)定量。该实验独立重复三次,每组每次大于20条线虫。
[0125]
秀丽隐杆线虫基因整合
[0126]
从n2基因组dna中扩增ctl
‑
2启动子和ctl
‑
2gdna,然后用融合pcr克隆试剂盒(takara,日本)与特定的供体载体片段重组。为了检测ctl
‑
2基因的表达水平,在ctl
‑
2gdna序列的下游克隆mcherry序列,构建了一个功能性的pctl
‑
2::ctl
‑
2gdna::mcherry转基因质粒。将pctl
‑
2::ctl
‑
2gdna::mcherry转基因质粒(50ng/μl)与plin
‑
44::gfp(20ng/μl)混合,通过显微注射一起注射到n2线虫中,再用紫外
‑
三羟甲基丙烷(uv
‑
tmp)进行基因整合,整合后的虫体与n2回交4次以获得稳定表达荧光的线虫。
[0127]
细胞培养与衰老
[0128]
使用端粒酶rna组分缺失的杂交小鼠(terc+/
‑
)获得小鼠胚胎成纤维细胞(mefs)并在37℃、5%co2培养箱中培养。在复制性衰老实验中,分别添加(细菌:细胞=100:1)或不添加青春双歧杆菌将细胞培养至第12代(p12)。在诱导性衰老实验中,先连续3天在培养基中加入40nm阿霉素(sigma
‑
aldrich,germany),然后再用新鲜的完全培养基连续培养三天,这样进行两个诱导循环,整个周期持续12天,然后将衰老的细胞与青春双歧杆菌共培养6天。接下来进行衰老相关的β
‑
半乳糖苷酶(sa
‑
β
‑
gal)染色试验。
[0129]
蛋白质印迹试验
[0130]
总蛋白用ripa裂解缓冲液提取,用bca蛋白检测试剂盒定量。蛋白质用聚丙烯酰胺凝胶电泳分离,电转移到聚偏氟乙烯膜上。室温下用5%脱脂牛奶封闭膜2小时,然后在4℃下用过氧化氢酶一抗(目录号21260
‑1‑
ap,proteintech)孵育过夜。在室温下清洗膜并用抗
5min
‑
无水乙醇ⅱ5min
‑
75%酒精5min,自来水洗,切片入pas染色液b中染色10
‑
15min,自来水洗,蒸馏水洗两遍;切片入pas染色液a浸染25
‑
30min,避光,流水冲洗5min;随后切片入pas染色液c染30s,自来水洗,盐酸水溶液分化,自来水洗,氨水返蓝,流水冲洗。随后脱水封片:切片依次放入无水乙醇i 5min
‑
无水乙醇ii 5min
‑
无水乙醇ⅲ5min
‑
二甲苯5min
‑
二甲苯ⅱ5min透明,中性树胶封片。最后显微镜镜检,杯状细胞壁呈紫红色,细胞核呈浅蓝色。
[0144]
免疫荧光(if)
[0145]
石蜡切片脱蜡至水:依次将切片放入二甲苯ⅰ15min
‑
二甲苯ⅱ15min
‑
无水乙醇ⅰ5min
‑
无水乙醇ⅱ5min
‑
85%酒精5min
‑
75%酒精5min
‑
蒸馏水洗。随后进行抗原修复:组织切片置于盛满edta抗原修复缓冲液(ph8.0)的修复盒中于微波炉内进行抗原修复。中火8min至沸,停火8min,再转中低火7min,,此过程中应防止缓冲液过度蒸发,切勿干片。自然冷却后将玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后用组化笔在组织周围画圈(防止抗体流走),甩干pbs,滴加bsa,封闭30min。(一抗是山羊来源用10%驴血清封闭,一抗其它来源的用3%bsa封闭)进行画圈血清封闭。然后加一抗:轻轻甩掉封闭液,在切片上滴加pbs按一定比例配好的一抗,切片平放于湿盒内4℃孵育过夜。(湿盒内加少量水防止抗体蒸发)。加二抗:玻片置于pbs(ph 7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加与一抗相应种属的二抗覆盖组织,避光室温孵育50min。最后dapi复染细胞核:玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加dapi染液,避光室温孵育10min。淬灭组织自发荧光:玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。在圈内加入自发荧光淬灭剂5min,流水冲洗10min。切片稍甩干后用抗荧光淬灭封片剂封片。切片于荧光显微镜下观察并采集图像。
[0146]
免疫组化(ihc)实验
[0147]
石蜡切片脱蜡至水:依次将切片放入二甲苯ⅰ15min
‑
二甲苯ⅱ15min
‑
二甲苯iii 15min
‑
无水乙醇ⅰ5min
‑
无水乙醇ⅱ5min
‑
85%酒精5min
‑
75%酒精5min
‑
蒸馏水洗。组织切片置于盛满柠檬酸抗原修复缓冲液(ph6.0)的修复盒中于微波炉内进行抗原修复,中火8min至沸,停火8min保温再转中低火7min,此过程中应防止缓冲液过度蒸发,切勿干片。自然冷却后将玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min进行抗原修复,切片放入3%双氧水溶液,室温避光孵育25min,将玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。随后用血清封闭:在组化圈内滴加3%bsa均匀覆盖组织,室温封闭30min。轻轻甩掉封闭液,在切片上滴加pbs按一定比例配好的一抗,切片平放于湿盒内4℃孵育过夜。(湿盒内加少量水防止抗体蒸发),玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加与一抗相应种属的二抗(hrp标记)覆盖组织,室温孵育50min。最后dab显色,复染细胞核:苏木素复染3min左右,自来水洗,苏木素分化液分化数秒,自来水冲洗,苏木素返蓝液返蓝,流水冲洗。最后脱水封片:将切片依次放入75%酒精5min
‑‑
85%酒精5min
‑‑
无水乙醇ⅰ5min
‑‑
无水乙醇ⅱ5min
‑‑
正丁醇5min
‑‑
二甲苯ⅰ5min中脱水透明,将切片从二甲苯拿出来稍晾干,中性树胶封片。用显微镜镜检,图像采集分析。
[0148]
过氧化氢酶(cat)活性测定
[0149]
取骨骼肌和脑组织,用冰冻pbs(25%w/v)匀浆,可见光法检测上清液种过氧化氢酶活性(过氧化氢酶cat测定试剂盒,南京建城生物工程研究所)。
[0150]
uhlc
‑
qe
‑
ms系统
[0151]
1、代谢物提取
[0152]
称取25mg样品,加入500μl提取液(甲醇:乙腈:水=2:2:1(v/v/v),含同位素标记内标混合物),涡旋混匀30s;35hz研磨处理4min,超声5min(冰水浴);重复步骤2,3次;
‑
40℃静置1h;将样品4℃,12000rpm离心15min;取上清于进样瓶中上机检测。所有样品另取等量上清混合成qc样品上机检测。
[0153]
2、lc
‑
ms/ms分析
[0154]
使用vanquish(thermo fisher scientific)超高效液相色谱仪,通过waters acquity uplc beh amide(2.1mm
×
100mm,1.7μm)液相色谱柱对目标化合物进行色谱分离。液相色谱a相为水相,含25mmol/l乙酸铵和25mmol/l氨水,b相为乙腈。采用梯度洗脱:0~0.5min,95%b;0.5~7min,95%~65%b;7~8min,65%~40%b;8~9min,40%b;9~9.1min,40%~95%b;9.1~12min,95%b。流动相流速:0.5ml/min,柱温:30℃,样品盘温度:4℃,进样体积:2μl。
[0155]
thermo q exactive hfx质谱仪能够在控制软件(xcalibur,thermo)控制下进行一级、二级质谱数据采集。详细参数如下:sheath gas flow rate:50arb,aux gas flow rate:10arb,capillary temperature:320℃,full ms resolution:60000,ms/ms resolution:7500,collision energy:10/30/60in nce mode,spray voltage:3.5kv(positive)或
‑
3.2kv(negative)。
[0156]
3、数据预处理与注释
[0157]
原始数据经proteowizard软件转成mzxml格式后,使用自主编写的r程序包(内核为xcms)进行峰识别、峰提取、峰对齐和积分等处理,然后与biotreedb(v2.1)自建二级质谱数据库匹配进行物质注释,算法打分的cutoff值设为0.3。
[0158]
上述具体实施方式用来解释说明本发明,仅为本发明的优选实施例,而不是对本发明进行限制,在本发明的精神和权利要求的保护范围内,对本发明作出的任何修改、等同替换、改进等,都落入本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1