一种可编程控释的温度响应型水凝胶胶囊壳及其制备方法
1.本发明属于医药技术和增材制造技术领域,具体涉及一种可编程控释的温度响应型水凝胶胶囊壳及其制备方法,还涉及胶囊的新应用。
背景技术:
2.传统的口服给药方式,如片剂和胶囊等,存在的一个重要问题是药物的剂量是固定的,大多数药物只能在有限的剂量强度下使用,需要多次给药。但是,对于同一类型疾病的治疗,不同患者的个体需求会有所不同。特定个体对个性化药物的需求正在不断增加(就剂量强度和/或释放时间而言),传统的给药方式不能够满足临床应用的需求,迫使制药行业考虑新的药物生产方法。
3.水凝胶是一类极为亲水的三维网络结构凝胶,具有良好的生物相容性、柔软性和可降解性等诸多优点,可以提供类似于天然组织的环境,现已广泛应用于多种领域,如药物递送、生物工程、再生医学等。聚(n
‑
异丙基丙烯酰胺)(pnipam)是一种典型的热敏水凝胶,在水中表现出最低临界溶液温度(lcst)相变现象,在32℃左右会发生快速的亲水
‑
疏水转变,随着温度的升高,凝胶内部网格尺寸减小,具有良好的温度敏感性,在不同温度下具有不同的孔隙尺寸。pnipam因其优异的特性,被广泛应用于药物输送、细胞封装、组织工程等领域。水凝胶药物更有利于蛋白质等活性因子的负载,药物质地柔软,患者吞咽感极佳,尤其适用于儿童、老人和其他特殊患者。但传统水凝胶药物只能通过模具制造成2d或简单的3d结构,不能满足特定患者对药物的个性化定制。
4.3d打印(3dp)技术的飞速发展开创了增材制造的新时代。3dp是一种计算机辅助的制造过程,采用离散材料(液体、粉末、丝、片、板、块等)逐层累加的原理,制造实体零件的技术,相对于传统的材料去除及切削加工技术,是一种“自下而上”的制造方法。可快速精密地制造出任意复杂形状的零件,实现了零件的“自由制造”。3dp所具有的优势,可应对制药行业面临的挑战,包括复杂几何形状的快速制造、多材料集成、多种赋形剂增溶、靶向治疗和药物控释等。
5.目前,虽然已有通过立体光刻、喷墨打印和挤出成型3d打印等技术来制备水凝胶药物,但还存在着许多缺陷,如药物打印形状不良,药物的负载有时需要通过将水凝胶浸泡在药物溶液中来实现,药物的释放模式主要是延迟释放和/或立即释放和/或恒定释放,无法通过体内环境刺激进行实时智能控释。
技术实现要素:
6.本发明的目的是提供一种可编程控释的温度响应型水凝胶胶囊壳,可以通过控制水凝胶胶囊壳的内部孔隙尺寸和释放温度来编程药物释放曲线,能够实现通过体内温度刺激进行实时智能控释。
7.本发明的目的通过如下技术方案实现:
8.一种可编程控释的温度响应型水凝胶胶囊壳,其特征在于:所述的胶囊壳通过3d
打印制备得到,所使用的原料的制备方法如下:将nipam、pegda、n,n
‑
亚甲基双丙烯酰胺和α
‑
酮戊二酸按摩尔比5000:830:1:10加入纯水中得到溶液,然后加入所述的溶液总体积0.01~60%(m/v)的致孔剂,混合均匀,搅拌下真空脱气,再加入流变改性剂充分搅拌后得到胶囊壳原料。
9.作为本发明更优的技术方案:所述的致孔剂成分为聚乙二醇(peg)和聚乙烯吡咯烷酮(pvp)中的一种或两种。
10.作为本发明更优的技术方案:所述的流变改性剂为羧基化纤维素纳米纤维和/或卡波姆,或laponite合成硅酸镁锂和/或pluronic f
‑
127。
11.作为本发明更优的技术方案:所述的胶囊壳总长度为23.3
±
0.3~13.9
±
0.3mm,最大外径为23.3
±
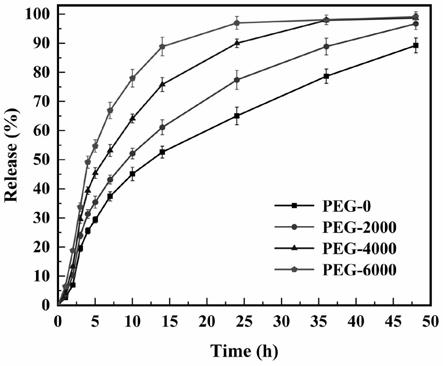
0.3~5.33
±
0.03mm。
12.本发明还有一个目的是提供所述的可编程控释的温度响应型水凝胶胶囊壳的制备方法,包括如下步骤:
13.步骤一、将所述的原料作为浆料装入到3d打印系统的浆料管中;
14.步骤二、将所述的胶囊壳用建模软件建立三维模型,再通过切片软件转换后传输到3d打印系统中;
15.步骤三、设置参数并启动3d打印系统,在基板上精确地成型出胶囊壳结构切片的第一层,完成后再向上移动基板,且移动高度与第一层的层厚相同,在第一层的基础上打印第二层,重复进行直至整个胶囊壳结构成型完成。
16.步骤四、将成型后的胶囊壳结构进行固化处理,以及根据需要进行溶胀,得到可编程控释的温度响应型水凝胶胶囊壳。
17.作为本发明更优的技术方案:步骤二中所述的建模软件为solid works或ug或3d max或autocad或catia或pro/e;所述的切片软件为slic3r或repetier host或cura。
18.作为本发明更优的技术方案:步骤四中所述的固化处理为uv光固化。
19.作为本发明更优的技术方案:步骤二中所述的建模软件为solid works或ug或3d max或autocad或catia或pro/e;
20.作为本发明更优的技术方案:所述的切片软件为slic3r或repetier host或cura。
21.作为本发明更优的技术方案:步骤三中所述的参数为挤出头出口直径为0.16mm~0.6mm,挤出速度为5mm/s~30mm/s,打印层厚为0.1mm~0.6mm。
22.本发明还有一个目的是提供一种所述的给药方式,治疗使用时,仅需将药物成分通过微针注入到一体式的胶囊壳内部即可实现药物负载,药物成分注射前可按需使用微针将胶囊壳内空气抽出,防止内部压力过大,胶囊壳产生破裂。首先通过体外试验得到胶囊的药物释放曲线,再根据患者的用药温度和所需药物释放曲线来改变待治疗用的水凝胶胶囊壳材料的致孔剂分子量和/或致孔剂含量,然后通过3d打印制备得到。
23.有益效果如下:
24.本发明的胶囊通过3d打印技术制备,可以独立精确地控制药物类型、剂量和壳厚,快速精密地制造出任意复杂结构的胶囊,工艺简单,减少了加工工序,缩短了加工周期,更有利于特定个体对药物的个性化定制。
25.本发明可以通过水凝胶胶囊壳材料的致孔剂分子量和致孔剂含量以及释放温度来编程药物释放曲线,胶囊壳具有高度的环境刺激响应,使得水凝胶胶囊能够通过体内环
境温度刺激进行实时智能控释,并且胶囊壳所负载的药物种类和含量可以通过微针注入到水凝胶胶囊壳内部,实现药物负载的自由。
附图说明
26.图1为本发明的可编程控释的温度响应型水凝胶胶囊壳的结构示意图;
27.图2为本发明的可编程控释的温度响应型水凝胶胶囊壳的截面示意图;
28.图3为本发明的可编程控释的温度响应型水凝胶胶囊壳的加工设备的结构示意图;
29.图4为本发明实施例中制备的不含致孔剂的可编程控释的温度响应型水凝胶胶囊在不同温度下的药物释放曲线;
30.图5为本发明实施例中含不同peg分子量致孔剂的可编程控释的温度响应型水凝胶胶囊在22℃下的药物释放曲线。
具体实施方式
31.根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施案例所描述的内容仅用于说明和解释本发明,并不用于限制权利要求书中所详细描述的本发明。除非特别说明,本发明采用的试剂、方法和设备如无特别说明,均为常规方法,所使用的试验材料如无特别说明,均可从商业公司获取。
32.在本发明实施例中使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本发明。在本发明实施例和所附权利要求书中所使用的单数形式的“一种”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。还应当理解,本文中使用的术语“和/或”是指并包含一个或多个相关联的列出项目的任何或所有可能组合。
33.实施例1:制备不含致孔剂的水凝胶胶囊壳
34.一、材料准备:
35.胶囊外壳材料的制备:按摩尔比为nipam:pegda:n,n
‑
亚甲基双丙烯酰胺:α
‑
酮戊二酸:naoh=5000:830:1:10:125的比例将以上物料加入10ml的纯水中混合均匀,搅拌下真空脱气,然后向油墨中加入1.5%的carbomer 940,充分搅拌后,得到用于3d打印的外壳打印油墨。
36.二、制备过程
37.(1)首先使用solidworks软件建立起可编程控释的温度响应型水凝胶胶囊壳的三维实体模型;
38.(2)stl文件数据转换,利用切片技术将可编程控释的温度响应型水凝胶胶囊壳模型进行分层切片;
39.(3)将stl格式文件输入到如图3所示的3d打印系统中,打印喷头内径为0.34mm,挤出速度为15mm/s,填充率为99%,打印层厚为0.15mm,启动3d打印系统,螺杆控制器控制浆料管中的浆料从打印喷头挤出形成线形流体,同时由主机自动控制打印模块改变其相对于可移动打印平台的运动轨迹,在基板上按照预先设计精确地成型出第一层胶囊结构;
40.(4)第一层胶囊结构完成后,启动平台控制器将打印模块向上移动0.15mm,第二层浆料的成型在第一层成型浆料形成的结构上进行,按照同样的方式成型下一层直至整个胶
囊三维结构成型完成;
41.(5)在透明密闭的盒子中持续通入氮气排出氧气,然后在uv光(≈50mw cm
‑2)下进行固化,得到最终的三维实体水凝胶胶囊。
42.通过微针将药物模型亮蓝注入到实施例1制备得到的不含致孔剂的水凝胶胶囊壳内,然后置于装有40ml pbs(ph=7.4)的烧杯中,分别置于22℃、27℃、32℃、37℃、42℃的环境中;在每个预定的时间点取出释放介质,通过紫外可见光分光光度计分析亮蓝的释放量。重复药物释放实验三次。
43.由图4的不含致孔剂的可编程控释的温度响应型水凝胶胶囊在不同温度下的药物释放曲线可知高温不利于胶囊内部药物的释放,随着温度的升高,药物的释放变慢。原因在于药物的释放高度依赖于药物与释放介质在水凝胶外壳内的接触,水凝胶内部的孔隙尺寸控制着药物和水凝胶网络之间的空间相互作用,随着温度的升高,水凝胶内部的孔隙尺寸会减小,水凝胶外壳内所含的释放介质越少,从而减少了释放介质与胶囊内药物的接触。与此同时,由于水凝胶孔隙尺寸的减小,释放介质和药物从水凝胶壳向外界释放的阻力增大,导致药物释放变慢。所以,温度是调节药物释放快慢的“开关”,可以用来编程药物的释放曲线。
44.实施例2:制备含致孔剂peg2000的水凝胶胶囊壳
45.本实施例与实施例1步骤不同之处在于,制备得到的胶囊壳材料含有溶液总体积30%(m/v)的致孔剂peg2000,胶囊壳尺寸与实施例1相同。
46.实施例3:制备含致孔剂peg4000的水凝胶胶囊壳
47.本实施例与实施例1步骤不同之处在于,制备得到的胶囊壳材料含有溶液总体积30%(m/v)的致孔剂peg4000,胶囊壳尺寸与实施例1相同。
48.实施例4:制备含致孔剂peg6000的水凝胶胶囊壳
49.本实施例与实施例1步骤不同之处在于,制备得到的胶囊壳材料含有溶液总体积30%(m/v)的致孔剂peg6000,胶囊壳尺寸与实施例1相同。
50.通过微针将药物模型亮蓝注入到实施例1、2、3和4制备得到的水凝胶胶囊壳内,然后分别置于装有40ml pbs(ph=7.4)的烧杯中,置于22℃的环境温度下;在每个预定的时间点取出释放介质,通过紫外可见光分光光度计分析亮蓝的释放量。重复药物释放实验三次。
51.由图5中的含不同peg分子量致孔剂的可编程控释的温度响应型水凝胶胶囊在22℃下的药物释放曲线可知随着致孔剂peg分子量的降低药物释放会变慢。
52.原因在于药物的释放高度依赖于药物与释放介质在水凝胶外壳内的接触,水凝胶内部的孔隙尺寸控制着药物和水凝胶网络之间的空间相互作用,随着致孔剂peg分子量的降低,水凝胶内部的孔隙尺寸会减小,水凝胶外壳内所含的释放介质越少,从而减少了释放介质与胶囊内药物的接触。与此同时,由于水凝胶孔隙尺寸的减小,释放介质和药物从水凝胶壳向外界释放的阻力增大,导致药物释放变慢。所以,致孔剂peg的分子量是调节药物释放快慢的关键因素,可以用来编程药物的释放曲线。
53.通过体外试验得到胶囊的药物释放曲线,再根据患者的用药温度和所需药物释放曲线来改变待治疗用的水凝胶胶囊壳材料的致孔剂分子量和致孔剂含量,然后通过3d打印制备得到,治疗使用时,仅需将药物成分通过微针注入到水凝胶胶囊壳内即可实现药物负载。
54.本发明可以制成口服胶囊,也可以制成外用胶囊置入需用药部位,通过预估某个时间的某患者的某个部位的体温变化,然后根据药物释放曲线,精确的控制每个时间点释放药量。
55.以上所述本发明具体实施方式,并不构成对本发明保护范围的限定。任何根据本发明的技术构思所作出的各种其他相应的改变与变形,均应包含在本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1