一种茶皂素/壳聚糖包覆二氢杨梅素脂质体及其制备方法和应用
本发明涉及药物化学
技术领域:
,尤其涉及一种茶皂素/壳聚糖包覆二氢杨梅素脂质体及其制备方法和应用。
背景技术:
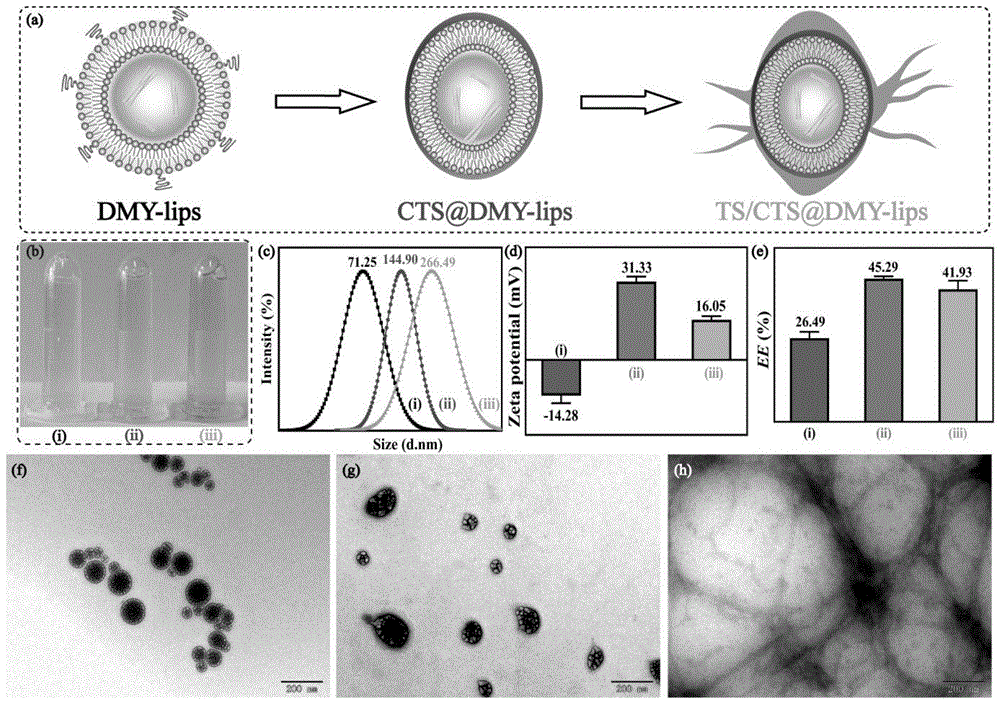
:二氢杨梅素(dmy)作为藤茶中最丰富(含量最高约为30wt%)的营养补充剂,具有预防酒精宿醉、抗癌、抗炎、抗菌等药理活性。然而,dmy低溶解度、低渗透性和低生物利用率等属性严重限制其在临床医学中的应用。liu等(liud,maoy,dingl,zengxa.dihydromyricetin:areviewonidentificationandquantificationmethods,biologicalactivities,chemicalstability,metabolismandapproachestoenhanceitsbioavailability.trendsfoodscitechnol.2019;91:586-97)研究表明dmy在大鼠体内的口服生物利用度仅为4.02%。现有技术中通常以单一的大豆磷脂作为包衣包覆dmy制备成脂质体,但dmy的生物利用率仍有待提高。技术实现要素:本发明的目的在于提供一种茶皂素/壳聚糖包覆二氢杨梅素脂质体及其制备方法和应用,本发明提供的茶皂素/壳聚糖包覆二氢杨梅素脂质体以修饰有聚乙二醇的磷脂类化合物作为第一包覆层,以接枝有茶皂素的壳聚糖作为第二包覆层,能够有效提高二氢杨梅素的生物利用率。为了实现上述发明目的,本发明提供以下技术方案:本发明提供了一种茶皂素/壳聚糖包覆二氢杨梅素脂质体,包括活性成分以及依次包覆在所述活性成分表面的第一包覆层和第二包覆层;所述活性成分为二氢杨梅素,所述第一包覆层的成分为修饰有聚乙二醇的磷脂类化合物,所述第二包覆层的成分为接枝有茶皂素的壳聚糖。优选地,所述茶皂素/壳聚糖包覆二氢杨梅素脂质体中二氢杨梅素的含量为30~45wt%。优选地,所述聚乙二醇为聚乙二醇4000、聚乙二醇2000或聚乙二醇4500。优选地,所述磷脂类化合物为蛋黄卵磷脂或大豆磷脂。优选地,所述茶皂素和壳聚糖的摩尔比为1:(0.5~2.0)。本发明提供了上述技术方案所述茶皂素/壳聚糖包覆二氢杨梅素脂质体的制备方法,包括以下步骤:将第一乳化剂、聚乙二醇与磷酸缓冲溶液混合,得到水相溶液;将磷脂类化合物、胆固醇、二氢杨梅素与有机溶剂混合,得到二氢杨梅素相溶液;将所述二氢杨梅素相溶液滴加至所述水相溶液中,得到乳浊液;去除所述乳浊液中的有机溶剂,得到二氢杨梅素脂质体溶液;将茶皂素、壳聚糖、乙酸、第二乳化剂与水混合,得到茶皂素-壳聚糖混合溶液,之后进行接枝反应,得到茶皂素/壳聚糖溶液;将所述二氢杨梅素脂质体溶液滴加至所述茶皂素/壳聚糖溶液中,进行包封处理,得到茶皂素/壳聚糖包覆二氢杨梅素脂质体。优选地,所述水相溶液中第一乳化剂的体积分数为0.05~0.25%,聚乙二醇的浓度为0.0005~0.015g/ml;所述二氢杨梅素相溶液中磷脂类化合物的浓度为0.01~0.2g/ml,胆固醇的浓度为0.001~0.02g/ml,二氢杨梅素的浓度为0.001~0.005g/ml;所述二氢杨梅素相溶液与水相溶液的体积比为1:(2~10)。优选地,所述茶皂素-壳聚糖混合溶液中茶皂素的浓度为0.004~0.006g/ml,壳聚糖的浓度为0.004~0.006g/ml,乙酸的体积分数为0.8~1.2%,第二乳化剂的体积分数为0.4~0.6%。优选地,所述二氢杨梅素脂质体溶液与茶皂素/壳聚糖溶液的体积比为1:(0.5~2.0)。本发明提供了上述技术方案所述茶皂素/壳聚糖包覆二氢杨梅素脂质体或上述技术方案所述制备方法制备得到的茶皂素/壳聚糖包覆二氢杨梅素脂质体在制备抗病原体制剂中的应用。本发明提供了一种茶皂素/壳聚糖包覆二氢杨梅素脂质体,包括活性成分以及依次包覆在所述活性成分表面的第一包覆层和第二包覆层;所述活性成分为二氢杨梅素,所述第一包覆层的成分为修饰有聚乙二醇的磷脂类化合物,所述第二包覆层的成分为接枝有茶皂素的壳聚糖。本发明以修饰有聚乙二醇的磷脂类化合物作为第一包覆层,能够解决dmy水解度低、生物半衰期短以及膜通透力差的问题,同时以接枝有茶皂素(ts)的壳聚糖(cts)作为第二包覆层,得到对细菌(如大肠杆菌(e.coli)和金色葡萄球菌(s.ausreus))具有强渗透作用的缓释型茶皂素/壳聚糖包覆二氢杨梅素脂质体(ts/cts@dmy-lips),其中,ts/cts@dmy-lips与e.coli外层脂多糖或s.ausreus外层磷壁酸存在静电作用,为纳米载体渗透细菌肽聚糖外层铺平道路,而缓慢持续释放药物的特点为dmy发挥最大药效提供基础,避免细菌产生耐药性。附图说明图1为本发明中基于接枝反应制备ts/cts的示意图;图2为本发明所述ts/cts@dmy-lips作用于细菌的示意图;图3为dmylips、cts@dmy-lips和ts/cts@dmy-lips的形貌结构以及载药率结果图;图4为dmylips、cts@dmy-lips和ts/cts@dmy-lips的综合结构表征图;图5为dmylips、cts@dmy-lips和ts/cts@dmy-lips在ph=3.0、ph=5.0、ph=6.0和ph=7.0环境下药物的释放速率图;图6为游离dmy对e.coli和s.aureus的抑菌活性结果图;图7为dmylips、blankcts-lips、blankts/cts-lips、cts@dmylips和ts/cts@dmy-lips对e.coli和s.aureus的抑菌活性结果图;图8为dmylips、cts@dmylips和ts/cts@dmy-lips处理24h后培养的e.coli和s.aureus菌落的生长情况图;图9为采用不同浓度ts/cts@dmy-lips处理后e.coli和s.aureus的od600生长曲线以及菌落生长情况图;图10为ts/cts@dmy-lips的抑菌机理分析图。具体实施方式本发明提供了一种茶皂素/壳聚糖包覆二氢杨梅素脂质体,包括活性成分以及依次包覆在所述活性成分表面的第一包覆层和第二包覆层;所述活性成分为二氢杨梅素,所述第一包覆层的成分为修饰有聚乙二醇的磷脂类化合物,所述第二包覆层的成分为接枝有茶皂素的壳聚糖。在本发明中,所述茶皂素/壳聚糖包覆二氢杨梅素脂质体中活性成分为二氢杨梅素,所述茶皂素/壳聚糖包覆二氢杨梅素脂质体中二氢杨梅素的含量优选为30~45wt%。本发明将修饰有聚乙二醇的磷脂类化合物作为第一包覆层以及接枝有茶皂素的壳聚糖作为第二包覆层,以其作为载药系统,能够有效提高二氢杨梅素的生物利用率。在本发明中,所述茶皂素/壳聚糖包覆二氢杨梅素脂质体中第一包覆层的成分为修饰有聚乙二醇的磷脂类化合物,所述聚乙二醇优选为聚乙二醇4000、聚乙二醇2000或聚乙二醇4500;所述磷脂类化合物优选为蛋黄卵磷脂或大豆磷脂。本发明采用聚乙二醇修饰磷脂类化合物,能够稳定整个脂质体机械骨架,有利于药物的负载,并可以防止免疫系统对脂质体的吞噬,促使整个载药系统能完整运输药物到体内病原体(如细菌)感染部位中。在本发明中,所述茶皂素/壳聚糖包覆二氢杨梅素脂质体中第二包覆层的成分为接枝有茶皂素的壳聚糖,所述茶皂素和壳聚糖的摩尔比优选为1:(0.5~2.0)。本发明在壳聚糖上接枝茶皂素,有利于改善壳聚糖在人体中性生理条件下的稳定性,进而有利于提高整个载药系统的机械强度,保证茶皂素/壳聚糖包覆二氢杨梅素脂质体在较宽ph值范围内(ph=3~7)具有较好的二氢杨梅素缓释效果,并有效提高载药系统对细菌的渗透能力。在本发明中,所述茶皂素/壳聚糖包覆二氢杨梅素脂质体的包封率优选为30~45%,所述茶皂素/壳聚糖包覆二氢杨梅素脂质体的粒度优选为50~300nm。本发明提供了上述技术方案所述茶皂素/壳聚糖包覆二氢杨梅素脂质体的制备方法,包括以下步骤:将第一乳化剂、聚乙二醇与磷酸缓冲溶液混合,得到水相溶液;将磷脂类化合物、胆固醇、二氢杨梅素与有机溶剂混合,得到二氢杨梅素相溶液;将所述二氢杨梅素相溶液滴加至所述水相溶液中,得到乳浊液;去除所述乳浊液中的有机溶剂,得到二氢杨梅素脂质体溶液;将茶皂素、壳聚糖、乙酸、第二乳化剂与水混合,得到茶皂素-壳聚糖混合溶液,之后进行接枝反应,得到茶皂素/壳聚糖溶液;将所述二氢杨梅素脂质体溶液滴加至所述茶皂素/壳聚糖溶液中,进行包封处理,得到茶皂素/壳聚糖包覆二氢杨梅素脂质体。在本发明中,若无特殊说明,所用原料均为本领域技术人员熟知的市售商品。本发明将第一乳化剂、聚乙二醇与磷酸缓冲溶液混合,得到水相溶液。在本发明中,所述第一乳化剂优选为吐温80或司班60,更优选为吐温80;本发明采用第一乳化剂有利于提高脂质体的载药率。在本发明中,所述水相溶液中第一乳化剂的体积分数优选为0.05~0.25%,更优选为0.1~0.2%;聚乙二醇的浓度优选为0.0005~0.015g/ml,更优选为0.0005~0.005g/ml。在本发明中,所述磷酸缓冲溶液的ph值优选为6.5。本发明对第一乳化剂、聚乙二醇与磷酸缓冲溶液混合的方式没有特殊限定,能够将各组分混合均匀即可。本发明将磷脂类化合物、胆固醇、二氢杨梅素与有机溶剂混合,得到二氢杨梅素相溶液。在本发明中,所述二氢杨梅素相溶液中磷脂类化合物的浓度优选为0.01~0.2g/ml,更优选为0.02~0.1g/ml;胆固醇的浓度优选为0.001~0.02g/ml,更优选为0.003~0.01g/ml;二氢杨梅素的浓度优选为0.001~0.005g/ml,更优选为0.002~0.004g/ml。在本发明中,所述有机溶剂优选为无水乙醇或无水甲醇。在本发明中,所述胆固醇能够提高脂质体的机械强度,稳定脂质体,使其不易分解。本发明对所述磷脂类化合物、胆固醇、二氢杨梅素与有机溶剂混合的方式没有特殊限定,能够将各组分混合均匀即可。得到水相溶液和二氢杨梅素相溶液后,本发明将所述二氢杨梅素相溶液滴加至所述水相溶液中,得到乳浊液。在本发明中,所述二氢杨梅素相溶液与水相溶液的体积比优选为1:(2~10),更优选为1:(2.5~5)。本发明优选将所述二氢杨梅素相溶液逐滴加入至所述水相溶液中,所述滴加优选在搅拌条件下进行,所述搅拌的转速优选为200~400rpm,更优选为250~300rpm。在本发明中,所述二氢杨梅素相溶液滴加过程中,水相溶液逐渐变黄且微浑浊;所述二氢杨梅素相溶液滴加结束后,即得到乳浊液。得到乳浊液后,本发明去除所述乳浊液中的有机溶剂,得到二氢杨梅素脂质体(dmy-lips)溶液。本发明优选将所述乳浊液加热以去除其中的有机溶剂,所述加热优选在搅拌条件下进行,所述搅拌的转速优选为80~120rpm,更优选为100rpm;所述加热的温度优选为40~45℃,更优选为42~43℃;所述加热的时间以有机溶剂完全去除为基准,在本发明的实施例中,具体可以加热1~5h;本发明通过在低温加热以及搅拌条件下促进有机溶剂的挥发,而在该条件下水不易挥发,待体系的体积保持恒定即认为有机溶剂完全去除,停止加热,得到二氢杨梅素脂质体溶液。本发明将茶皂素、壳聚糖、乙酸、第二乳化剂与水混合,得到茶皂素-壳聚糖混合溶液,之后进行接枝反应,得到茶皂素/壳聚糖(ts/cts)溶液。在本发明中,所述茶皂素-壳聚糖混合溶液中,所述茶皂素的浓度优选为0.004~0.006g/ml,更优选为0.005g/ml;壳聚糖的浓度优选为0.004~0.006g/ml,更优选为0.005g/ml;乙酸的体积分数为0.8~1.2%,更优选为1%;第二乳化剂的体积分数为0.4~0.6%,更优选为0.5%。在本发明中,所述第二乳化剂优选为吐温80或司班60,更优选为吐温80;本发明采用第二乳化剂有利于提高脂质体的载药率。本发明通过采用少量乙酸,保证在不破坏壳聚糖结构的基础上溶解壳聚糖。本发明优选将乙酸、第二乳化剂与水混合,得到乙酸-乳化剂混合溶液;之后将所述乙酸-乳化剂混合溶液与茶皂素、壳聚糖混合,得到茶皂素-壳聚糖混合溶液。在本发明中,所述接枝反应的温度优选为80~85℃,更优选为82~83℃;所述接枝反应的时间优选为1.5~2.5h,更优选为2h;所述接枝反应优选在搅拌条件下进行,所述搅拌的转速优选为150~250rpm,更优选为200rpm。所述接枝反应后,本发明优选将所得产物体系冷却至室温,之后进行透析以去除体系中残余的茶皂素,得到茶皂素/壳聚糖溶液。在本发明的实施例中,所述室温具体为25℃。在本发明中,所述透析采用的透析袋的截留分子量优选为5000da,所述透析优选以去离子水为透析液,所述透析的时间优选为4h。在本发明中,所述ts的分子结构式如下所示:图1为本发明中基于接枝反应制备ts/cts的示意图,由图1可知,ts中羧基分别与cts中羟基以及氨基反应,从而得到ts/cts。得到二氢杨梅素脂质体溶液和茶皂素/壳聚糖溶液后,本发明将所述二氢杨梅素脂质体溶液滴加至所述茶皂素/壳聚糖溶液中,进行包封处理,得到茶皂素/壳聚糖包覆二氢杨梅素脂质体。在本发明中,所述二氢杨梅素脂质体溶液与茶皂素/壳聚糖溶液的体积比优选为1:(0.5~2.0),更优选为1:1。在本发明中,所述二氢杨梅素脂质体溶液优选逐滴加入至所述茶皂素/壳聚糖溶液中。在本发明中,所述包封处理优选在室温条件下进行,所述包封处理的时间优选为3.5~4.5h,更优选为4h;所述包封处理的时间以二氢杨梅素脂质体溶液滴加完毕开始计。在本发明中,所述包封处理优选在搅拌条件下进行,所述搅拌的速率优选为150~250rpm,更优选为200rpm。在本发明中,所述包封处理完成后,得到含有茶皂素/壳聚糖包覆二氢杨梅素脂质体的溶液,经干燥后即得到茶皂素/壳聚糖包覆二氢杨梅素脂质体;所述干燥优选为冷冻干燥。本发明提供了上述技术方案所述茶皂素/壳聚糖包覆二氢杨梅素脂质体或上述技术方案所述制备方法制备得到的茶皂素/壳聚糖包覆二氢杨梅素脂质体在制备抗病原体制剂中的应用,在本发明中,所述抗病原体制剂优选为抗菌剂。本发明以修饰有聚乙二醇的磷脂类化合物作为第一包覆层,能够解决dmy水解度低、生物半衰期短以及膜通透力差的问题,同时以接枝有茶皂素(ts)的壳聚糖(cts)作为第二包覆层,得到对细菌(如大肠杆菌(e.coli)和金色葡萄球菌(s.ausreus))具有强渗透作用的缓释型茶皂素/壳聚糖包覆二氢杨梅素脂质体(ts/cts@dmy-lips)。图2为本发明所述ts/cts@dmy-lips作用于细菌的示意图(以蛋黄卵磷脂和聚乙二醇4000为例),ts/cts@dmy-lips与e.coli外层脂多糖或s.ausreus外层磷壁酸存在静电作用,为纳米载体渗透细菌肽聚糖外层铺平道路,而缓慢持续释放药物的特点为dmy发挥最大药效提供基础,避免细菌产生耐药性。下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。以下实施例以及测试例中所用实验仪器和试剂分别如表1和表2所示。表1实验仪器仪器名称仪器型号生产商真空冷冻干燥机alpha1-2ldplus德国christ公司紫外分光光度计s22pc上海棱光技术有限公司傅里叶红外光谱仪spectrum100美国perkinelmer公司拉曼光谱仪dxr2美国thermofisher公司x射线粉末衍射d8advance德国bruker公司同步热分析仪tga2美国mettler-toledo公司纳米粒度测试仪90pluspals美国brookhacen仪器公司透视电子显微镜tecnaig2f20美国fei公司溶出仪rc12ad天大天发科技有限公司电导率仪ct-3030深圳市柯迪达电子有限公司表2实验试剂试剂名称纯度生产厂家聚乙二醇-4000(peg-4000)分析纯天津市大茂化学试剂厂胆固醇分析纯上海麦克林生化科技有限公司茶皂素(ts)分析纯上海麦克林生化科技有限公司壳聚糖(cts)分析纯上海麦克林生化科技有限公司吐温80细胞培养级阿拉丁试剂(上海)有限公司蛋黄卵磷脂生物医药级艾伟拓(上海)医药科技有限公司lb营养琼脂细胞培养级北京索莱宝科技有限公司lb肉汤细胞培养级北京索莱宝科技有限公司此外,超微量na+/k+-atp酶测定试剂盒与总蛋白测定试剂盒(考马斯亮蓝法)购自于南京建成生物工程研究所;e.coli和s.aureus取自仲恺农业工程学院生化实验室。二氢杨梅素(dmy)采用水热提取法从藤茶中提取得到,包括以下步骤:将20g藤茶枯茎叶和400ml去离子水加入到圆底烧瓶中,搅拌均匀后使用naoh调节体系的ph值为7,将所述圆底烧瓶置于恒温加热磁力搅拌器中,在100℃条件下水浴提取0.5h;之后趁热过滤,弃滤渣,将提取液移至旋转烧瓶中浓缩,至所得浓缩液体积为所述提取液体积的1/4,将所述浓缩液放置在4℃的冰箱中冷藏12h,过滤,弃滤液,得到dmy粗提取物;将所述dmy粗提取物溶于8ml无水乙醇中,搅拌均匀后过滤,弃滤渣,再将滤液缓慢倒入到400ml去离子水中,在室温(25℃)条件下静置存放,直至析出dmy晶体,得到含有dmy晶体的悬液;使用减压抽滤机对所述悬液进行抽滤,弃滤液,将滤渣放置于烘箱中鼓风干燥,得到dmy(纯度为94.3%)。实施例1制备茶皂素/壳聚糖包覆二氢杨梅素脂质体,包括以下步骤:(1)采用水包油方法制备dmy-lip溶液,具体如下:将30μl吐温80、0.01gpeg-4000加入到20ml磷酸缓冲溶液(ph=6.5)中,搅拌均匀后得到水相溶液;将0.2g蛋黄卵磷脂、0.025g胆固醇和0.02gdmy加入到8ml无水乙醇中,搅拌使其充分溶解,得到dmy相溶液;在300rpm磁力搅拌条件下,将所述dmy相溶液逐滴加入到水相溶液中,滴加结束后,得到乳浊液;在43℃条件下以100rpm的转速搅拌所述乳浊液3h,直至除去乳浊液中的无水乙醇,待溶液保持恒定体积后,得到dmy-lips溶液(dmy-lips中dmy的含量为26.49wt%)。(2)制备ts/cts溶液,具体如下:将100μl乙酸和50μl吐温80加入到水中,得到10ml乙酸-吐温80混合溶液;准确称取0.05g壳聚糖(cts)和0.05g茶皂素(ts)溶解在10ml所述乙酸-吐温80混合溶液中,在200rpm磁力搅拌条件下,将所得体系置于83℃水浴锅反应2h;反应结束后冷却至室温(25℃),将所得产物体系置于5000da透析袋中,在去离子水中透析4h以除去多余的ts,得到ts/cts溶液(ts/cts含量为1wt%)。(3)制备ts/cts@dmylips,具体如下:在室温、200rpm磁力搅拌条件下,将10ml步骤(1)中dmy-lips溶液逐滴加入到10ml所述步骤(2)所述ts/cts溶液中,并持续搅拌4h,得到ts/cts@dmylips溶液。对比例1按照实施例1的方法操作,不同之处在于仅省略掉ts,最终制备得到壳聚糖负载二氢杨梅素脂质体(cts@dmylips)溶液;按照实施例1的方法操作,不同之处在于仅省略掉ts和dmy,最终制备得到未载药壳聚糖脂质体(blankcts-lips)溶液;按照实施例1的方法操作,不同之处在于仅省略掉dmy,最终制备得到未载药茶皂素/壳聚糖脂质体(blankts/cts-lips)溶液。以下测试例数据采用spss25.0统计软件进行统计学分析,所有结果均以数值±标准误差表示,p<0.05判定数值具有统计学意义。测试例1(1)载药分析准确称取5ml载药溶液(dmylips溶液、cts@dmy-lips溶液或ts/cts@dmy-lips溶液)置于10ml离心管中,6000r/min条件下离心20min,吸取1ml上清液并采用磷酸缓冲溶液稀释定容至25ml;以磷酸缓冲溶液为背景,使用紫外分光光度计在λ=293nm处测量未包封的dmy的吸光度。dmy的标准浓度(c)与吸光度(a)线性方程为a=48.3085c-0.00829;r2=0.9988。根据式1计算出溶液载药率(ee):式1中,mtotal代表体系中dmy总量,mg;mfree代表体系中未包封的dmy的量,mg;ee代表载药率,%。(2)结构表征与微观形貌观察采用纳米粒度测试仪测定dmylips溶液、cts@dmy-lips溶液和ts/cts@dmy-lips溶液中脂质体的粒径大小和zeta电位,采用透射电镜观察dmylips、cts@dmy-lips和ts/cts@dmy-lips的微观形态和粒径分布。使用真空冷冻干燥机冷冻干燥dmylips溶液、cts@dmy-lips溶液和ts/cts@dmy-lips溶液,得到相对应固体样品。在4000~400cm-1范围内,根据kbr片剂法使用傅里叶红外光谱仪对dmylips、cts@dmy-lips和ts/cts@dmy-lips进行红外分析;采用显微拉曼光谱仪对dmylips、cts@dmy-lips和ts/cts@dmy-lips进行拉曼分析;以cu靶kα为辐射源,使用x射线粉末衍射仪对dmylips、cts@dmy-lips和ts/cts@dmy-lips进行xrd分析,波长(λ)为0.154056nm,管电压为40kv,管电流为15ma;在n2保护下,使用同步热分析仪以10℃/min的升温速率考察dmylips、cts@dmy-lips和ts/cts@dmy-lips在40~900℃范围内的热稳定性。(3)结果分析图3为dmylips、cts@dmy-lips和ts/cts@dmy-lips的形貌结构以及载药率结果图。现根据图3进行详细说明。图3中的(a)为ts/cts@dmy-lips的合成示意图,本发明中ts/cts在脂质体表面的覆盖,能够提高脂质体的稳定性和渗透作用。图3中的(b)为dmylips(i)溶液、cts@dmy-lips(ii)溶液和ts/cts@dmy-lips(iii)溶液的宏观图,结果显示,dmylips溶液和cts@dmy-lips溶液为淡黄色透明溶液,而ts/cts@dmy-lips溶液为黄色透明溶液,表明物质微观结构发生变化。图3中的(c)为dmylips、cts@dmy-lips和ts/cts@dmy-lips的粒径分布图,结果显示,dmylips粒子大小为71.25nm,粒径均一;相比之下,cts@dmy-lips粒子和ts/cts@dmy-lips粒子的大小分别增大至144.90nm和266.49nm,粒子尺寸大小的增加归因于脂质体表面cts或ts/cts包覆层的形成。受自身带正电氨基团与蛋黄卵磷脂带负电磷酸基团驱动,ts/cts可自动覆盖在脂质体表面,并可能与脂质体表面peg-4000形成氢键而稳定存在载体表面。图3中的(d)为dmylips、cts@dmy-lips和ts/cts@dmy-lips的zeta电位图,结果显示,dmylips和cts@dmy-lips的zeta电位分别为-14.28mv和31.33mv,表面电荷反转证实了cts在脂质体表面的成功覆盖。此外,ts/cts@dmy-lips的zeta电位为16.05mv,这可能是ts/cts复合物的形成消耗了cts上的氨基官能团。值得注意的是,阳离子载药系统的构建不仅有利于对细菌的渗透作用,还能促进药物的负载。图3中的(e)为dmylips、cts@dmy-lips和ts/cts@dmy-lips的载药率结果图,结果显示,dmylips的载药率为26.49%,cts@dmy-lips和ts/cts@dmy-lips的载药率分别增大到45.29%和41.93%。载药率的增加是由脂质体表面cts的饱和吸收作用引起的,阳性cts与阴性dmy之间存在离子相互作用,从而促进脂质体对dmy的吸收。图3中的(f)、(g)和(h)分别为dmylips、cts@dmy-lips和ts/cts@dmy-lips的tem图(标尺均为200nm),结果显示,dmylips为纳米级球型结构,内含多个囊泡,具有双层结构;cts@dmy-lips呈现出椭圆型结构,粒子大小稍大于dmylips,与粒径测试结果一致;而ts/cts@dmy-lips呈现出树状细胞型结构,脂质体表面被完全覆盖。药物递送系统间由延伸的“触手”相连,并保持相对空间距离。该行为主要由两种原因导致,一是高分子量cts产生的高分散相导致载体表面具有流变性能(高粘弹性和良好的界面性能),二是ts中糖基上丰富的羟基与cts形成氢键促进其彼此交联。图4为dmylips、cts@dmy-lips和ts/cts@dmy-lips的综合结构表征图,其中,(i)dmylips;(ii)cts@dmy-lips;(iii)ts/cts@dmy-lips。现根据图4进行详细说明。图4中的(a)为dmylips、cts@dmy-lips和ts/cts@dmy-lips的红外分析图,结果显示,dmylips上位于3431cm-1处宽峰为-oh的伸缩振动峰,2919cm-1和2873cm-1处吸收峰是由外壳peg-4000上c-h的伸缩振动产生;此外,1735cm-1和1104cm-1处吸收峰可归结于c=o和c-o-c的拉伸振动。经cts包封后,脂质体上-oh的伸缩振动峰迁移至3416cm-1,这可能是由于peg-4000的-oh与cts的-oh和-nh2之间的相互干扰。cts@dmy-lips在1670cm-1处(酰胺i中c=o的拉伸振动)和1645cm-1处(酰胺ii中n-h的弯曲振动)出现了酰胺键的特征吸收带,充分证实了cts的存在。ts/cts@dmy-lips的红外曲线中,-oh吸收峰迁移至3410cm-1处且吸收带变宽,表明分子间氢键增多;cts酰胺键吸收峰迁移至1672cm-1处和1641cm-1处,并且c-h吸光度持续减少,表明ts成功地附着在cts上。图4中的(b)为dmylips、cts@dmy-lips和ts/cts@dmy-lips的拉曼分析图,结果显示,dmylips的拉曼曲线和cts@dmy-lips的拉曼曲线在1092cm-1处吸收峰可归结于c-o-c的拉伸振动;相比之下,ts/cts@dmy-lips的拉曼曲线新形成的酯基或酰氨基吸收峰(1374cm-1)直接证明了ts/cts@dmy-lips的成功合成。图4中的(c)为dmylips、cts@dmy-lips和ts/cts@dmy-lips的xrd图,结果显示,dmylips的xrd曲线呈现出宽且重叠图谱,表明其为非晶态结构;而cts@dmy-lips的xrd曲线出现部分布拉格峰,表明物质表面结构发生改变;相比之下,ts/cts@dmy-lip的xrd曲线布拉格峰重新消失且呈现非晶相结构特征,这可能与ts与cts的不定向复合有关,而粒径小、结晶度低的药物更容易溶解和吸收,表明本发明制备的非晶相ts/cts@dmy-lip可能有利于渗透并进入细菌内部。图4中的(d)为dmylips、cts@dmy-lips和ts/cts@dmy-lips的热重量分析法曲线,(e)为dmylips、cts@dmy-lips和ts/cts@dmy-lips的导数热重曲线。结果显示,dmylips、cts@dmy-lips和ts/cts@dmy-lips在40~150℃范围的失重均为物质表面游离水和结晶水的蒸发导致的,失重率分别为8.32%、6.56%和6.63%。继续升高温度,cts@dmy-lips在220~320℃出现第二阶段失重(12.49%),对应的dta峰为274.86℃,这主要与cts主链c-o-c键的断裂有关。相比之下,ts/cts@dmy-lips在该阶段的dta峰提高至284.79℃,这可能是由于酯键或酰胺键的建立提升了cts的整体热稳定性。而当温度在320~450℃范围内,dmylips、cts@dmy-lips和ts/cts@dmy-lips出现明显重量损失,这是因为脂质体骨架热瓦解导致的。dmylips、cts@dmy-lips和ts/cts@dmy-lips在该阶段的dta峰分别出现在400.98℃、389.56℃和405.95℃,表明ts/cts@dmy-lips具有更高的热稳定,这也为ts成功接枝cts提供了依据。测试例2缓释性能测试以游离的dmy为对照组,探究dmylips、cts@dmy-lips和ts/cts@dmy-lips在ph=3、5、6和7的磷酸缓冲溶液中的释放速率。具体的,准确配制500ml磷酸缓冲溶液并倒入溶出瓶中,根据溶出仪操作指示调整机械桨叶到最合适的高度。将2ml样品溶液装入5000da透析袋中,再将透析袋沉于溶出瓶底部,以37℃恒温机械搅拌(100rpm)溶出。每隔一段时间收集10ml溶出液,并由机器自动补偿纯净的磷酸缓冲溶液。采用紫外分光光度计测量收集的样品溶液的dmy吸光度(a),其标准工作曲线a=48.3085c-0.00829,并根据式2计算得到dmy的累积释放率(ri)。式2中,ρi代表样品中dmy的质量浓度,mg/ml;mdmy为2ml样品中dmy的总质量,mg。图5为dmylips、cts@dmy-lips和ts/cts@dmy-lips在ph=3.0、ph=5.0、ph=6.0和ph=7.0环境下药物的释放速率图,图5中的(a)为ph=3.0,(b)为ph=5.0,(c)为ph=6.0,(d)为ph=7.0;其中,(i)游离的dmy,(ii)dmylips,(iii)cts@dmy-lips,(iv)ts/cts@dmy-lips。由图5可知,在没有载药系统的保护下,游离的dmy在1h内迅速扩散且释放率随时间的延长不断加大,表明dmy的扩散不受透析袋影响;游离的dmy在四种ph环境下的累加释放率分别为82.39%、79.04%、84.77%和72.31%。相比之下,dmylips、cts@dmy-lips和ts/cts@dmy-lips三种载药系统能有效缓解dmy的释放,其中ts/cts@dmy-lips效果最佳,表明药物递送系统的性质对药物释放影响较大。cts在脂质体表面涂覆或嵌入磷脂双分子层,可防止脂质体崩解而使所包裹的药物泄漏。而ts与cts结合形成酰胺键能进一步抑制cts(pka=6.3~6.5)在中性条件水解,进一步巩固整个递送系统。dmylips在四种ph环境下溶出29h后,其总释放率分别为60.35%、64.08%、63.83%和56.50%。经ts/cts封装后,ts/cts@dmy-lips在四种ph环境下药物释放率分别降至28.10%、34.36%、34.82%和22.65%,这意味着绝大部分dmy将保留下来以供后续细菌吸收。由于大部分细菌感染部位存在于弱酸或中性环境下,具有广普ph缓释性能的ts/cts@dmy-lips在生物医疗领域具有巨大潜力。测试例3抑菌性能测试(1)抗菌活性研究准确称取0.02gdmy溶于20ml磷酸缓冲溶液(ph=6.5),将所得悬浊液于60℃加热直至dmy彻底溶解,静置冷却至室温,得到1.00mg/ml的dmy溶液,dmy溶液现配现用。采用琼脂扩散法测定dmylips溶液、cts@dmy-lips溶液和ts/cts@dmy-lips溶液对e.coli和s.aureus的抑菌能力。具体是在无菌超净台上,将25ml灭菌的琼脂培养基倒入灭菌的玻璃培养皿中,自然冷却至其凝固,随后吸取100μl活菌悬液(e.coli:1.0×108cfu/ml;s.aureus:1.0×106cfu/ml)并均匀接种于琼脂平板表面,使用打孔器在固体介质上挖出三个直径为6mm的圆孔,每个孔中加入80μl抗菌样品;封装培养皿,并将其放置于培养箱中,在37℃条件下孵育;24h后取出培养皿,多次实验后用交叉法测得抑菌圈的直径(具体结果见图7,后续会详细说明)。为了进一步评价dmylips、cts@dmy-lips和ts/cts@dmy-lips的抗菌能力,以无菌磷酸缓冲溶液(ph=6.5)为空白对照组,使用酶标仪测定药物处理24h后两种细菌悬浮液的od600生长曲线。具体是在无菌超净台中将20μl的菌悬液和80μl的灭菌lb肉汤液体培养基加入到无菌96孔板孔中,轻微震荡摇匀后,加入100μl液体药物样品;封装96孔板,并将其放置于摇床,37℃条件下培养24h,培养期间每隔一段时间使用酶标仪测定菌液的od600值。每个处理平行5次实验(具体结果见图8,后续会详细说明)。(2)最小抑菌浓度(mic)和最小杀菌浓度(mbc)测定采用标准微量稀释法测定ts/cts@dmy-lips溶液对e.coli和s.aureus的mic和mbc。具体是将20μl的菌悬液和80μl灭菌的lb肉汤加入到96孔板孔中,然后分别加入100μl不同浓度的ts/cts@dmy-lips溶液,使药物终浓度分别为0mg/ml、0.025mg/ml、0.05mg/ml、0.10mg/ml、0.2mg/ml、0.3mg/ml、0.5mg/ml;封装96孔板,并将其放置于摇床,37℃条件下培养24h,培养期间每隔一段时间使用酶标仪测定菌液的od600值。培养24h后,收集100μl含药菌液并均匀涂布在25ml琼脂固体培养基表面中,37℃孵育24h,拍照并记录琼脂上菌落形成情况。其中,mic被解释为抑制细菌生长的最低样品浓度,mbc被解释为能杀死菌液中99.9%的细菌的最低药物浓度。每个处理平行5次实验。(3)生物透视电镜观察在无菌条件下,吸取1ml菌悬液和1ml2micts/cts@dmy-lips溶液于2ml无菌的离心管中,封装离心管,并将其放置于摇床,37℃条件下培养6h,3000r/min离心10min,移去溶液,再往离心管中加满2.5%的戊二醛溶液以固定沉淀在管底的细菌,4℃保存24h后倒去固定液,再用0.1mol/l磷酸缓冲溶液(ph=7.0)洗涤重悬细菌3次,采用1%的锇酸溶液重新固定样品2h,再继续用磷酸缓冲溶液洗涤重悬细菌3次;采用乙醇溶液梯度洗脱细菌样品,再用包埋剂包埋细菌,之后切片、染色、晾干,采用生物透视电镜观察菌体的微观形态变化。(4)菌液电导率测定准确吸取4ml菌悬液于15ml无菌离心管中,3000r/min离心10min,倒去溶液,使用磷酸缓冲溶液(ph=7.0)洗涤细菌3次,再将干净的细菌沉淀物重新分散在15ml磷酸缓冲溶液中备用。吸取2ml干净的菌悬液于5ml灭菌离心管中,然后加入2ml2micts/cts@dmy-lips溶液或等体积无菌水,充分摇匀后将离心管放置于摇床,37℃条件下进行培养;之后将含药菌液置于超速离心机,3000r/min条件下离心10min,收集1ml上清液,再用超纯水稀释至25ml,采用电导率仪测定药物处理0h、1h、2h、4h和6h后菌液的电导率。每个处理平行3次实验。(5)胞内核酸溶出情况测定按照(4)中方法得到经ts/cts@dmy-lips处理后的菌液,使用超微量紫外分光光度计测定菌液在260nm的吸光度以判定胞内核酸溶出情况。每个处理平行3次实验。(6)胞内腺嘌呤核苷三磷酸(na+/k+-atp)的测定采用生理盐水对4ml菌悬液进行洗涤、重悬,并定容至15ml,吸取2ml干净的菌悬液于5ml灭菌离心管中,然后加入2ml2micts/cts@dmy-lips溶液或等体积无菌水,充分摇匀后将离心管放置在摇床,在37℃条件下进行培养;之后将含药菌液置于超速离心机,3000r/min条件下离心10min,弃滤液并保留底部细菌沉淀物,加入生理盐水重悬至溶液体积为0.2ml,再使用超声粉碎机破碎细菌。根据购买的na+/k+-atp试剂盒的操作说明配制指示剂和显示剂,孵化后使用超微量紫外分光光度计测定溶液在636nm处吸光度。每个处理平行3次实验。(7)结果分析图6为游离dmy对e.coli和s.aureus的抑菌活性结果图,图6中的(a)为经游离dmy处理后的e.coli,(b)为经游离dmy处理后的s.aureus。图7为dmylips、blankcts-lips、blankts/cts-lips、cts@dmylips和ts/cts@dmy-lips对e.coli和s.aureus的抑菌活性结果图,图7中的(a)为经不同药物处理后的e.coli,(b)为经不同药物处理后的s.aureus,(c)为经不同药物处理后的e.coli的od600生长曲线,(d)为经不同药物处理后的s.aureus的od600生长曲线。图8为dmylips、cts@dmylips和ts/cts@dmy-lips处理24h后培养的e.coli和s.aureus菌落的生长情况图,图8中的(a)为e.coli菌落的生长情况图,(b)为s.aureus菌落的生长情况图。由图6可知,游离dmy对e.coli和s.aureus无明显抑菌效果。由图7中的(a)和(b)可知,dmylips在e.coli上的抑菌圈为10.82±2.34mm,这主要是由于脂质体的包覆提高了dmy的溶解度并减缓药物释放。但dmylips在s.aureus培养基未发现抑菌圈。此外,blankcts-lips和blankts/cts-lips药孔在e.coli和s.aureus培养基中均有菌落生成,表面载药系统中的cts和ts/cts外衣对细菌无明显抑菌作用。相比之下,cts@dmylips对e.coli和s.aureus的抑菌圈分别为14.35±0.26mm和21.67±1.69mm,这可能是由于cts外衣增大了dmylips对e.coli和s.aureus的膜穿透力。cts能与革兰氏阴性菌(e.coli)的脂多糖和革兰氏阳性菌(s.aureus)的磷壁酸发生静电相互作用,从而导致渗透作用。而ts/cts@dmylips对e.coli和s.aureus的抑菌圈分别为15.44±0.49mm和20.29±2.01mm,表明ts与cts的相互作用并未降低整个药物递送系统的抑菌活性。由图7中的(c)和(d)可知,经dmylips处理后的e.coli和s.aureus菌液od600值随时间的延长而提升,24h后e.coli和s.aureus菌液od600值分别为0.81和0.63,表明dmylips的抑菌效果不显著。相比之下,经cts@dmylips和ts/cts@dmy-lips处理下两种细菌生长曲线呈现不增长甚至负增长趋势,这主要是由于菌液中所有的菌体被杀死或完全抑制导致的。由图8可知,与cts@dmylips共培养24h的e.coli菌液,培养在固体培养基后仍有菌落数生成,表明cts@dmylips未能完全杀死e.coli菌体。相比之下,与ts/cts@dmylips共培养24h的e.coli和s.aureus菌液无菌落数生成,表明ts/cts@dmylips对e.coli和s.aureus具有100%灭杀能力。因此,基于以上抑菌分析,说明ts/cts@dmy-lips的成功制备大幅度提升了dmy对的e.coli和s.aureus抑菌活性。图9为采用不同浓度ts/cts@dmy-lips处理后e.coli和s.aureus的od600生长曲线以及菌落生长情况图,图9中的(a)为采用不同浓度ts/cts@dmy-lips处理后e.coli的od600生长曲线,(b)为采用不同浓度ts/cts@dmy-lips处理后s.aureus的od600生长曲线,(c)为采用不同浓度ts/cts@dmy-lips处理24h后培养的e.coli和s.aureus菌落的生长情况图。其中,高od600值被解释为高细菌浓度和较差抑菌活性。由图9中的(a)和(b)可知,相比对照组(0mg/ml),与ts/cts@dmy-lips共培养的e.coli和s.aureus菌液od600值显著下降,且随时间推移不断减低。当ts/cts@dmy-lips处理浓度≥0.05mg/ml,e.coli和s.aureus菌液呈现不生长甚至负增长趋势,表明菌体被杀死或被完全抑制。为进一步确认ts/cts@dmy-lips处理后菌液是否具备菌活性,将与药物共培养24h的菌液涂布培养在固体培养基中以观察菌落数,如图9中的(c)所示,与对照组相比,0.025mg/mlts/cts@dmy-lips处理的e.coli菌液菌落数明显减少,并且ts/cts@dmy-lips处理浓度高于0.20mg/ml后培养基无e.coli菌落生成,表明ts/cts@dmy-lips对e.coli的mic和mbc分别为0.025mg/ml和0.20mg/ml。同理,ts/cts@dmy-lips对s.aureus的mic和mbc分别为0.025mg/ml和0.05mg/ml。图10为ts/cts@dmy-lips的抑菌机理分析图,图10中的(a)为ts/cts@dmy-lips处理后e.coli的扫描电镜图(标尺为1μm);(b)为ts/cts@dmy-lips对e.coli胞外电导率的影响图;(c)为ts/cts@dmy-lips对e.coli胞内核酸释放量的影响图;(d)为ts/cts@dmy-lips处理后s.aureus的扫描电镜图(标尺为0.5μm);(e)为ts/cts@dmy-lips对s.aureus胞外电导率的影响图;(f)为ts/cts@dmy-lips对s.aureus胞内核酸释放量的影响图;(g)为不同药物处理6h后e.coli和s.aureus菌液图片,其中,(i)为经无菌水处理的e.coli菌液,(ii)为经ts/cts@dmy-lips处理的e.coli菌液,(iii)为经无菌水处理的s.aureus菌液,(iv)为经ts/cts@dmy-lips处理的s.aureus菌液;(h)为ts/cts@dmy-lips对e.coli胞内atp含量的影响图;(i)为ts/cts@dmy-lips对s.aureus胞内atp含量的影响图。图中标记星号的柱状图之间的数值具有统计学差异(p<0.05)。由图10中的(a)和(d)可知,e.coli和s.aureus遭受到ts/cts@dmy-lips的严重破坏,两种菌体均表现出形态萎缩或扭曲、细胞膜损坏和菌内原生质泄漏,这些形态变化进一步证明了ts/cts@dmy-lips比未处理的dmy样品能够更有效地破坏细菌生物膜。ts/cts@dmy-lips对e.coli和s.aureus灭杀活性通过载体外层cts助力。cts能与革兰氏阴性菌(e.coli)的脂多糖或与革兰氏阳性菌(s.aureus)的磷壁酸发生静电相互作用,从而推动整个载药系统的渗透作用。由图10中的(b)和(e)可知,与对照组(0mg/ml)相比,与ts/cts@dmy-lips共培养的两种菌液电导率随时间的延长不断提升;处理6h后,e.coli菌液电导率由1025.33μs/cm提升至1690.33μs/cm,而s.aureus菌液电导率由1035.33μs/cm提升至1820.67μs/cm。由图10中的(c)和(f)可知,与ts/cts@dmy-lips共培养的e.coli和s.aureus菌液胞内核酸释放量迅速增加,处理6h后,e.coli菌液od260由0.02迅速升高到0.57,而s.aureus菌液od260由0.02迅速升高到0.73。这揭示了dmy对e.coli和s.aureus生物膜具有高效损坏效果。由图10中的(g)可知,与ts/cts@dmy-lips共培养后的菌液经atp显示剂染色后颜色变淡,表明菌体中atp含量大幅度减少。根据商业atp试剂盒指示说明,采用超微量紫外分光光度计测定菌液在636nm处的吸光度,结果如图10中的(h)和(i)所示,与对照组(0mg/ml)相比,与ts/cts@dmy-lips共培养6h的e.coli菌液atp含量由66.15gprot/l减少至22.79gprot/l,而与ts/cts@dmy-lips共培养6h的s.aureus菌液atp含量由78.26gprot/l减少至47.12gprot/l。这说明ts/cts@dmy-lips导致细菌无法正常分解葡萄糖获得能量,进而导致atp合成受阻。由以上实施例和测试例可知,本发明以磷脂类化合物为载体、聚乙二醇为修饰剂制备dmylips,再以cts和ts为包封剂功能化整个纳米载体,最终得到ts/cts@dmy-lips。整个载药系统的构建不仅有效提高dmy的亲水性和水解度,还促进dmy渗透细菌膜。带正电荷的ts/cts@dmy-lips与带负电荷的e.coli和s.aureus之间存在静电相互作用,为纳米载体滞留并进入细菌铺平道路。而广谱ph缓释性能为dmy在细菌内部的长效释放提供舞台,导致ts/cts@dmy-lips对e.coli和s.aureus具有100%灭杀活性。ts/cts@dmy-lips不可逆损坏细胞膜,导致细菌原生质溶出而死亡。同时,ts/cts@dmy-lips有效抑制细菌氧化呼吸和能量代谢,扼杀了细菌分裂扩散的可能。与传统抑菌剂不同,组成ts/cts@dmy-lips的主要壁材与药物均为天然产物,提高了患者对抗菌治疗的依从性。因此,该长效缓释型载药系统在未来生物学医疗研究前景无限。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1