包含细菌菌株的组合物的制作方法
包含细菌菌株的组合物
1.相关申请
2.本技术是中国专利申请201680033991.0号的分案申请,并要求2015年6月15日提交的英国申请gb1510467.2号和2015年11月20日提交的英国申请gb1520501.6号的优先权。
发明领域
3.本发明属于包含从哺乳动物消化道分离的细菌菌株的组合物和此类组合物用于治疗疾病的用途的领域。
4.发明背景
5.虽然认为人类肠道在子宫内是无菌的,但在出生后其立刻暴露于大量的母体和环境微生物。此后,出现微生物定殖和演替的动态期,其受例如分娩模式、环境、饮食和宿主基因型等因素影响,所有因素都影响肠微生物丛的组成,特别是在童年期间。随后,微生物丛稳定化并变成成人样[1]。人类肠微生物丛含有超过500-1000个基本上属于两大细菌分类脆弱拟杆菌(bacteroidete)和厚壁门菌(firmicute)的不同种系型[2]。由人类肠的细菌定殖产生的成功共生关系产生多种代谢、结构、保护和其它有益功能。定殖于肠的增强代谢活性确保降解以其它方式无法摄取的饮食组分,同时释放副产物,为宿主提供重要的营养物来源。类似地,充分认识到肠微生物丛的免疫重要性,且在免疫系统减弱的无菌动物中例示,其免疫系统在引入共生细菌后在功能上复原[3-5]。
[0006]
微生物丛组成的显著变化已经在例如发炎性肠病(ibd)等肠胃病症中证明。举例来说,在ibd患者中梭菌属(clostridium)xiva簇细菌的含量降低,而大肠杆菌数目增加,表明肠内共生体与病原性共生体的平衡的变化[6-9]。有趣地,此微生物生态失调也与效应t细胞群体的不平衡相关。
[0007]
认识到某些细菌菌株对动物肠可能具有潜在的积极作用,已经提议各种菌株用于治疗各种疾病(参见例如[10-13])。也已经提议某些菌株,包括大部分乳杆菌属(lactobacillus)和双歧杆菌属(bifidobacterium)菌株,用于治疗不直接与肠相关的各种发炎性和自身免疫性疾病(综述参见[14]和[15])。然而,不同疾病和不同细菌菌株之间的关系和在全身层面上特定细菌菌株对肠和对任何特定类型疾病的准确作用尚未很好地表征。
[0008]
本领域中需要治疗发炎性和自身免疫性疾病的新方法。还需要待表征的肠细菌的潜在作用,以可以研发使用肠细菌的新疗法。
发明概要
[0009]
本发明人已经研发用于治疗和预防发炎性和自身免疫性疾病的新疗法。具体来说,本发明人已经研发用于治疗和预防由il-17或th17通路介导的疾病和病状的新疗法。具体来说,本发明人已经鉴别一种有效减少th17发炎反应的新细菌菌株。如实施例中所描述,经口施用包含以登记号ncimb 42380寄存的细菌的组合物可以降低哮喘、类风湿性关节炎和多发性硬化的小鼠模型中包括th17发炎反应在内的发炎反应的严重程度。还如实施例中
所描述,经口施用包含以登记号ncimb 42380寄存的细菌的组合物可以减小可能与th17发炎反应相关的癌症的小鼠模型中的肿瘤尺寸。
[0010]
因此,在第一实施方案中,本发明提供了一种包含以登记号ncimb 42380寄存的细菌或其生物型的组合物,其用于治疗或预防由il-17或th17通路介导的疾病或病状的方法中。本发明人已经鉴别用此类细菌菌株治疗可以降低作为th17通路(包括il-17)的一部分的细胞因子的含量,可以减轻th17发炎反应且在由il-17和th17通路介导的发炎性和自身免疫性疾病的小鼠模型中可以提供临床益处。
[0011]
在特定实施方案中,本发明提供了一种包含以登记号ncimb 42380寄存的细菌或其生物型的组合物,其用于治疗或预防选自由以下组成的群组的疾病或病状的方法中:多发性硬化;关节炎,例如类风湿性关节炎、骨关节炎、牛皮癣性关节炎或幼年特发性关节炎;视神经脊髓炎(德维克氏病(devic's disease));强直性脊椎炎;脊椎关节炎;牛皮癣;全身性红斑狼疮;发炎性肠病,例如克罗恩氏病(crohn’s disease)或溃疡性结肠炎;乳糜泻;哮喘,例如过敏性哮喘或中性粒细胞性哮喘;慢性阻塞性肺病(copd);癌症,例如乳癌、结肠癌、肺癌或卵巢癌;葡萄膜炎;巩膜炎;血管炎;白塞氏病(behcet's disease);动脉粥样硬化;异位性皮炎;肺气肿;牙周炎;过敏性鼻炎;以及同种异体移植排斥。以登记号ncimb 42380寄存的细菌展示的对th17发炎反应的作用可以为由il-17和th17通路介导的疾病和病状,例如上列疾病和病状提供治疗益处。
[0012]
在优选实施方案中,本发明提供了一种包含以登记号ncimb 42380寄存的细菌或其生物型的组合物,其用于治疗或预防哮喘,例如中性粒细胞性哮喘或过敏性哮喘的方法中。本发明人已经鉴别用以登记号ncimb 42380寄存的细菌治疗可以减少中性粒细胞和嗜酸细胞募集到肺中,此可以帮助治疗或预防哮喘。此外,本发明人已经测试和证明以登记号ncimb 42380寄存的细菌在哮喘的小鼠模型中的功效。在某些实施方案中,组合物用于治疗或预防中性粒细胞性哮喘或嗜酸性粒细胞性哮喘的方法中。本发明的组合物展示的对中性粒细胞和嗜酸性粒细胞的作用意味着其可以特别有效地治疗或预防中性粒细胞性哮喘和嗜酸性粒细胞性哮喘。实际上,在某些实施方案中,组合物用于哮喘治疗或预防中降低中性粒细胞性发炎反应的方法中,或组合物用于哮喘治疗或预防中降低嗜酸性粒细胞性发炎反应的方法中。在某些实施方案中,本发明提供了一种包含以登记号ncimb 42380寄存的细菌或其生物型的组合物,其用于治疗哮喘。在尤其优选的实施方案中,本发明提供了一种包含以登记号ncimb 42380寄存的细菌的组合物,其用于治疗哮喘且尤其中性粒细胞性哮喘。以登记号ncimb 42380寄存的细菌在哮喘模型中展示对中性粒细胞具有特别深远的作用,且用此细菌治疗可以特别有效地治疗中性粒细胞性哮喘。
[0013]
在其它优选实施方案中,本发明提供了一种包含以登记号ncimb 42380寄存的细菌或其生物型的组合物,其用于治疗或预防类风湿性关节炎的方法中。本发明人已经确定用以登记号ncimb 42380寄存的细菌治疗可以在类风湿性关节炎的小鼠模型中提供临床益处且可以减少关节肿胀。在优选实施方案中,本发明提供了一种包含以登记号ncimb 42380寄存的细菌或其生物型的组合物,其用于治疗类风湿性关节炎。使用以登记号ncimb 42380寄存的细菌的组合物可以特别有效地治疗类风湿性关节炎。
[0014]
在其它优选实施方案中,本发明提供了一种包含以登记号ncimb 42380寄存的细菌或其生物型的组合物,其用于治疗或预防多发性硬化的方法中。本发明人已经确定用以
登记号ncimb 42380寄存的细菌治疗可以在多发性硬化的小鼠模型中降低发病率和疾病严重程度。在优选实施方案中,本发明提供了一种包含以登记号ncimb 42380寄存的细菌或其生物型的组合物,其用于治疗多发性硬化。使用以登记号ncimb 42380寄存的细菌的组合物可以特别有效地治疗多发性硬化。
[0015]
在其它优选实施方案中,本发明提供了一种包含以登记号ncimb 42380寄存的细菌或其生物型的组合物,其用于治疗或预防例如乳癌、肺癌或肝癌等癌症的方法中。本发明人已经确定用以登记号ncimb 42380寄存的细菌治疗可以在乳癌、肺癌或肝癌的小鼠模型中降低肿瘤生长。在某些实施方案中,组合物用于癌症治疗中减小肿瘤尺寸或预防肿瘤生长的方法中。
[0016]
在其它优选实施方案中,本发明提供了一种包含以登记号ncimb 42380寄存的细菌或其生物型的组合物,其用于治疗或预防例如后葡萄膜炎等葡萄膜炎的方法中。包含以登记号ncimb 42380寄存的细菌或其生物型的组合物可以特别有效地治疗葡萄膜炎。
[0017]
在某些实施方案中,本发明的组合物用于由il-17或th17通路介导的疾病或病状的治疗或预防中减少il-17产生或减少th17细胞分化的方法中。具体来说,本发明的组合物可以用于哮喘、类风湿性关节炎或多发性硬化或者哮喘、类风湿性关节炎、多发性硬化、癌症或葡萄膜炎的治疗或预防中减少il-17产生或减少th17细胞分化。优选地,本发明提供了包含以登记号ncimb 42380寄存的细菌或其生物型的组合物,其用于哮喘、类风湿性关节炎或多发性硬化的治疗或预防中减少il-17产生或减少th17细胞分化。本发明还提供了包含以登记号ncimb 42380寄存的细菌或其生物型的组合物,其用于癌症的治疗或预防中减少il-17产生或减少th17细胞分化。
[0018]
在某些实施方案中,组合物用于具有升高的il-17含量或th17细胞的患者中。以登记号ncimb 42380寄存的细菌展示的对th17发炎反应的作用可能特别有益于此类患者。
[0019]
在本发明的优选实施方案中,组合物中的细菌菌株是以登记号ncimb 42380寄存的细菌。也可使用生物型细菌菌株,例如具有与以登记号ncimb 42380寄存的细菌的16s rrna序列至少95%、96%、97%、98%、99%、99.5%或99.9%一致的16s rrna序列的细菌菌株。优选地,细菌菌株具有与seq id no:1至少95%、96%、97%、98%、99%、99.5%或99.9%一致的16s rrna序列。优选地,用于本发明的细菌菌株具有由seq id no:1表示的16s rrna序列。
[0020]
在某些实施方案中,本发明的组合物用于经口施用。经口施用本发明的菌株可以有效地治疗il-17或th17通路介导的疾病和病状。此外,经口施用便于患者和开业医师且允许传递到肠和/或部分或全部定殖于肠。
[0021]
在某些实施方案中,本发明的组合物包含一种或多种药学上可接受的赋形剂或载剂。
[0022]
在某些实施方案中,本发明的组合物包含已冻干的细菌菌株。冻干是一项制备允许传递细菌的稳定组合物的有效和便利的技术。
[0023]
在某些实施方案中,本发明提供了一种包含如上所述的组合物的食品。
[0024]
在某些实施方案中,本发明提供了一种包含如上所述的组合物的疫苗组合物。
[0025]
另外,本发明提供了一种治疗或预防由il-17或th17通路介导的疾病或病状的方法,其包括施用包含以登记号ncimb 42380寄存的细菌或其生物型的组合物。
17含量或th17细胞的患者中。
[0042]
15.如前述实施方案中任一项所述的组合物,其中所述生物型具有与以登记号ncimb 42380寄存的细菌的16s rrna序列至少95%、96%、97%、98%、99%、99.5%或99.9%一致的16s rrna序列。
[0043]
16.如实施方案1至14中任一项所述的组合物,其中所述生物型具有与seq id no:1至少95%、96%、97%、98%、99%、99.5%或99.9%一致的16s rrna序列。
[0044]
17.如前述实施方案中任一项所述的组合物,其中所述组合物用于经口施用。
[0045]
18.如前述实施方案中任一项所述的组合物,其中所述组合物包含一种或多种药学上可接受的赋形剂或载剂。
[0046]
19.如前述实施方案中任一项所述的组合物,其中所述细菌菌株是冻干的。
[0047]
20.一种食品,其包含如前述实施方案中任一项所述的组合物,其用于前述实施方案中任一项的用途中。
[0048]
21.一种疫苗组合物,其包含如前述实施方案中任一项所述的组合物,其用于前述实施方案中任一项的用途中。
[0049]
22.一种治疗或预防由il-17或th17通路介导的疾病或病状的方法,其包括施用包含以登记号ncimb 42380寄存的细菌或其生物型的组合物。
[0050]
23.一种以登记号ncimb 42380寄存的细菌或其衍生物的细胞。
[0051]
24.一种组合物,其包含如实施方案23所述的细胞。
[0052]
25.如实施方案24所述的组合物,其包含药学上可接受的载剂或赋形剂。
[0053]
26.一种以登记号ncimb 42380寄存的细菌或其衍生物的生物纯培养物。
[0054]
27.一种以登记号ncimb 42380寄存的细菌或其衍生物的细胞,其用于治疗中。
[0055]
28.如实施方案27所述的细胞,其中所述细胞用于实施方案1至14中任一项中定义的方法中。
[0056]
图示简单说明
[0057]
图1:房尘螨诱发的哮喘的小鼠模型-总bal流体细胞计数。
[0058]
图2:房尘螨诱发的哮喘的小鼠模型-balf中总嗜酸性粒细胞计数。
[0059]
图3:房尘螨诱发的哮喘的小鼠模型-balf中嗜酸性粒细胞比例。
[0060]
图4:房尘螨诱发的哮喘的小鼠模型-balf中总巨噬细胞计数。
[0061]
图5:房尘螨诱发的哮喘的小鼠模型-balf中巨噬细胞比例。
[0062]
图6:房尘螨诱发的哮喘的小鼠模型-balf中总中性粒细胞计数。
[0063]
图7:房尘螨诱发的哮喘的小鼠模型-balf中中性粒细胞比例。
[0064]
图8:房尘螨诱发的哮喘的小鼠模型-balf中总淋巴细胞计数。
[0065]
图9:房尘螨诱发的哮喘的小鼠模型-balf中淋巴细胞比例。
[0066]
图10:严重中性粒细胞性哮喘的小鼠模型-总bal流体细胞计数。
[0067]
图11:严重中性粒细胞性哮喘的小鼠模型-balf中总嗜酸性粒细胞计数。
[0068]
图12:严重中性粒细胞性哮喘的小鼠模型-balf中嗜酸性粒细胞比例。
[0069]
图13:严重中性粒细胞性哮喘的小鼠模型-balf中总巨噬细胞计数。
[0070]
图14:严重中性粒细胞性哮喘的小鼠模型-balf中巨噬细胞比例。
[0071]
图15:严重中性粒细胞性哮喘的小鼠模型-balf中总中性粒细胞计数。
[0072]
图16:严重中性粒细胞性哮喘的小鼠模型-balf中中性粒细胞比例。
[0073]
图17:严重中性粒细胞性哮喘的小鼠模型-balf中总淋巴细胞计数。
[0074]
图18:严重中性粒细胞性哮喘的小鼠模型-balf中淋巴细胞比例。图19:类风湿性关节炎的小鼠模型-体重,第-14天到第0天。数据呈现为初始(第-14天)体重的平均值
±
sem百分比。统计显著性:
▲
p《0.05和
▲▲▲▲
p《0.0001,当与媒介物处理组比较时。
[0075]
图20:类风湿性关节炎的小鼠模型-体重,第0天到第42天。数据呈现为初始(第0天)体重的平均值
±
sem百分比。
▲
p《0.05,
◆
p《0.05,
▲▲▲
p《0.001,
····
p《0.0001,当与媒介物处理组比较时。
[0076]
图21:类风湿性关节炎的小鼠模型-临床评分。数据呈现为平均值
±
sem。****p《0.0001,当与媒介物处理组中第21天比较时。
◆
,op《0.05,当既定日与媒介物处理组比较时。
[0077]
图22:类风湿性关节炎的小鼠模型-对ii型胶原蛋白的脾细胞增殖反应。基于3h-tdr并入的每分钟减去培养基背景[cii刺激-培养基背景]计数。所有数据呈现为平均值
±
sem。**p《0.01,与媒介物组相比。
[0078]
图23:类风湿性关节炎的小鼠模型-组织培养上清液中ifnγ的含量。线表示组中位值。
[0079]
图24:类风湿性关节炎的小鼠模型-组织培养上清液中il-17a的含量。线表示组中位值。
[0080]
图25:类风湿性关节炎的小鼠模型-组织培养上清液中il-10的含量。线表示组中位值。
[0081]
图26:类风湿性关节炎的小鼠模型-组织培养上清液中il-6的含量。
[0082]
线表示组中位值。
[0083]
图27:组织病理学评分系统。
[0084]
图28:房尘螨诱发的哮喘的小鼠模型-血清中总ige。
[0085]
图29:房尘螨诱发的哮喘的小鼠模型-血清中hdm特异性igg1。
[0086]
图30:房尘螨诱发的哮喘的小鼠模型-balf中总ige。
[0087]
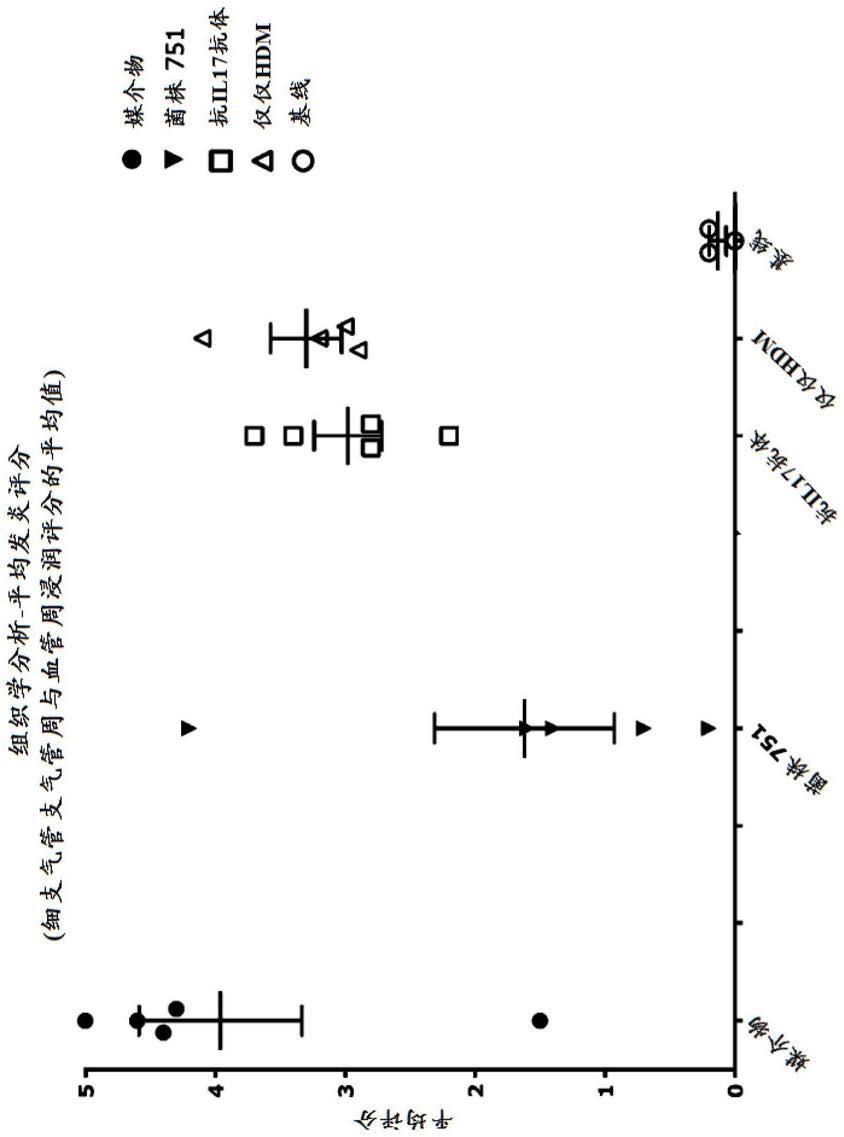
图31:房尘螨诱发的哮喘的小鼠模型-balf中hdm特异性igg1。图32:房尘螨诱发的哮喘的小鼠模型-组织学分析-平均细支气管周浸润评分。
[0088]
图33:房尘螨诱发的哮喘的小鼠模型-组织学分析-平均血管周浸润评分。
[0089]
图34:房尘螨诱发的哮喘的小鼠模型-组织学分析-平均发炎评分(细支气管周与血管周浸润评分的平均值)。
[0090]
图35:房尘螨诱发的哮喘的小鼠模型-组织学分析-粘液评分。
[0091]
图36:房尘螨诱发的哮喘的小鼠模型-肺组织中il-9含量。
[0092]
图37:房尘螨诱发的哮喘的小鼠模型-肺组织中il-1a含量。
[0093]
图38:房尘螨诱发的哮喘的小鼠模型-肺组织中ifng含量。
[0094]
图39:房尘螨诱发的哮喘的小鼠模型-肺组织中il-17a含量。
[0095]
图40:房尘螨诱发的哮喘的小鼠模型-肺组织中il-4含量。
[0096]
图41:房尘螨诱发的哮喘的小鼠模型-肺组织中il-5含量。
[0097]
图42:房尘螨诱发的哮喘的小鼠模型-肺组织中il-1b含量。
[0098]
图43:房尘螨诱发的哮喘的小鼠模型-肺组织中rantes含量。
[0099]
图44:房尘螨诱发的哮喘的小鼠模型-肺组织中mip-1a含量。
[0100]
图45:房尘螨诱发的哮喘的小鼠模型-肺组织中kc含量。
[0101]
图46:房尘螨诱发的哮喘的小鼠模型-肺组织中mip-2含量。
[0102]
图47:严重中性粒细胞性哮喘的小鼠模型-血清中hdm特异性igg1。
[0103]
图48:严重中性粒细胞性哮喘-血清中hdm特异性igg2a。
[0104]
图49:严重中性粒细胞性哮喘-balf中hdm特异性igg1。
[0105]
图50:严重中性粒细胞性哮喘-balf中hdm特异性igg2a。
[0106]
图51:严重中性粒细胞性哮喘的小鼠模型-组织学分析-平均细支气管周浸润评分。
[0107]
图52:严重中性粒细胞性哮喘的小鼠模型-组织学分析-平均血管周浸润评分。
[0108]
图53:严重中性粒细胞性哮喘的小鼠模型-组织学分析-平均发炎评分(细支气管周与血管周浸润评分的平均值)。
[0109]
图54:严重中性粒细胞性哮喘的小鼠模型-肺组织中tnfa含量。
[0110]
图55:严重中性粒细胞性哮喘的小鼠模型-肺组织中il-1a含量。
[0111]
图56:严重中性粒细胞性哮喘的小鼠模型-肺组织中ifng含量。
[0112]
图57:严重中性粒细胞性哮喘的小鼠模型-肺组织中il-17f含量。
[0113]
图58:严重中性粒细胞性哮喘的小鼠模型-肺组织中il-1b含量。
[0114]
图59:严重中性粒细胞性哮喘的小鼠模型-肺组织中rantes含量。
[0115]
图60:严重中性粒细胞性哮喘的小鼠模型-肺组织中mip-2含量。
[0116]
图61:严重中性粒细胞性哮喘的小鼠模型-肺组织中kc含量。
[0117]
图62:严重中性粒细胞性哮喘的小鼠模型-肺组织中il-17a含量。
[0118]
图63:严重中性粒细胞性哮喘的小鼠模型-肺组织中mip-1a含量。
[0119]
图64:严重中性粒细胞性哮喘的小鼠模型-肺组织中il-33含量。
[0120]
图65:类风湿性关节炎的小鼠模型-组织病理学评分的目测模板。代表性影像展示胶原蛋白诱发的关节炎研究中来自小鼠跗关节的综合评分。
[0121]
图66:类风湿性关节炎的小鼠模型-组织病理学:发炎评分。数据呈现为平均值
±
sem。**p《0.01,当与媒介物处理组比较时。
[0122]
图67:类风湿性关节炎的小鼠模型-组织病理学:软骨评分。数据呈现为平均值
±
sem。***p《0.001,当与媒介物处理组比较时。
[0123]
图68:类风湿性关节炎的小鼠模型-组织病理学:骨骼评分。数据呈现为平均值
±
sem。***p《0.001,当与媒介物处理组比较时。
[0124]
图69:类风湿性关节炎的小鼠模型-组织病理学:总评分。数据呈现为平均值
±
sem。*p《0.05,***p《0.001,当与媒介物处理组比较时。
[0125]
图70:类风湿性关节炎的小鼠模型-组织病理学:代表性图。在括号之间指示动物id(#n.n)和四肢(r为右,l为左)。左上影像(媒介物):发炎和纤维化延伸到关节周围的软组织的大范围关节和骨骼破坏。
[0126]
图71:多发性硬化的小鼠模型-临床评分。
[0127]
图72:多发性硬化的小鼠模型-发病率。
[0128]
图73:乳癌的小鼠模型-肿瘤体积。
[0129]
图74:肺癌的小鼠模型-肿瘤体积。
[0130]
图75:肝癌的小鼠模型-肝重。
[0131]
图76:mrx004和短双岐杆菌(b.breve)型菌株与人类细胞的附着。
[0132]
图77:胞外多糖产生分析。
[0133]
图78:mrx004的结合和释放的胞外多糖的产生
[0134]
图79:mrx004与caco-2细胞的附着
[0135]
图80:单独mrx004(a)和与短双歧杆菌型菌株比较(b)的rapid id 32a剖面。白色=阴性反应(无变色),向下交叉阴影=中等阳性反应(弱变色)并且黑色=阳性反应(强烈适当变色)。
[0136]
图81:mrx004的50ch分析。向上交叉阴影=阴性反应(无变色),向下交叉阴影=中等阳性反应(弱变色),黑色=阳性反应(强烈适当变色)并且白色=可疑反应(意外变色)。
[0137]
发明详述
[0138]
细菌菌株
[0139]
本发明的组合物包含以登记号ncimb 42380寄存的细菌或其生物型。所述实施例证明此类细菌可用于治疗或预防由il-17或th17通路介导的疾病和病状。所述实施例也证明此类细菌可用于治疗或预防癌症。优选的细菌菌株是以登记号ncimb 42380寄存的细菌。
[0140]
以登记号ncimb 42380寄存的细菌在所述实施例中进行测试且在本文中又称为菌株751或mrx004。测试的751菌株的部分16s rrna序列在seq id no:1中提供。菌株751由gt biologics有限公司(life sciences innovation building,aberdeen,ab25 2zs,scotland)在2015年3月12日寄存在国际寄存局ncimb有限公司(ferguson building,aberdeen,ab21 9ya,scotland)并分配登记号ncimb 42380。gt biologics有限公司随后将其名称改为4d pharma research有限公司。
[0141]
菌株751的基因组序列提供于seq id no:2中。
[0142]
还预期作为以登记号ncimb 42380寄存的细菌的生物型的细菌菌株有效治疗或预防由il-17或th17通路介导的疾病和病状。还预期作为以登记号ncimb 42380寄存的细菌的生物型的细菌菌株有效治疗或预防癌症。生物型是具有相同或极类似的生理和生物化学特性的密切相关菌株。
[0143]
在某些实施方案中,用于本发明的细菌菌株具有与以登记号ncimb 42380寄存的细菌的16s rrna序列至少95%、96%、97%、98%、99%、99.5%或99.9%一致的16s rrna序列。优选地,用于本发明的细菌菌株具有与seq id no:1至少95%、96%、97%、98%、99%、99.5%或99.9%一致的16s rrna序列。优选地,用于本发明的细菌菌株具有由seq id no:1表示的16s rrna序列。
[0144]
或者,作为以登记号ncimb 42380寄存的细菌的生物型且适合用于本发明中的菌株可以通过对以登记号ncimb 42380寄存的细菌的其它核苷酸序列进行测序来鉴别。举例来说,基本上全基因组可以测序,且用于本发明的生物型菌株可以在其全基因组的至少80%上(例如在至少85%、90%、95%或99%上或在其全基因组上)具有至少95%、96%、97%、98%、99%、99.5%或99.9%序列一致性。用于鉴别生物型菌株的其它适合序列可以
包括hsp60或重复序列,例如box、eric、(gtg)5或rep或[16]。生物型菌株可以具有与以登记号ncimb 42380寄存的细菌的对应序列至少95%、96%、97%、98%、99%、99.5%或99.9%序列一致的序列。
[0145]
在某些实施方案中,用于本发明的细菌菌株具有与seq id no:2序列一致的基因组。在优选实施方案中,用于本发明的细菌菌株具有在seq id no:2的至少60%(例如至少65%、70%、75%、80%、85%、95%、96%、97%、98%、99%或100%)上与seq id no:2至少90%序列一致(例如至少92%、94%、95%、96%、97%、98%、99%或100%序列一致)的基因组。举例来说,用于本发明的细菌菌株可以具有在seq id no:2 70%上与seq id no:2至少90%序列一致,或在seq id no:2 80%上与seq id no:2至少90%序列一致,或在seq id no:290%上与seq id no:2至少90%序列一致,或在seq id no:2 100%上与seq id no:2至少90%序列一致,或在seq id no:2 70%上与seq id no:2至少95%序列一致,或在seq id no:2 80%上与seq id no:2至少95%序列一致,或在seq id no:2 90%上与seq id no:2至少95%序列一致,或在seq id no:2 100%上与seq id no:2至少95%序列一致,或在seq id no:2 70%上与seq id no:2至少98%序列一致,或在seq id no:2 80%上与seq id no:2至少98%序列一致,或在seq id no:2 90%上与seq id no:2至少98%序列一致,或在seq id no:2 100%上与seq id no:2至少98%序列一致的基因组。
[0146]
或者,作为以登记号ncimb 42380寄存的细菌的生物型且适用于本发明中的菌株可以通过使用登记号ncimb 42380寄存物和限制片段分析和/或pcr分析,例如通过使用荧光增强的片段长度多态现象(fluorescent amplified fragment length polymorphism,faflp)和重复dna组件(rep)-pcr指纹或蛋白质剖析或部分16s或23s rdna测序来鉴别。在优选实施方案中,此类技术可以用于与以登记号ncimb 42380寄存的细菌相同物种的菌株。
[0147]
在某些实施方案中,作为以登记号ncimb 42380寄存的细菌的生物型且适用于本发明中的菌株是当通过增强的核蛋白体dna限制分析(amplified ribosomal dna restriction analysis,ardra)分析时,例如当使用sau3ai限制酶(关于示例性方法和指导参见例如[17])时提供与以登记号ncimb 42380寄存的细菌相同模式的菌株。或者,生物型菌株被确定是具有与以登记号ncimb 42380寄存的细菌相同的碳水化合物发酵模式的菌株。
[0148]
作为以登记号ncimb 42380寄存的细菌的生物型且适用于本发明的组合物和方法的细菌菌株可以使用任何适当方法或策略,包括实施例中描述的分析鉴别。举例来说,用于本发明中的生物型可以通过在厌氧ycfa中培养和/或将细菌施用到ii型胶原蛋白诱发的关节炎小鼠模型并接着评估细胞因子含量来鉴别。具体来说,具有与以登记号ncimb 42380寄存的细菌类似的生长模式、代谢类型和/或表面抗原的细菌菌株可用于本发明。生物型菌株将具有与ncimb 42380菌株可比的免疫调节活性。具体来说,生物型菌株将对哮喘、关节炎、多发性硬化和癌症疾病模型引起与实施例中所示的作用可比的作用,并且对细胞因子含量引起与实施例中所示的作用可比的作用,其可以通过使用实施例中描述的培养和施用方案来鉴别。
[0149]
本发明的一种尤其优选的菌株是以登记号ncimb 42380寄存的细菌。它是实施例中测试的示例性751菌株并且展示有效治疗疾病。因此,本发明提供以登记号ncimb 42380寄存的细菌或其衍生物的细胞,例如分离细胞。本发明还提供了一种组合物,其包含以登记
号ncimb 42380寄存的细菌或其衍生物的细胞。本发明还提供了一种以登记号ncimb 42380寄存的细菌的生物纯培养物。本发明还提供了以登记号ncimb 42380寄存的细菌或其衍生物的细胞,其用于治疗中,尤其用于本文中描述的疾病。
[0150]
以登记号ncimb 42380寄存的细菌的衍生物可以是子代菌株(子代)或从原始培养(亚克隆)的菌株。本发明菌株的衍生物可以例如在基因层面下修饰,而不消除生物活性。具体来说,本发明的衍生菌株是治疗活性的。衍生菌株将具有与ncimb 42380菌株可比的免疫调节活性。具体来说,衍生物菌株将对哮喘、关节炎、多发性硬化和癌症疾病模型引起与实施例中所示的作用可比的作用,并且对细胞因子含量引起与实施例中所示的作用可比的作用,其可以通过使用实施例中描述的培养和施用方案来鉴别。ncimb 42380菌株的衍生物一般将是ncimb 42380菌株的生物型。
[0151]
对以登记号ncimb 42380寄存的细菌的细胞的提及涵盖具有与以登记号ncimb 42380寄存的菌株相同的安全性和治疗功效特性的任何细胞,并且本发明涵盖此类细胞。
[0152]
在优选实施方案中,本发明组合物中的细菌菌株是活的且能够部分或全部定殖于肠。
[0153]
在某些实施方案中,用于本发明的细菌菌株具有低的与人类肠上皮细胞、尤其caco-2细胞的附着。在一优选实施方案中,与双歧杆菌、尤其短双歧杆菌相比,用于本发明的细菌菌株在ycfa中具有低的与人类肠上皮细胞、尤其caco-2细胞的附着。在某些实施方案中,当在实施例12中描述的条件下测试时,用于本发明的细菌菌株展现小于总培养1%,例如优选小于0.5%或小于0.3%的附着。
[0154]
在某些实施方案中,用于本发明的细菌菌株产生胞外多糖,例如其中胞外多糖结合于细菌菌株的细胞外表面。在某些实施方案中,结合的胞外多糖的产生增加用于本发明的细菌菌株附着到粘液或例如人类肠上皮细胞等上皮细胞表面。在一优选实施方案中,与双歧杆菌、尤其短双歧杆菌相比,用于本发明的细菌菌株产生更多的结合的表面胞外多糖。
[0155]
在一优选实施方案中,与双歧杆菌、尤其短双歧杆菌相比,用于本发明的细菌菌株在ycfa中具有低的与人类肠上皮细胞、尤其caco-2细胞的附着(例如当在实施例12中描述的条件下测试时附着小于总培养的1%,例如优选小于0.5%或小于0.3%),并且与双歧杆菌、尤其短双歧杆菌相比,产生更多的结合的表面胞外多糖。
[0156]
在某些优选实施方案中,用于本发明的细菌菌株例如在适当悬浮培养基(例如api悬浮培养基)中在37℃下培养4小时时能使多糖棉子糖发酵。
[0157]
在某些实施方案中,与双歧杆菌、尤其短双歧杆菌相比,用于本发明的细菌菌株例如在适当悬浮培养基(例如api悬浮培养基)中在37℃下培养4小时时,使α-葡糖苷酶和/或β-葡糖苷酶发酵的能力降低。
[0158]
在某些实施方案中,用于本发明的细菌菌株包含表1中列出的一个或多个基因,例如表1中的5个、10个、20个、50个或所有基因。在某些实施方案中,用于本发明的细菌菌株包含表1中列出的用单下划线突出的一个或多个基因,例如预测ecf转运蛋白的供能模块的横跨膜组件bl0694和/或预测ecf转运蛋白的供能模块的复制atp酶组件bl0693。在某些实施方案中,用于本发明的细菌菌株包含表1中列出的用双下划线和粗体突出的一个或多个基因,例如选自以下的1个、2个、3个、4个或5个基因:麦芽糖糊精葡糖苷酶(ec 3.2.1.20)、假定半乳糖苷酶、纤维素合酶(形成udp)(ec 2.4.1.12)、壳多糖酶(ec3.2.1.14)及感觉盒/
ggdef家族蛋白。在某些实施方案中,用于本发明的细菌菌株包含表1中列出的用斜体突出的一个或多个基因,例如选自以下的1个、2个、3个、4个、5个、6个、7个、8个或9个基因:ω-3多不饱和脂肪酸合酶亚单位pfaa、i型聚酮化合物合酶、未知功能的假定糖基水解酶(duf1680)、生物素ecf转运蛋白的供能模块的atp酶组件biom、转运阳离子的atp酶e1-e2家族、核糖abc转运系统透性酶蛋白rbsc(tc 3.a.1.2.1)、核糖abc转运系统atp结合蛋白rbsa(tc 3.a.1.2.1)、3'到5'寡核糖核酸酶(orn)、与放线杆菌属蛋白有关的膜蛋白(1944168)。
[0159]
在优选实施方案中,用于本发明的细菌菌株包含选自以下的一个或多个(例如5个、10个、15个、20个、25个、30个、40个、45个、50个或所有)基因:2-丁二酰基-5-烯醇丙酮酰基-6-羟基-3-环己烯-1-甲酸合酶(ec 2.2.1.9);3'到5'寡核糖核酸酶(orn);α-半乳糖苷酶(ec 3.2.1.22);ecf转运蛋白的通用供能模块的atp酶组件;q核苷调节的ecf转运蛋白的供能模块的atp酶组件sty3233;atp依赖性dna解旋酶recg(ec 3.6.1.-);β-葡糖苷酶(ec 3.2.1.21);纤维素合酶(形成udp)(ec 2.4.1.12);壳多糖酶(ec 3.2.1.14);cog1309:转录调节因子;d-丙氨酰基-d-丙氨酸羧肽酶(ec 3.4.16.4);预测ecf转运蛋白的供能模块的复制atp酶组件bl0693;果糖激酶(ec 2.7.1.4);葡萄糖/甘露糖:h+共输送体glcp;糖基转移酶(ec 2.4.1.-);gmp合酶[水解谷氨酰胺](ec 6.3.5.2);与激酶的靛蓝素合酶inda、pfkb家族群集的假设糖激酶;倾向次黄嘌呤核苷-尿嘧啶核苷的核苷水解酶(ec 3.2.2.1);与锌无关的处于lsu核糖体蛋白l31p的lsu核糖体蛋白l31p;与锌无关的处于lsu核糖体蛋白l33p的lsu核糖体蛋白l33p;麦芽糖糊精葡糖苷酶(ec 3.2.1.20);与放线杆菌属蛋白有关的膜蛋白(1944168);膜结合的溶解胞壁质转糖基酶d前体(ec 3.2.1.-);甲基转移酶(ec 2.1.1.-);nadh依赖性丁醇脱氢酶a(ec 1.1.1.-);磷酸乙醇酸磷酸酶(ec 3.1.3.18);磷酸核糖基氨基苯甲酸异构酶(ec 5.3.1.24);未知功能的假定糖基水解酶(duf1680);含有鼠李糖的多糖易位透性酶;核糖激酶(ec 2.7.1.15);核糖abc转运系统,atp结合蛋白rbsa(tc 3.a.1.2.1);核糖abc转运系统,atp结合蛋白rbsa(tc 3.a.1.2.1);核糖abc转运系统,高亲和力透性酶rbsd(tc 3.a.1.2.1);核糖abc转运系统,周质核糖结合蛋白rbsb(tc 3.a.1.2.1);核糖abc转运系统,透性酶蛋白rbsc(tc 3.a.1.2.1);核糖abc转运系统,透性酶蛋白rbsc(tc 3.a.1.2.1);山梨醇脱氢酶(ec 1.1.1.14);与锌无关的处于ssu核糖体蛋白s14p(s29e)的ssu核糖体蛋白s14p(s29e);q核苷调节的ecf转运蛋白的底物特异性组件sty3230;蔗糖-6-磷酸水解酶(ec 3.2.1.b3);磷壁酸质输出atp结合蛋白tagh(ec 3.6.3.40);预测ecf转运蛋白的供能模块的横跨膜组件bl0694;q核苷调节的ecf转运蛋白的供能模块的横跨膜组件sty3231;与hrtab转运蛋白共同定位的双组件反应调节因子;i型限制修饰系统,dna甲基转移酶亚单位m(ec 2.1.1.72);i型限制修饰系统,限制亚单位r(ec 3.1.21.3);i型限制修饰系统,特异性亚单位s(ec 3.1.21.3);i型限制修饰系统,特异性亚单位s(ec 3.1.21.3);i型限制修饰系统,特异性亚单位s(ec 3.1.21.3);木糖醇脱氢酶(ec 1.1.1.9);以及木糖abc转运蛋白,周质木糖结合蛋白xylf。在优选实施方案中,用于本发明的细菌菌株包含前面句子中列出并且未在表1中突出的一个或多个(例如5个、10个、15个、20个、25个、30个、35个或所有)基因。
[0160]
治疗用途
[0161]
如实施例中证明,本发明的细菌组合物有效减少th17发炎反应。具体来说,用本发明的组合物治疗实现il-17a含量和其它th17通路细胞因子减少,和由il-17和th17通路介
导的病状的动物模型中的临床改善。因此,本发明的组合物可用于治疗或预防发炎性和自身免疫性疾病和尤其由il-17介导的疾病或病状。具体来说,本发明的组合物可用于减少或预防il-17发炎反应升高。
[0162]
th17细胞是产生例如il-17a、il17-f、il-21和il-22的t辅助细胞子集。th17细胞分化和il-17表达可能由il-23驱动。这些细胞因子和其它因子形成th17通路的重要部分,th17通路是公认的发炎信号传导通路,其促进且引起大量的发炎性和自身免疫性疾病(如例如[18-23]中所述)。th17通路活化的疾病是th17通路介导的疾病。th17通路介导的疾病可以通过抑制th17通路改善或减轻,th17通路可以通过减少th17细胞分化或降低其活性或减少th17通路细胞因子的含量来抑制。由th17通路介导的疾病可以通过th17细胞产生的细胞因子,例如il-17a、il-17f、il-21、il-22、il-26、il-9的含量增加表征([24]中评述)。由th17通路介导的疾病可以通过th-17相关基因,例如stat3或il-23r的表现增加表征。由th17通路介导的疾病可以与增加的th17细胞含量相关。
[0163]
il-17是一种促发炎细胞因子,其促进若干发炎性和自身免疫性疾病和病状的发病机理。如本文所用,il-17可以指il-17家族的任何成员,包括il-17a、il-17b、il-17c、il-17d、il-17e和il-17f。il-17介导的疾病和病状特征在于罹患所述疾病或病状的组织中il-17的高表达和/或il-17阳性细胞的累积或存在。类似地,il-17介导的疾病和病状是因高il-17含量或il-17含量增加而加重且因低il-17含量或il-17含量减少而减轻的疾病和病状。il-17发炎反应可以是局部或全身性的。
[0164]
可能由il-17或th17通路介导的疾病和病状的实例包括多发性硬化;关节炎,例如类风湿性关节炎、骨关节炎、牛皮癣性关节炎或幼年特发性关节炎;视神经脊髓炎(德维克氏病);强直性脊椎炎;脊椎关节炎;牛皮癣;全身性红斑狼疮;发炎性肠病,例如克罗恩氏病或溃疡性结肠炎;乳糜泻;哮喘,例如过敏性哮喘或中性粒细胞性哮喘;慢性阻塞性肺病(copd);癌症,例如乳癌、结肠癌、肺癌或卵巢癌;葡萄膜炎;巩膜炎;血管炎;白塞氏病;动脉粥样硬化;异位性皮炎;肺气肿;牙周炎;过敏性鼻炎;以及同种异体移植排斥。在优选实施方案中,本发明的组合物用于治疗或预防这些病状或疾病中的一种或多种。在其它优选实施方案中,病状或疾病由il-17或th17通路介导。
[0165]
在某些实施方案中,本发明的组合物用于由il-17或th17通路介导的疾病或病状的治疗或预防中减少il-17产生或减少th17细胞分化的方法中。在某些实施方案中,本发明的组合物用于治疗或预防发炎性或自身免疫性疾病,其中所述治疗或预防通过减少th17发炎反应或预防其升高来实现。在某些实施方案中,本发明的组合物用于治疗患有发炎性或自身免疫性疾病的患者中,其中所述患者具有升高的il-17含量或升高的th17细胞或展现th17发炎反应。在某些实施方案中,患者可以经诊断患有慢性发炎性或自身免疫性疾病或病状,或本发明的组合物可以用于预防发展成为慢性发炎性或自身免疫性疾病或病状的发炎性或自身免疫性疾病或病状。在某些实施方案中,疾病或病状可能对用tnf-α抑制剂治疗不起反应。本发明的这些用途可以应用于前段中列出的任何特定疾病或病状。
[0166]
il-17和th17通路常常与慢性发炎性和自身免疫性疾病相关,因此本发明的组合物可能特别适用于治疗或预防如上列出的慢性疾病或病状。在某些实施方案中,组合物用于患有慢性疾病的患者中。在某些实施方案中,组合物用于预防慢性疾病发展。
[0167]
本发明的组合物可用于治疗由il-17或th17通路介导的疾病和病状且对付th17发
炎反应,因此本发明的组合物可能特别适用于治疗或预防慢性疾病、治疗或预防患者的对其它疗法(例如用tnf-α抑制剂治疗)起反应的疾病,和/或治疗或预防与il-17和th17细胞相关的组织损伤和症状。举例来说,已知il-17活化软骨和骨组织中基质破坏并且il-17对软骨细胞和成骨细胞中基质产生具有抑制作用,因此本发明的组合物可用于治疗或预防骨质侵蚀或软骨破坏。
[0168]
在某些实施方案中,用本发明的组合物治疗减少il-17含量、尤其il-17a含量或预防其升高。在某些实施方案中,用本发明的组合物治疗减少ifn-γ、il-1β、rantes、mip-1α、il-8或il-6含量或预防其升高。这些细胞因子的含量的此类减少或预防含量升高可用于治疗或预防发炎性和自身免疫性疾病和病状,尤其由il-17或th17通路介导的疾病和病状。
[0169]
在某些实施方案中,用本发明的组合物治疗阻断病原性细胞、例如大肠杆菌和/或肠炎沙门菌附着或侵入人类细胞,例如人类上皮细胞。
[0170]
在某些实施方案中,用本发明的组合物治疗减少或预防病原性细胞、例如大肠杆菌和/或肠炎沙门菌结合于人类上皮细胞,例如人类肠上皮细胞。
[0171]
在某些实施方案中,本发明组合物的细菌菌株的胞外多糖的产生和释放可以具有防御病原性物种,例如大肠杆菌和/或肠炎沙门菌的作用。在某些实施方案中,本发明组合物的细菌菌株的胞外多糖的产生和释放可以介导细菌对il-17或th17通路的作用并且可以影响宿主免疫反应。在某些实施方案中,本发明的组合物用于产生胞外多糖,治疗发炎性和自身免疫性疾病,以及尤其il-17介导的疾病或病状。
[0172]
在某些实施方案中,本发明组合物的细菌菌株的低的与人类肠上皮细胞、尤其caco-2细胞的附着可以增加本发明的组合物对il-17或th17通路以及由il-17或th17通路介导的疾病的有益作用。
[0173]
在某些实施方案中,用本发明的组合物治疗增加肠中棉子糖的发酵。实施例证明本发明组合物的细菌菌株使多糖棉子糖发酵,并且棉子糖发酵可以赋予对宿主的作用,例如增加的盲肠丁酸盐和增加的胃肠增殖。在某些实施方案中,本发明的组合物用于增加肠中棉子糖的发酵,治疗发炎性和自身免疫性疾病,以及尤其由il-17介导的疾病或病状。
[0174]
哮喘
[0175]
在优选实施方案中,本发明的组合物用于治疗或预防哮喘。实施例证明本发明的组合物减少敏化和用房尘螨提取物激发后中性粒细胞和/或嗜酸性粒细胞募集到气道中,因此其可用于治疗或预防哮喘。哮喘是一种特征为气道发炎和限制的慢性疾病。哮喘发炎可以由il-17和/或th17细胞介导,因此本发明的组合物可以特别有效预防或治疗哮喘。哮喘发炎可以由嗜酸性粒细胞和/或中性粒细胞介导。
[0176]
在某些实施方案中,哮喘是嗜酸性粒细胞或过敏性哮喘。嗜酸性粒细胞和过敏性哮喘的特征是外周血和气道分泌物中嗜酸性粒细胞数目增加且病理学上与基底膜区域变厚和药理学上与皮质类固醇反应相关[25]。减少或抑制嗜酸性粒细胞募集或活化的组合物可用于治疗或预防嗜酸性粒细胞和过敏性哮喘。
[0177]
在其它实施方案中,本发明的组合物用于治疗或预防中性粒细胞性哮喘(或非嗜酸性粒细胞性哮喘)。高中性粒细胞数目与可能对皮质类固醇治疗不敏感的严重哮喘有关。减少或抑制中性粒细胞募集或活化的组合物可用于治疗或预防中性粒细胞性哮喘。
[0178]
嗜酸性粒细胞和中性粒细胞性哮喘并非互斥病状且一般帮助对付任一嗜酸性粒
细胞和中性粒细胞反应的治疗可用于治疗哮喘。
[0179]
增加的il-17含量和th17通路活化与严重哮喘有关,因此本发明的组合物可用于预防严重哮喘的发展或用于治疗严重哮喘。
[0180]
在某些实施方案中,本发明的组合物用于在哮喘治疗或预防中降低嗜酸性粒细胞发炎反应的方法中,或用于在哮喘治疗或预防中降低中性粒细胞性发炎反应的方法中。如上所指出,哮喘中高含量嗜酸性粒细胞在病理学上与基底膜区域变厚相关,因此在哮喘治疗或预防中减少嗜酸性粒细胞发炎反应也许能特别地对付所述疾病的此特征。此外,与升高的嗜酸性粒细胞组合或其不存在的升高的嗜中性粒细胞与严重哮喘和慢性气道变窄有关。因此,减少中性粒细胞性发炎反应可能特别适用于对付严重哮喘。
[0181]
在某些实施方案中,组合物减少过敏性哮喘中细支气管周浸透,或用于在过敏性哮喘的治疗中减少细支气管周浸透。在某些实施方案中,组合物减少中性粒细胞性哮喘中细支气管周和/或血管周浸透,或用于在过敏性中性粒细胞性哮喘的治疗中减少细支气管周和/或血管周浸透。
[0182]
在某些实施方案中,用本发明的组合物治疗减少il-1β、ifnγ、rantes、mip-1α或il-8含量或预防其升高。
[0183]
在某些实施方案中,本发明的组合物用于减少嗜酸性粒细胞和/或中性粒细胞性发炎反应的哮喘治疗方法中。在某些实施方案中,待治疗的患者已经或先前已经被鉴别为具有升高的嗜中性粒细胞或嗜酸性粒细胞含量,例如如通过采血或唾液分析来鉴别。
[0184]
本发明的组合物在施用于新生儿或孕妇时可用于预防新生儿中哮喘发展。组合物可用于预防儿童中哮喘发展。本发明的组合物可用于治疗或预防成年发作型哮喘。本发明的组合物可用于管理或减轻哮喘。本发明的组合物可能特别适用于减少与由例如房尘螨等过敏原加重的哮喘相关的症状。
[0185]
治疗或预防哮喘可以指例如减轻症状严重程度或减小对患者而言成问题的恶化频率或触发范围。
[0186]
在某些实施方案中,用本发明的组合物治疗减少例如肠中或血浆中苯丙氨酸和/或组氨酸的浓度。实施例证明本发明组合物的细菌菌株测得对包括苯丙氨酸和组氨酸在内的氨基酸的发酵呈阳性,并且已经报告苯丙氨酸和组氨酸增加的血浆浓度与哮喘中的副作用有关。在某些实施方案中,本发明的组合物用于降低苯丙氨酸和/或组氨酸的血浆浓度,治疗哮喘和尤其治疗与哮喘有关的组胺产生或气道过度反应。
[0187]
在某些实施方案中,用本发明的组合物治疗减少例如肠中半乳糖和/或果糖的浓度。实施例证明本发明组合物的细菌菌株使包括半乳糖和果糖在内的碳水化合物底物发酵,并且来源于肉来源的半乳糖α-1,3-半乳糖是过敏反应已知的过敏原和病原体,并且膳食果糖的摄入水平与增加的哮喘严重程度相关。在某些实施方案中,本发明的组合物用于降低半乳糖和/或果糖的浓度,治疗哮喘和尤其治疗严重哮喘。
[0188]
关节炎
[0189]
在优选实施方案中,本发明的组合物用于治疗或预防类风湿性关节炎(rheumatoid arthritis,ra)。实施例证明本发明的组合物减少小鼠模型中ra临床征象,减少软骨和骨骼破坏,并且减少il-17发炎反应,因此其可用于治疗或预防ra。ra是一种主要影响关节的全身性发炎病症。ra与引起关节肿胀、滑液增生和软骨和骨骼破坏的发炎反应
有关。il-17和th17在ra中可能具有关键作用,例如因为il-17抑制软骨细胞和成骨细胞中基质产生,并且活化基质金属蛋白酶的产生和功能,且因为ra疾病活动与il-17含量和th-17细胞数相关[26,27],因此本发明的组合物可特别有效预防或治疗ra。
[0190]
在某些实施方案中,本发明的组合物用于在ra治疗或预防中降低il-17含量或预防il-17含量升高。在某些实施方案中,用本发明的组合物治疗减少il-17含量、尤其il-17a含量或预防其升高。在某些实施方案中,用本发明的组合物治疗减少ifn-γ或il-6含量或预防其升高。
[0191]
在某些实施方案中,用本发明的组合物治疗减少关节肿胀。在某些实施方案中,本发明的组合物用于关节肿胀的患者或经鉴别处于关节肿胀风险中的患者中。在某些实施方案中,本发明的组合物用于减少ra中关节肿胀的方法中。
[0192]
在某些实施方案中,用本发明的组合物治疗减少软骨破坏或骨骼破坏。在某些实施方案中,本发明的组合物用于在ra治疗中减少或预防软骨或骨骼破坏。在某些实施方案中,组合物用于治疗患有严重ra的处于软骨或骨骼破坏风险中的患者。
[0193]
增加的il-17含量和th17细胞数与ra中软骨和骨组织破坏有关[26,27]。已知il-17活化软骨和骨组织中基质破坏并且il-17对软骨细胞和成骨细胞中基质产生具有抑制作用。因此,在某些实施方案中,本发明的组合物用于在ra治疗中预防骨质侵蚀或软骨破坏。在某些实施方案中,组合物用于治疗展现骨质侵蚀或软骨破坏的患者或经鉴别处于骨质侵蚀或软骨破坏风险中的患者。
[0194]
tnf-α也与ra相关,但tnf-α不参与所述疾病后期的发病机理。相比之下,il-17在整个慢性疾病阶段具有作用[28]。因此,在某些实施方案中,本发明的组合物用于治疗慢性ra或晚期ra,例如包括关节破坏和软骨丧失的疾病。在某些实施方案中,本发明的组合物用于治疗先前已接受抗tnf-α疗法的患者。在某些实施方案中,尚未治疗的患者不或不再对抗tnf-α疗法起反应。
[0195]
本发明的组合物可用于调节患者的免疫系统,因此,在某些实施方案中,本发明的组合物用于预防已经被鉴别为处于ra风险中或已经被诊断患有早期ra的患者的ra。本发明的组合物可用于预防ra发展。
[0196]
本发明的组合物可用于管理或减轻ra。本发明的组合物可能特别适用于减少与关节肿胀或骨组织破坏相关的症状。治疗或预防ra可指例如减轻症状严重程度或减小对患者而言成问题的恶化频率或触发范围。
[0197]
多发性硬化
[0198]
在优选实施方案中,本发明的组合物用于治疗或预防多发性硬化。实施例证明本发明的组合物减少多发性硬化小鼠模型(eae模型)的发病率和疾病严重程度,因此其可用于治疗或预防多发性硬化。多发性硬化是一种与特别脑和脊柱中神经元髓鞘破坏相关的发炎病症。多发性硬化是一种慢性疾病,其逐步丧失活动能力且连串进展。il-17和th17细胞在多发性硬化中可能具有关键作用,例如因为il-17含量可能与多发性硬化病变相关,il-17会破坏血脑屏障内皮细胞紧密接头,且th17细胞会迁移到中枢神经系统中并引起神经元丧失[29,30]。因此,本发明的组合物可以特别有效预防或治疗多发性硬化。
[0199]
在某些实施方案中,用本发明的组合物治疗降低发病率或疾病严重程度。在某些实施方案中,本发明的组合物用于降低发病率或疾病严重程度。在某些实施方案中,用本发
明的组合物治疗预防运动功能衰退或改善运动功能。在某些实施方案中,本发明的组合物用于预防运动功能衰退或用于改善运动功能。在某些实施方案中,用本发明的组合物治疗预防出现瘫痪。在某些实施方案中,本发明的组合物在多发性硬化治疗中用于预防瘫痪。
[0200]
本发明的组合物可用于调节患者的免疫系统,因此,在某些实施方案中,本发明的组合物用于预防已经被鉴别为处于多发性硬化风险中或已经被诊断患有早期多发性硬化或“复发缓解型”多发性硬化的患者的多发性硬化。本发明的组合物可用于预防出现硬化症。实际上,实施例展示施用本发明的组合物预防许多小鼠中出现疾病。
[0201]
本发明的组合物可用于管理或减轻多发性硬化。本发明的组合物可能特别适用于减少与多发性硬化相关的症状。治疗或预防多发性硬化可以指例如减轻症状严重程度或减小对患者而言成问题的恶化频率或触发范围。
[0202]
葡萄膜炎
[0203]
在优选实施方案中,本发明的组合物用于治疗或预防葡萄膜炎。本发明的组合物可以降低葡萄膜炎的动物模型的发病率和疾病严重程度,因此其可用于治疗或预防葡萄膜炎。葡萄膜炎是葡萄膜发炎且会引起视网膜组织破坏。其可以呈不同解剖形式(前部、中间、后部或扩散)存在且由不同但相关的病因引起,包括全身性自身免疫性病状。il-17和th17通路主要与葡萄膜炎相关,因此本发明的组合物可以特别有效预防或治疗葡萄膜炎。参考文献[31-38]描述葡萄膜炎患者中升高血清含量的介白素-17a,il17a遗传变异体与全葡萄膜炎特定相关,th17相关的细胞因子在实验自身免疫性葡萄膜炎的发病机理中的作用,在单相实验自身免疫性葡萄膜炎期间th17细胞与调节t细胞之间的不平衡,葡萄膜炎和活动性亚当=白塞和沃格特-小柳-原田(vogt-koyanagi-harada,vkh)疾病患者中il-17a上调,用苏金单抗(secukinumab)(抗il-17a抗体)治疗非感染性葡萄膜炎,和葡萄膜炎眼睛中的th17。
[0204]
在某些实施方案中,葡萄膜炎是后葡萄膜炎。后葡萄膜炎主要存在视网膜和脉络膜发炎,并且本发明的组合物可以有效减少视网膜发炎和破坏。
[0205]
在某些实施方案中,用本发明的组合物治疗减少视网膜损伤。在某些实施方案中,本发明的组合物在葡萄膜炎治疗中用于减少或预防视网膜损伤。在某些实施方案中,组合物用于治疗处于视网膜损伤风险中的严重葡萄膜炎患者。在某些实施方案中,用本发明的组合物治疗减少视神经盘发炎。在某些实施方案中,本发明的组合物用于治疗减少或预防视神经盘发炎。在某些实施方案中,用本发明的组合物治疗减少发炎细胞浸透视网膜组织。在某些实施方案中,本发明的组合物用于减少发炎细胞浸透视网膜组织。在某些实施方案中,用本发明的组合物治疗维持或改善视力。在某些实施方案中,本发明的组合物用于维持或改善视力。
[0206]
在某些实施方案中,组合物用于治疗或预防与非感染性或自身免疫性疾病,例如白塞氏病、克罗恩氏病、富克斯异色性虹膜睫状体炎(fuchs heterochromic iridocyclitis)、肉芽肿病伴多血管炎、hla-b27相关葡萄膜炎、幼年特发性关节炎、结节病、脊椎关节炎、交感性眼炎、小管间质性肾炎和葡萄膜炎症候群或沃格特-小柳-原田症候群相关的葡萄膜炎。il-17a已经显示与例如白塞氏病和沃格特-小柳-原田疾病相关。
[0207]
葡萄膜炎的治疗或预防可以指例如减轻症状严重程度或预防复发。
[0208]
治疗癌症
[0209]
在优选实施方案中,本发明的组合物用于治疗或预防癌症。所述实施例证明施用本发明的组合物可以减少多种肿瘤模型中的肿瘤生长。
[0210]
在某些实施方案中,用本发明的组合物治疗减小肿瘤尺寸或减少肿瘤生长。在某些实施方案中,本发明的组合物用于减小肿瘤尺寸或减少肿瘤生长。所述实施例证明本发明的组合物可以有效减小肿瘤尺寸或生长。在某些实施方案中,本发明的组合物用于具有实体肿瘤的患者中。在某些实施方案中,本发明的组合物在癌症治疗中用于减少或预防血管生成。il-17和th17细胞在血管生成中具有重要作用。在某些实施方案中,本发明的组合物用于预防转移。
[0211]
在优选实施方案中,本发明的组合物用于治疗或预防乳癌。所述实施例证明本发明的组合物可以有效治疗乳癌。在某些实施方案中,本发明的组合物用于在乳癌治疗中减小肿瘤尺寸,减少肿瘤生长,或减少血管生成。在优选实施方案中,癌症是乳癌。在优选实施方案中,癌症是iv期乳癌。
[0212]
在某些实施方案中,本发明的组合物用于治疗或预防肺癌。所述实施例证明本发明的组合物可以有效治疗肺癌。在某些实施方案中,本发明的组合物用于在肺癌治疗中减小肿瘤尺寸,减少肿瘤生长,或减少血管生成。在优选实施方案中,癌症是肺癌。
[0213]
在某些实施方案中,本发明的组合物用于治疗或预防肝癌。所述实施例证明本发明的组合物可以有效治疗肝癌。在某些实施方案中,本发明的组合物用于在肝癌治疗中减小肿瘤尺寸,减少肿瘤生长,或减少血管生成。在优选实施方案中,癌症是肝癌(肝细胞癌)。
[0214]
在某些实施方案中,本发明的组合物用于治疗或预防癌瘤。所述实施例证明本发明的组合物可以有效治疗许多类型癌瘤。在某些实施方案中,本发明的组合物用于治疗或预防非免疫原性癌。所述实施例证明本发明的组合物可以有效治疗非免疫原性癌。
[0215]
il-17和th17通路在癌症发展和进展中具有重要作用,并且虽然il-17和th17在癌症中的作用尚未完全了解,但已知il-17和th17细胞的许多促肿瘤作用。举例来说,th17细胞和il-17可以促进血管生成,增加增生和肿瘤细胞存活并且活化促肿瘤转录因子[39-41]。因此,本发明的组合物可用于治疗或预防癌症。此外,所述实施例证明本发明的组合物有效减少乳房、肺和肝癌中的肿瘤体积,并且il-17和th17细胞在这些特定类型癌症中具有重要作用[42-44]。
[0216]
本发明组合物对癌症的治疗作用可以通过促发炎机制介导。发炎可以具有癌症抑制作用[45]且例如tnfα等促发炎细胞因子正作为癌症疗法来研究[46]。本发明的组合物可用于通过类似机制治疗癌症。举例来说,本发明的组合物可以引起ifnγ类型反应。ifnγ是可以刺激杀肿瘤活性的有效巨噬细胞活化因子[47],并且cxcl9和cxcl10例如也具有抗癌作用[48-50]。因此,在某些实施方案中,本发明的组合物在癌症治疗中用于促进发炎。在优选实施方案中,本发明的组合物在癌症治疗中用于促进th1发炎。th1细胞产生ifnγ且具有有效抗癌作用[45]。在某些实施方案中,本发明的组合物用于治疗早期癌症,例如尚未转移的癌症或者0期或1期癌症。促进发炎可以更有效地针对早期癌症[45]。在某些实施方案中,本发明的组合物用于促进发炎以增强第二抗癌剂的作用。
[0217]
在其它实施方案中,本发明的组合物用于治疗或预防急性成淋巴细胞性白血病(acute lymphoblastic leukemia,all)、急性骨髓性白血病、肾上腺皮质癌、基细胞癌瘤、胆管癌、膀胱癌、骨肿瘤、骨肉瘤/恶性纤维组织细胞瘤、脑干神经胶质瘤、脑肿瘤、小脑星形
细胞瘤、大脑星形细胞瘤/恶性神经胶质瘤、室管膜瘤、髓母细胞瘤、幕上原始神经外胚层肿瘤、乳癌、支气管腺瘤/类癌瘤、伯基特氏淋巴瘤(burkitt's lymphoma)、类癌瘤肿瘤、子宫颈癌、慢性淋巴细胞性白血病、慢性骨髓性白血病、慢性脊髓增生病、结肠癌、皮肤t细胞淋巴瘤、子宫内膜癌、室管膜瘤、食道癌、尤因肉瘤(ewing's sarcoma)、眼内黑色素瘤、视网膜母细胞瘤、胆囊癌、胃癌、胃肠道类癌肿瘤、胃肠基质肿瘤(gastrointestinal stromal tumor,gist)、生殖细胞肿瘤、儿童期视觉通路和下丘脑神经胶质瘤、霍奇金氏淋巴瘤(hodgkin lymphoma)、黑色素瘤、胰岛细胞癌瘤、卡波西氏肉瘤(kaposi sarcoma)、肾细胞癌、喉癌、白血病、淋巴瘤、间皮瘤、神经母细胞瘤、非霍奇金淋巴瘤、口咽癌、骨肉瘤、卵巢癌、胰腺癌、甲状旁腺癌、咽癌、垂体腺瘤、浆细胞瘤形成、前列腺癌、肾细胞癌瘤、视网膜母细胞瘤、肉瘤、睪丸癌、甲状腺癌或子宫癌。
[0218]
本发明的组合物在与其它治疗剂组合使用时会特别有效。本发明组合物的免疫调节作用会在与更直接抗癌剂组合时有效。因此,在某些实施方案中,本发明提供了一种组合物,其包含以登记号ncimb42380寄存的细菌或其生物型和抗癌剂。在优选实施方案中,抗癌剂是免疫检查点抑制剂、靶向抗体免疫疗法、car-t细胞疗法、溶瘤病毒或抑制细胞生长药物。在优选实施方案中,组合物包含选自由以下组成的群组的抗癌剂:yervoy(易普利单抗(ipilimumab),bms);keytruda(派姆单抗(pembrolizumab),merck);opdivo(纳武单抗(nivolumab),bms);medi4736(az/medimmune);mpdl3280a(roche/genentech);曲美目单抗(tremelimumab)(az/medimmune);ct-011(皮利珠单抗(pidilizumab),curetech);bms-986015(利鲁单抗(lirilumab),bms);medi0680(az/medimmune);msb-0010718c(merck);pf-05082566(pfizer);medi6469(az/medimmune);bms-986016(bms);bms-663513(优瑞路单抗(urelumab),bms);imp321(prima biomed);lag525(novartis);argx-110(argen-x);pf-05082466(pfizer);cdx-1127(瓦利路单抗(varlilumab);celldex therapeutics);trx-518(gitr inc.);mk-4166(merck);jtx-2011(jounce therapeutics);argx-115(argen-x);nlg-9189(英多莫德(indoximod),newlink genetics);incb024360(incyte);iph2201(innate immotherapeutics/az);nlg-919(newlink genetics);抗vista(jnj);依帕斯塔特(epacadostat)(incb24360,incyte);f001287(flexus/bms);cp 870893(university of pennsylvania);mga271(macrogenix);依玛珠单抗(emactuzumab)(roche/genentech);加尼斯替(galunisertib)(eli lilly);优库路单抗(ulocuplumab)(bms);bkt140/bl8040(biokine therapeutics);巴维昔单抗(bavituximab)(peregrine pharmaceuticals);cc 90002(celgene);852a(pfizer);vtx-2337(ventirx pharmaceuticals);imo-2055(hybridon,idera pharmaceuticals);ly2157299(eli lilly);ew-7197(ewha women's university,korea);威罗菲尼(vemurafenib)(plexxikon);达拉菲尼(dabrafenib)(genentech/gsk);bms-777607(bms);blz945(memorial sloan-kettering cancer centre);unituxin(地土昔单抗(dinutuximab),united therapeutics corporation);blincyto(布尔莫单抗(blinatumomab),amgen);cyramza(雷莫芦单抗(ramucirumab),eli lilly);gazyva(欧努珠单抗(obinutuzumab),roche/biogen);kadcyla(阿多曲妥珠单抗恩他新(ado-trastuzumab emtansine),roche/genentech);perjeta(帕妥珠单抗(pertuzumab),roche/genentech);adcetris(布瑞西单抗维多新(brentuximab vedotin),takeda/millennium);arzerra(奥法木单抗
bio);seprehvir(hsv1716,virttu biologics);orienx010(oriengene biotechnology);reolysin(oncolytics biotech);svv-001(neotropix);cacatak(cva21,viralytics);alimta(eli lilly)、顺铂(cisplatin)、奥沙利铂(oxaliplatin)、伊立替康(irinotecan)、亚叶酸(folinic acid)、甲氨蝶呤(methotrexate)、环磷酰胺(cyclophosphamide)、5-氟尿嘧啶(5-fluorouracil)、zykadia(novartis)、tafinlar(gsk)、xalkori(pfizer)、iressa(az)、gilotrif(boehringer ingelheim)、tarceva(astellas pharma)、halaven(eisai pharma)、veliparib(abbvie)、azd9291(az)、阿雷替尼(alectinib)(chugai)、ldk378(novartis)、盖纳特皮(genetespib)(synta pharma)、tergenpumatucel-l(newlink genetics)、gv1001(kael-gemvax)、替瓦替尼(tivantinib)(arqule);cytoxan(bms);oncovin(eli lilly);阿霉素(adriamycin)(pfizer);gemzar(eli lilly);xeloda(roche);ixempra(bms);abraxane(celgene);trelstar(debiopharm);taxotere(sanofi);nexavar(bayer);immu-132(immunomedics);e7449(eisai);thermodox(celsion);cometriq(exellxis);lonsurf(taiho pharmaceuticals);camptosar(pfizer);uft(taiho pharmaceuticals);和ts-1(taiho pharmaceuticals)。
[0219]
施用模式
[0220]
优选地,本发明的组合物待施用于胃肠道,以能够传递到肠和/或使本发明的细菌菌株部分或全部定殖于肠。一般地,虽然本发明的组合物经口施用,但其可以直肠、鼻内或通过颊或舌下途径施用。
[0221]
在某些实施方案中,本发明的组合物可以呈泡沫、喷雾或凝胶形式施用。
[0222]
在某些实施方案中,本发明的组合物可以呈栓剂,例如直肠栓剂,例如呈可可豆油(可可脂)、合成硬脂(例如suppocire、witepsol)、甘油基-明胶、聚乙二醇或肥皂甘油组合物的形式施用。
[0223]
在某些实施方案中,本发明的组合物通过管,例如鼻饲管、口胃管、胃管、空肠造口管(j型管)、经皮内窥镜胃造口术(percutaneous endoscopic gastrostomy,peg)或端口,例如通向胃、空肠和其它适合进入埠的胸壁端口施用胃肠道。
[0224]
本发明的组合物可以施用一次,或其可以作为治疗方案一部分连续施用。在某些实施方案中,本发明的组合物将每日施用。
[0225]
在本发明的某些实施方案中,根据本发明的治疗伴随有患者肠微生物丛的评估。如果本发明的菌株传递和/或部分或全部定殖未实现,使得功效未观测到,那么可以重复治疗,如果传递和/或部分或全部定殖成功且观测到功效,那么可以停止治疗。
[0226]
在某些实施方案中,本发明的组合物可以施用于怀孕动物,例如哺乳动物,例如人类,以预防发炎性或自身免疫性疾病在其子女中在子宫内和/或其出生后出现。
[0227]
本发明的组合物可以施用于经诊断患有由il-17或th17通路介导的疾病或病状或已经被鉴别为处于由il-17或th17通路介导的疾病或病状风险中的患者。组合物也可以作为预防措施施用以预防健康患者中由il-17或th17通路介导的疾病或病状出现。
[0228]
本发明的组合物可以施用于已经被鉴别为具有异常肠微生物丛的患者。举例来说,患者可以具有减少或缺乏以登记号ncimb 42380寄存的细菌定殖。
[0229]
本发明的组合物可以作为食品,例如营养增补剂施用。
[0230]
一般地,本发明的组合物用于治疗人类,不过其可以用于治疗动物,包括单胃哺乳
动物,例如家禽、猪、猫、犬、马或兔。本发明的组合物可用于增强动物的生长和效能。若施用于动物,则可以使用经口管饲法。
[0231]
组合物
[0232]
一般地,本发明的组合物包含细菌。在本发明的优选实施方案中,组合物呈冻干形式配制。举例来说,本发明的组合物可以包含含有本发明的细菌菌株的颗粒或明胶胶囊,例如硬明胶胶囊。
[0233]
优选地,本发明的组合物包含冻干细菌。细菌冻干是公知程序且相关指导可于例如参考文献[51-53]中获得。
[0234]
或者,本发明的组合物可以包含活的活性细菌培养物。
[0235]
在优选实施方案中,本发明的组合物经囊封以能够传递细菌菌株到肠。囊封保护组合物免于降解,直到通过例如用化学或物理刺激,例如压力、酶活性或物理性崩解(其可以通过ph值改变而触发)进行破裂,在目标位置传递。可以使用任何适当囊封法。示例性囊封技术包括截留在多孔基质内、附着或吸附在固体载体表面上、通过絮凝或利用交联剂而自我凝聚以及机械容纳在微孔膜或微胶囊后。关于可用于制备本发明的组合物的囊封的指导可以于例如参考文献[54]和[55]中获得。
[0236]
组合物可以经口施用且可以呈片剂、胶囊或散剂形式。囊封产品是优选的,因为以登记号ncimb 42380寄存的细菌可以是厌氧菌。其它成分(例如维生素c)可以作为除氧剂和益生基质包括以改善活体内传递和/或部分或全部定殖和存活。或者,本发明的益生组合物可以作为食品或营养产品,例如基于牛奶或乳清的发酵乳制品,或作为药品经口施用。
[0237]
组合物可以配制为益生菌。
[0238]
本发明的组合物包括治疗有效量的本发明的细菌菌株。治疗有效量的细菌菌株足以对患者发挥有益作用。治疗有效量的细菌菌株可以足够传递到患者肠和/或部分或全部定殖于患者肠。
[0239]
例如适合于成年人的细菌日剂量可以是约1
×
103到约1
×
10
11
菌落形成单位(colony forming unit,cfu);例如约1
×
107到约1
×
10
10
cfu;在另一实例中,约1
×
106到约1
×
10
10
cfu。
[0240]
在某些实施方案中,组合物含有相对于组合物的重量,约1
×
106到约1
×
10
11
cfu/g,例如约1
×
108到约1
×
10
10
cfu/g的量的细菌菌株。剂量可以是例如1g、3g、5g和10g。
[0241]
通常,益生菌,例如本发明的组合物,任选与至少一种适合益生化合物组合。益生化合物通常是不易消化的碳水化合物,例如寡糖或多糖,或糖醇,其在上部消化道中不降解或吸收。已知的益生菌包括商业产品,例如菊糖和反式半乳寡糖。
[0242]
在某些实施方案中,本发明的益生菌组合物包括相对于组合物总重量,约1到约30重量%(例如5到20重量%)的量的益生菌化合物。碳水化合物可以选自由以下组成的群:果寡糖(或fos)、短链果寡糖、菊糖、异麦芽寡糖、果胶、木寡糖(或xos)、几丁寡糖(或cos)、β-葡聚糖、阿拉伯胶改性和抗性淀粉、聚葡萄糖、d-塔格糖、阿拉伯胶纤维、角豆树、燕麦和柑桔纤维。在一个方面中,益生菌是短链果糖-寡糖(下文中简单起见展示为foss-c.c);所述foss-c.c是不可消化的碳水化合物,一般由甜菜糖转变获得并且包括三个葡萄糖分子键结的蔗糖分子。
[0243]
本发明的组合物可以包含药学上可接受的赋形剂或载剂。此类适合赋形剂的实例
可以见于参考文献[56]中。用于治疗用途的可接受的载剂或稀释剂是医药技术中众所周知的并且描述于例如参考文献[57]中。适合载剂的实例包括乳糖、淀粉、葡萄糖、甲基纤维素、硬脂酸镁、甘露糖醇、山梨糖醇等等。适合稀释剂的实例包括乙醇、甘油和水。医药载剂、赋形剂或稀释剂的选择可以针对预期施用途径和标准医药实践来选择。药物组合物可以包含任何适合粘合剂、润滑剂、悬浮剂、包被剂、增溶剂作为载剂、赋形剂或稀释剂或除载剂、赋形剂或稀释剂之外可以包含所述物质。适合粘合剂的实例包括淀粉、明胶、天然糖(例如葡萄糖、无水乳糖、自由流动乳糖、β-乳糖、玉米甜味剂)、天然和合成树胶(例如阿拉伯胶、黄蓍胶)或海藻酸钠、羧甲基纤维素和聚乙二醇。适合润滑剂的实例包括油酸钠、硬脂酸钠、硬脂酸镁、苯甲酸钠、乙酸钠、氯化钠等等。防腐剂、稳定剂、染料和甚至调味剂可以提供于药物组合物中。防腐剂的实例包括苯甲酸钠、山梨酸和对羟基苯甲酸酯。也可以使用抗氧化剂和悬浮剂。
[0244]
本发明的组合物可以配制为食品。举例来说,除本发明的治疗作用之外,食品可以提供营养益处,例如营养增补剂中。类似地,食品可以被配制成增强本发明组合物的口味,或通过使其更类似于常见食品而非药物组合物,使得组合物食用起来更具吸引力。在某些实施方案中,本发明的组合物被配制为基于牛奶的产品。术语“基于牛奶的产品”意指具有变化脂肪含量的任何基于牛奶或乳清的液体或半固体产品。基于牛奶的产品可以是例如奶牛奶、山羊奶、绵羊奶、脱脂乳、全乳、无任何加工下奶粉与乳清重组的牛奶或加工产品,例如酸奶酪、凝乳、凝块、酸牛奶、酸全乳、酪乳和其它酸牛奶产品。另一重要组包括乳制饮料,例如乳清饮料、发酵牛奶、炼乳、婴儿或婴孩牛奶;增香乳、冰淇淋;含牛奶的食品,例如甜食。
[0245]
在某些实施方案中,本发明的组合物含有单一细菌菌株或物种且不含有任何其它细菌菌株或物种。此类组合物可以仅仅包含最低限度或生物学上不相关量的其它细菌菌株或物种。此类组合物可以是基本上不含其它生物体物种的培养物。
[0246]
根据本发明使用的组合物可能需要或可能不需要销售批准。
[0247]
在一些情况下,冻干细菌菌株在施用之前复原。在一些情况下,复原是通过使用本文中描述的稀释剂。
[0248]
本发明的组合物可以包含药学上可接受的赋形剂、稀释剂或载剂。
[0249]
在某些实施方案中,本发明提供了一种药物组合物,其包含:本发明的细菌菌株;和药学上可接受的赋形剂、载剂或稀释剂;其中细菌菌株在施用有于需要的受试者时量足够治疗病症;并且其中病症选自由以下组成的群组:哮喘、过敏性哮喘、中性粒细胞性哮喘、骨关节炎、牛皮癣性关节炎、幼年特发性关节炎、视神经脊髓炎(德维克氏病)、强直性脊椎炎、脊椎关节炎、全身性红斑狼疮、乳糜泻、慢性阻塞性肺病(copd)、癌症、乳癌、结肠癌、肺癌、卵巢癌、葡萄膜炎、巩膜炎、血管炎、白塞氏病、动脉粥样硬化、异位性皮炎、肺气肿、牙周炎、过敏性鼻炎和同种异体移植排斥。
[0250]
在某些实施方案中,本发明提供药物组合物,其包含:本发明的细菌菌株;和药学上可接受的赋形剂、载剂或稀释剂;其中细菌菌株的量足够治疗或预防由il-17或th17通路介导的疾病或病状。在优选实施方案中,所述疾病或病状选自由以下组成的群组:类风湿性关节炎、多发性硬化、牛皮癣、发炎性肠病、克罗恩氏病、溃疡性结肠炎、乳糜泻、哮喘、过敏性哮喘、中性粒细胞性哮喘、骨关节炎、牛皮癣性关节炎、幼年特发性关节炎、视神经脊髓炎
(德维克氏病)、强直性脊椎炎、脊椎关节炎、全身性红斑狼疮、慢性阻塞性肺病(copd)、癌症、乳癌、结肠癌、肺癌、卵巢癌、葡萄膜炎、巩膜炎、血管炎、白塞氏病、动脉粥样硬化、异位性皮炎、肺气肿、牙周炎、过敏性鼻炎和同种异体移植排斥。
[0251]
在某些实施方案中,本发明提供以上药物组合物,其中细菌菌株的量是相对于组合物的重量每克约1
×
103到约1
×
10
11
菌落形成单位。
[0252]
在某些实施方案中,本发明提供以上药物组合物,其中组合物以1g、3g、5g或10g的剂量施用。
[0253]
在某些实施方案中,本发明提供以上药物组合物,其中组合物通过选自由口腔、直肠、皮下、鼻、颊和舌下组成的群组的方法施用。
[0254]
在某些实施方案中,本发明提供以上药物组合物,其包含选自由乳糖、淀粉、葡萄糖、甲基纤维素、硬脂酸镁、甘露糖醇和山梨糖醇组成的群组的载剂。
[0255]
在某些实施方案中,本发明提供以上药物组合物,其包含选自由乙醇、甘油和水组成的群组的稀释剂。
[0256]
在某些实施方案中,本发明提供以上药物组合物,其包含选自由以下组成的群组的赋形剂:淀粉、明胶、葡萄糖、无水乳糖、自由流动的乳糖、β-乳糖、玉米甜味剂、阿拉伯胶、黄蓍胶、海藻酸钠、羧甲基纤维素、聚乙二醇、油酸钠、硬脂酸钠、硬脂酸镁、苯甲酸钠、乙酸钠和氯化钠。
[0257]
在某些实施方案中,本发明提供以上药物组合物,其进一步包含防腐剂、抗氧化剂和稳定剂中的至少一种。
[0258]
在某些实施方案中,本发明提供以上药物组合物,其包含选自由苯甲酸钠、山梨酸和对羟基苯甲酸酯组成的群组的防腐剂。
[0259]
在某些实施方案中,本发明提供以上药物组合物,其中所述细菌菌株是冻干的。
[0260]
在某些实施方案中,本发明提供以上药物组合物,其中当组合物存储在密封容器中约4℃或约25℃下且容器置于具有50%相对湿度的气氛中时,在至少约1个月、3个月、6个月、1年、1.5年、2年、2.5年或3年时期后如以菌落形成单位测量,至少80%细菌菌株残留。
[0261]
培养方法
[0262]
用于本发明的细菌菌株可以使用如例如参考文献[58-60]中详述的标准微生物学技术培养。
[0263]
用于培养的固体或液体培养基可以是ycfa琼脂或ycfa培养基。ycfa培养基可以包括(每100ml,近似值):酪胨(1.0g)、酵母提取物(0.25g)、nahco3(0.4g)、半胱氨酸(0.1g)、k2hpo4(0.045g)、kh2po4(0.045g)、nacl(0.09g)、(nh4)2so4(0.09g)、mgso4·
7h2o(0.009g)、cacl2(0.009g)、刃天青(0.1mg)、氯化血红素(1mg)、生物素(1μg)、钴胺素(1μg)、对氨基苯甲酸(3μg)、叶酸(5μg)和吡哆胺(15μg)。
[0264]
用于疫苗组合物中的细菌菌株
[0265]
本发明人已经确定本发明的细菌菌株可用于治疗或预防由il-17或th17通路介导的疾病或病状。此可能是本发明的细菌菌株作用于宿主免疫系统的结果。因此,当作为疫苗组合物施用时,本发明的组合物也可用于预防由il-17或th17通路介导的疾病或病状。在某些此类实施方案中,本发明的细菌菌株可以是杀死的、灭活的或减毒的。在某些此类实施方案中,组合物可以包含疫苗佐剂。在某些实施方案中,组合物用于通过注射,例如通过皮下
注射施用。
[0266]
通则
[0267]
除非另外指明,否则本发明的实施将采用在本领域技能内的常规化学、生物化学、分子生物学、免疫学和药理学方法。此类技术在文献中充分解释。参见例如参考文献[61]和[62-68]等。
[0268]
术语“包含”涵盖“包括”以及“由
……
组成”,例如“包含”x的组合物可以仅仅由x组成,或可以包括其它某物,例如x+y。
[0269]
关于数值x的术语“约”是任选选用的并且意指例如x
±
10%。
[0270]
词语“基本上”不排除“完全”,例如“基本上不含”y的组合物可完全不含y。必要时,本发明的定义中可以省略词语「基本上」。
[0271]
提及两种核苷酸序列之间的序列一致性百分比意指在比对时,比较两种序列中相同的核苷酸百分比。此比对和同源性或序列一致性百分比可以使用本领域中已知的软件程序,例如参考文献[69]的部分7.7.18中描述的软件程序确定。优选比对通过smith-waterman同源性搜索算法使用仿射空位搜索(其中开放空位罚分是12且空位延伸罚分是2、blosum 62矩阵)来确定。smith-waterman同源性搜索算法在参考文献[70]中公开。
[0272]
除非特别陈述,否则包括多个步骤的工艺或方法可以在方法开始或结束包括其它步骤,或可以包括其它插入步骤。此外,适当时步骤可以组合,省去或以替代次序进行。
[0273]
本文中描述本发明的多个实施方案。应了解每个实施方案中说明的特征都可以与其它所说明的特征组合以提供其它实施方案。具体来说,本文中强调为适合、典型或优选的实施方案可以彼此组合(除非其互斥时)。
[0274]
用于进行本发明的模式
[0275]
实施例1-房尘螨诱发的哮喘的小鼠模型中细菌接种物的功效
[0276]
概述
[0277]
向小鼠施用包含根据本发明的细菌菌株的组合物,且随后用房尘螨(hdm)提取物激发以引起过敏性发炎反应。对hdm的发炎反应包括嗜酸性粒细胞和中性粒细胞性组分,由il-17和th17通路介导,并且是哮喘模型。将用本发明组合物治疗的小鼠所展现的发炎反应的量值和特征与对照组相比。发现本发明的组合物减轻发炎反应,并且减少嗜酸性粒细胞和嗜中性粒细胞募集,表明其可用于治疗il-17介导的病状,例如嗜酸性粒细胞增多、中性粒细胞增多和哮喘。
[0278]
菌株
[0279]
751:以登记号ncimb 42380寄存的细菌
[0280]
研究设计
[0281]
组:
[0282]
1.阴性对照组。用媒介物对照物处理(经口)。
[0283]
4.用治疗性细菌接种物菌株751处理(经口)。
[0284]
7.阳性对照组。用地塞米松处理(腹膜内)。
[0285]
8.未处理的对照组。
[0286]
每组小鼠数目=5
[0287]
第-14天到第13天:每日经口施用媒介物对照物(组1)。
[0288]
第-14天到第13天:每日经口施用治疗性细菌接种物(组2-6)。
[0289]
第0、2、4、7、9、11天,经鼻施用于30ul体积pbs中的15ug hdm(房尘螨提取物-目录号:xpb70d3a25,批号:231897,greer laboratories,lenoir,nc,usa)(组1-8)。
[0290]
第0、2、4、7、9、11天施用地塞米松(腹膜内,3mg/kg,sigma-aldrich,目录号d1159)(组7)。
[0291]
第14天处死所有动物用于分析。
[0292]
小鼠总数=40。
[0293]
终点和分析
[0294]
在第14天,通过腹膜内注射致命戊巴比妥(pentabarbitol)(streuli pharma ag,uznach,目录号:1170139a)处死动物,接着立刻进行支气管肺泡灌洗(bal)。
[0295]
细胞与bal(支气管肺泡灌洗)流体分离并进行细胞分类计数(200个细胞计数/样品)。
[0296]
材料与方法
[0297]
小鼠。从charles river laboratories购买雌性7周龄balb/c小鼠且随机分配到笼,每笼都5只小鼠(通风笼来源于indulab ag,gams,switzerland笼型:“thesealsafetm-ivc笼。产品号1248l)。笼标记有研究号、组号和实验开始日期。每周监测小鼠且适应设施7天,接着开始研究(研究第-14天)。在研究第-14天动物是8周龄。饮用水和食物可随意取用。存在笼富集。根据地方特许牌照号2283.1(经service de la consommation et des affaires v
é
t
é
rinaires du canton de vaud颁予和批准)进行动物的每日护理。饮用水和食物可随意取用且每日补充一次。存在笼富集。观测到如瑞士官方根据fvo(federal veterinary office)关于实验动物饲养管理、遗传修饰动物产生和动物实验方法的条例455.163所给出的动物福利规定。
[0298]
培养细菌接种物。在无菌工作站内,通过将手套手温热使细菌的低温小瓶解冻且约0.7ml内含物注射到含有8ml厌氧ycfa的亨盖特管(hungate tube)(目录号1020471,ochs,bovenden-lenglern,germany)中。通常每个菌株准备两个管。接着亨盖特管在37℃下培育(静止)16小时(菌株751)。
[0299]
培养媒介物对照物。将含有8ml厌氧ycfa的亨盖特管在37℃下培育(静止)16小时。
[0300]
施用细菌接种物或媒介物对照物。将400ul培养的细菌接种物或媒介物对照物每天根据经口管饲法施用。
[0301]
鼻内敏化。通过腹膜内注射每公斤9.75mg xylasol和48.75mg ketasol(dr.e.graeub ag,bern,switzerland)使小鼠麻醉且每个鼻施用于30ul体积pbs中的15ug hdm(目录号:xpb70d3a25,批号:231897,greer laboratories,lenoir,nc,usa)。
[0302]
制备和施用阳性对照化合物地塞米松。地塞米松21-磷酸二钠盐(sigma-aldrich,目录号d1159,货号n
°
slbd.1030v)溶解在h2o中,且以3mg/kg的剂量于200ul体积中在以上研究方案中指示天数经口施用动物。
[0303]
终末程序。在第14天,通过腹膜内注射致命戊巴比妥(streuli pharmaag,uznach,目录号:1170139a)处死动物,接着立刻进行500ul生理食盐水中支气管肺泡灌洗(bal)。
[0304]
测量bal中的细胞浸润。细胞与bal流体分离并基于标准形态学和细胞化学标准进行细胞分类计数。
[0305]
图表和统计分析。所有图表都用graphpad prism第6版产生并应用单向anova。来自统计分析的结果具备个别数据表。误差线表示平均标准误差(standard error of the mean,sem)。
[0306]
结果和分析
[0307]
实验结果展示于图1-9中。
[0308]
在用细菌或媒介物处理的小鼠中未记录到发病或死亡。两种对照物媒介物处理(阴性对照)和地塞米松处理(阳性对照)如所预期表现,其中地塞米松处理后记录到嗜酸性粒细胞增多和中性粒细胞增多减弱。
[0309]
此实验的最重要结果展现在图6和7中,图6和7报告在用hdm激发后在支气管灌洗中检测到的嗜中性粒细胞的总数和百分比。菌株751相对于仅仅媒介物的对照物,减少bal中嗜中性粒细胞总量和嗜中性粒细胞的比例。
[0310]
实施例2-严重中性粒细胞性哮喘的小鼠模型中细菌接种物的功效
[0311]
概述
[0312]
向小鼠施用包含根据本发明的细菌菌株的组合物且随后通过皮下施用房尘螨(hdm)提取物来敏化,并且通过鼻内施用hdm激发,以模拟严重中性粒细胞性哮喘的发炎反应。将用本发明组合物治疗的小鼠所展现的发炎反应的量值和特征与对照组相比。发现本发明的组合物减轻发炎反应,并且尤其减少嗜中性粒细胞的募集,方式与包括施用抗il-17抗体的阳性对照物相当。因此,数据表明本发明的组合物可用于治疗il-17和th17介导的病状,例如中性粒细胞增多和哮喘。
[0313]
菌株
[0314]
751:以登记号ncimb 42380寄存的细菌
[0315]
研究设计
[0316]
组:
[0317]
1.阴性对照组。用媒介物对照物处理(经口)。
[0318]
4.用治疗性细菌接种物菌株751处理(经口)。
[0319]
7.阳性对照组。用抗il-17处理(腹膜内)。
[0320]
8.未处理的对照组。
[0321]
9:健康小鼠(基线)。
[0322]
每组小鼠数目(组1-8)=5
[0323]
第-14天到第17天:每日经口施用媒介物对照物(组1)。
[0324]
第-14天到第17天:每日经口施用治疗性细菌接种物(组2-6)。
[0325]
第0天:用cfa中hdm敏化(皮下)(组1-8)。
[0326]
第7天:用cfa中hdm敏化(皮下)(组1-8)。
[0327]
第13、15、17天:经腹膜内施用抗il-17中和抗体(组7)。
[0328]
第14、15、16、17天:经鼻用30ul pbs中hdm激发(组1-8)。
[0329]
第18天:处死所有动物用于分析。
[0330]
终点和分析:
[0331]
在第14天,通过腹膜内注射致命戊巴比妥(streuli pharma ag,uznach,目录号:1170139a)处死动物,接着立刻进行支气管肺泡灌洗(bal)。细胞与bal流体分离且进行细胞
分类计数(200个细胞计数/样品)。
[0332]
材料与方法
[0333]
小鼠。从charles river laboratories购买雌性7周龄c57bl/6小鼠且随机分配到笼,每笼都5只小鼠(通风笼来源于indulab ag,gams,switzerland笼型:“the sealsafetm-ivc笼。产品号1248l)。笼标记有研究号、组号和实验开始日期。每周监测小鼠且适应设施7天,接着开始研究(研究第-14天)。在研究第-14天动物为8周龄。饮用水和食物可随意取用。存在笼富集。根据地方特许牌照号2283.1(经service de la consommation et des affaires v
é
t
é
rinaires du canton de vaud颁予和批准)进行动物的每日护理。饮用水和食物可随意取用且每日补充一次。存在笼富集。观测到如瑞士官方根据fvo(federal veterinary office)关于实验动物饲养管理、遗传修饰动物产生和动物实验方法的条例455.163所给出的动物福利规定。
[0334]
培养细菌接种物。在无菌工作站内,通过将手套手温热使细菌的低温小瓶解冻且约0.7ml内含物注射到含有8ml厌氧ycfa的亨盖特管(目录号1020471,ochs,bovenden-lenglern,germany)中。通常每个菌株准备两个管。接着亨盖特管在37℃下培育(静止)16小时(菌株751)。
[0335]
培养媒介物对照物。含有8ml厌氧ycfa的亨盖特管在37℃下培育(静止)16小时。
[0336]
施用细菌接种物或媒介物对照物。将400ul培养的细菌接种物或媒介物对照物每天根据经口管饲法施用。
[0337]
hdm敏化。将pbs中50μg hdm(目录号:xpb70d3a25,批号:231897,greer laboratories,lenoir,nc,usa)在等体积完全弗氏佐剂(complete freund’s adjuvant,cfa chondrex inc.washington,usa)中乳化,并且在两周内在对侧腰窝上以200μl体积皮下施用两次。第二次免疫接种后一周,通过腹膜内注射每公斤9.75mg xylasol和48.75mg ketasol(dr.e.graeub ag,bern,switzerland)使小鼠麻醉,接着连续4日,以30ul体积pbs中15μg hdm鼻内激发。最终激发后一天进行分析。
[0338]
阳性对照化合物抗小鼠il-17抗体的制备和施用。抗il-17中和抗体来源于bio x cell且存储在4℃下(克隆17f3,目录号be0173,bio x cell),且经腹膜内以12.5mg/kg的剂量在以上研究方案中指示天数施用。
[0339]
终末程序。在第18天,通过腹膜内注射致命戊巴比妥(streuli pharma ag,uznach,目录号:1170139a)处死动物,接着立刻进行500ul生理食盐水中支气管肺泡灌洗(bal)。
[0340]
测量bal中的细胞浸润。细胞与bal流体分离并基于标准形态学和细胞化学标准进行细胞分类计数。
[0341]
图表和统计分析。所有图表都用graphpad prism第6版产生并应用单向anova。来自统计分析的结果具备个别数据表。误差线表示平均标准误差(sem)。
[0342]
结果和分析
[0343]
实验结果展示于图10-18中。
[0344]
在用细菌或媒介物处理的小鼠中未记录到发病或死亡。如图15和16中所示,菌株751高度有效地减轻中性粒细胞性发炎反应的程度。实际上,用菌株751处理展示与用抗il-17抗体处理相当的结果。另外,菌株751相对于对照减少嗜酸性粒细胞数目,如图11和12中
所示。
[0345]
实施例3-ii型胶原蛋白诱发的关节炎小鼠模型中细菌接种物治疗关节炎的功效
[0346]
材料与方法
[0347]
菌株
[0348]
751:以登记号ncimb 42380寄存的细菌
[0349]
细菌培养物
[0350]
细菌培养物在厌氧工作站(don whitley scientific)中生长用于施用。
[0351]
细菌菌株#751使用甘油原液生长。甘油原液存储在-80℃下。每周三次,甘油原液在室温下解冻且在ycfa盘上划线。每次使用新的甘油等分试样。使细菌在给定盘上生长多达72小时。
[0352]
待施用动物的溶液每日制备两次,上午(am)和下午(pm)处理具有八小时时间间隔。从划线盘挑选菌落,并且转移到含有ycfa培养基的管中。使细菌菌株#751生长16小时,接着am施用。细菌以1%传代培养到ycfa培养基中进行pm施用。在上午和下午处理制备后记录每一菌株的od值。
[0353]
ii型胶原蛋白诱发的关节炎小鼠模型
[0354]
成年雄性dba/1小鼠随机分配到实验组并使其适应两周。在第0天,通过皮下注射100微升含有100微克ii型胶原蛋白(cii)于补充有4mg/ml结核分枝杆菌(mycobacterium tuberculosis)h37ra的不完全弗氏佐剂中的乳液来施用动物。在第21天,通过皮下注射含有100μgii型胶原蛋白于不完全弗氏佐剂中的加强乳液来施用动物。
[0355]
根据以下施用时程给与处理。从第-14天直到第45天实验结束,将动物每周称重三次。从第21天直到实验结束,每周针对关节炎的临床征象,包括后爪和前爪、桡腕(腕)关节和胫跗(踝)关节的肿胀对动物评分三次。
[0356]
在第45天,挑选小鼠并且取终末血液样品用于细胞因子分析。
[0357]
在第-14天、第0天和第45天,收集粪便样品用于微生物分析,立刻速冻且存储在-80℃下。
[0358]
胶原蛋白诱发的关节炎(cia)小鼠模型是公认的类风湿性关节炎小鼠模型[71]。用cii免疫接种引起包括类风湿性关节炎的若干重要病理学特征,包括滑液增生、单核细胞浸润和软骨退变的发病机理。重要地,cia的发展由th17细胞,通过分泌il-17a介导[72]。潜伏在关节炎模型下的免疫反应通过使用补充有结核分枝杆菌的弗氏佐剂增强。
[0359]
在第21天,从每组中三个卫星动物收集脾。细胞在ii型胶原蛋白存在或不存在下培养72小时。通过luminex定量培养物上清液中和终末血清中的包括tnf-α、il-6、ifn-γ、il-4、il-10和il-17在内的细胞因子。使用氚化胸腺嘧啶并入法定量细胞增殖。
[0360]
处理组和剂量
[0361]
所有组n=15(主要研究组n=12且卫星组n=3)。
[0362]
用于生物治疗剂的媒介物是酵母提取物-酪胨-脂肪酸(ycfa)培养基。
[0363][0364][0365]
po:经口管饲法,sc:皮下注射,bid:每天两次,cfa:完全弗氏佐剂
[0366]
体重
[0367]
从第-14天直到实验结束,将动物每周称重三次。将数据绘图(平均值
±
sem)。
[0368]
非特定的临床观测结果
[0369]
从第-14天到实验结束,每日检查动物的非特定临床征象,包括姿势异常(弓背)、异常皮毛情况(竖毛)和异常活动程度(活动减少或增加)。
[0370]
临床观测结果
[0371]
从第21天直到第45天实验结束,每周针对关节炎的临床征象,包括后爪和前爪、桡腕(腕)关节和胫跗(踝)关节的肿胀对动物评分三次。使用以下量表对每肢评分:(0)正常,(1)轻微肿胀,(2)轻度肿胀,(3)中度肿胀和(4)严重肿胀。通过加入每肢评分计算临床评分。动物的最大可能临床评分是(16)。挑选两个连续时刻的评分等于(12)的动物和任一时刻评分超过(12)的动物。将数据绘图(平均值
±
sem)。
[0372]
细胞增殖分析
[0373]
第21天,每组挑选三个卫星动物且将脾解剖出。脾细胞在ii型胶原蛋白存在或不存在下培养72小时。72小时后,细胞在氚化胸腺嘧啶存在下脉冲过夜。通过测量胸苷并入来定量细胞增殖。将数据绘图(平均值
±
sem)。取上清液并测试关键细胞因子的存在。
[0374]
细胞因子分析
[0375]
通过luminex测试来自脾细胞培养物的终末上清液以定量tnf-α、il-6、ifn-γ、il-4、il-10和il-17。将数据绘图(平均值
±
sem)。
[0376]
微生物分析
[0377]
在第-14天、第0天和第45天,从每个动物收集粪便样品,立刻速冻且存储在-80℃下。盲肠(包括内含物)立刻速冻且存储在-80℃下。每日通过涂铺细菌进行细菌鉴别测试。
[0378]
组织病理学
[0379]
在实验结束时,后爪存储在组织固定剂中。样品转移到脱钙溶液中。将组织样品加工,切片,并用苏木精与曙红染色。通过对实验设计不知情的合格组织病理学家,针对关节炎征象,包括发炎、关节软骨破坏和下层干骺端骨骼的破坏,对切片评分。使用详述评分系统(见下文)。将数据绘图(平均值
±
sem)。提供原始和分析数据以及代表性图。
[0380]
表1:组织病理学评分系统
[0381][0382]
结果和分析
[0383]
存活和非特异性临床观测结果
[0384]
一些动物因关节炎的临床征象的严重程度或因非特定临床观测结果的严重程度而在研究时程结束之前被淘汰。
[0385]
3只动物被淘汰或发现死亡或在预处理时期(第-14天到第0天)期间被淘汰:组1中的1只动物(媒介物处理的动物从供应者处到达后断腿且淘汰)和组2中的两只动物(生物治疗剂#751处理,在预处理第一天可能肺给药,和预处理第二天给药后临床征象)。
[0386]
8只动物因关节炎临床征象的严重程度而被淘汰:组1中的5只动物(媒介物处理)和组2中的3只动物(生物治疗剂#751处理)。
[0387]
4只动物因包括姿势异常(弓背)、异常皮毛情况(竖毛)、异常活动程度(活动减少)在内的非特定临床征象的严重程度而淘汰:组1中3只动物(媒介物处理)和组2中1只动物(生物治疗剂#751处理)。
[0388]
体重
[0389]
从第-14天直到第0天记录体重数据,且表示为初始(第-14天)体重的百分比,通过双向anova,接着邓尼特事后检验(dunnett’spost-test)分析,以与第-14天进行多重比较,接着与媒介物处理组进行多重比较。数据呈现于图19中。从分析中排除来自实验时程结束之前被淘汰的动物的数据。
[0390]
当与第-14天比较时,在媒介物处理组中,在第-9天和第-7天,通过经口管饲法每日施用两次诱发显著体重损失。
[0391]
在生物治疗剂处理组中第-14天与第-1天之间测量的体重不与在任何给定天在媒介物处理组中测量的体重不同。
[0392]
从第0天直到第28天记录体重数据,且表示为初始(第0天)体重的百分比,通过双向anova,接着邓尼特事后检验分析,以与媒介物组中第0天进行多重比较,接着与媒介物处理组进行多重比较。数据呈现于图20中。从分析中排除来自实验时程结束之前被淘汰的动物和来自卫星动物的数据。第28天、第35天和第42天数据通过单向anova,接着邓尼特事后检验进一步分析,以与媒介物处理组进行多重比较。
[0393]
当与媒介物处理组中第0天比较时,在第26天和第28天关节炎临床征象的发作与显著体重丧失有关(p《0.0001)。
[0394]
在第35天或第42天实验组之间差异不显著。
[0395]
临床观测结果
[0396]
通过双向anova,接着邓尼特事后检验分析临床评分数据,以在媒介物处理组中各天之间进行多重比较,接着在实验组与媒介物处理组之间每天进行多重比较。数据呈现于图21中。从分析中排除从实验结束之前被淘汰的动物记录的数据。当动物因关节炎临床征象的严重程度而被淘汰时,报告以下天的最后记录评分且用于统计分析中。
[0397]
当与第21天比较时,从第28天直到第45天,在媒介物处理组中观测到临床评分显著增加(p《0.0001)。
[0398]
当从第31天直到第45天与媒介物处理组比较时,生物治疗剂#751诱发临床评分减少,不过差异不显著。
[0399]
细胞增殖分析
[0400]
为了使所述分析有效,脾细胞在作为阳性对照刺激物的可溶性抗cd3和抗cd28(抗cd3/cd28)存在下培养以证实细胞的增殖潜能。
[0401]
在所有实验组中都看到对抗cd3/cd28的强烈增殖反应,展示细胞健康、有活力且能够对活化信号作出反应。
[0402]
为了测试在ii型胶原蛋白(cii)存在下的增殖反应,脾细胞在50μg/ml cii存在下培养。通过双向anova,接着斯达克事后检验(sydak’s post-test),分析对cii的脾细胞增殖反应,以在未刺激与cii刺激的脾细胞之间进行多重比较,且通过单向anova,接着邓尼特事后检验分析,以将不同实验组与媒介物处理组中cii刺激的反应进行比较。数据呈现于图22中。
[0403]
当与媒介物处理组中未刺激脾细胞比较时,cii诱发3h-胸苷并入(cpm)极显著增加(p《0.0001)。
[0404]
用生物治疗剂#751处理的组证明cii诱发的脾细胞增殖水平显著低于媒介物处理组。
[0405]
组织培养上清液中细胞因子含量
[0406]
通过luminex分析,在来源于抗cd3/cd28刺激的培养物的组织培养上清液中,测量每种细胞因子的含量。这些展示所有测量的细胞因子的稳固反应(媒介物组中平均含量如下:il-4=6,406pg/ml;il-6=306pg/ml;il-10=10,987pg/ml;il-17a=11,447pg/ml;ifn-γ=15,581pg/ml;tnf-α=76pg/ml)。
[0407]
以下部分概括从ii型胶原蛋白刺激的培养物获得的数据。适用时,未刺激和cii刺激的脾细胞的上清液中细胞因子含量之间的差异统计分析使用双向anova,接着斯达克事后检验进行,以进行多重比较,而单向anova、接着邓尼特事后检验用于比较生物治疗剂处理组与媒介物处理组的cii刺激的反应。在两种情况下所述组之间的细胞因子含量无显著差异。此可能归因于使用的样本尺寸小(n=3)。
[0408]
为了更精确地呈现细胞因子的数据分布与数据的大体布置,此作为散布图呈现。
[0409]
在用cii刺激后组织培养上清液中il-4的组平均值《5pg/ml。这些不视为生物学上显著的且此处不包括。用胶原蛋白刺激后组织培养上清液中tnf-α的组平均值低于定量限度。
[0410]
ifn-γ的上清液含量(图23)
[0411]
与il-17一起,ifn-γ是cia模型中驱动疾病的主要细胞因子。图23中的散布图证明cii刺激后的ifn-γ含量,与生物治疗剂比较,媒介物处理组的组中位数更高。来自相同组2名受试者的离群值结果引起此组中ifn-γ和il-10的中位数更高。
[0412]
il-17a的上清液含量(图24)
[0413]
在媒介物处理组的cii刺激的培养物中il-17a含量是50pg/ml。与媒介物处理比较,在生物治疗剂组中此细胞因子的含量似乎较低。
[0414]
il-10的上清液含量(图25)
[0415]
媒介物处理组中cii刺激和培养基对照培养物的il-10含量分别是13pg/ml和2.1pg/ml。可预期媒介物处理组的il-10(其是消炎细胞因子)含量较高,因为发炎和促炎细胞因子诱发可以伴随有消炎反馈机制。
[0416]
il-6的上清液含量(图26)
[0417]
例如il-6和tnf-α等发炎细胞因子在抗cii培养物中通常不高水平产生。然而,其含量可能由于免疫调节而改变。cii刺激的培养物中il-6含量少,达到10pg/ml。虽然高于培养基对照培养物,但这些差异太小,以致于无法提供进行统计分析的基本原理。
[0418]
微生物分析
[0419]
通过使用光谱仪测量600nm下光密度来证实细菌生长。通过比较划线盘图像与参考图像,证实细菌身份。
[0420]
在改良的细菌制备方法后,如测量的高od值所指示,从第-2天和第-3天施用一致高剂量的细菌菌株。
[0421]
在第-14天、第0天和终止时收集粪便样品并速冻。
[0422]
组织病理学
[0423]
组织病理学结果展示于图66-70中。如对此模型所预期,根据关节炎存在/不存在或存在的改变严重程度,观测个体内和个体间变化性。
[0424]
病理性质如针对此模型所预期,滑膜和滑液囊大范围混合型慢性活动性发炎,延
伸到涉及关节周围的软组织(肌肉、脂肪组织、皮肤胶原蛋白)。在最严重受影响的关节中,存在关节软骨退化和丧失,具有关节内碎片和发炎以及关节和骨结构因纤维化和发炎而破坏。
[0425]
组织病理学改变的发生率是:媒介物-80%(16/20);生物治疗剂#751-45%(9/20)。当与媒介物处理组比较时,用生物治疗剂#751处理减少小鼠后肢中组织病理学评分的发生率(参见图66-69)。通过单向anova,针对非参数数据(克鲁斯凯-沃利斯检验(kruskal-wallis test))分析组织病理学评分,接着邓尼特事后检验,与媒介物处理组进行多重比较。当与媒介物处理组比较时,生物治疗剂#751诱发在组织病理学中观测到的关节发炎评分显著减少(p《0.01)。当与媒介物处理组比较时,生物治疗剂#751诱发在组织病理学中观测到的软骨破坏评分显著减少(p《0.001)。当与媒介物处理组比较时,生物治疗剂#751诱发在组织病理学中观测到的骨骼破坏评分显著减少(p《0.001)。当与媒介物处理组比较时,生物治疗剂#751诱发总组织病理学评分显著减少(p《0.01)。
[0426]
概述
[0427]
如dba/1小鼠中关节炎模型中所预期,从ii型胶原蛋白第一次施用后第28天观测到临床评分增加。生物治疗剂#751展示在此模型中有效治疗关节炎并且生物治疗剂#751有效减少临床评分的严重程度。生物治疗剂#751也有效减少关节中的病理性疾病,如组织病理学分析中所证明。
[0428]
在来自所有实验组的脾细胞培养物中都看到对ii型胶原蛋白的增殖回忆反应。胶原蛋白特定的反应在用生物治疗剂#751处理后显著减少(组2)。
[0429]
大部分所测试的t细胞细胞因子展示在媒介物处理组中ii型胶原蛋白刺激的培养基与培养基对照之间可检测的增加。这些增加在生物治疗剂处理组中不如此明显。此广泛证明上述对ii型胶原蛋白的增殖回忆反应。
[0430]
有证据证明抑制th1/th17轴,th1/th17轴是此模型和人类ra中的病原性反应。降低的细胞因子含量与减少的增殖的相关性暗示免疫调节。无证据证明此调节由th2相关的il-4含量增加或免疫调节细胞因子il-10增加引起。
[0431]
实施例4-房尘螨诱发的哮喘的小鼠模型中细菌接种物的作用的进一步分析
[0432]
在实施例1中测试的小鼠进行进一步分析以进一步表征本发明的组合物对过敏性哮喘发炎反应的作用。
[0433]
材料与方法
[0434]
在第14天抽血和血清制备。动物的血液样品通过心脏刺穿收集。通过在14000g下离心5分钟,将血清自血液样品分离并存储在-20℃下。
[0435]
在第14天去除器官。左肺叶收集在福尔马林中以进行改进型组织学分析。收集右肺叶(所有剩余叶)和去除血清以速冻和用于改进型分析。剩余bal流体速冻用于改进型分析。
[0436]
血清和bal流体中抗体含量的测量
[0437]
通过elisa分析,在bal和血清中测量全部ige和房尘螨(hdm)特异性igg1抗体产生。
[0438]
肺分离和组织学分析
[0439]
左肺叶固定在福尔马林中,接着埋入石蜡中,切片,且用苏木精和曙红和pas染色。
如下盲法进行随后组织学评分:针对发炎(支气管周浸润和血管周浸润)和粘液产生,对每个样品的5个随机视场评分。发炎浸润用以下分级系统评分:
[0440]
0-正常
[0441]
1-轻度发炎浸润
[0442]
2-中度发炎浸润
[0443]
3-显著发炎浸润
[0444]
4-严重发炎浸润
[0445]
5-非常严重发炎浸润
[0446]
在每个视场中,气道以尺寸测量且粘液细胞数以um定量。
[0447]
测量肺组织中发炎介体
[0448]
分离用于定量发炎介体的右肺叶(所有剩余叶)速冻,用于随后通过市售多任务分析(merck-millipore)测量ccl11、ifn-γ、il-1α、il-1β、il-4、il-5、il-9、il-17a、cxcl1、ccl3、cxcl2和ccl5。根据制造商的说明书进行分析。
[0449]
结果和分析
[0450]
实验结果展示于图28-46中。
[0451]
支持实施例1中描述的发现,用菌株751处理的小鼠的肺组织中细胞浸润物的分析展示平均发炎评分显著和统计上显著的减少(参见图32和34)。
[0452]
分析bal流体和血清中抗体含量(参见图28-31)。观测到细菌处理对血清抗体含量无明确作用。此可以反映实验失败,因为数据的散布和每一处理的误差线大,并且阳性和阴性对照物似乎未如预期起作用。此外,基线血清抗体含量可能已屏蔽任何改变。
[0453]
类似地,观测到细菌处理对肺组织中细胞因子含量无明确作用(参见图36-46)。再次,此可以反映实验失败,因为数据的散布和每一处理的误差线大,并且阳性和阴性对照似乎未如预期起作用。也可能涉及的作用机制影响较早细胞因子反应,所述细胞因子反应在最终hdm气道激发后第4天不再可检测。归因于所检测的含量的变化性,当解释当前研究中细胞因子数据时应谨慎一些。此变化性可以通过以下事实解释:分离肺组织用于不同分析,且归因于发炎的分布不规则,因此一个肺叶可能不具充分代表性或可与其它小鼠中相同叶匹敌。
[0454]
实施例5-严重中性粒细胞性哮喘的小鼠模型中细菌接种物的作用的进一步分析
[0455]
在实施例2中测试的小鼠进行进一步分析以进一步表征本发明的组合物对与严重哮喘相关的中性粒细胞性反应的作用。
[0456]
材料与方法
[0457]
在第18天去除器官。左肺叶收集在福尔马林中以进行改进型组织学分析。收集右肺叶(所有剩余叶)和去除血清以速冻和用于改进型分析。剩余bal流体速冻用于改进型分析。
[0458]
肺组织中发炎介体的测量(改进型分析)。分离用于定量发炎介体的右肺叶(所有剩余叶)速冻,用于随后通过市售多任务分析(merck-millipore)测量ifn-γ、il-1α、il-1β、cxcl1、ccl3、cxcl2、ccl5、il-17a、tnf-α、il-17f、il-23和il-33。根据制造商的说明书进行分析。
[0459]
血清和bal流体中抗体含量的测量(改进型分析)。通过elisa分析,在bal和血清中
测量房尘螨(hdm)特异性igg1和igg2a抗体产生。
[0460]
肺分离和组织学分析(改进型分析)。左肺叶固定在福尔马林中,接着埋入石蜡中,切片,且用苏木精和曙红和pas染色。如下盲法进行随后组织学评分:针对发炎(支气管周浸润和血管周浸润)和粘液产生,对每个样品的5个随机视场评分。发炎浸润用以下分级系统评分:
[0461]
0-正常
[0462]
1-轻度发炎浸润
[0463]
2-中度发炎浸润
[0464]
3-显著发炎浸润
[0465]
4-严重发炎浸润
[0466]
5-非常严重发炎浸润
[0467]
结果和分析
[0468]
实验结果展示于图47-64中。
[0469]
抗体含量的进一步分析揭露细菌菌株751的功效也反映在bal流体和血清中hdm特异性igg1含量降低(参见图47和49)。关于对igg2a含量的作用的确定结论无法绘图。总体来说,来自抗体分析的数据表明与对抗体同型切换的选择性作用相对比,与总体减少的发炎反应相关的减少。
[0470]
组织学分析证明来自bal流体的细胞分类计数,展示用菌株751处理的小鼠中细胞浸润减少(参见图51-53)。
[0471]
关于细胞因子含量,如针对实施例4,数据的散布和每一处理的误差线大,且阳性和阴性对照物似乎未如预期必要地起作用。也可能涉及的作用机制影响较早细胞因子反应,所述细胞因子反应在最终hdm气道激发后第4天不再可检测。归因于所检测的含量的变化性,当解释当前研究中的细胞因子数据时应谨慎一些。此变化性可以通过以下事实解释:分离肺组织用于不同分析,且归因于发炎的分布不规则,因此一个肺叶可能不具充分代表性或可以与其它小鼠中相同叶匹敌。尽管此变化性,展示菌株751对细胞因子含量的明确消炎作用,且阳性对照物抗il-17ab一般如预期起作用。
[0472]
在以上告诫下,图56、58、59、61和63中的数据表明用本发明的细菌菌株和尤其菌株751处理可以实现il-1b、ifng、rantes、mip-1a和kc(人类il-8的小鼠直系同源物)的含量减少,此可以表明与对基质或先天免疫细胞的趋化因子释放(和因此细胞募集)的影响相关的作用机制。这些细胞因子属于th17通路。将此数据集联系在一起,可以得出以下明确结论:在严重中性粒细胞性哮喘的此小鼠模型中菌株751高度有效保护小鼠避免发炎。
[0473]
实施例6-多发性硬化的小鼠模型中细菌接种物的功效
[0474]
概述
[0475]
向小鼠施用包含根据本发明的细菌菌株的组合物且随后用髓磷脂少突神经胶质细胞糖蛋白将小鼠免疫接种以诱发实验自身免疫性脑脊髓炎(eae)。eae是人类多发性硬化最常用的实验模型。发现本发明的组合物对发病率和疾病严重程度具有显著作用。
[0476]
菌株
[0477]
751:以登记号ncimb 42380寄存的细菌
[0478]
研究设计
[0479]
组:
[0480]
1.阴性对照组。用媒介物对照物处理(经口)。
[0481]
4.用治疗性细菌接种物菌株751处理(经口)。
[0482]
9.阳性对照组。用地塞米松处理(腹膜内)。
[0483]
10.未处理的对照组。
[0484]
每组小鼠数目=10
[0485]
第-14天到第27天:每日经口施用媒介物对照物(组1)。
[0486]
第-14天到第27天:每日经口施用治疗性细菌接种物(组4)。
[0487]
第0-28天:一周施用地塞米松(腹膜内)三次(组9)
[0488]
第0天:mog35-55(髓磷脂少突神经胶质细胞糖蛋白-2mg/ml)和cfa(2mg/ml mtb)1:1混合,产生1mg/ml溶液。100μl肽-cfa混合物皮下注射到每个后腿中。腹膜内施用百日咳毒素(300ng)。
[0489]
第1天:腹膜内施用百日咳毒素(300ng)。
[0490]
第7天-向前:测量发病率和称重,一周三次。
[0491]
终点和分析
[0492]
分析小鼠的发病率和疾病严重程度,一周三次。评分盲法进行。使用在0到5范围内的临床评分评估疾病严重程度,其中5指示小鼠死亡(参见以下临床评分系统)。
[0493]
监测
[0494]
在指示天数,将小鼠称重并观测疾病活动评分和发病率。
[0495]
疾病活动评分观测结果:
[0496]
0-与未免疫接种小鼠比较,运动功能无明显变化。
[0497]
0.5-尾部尖端无力。
[0498]
1.0-尾巴无力。
[0499]
1.5-尾巴无力和后腿抑制。
[0500]
2.0-尾巴无力和后腿虚弱。
[0501]
或-当观测行走时存在明显头部倾斜征象。平衡性差。
[0502]
2.5-尾巴无力和后腿打滑。
[0503]-或-存在强烈头部倾斜,引起小鼠有时跌倒。
[0504]
3.0-尾巴无力和后腿完全麻痹。
[0505]
3.5-尾巴无力和后腿完全麻痹。
[0506]
外加:小鼠绕笼移动,但当放在其侧面上时,不能恢复常态。
[0507]
后腿一起在身体一侧上。
[0508]
4.0-尾巴无力、后腿完全瘫痪和前腿部分瘫痪。
[0509]-小鼠最低限度地绕笼移动,但似乎警觉且进食
[0510]
4.5-后腿完全瘫痪和前腿部分瘫痪,不绕笼运动。
[0511]
立刻对小鼠执行安乐死并从笼去除。
[0512]
5.0因严重瘫痪而对小鼠执行安乐死。
[0513]
当动物具有等于或大于1的疾病活动评分时,认为其具有正发病评分。
[0514]
结果
[0515]
研究结果展示于图71和72中。
[0516]
阴性对照组中疾病诱发成功,其中媒介物对照物和未处理的对照展示高分。用菌株751处理的作用显著并且用菌株751处理的小鼠展现显著降低的发病率和疾病严重程度。实际上,发病率和疾病严重程度降低可以与阳性对照组相当。这些数据指示菌株751可用于治疗或预防多发性硬化。
[0517]
实施例7-小鼠癌症模型中细菌接种物的功效
[0518]
概述
[0519]
此研究在四个肿瘤模型中测试包含根据本发明的细菌菌株的组合物的功效。
[0520]
材料
[0521]
测试物质-细菌菌株#mrx004(菌株751)。
[0522]
参考物质-抗ctla-4抗体(克隆:9h10,目录号:be0131,同型:金黄地鼠igg1,bioxcell)。
[0523]
测试和参考物质媒介物-细菌培养基(酵母提取物、酪胨、脂肪酸培养基(ycfa))。注射到小鼠的每一天,抗体用pbs(货号:be14-516f,lonza,france)稀释。
[0524]
处理剂量-细菌:200μl中2
×
108。抗ctla-4以每次注射10mg/kg注射。抗ctla-4以根据小鼠的最近体重每次施用10ml/kg的剂量体积(即1只重量是20g的小鼠,将施用200μl测试物质)施用。
[0525]
投药途径-细菌接种物通过经口管饲法(经口,po)经由套管施用。套管每天净化。抗ctla-4注射到小鼠腹膜腔(腹膜内,ip)中。
[0526]
细菌菌株的培养条件-细菌菌株的培养条件如下:
[0527]
·
吸移10ml ycfa(自制备的10ml e&o实验室瓶子)到亨盖特管中
[0528]
·
将管密封且使用注射器输入和排气系统用co2冲洗
[0529]
·
将亨盖特管高压灭菌
[0530]
·
冷却时,将亨盖特管用1ml甘油原液接种
[0531]
·
将管放在静止37℃培育箱中约16小时。
[0532]
·
第二天,取1ml此次代培养物并且接种10ml ycfa(再次预先温热的冲洗的亨盖特管,都一式两份)
[0533]
·
将其放在静止37℃培育箱中5到6小时
[0534]
癌细胞系和培养条件-[0535]
使用的细胞系详述于下表中:
[0536]
细胞系类型小鼠品系来源emt-6乳癌balb/catccll/2(llc1)肺癌c57bl/6atcc crl1642hepa1-6肝细胞癌c57bl/6ipsen innovation
[0537]
从植入增生乳腺泡结节后的balb/ccrgl小鼠中产生的可移植的鼠类乳癌建立emt-6细胞系[73]。
[0538]
从负载由植入原发性路易斯肺癌引起的肿瘤的c57bl小鼠的肺建立ll/2(llc1)细胞系[74]。
[0539]
hepa 1-6细胞系是在c57/l小鼠中产生的bw7756小鼠肝癌的衍生物[75]。
[0540]
细胞培养条件-所有细胞系在37℃下在湿润气氛(5%co2、95%空气)中生长为单层。培养基和补充物指示于以下表中:
[0541][0542]
对于实验使用,通过在无钙或镁的汉克培养基(hanks'medium)(货号:be10-543f,lonza)中用胰蛋白酶-维尔希(versene)(货号:be17-161e,lonza)处理5分钟,附着肿瘤细胞从培养瓶脱离,并且通过添加完全培养基中和。细胞在血球计中计数,并且将通过0.25%锥虫蓝排除分析评估其存活力。
[0543]
动物使用-[0544]
匹配重量和年龄的健康雌性balb/c(balb/cbyj)小鼠从charles river(l'arbresles)获得用于emt6模型实验。
[0545]
匹配重量和年龄的健康雌性c57bl/6(c57bll6j)小鼠从charles river(l'arbresles)获得用于ll/2(llc1)和hepa1-6模型实验。
[0546]
动物根据felasa准则维持于spf健康状态,并且遵循根据法国和欧洲规定和实验室动物护理与使用nrc指南(nrc guide for the care and use of laboratory animals)的动物圈养与实验程序[76,77]。动物维持于圈养房间中控制环境条件下:温度:22
±
2℃,湿度55
±
10%,光周期(12h亮/12h暗),hepa过滤空气,每小时换气15次,不再循环。动物围栏具备无菌和足够空间,具有草垫材料、食物和水,环境和群居富集(圈养组)如下所述:通风架中的900cm2笼(货号:绿色,tecniplast),epicea草垫(safe),10kgy照射饮食(a04-10,safe),用于免疫胜任啮齿动物的精加工食物-r/m-h extrudate,水来自水瓶。
[0547]
实验设计和处理
[0548]
抗肿瘤活性,emt6模型
[0549]
处理时程-第一次给药开始视为第0天。在第0天,使用vivo软件(biosystemes,couternon,france)将未移植小鼠根据其个别体重随机化到9/8组。在第0天,小鼠接受媒介物(培养基)或细菌菌株。在第14天,所有小鼠如下所述移植emt-6肿瘤细胞。在第24天,来自阳性对照组的小鼠接受抗ctla-4抗体处理。
[0550]
处理时程概述于以下表中:
[0551][0552]
动物的监测如下所述进行。
[0553]
动物中emt6肿瘤的诱发-在第14天,通过皮下注射200μlrpmi1640中1
×
106个emt-6细胞到小鼠右侧腹中来诱发肿瘤。
[0554]
安乐死-当小鼠到达如下所述的人道终点时或开始给药后6周最大时间后,对每个小鼠执行安乐死。
[0555]
抗肿瘤活性,ll/2(llc1)模型
[0556]
处理时程-第一次给药开始视为第0天。在第0天,使用vivo软件(biosystemes,couternon,france)将未移植小鼠根据其个别体重随机化到9/8中的7组。在第0天,小鼠将接受媒介物(培养基)或细菌菌株。在第14天,所有小鼠如下所述移植ll/2肿瘤细胞。在第27天,来自阳性对照组的小鼠接受抗ctla-4抗体处理。
[0557]
处理时程概述于以下表中:
[0558][0559]
动物的监测如下所述进行。
[0560]
动物中ll/2(llc1)肿瘤的诱发-在第14天,通过皮下注射200μlrpmi 1640中1
×
106个ll/2(llc1)细胞到小鼠右侧腹中来诱发肿瘤。
[0561]
安乐死-当小鼠到达如下所述的人道终点时或开始给药后6周最大时间后,对每个小鼠执行安乐死。
[0562]
抗肿瘤活性,hepa1-6模型
[0563]
处理时程-第一次给药开始视为第0天。在第0天,使用vivo软件(biosystemes,couternon,france)将未移植小鼠根据其个别体重随机化到9组中的7组。在第0天,小鼠接受媒介物(培养基)或细菌菌株。在第14天,所有小鼠如下所述移植hepa 1-6
肿瘤细胞。在第16天,来自阳性对照组的小鼠接受抗ctla-4抗体处理。
[0564]
处理时程概述于以下表中:
[0565][0566]
动物的监测如下所述进行。
[0567]
通过脾内注射在动物中正位诱发hepa 1-6肿瘤细胞-在第14天,通过脾内注射将50μl rpmi 1640培养基中一百万(1
×
106)个hepa 1-6肿瘤细胞移植到小鼠中。简单地说,制造小的左肋骨下侧腹切口并将脾由腹取出。脾暴露在消毒纱布衬垫上,并且在目视控制下用27规格针注射细胞悬浮液。细胞接种后,切除脾。
[0568]
安乐死-当小鼠到达如以下部分中所描述的人道终点时或开始给药后6周最大时间后,对每个小鼠执行安乐死。
[0569]
安乐死时肿瘤负荷的评估-在结束时,收集肝且称重。
[0570]
动物监测
[0571]
临床监测-每周用测径规测量肿瘤的长度和宽度两次并且通过此式估计肿瘤体积[78]:
[0572][0573]
人道终点[79]:疼痛、痛苦或忧伤的征象:疼痛姿势、疼痛面部表情、行为;肿瘤超过正常体重10%,但未超过2000mm3;肿瘤干扰步行或营养;肿瘤溃烂或组织糜烂;连续3日体重保持丧失20%;身体情况差、憔悴、恶病质、脱水;长期缺乏对外界刺激的有意反应;快速困难的呼吸、贫血、大量出血;神经病学征象:转圈、惊厥、瘫痪;体温持续下降;腹部胀大。
[0574]
麻醉-异氟烷气体麻醉用于所有程序:手术或肿瘤接种、静脉内注射、血液收集。氯胺酮和甲苯噻嗪麻醉用于趋实体性手术程序。
[0575]
止痛-卡洛芬(carprofen)或多峰卡洛芬/丁丙诺啡(buprenorphine)止痛方案针对手术程序的严重程度调整。为所有疼痛程序提供非药理学护理。另外,在主治兽医建议下提供不干扰研究(主题处理)的药理学护理。
[0576]
安乐死-通过气体麻醉过度剂量(异氟烷)对动物执行安乐死,接着子宫颈移位或放血。
[0577]
结果
[0578]
抗肿瘤活性,emt6模型
[0579]
结果展示于图73中。用本发明的细菌菌株处理相对于两个阴性对照物明显减少肿
瘤体积。如将预期,阳性对照物也减少肿瘤体积。
[0580]
抗肿瘤活性,ll/2(llc1)模型
[0581]
结果展示于图74中。阴性和阳性对照物未如预期表现,因为肿瘤体积在用阳性对照物处理的小鼠比阴性对照组中更大。然而,用本发明的细菌菌株处理的小鼠中的肿瘤体积可与阳性对照组相当,此与有益治疗作用一致。
[0582]
抗肿瘤活性,hepa1-6模型
[0583]
结果展示于图75中。未处理的阴性对照不如预期表现,因为此组中比另一组中肝重量低。然而,媒介物阴性对照组和阳性对照组都如预期表现,因为单独用媒介物处理的小鼠比用抗ctla4抗体处理的小鼠的肝大,反映了媒介物阴性对照组中肿瘤负荷更大。相对于媒介物阴性对照组中的小鼠,用本发明的细菌菌株处理明显减少肝重量(且因此肿瘤负荷)。
[0584]
这些数据表明菌株751/mrx004可用于治疗或预防癌症,并且尤其减少乳癌、肺癌和肝癌中的肿瘤体积。
[0585]
实施例8-ycfa培养基中与人类细胞的附着
[0586]
概述
[0587]
在ycfa培养基中在3个不同时间点确定菌株751和多种短双歧杆菌菌株与人类细胞结合的程度。附着于人类细胞的细菌再悬浮于培养基中并接着分析培养基的光密度-光密度越高,细菌细胞数目越高,因此,细菌细胞与人类细胞结合的程度越高。发现与短双歧杆菌参考菌株相比,751菌株展示降低的与人类细胞附着的程度。
[0588]
结果与分析
[0589]
实验结果展示于图76中。
[0590]
如图76中所示,短双歧杆菌菌株展示在所有时间点,与人类细胞附着的程度高。另一方面,751菌株大幅度降低与人类细胞附着的程度。因此,菌株751与人类细胞的低附着可以增加本发明的组合物对il-17或th17通路以及对由il-17或th17通路介导的疾病的有益作用。
[0591]
实施例9-检测胞外多糖产生的分析
[0592]
概述
[0593]
在37℃下分析本发明的细菌菌株(751)和多种短双歧杆菌菌株的胞外多糖(eps)产生水平48小时,并且在30℃下分析72小时。eps是通过某些细菌产生的结合于细菌细胞外表面的多糖。细菌表面上的eps含量可以使用结合于多糖的刚果红分析来确定。刚果红吸亮度的强度越高,表明细菌表面上eps的浓度越高。发现本发明的细菌菌株产生和结合的eps比短双歧杆菌菌株多。
[0594]
结果与分析
[0595]
此实验结果展示于图77中。
[0596]
如图77中所示,本发明的细菌菌株展示在两个温度与时间点刚果红吸亮度比短双歧杆菌菌株大。因此,本发明的菌株显示更大的eps产生和更大含量的细胞外结合的eps。因为eps使细菌能够结合于粘液和上皮细胞,所以本发明的细菌菌株可用于与病原性细胞竞争上皮细胞上和粘膜内的结合位点。因此,本发明的细菌菌株可用于调节微生物组并治疗多种与微生物组相关的疾病。
[0597]
实施例10-稳定性测试
[0598]
含有至少一种本文中描述的细菌菌株的本文中描述的组合物存储在密封容器中25℃或4℃下并且容器置于具有30%、40%、50%、60%、70%、75%、80%、90%或95%相对湿度的气氛中。1个月、2个月、3个月、6个月、1年、1.5年、2年、2.5年或3年后,至少50%、60%、70%、80%或90%的细菌菌株应残留,如以通过标准规方案测定的菌落形成单位测量。
[0599]
实施例11-mrx004的结合和释放的胞外多糖产生的分析
[0600]
为了提取eps,将mrx004在10ml ycfa中培养,直到其到达指数生长晚期,此时通过离心分离细菌细胞和上清液。细胞用pbs洗涤一次,以去除任何残余培养基。通过用冰冷100%乙醇处理(在4℃下在缓缓搅拌下过夜),分泌或释放的eps(eps-r)从培养上清液沉淀。为了提取荚膜或结合的eps(eps-b),细胞与0.05m edta一起培育(在4℃下在缓缓搅拌下过夜),并收集来自此处理的上清液,并随后用100%冰冷乙醇(在4℃下在缓缓搅拌下过夜)处理,以使eps-b沉淀。沉淀eps-b和eps-r通过离心成球粒,并且在层流罩中短暂干燥,接着使其再悬浮于足够无菌超纯水中,以实现均一溶液。为了进一步纯化样品,其针对无菌超纯水,以1:100的比率透析48小时,缓冲液改变3次。eps-b和eps-r使用苯酚-硫酸法,使用葡萄糖作为标准来定量。使用此分析,发现mrx004产生的eps-r(115μg)量大于eps-b(17μg)(图78)。
[0601]
实施例12-mrx004与caco-2细胞的附着分析
[0602]
使用体外共培养分析,利用caco-2肠上皮细胞分析mrx004与宿主细胞的附着。caco-2细胞以1
×
10的密度接种,细菌在10ml ycfa中培养,直到其到达指数生长晚期,此时其成球,用pbs洗涤两次,并再悬浮于无抗生素的细胞培养基中。调节细菌密度以获得大约10:1的感染复数(multiplicity of infection,moi)(通过使用wasp标准方案,涂铺在ycfa琼脂上来证实),并且mrx004与caco-2细胞在缺氧条件中在37℃下共同培育2小时。随后去除培养基,并且通过用pbs洗涤caco-2细胞三次来去除未结合的细菌。使细菌结合的caco-2细胞溶解,并用0.1%triton x-100处理,从容器去除,并且使用wasp,将50μl体积的稀溶解产物涂铺在ycfa琼脂中。通过计数从溶解产物回收的细菌的数目并将此表示成总细菌百分比来计算附着。发现mrx004显示低水平的与caco-2细胞的附着(总培养的0.3%)(图79)。
[0603]
实施例13-酶活性的表征
[0604]
分析特征指数测试系统由含有分析在细菌物种中的酶活性的小型化生物化学测试的条带组成。mrx004(菌株751,以寄存编号ncimb 42380寄存的细菌)使用两个api测试系统表征:rapid id32a,此系统特别为厌氧物种设计并且涵盖碳水化合物、氨基酸和硝酸盐代谢以及碱性磷酸酶活性的测试;和50ch,此系统测试49个碳水化合物来源的发酵,并且可以连同用于分析厌氧物种的chl培养基一起使用。
[0605]
在菌落上,根据制造商的说明书,进行rapid id 32a测试。简单地说,细菌在厌氧工作站中在ycfa琼脂上在37℃下培养24小时。使用无菌5μl接种环,从盘去除菌落,并再悬浮于悬浮培养基的2ml安瓿中,直到实现大致等于mcfarland标准编号4的密度的密度。五十五微升细菌悬浮液加入rapid id 32a条带上的每个杯形器,并且用两滴矿物油覆盖尿素酶测试。条带被塑料盖覆盖,并在37℃下有氧培育4小时,接着使用以下试剂使杯形
器的底端行显影:nit:1滴nit1和nit2每一者;ind:1滴james试剂;所有剩余杯形器:1滴fastblue试剂。条带在室温下培育5分钟,接着记录每个杯形器的颜色并且分配阴性、中等阳性或阳性的值。
[0606]
rapid id 32a分析的结果展示在图80中。mrx004测得对若干碳水化合物来源,即α-半乳糖苷酶和β-半乳糖苷酶、α-葡糖苷酶和β-葡糖苷酶、α-阿拉伯糖、甘露糖和棉子糖以及氨基酸精氨酸、脯氨酸、苯丙氨酸、亮氨酸、酪氨酸、甘氨酸和组氨酸的发酵呈阳性。有趣地,已经报告了这些氨基酸中的一些在哮喘中的作用。举例来说,已经报告了苯丙氨酸和组氨酸的血浆浓度增加与哮喘中的副作用有关,所述副作用包括增加的发炎、组胺产生和气道过度反应。另外,精氨酸代谢与哮喘发病机理相关,因为已经在儿科患者中报告精氨酸代谢物l-鸟氨酸的含量增加,并且施用精氨酸减弱体内哮喘模型中的发炎。基于这些报告,可能mrx004的氨基酸代谢可能与此菌株的抗哮喘作用相关。
[0607]
在mrx004与四个短双歧杆菌型菌株之间进行比较rapid id32a分析,所述四个短双歧杆菌型菌株在图80b中注释为bif ref 1(dsm 20091)、bif ref 2(dsm 20213)、bif ref 6(jcm 7017)和bif ref7(ucc2003)。此分析证明了mrx004是测得使多糖棉子糖发酵的唯一菌株,其可能是显著的,因为棉子糖与例如胞外多糖等细菌组分的产生相关,并且据报告棉子糖发酵还可以赋予对宿主的作用,例如增加的盲肠丁酸盐、增加的胃肠增殖和重量减轻。
[0608]
进行50ch测试以进一步检查mrx004中的碳水化合物代谢。根据制造商的说明书,细菌在厌氧工作站中在10ml ycfa肉汤中在37℃下培养16-18小时。此培养物在10mlchl培养基中稀释,以致实现大致等于mcfarland标准编号2的密度,并且110μl此混合物用于接种一组50ch测试条带上的每个杯形器。测试条带在厌氧工作站中湿润培育箱中37℃下培育48小时,接着记录每个杯形器的颜色并且分配阴性、中等阳性、阳性或可疑的值。
[0609]
使用50,测得mrx004对于用于以下碳水化合物来源呈阳性:阿米酮(淀粉)、扁桃苷、熊果苷、纤维二糖、七叶苷、半乳糖、龙胆二糖、葡萄糖、糖原、果糖、岩藻糖、乳糖、麦芽糖、甘露糖、甘露糖醇、蜜二糖、松三糖、甲基α-d-果聚糖、n-乙酰葡糖胺、核糖、蔗糖(蔗糖)、水杨苷、山梨糖醇、海藻糖、松二糖和木糖醇。这些结果与针对rapid id 32a测试获得的结果相关,因为mrx004在两个测试系统中证实半乳糖、葡萄糖、甘露糖和棉子糖的发酵。有趣地,基于文献中的报告作用,一些mrx004碳水化合物底物,即半乳糖和果糖,可能与此菌株的作用机制相关。来源于肉来源的半乳糖α-1,3-半乳糖是过敏反应已知的过敏原和病原体,并且膳食果糖的摄入含量与增加的哮喘严重程度相关。综上所述,mrx004的两组数据表明此菌株的代谢可能在其抗哮喘作用中起作用。
[0610]
实例14-染色体组分析
[0611]
使用blastn作为程序的blast+2.3.0套的一部分,比较菌株mrx004和短双歧杆菌参考菌株1、2、6和7的基因组含量。在整个分析中采用10e-5的最大e-值截止评分。
[0612]
鉴别存在于菌株mrx004的基因组中,但在短双歧杆菌参考菌株1(dsm 20091)、2(dsm 20213)、6(jcm 7017)和7(ucc2003)中缺乏的333个基因(表1)。频繁地观测到表1中列出的许多基因,在短双歧杆菌菌株间高变[80]。正如所料,可变区包括编码与碳水化合物代
谢和转运有关的蛋白质的基因、噬菌体相关基因、可动元件以及预测编码未知功能的蛋白质或基因的173个基因。
[0613]
存在于mrx004中,但在短双歧杆菌参考菌株1、2、6和7中缺乏的基因在表1中列出。未突出的基因在四个参考菌株中超过一个中缺乏。存在于mrx004中,但不存在于许多短双歧杆菌参考菌株中的大量基因表明mrx004与这些已知的短双歧杆菌菌株不同和/或可与其区别开。用单下划线突出的基因存在于mrx004中,但在短双歧杆菌参考菌株1中缺乏。用双下划线和粗体突出的基因存在于mrx004中,但在短双歧杆菌参考菌株2中缺乏。用斜体突出的基因存在于mrx004中,但在短双歧杆菌参考菌株6中缺乏。在blastn分析中采用10e-5的最大e-值截止评分。
[0614]
表1
[0615]
[0616]
[0617]
[0618]
[0619]
[0620]
[0621]
[0622]
[0623]
[0624]
[0625][0626]
序列
[0627]
seq id no:1(菌株751的共同16s rrna序列)
[0628][0629]
seq id no:2(菌株751基因组序列)-参见电子序列表。
[0630]
参考文献
[0631]
[1]spor et al.(2011)nat rev microbiol.9(4):279-90.
[0632]
[2]eckburg et al.(2005)science.10;308(5728):1635-8.
[0633]
[3]macpherson et al.(2001)microbes infect.3(12):1021-35
[0634]
[4]macpherson et al.(2002)cell mol life sci.59(12):2088-96.
[0635]
[5]mazmanian et al.(2005)cell 15;122(1):107-18.
[0636]
[6]frank et al.(2007)pnas 104(34):13780-5.
[0637]
[7]scanlan et al.(2006)j clin microbiol.44(11):3980-8.
[0638]
[8]kang et al.(2010)inflamm bowel dis.16(12):2034-42.
[0639]
[9]machiels et al.(2013)gut.63(8):1275-83.
[0640]
[10]wo 2013/050792
[0641]
[11]wo 03/046580
[0642]
[12]wo 2013/008039
[0643]
[13]wo 2014/167338
[0644]
[14]goldin and gorbach(2008)clin infect dis.46suppl 2:s96-100.
[0645]
[15]azad et al.(2013)bmj.347:f6471.
[0646]
[16]masco et al.(2003)systematic and applied microbiology,26:557-563.
[0647]
[17]et al.(2011)j.microbiol.methods,87(1):10-6.
[0648]
[18]ye et al.(2015)plos one.10(1):e0117704.
[0649]
[19]fabro et al.(2015)immunobiology.220(1):124-35.
[0650]
[20]yin et al.(2014)immunogenetics.66(3):215-8.
[0651]
[21]chelnvappa et al.(2014)clin exp immunol.175(2):316-22.
[0652]
[22]schieck et al.(2014)j allergy clin immnunol.133(3):888-9l.
[0653]
[23]balato et al.(2014)j eur acad dermatol venereol.28(8):1016-24.
[0654]
[24]monteleone et al.(2011)bmc medicine.2011,9:122.
[0655]
[25]fahy(2009)proc am thorac soc 6.256-259
[0656]
[26]miossec and kolls(2012)nat rev drug discov.11(10):763-76.
[0657]
[27]yang et al.(2014)trends pharmacol sci.35(10):493-500.
[0658]
[28]koenders et al.(2006)j.immunol.176:6262-6269.
[0659]
[29]amedei et al.(2012)int j mol sci.13(10):13438-60.
[0660]
[30]shabgah et al.(2014)postepy.dermatol.alergol.31(4):256-61.
[0661]
[31]zhang(2015)inflammation.aug 23.
[0662]
[32]sun et al.(2015)cytokine.74(1):76-80.
[0663]
[33]mucientes et al.(2015)br j ophthalmol.99(4):566-70.
[0664]
[34]jawad et al.(2013)ocul immunol inflamm.21(6):434-9.
[0665]
[35]maya et al.(2014)j.ophthalmology.310329
[0666]
[36]chi et al.(2007)j.allergy and clinical immunology.119(5):1218-1224.
[0667]
[37]chi et al.(2008)investigative ophthalmology&visual science.49(7):3058-3064.
[0668]
[38]luger and caspi(2008)semin.immnunopathol.30(2):134-143.
[0669]
[39]numasaki et al.(2003)blood.101:2620-2627.
[0670]
[40]zhang et al.(2008)biochem.biophys.res.commun.374:533-537.
[0671]
[41]karin(2006)nature.441:431-436.
[0672]
[42]faghih et al.(2013).iranian journal of immunology.10(4):193-204.
[0673]
[43]numasaki et al.(2005)j.immunol.175:6177-6189
[0674]
[44]hammerich and tacke(2014)clin exp gastroenterol.7:297-306.
[0675]
[45]haabeth et al.(2012)oncoimmunology 1(1):1146-1152.
[0676]
[46]lejeune et al.(2006)cancer immun.6:6
[0677]
[47]pace et al.(1983)pnas.80:8782-6.
[0678]
[48]sgadari et al.(1996)pnas.93:13791-6.
[0679]
[49]arenberg et al.(1996)j.exp.med.184:981-92.
[0680]
[50]sgadari et al.(1997)blood.89:2635-43.
[0681]
[51]miyamoto-shinohara et al.(2008)j.gen.appl.microbiol.,54,9-24.
[0682]
[52]cryopreservation and freeze-drying protocols,ed.by day and mclellan,humana press.
[0683]
[53]leslie et al.(1995)appl.environ.microbiol.61,3592-3597.
[0684]
[54]mitropoulou et al.(2013)j nutr metab.(2013)716861.
[0685]
[55]kailasapathy et al.(2002)curr issues intest microbiol.3(2):39-48.
[0686]
[56]handbook of pharmaceutical excipients,2nd edition,(1994),edited by a wade and pj weller
[0687]
[57]remington
′
s pharmaceutical sciences,mack publishing co.(a.r.gennaro edit.1985)
[0688]
[58]handbook of microbiological media,fourth edition(2010)ronald atlas,crc press.
[0689]
[59]maintaining cultures for biotechnology and industry(1996)jcnnie c.hunter-cevera,academic press
[0690]
[60]strobel(2009)methods mol biol.581:247-61.
[0691]
[61]gennaro(2000)remington:the science and practice of pharmacy.20th edition,isbn:0683306472.
[0692]
[62]molecular biology techniques:an intensive laboratory course,(ream et al.,eds.,1998,academic press).
[0693]
[63]methods in enzymology(s.colowick and n.kaplan,eds.,academic press,inc.)
[0694]
[64]handbook of experimental immunology,vols.i-iv(d.m.weir and c.c.blackwell,eds,1986,blackwell scientific publications)
[0695]
[65]sambrook et al.(2001)molecular cloning:a laboratory manual,3rd edition(cold spring harbor laboratory press).
[0696]
[66]handbook of surface and colloidal chemistry(birdi,k.s.ed.,crc press,1997)
[0697]
[67]ausubel et al.(eds)(2002)short protocols in molecular biology,5th edition(current protocols).
[0698]
[68]pcr(introduction to biotechniques series),2nd ed.(newton&graham eds.,1997,springer verlag)
[0699]
[69]current protocols in molecular biology(f.m.ausubel et al.,eds.,1987)supplement 30
[0700]
[70]smith&waterman(1981)adv.appl.math.2:482-489.
[0701]
[71]brand et al.(2007)noture protocols.2(5):1269-1275
[0702]
[72]jiao et al.(2014)immunopathology and infectious diseases.184(4):1085-93.
[0703]
[73]rockwell et al.,(1972)j natl cancer inst.49:735-49.
[0704]
[74]bertram and janik(1980)cancer lett.11:63-73.
[0705]
[75]darlington(1987)meth enzymol.151:19-38.
[0706]
[76]principe d
’é
thique de l’exp
é
rimentation animale,directive n
°
2010/63 cee 22nd september 2010,n
°
2013-118lst february2013.
[0707]
[77]guide for the care and use of laboratory animals:eighth edition.the national academies press;2011
[0708]
[78]simpson-herren and lloyd(1970)cancer chemother rep.54:143-74.
[0709]
[79]workman et al.(2010)br.j.cancer.102:1555-77.
[0710]
[80]bottacini et al(2014)bmc genomics.15:170,doi:10.1186/1471-2164-15-170,pmid:24581150
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1