包含糖胺聚糖衍生物和趋化因子受体活性调节材料的组合物的制作方法
包含糖胺聚糖衍生物和趋化因子受体活性调节材料的组合物
1.本技术是中国专利申请201680031602.0的分案申请,原申请201680031602.0的申请日为2016年05月30日,其名称为“包含糖胺聚糖衍生物和趋化因子受体活性调节材料的组合物”。
技术领域
2.本发明涉及包含糖胺聚糖衍生物和趋化因子受体活性调节材料的组合物和医药组合物。
背景技术:
3.参与病理性的血管新生的后眼部疾病即老年性黄斑变性症(age
‑
related macular degeneration:以下,简记作“amd”)大致分为渗出型和萎缩型。渗出型amd是以由于黄斑部的视网膜色素上皮细胞
‑
布鲁赫膜
‑
脉络膜的变化而发生的脉络膜新生血管(choroidal neovascularization:以下,简记作“cnv”)和其增殖变化为原态的疾病,进行也快,产生持久的高度的视力下降。
4.已知的是,作为cc趋化因子受体(以下,简记作“ccr”)之一的ccr3在从渗出型amd患者采集的cnv的血管内皮细胞中特异性表达(例如参照nature,2009,460:225
‑
230.),作为amd病态模型的激光诱导小鼠cnv模型中,ccr3抑制剂的玻璃体内给予抑制cnv,对渗出型amd治疗是有用的(例如参照美国专利第8592482号说明书)。
5.另一方面,作为硫酸化的糖胺聚糖(以下,将糖胺聚糖简记作“gag”)的硫酸乙酰肝素、肝素对激光诱导小鼠cnv模型的玻璃体内给予抑制cnv,对渗出型amd治疗是有用的(例如参照国际公开第2011/122321号)。另外,heebeom koo等人将透明质酸(以下,简记作“ha”)中导入有5β
‑
胆烷酸的化合物进行玻璃体内给予,并使用病理组织标本评价眼内分布(例如参照biomaterials,2012,33:3485
‑
3493.)。
6.现有技术文献
7.专利文献
8.专利文献1:美国专利第8592482号说明书
9.专利文献2:国际公开第2011/122321号
10.非专利文献
11.非专利文献1:nature,2009,460:225
‑
230.
12.非专利文献2:biomaterials,2012,33:3485
‑
3493.
技术实现要素:
13.发明要解决的问题
14.然而,为了调制美国专利第8592482号说明书中记载的、具有药效的浓度的ccr3抑制剂,包含规定量以上的dmso等增溶剂的溶液在玻璃体内刚刚给予后,有时产生接近于玻璃体的组织(例如晶状体等)的急剧的变性等。而且biomaterials,2012,33:3485
‑
3493.和
国际公开第2011/122321号中没有公开也没有暗示关于趋化因子受体活性调节材料的内容。
15.本发明的目的在于,提供:伴随着给予的急剧的组织变性被抑制、显示出优异的趋化因子受体活性调节作用、对后眼部疾病等的优异的药效的组合物和医药组合物。
16.用于解决问题的方案
17.用于解决前述课题的具体方案如以下所述,本发明包含以下的方案。
18.<1>一种组合物,其包含gag衍生物和趋化因子受体活性调节材料。
19.<2>根据<1>所述的组合物,其中,gag衍生物为导入了疏水基团的gag。
20.<3>根据<1>或<2>所述的组合物,其中,gag衍生物为gag交联体。
21.<4>根据<1>~<3>中任一项所述的组合物,其包含gag衍生物与趋化因子受体活性调节材料的共价键合物。
22.<5>根据<1>~<4>中任一项所述的组合物,其中,gag衍生物为ha或硫酸软骨素(以下,简记作“cs”)的衍生物。
23.<6>根据<1>~<5>中任一项所述的组合物,其中,趋化因子受体活性调节材料为趋化因子受体拮抗剂。
24.<7>一种医药组合物,其包含<1>~<6>中任一项所述的组合物。
25.<8>根据<7>所述的医药组合物,其为后眼部疾病处置剂。
26.<9><1>~<6>中任一项所述的组合物作为后眼部疾病处置的应用。
27.<10>一种后眼部疾病的处置方法,其包括:将<1>~<6>中任一项所述的组合物给予至玻璃体内。
28.发明的效果
29.根据本发明,可以提供:伴随着给予的急剧的组织变性被抑制、显示出优异的趋化因子受体调节作用、对后眼部疾病等的优异的药效的组合物和医药组合物。
附图说明
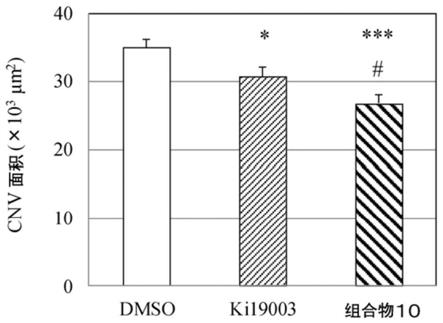
30.图1为示出对动物模型玻璃体内给予了本实施方式的导入了ki19003的cs衍生物时的、cnv的抑制作用的图。
31.图2为示出对动物模型玻璃体内给予了本实施方式的导入了ki19003的cs衍生物时的、cnv的抑制作用的图。
32.图3为示出对动物模型玻璃体内给予了本实施方式的导入了ki19003的cs衍生物时的、cnv的抑制作用的图。
33.图4为示出对动物模型玻璃体内给予了本实施方式的包含sb328437和cs衍生物的组合物时的、cnv的抑制作用的图。
34.图5为示出对动物模型玻璃体内给予了本实施方式的包含sb225002和ha衍生物的组合物时的、cnv的抑制作用的图。
35.图6为示出对动物模型玻璃体内给予了本实施方式的包含gw766994和ha衍生物的组合物时的、cnv的抑制作用的图。
36.图7为示出对动物模型玻璃体内给予了本实施方式的包含ki19003和ha衍生物的组合物时的、cnv的抑制作用的图。
37.图8为示出对动物模型玻璃体内给予了本实施方式的包含azd3778和ha衍生物的组合物时的、cnv的抑制作用的图。
38.图9为示出对动物模型玻璃体内给予了本实施方式的包含sb328437和ha衍生物的组合物时的、cnv的抑制作用的图。
39.图10为示出对动物模型玻璃体内给予了本实施方式的包含gw766994和gag衍生物的组合物时的、cnv的抑制作用的图。
40.图11为示出对动物模型玻璃体内给予了本实施方式的包含ki19003和gag衍生物的组合物时的、cnv的抑制作用的图。
41.图12为示出对动物模型玻璃体内给予了本实施方式的包含gw766994和cs衍生物的组合物时的、cnv的抑制作用的图。
42.图13为示出对动物模型玻璃体内给予了本实施方式的包含rs504393和ha衍生物的组合物时的、cnv的抑制作用的图。
43.图14为示出对动物模型玻璃体内给予了本实施方式的包含ps372424和ha衍生物的组合物时的、cnv的抑制作用的图。
44.图15为示出对动物模型玻璃体内给予了本实施方式的包含gw766994和cs衍生物的组合物时的、cnv的抑制作用的图。
45.图16为确认了对动物模型玻璃体内给予了cs时的、cnv的抑制作用的图。
46.图17为确认了对动物模型玻璃体内给予了cs或cs衍生物时的、cnv的抑制作用的图。
47.图18a为示出对动物玻璃体内给予了ki19003溶液后的、眼内状态的图像。
48.图18b为示出对动物玻璃体内给予了sb328437溶液后的、眼内状态的图像
49.图18c为示出对动物玻璃体内给予了gw766994溶液后的、眼内状态的图像。
50.图18d为示出对动物玻璃体内给予了本实施方式的包含ki19003和cs衍生物的组合物后的、眼内状态的图像。
51.图18e为示出了对动物玻璃体内给予本实施方式的包含gw766994和cs衍生物的组合物后的、眼内状态的图像。
52.图18f为示出对动物玻璃体内给予了本实施方式的包含ki19003和cs衍生物的组合物后的、眼内状态的图像。
53.图18g为示出对动物玻璃体内给予了本实施方式的包含ki19003和cs衍生物的组合物后的、眼内状态的图像。
54.图18h为示出对动物玻璃体内给予了本实施方式的包含sb328437和ha衍生物的组合物后的、眼内状态的图像。
55.图19a为示出对动物玻璃体内给予了rs504393溶液后的、眼内状态的图像。
56.图19b为示出对动物玻璃体内给予了ps372424溶液后的、眼内状态的图像。
57.图19c为示出对动物玻璃体内给予了本实施方式的包含rs504393和ha衍生物的组合物后的、眼内状态的图像。
58.图19d为示出对动物玻璃体内给予了本实施方式的包含ps372424和ha衍生物的组合物后的、眼内状态的图像。
59.图19e为示出对动物玻璃体内给予了本实施方式的包含gw766994和cs衍生物的组
合物后的、眼内状态的图像。
60.图19f为示出对动物玻璃体内给予了本实施方式的包含gw766994和cs衍生物的组合物后的、眼内状态的图像。
具体实施方式
61.本说明书中,术语“步骤”当然包括独立的步骤,还包括无法与其他步骤明确区分也可以达成该步骤的期望目的的方案。而且,对于组合物中的成分的含量,属于该成分的物质在组合物中存在多个时,只要没有特别说明,则是指组合物中存在的该多个物质的合计量。
62.以下,根据发明的实施方式对本发明进行详细说明。
63.(1)组合物
64.本发明的组合物含有gag衍生物和趋化因子受体活性调节材料。本发明的组合物中,gag衍生物与趋化因子受体活性调节材料可以以分别独立的化合物的形式含有,gag衍生物与趋化因子受体活性调节材料也可以以通过物理相互作用或化学键合进行复合化的复合物的形式含有。
65.作为该“gag衍生物”,例如可以举出:源自gag的基团与疏水基团根据情况借助间隔物基团进行共价键合的导入了疏水基团的gag;gag在分子内或分子间进行交联而成的gag交联体;包含源自gag的基团和间隔物基团的化合物等。
66.而且,作为“导入了疏水基团的gag”,例如可以举出:利用与gag所具有的羧基形成的酰胺键或者酯键、或与gag所具有的羟基形成的醚键或者酯键,疏水基团根据情况借助间隔物基团进行共价键合而得到的化合物。而且,作为“gag交联体”,例如可以举出gag在分子内或分子间、gag所具有的羧基或羟基借助交联性基团彼此进行共价键合而形成的化合物;gag在分子内或分子间、gag所具有的羧基和羟基不借助交联性基团地交联而形成的化合物等。
67.构成gag衍生物的gag是具有由氨基糖和糖醛酸(或半乳糖)构成的二糖的重复结构的酸性多糖。作为这样的gag的例子,可以举出ha、软骨素、cs、硫酸皮肤素和硫酸角质素,其中,优选ha和cs。另外,gag所具有的羧基等酸性官能团可以为不形成盐的游离状态,也可以为形成药学上能允许的盐的状态。
68.作为药学上能允许的盐,例如可以举出钠盐、钾盐等与碱金属离子的盐、镁盐、钙盐等与碱土金属离子的盐。其中,从对生物体的适合性和亲和性的观点出发,优选药学上允许的与碱金属离子的盐、更优选钠盐。
69.gag的重均分子量没有特别限定,可以根据目的等而适宜选择。作为gag的重均分子量,可以举出500da~1000万da或4万da~500万da。gag的重均分子量可以通过光散射法测定。
70.构成gag衍生物的gag可以根据其种类用公知的方法制造。作为这样的方法,例如可以举出自动物来源原料的提取纯化、自gag产生菌等的培养纯化、糖链修饰、糖链合成等。
71.导入了疏水基团的gag中的“源自gag的基团”是指,从gag所具有的羧基除去羟基而形成的基团,从gag所具有的羟基等除去氢原子而形成的基团等。
72.导入了疏水基团的gag中的“疏水基团”没有特别限定,可以举出:源自作为胆汁酸
的胆酸、石胆酸、脱氧胆酸、它们的基本骨架即胆烷酸等脂环式化合物的基团;源自硬脂酸、油酸等脂肪酸的基团,优选选自它们中的至少1种,更优选源自脂环式化合物的基团,进一步优选源自胆烷酸、尤其是5β
‑
胆烷酸的基团。此处,“源自脂环式化合物的基团”是指,从脂环式化合物除去氢原子或羟基而形成的基团,“源自脂肪酸的基团”是指,从脂肪酸除去羟基而形成的基团。
73.另外,疏水基团对gag的导入率没有特别限定,可以根据目的等而适宜选择,例如可以举出0.1~80mol%。
74.导入了疏水基团的gag可以使源自gag的基团借助间隔物基团与疏水基团进行共价键合。
[0075]“间隔物基团”是指,可以将2个基团用共价键连接的2价基团,具体而言,可以举出:
[0076]
‑
nh
‑
(ch2)
m
‑
nh
‑
、
‑
c(=o)
‑
(ch2)
m
‑
nh
‑
、
[0077]
‑
c(=o)
‑
(ch2)
m
‑
c(=o)
‑
、
‑
nh
‑
(ch2)
m
‑
o
‑
、
[0078]
‑
nh
‑
ch2‑
(och2)
m
‑
nh
‑
、
‑
nh
‑
ch2‑
(och2)
m
‑
o
‑
、
[0079]
‑
c(=o)
‑
ch2‑
(och2)
m
‑
nh
‑
、
[0080]
‑
c(=o)
‑
ch2‑
(och2)
m
‑
(c=o)
‑
、
[0081]
‑
c(=o)
‑
(ch2)
m
‑
o
‑
、
‑
c(=o)
‑
ch2‑
(och2)
m
‑
o
‑
等,优选选自它们中的至少1种,更优选下式:
[0082]
‑
nh
‑
(ch2)
m
‑
nh
‑ꢀꢀ
(i)
[0083]
‑
c(=o)
‑
(ch2)
m
‑
nh
‑ꢀꢀ
(ii)或
[0084]
‑
nh
‑
(ch2)
m
‑
o
‑ꢀꢀ
(iii)
[0085]
所示的基团。此处,m彼此独立地表示2~12的整数,优选2~5,特别优选2。
[0086]
需要说明的是,间隔物基团不限定于直链,间隔物基团中所含的亚甲基上也可以具有烷基、芳基、羟基、卤素原子等取代基。而且,亚甲基中的至少一部分可以被氧原子、芳基等所取代。
[0087]
导入了疏水基团的gag可以通过使gag、形成疏水基团的化合物、和根据需要使用的形成间隔物基团的化合物使用缩合剂等进行结合的通常的方法来制造。
[0088]
gag交联体例如可以如下形成:使用具有2个交联性基团的交联性化合物,使gag所具有的羧基、羟基中的至少一者借助交联性基团彼此共价键合,从而形成。作为交联性化合物,可以举出具有光反应性基团、聚合性官能团、氨基或巯基的化合物,优选为具有光反应性基团或聚合性官能团的化合物。作为gag的交联方法,例如可以举出下述4个类别,其方法没有限定。
[0089]
(a)利用甲醛、戊二醛那样的醛交联剂进行的交联。
[0090]
(b)利用gag所具有的羧基与gag所具有的羟基进行的、不使用交联性基团的自交联。
[0091]
(c)利用二环氧化物化合物、二乙烯基砜、二胺化合物、二酰肼化合物等均聚二官能性交联剂、表卤代醇等杂二官能性交联剂进行的交联。
[0092]
(d)利用使导入了光反应性基团、聚合性官能团、氨基、巯基、卤素原子等官能团的gag、与对上述官能团导入了互补的反应性基团的gag、或具有2个该反应性基团的交联剂反
应进行的交联。
[0093]
其中,优选基于(d)的交联的gag交联体,更优选的是:使导入了光反应性基团的gag光交联而得到的gag衍生物;使导入了聚合性官能团的gag用具有2个巯基的交联剂进行交联而得到的gag交联体等。
[0094]
作为该光反应性基团,可以举出源自肉桂酸的基团等。这样的光反应性基团可以借助间隔物基团与源自gag的基团键合,优选源自肉桂酸的基团借助上式(i)、(ii)或(iii)所示的间隔物基团肉桂酸与gag共价键合。作为聚合性官能团,可以举出源自(甲基)丙烯酸的基团等,这些聚合性官能团可以借助间隔物基团与源自gag的基团键合,优选源自(甲基)丙烯酸的基团借助上式(i)、(ii)或(iii)所示的间隔物基团与gag共价键合。作为与聚合性官能团互补的反应性基团,例如可以举出巯基等,作为具有2个巯基的交联剂,可以举出硫醇
‑
peg
‑
硫醇等。
[0095]
gag交联体中的交联性基团的含量没有特别限制,可以根据目的等而适宜选择。
[0096]“包含源自gag的基团和间隔物基团的化合物”是间隔物基团的一端共价键合于源自gag的基团而成的化合物。组合物包含该化合物时,优选的是,源自趋化因子受体活性调节材料的基团共价键合于间隔物基团的另一端。对于源自gag的基团和间隔物基团,如上述,源自趋化因子受体活性调节材料的基团是从后述的趋化因子受体活性调节材料除去氢原子或羟基而形成的基团。
[0097]
包含源自gag的基团和间隔物基团的化合物中的间隔物基团的含量没有特别限制,可以根据目的等而适宜选择。
[0098]“趋化因子受体活性调节材料”是指,作用于趋化因子受体或与趋化因子受体结合的物质、并调节(抑制或亢进)借助趋化因子受体的信号传递的化合物(药剂),例如可以举出趋化因子受体抑制剂、抗趋化因子抗体、趋化因子受体激动剂等。作为抑制借助趋化因子受体的信号传递的药剂,例如可以举出竞争抑制或者非竞争抑制趋化因子受体的药剂等作为趋化因子受体拮抗剂,其中,优选ccr3拮抗剂、cxc受体(cxcr)2拮抗剂、ccr2拮抗剂等。作为使借助趋化因子受体的信号传递亢进的药剂,可以举出作用于趋化因子受体并使其作用增强的药剂等作为趋化因子受体激动剂,例如优选cxcr3激动剂等。
[0099]
具体而言,作为ccr3拮抗剂,可以举出ki19003(例如参照国际公开02/059081号)、sb328437(例如参照journal of biological chemistry,2000,275(47),36626
‑
31.)、gw766994(例如参照国际公开03/082292号)、azd3778(例如参照国际公开03/004487号)等,作为cxcr2拮抗剂,可以举出sb225002(例如参照bioorganic&medicinal chemistry,2009,17(23),8102
‑
8112.)。作为ccr2拮抗剂,可以举出rs504393(例如参照j.biol.chem.,2000,275(33))。作为cxcr3激动剂,可以举出ps372424(例如参照biochem.biophys.res.commun.,2006,349(1),221
‑
8)。其中,特别优选使用ccr3拮抗剂。以下,以结构式示出趋化因子受体活性调节材料的具体例,但本发明中使用的趋化因子受体活性调节材料不限定于这些化合物。
[0100][0101]
这样的趋化因子受体活性调节材料可以形成盐(例如药学上允许的盐)。作为盐,可以举出盐酸盐、氢溴酸盐、氢碘酸盐、硫酸氢盐、磷酸氢盐、甲磺酸盐、硝酸盐、马来酸氢盐、乙酸盐、柠檬酸氢盐、富马酸氢盐、酒石酸氢盐、草酸氢盐、琥珀酸氢盐、苯甲酸盐、对甲苯磺酸盐等。
[0102]
趋化因子受体活性调节材料可以以与gag衍生物通过物理相互作用而复合化的复合物的形式包含于组合物。包含导入了疏水基团的gag、gag交联体等gag衍生物和趋化因子受体活性调节材料的复合物可以抑制伴随着给予的急剧的组织变性,并且显示出优异的趋化因子受体活性调节作用、对amd等后眼部疾病等的优异的药效。
[0103]
而且,趋化因子受体活性调节材料与gag衍生物可以通过化学键合形成复合物,其中,优选的是,源自gag的基团借助间隔物基团与源自趋化因子受体活性调节材料的基团共
价键合而得到的共价键合物。其中,优选的是,gag的羧基、与趋化因子受体活性调节材料所具有的羧基借助下式(iii)所示的间隔物基团共价键合而得到的共价键合物,特别优选的是,gag的羧基与式(iii)的间隔物基团形成酰胺键的共价键合物。
[0104]
‑
nh
‑
(ch2)
m
‑
o
‑ꢀꢀ
(iii)
[0105]
式中,m表示2~12的整数,优选2~5,更优选2。
[0106]
前述共价键合物中的、源自趋化因子受体活性调节材料的基团与间隔物基团之间的共价键合形式也没有特别限定,例如可以举出酯键。
[0107]
前述共价键合物的调制方法、趋化因子受体活性调节材料的导入率等没有特别限制,可以根据目的等而适宜选择。
[0108]
对于本发明的组合物,即使为以往以单剂不显示药效那样的低浓度、为了玻璃体内给予也不得不溶解于增溶剂的趋化因子受体活性调节材料,可以不使用增溶剂、或者即使使用也极少量残留地进行玻璃体内给予。
[0109]
此处,本技术说明书中所谓“增溶剂”只要可以溶解难水溶性的趋化因子受体活性调节材料就没有特别限定,例如可以举出dmso等有机溶剂、聚山梨酯80、聚乙二醇400、环糊精等。
[0110]
本发明的组合物中,这样的增溶剂(例如有机溶剂)的含量优选10重量%以下,更优选实质上不含有。
[0111]
另外,本发明的组合物对眼内给予时,优选不引起眼内出血恶化。眼内出血恶化的有无可以通过后述实施例的方法来确认。
[0112]
(2)组合物的制造方法
[0113]
作为本发明的组合物的实施方式,例如可以举出:将gag衍生物与趋化因子受体活性调节材料混合而得到的组合物、gag衍生物与趋化因子受体活性调节材料进行共价键合而成的共价键合物。此时的混合方法、共价键合方法也没有特别限定。例如作为混合方法,可以举出将gag衍生物的pbs溶液和溶解于乙醇等溶剂的趋化因子受体活性调节材料进行搅拌混合的方法。另外,例如作为共价键合方法,可以举出使趋化因子受体活性调节材料酰胺键合、酯键合、或醚键合于gag衍生物(优选包含间隔物基团的gag衍生物)的官能团的方法等。之后,根据需要也可以使其透析、沉淀、冻干、浓缩干固等。
[0114]
(2
‑
1)包含导入了疏水基团的gag和趋化因子受体活性调节材料的组合物的制造方法
[0115]
(2
‑1‑
1)导入了疏水基团的gag的制造方法
[0116]
导入了疏水基团的gag例如可以如下得到:使gag分子所具有的官能团(例如羧基)与疏水基团所具有的官能团(羧基)借助间隔物基团进行共价键合,从而得到。以下,作为导入了疏水基团的gag的制造方法的一例,对形成疏水基团的化合物为5β
‑
胆烷酸的情况进行说明,但不限定于此。将源自gag的基团与源自5β
‑
胆烷酸的基团借助间隔物进行共价键合而成的导入了疏水基团的gag例如可以利用包含以下步骤的方法而制造。
[0117]
一种制造方法,其包括:(a)使5β
‑
胆烷酸所具有的羧基与间隔物形成分子的氨基缩合并进行共价键合(酰胺键);和,
[0118]
(b)使gag所具有的羧基与间隔物形成分子的氨基缩合并进行共价键合(酰胺键)。
[0119]
(a)的步骤中,使5β
‑
胆烷酸所具有的羧基与间隔物形成分子的氨基缩合并进行共
价键合。此时间隔物形成分子与gag反应的预订的氨基可以根据需要利用通常使用的方法预先保护。
[0120]
(b)的步骤中,使gag所具有的羧基与间隔物形成分子的氨基缩合并进行共价键合。
[0121]
gag衍生物的制造方法只要包括(a)的步骤和(b)的步骤即可,执行步骤的顺序没有限定。
[0122]
需要说明的是,作为间隔物形成分子,可以举出下式所示的化合物。
[0123]
h2n
‑
(ch2)
m
‑
nh2[0124]
式中,m表示1~12的整数,优选2~5,更优选2。
[0125]
导入了疏水基团的gag的制造中使用的缩合(酯化、酰胺化)方法可以从通常使用的方法中适宜选择。例如可以举出如下方法:使用水溶性碳二亚胺(例如1
‑
(3
‑
二甲基氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(wsc))、含氯化4
‑
(4,6
‑
二甲氧基
‑
1,3,5
‑
三嗪
‑2‑
基)
‑4‑
甲基吗啉水合物(dmt
‑
mm)、二环己基碳二亚胺等缩合剂的方法;对称酸酐法;混合酸酐法;活性酯法等方法。缩合反应条件可以根据应用的缩合反应而适宜选择。
[0126]
作为缩合反应中使用的溶剂,例如可以举出水、dmso、甲醇、乙醇、丙醇、丁醇、乙腈、dmf、thf、甲酰胺、和它们的混合溶剂,优选为乙醇与水的混合溶剂和dmf与甲酰胺的混合溶剂。
[0127]
(2
‑1‑
2)导入了疏水基团的gag与趋化因子受体活性调节材料的混合方法
[0128]
可以将导入了疏水基团的gag的pbs溶液与例如溶解于乙醇的趋化因子受体活性调节材料混合后进行透析
·
冻干而得到。对混合方法、透析
·
冻干方法没有限定,可以从通常使用的方法中适宜选择。
[0129]
(2
‑
2)包含gag交联体和趋化因子受体活性调节材料的组合物的制造方法1
[0130]
(2
‑2‑
1)gag交联体的制造方法
[0131]
作为gag交联体的一例,例如可以通过日本特开2002
‑
249501号公报中记载的方法调制光交联性gag。具体而言,通过将光反应性基团(例如肉桂酸衍生物)以缩合反应导入至gag的羧基,从而可以得到光反应交联性gag。通过将所得光交联性gag供至光反应,从而可以制造gag交联体。
[0132]
(2
‑2‑
2)gag交联体与趋化因子受体活性调节材料的混合方法
[0133]
通过在上述中得到的gag交联体的水溶液中搅拌混合趋化因子受体活性调节材料,从而可以调制目标组合物。
[0134]
(2
‑
3)包含gag交联体和趋化因子受体活性调节材料的组合物的制造方法2
[0135]
(2
‑3‑
1)gag交联前体的制造方法
[0136]
例如利用后述的实施例中记载的方法,向gag的羧基中根据需要借助间隔物基团导入甲基丙烯酰基,从而可以调制gag交联前体。所得gag交联前体例如可以通过与硫醇
‑
peg
‑
硫醇反应而生成交联体,不限定于该化合物。
[0137]
(2
‑3‑
2)组合物的制造方法
[0138]
通过在上述中得到的gag交联前体中混合趋化因子受体活性调节材料、进而以硫醇
‑
peg
‑
硫醇等交联剂进行交联反应等方法,从而可以得到期望的组合物。
[0139]
(2
‑
4)gag衍生物与趋化因子受体活性调节材料的共价键合物的制造方法3
[0140]
共价键合有趋化因子受体活性调节材料的gag衍生物可以通过使gag所具有的官能团(例如羧基)与趋化因子受体活性调节材料所具有的官能团(例如羧基)借助间隔物基团进行共价键合而得到。
[0141]
(2
‑4‑
1)共价键合有趋化因子受体活性调节材料的gag的制造方法
[0142]
将源自gag的基团与源自趋化因子受体活性调节材料的基团借助间隔物进行共价键合而成的gag衍生物例如可以通过包括以下的步骤的方法而制造。
[0143]
一种制造方法,其包括:(a)使趋化因子受体活性调节材料所具有的羧基与间隔物形成分子的羟基缩合并进行共价键合(酯键);和,
[0144]
(b)使gag所具有的羧基与间隔物形成分子的氨基缩合并进行共价键合(酰胺键)。
[0145]
(a)的步骤中,使趋化因子受体活性调节材料所具有的羧基与间隔物形成分子的羟基缩合并进行共价键合。此时间隔物形成分子与gag反应的预计的氨基可以根据需要用通常使用的方法事先保护。
[0146]
(b)的步骤中,将gag所具有的羧基与间隔物形成分子的氨基缩合并进行共价键合。
[0147]
gag衍生物的制造方法只要包括(a)的步骤和(b)的步骤即可,执行步骤的顺序没有限定。
[0148]
需要说明的是,作为间隔物形成分子,可以举出下式所示的化合物。
[0149]
ho
‑
(ch2)
m
‑
nh2[0150]
式中,m表示1~12的整数,优选2~5,更优选2。
[0151]
而且,缩合(酯化、酰胺化)方法从通常使用的方法中适宜选择即可。
[0152]
gag衍生物可以采用各种结构。作为gag衍生物的结构的具体例,例如cs衍生物的情况下,可以举出包含至少1个下述化学式(iva)所示的至少1种结构单元的结构,ha衍生物的情况下,可以举出包含至少1个下述化学式(va)所示的至少1种结构单元的结构。
[0153][0154]
r
12
或r
13
所示的基团在式中的*的位置与源自gag的羰基以共价键键合。
[0155]
作为gag衍生物与趋化因子受体活性调节材料的共价键合物的结构的具体例,例如cs衍生物的情况下,可以举出包含至少1个下述化学式(ivb)所示的至少1种结构单元的结构,ha衍生物的情况下,可以举出包含至少1个下述化学式(vb)所示的至少1种结构单元的结构。
[0156][0157]
r
22
或r
23
所示的基团在式中的*的位置与源自gag的羰基以共价键键合。
[0158]
(3)医药组合物
[0159]
本发明的医药组合物包含前述组合物,根据需要还可以包含药学上允许的赋形剂等其他成分。作为其他成分,除药学上允许的赋形剂之外,可以举出表面活性剂、稳定化剂、液态介质等。
[0160]
医药组合物的用途没有特别限制,例如优选用于后眼部疾病处置。
[0161]
(4)后眼部疾病处置剂
[0162]
后眼部疾病处置剂为包含前述组合物的医药组合物,且用于后眼部疾病的处置。
[0163]
本说明书中使用的“处置”只要为对疾病施加的任意处置即可,例如可以举出疾病的治疗、改善和进行的抑制(恶化的防止)。
[0164]
后眼部疾病处置剂的形态只要为能对人眼给予的制剂或医药的形态就没有特别限定。给予时的形态优选液体,例如可以举出溶液、悬浮液等形态。溶液、悬浮液也可以通过将前述组合物的粉体用时溶解并调制从而给予。
[0165]
作为后眼部疾病处置剂的给予量,例如液体的情况下,如果为玻璃体内给予,则可以举出10~1000μl左右。
[0166]
另外,液体时的后眼部疾病处置剂的浓度以趋化因子受体活性调节材料计可以举出0.001~5重量%,以gag衍生物计可以举出0.01~10重量%。
[0167]
作为后眼部疾病处置剂的给予方法,例如可以举出玻璃体内给予、结膜下给予、结膜囊给予、tenon囊下给予、滴眼给予、对置留于眼内的设备的给予等,优选玻璃体内给予。玻璃体内给予中,最优选玻璃体内注射。
[0168]
后眼部疾病处置剂的给予频率根据病态、药剂的浓度等而适宜设定即可。或者,在病态恶化时可以根据需要给予,但不限定于这些。
[0169]
后眼部疾病处置剂是以用于后眼部疾病的处置为目的的。此处,“后眼部疾病”是
指,在源自新生血管或向呈现血管新生的病态进展的后眼部引起的疾病等任何异常,例如包括:糖尿病视网膜症、糖尿病黄斑水肿、视网膜动脉阻塞症、视网膜静脈分支阻塞症(brvo)、视网膜中心静脉阻塞症(crvo)、早产儿视网膜症、中心性浆液性脉络视网膜症、中心性渗出性脉络视网膜症、新生血管黄斑症、amd(具有cnv病变的渗出型amd和具有cnv发病风险的和/或向渗出型amd移行的萎缩型amd)等。其中,本发明的后眼部疾病处置剂的更优选的适应性疾病为amd、糖尿病视网膜症、糖尿病黄斑水肿,特别优选的适应性疾病为渗出型amd。
[0170]
作为后眼部疾病处置剂的方案,例如可以举出:不会引起眼内出血恶化、且增溶剂的含量为10重量%以下的液体制剂;不会引起眼内出血恶化、且包含gag交联体和趋化因子受体活性调节材料而成的液体制剂;不会引起眼内出血恶化、且增溶剂的含量为10重量%以下、包含gag交联体和趋化因子受体活性调节材料而成的液体制剂;不会引起眼内出血恶化、且包含光交联ha和趋化因子受体拮抗剂而成的液体制剂;不会引起眼内出血恶化、且增溶剂的含量为10重量%以下、包含光交联ha和趋化因子受体拮抗剂而成的液体制剂;不会引起眼内出血恶化、且包含导入了疏水性基团的gag和趋化因子受体活性调节材料而成的液体制剂;不会引起眼内出血恶化、且增溶剂的含量为10重量%以下、包含导入了疏水性基团的gag和趋化因子受体活性调节材料而成的液体制剂;不会引起眼内出血恶化、且包含导入了疏水性团的cs和趋化因子受体拮抗剂而成的液体制剂;不会引起眼内出血恶化、且增溶剂的含量为10重量%以下、包含导入了疏水性基团的cs和趋化因子受体拮抗剂而成的液体制剂;不会引起眼内出血恶化、且包含导入了源自胆烷酸的基团的cs和ccr3抑制剂而成的液体制剂;不会引起眼内出血恶化、且增溶剂的含量为10重量%以下、包含导入了源自胆烷酸的基团的cs和ccr3抑制剂而成的液体制剂;等。这些方案的后眼部疾病处置剂可以作为渗出型amd进行抑制剂使用,所述渗出型amd进行抑制剂的特征在于,通过注射被给予至人眼的玻璃体内。
[0171]
(5)后眼部疾病的处置方法
[0172]
后眼部疾病的处置方法包括:眼内给予后眼部疾病处置剂的步骤。后眼部疾病的处置方法根据需要可以还包括其他步骤。后眼部疾病的处置方法也可按照前述(4)后眼部疾病处置剂中的说明同样地实施,优选的处置剂的条件
·
给予频率等与前述同样。
[0173]
实施例
[0174]
以下,对本发明的实施例和试验例更具体地进行详细说明。然而,不由此限制本发明的保护范围。需要说明的是,组合物内的gag取代基和趋化因子受体活性调节材料的含量通过后述的方法测定。而且,gag的分子量为重均分子量。
[0175]
(1)gag衍生物和组合物的调制
[0176]
(实施例1)氨基乙基5β
‑
胆酰胺(aminoethyl 5β
‑
cholanoamide)的合成
[0177]
在5β
‑
胆烷酸(1g、aldrich公司制)中加入甲醇(5ml)、浓盐酸(0.18ml),以60℃搅拌6小时后,将反应液冷却至室温,滤取析出的固体。在所得化合物中加入乙二胺(5ml、和光纯药工业株式会社制),以130℃搅拌5小时,用lcms确认目标物后,恢复至室温,滤取所得固体,用蒸馏水清洗后干燥,得到化合物1(895mg)。
[0178]
esi
‑
ms;计算值(calcd for)c267h3746n2o[m
+
h]
+
,404;实验值(found)404
[0179]
(实施例2)导入了5β
‑
胆烷酸的ha的合成
[0180]
在ha(平均分子量约21万、lifecore biomedical公司制、500mg)中加入甲酰胺(40ml),以40℃加热搅拌2小时,从而使其溶解,加入wsc(和光纯药工业株式会社制、205mg)、n
‑
羟基琥珀酰亚胺(渡边化学工业株式会社制、123mg)并搅拌。在其中加入化合物1(96mg)的dmf溶液(10ml),进而加入dmf(30ml),以室温搅拌24小时。将反应液放入至透析膜(spectra/por rc生物膜mwco 8
‑
10kda、自funakoshi株式会社购入),以甲醇:蒸馏水(3:1)、甲醇:蒸馏水(1:1)、蒸馏水的顺序依次进行三天透析。回收透析液,加入阳离子交换树脂(dowex
tm 50wx8 50
‑
100,2g,和光化学株式会社制),搅拌30分钟。将反应液过滤,冻干,得到化合物2(590mg)。需要说明的是,5β
‑
胆烷酸的导入率为4.7mol%。
[0181]
(实施例3)导入了5β
‑
胆烷酸的cs的合成
[0182]
使用cs(平均分子量约4万、生化学工业株式会社制、500mg),依据实施例2的方法进行反应,得到化合物3(490mg)。需要说明的是,5β
‑
胆烷酸的导入率为10.0mol%。对于动物给予用药液,将冻干品用pbs以成为10mg/ml的方式溶解,用0.22μm过滤器过滤,从而调制。
[0183]
(实施例4)含ki19003的ha衍生物的调制
[0184]
将ki19003(依据国际公开02/059081a2合成、35mg)溶解于乙醇(2ml),加入实施例2中合成的化合物2(40mg)的pbs(8ml,ph7.4)溶液,溶解后,混合搅拌,在蒸馏水中进行7小时透析(spectra/por rc生物膜mwco3.5
‑
5kda、spectrum laboratories inc.制)。回收透析液后,用0.45μm过滤器过滤,进行冻干,从而得到组合物4(35mg)。ki19003含有率为14.0重量%。将所得组合物4用pbs以成为3mg/ml的方式溶解,用0.22μm过滤器过滤,从而调制,作为动物给予用试样。
[0185]
(实施例5)含ki19003的cs衍生物的调制
[0186]
使用实施例3中合成的化合物3(35mg)的pbs(8ml,ph7.4)溶液,依据实施例4的方法进行反应,得到组合物5(33mg)。ki19003含有率为22.0wt%。将所得组合物5用pbs以成为3mg/ml的方式溶解,用0.22μm过滤器过滤,从而调制,作为动物给予用试样。
[0187]
(实施例6)含gw766994的ha衍生物的调制
[0188]
将gw766994(依据国际公开03/082292a1合成、30mg)溶解于乙醇(2ml),加入实施例2中合成的化合物2(40mg)的pbs(8ml,ph7.4)溶液并分散,将所得分散液在蒸馏水中进行7小时透析(spectra/por rc生物膜,mwco 3.5
‑
5kda)。回收透析液后用0.45μm过滤器过滤,冻干,从而得到组合物6(35mg)。gw766994含有率为23.5重量%。将所得组合物6用pbs以成为3mg/ml的方式溶解,用0.22μm过滤器过滤,从而调制,作为动物给予用试样。
[0189]
(实施例7)含gw766994的cs衍生物的调制(1)
[0190]
使用实施例3中合成的化合物3(35mg)的pbs(8ml,ph7.4)溶液,依据实施例6的方法进行反应,得到组合物7(31mg)。gw766994含有率为27.7重量%。将所得组合物7用pbs以成为3mg/ml的方式溶解,用0.22μm过滤器过滤,从而调制,作为动物给予用试样。
[0191]
(实施例8)含gw766994的cs衍生物的调制(2)
[0192]
将gw766994(12mg)溶解于乙醇(2ml),加入实施例3中合成的化合物3(60mg)的pbs(8ml,ph7.4)溶液,混合搅拌。将混合液在蒸馏水中进行7小时透析(slide
‑
a
‑
lyzer,mwco 3.5kda、thermo fisher scientific inc.制)。回收透析液,用0.22μm过滤器过滤,冻干,从而得到组合物8(40mg)。gw766994含有率为9.4重量%。将所得组合物8用pbs以成为10mg/ml
的方式溶解,从而调制,作为动物给予用试样。
[0193]
(实施例9)2
‑
氨基乙基酯化的ki19003的合成
[0194]
将ki19003(190mg)溶解于二氯甲烷(2ml),加入二甲基氨基吡啶(和光纯药工业株式会社制、13mg)、wsc(和光纯药工业株式会社制、206mg)、n
‑
boc
‑
乙醇胺(和光纯药工业株式会社制、174mg),在氮气气氛下、以室温搅拌3小时。用lcms确认反应结束后,将反应液用饱和食盐水清洗,用无水硫酸镁脱水、过滤、浓缩,将所得残渣用硅胶柱色谱法(己烷:乙酸乙酯=1:2)纯化,得到白色固体(81mg)。向其中加入4m hcl/acoet(10ml、国产化学工业株式会社制),以室温搅拌1小时。用lcms确认目标物后,将反应液浓缩得到化合物9(71mg)。
[0195]
esi
‑
ms;calcd for c27h37cl3n4o3[m
+
h]
+
,573;found 573
[0196]
(实施例10)导入了ki19003的cs的合成
[0197]
在cs(平均分子量约4万、生化学工业株式会社制、270mg)中加入蒸馏水(4ml)搅拌30分钟,使其溶解。加入化合物9(64mg)的乙醇溶液(4ml),进而加入dmt
‑
mm(和光纯药工业株式会社制、47mg),以室温搅拌一晩。在反应液中加入食盐(270mg),滴加至乙醇(40ml)中。滤取析出的白色固体,用90%乙醇水清洗3次,用真空泵整夜干燥,得到化合物10(281mg、导入率18.0重量%)。将所得化合物10用pbs以成为3mg/ml的方式溶解,再次用0.22μm过滤器过滤,从而得到组合物10。将其作为动物给予用试样。
[0198]
(实施例11)导入了ki19003的cs的合成2
[0199]
对于cs(平均分子量约15万、生化学工业株式会社制、150mg),依据实施例10中记载的方法进行反应。在反应液中加入食盐(150mg),滴加至乙醇(40ml)中。滤取析出的白色固体,用90%乙醇水清洗3次,用真空泵整夜干燥,得到白色固体。将所得固体溶解于蒸馏水,用0.22μm过滤器过滤,冻干,从而得到化合物11(91mg、导入率5.3重量%)。将所得化合物11用pbs以成为10mg/ml的方式溶解,从而得到组合物11。将其作为动物给予用试样。
[0200]
(实施例12)甲基丙烯酸2
‑
氨基乙酯盐酸盐的合成
[0201]
在n
‑
boc
‑
乙醇胺(15.5g、东京化成工业株式会社制)与二异丙基乙基胺(25.2ml、东京化成工业株式会社制)的二氯甲烷(180ml)溶液中,在氩气气氛下,在
‑
78℃下用3分钟滴加甲基丙烯酰氯(10.5ml、东京化成工业株式会社制)并搅拌1小时。之后,在室温下搅拌14小时。将反应液水洗,用二氯甲烷萃取后,用硫酸钠干燥。将固体以过滤除去后,将浓缩而得到的油状物用硅胶柱色谱法(己烷:乙酸乙酯=4:1)纯化。将所得黄色固体用二乙基醚和己烷清洗,以白色固体的形式得到n
‑
boc化的酯体(12.3g)。
[0202]1h
‑
nmr(cdcl3)δ6.71(1h,br
‑
s),5.75(1h,s),5.33
‑
5.33(1h,m),4.96)1h,br
‑
s),3.40
‑
3.43(2h,m),3.32
‑
3.35(2h,m),1.96
‑
1.96(3h,m),1.44(9h,s)
[0203]
在该固体中加入4m hcl/二氧杂环己烷(120ml、国产化学工业株式会社制),在室温下,搅拌3小时。将反应液浓缩,将析出的固体用己烷清洗。在室温下减压干燥,以白色固体的形式得到化合物12(8.83g)。
[0204]1h
‑
nmr(d2o)δ5.73(1h,s),5.47(1h,s),3.15(2h,t,j=6.0hz),2.54(2h,t,j=6.0hz),1.90(3h,s)
[0205]
(实施例13)导入了甲基丙烯酰基的cs的合成
[0206]
使cs(平均分子量约4万、生化学工业株式会社制、4.03g)溶解于去离子水(120ml),室温下,依次加入化合物12(0.23g)、dmt
‑
mm(0.36g),搅拌18小时。
[0207]
在反应液中加入小苏打(3.0g),搅拌30分钟后,用乙酸中和至ph7.0。搅拌30分钟后,加入食盐(12.0g),搅拌30分钟。加入90%乙醇(240ml),搅拌30分钟后,将上清液废弃。再次加入90%乙醇(240ml),搅拌30分钟后,将上清液废弃。进一步实施该操作2次后,将固体在蒸馏水中整夜透析(纤维素管36/32,mwco 10kda、
エーディア
社制)。进行冻干,以白色固体的形式得到化合物13(4.34g)。导入率为9.5mol%。
[0208]
(实施例14)含sb328437的cs衍生物的调制1
[0209]
在化合物13(50.0mg)和sb328437(2.0mg、依据journal of biological chemistry,2000,275(47),36626
‑
31.而合成)中加入硫醇
‑
peg
‑
硫醇(分子量3400、laysan bio公司制)的生理盐水(saline)溶液(0.2mg/ml)65μl后,加入生理盐水135μl。搅拌1分钟后,静置48小时,得到凝胶状化合物。在生理盐水(3ml)中加入凝胶状化合物后,静置24小时。仅将凝胶状化合物转移至在前端部使2根连接的灭菌注射器,将柱塞插入至注射器筒。排出注射器内部的空气后,使柱塞交替挤压30次,将所得凝胶状化合物转移至一个注射器,得到组合物14。将其作为动物给予用试样。
[0210]
(实施例15)含sb328437的cs衍生物的调制2
[0211]
使实施例14中的、硫醇
‑
peg
‑
硫醇的saline溶液(0.2mg/ml)的添加量为100μl、之后的saline添加量为100μl进行反应,同样地合成而得到组合物15。将其作为动物给予用试样。
[0212]
(实施例16)含sb328437的cs衍生物的调制3
[0213]
使实施例14中的、硫醇
‑
peg
‑
硫醇的saline溶液(0.2mg/ml)的添加量为200μl,进行反应,同样地合成而得到组合物16。将其作为动物给予用试样。
[0214]
(实施例17)氨基乙基油酸酰胺的合成
[0215]
将油酸(500mg、东京化成工业株式会社制)溶解于二甲基甲酰胺(8ml、和光纯药工业株式会社制),加入三乙胺(和光纯药工业株式会社制、0.49ml)、wsc(和光纯药工业株式会社制、408mg)、hobt(国产化学工业株式会社制、406mg)、n
‑
boc
‑
二乙胺(和光纯药工业株式会社制、312mg),在氮气气氛下、以室温搅拌3小时。用lcms确认反应结束后,在反应液中加入乙酸乙酯,将有机层用饱和碳酸氢盐水、饱和氯化铵水、饱和食盐水依次清洗,用无水硫酸镁脱水、过滤、浓缩,将所得残渣用硅胶柱色谱法(己烷:乙酸乙酯=1:1)纯化,得到白色固体(360mg)。对其加入甲醇(2ml、和光纯药工业株式会社制)和4m hcl/acoet(10ml、国产化学工业株式会社制),以室温搅拌一晩。用lcms确认目标物后,将反应液浓缩,得到化合物17(250mg)。
[0216]
esi
‑
ms;calcd for c
20
h
40
n2o[m+h]+,325;found 325
[0217]
(实施例18)导入了油酸的cs的合成
[0218]
在cs(平均分子量约4万、生化学工业株式会社制、500mg)中加入蒸馏水(20ml),搅拌30分钟,使其溶解。加入化合物17(36mg)的乙醇溶液(20ml),进而加入dmt
‑
mm(tokuyama corporation制、55mg),以室温搅拌一晩。在反应液中加入1n氢氧化钠水溶液(2.5ml),搅拌30分钟,将反应液的总量加入至透析膜(slide
‑
a
‑
lyzer g2、mwco10k、30ml、自funakoshi株式会社购入),以乙醇:蒸馏水(1:1)、蒸馏水的顺序依次进行两天透析。将透析液回收,加入阳离子交换树脂(dowextm 50wx8 50
‑
100,2g,和光化学株式会社制),搅拌30分钟。将反应液过滤,冻干,得到化合物18(277mg)。需要说明的是,5β
‑
油酸的导入率为10.3mol%。
[0219]
(实施例19)导入了含gw766994的油酸的cs的合成
[0220]
将gw766994(15mg)溶解于乙醇(2ml),加入实施例18中合成的化合物18(90mg)的pbs(9ml,ph7.4)溶液并混合,将所得液体在蒸馏水中透析7小时(slide
‑
a
‑
lyzer g2、mwco3.5k、15ml、自funakoshi株式会社购入)。将透析液回收后用0.22μm过滤器过滤,冻干,从而得到组合物19(75mg)。gw766994含有率为8.62重量%。将所得组合物19用pbs以成为10mg/ml的方式溶解,用0.22μm过滤器过滤,从而调制,作为动物给予用试样。
[0221]
(实施例20)氨基乙基石胆酸酰胺的合成
[0222]
将石胆酸(500mg、东京化成工业株式会社制)溶解于二甲基甲酰胺(8ml、和光纯药工业株式会社制),加入wsc(和光纯药工业株式会社制、305mg)、hobt(国产化学工业株式会社制、304mg)、n
‑
boc
‑
二乙胺(和光纯药工业株式会社制、254mg),在氮气气氛下、以室温搅拌3小时。用lcms确认反应结束后,在反应液中加入乙酸乙酯,将有机层用饱和碳酸氢盐水、饱和氯化铵水、饱和食盐水依次清洗,用无水硫酸镁脱水、过滤、浓缩,将所得残渣用硅胶柱色谱法(己烷:乙酸乙酯=1:1)纯化,得到白色固体(310mg)。对于其加入thf(2ml、和光纯药工业株式会社制)和4m hcl/acoet(10ml、国产化学工业株式会社制),以45度搅拌1小时。用lcms确认目标物后,将反应液浓缩得到化合物20(305mg)。
[0223]
esi
‑
ms;calcd for c
26
h
46
n2o2[m+h]+,419;found 419
[0224]
(实施例21)导入了石胆酸的cs的合成
[0225]
在cs(平均分子量约4万、生化学工业株式会社制、400mg)中加入蒸馏水(18ml),搅拌30分钟,使其溶解。加入化合物20(36mg)的乙醇溶液(18ml),进而加入dmt
‑
mm(tokuyama corporation制、55mg),以室温搅拌一晩。在反应液中加入1n氢氧化钠水溶液(2.0ml),搅拌30分钟,将反应液的总量加入至透析膜(slide
‑
a
‑
lyzer g2、mwco10k、30ml、自funakoshi株式会社购入),用乙醇:蒸馏水(1:1)、蒸馏水依次进行两天透析。将透析液回收,加入阳离子交换树脂(dowex
tm 50wx8 50
‑
100,2g,和光化学株式会社制),搅拌30分钟。将反应液过滤,冻干,得到化合物21(250mg)。需要说明的是,5β
‑
石胆酸的导入率为10.0mol%。
[0226]
(实施例22)导入了含gw766994的石胆酸的cs的合成
[0227]
将gw766994(11mg)溶解于乙醇(2ml),加入实施例21中合成的化合物21(66mg)的pbs(6ml,ph7.4)溶液并混合,将所得液体在蒸馏水中透析7小时(slide
‑
a
‑
lyzer g2、mwco3.5k、15ml、自funakoshi株式会社购入)。将透析液回收后用0.22μm过滤器过滤,冻干,从而得到组合物22(75mg)。gw766994含有率为10.3重量%。将所得组合物22用pbs以成为10mg/ml的方式溶解,用0.22μm过滤器过滤,从而调制,作为动物给予用试样。
[0228]
(gag取代基和趋化因子受体活性调节材料的含量率的测定方法)
[0229]
(a)5β
‑
胆烷酸导入率测定法
[0230]
实施例1和2中的5β
‑
胆烷酸导入率如以下测定。
[0231]
在氘代水
‑
氘代甲醇(1:1)混合溶剂中测定1h
‑
nmr,由下述式算出。
[0232]
5β
‑
胆烷酸导入率(mol%)=
[0233]
(源自5β
‑
胆烷酸的21位甲基的积分值)/(源自gag的n
‑
乙酰基的积分值)
[0234]
(b)甲基丙烯酰基导入率测定法
[0235]
实施例13中的甲基丙烯酰基导入率如以下测定。
[0236]
在氘代水中测定1h
‑
nmr,由下式算出。
[0237]
甲基丙烯酰基导入率(mol%)=
[0238]
(源自甲基丙烯酰基的积分值)/(源自gag的n
‑
乙酰基的积分值)
[0239]
(c)趋化因子受体活性调节材料的含量测定法
[0240]
·
实施例4和5中的ki19003含有率测定法
[0241]
使用分光光度计(株式会社岛津制作所、uv spectrophotometer、测定波长220nm)制成标准曲线后测定。药物的含有率通过下式算出。
[0242]
含有率(wt%)=
[0243]
(组合物内的ki19003重量)/(组合物的重量)
×
100
[0244]
·
实施例6、7和8中的gw766994含有率测定法
[0245]
使用hplc在以下的条件下制成标准曲线后测定。
[0246]
柱:ods
‑
3,4.6
×
150mm,5um(gl science公司制)
[0247]
流速:0.8ml/min
[0248]
检测器:225nm
[0249]
洗脱液:乙腈:20mm乙酸铵水溶液=5:5(等度)
[0250]
药物的含有率通过下式算出。
[0251]
含有率(wt%)=
[0252]
(组合物内的gw766994重量)/(组合物的重量)
×
100
[0253]
·
实施例10和11中的ki19003含有率的算出方法
[0254]
将称量好的化合物10和11在2m氢氧化钠水溶液中、以37℃加温2小时,从而进行水解,然后将经过游离的ki19003在以下的hplc的条件下制成标准曲线后,测定。
[0255]
柱:ods
‑
3,4.6
×
150mm,5um(gl science公司制)
[0256]
流速:0.8ml/min
[0257]
检测器:225nm
[0258]
洗脱液:乙腈:50mm甲酸水溶液=3:7(等度)
[0259]
对于含有率,通过下式算出。
[0260]
含有率(wt%)=
[0261]
(从化合物游离的ki19003重量)/(化合物的重量)
×
100
[0262]
(2)评价方法
[0263]
(试验例1)使用组合物10的cnv抑制作用的验证
[0264]
制作大鼠的激光诱导cnv模型,研究利用组合物10或者ki19003的玻璃体内给予的血管新生抑制作用。
[0265]
<试验物质>
[0266]
将ki19003溶解于dmso,得到ki19003(0.6mg/ml)的溶液。作为试验物质,使用以下。
[0267]
1)组合物10(包含0.54mg/ml的ki19003)
[0268]
2)ki19003(0.6mg/ml)
[0269]
3)dmso
[0270]
(组合物10使用实施例10中调制的动物给予用试样)
[0271]
<方法>
[0272]
(1)激光诱导cnv模型制作和试验物质给予
[0273]
动物模型使用bn/crlcrlj大鼠(雄性、日本charles river株式会社)。在利用麻醉用混合液(生理食盐液:戊巴比妥=9:1)的腹腔内给予(约2ml/只)的全身麻醉下,通过mydrin p滴眼液的滴眼,使两眼散瞳。对视神经乳头周围的视网膜照射激光,诱导cnv。激光照射使用scopisol眼科溶液、眼底5.4mm激光透镜、激光光凝固装置和细隙灯照射系统。刚刚激光照射后,将5μl/眼的试验物质对两眼的玻璃体内单次给予。刚刚给予后,滴眼抗菌药(vigamox滴眼液0.5%)一滴。
[0274]
(2)flatmount的制作
[0275]
模型制作后10天,用co2使其安乐死。摘除眼球,浸渍于10%中性缓冲福尔马林液(室温、约60分钟)。制作眼杯,用pbs清洗,用甲醇进行脱水后,将眼杯浸渍于含有1%牛血清白蛋白和0.5%triton x
‑
100的pbs(室温、约60分钟)。除去视网膜后,在眼杯中添加0.5%fluorescein griffonia simplicifolia lectin i,fitc
‑
conjugate 60μl,放置(冷藏、一晩)。由此,将cnv的血管内皮细胞用fitc
‑
lectin进行荧光染色。在眼杯中引入放射状的切口8处,制作flatmount。将flatmount用含有0.1%triton x
‑
100的pbs清洗2次后,使用约120μl的prolong gold antifade reagent封入至载玻片。
[0276]
(3)cnv图像拍摄和面积测定
[0277]
使用荧光显微镜,拍摄封入于载玻片的flatmount的cnv荧光图像。使用图像解析软件(image pro exp)测定cnv面积。
[0278]
<统计解析>
[0279]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0280]
<试验结果>
[0281]
将cnv面积测定的结果示于下表和图1。
[0282]
组合物10与dmso和ki19003相比,显示出显著的cnv抑制作用。
[0283]
[表1]
[0284] 平均s.e.n检验结果dmso34980112516 ki1900330752137114*组合物1026811120616***,#
[0285]
*:p<0.05,***:p<0.001(相对于dmso)、t检验
[0286]
#:p<0.05(相对于ki19003)、t检验
[0287]
(试验例2)使用组合物11的cnv抑制作用的验证1
[0288]
制作大鼠的激光诱导cnv模型,研究利用组合物11或者ki19003的玻璃体内给予的血管新生抑制作用。
[0289]
<试验物质>
[0290]
将ki19003溶解于dmso,得到ki19003(0.53mg/ml)的溶液。作为试验物质,使用以下。
[0291]
1)组合物11(包含0.53mg/ml的ki19003)
[0292]
2)ki19003(0.53mg/ml)
[0293]
3)dmso
[0294]
(组合物11使用实施例11中调制的动物给予用试样)
[0295]
<方法>
[0296]
与试验例1的<方法>同样地实施。
[0297]
<统计解析>
[0298]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0299]
<试验结果>
[0300]
将cnv面积测定的结果示于下表和图2。
[0301]
组合物11与dmso和ki19003相比,显示出显著的cnv抑制作用。
[0302]
[表2]
[0303] 平均s.e.n检验结果dmso4361323449 ki1900340222141910n.s.组合物1135660106410**,#
[0304]
**:p<0.01(相对于dmso)、t检验
[0305]
#:p<0.05(相对于ki19003)、t检验
[0306]
n.s.:无显著性(相对于dmso)、t检验
[0307]
<结论>
[0308]
根据试验例1、试验例2显示了:导入了ki19003的cs可以作为显示出高于ki19003的药效的后眼部疾病处置剂、特别是amd治疗剂使用。显示了:作为构成gag衍生物的gag,可以使用cs。
[0309]
(试验例3)使用组合物11的cnv抑制作用的验证2
[0310]
制作大鼠的激光诱导cnv模型,研究利用组合物11或者cs与ki19003的配合剂的玻璃体内给予的血管新生抑制作用。
[0311]
<试验物质>
[0312]
将cs(19mg、与实施例11中的cs相同、生化学工业株式会社制)、ki19003(1mg)与pbs(2ml)混合,振荡,从而调制cs与ki19003的配合剂1。作为试验物质,使用以下。
[0313]
1)组合物11(包含0.53mg/ml的ki19003)
[0314]
2)配合剂1((包含0.5mg/ml的ki19003)
[0315]
3)dmso
[0316]
(组合物11使用实施例11中调制的动物给予用试样)
[0317]
<方法>
[0318]
与试验例1的<方法>同样地实施。
[0319]
<统计解析>
[0320]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0321]
<试验结果>
[0322]
将cnv面积测定的结果示于下表和图3。
[0323]
组合物11与dmso相比,显示出显著的cnv抑制作用。
[0324]
[表3]
[0325] 平均s.e.n检验结果dmso4361323449 配合剂140385243810n.s.组合物1135660106410**
[0326]
**:p<0.01(相对于dmso)、t检验
[0327]
n.s.:无显著性(相对于dmso)、t检验
[0328]
<结论>
[0329]
显示了:导入了ki19003的cs可以作为显示出高于cs与ki19003的配合剂的药效的后眼部疾病处置剂、特别是amd治疗剂使用。显示了:仅单纯地配合gag和趋化因子受体拮抗剂时,作为后眼部疾病处置剂是不充分的,确认了使用gag衍生物与趋化因子受体拮抗剂的共价键合物的有用性。
[0330]
(试验例4)使用组合物14、组合物15和组合物16的cnv抑制作用的验证
[0331]
制作大鼠的激光诱导cvn模型,研究利用组合物14、组合物15、组合物16和sb328437的玻璃体内给予的血管新生抑制作用。
[0332]
<试验物质>
[0333]
将sb328437溶解于dmso,得到sb328437(2mg/ml)的溶液。作为试验物质,使用以下。
[0334]
1)组合物14(包含1.33mg/ml的sb328437)
[0335]
2)组合物15(包含1.67mg/ml的sb328437)
[0336]
3)组合物16(包含3.33mg/ml的sb328437)
[0337]
4)sb328437(2mg/ml)
[0338]
(组合物14、15、16分别使用实施例14、15、16中调制的动物给予用试样)
[0339]
<方法>
[0340]
与试验例1的<方法>同样地实施。
[0341]
<统计解析>
[0342]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0343]
<试验结果>
[0344]
将cnv面积测定的结果示于下表和图4。
[0345]
组合物14、组合物15和组合物16与sb328437相比,显示出显著的cnv抑制作用。
[0346]
[表4]
[0347] 平均s.e.n检验结果sb328437260409338 组合物14226476288**组合物152095710798**组合物162095310158**
[0348]
**:p<0.01(相对于sb328437)、t检验
[0349]
<结论>
[0350]
显示了:包含sb328437和cs交联体的组合物可以作为显示出高于sb328437的药效的后眼部疾病处置剂、特别是amd治疗剂使用。显示了:作为gag衍生物,可以使用gag交联体,显示了:作为gag,可以使用cs。另外显示了,作为趋化因子受体拮抗剂,可以使用sb328437。
[0351]
(试验例5)
[0352]
使用包含sb225002和ha交联体(gel
‑
one)的组合物的cnv抑制作用的验证
[0353]
制作大鼠的激光诱导cnv模型,研究利用包含sb225002和gel
‑
one(光交联ha:生化学工业株式会社制)的组合物和sb225002的玻璃体内给予的血管新生抑制作用。
[0354]
<试验物质>
[0355]
将sb225002(依据bioorganic&medicinal chemistry,2009,17(23),8102
‑
8112而合成)溶解于dmso,得到sb225002(0.02mg/ml)的溶液。将sb225002溶解于dmso,得到sb225002(0.2mg/ml)的溶液后,将sb225002(0.2mg/ml)溶液0.15ml与gel
‑
one(1.5ml)混合并搅拌,从而得到组合物31。将sb225002溶解于dmso,得到sb225002(2mg/ml)后,将2mg/ml的sb225002(0.015ml)与gel
‑
one(1.5ml)混合并搅拌,从而得到组合物32。作为试验物质,使用以下。
[0356]
1)组合物31(包含0.018mg/ml的sb225002)
[0357]
2)组合物32(包含0.02mg/ml的sb225002)
[0358]
3)sb225002(0.02mg/ml)
[0359]
4)dmso
[0360]
<方法>
[0361]
与试验例1的<方法>同样地实施。
[0362]
<统计解析>
[0363]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0364]
<试验结果>
[0365]
将cnv面积测定的结果示于下表和图5。
[0366]
组合物31和组合物32与dmso和sb225002相比,显示出显著的cnv抑制作用。
[0367]
[表5]
[0368] 平均s.e.n检验结果dms042892242410 sb2250024312118369n.s.组合物3134453266410*,#组合物3233387300910*,#
[0369]
*:p<0.05(相对于dmso)、t检验
[0370]
#:p<0.05(相对于sb225002)、t检验
[0371]
n.s.:无显著性(相对于dms0)、t检验
[0372]
<结论>
[0373]
显示了:包含sb225002和gel
‑
one的组合物可以作为显示出高于sb225002的药效
的后眼部疾病处置剂、特别是amd治疗剂使用。显示了:作为gag衍生物,可以使用gag交联体,显示了作为gag,可以使用ha。另外显示了,作为趋化因子受体拮抗剂,可以使用sb225002。
[0374]
(试验例6)使用包含gw766994和ha交联体(gel
‑
one)的组合物的cnv抑制作用的验证
[0375]
制作大鼠的激光诱导cnv模型,研究利用包含gw766994和gel
‑
one(光交联ha:生化学工业株式会社制)的组合物和gw766994的玻璃体内给予的血管新生抑制作用。
[0376]
<试验物质>
[0377]
将gw766994溶解于dmso,得到gw766994(2mg/ml)的溶液。将gw766994溶解于dmso,得到gw766994(50mg/ml)后,将50mg/ml的gw766994(0.0417ml)与gel
‑
one(1.0ml)混合并搅拌,从而得到组合物33。作为试验物质,使用以下。
[0378]
1)组合物33(包含2mg/ml的gw766994)
[0379]
2)gw766994(2mg/ml)
[0380]
3)dmso
[0381]
<方法>
[0382]
与试验例1的<方法>同样地实施。
[0383]
<统计解析>
[0384]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0385]
<试验结果>
[0386]
将cnv面积测定的结果示于下表和图6。
[0387]
组合物33与dmso和gw766994相比,显示出显著的cnv抑制作用。
[0388]
[表6]
[0389] 平均s.e.n检验结果dms04261314049 gw7669944154812589n.s.组合物3334476105210***,###
[0390]
***:p<0.001(相对于dms0)、t检验
[0391]
###:p<0.001(相对于gw766994)、t检验
[0392]
n.s.:无显著性(相对于dmso)、t检验
[0393]
<结论>
[0394]
显示了:包含gw766994和gel
‑
one的组合物可以作为显示出高于gw766994的药效的后眼部疾病处置剂、特别是amd治疗剂使用。显示了:作为趋化因子受体拮抗剂,可以使用gw766994。
[0395]
(试验例7)使用包含ki19003和ha交联体(gel
‑
one)的组合物的cnv抑制作用的验证
[0396]
制作大鼠的激光诱导cnv模型,研究利用包含ki19003和gel
‑
one(光交联ha:生化学工业株式会社制)的组合物和ki19003的玻璃体内给予的血管新生抑制作用。
[0397]
<试验物质>
[0398]
将ki19003溶解于dmso,得到ki19003(0.5mg/ml)的溶液。将ki19003溶解于dmso,得到ki19003(25mg/ml)后,将25mg/ml的ki19003(0.0204ml)与gel
‑
one(1.0ml)混合并搅拌,从而得到组合物34。作为试验物质,使用以下。
[0399]
1)组合物34(包含0.5mg/ml的ki19003)
[0400]
2)ki19003(0.5mg/ml)
[0401]
3)dmso
[0402]
<方法>
[0403]
与试验例1的<方法>同样地实施。
[0404]
<统计解析>
[0405]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0406]
<试验结果>
[0407]
将cnv面积测定的结果示于下表和图7。
[0408]
组合物34与dmso相比,显示出显著的cnv抑制作用。
[0409]
[表7]
[0410] 平均s.e.n检验结果dms040833114710 ki1900341393261410n.s.组合物3436423148310*
[0411]
*:p<0.05(相对于dmso)、t检验
[0412]
n.s.:无显著性(相对于dmso)、t检验
[0413]
<结论>
[0414]
显示了:包含ki19003和gel
‑
one的组合物可以作为显示出高于ki19003的药效的后眼部疾病处置剂、特别是amd治疗剂使用。另外,根据试验例1、试验例2、试验例3、试验例7,ki19003可以与多个gag衍生物(导入了疏水基团的gag或者gag交联体)组合。由此显示了,gag衍生物与趋化因子受体拮抗剂的组合不限定于1对1对应。
[0415]
(试验例8)使用包含azd3778和ha交联体(gel
‑
one)的组合物的cnv抑制作用的验证
[0416]
制作大鼠的激光诱导cnv模型,研究利用包含azd3778(依据国际公开03/004487a1而合成)和gel
‑
one(光交联ha:生化学工业株式会社制)的组合物和azd3778的玻璃体内给予的血管新生抑制作用。
[0417]
<试验物质>
[0418]
将azd3778溶解于dmso,得到azd3778(0.1mg/ml)的溶液。将azd3778溶解于dmso,得到azd3778(5mg/ml)后,将5mg/ml的azd3778(0.0204ml)与gel
‑
one(1.0ml)混合并搅拌,从而得到组合物35。作为试验物质,使用以下。
[0419]
1)组合物35(包含0.1mg/ml的azd3778)
[0420]
2)azd3778(0.1mg/ml)
[0421]
3)dmso
[0422]
<方法>
[0423]
与试验例1的<方法>同样地实施。
[0424]
<统计解析>
[0425]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0426]
<试验结果>
[0427]
将cnv面积测定的结果示于下表和图8。
[0428]
组合物35与azd3778相比,显示出显著的cnv抑制作用。
[0429]
[表8]
[0430] 平均s.e.n检验结果dmso42579201610 azd377843935195210n.s.组合物3535345144110**,##
[0431]
**:p<0.01(相对于dmso)、t检验
[0432]
##:p<0.01(相对于azd3778)、t检验
[0433]
n.s.:无显著性(相对于dmso)、t检验
[0434]
<结论>
[0435]
显示了:包含azd3778和gel
‑
one的组合物可以作为显示出高于azd3778的药效的后眼部疾病处置剂、特别是amd治疗剂使用。另外显示了,作为趋化因子受体拮抗剂,可以使用azd3778。
[0436]
(试验例9)使用包含sb328437和ha交联体(gel
‑
one)的组合物的cnv抑制作用的验证
[0437]
制作大鼠的激光诱导cnv模型,研究利用包含sb328437和gel
‑
one(光交联ha:生化学工业株式会社制)的组合物和sb328437的玻璃体内给予的血管新生抑制作用。
[0438]
<试验物质>
[0439]
将sb328437溶解于dmso,得到sb328437(1mg/ml)的溶液。将sb328437溶解于dmso,得到sb328437(50mg/ml)后,将50mg/ml的sb328437(0.02ml)与gel
‑
one(1.0ml)混合并搅拌,从而得到组合物36。作为试验物质,使用以下。
[0440]
1)组合物36(包含1mg/ml的sb328437)
[0441]
2)sb328437(1mg/ml)
[0442]
3)dmso
[0443]
<方法>
[0444]
与试验例1的<方法>同样地实施。
[0445]
<统计解析>
[0446]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0447]
<试验结果>
[0448]
将cnv面积测定的结果示于下表和图9。
[0449]
组合物36与sb328437相比,显示出显著的cnv抑制作用。
[0450]
[表9]
[0451] 平均s.e.n检验结果dms043155154810 sb3284373891198810*组合物363501275110***,##
[0452]
*:p<0.05、***:p<0.001(相对于dmso)、t检验
[0453]
##:p<0.01(相对于sb328437)、t检验
[0454]
<结论>
[0455]
显示了:包含sb328437和gel
‑
one的组合物可以作为显示出高于sb328437的药效的后眼部疾病处置剂、特别是amd治疗剂使用。另外显示了,作为趋化因子受体拮抗剂,可以使用sb328437。根据试验例5、试验例6、试验例7、试验例8、试验例9,gag交联体可以与多个趋化因子受体拮抗剂(gw766994、ki19003、azd3778、sb328437、sb225002)组合。由此显示了,gag衍生物与趋化因子受体拮抗剂的组合不限定于1对1对应。
[0456]
(试验例10)使用组合物6和组合物7的cnv抑制作用的验证
[0457]
制作大鼠的激光诱导cnv模型,研究利用组合物6、组合物7和gw766994的玻璃体内给予的血管新生抑制作用。
[0458]
<试验物质>
[0459]
将gw766994溶解于dmso,得到gw766994(1.5mg/ml)的溶液。作为试验物质,使用以下。
[0460]
1)组合物6(包含0.71mg/ml的gw766994)
[0461]
2)组合物7(包含0.83mg/ml的gw766994)
[0462]
3)gw766994(1.5mg/ml)
[0463]
4)dmso
[0464]
(组合物6、7分别使用实施例6、7中调制的动物给予用试样)
[0465]
<方法>
[0466]
与试验例1的<方法>同样地实施。
[0467]
<统计解析>
[0468]
关于dmso组和其他组的cnv面积,通过dunnett检验进行解析。显著性水平设为两侧5%。另外,关于gw766994组和组合物群的cnv面积,通过dunnett检验进行解析。显著性水平设为两侧5%。
[0469]
<试验结果>
[0470]
将cnv面积测定的结果示于下表和图10。
[0471]
组合物6、组合物7与gw766994相比,显示出显著的cnv抑制作用。
[0472]
[表10]
[0473] 平均s.e.n检验结果dms03288933718 gw7669943079517018n.s.组合物62538710107*,#组合物7246149698*,##
[0474]
*:p<0.05(相对于dmso)、dunnett检验
[0475]
n.s.:无显著性(相对于dmso)、dunnett检验
[0476]
#:p<0.05,##:p<0.01(相对于gw766994)dunnett检验
[0477]
<结论>
[0478]
显示了:包含gw766994和导入了疏水基团的ha的组合物、包含gw766994和导入了疏水基团的cs的组合物可以作为显示出高于gw766994的药效的后眼部疾病处置剂、特别是amd治疗剂使用。显示了:作为导入了疏水基团的gag中使用的gag,可以使用ha和cs。
[0479]
(试验例11)使用组合物4和组合物5的cnv抑制作用的验证
[0480]
制作大鼠的激光诱导cnv模型,研究利用组合物4、组合物5和ki19003的玻璃体内给予的血管新生抑制作用。
[0481]
<试验物质>
[0482]
将ki19003溶解于dmso,得到ki19003(0.6mg/ml)的溶液。作为试验物质,使用以下。
[0483]
1)组合物4(包含0.42mg/ml的ki19003)
[0484]
2)组合物5(包含0.66mg/ml的ki19003)
[0485]
3)ki19003(0.6mg/ml)
[0486]
4)dmso
[0487]
(组合物4、5分别使用实施例4、5中调制的动物给予用试样)
[0488]
<方法>
[0489]
与试验例1的<方法>同样地实施。
[0490]
<统计解析>
[0491]
关于dmso组和其他组的cnv面积,通过dunnett检验进行解析。显著性水平设为两侧5%。
[0492]
<试验结果>
[0493]
将cnv面积测定的结果示于下表和图11。组合物4、组合物5与dmso相比,显示出显著的cnv抑制作用。
[0494]
[表11]
[0495] 平均s.e.n检验结果dmso34980112516 ki1900330752137114n.s.组合物428766122613**组合物527525134615***
[0496]
**:p<0.01,***:p<0.001(相对于dmso)、t检验
[0497]
n.s.:无显著性(相对于dmso)、dunnett检验
[0498]
<结论>
[0499]
显示了:包含ki19003和导入了疏水基团的ha的组合物和包含ki19003和导入了疏水基团的cs的组合物可以作为显示出高于ki19003的药效的后眼部疾病处置剂、特别是amd治疗剂使用。显示了:作为导入了疏水基团的gag中使用的gag,可以使用ha和cs。
[0500]
(试验例12)使用了组合物8的cnv抑制作用和对眼内出血的影响的验证
[0501]
制作大鼠的激光诱导cnv模型,研究利用组合物8或者肝素与gw766994的配合剂的
玻璃体内给予的血管新生抑制作用和对眼内出血的影响
[0502]
<试验物质>
[0503]
将gw766994溶解于dmso,得到gw766994(10mg/ml)的溶液。将肝素(10mg、aldrich公司制)溶解于pbs(1ml),得到肝素(10mg/ml)后,与10mg/ml的gw766994(0.1ml)混合,调制肝素与gw766994的配合剂2。作为试验物质,使用以下。
[0504]
1)组合物8(包含0.96mg/ml的gw766994)
[0505]
2)配合剂2(包含0.91mg/ml的gw766994)
[0506]
3)pbs
[0507]
(组合物8使用实施例8中调制的动物给予用试样)
[0508]
<方法>
[0509]
(血管新生抑制作用)
[0510]
与试验例1的<方法>同样地实施。
[0511]
(对眼内出血的影响)
[0512]
试验物质刚刚给予后和给予后10天,进行眼内出血的分数评价,根据眼内出血恶化的有无来研究对眼内出血的影响。
[0513]
(1)试验物质刚刚给予后的眼内出血分数评价
[0514]
使用裂隙灯等进行眼内观察,使用下述眼内出血分数基准,作为眼内出血分数。
[0515]
分数0:在观察范围内未观察到出血。
[0516]
分数1:在观察范围内的1/4以下观察到出血。
[0517]
分数2:在观察范围内的1/4以上且1/2以下观察到出血。
[0518]
分数3:在观察范围内的1/2以上观察到出血。
[0519]
(2)给予后第10天的眼内出血分数评价
[0520]
刚刚制作眼杯后,观察玻璃体液/视网膜,使用下述玻璃体液/视网膜的出血分数基准进行分数化。将玻璃体液/视网膜的出血分数的平均值作为眼内出血分数。
[0521]
分数0:在观察范围内未观察到出血。
[0522]
分数1:在观察范围内的1/4以下观察到出血。
[0523]
分数2:在观察范围内的1/4以上且1/2以下观察到出血。
[0524]
分数3:在观察范围内的1/2以上观察到出血。
[0525]
(3)眼内出血恶化的有无的算出
[0526]
根据刚刚给予试验物质后和给予后10天的眼内出血分数的差异,算出有恶化(差为+的眼)的眼数、和无恶化(差为
‑
或0)的眼数。
[0527]
<统计解析>
[0528]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0529]
关于各组的眼内出血恶化的有无,通过2
×
2fisher的直接概率检验进行解析。显著性水平设为单侧5%。
[0530]
<试验结果>
[0531]
将cnv面积测定的结果示于表12和图12。组合物8与pbs相比,显示出显著的cnv抑制作用。
[0532]
将对眼内出血的影响的结果示于表13。肝素与gw766994的配合剂2与pbs和组合物8相比,显示了眼内出血的恶化数显著多。
[0533]
[表12]
[0534] 平均s.e.n检验结果pbs43914182414 配合剂242506171020n.s.组合物838469145418*
[0535]
*:p<0.05(相对于pbs)、t检验
[0536]
n.s.:无显著性(相对于pbs)、t检验
[0537]
[表13]
[0538][0539]
*:p<0.05(相对于pbs)
[0540]
#:p<0.05(相对于组合物8)
[0541]
n.s.:无显著性(相对于pbs)
[0542]
<结论>
[0543]
显示了:包含gw766994和导入了疏水基团的cs的组合物可以作为显示出高于肝素与gw766994的配合剂2的药效的后眼部疾病处置剂、特别是amd治疗剂使用。显示了:单纯地仅配合gag和趋化因子受体拮抗剂时,作为后眼部疾病处置剂是不充分的,确认了使用包含gag衍生物和趋化因子受体拮抗剂的组合物的有用性。
[0544]
对于肝素与gw766994的配合剂2,确认了眼内出血恶化,因此不适于玻璃体内给予。
[0545]
(试验例13)使用专利文献1中使用的增溶剂(dmso)的趋化因子受体拮抗剂溶液、和本发明的组合物的玻璃体内给予时的组织变性的验证
[0546]
向大鼠的玻璃体内单次给予试验物质,观察眼内的状态。
[0547]
<试验物质>
[0548]
作为试验物质,使用以下。
[0549]
1)ki19003(0.6mg/ml)
[0550]
2)sb328437(1mg/ml)
[0551]
3)gw766994(1.5mg/ml)
[0552]
4)组合物5(包含0.66mg/ml的ki19003)
[0553]
5)组合物7(包含0.83mg/ml的gw766994)
[0554]
6)组合物10(包含0.54mg/ml的ki19003)
[0555]
7)组合物11(包含0.53mg/ml的ki19003)
[0556]
8)组合物36(包含1mg/ml的sb328437)
[0557]
(对于组合物5、7、10、11、36,分别使用实施例5、7、10、11、试验例9中调制的动物给予用试样)
[0558]
ki19003与试验例1同样地得到,sb328437与试验例9同样地得到,gw766994与试验例10同样地得到。
[0559]
<方法>
[0560]
(1)试验物质给予
[0561]
动物使用bn/crlcrlj大鼠(雄性、日本charles river株式会社)。在利用麻醉用混合液(生理食盐液:戊巴比妥=9:1)的腹腔内给予(约2ml/只)的全身麻醉下,利用mydrin p滴眼液的滴眼使两眼散瞳。之后,将5μl/眼的试验物质单次给予至两眼的玻璃体内。刚刚给予后,滴眼抗菌药(vigamox滴眼液0.5%)一滴。
[0562]
(2)眼内拍摄
[0563]
使用数码显微镜,拍摄大鼠眼内的状态。
[0564]
<试验结果>
[0565]
将眼内拍摄的结果示于图18a~18h。
[0566]
使用增溶剂的趋化因子受体拮抗剂溶液(ki19003(图18a)、sb328437(图18b)、gw766994(图18c))中,如图中的箭头所示那样,产生了晶状体的组织变性。另一方面,包含gag衍生物和趋化因子受体拮抗剂的组合物即组合物5(图18d)、组合物7(图18e)、组合物10(图18f)、组合物11(图18g)和组合物36(图18h)中,未观察到晶状体的组织变性。
[0567]
<结论>
[0568]
显示了:与使用增溶剂的趋化因子受体拮抗剂溶液相比,包含gag衍生物和趋化因子受体拮抗剂的组合物可以抑制急剧的组织变性的发生,具有优异的趋化因子受体拮抗作用。
[0569]
(试验例14)使用包含rs504393和ha交联体(gel
‑
one)的组合物的cnv抑制作用的验证
[0570]
制作大鼠的激光诱导cnv模型,研究利用包含rs504393和gel
‑
one(光交联ha:生化学工业株式会社制)的组合物和rs504393的玻璃体内给予的血管新生抑制作用。
[0571]
<试验物质>
[0572]
将rs504393(10mg、abcam公司制)溶解于dmso,得到rs504393(0.01mg/ml)的溶液。将rs504393溶解于dmso,得到rs504393(1mg/ml)后,将1mg/ml的rs504393(0.01ml)与gel
‑
one(1.0ml)混合并搅拌,从而得到组合物37。作为试验物质,使用以下。
[0573]
1)组合物37(包含0.01mg/ml的rs504393)
[0574]
2)rs504393(0.01mg/ml)
[0575]
3)dmso
[0576]
<方法>
[0577]
与试验例1的<方法>同样地实施。
[0578]
<统计解析>
[0579]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设
为两侧5%。
[0580]
<试验结果>
[0581]
将cnv面积测定的结果示于下表和图13。
[0582]
组合物37与dmso和rs504393相比,显示出显著的cnv抑制作用。
[0583]
[表14]
[0584] 平均s.e.n检验结果dmso41672281210 rs50439344137223110n.s.组合物3734418162410*,##
[0585]
*:p<0.05(相对于dmso)、t检验
[0586]
##:p<0.01(相对于rs504393)、t检验
[0587]
n.s.:无显著性(相对于dmso)、t检验
[0588]
<结论>
[0589]
显示了:包含rs504393和gel
‑
one的组合物可以作为显示出高于rs504393的药效的后眼部疾病处置剂、特别是amd治疗剂使用。另外显示了,作为趋化因子受体拮抗剂,可以使用rs504393。
[0590]
(试验例15)使用包含ps372424和ha交联体(gel
‑
one)的组合物的cnv抑制作用的验证
[0591]
制作大鼠的激光诱导cnv模型,研究了利用包含ps372424和gel
‑
one(光交联ha:生化学工业株式会社制)的组合物和ps372424的玻璃体内给予的血管新生抑制作用。
[0592]
<试验物质>
[0593]
将ps372424(10mg、calbiochem公司制)溶解于dmso,得到ps372424(0.1mg/ml)的溶液。将ps372424溶解于dmso,得到ps372424(1mg/ml)后,将1mg/ml的ps372424(0.1ml)与gel
‑
one(1.0ml)混合并搅拌,从而得到组合物38。作为试验物质,使用以下。
[0594]
1)组合物38(包含0.091mg/ml的ps372424)
[0595]
2)ps372424(0.1mg/ml)
[0596]
3)dmso
[0597]
<方法>
[0598]
与试验例1的<方法>同样地实施。
[0599]
<统计解析>
[0600]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0601]
<试验结果>
[0602]
将cnv面积测定的结果示于下表和图14。
[0603]
组合物38与dmso和ps372424相比,显示出显著的cnv抑制作用。
[0604]
[表15]
[0605] 平均s.e.n检验结果dmso4243718739 ps37242436842102310*
组合物3831285155310***,##
[0606]
*:p<0.05(相对于dms0)、t检验
[0607]
***:p<0.001(相对于dmso)、t检验
[0608]
##:p<0.01(相对于ps372424)、t检验
[0609]
<结论>
[0610]
显示了:包含ps372424和gel
‑
one的组合物可以作为显示出高于ps372424的药效的后眼部疾病处置剂、特别是amd治疗剂使用。另外显示了,作为趋化因子受体激动剂,可以使用ps372424。
[0611]
(试验例16)使用组合物22(导入了石胆酸的cs:实施例22)和组合物19(导入了油酸的cs:实施例19)的cnv抑制作用的验证
[0612]
制作大鼠的激光诱导cnv模型,研究了利用组合物22、组合物19的玻璃体内给予的血管新生抑制作用。
[0613]
<试验物质>
[0614]
作为试验物质,使用以下。
[0615]
1)pbs
[0616]
2)组合物22(包含0.86mg/ml的gw766994)
[0617]
3)组合物19(包含1.03mg/ml的gw766994)
[0618]
(组合物22、19分别使用实施例22、19中调制的动物给予用试样)
[0619]
<方法>
[0620]
与试验例1的<方法>同样地实施。
[0621]
<统计解析>
[0622]
关于pbs组和其他组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0623]
<试验结果>
[0624]
将cnv面积测定的结果示于下表和图15。组合物22、组合物19与pbs相比,显示出显著的cnv抑制作用。
[0625]
[表16]
[0626] 平均s.e.n检验结果pbs46885187710 组合物2239428142310**组合物1939917198710*
[0627]
*:p<0.05(相对于pbs)、t检验
[0628]
**:p<0.01(相对于pbs)、t检验
[0629]
需要说明的是,如试验例6和10中记载的,溶解于dmso的gw766994(2mg/ml和1.5mg/ml)与dmso相比,在任意浓度下均不具有cnv抑制作用。
[0630]
<结论>
[0631]
显示了:包含gw766994和导入了疏水基团的cs的组合物可以作为显示出高于gw766994的药效的后眼部疾病处置剂、特别是amd治疗剂使用。对于导入了疏水基团的gag中的“疏水基团”,显示了可以使用源自作为胆汁酸的石胆酸等的基本骨架即胆烷酸等脂环
式化合物的基团、源自油酸等脂肪酸的基团。
[0632]
(试验例17)使用了美国专利第8592482号说明书中使用的增溶剂(dmso)的趋化因子受体活性调节剂溶液、和本发明的组合物的玻璃体内给予时的组织变性的验证
[0633]
对大鼠的玻璃体内单次给予试验物质,观察眼内的状态。
[0634]
<试验物质>
[0635]
作为试验物质,使用以下。
[0636]
1)rs504393(0.01mg/ml)
[0637]
2)ps372424(0.1mg/ml)
[0638]
3)组合物37(包含0.01mg/ml的rs504393)
[0639]
4)组合物38(包含0.1mg/ml的ps372424)
[0640]
5)组合物22(包含0.86mg/ml的gw766994)
[0641]
6)组合物19(包含1.03mg/ml的gw766994)
[0642]
(分别地,对于组合物37、rs504393,使用试验例14中调制的动物给予用试样,对于组合物38、ps372424,使用试验例15中调制的动物给予用试样,对于组合物22,使用实施例22中调制的动物给予用试样,对于组合物19,使用实施例19中调制的动物给予用试样)
[0643]
<方法>
[0644]
与试验例13的<方法>同样地实施。
[0645]
<试验结果>
[0646]
将眼内拍摄的结果示于图19a~19f。
[0647]
使用了增溶剂的趋化因子受体活性调节剂溶液(rs504393(图19a)、ps372424(图19b))中,如图中的箭头所示那样,产生了晶状体的组织变性。另一方面,包含gag衍生物和趋化因子受体活性调节剂的组合物即组合物37(图19c)、组合物38(图19d)、组合物22(图19e)和组合物19(图19f)中,未观察到晶状体的组织变性。
[0648]
<结论>
[0649]
显示了:与使用了增溶剂的趋化因子受体活性调节剂溶液相比,包含gag衍生物和趋化因子受体活性调节剂的组合物可以抑制急剧的组织变性的发生,具有优异的趋化因子受体活性调节作用。
[0650]
(试验例18)使用了cs的cnv抑制作用的验证
[0651]
制作大鼠的激光诱导cnv模型,研究利用cs的玻璃体内给予的血管新生抑制作用。
[0652]
<试验物质>
[0653]
将cs(平均分子量约14万、生化学工业株式会社制)溶解于pbs,得到cs(20mg/ml)。作为试验物质,使用以下。
[0654]
1)cs(20mg/ml)
[0655]
2)pbs
[0656]
<方法>
[0657]
与试验例1的<方法>同样地实施。
[0658]
<统计解析>
[0659]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0660]
<试验结果>
[0661]
将cnv面积测定的结果示于下表和图16。
[0662]
cs与pbs相比,未显示出显著的cnv抑制作用。
[0663]
[表17]
[0664] 平均s.e.n检验结果pbs29359174310 cs3046218658n.s.
[0665]
n.s.:无显著性(相对于pbs)、t检验
[0666]
cs单独时,作为老年黄斑变性治疗药,不显著显示出药效。
[0667]
(试验例19)使用了化合物3的cnv抑制作用的验证
[0668]
制作大鼠的激光诱导cnv模型,研究利用化合物3的玻璃体内给予的血管新生抑制作用。
[0669]
<试验物质>
[0670]
将cs(平均分子量约4万、生化学工业株式会社制)溶解于pbs,得到cs(10mg/ml)。作为试验物质,使用以下。
[0671]
1)化合物3
[0672]
2)cs(10mg/ml)
[0673]
<方法>
[0674]
将试验例1的<方法>中的flatmount的制作设为模型制作后4天代替模型制作后10天,除此之外,与试验例1同样地实施。
[0675]
<统计解析>
[0676]
关于各组的cnv面积,通过无对应的两组的检验(t检验)进行解析。显著性水平设为两侧5%。
[0677]
<试验结果>
[0678]
将cnv面积测定的结果示于下表和图17。
[0679]
化合物3与cs相比,未显示出显著的cnv抑制作用。
[0680]
[表18]
[0681] 平均s.e.n检验结果cs5023623718 化合物35192527768n.s.
[0682]
n.s.:无显著性(相对于cs)、t检验
[0683]
<结论>
[0684]
仅为导入了胆烷酸的cs时,与仅为cs同样地,作为老年黄斑变性治疗药,不显著显示出药效。
[0685]
对于日本专利申请2015
‑
110784号(申请日:2015年5月29日)的公开内容,将其整体作为参照引入至本说明书。
[0686]
本说明书中记载的全部文献、专利申请和技术标准与具体且分别地记载各文献、专利申请和技术标准通过参照引入的情况同等程度地,通过参照引入至本说明书。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1