一种布洛芬控释片及其制备方法与流程
1.本发明属于医药技术领域,具体涉及一种布洛芬控释片及其制备方法。
背景技术:
2.布洛芬具有抗炎、镇痛、解热作用,是目前最广泛使用的镇痛解热消炎药之一。在1969年,它首次用于治疗风湿和疼痛的病症。它现在用于缓解和治疗:非严重的关节炎病症的疼痛、风湿、肌肉疼痛、背痛、神经痛、头痛(包括偏头痛)、牙科疼痛、痛经、发热、感冒和流行性感冒的症状。
3.疼痛是一个全球性的巨大问题,据估计,全球约有20%的成年人患有疼痛。疼痛会给人带来各种严重问题,包括但不限于抑郁、无法工作、中断社会关系、自杀想法,因此疼痛会影响人的正常生活。
4.目前市场的布洛芬药品分为两类,一种是速释型,另一种是缓释型。速释剂型释放迅速,但是由于布洛芬的半衰期短(t
1/2
约2小时),药物在体内很快消除,所以药效不能持久,病人需要多次给药。目前市售的缓释剂型能够在一定长的时间内持续起效,减少服药次数,提高患者顺应性,但是不能在服药后快速起效,达不到快速降低患者病痛的作用。
5.本领域需要一种能够快速起效抑制疼痛,且疗效持续时间长,一日服用一次,止痛作用优于已上市布洛芬品种的制剂,同时需要该制剂的制备工艺稳定可控,适合生产商业化生产。
技术实现要素:
6.本发明的目的是克服现有技术的不足之处,提供一种布洛芬控释片及其制备方法,该布洛芬控释片结合了速释和缓释剂型的优点,患者服药后,药物既可以快速起效也可以长时间有效,有积极的临床应用价值。
7.本发明的上述目的是采用如下技术方案来实现的。
8.一方面,本发明提供一种布洛芬控释片,该控释片由含药速释层(即含有布洛芬药物的速释层,也称为速释层)和含药缓释层(即含有布洛芬药物的缓释层,也称为缓释层)组成,其中所述含药缓释层中布洛芬的质量大于所述含药速释层中布洛芬的质量。
9.所述含药缓释层中布洛芬的质量与所述含药速释层中布洛芬的质量的比值≤7,优选地,所述含药缓释层中布洛芬的质量与所述含药速释层中布洛芬的质量之比为7:1~2.2:1,3:1~7:1,4:1~7:1,2.5~7:1,6:1~7:1,2.2:1~3:1,2.2:1~4:1,2.2:1~5:1,2.2:1~6:1,3:1~4:1,4:1~5:1或5:1~6:1之间。
10.优选地,所述含药速释层由以下组分组成:布洛芬、填充剂、粘合剂、崩解剂、润滑剂、助流剂;优选地,以所述布洛芬控释片计,所述含药速释层含重量百分含量为5.00-30.00%的布洛芬,0.50-5.00%的崩解剂;优选地,以所述布洛芬控释片计,所述含药速释层由以下组分组成:布洛芬5.00-30.00%、填充剂2.50-15.00%、粘合剂1.00-5.00%、崩解剂0.50-5.00%、润滑剂0.05-0.5%、助流剂0.05-0.50%;
11.更优选地,以所述布洛芬控释片计,所述含药速释层由以下组分组成:布洛芬6.02-23.04%、填充剂4.70-9.37%、粘合剂1.13-2.76%、崩解剂0.64-2.35%、润滑剂0.08-0.16%、助流剂0.15-0.32%;
12.优选地,所述含药缓释层由以下组分组成:布洛芬、缓释聚合物、填充剂、润滑剂、助流剂;
13.优选地,以所述布洛芬控释片计,所述含药速释层含重量百分含量为芬30.00-65.00%的布洛芬,5.00-25.00%的缓释聚合物;优选地,以所述布洛芬控释片计,所述含药缓释层由以下组分组成:布洛芬30.00-65.00%、缓释聚合物5.00-25.00%、填充剂1.50-25.00%、润滑剂0.10-0.50%、助流剂0.10-0.50%。
14.更优选地,以所述布洛芬控释片计,所述含药缓释层由以下组分组成:布洛芬39.16-50.98%、缓释聚合物11.44-21.97%、填充剂2.13-19.82%、润滑剂0.34-0.42%、助流剂0.16-0.21%。
15.优选地,所述缓释聚合物含黄原胶,且以所述布洛芬控释片计,黄原胶的重量百分含量为5~10%。
16.优选地,所述含药缓释层的质量与所述含药速释层的质量之比为5.6:1~1.66:1。
17.优选地,所述控释片的形状为椭圆形或胶囊形。所述含药速释层和含药缓释层分别构成所述布洛芬控释片的上层和下层。
18.布洛芬控释片的外形会影响患者服药的顺应性,优选的其形状为椭圆形。如剂量为800mg,则片子长宽优选为21x10mm,片厚优选为5~9mm。片剂尺寸可根据剂量和片重调整至合适尺寸。
19.优选地,所述的控释片在压片过程中,预压力范围为0.1-2kn,优选为0.1~0.5kn;主压力范围为5~60kn,优选为10~50kn。
20.优选地,所述的布洛芬控释片还包括包裹在所述含药速释层和含药缓释层之间的片芯层。
21.优选地,所述片芯层为速释片芯层或缓释片芯层。
22.优选地,当所述片芯层为缓释片芯层时,所述含药缓释层和所述缓释片芯层中布洛芬质量之和与所述含药速释层中的布洛芬质量之比为2.2:1~7:1,3:1~7:1,4:1~7:1,2.5~7:1,6:1~7:1,2.2:1~3:1,2.2:1~4:1,2.2:1~5:1,2.2:1~6:1,3:1~4:1,4:1~5:1或5:1~6:1;其中所述含药缓释层中的布洛芬质量和所述缓释片芯层中布洛芬质量之比为27:1~3:1或19:1~4.6:1
23.当所述片芯层为速释片芯层时,所述含药缓释层中布洛芬质量与所述速释片芯层和所述含药速释层中的布洛芬质量之和的比值为2.2:1~7:1,3:1~7:1,4:1~7:1,2.5~7:1,6:1~7:1,2.2:1~3:1,2.2:1~4:1,2.2:1~5:1,2.2:1~6:1,3:1~4:1,4:1~5:1或5:1~6:1;其中所述含药速释层中的布洛芬质量和所述速释片芯层中布洛芬质量之比为11:1~1:1或10:1~2:1
24.优选地,所述片芯层的片型为圆形,直径为≤7mm(例如6mm),片芯片重占总片重的6.63~13.32%;
25.优选地,所述缓释片芯层由以下组分组成:布洛芬、缓释聚合物、填充剂、润滑剂、助流剂、肠溶包衣预混剂;
26.优选地,以所述布洛芬控释片计,所述缓释片芯层由以下组分组成:布洛芬2.00-10.00%、缓释聚合物0.50-5.00%、填充剂0.50-5.00%、润滑剂0.01-2.00%、助流剂0.01-2.00%、肠溶包衣预混剂0.500-5.00%。
27.更优选地,以所述布洛芬控释片计,所述缓释片芯层由以下组分组成:布洛芬2.50-7.50%、缓释聚合物1.00-3.00%、填充剂1.00-3.00%、润滑剂0.03-1.00%、助流剂0.01-1.00%、肠溶包衣预混剂0.50-3.00%。
28.优选地,所述速释片芯层由以下组分组成:布洛芬、填充剂、粘合剂、崩解剂、润滑剂、助流剂、肠溶包衣预混剂;
29.优选地,以所述布洛芬控释片计,所述速释片芯层由以下组分组成:布洛芬3.00-15.00%、填充剂0.30-5.00%、粘合剂0.50-8.00%、崩解剂0.20-5.00%、润滑剂0.05-2.00%、助流剂0.01-2.00%、肠溶包衣预混剂0.50-5.00%。
30.更优选地,以所述布洛芬控释片计,所述速释片芯层由以下组分组成:布洛芬2.00-10.00%、填充剂0.50-3.00%、粘合剂0.50-5.00%、崩解剂0.20-2.00%、润滑剂0.03-1.00%、助流剂0.01-1.00%、肠溶包衣预混剂0.50-3.00%。
31.优选地,所述含药速释层、所述含药缓释层、所述速释片芯层和所述缓释片芯层中的填充剂独立地选自乳糖、玉米淀粉、预胶化淀粉和微晶纤维素中的一种或多种;优选为玉米淀粉、预胶化淀粉或微晶纤维素;
32.优选地,所述含药速释层和所述速释片芯层中的粘合剂独立地选自羧甲基纤维素钠、聚维酮、和羟丙基纤维素(hpc)中的一种或多种;优选为聚维酮或羟丙基甲基纤维素(hpmc);
33.优选地,所述含药速释层和所述速释片芯层中的崩解剂独立地选自交联羧甲基淀粉钠、交联羧甲基纤维素钠、交联聚维酮pvpp和低取代羟丙基纤维素l-hpc中的一种或多种;优选为交联羧甲基淀粉钠或交联羧甲基纤维素钠;
34.优选地,所述含药速释层、所述含药缓释层、所述速释片芯层和所述缓释片芯层中的润滑剂独立地选自硬脂酸镁、硬脂酸、硬脂富马酸钠、山嵛酸甘油酯、氢化蓖麻油和十二烷基硫酸钠中的一种或多种;优选为硬脂酸镁或硬脂酸;
35.优选地,所述含药速释层、所述含药缓释层、所述速释片芯层和所述缓释片芯层中的助流剂独立地为胶态二氧化硅或滑石粉;优选为胶态二氧化硅;
36.优选地,所述含药缓释层和所述缓释片芯层中的缓释聚合物为羟丙甲基纤维素和黄原胶的组合。
37.优选地,所述速释片芯层和所述缓释片芯层中的肠溶包衣预混剂为甲基丙烯酸共聚物、聚乙烯醇醋酸苯二甲酸酯和欧巴代中的一种或多种;优选为甲基丙烯酸共聚物。
38.优选地,所述控释片中黄原胶(xg)的含量为5.00~10.00%。该物质的含量对控制药物释放起着关键作用,本发明发现:当处方中黄原胶的比例大于10%时,会导致以下问题:(1)湿法制粒需要极大比例地增加制粒液中的有机溶剂,否则湿整粒过程会出现严重的堵塞筛网情况,造成收率急剧下降甚至工艺无法进行的情况;(2)提高制粒液中的有机溶剂比例,本身会增加成本,也会增加工艺的危险性,同时生产设备需要配备防暴设施,极大地增加了生产成本;(3)提高制粒液中的有机溶剂比例,同时还会导致最终片剂中的有机溶剂残留量增加,增大了片剂的不安全风险;(4)由于黄原胶本身的特殊性质,其在处方中比例
大于10%后,会导致颗粒可压性下降,导致片剂硬度无法提高,达不到正常的硬度要求,易出现片剂脆碎度不合格问题,也会导致裂片问题;(5)当处方中黄原胶的比例大于10%时,还会出现片剂进行加速稳定性考察一段时间后,体外溶出速率显著增加的问题(见图9);(6)当黄原胶的处方比例大于10%,甚至更高时,引发的布洛芬压片时的粘冲问题就越严重。因此,本技术通过调整处方,降低黄原胶的比例至5.00~10.00%,可以避免以上所有问题,且同样可以达到体内24h持续有效的目的。
39.优选地,以所述布洛芬控释片计,所述缓释聚合物中的羟丙基甲基纤维素(hpmc)的含量为1~25%,优选为1.58%~16.97%。
40.优选地,所述缓释聚合物中的羟丙基甲基纤维素(hpmc)的粘度范围为3~2000mpa.s。
41.优选地,所述控释片中缓释聚合物中的羟丙基甲基纤维素(hpmc)选自e3lv、e5lv、e6 lv、e15 lv、e30 lv、e50lv、k100lv、sh50、sh400和sh1500的一种或多种。
42.所述布洛芬控释片中,所述缓释聚合物中的羟丙甲纤维素(hpmc)对控制药物释放行为起着重要作用,所述缓释聚合物中的hpmc的最优处方占比范围是1.58%~16.97%,hpmc的粘度对药物的溶出有重要影响,其最优的粘度范围是3~2000mpa.s,在本技术中,hpmc选自e3lv、e5 lv、e6 lv、e15 lv、e30 lv、e50lv、k100lv、sh50、sh400和sh1500中的一种或多种。
43.所述的布洛芬控释片的片重根据剂量增加而增加。如剂量为800mg,则缓释层片重范围为625mg~1400mg,速释层片重范围为250mg~375mg。如剂量为800mg时,在空腹条件进行人体pk实验,1h~24h血药浓度可达到5.0μg/ml。
44.另一方面,本发明提供一种制备布洛芬控释片的方法,该方法包括如下步骤:
45.a、称取制备含药速释层所需处方量的布洛芬、填充剂,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入粘合剂、崩解剂、助流剂,预混合,再加入润滑剂混合,制得含药速释层颗粒,备用;
46.b、称取制备含药缓释层所需处方量的布洛芬、缓释聚合物、填充剂,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入助流剂,预混合,再加入润滑剂混合制得含药缓释层颗粒,备用;
47.d、将处方量的含药缓释层颗粒置于压片机的冲模内,预压;再将处方量的含药速释层颗粒置于冲模内,压制成片;
48.优选地,本发明提供一种制备布洛芬控释片的方法,该方法包括如下步骤:
49.a、称取制备含药速释层所需处方量的布洛芬、填充剂,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入粘合剂、崩解剂、助流剂,预混合,再加入润滑剂混合,制得含药速释层颗粒,备用;
50.b、称取制备含药缓释层所需处方量的布洛芬、缓释聚合物、填充剂,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入助流剂,预混合,再加入润滑剂混合制得含药缓释层颗粒,备用;
51.c、取制得的含药速释层或者含药缓释层颗粒置于压片机的冲模内,压制成片芯素片;以及
52.e、称取处方量的肠溶包衣预混剂,用醇溶液配制成肠溶包衣液;将步骤c压制的片
芯素片置于包衣机内使用配置的肠溶包衣液进行包衣,制得片芯层,备用;
53.f、将处方量的缓释层颗粒置于压片机的冲模内,将片芯层置于缓释层上,预压;再将处方量的速释层颗粒置于冲模内,压制成片;
54.优选地,在步骤d或f中,所述预压力为0.1-2kn,优选0.1~0.5kn;主压力为5-60kn,优选10~50kn。所述的布洛芬控释片在压片过程中,预压压力对片剂的硬度和脆碎度有重要影响,预压压力太小导致填充量不够,达不到目标片重;预压压力太大会导致裂片,预压力的最优范围是0.1~0.5kn。主压力也会影响片剂的硬度和脆碎度,主压力太小可能导致达不到目标硬度,脆碎度不合格,预压压力太大易导致裂片或硬度超限,主压力的最优范围为10~50kn。
55.本发明提供的布洛芬控释片兼顾了快速起效和持续起效,其制备工艺易于控制、便于扩大生产、过程中不会产生杂质,所制备的布洛芬控释片具有稳定的结构从而保障预定的药物释放模型。在优选实施方案中,本发明具有如下技术效果:以800mg规格片剂为例,在本发明试验的所述溶出条件下,1h体外溶出度为20%~40%,18h体外溶出度》90%,在空腹条件下,药物服用1片后,含药速释层快速崩解释放药物,布洛芬迅速起效产生疼痛抑制作用,同时含药缓释层可以控制药物缓慢释放l,1-24小时内的体内血药浓度可以达到5.0μg/ml,即服用本发明提供的布洛芬片剂1片,即可达到24小时有效止痛的效果。
附图说明
56.图1为本技术的布洛芬控释片的结构示意图(不含片芯);
57.图2为本技术的布洛芬控释片的结构示意图(含片芯);
58.图3为实施例1-5的布洛芬控释片的体外溶出曲线;
59.图4为实施例7-8的布洛芬控释片的体外溶出曲线;
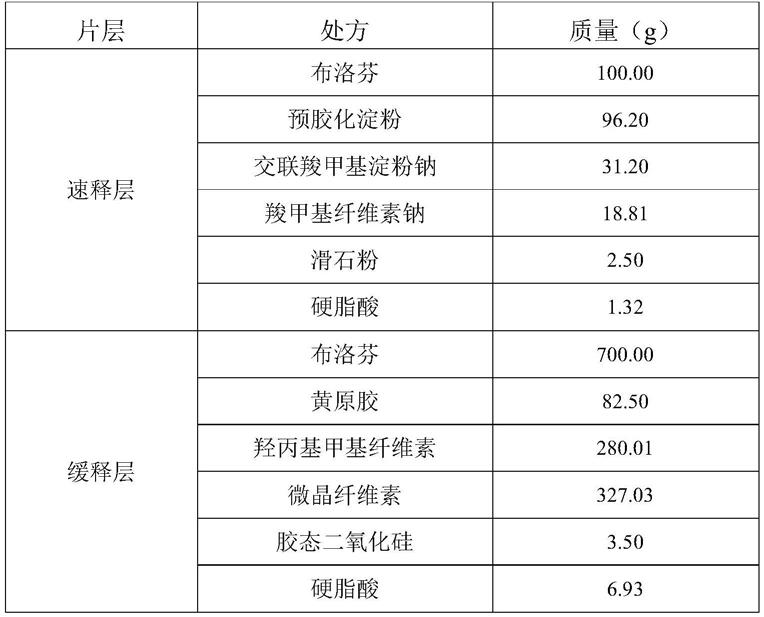
60.图5为处方i、ii的体外溶出曲线;
61.图6为实施例2、5的布洛芬控释片的体内曲线;
62.图7为实施例7的布洛芬控释片的体内曲线;
63.图8为实施例2和市售布洛芬产品体内血药浓度曲线;
64.图9不同黄原胶比例处方稳定性溶出比较。
具体实施方式
65.下面通过实施例对本发明作进一步详述。
66.以下实施例中采用的溶出条件如下:桨法+沉降篮,溶出介质为ph7.2磷酸盐缓冲液+2%sds,900ml,转速为200rpm,溶液温度为37℃。
67.实施例1制备1000片布洛芬控释片(不含片芯)
68.以制备1000片布洛芬控释片为例,其各组成成分及用量如下表:
[0069][0070]
本发明实施例1制备布洛芬控释片的方法包括如下步骤:
[0071]
a、称取制备速释层所需处方量的布洛芬100.00g、填充剂96.20g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入粘合剂18.81g、崩解剂31.20g、助流剂2.50g,预混合,再加入润滑剂1.32g混合,制得速释层颗粒,备用;
[0072]
b、称取制备缓释层所需处方量的布洛芬700.00g、缓释聚合物362.51g、填充剂327.03g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入助流剂3.50g,预混合,再加入润滑剂6.93g混合制得缓释层颗粒,备用;
[0073]
c、将处方量的缓释层颗粒置于压片机的冲模内,0.5kn预压;再将处方量的速释层颗粒置于冲模内,主压力10kn压制成片。
[0074]
实施例2制备2000片布洛芬控释片(不含片芯)
[0075]
以制备2000片布洛芬控释片为例,其各组成成分及用量如下表:
[0076][0077]
本发明实施例2制备布洛芬控释片的方法包括如下步骤:
[0078]
a、称取制备速释层所需处方量的布洛芬300.00g、填充剂185.90g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入粘合剂44.88g、崩解剂60.00g、助流剂6.12g,预混合,再加入润滑剂3.05g混合,制得速释层颗粒,备用;
[0079]
b、称取制备缓释层所需处方量的布洛芬1300.00g、缓释聚合物471.00g、填充剂164.50g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入助流剂4.85g,预混合,再加入润滑剂9.70g混合制得缓释层颗粒,备用;
[0080]
c、将处方量的缓释层颗粒置于压片机的冲模内,0.4kn预压;再将处方量的速释层颗粒置于冲模内,主压力20kn压制成片。
[0081]
实施例3制备800片布洛芬控释片(不含片芯)
[0082]
以制备800片布洛芬控释片为例,其各组成成分及用量如下表:
[0083]
[0084][0085]
本发明实施例3制备布洛芬控释片的方法包括如下步骤:
[0086]
a、称取制备速释层所需处方量的布洛芬160.00g、填充剂57.10g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入粘合剂19.50g、崩解剂19.50g、助流剂2.60g,预混合,再加入润滑剂1.30g混合,制得速释层颗粒,备用;
[0087]
b、称取制备缓释层所需处方量的布洛芬480.00g、缓释聚合物143.90g、填充剂55.00g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入助流剂1.70g,预混合,再加入润滑剂3.40g混合制得缓释层颗粒,备用;
[0088]
c、将处方量的缓释层颗粒置于压片机的冲模内,0.3kn预压;再将处方量的速释层颗粒置于冲模内,主压力30kn压制成片。
[0089]
实施例4制备1000片布洛芬控释片(不含片芯)
[0090]
以制备1000片布洛芬控释片为例,其各组成成分及用量如下表:
[0091]
[0092][0093]
本发明实施例4制备布洛芬控释片的方法包括如下步骤:
[0094]
a、称取制备速释层所需处方量的布洛芬250.00g、填充剂51.00g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入粘合剂26.26g、崩解剂17.50g、助流剂3.50g,预混合,再加入润滑剂1.74g混合,制得速释层颗粒,备用;
[0095]
b、称取制备缓释层所需处方量的布洛芬550.00g、缓释聚合物125.64g、填充剂53.82g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入助流剂1.84g,预混合,再加入润滑剂3.70g混合制得缓释层颗粒,备用;
[0096]
c、将处方量的缓释层颗粒置于压片机的冲模内,0.1kn预压;再将处方量的速释层颗粒置于冲模内,主压力50kn压制成片。
[0097]
实施例5制备500片布洛芬控释片(不含片芯)
[0098]
以制备500片布洛芬控释片为例,其各组成成分及用量如下表:
[0099]
[0100][0101]
本发明实施例5制备布洛芬控释片的方法包括如下步骤:
[0102]
a、称取制备速释层所需处方量的布洛芬150.00g、填充剂15.96g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入粘合剂14.07g、崩解剂4.69g、助流剂1.89g,预混合,再加入润滑剂0.90g混合,制得速释层颗粒,备用;
[0103]
b、称取制备缓释层所需处方量的布洛芬250.00g、缓释聚合物61.20g、填充剂8.87g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入助流剂0.80g,预混合,再加入润滑剂1.62g混合制得缓释层颗粒,备用;
[0104]
c、将处方量的缓释层颗粒置于压片机的冲模内,0.1kn预压;再将处方量的速释层颗粒置于冲模内,主压力50kn压制成片。
[0105]
实施例6制备500片布洛芬控释片(不含片芯)
[0106]
以制备500片布洛芬控释片为例,其各组成成分及用量如下表:
[0107][0108]
本发明实施例6制备布洛芬控释片的方法包括如下步骤:
[0109]
a、称取制备速释层所需处方量的布洛芬75.00g、填充剂46.47g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入粘合剂11.22g、崩解剂14.98g、助流剂1.54g,预混合,再加入润滑剂0.78g混合,制得速释层颗
粒,备用;
[0110]
b、称取制备缓释层所需处方量的布洛芬325.00g、缓释聚合物149.63g、填充剂9.27g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入助流剂1.22g,预混合,再加入润滑剂2.42g混合制得缓释层颗粒,备用;
[0111]
c、将处方量的缓释层颗粒置于压片机的冲模内,0.4kn预压;再将处方量的速释层颗粒置于冲模内,主压力20kn压制成片。
[0112]
实施例1-5片剂的结构图如图1所示。通过前述的溶出方法检测实施例1-5布洛芬控释片的体外释放情况和实施例2、5的布洛芬控释片的空腹体内血药浓度,结果分别如图3和图6所示。
[0113]
实施例1~4的1-24h血药浓度均能达到5.0μg/ml,均高于4.0μg/ml;实施例5的24h血药浓度只有3.25μg/ml,不能实现24h长效止痛的效果。
[0114]
实施例7制备1000片布洛芬控释片(含片芯)
[0115]
以制备1000片布洛芬控释片为例,其各组成成分及用量如下表:
[0116]
[0117][0118]
本发明实施例7制备布洛芬控释片的方法包括如下步骤:
[0119]
a、称取制备速释层所需处方量的布洛芬100.00g、填充剂96.14g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入粘合剂18.76g、崩解剂31.25g、助流剂2.50g,预混合,再加入润滑剂1.33g混合,制得速释层颗粒,备用;
[0120]
b、称取制备缓释片芯层所需处方量的布洛芬50.00g、缓释聚合物25.90、填充剂23.45g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入助流剂0.20g,预混合,再加入润滑剂0.50g混合制得缓释层颗粒,备用;
[0121]
c、称取制备缓释层所需处方量的布洛芬650.00g、缓释聚合物336.70g、填充剂303.65g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入助流剂3.16g,预混合,再加入润滑剂6.50g混合制得缓释层颗粒,备用;
[0122]
d、取制得的缓释片芯层颗粒置于压片机的冲模内,压制成片芯素片;以及
[0123]
e、称取处方量的肠溶包衣预混剂9.96g,用95%醇溶液配制成固含量9.9%肠溶包衣液;将步骤d压制的片芯素片置于包衣机内用配置的肠溶包衣液进行包衣,制得片芯层,备用;
[0124]
f、将处方量的缓释层颗粒置于压片机的冲模内,将片芯层置于缓释层上,0.5kn预压;再将处方量的速释层颗粒置于冲模内,主压力10kn压制成片。
[0125]
实施例8制备800片布洛芬控释片(含片芯)
[0126]
以制备800片布洛芬控释片为例,其各组成成分及用量如下表:
[0127][0128]
本发明实施例8制备布洛芬控释片的方法包括如下步骤:
[0129]
a、称取制备速释层所需处方量的布洛芬120.00g、填充剂85.32g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入粘合剂17.28g、崩解剂5.82g、助流剂2.36g,预混合,再加入润滑剂1.18g混合,制得速释层颗粒,备用;
[0130]
b、称取制备速释片芯层所需处方量的布洛芬80.00g、填充剂8.46g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入粘合剂7.55g、崩解剂2.46g、助流剂1.00g,预混合,再加入润滑剂0.45g混合,制得速释片芯层颗粒,备用;
[0131]
c、称取制备缓释层所需处方量的布洛芬440.00g、缓释聚合物104.07g、填充剂19.37g,用纯化水或醇溶液进行湿法制粒,湿整粒过1000-8000μm筛网,干燥,干整粒过1000-8000μm筛网,加入助流剂1.46g,预混合,再加入润滑剂3.18g混合制得缓释层颗粒,备用;
[0132]
d、取制得的速释片芯层颗粒置于压片机的冲模内,压制成片芯素片;以及
[0133]
e、称取处方量的肠溶包衣预混剂9.64g,用95%醇溶液配制成固含量9.9%肠溶包衣液;将步骤d压制的片芯素片置于包衣机内用配置的肠溶包衣液进行包衣,制得片芯层,备用;
[0134]
f、将处方量的缓释层颗粒置于压片机的冲模内,将片芯层置于缓释层上,0.1kn预压;再将处方量的速释层颗粒置于冲模内,主压力50kn压制成片。
[0135]
上述方法制备得到的片剂的结构图如图2所示。实施例7-8的体外溶出数据及实施例7体内数据分别如图4和图7所示。
[0136]
实施例9
[0137]
本实施例验证了不同处方(实施例2、实施例3与市售产品)的体内血药浓度。市售产品基本信息如下表所示:
[0138][0139]
目前市场的布洛芬药品分为两类,一种是速释型(advil、ibu
tm
),另一种是缓释型速释剂型释放迅速,但是由于布洛芬的半衰期短(t
1/2
约2小时),药物在体内很快消除,所以药效不能持久,病人需要多次给药。目前市售的缓释剂型能够在一定长的时间内持续起效,减少服药次数,提高患者顺应性,但是不能在服药后快速起效,达不到快速降低患者病痛的作用。目前市场上唯一的速释加缓释的制剂可以做到服药后快速起效,但达不到24h持续有效的效果,仍然需要每天服药2次。
[0140]
实验结果如图8所示,可以看出,实施例2在0-4h的血药浓度,高于advil、的市售制剂,能够快速起效;在12-24h的血药浓度,均高于ibu
tm
800mg速释片,将有效时间从12h延长到了24h。
[0141]
实施例10
[0142]
本实施例验证了不同黄原胶比例(实施例2和实施例6)处方的稳定性溶出,结果如图9所示,可以看出,当处方中黄原胶的比例大于10%时,进行加速稳定性考察一段时间后,还会出现片剂体外溶出速率显著增加的问题。
[0143]
同时检测了不同黄原胶比例(实施例2、实施例4和实施例5)下,控释片硬度和脆碎度情况,结果如下表所示:
[0144]
实施例黄原胶比例硬度n脆碎度%是否裂片实施例27%150-2300.02否实施例410%120-1700.09否实施例511%70-1000.12是
[0145]
可以看出,当处方中黄原胶比例大于10%时,可能出现硬度较低及脆碎度不合格(裂片)的情况。
[0146]
综上,当配方中黄原胶比例高于10%时,不仅仅血药浓度达不到止痛效果(实施例5的空腹血药检测数据),配方不适于量产。
[0147]
实施例11
[0148]
本实施例验证了速释层和缓释层组合的处方i和处方ii的效果,具体处方i和处方ii的组成如下:
[0149][0150][0151]
处方i中,缓释聚合物为hpmc-k100lv,含量12%,缓释层与速释层中布洛芬的比例为2;进行体外溶出试验,结果见图5所示,可以看出,处方i的缓释层药物12个小时就完全释放了,不能实现24小时长效止痛;
[0152]
处方ii中,缓释聚合物为hpmc-k100m,含量18%;缓释层与速释层中布洛芬的比例为2;进行体外溶出试验,结果见图5所示,可以看出,处方ii虽然持续释放24h,但是释放溶出度仅有66%,释放不完全,不可能实现理想的血药浓度,即不能实现长效止痛。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1