一种黄精炮制方法与流程
1.本发明属于中药材炮制技术领域,涉及一种黄精的炮制工艺方法。
背景技术:
2.黄精,又名鸡头黄精、黄鸡菜、老虎姜,为百合科黄精属植物黄精(polygonatum sitbiricum red.)的根茎,曾被李时珍誉为“宝药”,是一种传统的名贵滋补中药。
3.黄精具有补脾润肺、益气养阴、生津止渴功效,味甘、性平和,适用于脾胃虚寒、体倦乏力、精神疲倦、肺燥干咳、消渴以及阳痿等患者食用。以黄精为主药,配以其他中药材,对治疗肺结核咯血、冠心病、心绞痛、肺燥干咳和百日咳等有显著疗效。现代药理研究发现,黄精具有降血压血糖、增强生物体免疫力、预防动脉粥样硬化、肝脂肪浸润、延缓衰老等作用,是男女老少四季皆宜的保健食品。
4.生黄精具有麻味,服用对口舌和咽喉有刺激,一般不直接入药或食用,需经炮制后方可食用。
5.黄精的炮制方法始载于南北朝《雷公炮炙论》,唐代创制“九蒸九晒”法。历代黄精炮制方法主要有清蒸、酒蒸、九蒸九晒、酒炖合蒸、黑豆制、熟地汁制等法。《中国药典》(一部)2020版品种“黄精”中提供了酒黄精的炮制工艺:“取净黄精,照酒炖法或酒蒸法(通则0213)炖透或蒸透,稍晾,切厚片,干燥”。经此炮制黄精的性味有较大的变化。
6.目前的黄精炮制工艺总体处于百花齐放状态,大多黄精炮制工艺比较含糊,加工方法不明确,导致炮制出的黄精质量和口感参差不齐,成品中多糖、总皂苷、总黄酮等功效成分波动较大,药效极不稳定。
7.cn 105232961a、cn 110215496a、cn 108743797a等公开的黄精炮制方法中,都是通过减少蒸制次数的方式,以期达到降低多糖流失的目的。但其同时还存在着生黄精对咽喉的刺激和滋腻性没有完全消除的问题,另外,其功效相对于传统的黄精制品也并没有明显区别。
8.cn 110772597a公开了一种滇黄精九蒸九晒特色加工工艺,在提供了具体蒸晒工艺参数的基础上,该专利仅对所制备滇黄精的保质期进行了初步分析,却对成品滇黄精的品质欠缺论证。
技术实现要素:
9.本发明的目的是提供一种黄精炮制方法,在充分去除黄精的刺激性,改善黄精食用口感,减少蒸晒过程中多糖等有效成分的损失,最大程度保持炮制黄精原有药效的同时,强化其提高免疫力的效果。
10.本发明所述的黄精炮制方法包括:1)、将生黄精于150~170℃蒸制8~12h,晾晒至含水量12~14wt%;2)、取生黄精质量4~6wt%的黄酒,均匀喷洒在步骤1)晾晒后的黄精上;3)、再次于150~170℃下蒸制,然后晾晒,并在蒸制过程中收集产生的黄精汁;
4)、重复步骤3),反复蒸制、晾晒2~6次并收集产生的黄精汁后,切制黄精切片;5)、合并收集的黄精汁,加入由乳酸菌和酒药组成的复合有益菌,活化2~5h后,均匀转移至黄精切片上,30~35℃下发酵18~22h;6)、发酵后的黄精切片于150~170℃蒸制1~2次,并晾晒,至黄精切片含水量9~10wt%,获得炮制黄精。
11.其中,优选地,本发明是将收集到的黄精汁浓缩至生黄精质量的4~6wt%。
12.进而,更具体地,所述的复合有益菌是由6~8质量份乳酸菌与1~2质量份含有戊糖片球菌和扣囊复膜孢酵母的酒药混合得到的。
13.其中,所述的酒药是用于酿造黄酒或江米酒的曲。本发明使用的酒药中,戊糖片球菌与扣囊复膜孢酵母的比例为1∶2~3。
14.进一步地,本发明中在黄精汁中加入复合有益菌的用量为生黄精质量的1~2wt%。
15.优选地,本发明是将黄精切成厚度为3~5mm的黄精切片。
16.一般地,本发明炮制方法中使用的原料生黄精的含水量为30~45wt%。
17.在本发明的炮制方法中,优选控制蒸制过程中的蒸汽压力为0.2~0.25mpa。
18.更优选地,本发明是将传统的九蒸九晒方式与本发明的黄精炮制方法进行结合,用于制备九蒸九晒黄精。
19.具体地,所述的九蒸九晒是按照上述黄精炮制方法,将生黄精蒸制、晾晒1次;喷洒上黄酒,反复蒸制、晾晒6次,并收集6次蒸制产生的黄精汁;以及将经加有复合有益菌的黄精汁发酵后的黄精切片蒸制、晾晒2次。
20.更具体地,在所述九蒸九晒的过程中,控制第2次蒸制的时间为第1次蒸制时间的一半,并从第2次蒸制开始,采用以相同的蒸制时间蒸制2次后将蒸制时间减半的方式,逐渐减少蒸制时间。
21.经检测,采用本发明炮制方法获得的黄精制品含蛋白质6.35
±
0.52%、膳食纤维20.96
±
0.72%、粗纤维8.76
±
1.12%、总糖51.22
±
4.28%、碳水化合物70.9
±
7.33%、黄精多糖(以葡萄糖计)3.95
±
0.64%、总黄酮396.12
±
20.71mg/100g,总皂苷15.37
±
2.83mg/g,制品中保持了较高的有效组分含量。
22.本发明黄精炮制方法的关键是采用加入酒药和乳酸菌的浓缩黄精汁喷洒入黄精中进行发酵,是影响黄精中皂苷和黄酮有效活性组分含量的关键工序。将黄精经微生物复合菌种混合发酵后,使得炮制出的黄精制品不仅总皂苷和总黄酮含量较传统黄酒浸泡黄精制品明显增加,而且显著提高了制品的细胞修复能力和免疫力效果。同时,采用本发明工艺方法炮制出的黄精外观油润有光泽,香气更为纯正,口感更佳。
23.特别是经实验验证,本发明添加有益菌炮制得到的黄精制品可以提高m0型巨噬细胞的增殖能力,增加m0型巨噬细胞的atp产能,增强机体的免疫力;在体外模拟的肿瘤微环境中通过降低肿瘤相关m2型巨噬细胞atp产能、减少m2型巨噬细胞极化,从而提高抗炎和抗肿瘤的免疫能力。在正常支气管上皮细胞和炎症支气管上皮细胞中,本发明黄精制品也显示出了增加支气管上皮细胞atp产能,提高细胞修复能力的作用。
24.本发明所述的黄精炮制方法中,工艺流程基本与传统的蒸制工艺一致,所述蒸晒用的蒸笼和簸箕优选采用传统的竹制蒸笼和竹簸箕,避免了黄精加工过程中与铁器接触;所述的加热蒸制采用了蒸汽灶蒸煮而不采用高温高压蒸煮模式,对设备要求极低,适合大
面积推广且不影响大规模生产。
25.采用本发明炮制方法获得的黄精制品,不论是直接泡茶、制作冲剂还是提取制作黄精膏制品,其清亮性更好,稳定性更佳,明显提高了黄精产品的品质。
附图说明
26.图1是本发明黄精制品对正常支气管上皮beas
‑
2b细胞的atp产量结果。
27.图2是本发明黄精制品对炎症支气管上皮beas
‑
2b细胞的atp产量结果。
28.图3是不同实验组黄精制品对m0型巨噬细胞raw264.7的增殖作用影响,其中a)为第一对照组,b)为第二对照组,c)为试验组。
29.图4是不同实验组黄精制品对m0型巨噬细胞raw264.7的atp产量结果,其中a)为第一对照组,b)为第二对照组,c)为试验组。
30.图5是不同实验组黄精制品对极化的m2型巨噬细胞raw264.7的atp产量结果,其中a)为第一对照组,b)为第二对照组,c)为试验组。
具体实施方式
31.下面结合实施例和比较例,对本发明的具体实施方式作进一步详细描述。以下实施例和比较例仅用于更加清楚地说明本发明的技术方案,从而使本领域技术人员能很好地理解和利用本发明,而不是限制本发明的保护范围。
32.本发明实施例和比较例中涉及到的实验方法、生产工艺、仪器以及设备,其名称和简称均属于本领域内常规的名称,在相关用途领域内均非常清楚明确,本领域内技术人员能够根据该名称理解常规工艺步骤并应用相应的设备,按照常规条件或制造商建议的条件进行实施。
33.本发明实施例和比较例中使用的各种原料或试剂,并没有来源上的特殊限制,均为可以通过市售购买获得的常规产品。也可以按照本领域技术人员熟知的常规方法进行制备。
34.本发明炮制过程中用到的复合有益菌中的戊糖片球菌、扣囊复膜孢酵母和乳酸菌,均按照常规微生物培养中各自的最适培养基和培养条件进行培养并收集菌体使用。
35.本发明各实施例生黄精与炮制黄精的基本组分含量按照以下方法进行测定。
36.水分:参照gb 5009.3
‑
2016《食品安全国家标准 食品中水分的测定》。
37.灰分:参照gb 5009.4
‑
2016《食品安全国家标准 食品中灰分的测定》。
38.总糖:参照gb/t 15672
‑
2009《食用菌中总糖含量的测定》。
39.脂肪:参照gb 5009.6
‑
2016《食品安全国家标准 食品中脂肪的测定》。
40.蛋白质:参照gb 5009.5
‑
2016《食品安全国家标准 食品中蛋白质的测定》。
41.膳食纤维:参照gb 5009.88
‑
2014《食品安全国家标准 食品中膳食纤维的测定》。
42.粗纤维:参照gb/t 5009.10
‑
2003《植物类食品中粗纤维的测定》。
43.维生素:参照gb 5009.82
‑
2016《食品安全国家标准 食品中维生素a、d、e的测定》、gb 5009.84
‑
2016《食品安全国家标准 食品中维生素b1的测定》、gb 5009.85
‑
2016《食品安全国家标准 食品中维生素b2的测定》。
44.黄精多糖:取黄精炮制品适量,分别加入15倍量水蒸煮提取2次,每次2h,合并滤
液,浓缩后加无水乙醇使含醇量达到80%用于沉淀多糖。静置过夜后抽滤,干燥即得黄精多糖。多糖含量的测定参照sn/t 4260
‑
2015《出口植物源食品中粗多糖的测定 苯酚
‑
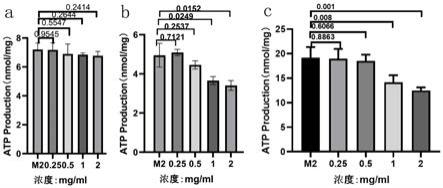
硫酸法》。
45.总黄酮:取少量黄精粉末,加入20倍体积的80%乙醇,70℃条件下提取2次,每次2h,即得黄精总黄酮提取物。总黄酮含量采用sn/t 4592
‑
2016《出口食品中总黄酮的测定》中比色法测定。
46.总皂苷:取适量黄精粉末,加入10倍量的80%无水乙醇,60℃条件下采用超声辅助提取法提取30min,重复3次,将滤液转移至50ml容量瓶中,加入80%无水乙醇溶解稀释至刻度,混匀。总皂苷含量测定参照《保健食品检验与评价技术规范》(2003版)。
47.实施例1。
48.本发明选择浙江天台出产的生黄精作为本发明炮制黄精的原料,并对生黄精的成分及含量进行了全面检测。
49.主要营养成分中,蛋白质含量以干基和湿基计分别为4.08%和2.33%;未检出脂肪。
50.矿质元素成分中,以干基计的常量元素钙含量2714.54mg/kg,镁含量436.08mg/kg;另外还含有含量丰富的微量元素铁、硒、锌等。
51.维生素中,常见的维生素a、维生素b1,维生素b2、维生素b12和维生素c等均未检出。
52.其他成分中,膳食纤维含量以干基和湿基计分别为14.82%和8.46%,水分含量42.90g/100g,灰分含量1.90g/100g。
53.更需要引起关注的生黄精的生理活性物质中,以干基计的多糖含量24.87%,皂苷含量6.3g/kg,黄酮含量141.9mg/100g,若以湿基计,分别为14.2%、3.6g/kg和81mg/100g。
54.实施例2。
55.1)称取去杂、晒干的生黄精600kg,经刷洗机、冲洗机清洗并经清水冲洗干净、沥水后,控制生黄精的含水量为30~45%,装入蒸炉中。每只蒸笼装约4kg黄精,每个蒸炉装10只蒸笼。
56.2)向蒸炉中通入压力0.2mpa的蒸汽,控制温度为150℃进行蒸制。待最上面蒸笼见汽开始计时,蒸制8h后停止通入蒸汽。将蒸透的黄精按每蒸笼一个竹簸箕摊开,在阳光下晾晒至水分含量为12~14%,完成第一轮蒸晒,获得一蒸一晒黄精。
57.3)将一蒸一晒黄精倒入浸泡槽内,边倒黄精边喷洒干黄酒,均匀喷洒上30kg干黄酒后,浸泡1h。
58.4)再将浸泡干黄酒的黄精装入蒸炉中,按照步骤2)中工艺,控制蒸制时间依次为4、4、2、2、1、1h,进行第二轮至第七轮的六次反复蒸晒,并同时收集蒸制过程中产生的黄精汁,直至第七轮蒸晒结束,获得七蒸七晒黄精。
59.5)用切片机将七蒸七晒黄精切成厚度为3~5mm的切片。
60.6)称取用于酿造黄酒的酒药4kg,检测其中含有的戊糖片球菌和扣囊复膜孢酵母的比例约为1∶2,将其与16kg乳酸菌混合均匀,得到复合有益菌。
61.7)合并步骤4)六次蒸晒收集的黄精汁,浓缩至30kg后,加入步骤6)的复合有益菌12kg,混合均匀,常温下活化处理2h,得到混合溶液。
62.8)将黄精切片倒入发酵池中,加入上述混合溶液,翻抖5~10min使混合均匀,控制
发酵池温度在35℃,发酵20h。
63.9)再将发酵后的黄精切片装入蒸炉中,按照步骤2)中工艺,并控制两次的蒸制时间为0.5h,分别进行第八轮和第九轮的蒸晒,最终晾晒至黄精切片含水量9~10wt%,获得九蒸九晒黄精成品约400kg。
64.对本实施例九蒸九晒炮制黄精制品进行检测,其中含膳食纤维20.96%、粗纤维8.76%、总糖51.22%、碳水化合物70.9%、蛋白质6.35%、黄精多糖(以葡萄糖计)3.95%、总黄酮396.12mg/100g、总皂苷15.37mg/g。
65.可以看出,采用本发明炮制方法制备的黄精制品中,生理活性物质总黄酮和总皂苷均较生黄精有显著提高。
66.实施例3。
67.1)称取去杂、晒干的生黄精600kg,经刷洗机、冲洗机清洗并经清水冲洗干净、沥水后,控制生黄精的含水量为30~45%,装入蒸炉中。每只蒸笼装约4kg黄精,每个蒸炉装10只蒸笼。
68.2)向蒸炉中通入压力0.2mpa的蒸汽,控制温度为150℃进行蒸制。待最上面蒸笼见汽开始计时,蒸制8h后停止通入蒸汽。将蒸透的黄精按每蒸笼一个竹簸箕摊开,在阳光下晾晒至水分含量为12~14%,完成第一轮蒸晒,获得一蒸一晒黄精。
69.3)将一蒸一晒黄精倒入浸泡槽内,边倒黄精边喷洒干黄酒,均匀喷洒上30kg干黄酒后,浸泡1h。
70.4)再将浸泡干黄酒的黄精装入蒸炉中,按照步骤2)中工艺,控制蒸制时间依次为4、4、2、2、1、1h,进行第二轮至第七轮的六次反复蒸晒,并同时收集蒸制过程中产生的黄精汁,直至第七轮蒸晒结束,获得七蒸七晒黄精。
71.5)用切片机将七蒸七晒黄精切成厚度为3~5mm的切片。
72.6)合并步骤4)六次蒸晒收集的黄精汁,浓缩至30kg后,加入到步骤5)的黄精切片上,混合均匀。
73.7)再将加入黄精汁的黄精切片装入蒸炉中,按照步骤2)工艺,并控制两次蒸制时间为0.5h,分别进行第八轮和第九轮的蒸晒,最终晾晒至黄精切片含水量9~10wt%,获得传统九蒸九晒黄精成品约400kg。
74.应用例1。
75.以正常肺支气管上皮细胞beas
‑
2b和脂多糖(lps)诱导16h的炎症肺支气管上皮细胞beas
‑
2b为研究细胞系,检测细胞的atp产量,考察本发明黄精制品的抗炎及细胞修复能力。
76.将beas
‑
2b细胞以1.2
×
105个/ml的密度接种于6孔板内,待细胞贴壁后,分别加入同体积不同浓度(0、0.125、0.25、0.5、1、2mg/ml)的黄精溶液,各组均设置重复孔。
77.药物作用24h后,吸除培养液,使用碧云天增强型atp检测试剂盒,按照试剂盒使用说明,加入裂解液裂解细胞,使用带有luminometer检测模式的多功能酶标仪测定得到atp浓度,并采用碧云天bca蛋白浓度测定试剂盒测定各实验组细胞的蛋白浓度,将atp浓度/bca蛋白浓度换算成nmol/mg蛋白的形式。
78.同时,将beas
‑
2b细胞以1.2
×
105个/ml的密度接种于6孔板内,待细胞贴壁后,分别加入同体积不同浓度(0、0.25、0.5、1、2mg/ml)的黄精溶液,8h后,再加入lps 1
µ
g/ml/孔,
与细胞共孵育16h后,吸除培养液,加入裂解液裂解细胞,同样方法测定得到atp浓度。
79.图1和图2分别给出了本发明黄精制品针对正常肺支气管上皮beas
‑
2b细胞和炎症肺支气管上皮beas
‑
2b细胞的atp产量结果。
80.图1中,0.125~2mg/ml黄精均能增加正常肺支气管上皮beas
‑
2b细胞atp产量,且1mg/ml时增加最多,可以增至正常肺支气管上皮beas
‑
2b细胞(con组)atp产量的156.91
±
7.79%。
81.而从图2中可以看出,与正常肺支气管上皮beas
‑
2b细胞(con组)atp产量比较,经lps诱导后的炎症肺支气管上皮细胞beas
‑
2b(lps组)atp产量显著降低,但在加入一定浓度的黄精溶液后,对比lps组,atp产量可明显提高,并接近con组水平,证明本发明黄精制品具有一定的保护性抗炎及促进肺支气管上皮细胞修复作用。
82.应用例2。
83.分别设置以下各实验组:以按照本发明黄精炮制方法制备的实施例2黄精制品作为试验组,以按照传统黄精炮制方法制备的实施例3黄精制品为第一对照组,并以国内某中药配方颗粒生产企业生产的优质黄精配方颗粒作为第二对照组。
84.1、对鼠源性m0型巨噬细胞raw的促增殖作用。
85.以m0型巨噬细胞raw264.7为研究细胞系,采用cck
‑
8法进行细胞增殖实验。
86.取处于对数生长期的m0型巨噬细胞raw264.7,调整细胞浓度进行96孔板铺板,10列
×
6行,每孔100
µ
l细胞悬液。待细胞贴壁后,分别加入同体积不同浓度(0、0.125、0.25、0.5、1、2mg/ml)的试验组、第一对照组、第二对照组黄精溶液,各组均设置重复孔。
87.培养48h后,分别加入10
µ
l cck
‑
8试剂,避光操作。调节酶标仪波长为450nm进行吸光度(od)检测。
88.以黄精浓度为0的正常培养m0型巨噬细胞raw264.7的细胞增值率为100%,计算各实验组不同浓度下的细胞增值率:细胞增值率=(试验组od值-空白od值)/(试验组0浓度od值-空白od值)
×
100%。不同实验组的细胞增殖率变化情况如图3和表1所示。
89.从图3和表1可以看出,第一对照组仅2mg/ml对raw264.7细胞表现出一定的促进增殖作用,其他浓度结果无统计学差异;第二对照组虽然在0.125~0.25mg/ml的低浓度时表现出一定的促增殖作用,但随着浓度增加,反而显示出增殖抑制的作用。而本发明制备的黄
精制品在0.125~2mg/ml的浓度范围内,均显示出了极显著的促进巨噬细胞增殖作用(p<0.001),证明本发明黄精制品可以显著增强巨噬细胞的免疫功能。
90.2、对鼠源性m0型巨噬细胞raw的atp产量影响。
91.采用atp检测试剂盒,以m0型巨噬细胞raw264.7为研究细胞系,进行细胞水平的atp产能分析。
92.将细胞以2.5
×
105个/ml的密度接种于6孔板内,分别加入同体积不同浓度(0、0.125、0.25、0.5、1、2mg/ml)的试验组、第一对照组、第二对照组黄精溶液,药物作用48h后,吸除培养液,按照应用例1中方法加入裂解液裂解细胞,测定得到atp浓度。
93.设定黄精浓度为0的正常培养m0型巨噬细胞raw264.7的atp产量为100%,将各实验组试验结果与正常培养的m0型巨噬细胞raw264.7进行比较,以验证不同黄精制品的供能及提高免疫力效果,具体结果如图4和表2所示。
94.从图4和表2可以看出,第一对照组和第二对照组均对鼠源性m0型巨噬细胞raw264.7的atp产量无明显影响,但试验组黄精制品1~2mg/ml则表现出能够增加raw264.7细胞的atp产量,特别是2mg/ml时,atp产量的增加更为显著(p=0.006)。
95.3、对极化的m2型巨噬细胞raw的atp产量影响。
96.以白细胞介素
‑
4(il
‑
4)诱导48h的m2型巨噬细胞raw264.7为研究细胞系,进行细胞水平的atp产能分析。
97.分别在正常培养的m2型巨噬细胞raw264.7中添加同体积不同浓度(0、0.25、0.5、1、2mg/ml)的试验组、第一对照组、第二对照组黄精溶液,按照atp检测方法进行细胞水平的atp产能分析,并与正常培养的m2型巨噬细胞raw264.7进行比较,以验证不同黄精制品的供能及提高免疫力效果,结果如图5和表3所示。
98.从图5和表3可以看出,第一对照组对m2型巨噬细胞raw264.7的atp产量降低无统计学差异,提示其不能降低m2型巨噬细胞raw264.7的atp产量。而虽然1及2mg/ml第二对照组和试验组均能降低m2型巨噬细胞raw264.7的atp产量,但从统计学数值比较,第二对照组的p值分别为0.0249和0.0152,<0.05,差异显著;而试验组的p值分别为0.008和0.001,分别<0.01和<0.001,差异极显著。
99.上述试验结果证明,虽然第二对照组与本发明黄精制品均能通过调节atp产能的方式,下降肿瘤相关m2型巨噬细胞raw364.7的极化,但结合m0型巨噬细胞raw264.7的atp产量变化情况,本发明黄精制品下降肿瘤相关m2型巨噬细胞raw264.7极化的作用更为显著。
100.巨噬细胞是人体重要的固有免疫细胞之一,可通过释放多种细胞因子激活获得性免疫反应,参与炎症反应,维持内环境稳态。巨噬细胞m0可极化为m1和m2两种表型,极化过程构成一个功能不同的群体,在免疫不同阶段发挥作用。经典激活的m1型释放促炎因子发挥其促炎、杀菌、抗肿瘤的作用;替代激活的m2型产生细胞因子,发挥抗炎、促进肿瘤的作用。巨噬细胞m1/m2表型是一个动态平衡的过程。肿瘤微环境中,细胞因子或生长因子可优先促进m0向m2型极化或 m1型向m2型转化,故肿瘤微环境中m2型肿瘤相关巨噬细胞占绝大多数。m2型巨噬细胞具有免疫抑制作用,有利于肿瘤的生长、侵袭、血管生成和转移,与不良预后相关,并且m2型巨噬细胞以氧化磷酸化(oxphos)为其主要产能方式。
101.上述实验结论证明,本发明制备的黄精制品可以促进m0巨噬细胞增殖,增加m0巨噬细胞的atp产能,从而增强正常巨噬细胞的免疫功能和活性,并且通过降低肿瘤相关m2型巨噬细胞的atp产能,抑制巨噬细胞向m2型极化,以明显提高抗肿瘤免疫能力。
102.本发明以上实施例并没有详尽叙述所有的细节,也不限制本发明仅为以上所述实施例。本领域普通技术人员在不脱离本发明原理和宗旨的情况下,针对这些实施例进行的各种变化、修改、替换和变型,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1