一种铁死亡诱导剂及其制备方法和应用与流程
1.本发明属于抗肿瘤药物制备技术领域,具体涉及一种铁死亡诱导剂及其制备方法和应用。
背景技术:
2.随着发病率和死亡率的不断增加,癌症已经成为一个重大的全球公共卫生问题。目前癌症主要的治疗方式有手术,化疗,放疗,免疫治疗等,但是这些常用的治疗方式也存在着一些弊端,比如手术易复发,放疗因辐射抵抗的问题使得放疗效果不理想,化疗因药物选择性差会带来严重的副作用。因此,生物治疗等新兴的癌症治疗方式为了解决现有技术中存在的问题也在不断涌现。
3.铁死亡是一种由铁依赖的脂质过氧化物的积累导致细胞死亡的新型程序性细胞死亡方式,由brent r.stockwell教授于2012年首次提出。近期研究表明,诱导铁死亡可以用于癌症治疗,尤其在根除对传统疗法有耐药性的侵袭性恶性肿瘤。随着纳米生物技术的发展,基于铁死亡的抗癌纳米药物也取得了重要进展,主要分为铁基纳米材料和非铁基纳米材料两大类。
4.铁基纳米材料能够在细胞内富集铁离子,加快芬顿(fenton)反应,从而提高细胞内活性氧(ros)水平,诱导铁死亡。如ma等构建的负载顺铂的氧化铁纳米前药(fept np2)可以在肿瘤特定部位释放出顺铂和fe
2+
/fe
3+
,原位发生fenton反应,显著提高细胞内ros水平,从而诱导肿瘤细胞铁死亡,增强抗癌活性。pu等报道的铁螯合半导体多复合纳米颗(spfen)将光热疗法与铁死亡疗法相结合,加强了癌症治疗效果。但是,负载顺铂的氧化铁纳米前药和铁螯合半导体多复合纳米颗粒等铁基纳米材料虽然通过诱导铁死亡效应增强了抗肿瘤效果,但是往往需要使用较高的铁剂量或者与其他治疗方式联合使用,因此具有复杂的纳米结构和多金属成分,生物安全性不高。
5.非铁基纳米材料可以抑制谷胱甘肽过氧化物酶(gpx4)或者通过外源性调节增加肿瘤细胞脂质过氧化程度来诱导铁死亡。gao等利用两亲性聚合物胶束递送gpx4抑制剂rsl3,通过gpx4抑制、谷胱甘肽(gsh)衰减及脂质过氧化三者协同诱导铁死亡逆转多药耐药。wang等制备的富精氨酸的锰硅纳米泡可以通过细胞内gsh耗竭作为铁死亡诱导剂实现肿瘤靶向诊疗。然而,包载小分子铁死亡诱导剂的聚合物胶束以及现有技术公开的无定型碳酸钙复合纳米药物虽然可以通过诱导铁死亡有效逆转耐药或者联合化疗进一步杀伤肿瘤细胞,但是存在药物泄露与毒副作用的风险。具有gsh消耗能力的锰硅纳米泡虽然可以同时实现肿瘤的诊断与治疗,但只能针对精氨酸琥珀酸合成酶缺陷的肿瘤细胞,对肿瘤细胞不具有普适性。此外,体内残留的纳米材料可能存在长期毒性的风险等。
6.因此,研究开发一种对肿瘤细胞具有普适性且无细胞毒性风险的超薄蛭石纳米片来诱导铁死亡,将具有良好的应用前景和广阔的适用性。
技术实现要素:
7.为了克服现有技术存在的缺陷,本发明提出了一种铁死亡诱导剂及其制备方法和应用。本发明提供的铁死亡诱导剂一旦被缺氧的肿瘤细胞吸收,氧化还原对(fe
2+
/fe
3+
)通过过氧化氢的歧化反应以及fenton反应生成
·
oh和o2,能够自主补充氧气。此外,本发明的铁死亡诱导剂能够通过消耗谷胱甘肽来调节肿瘤微环境(tme),谷胱甘肽可诱导肿瘤细胞的铁下垂,因此适用于制备基于铁死亡的抗癌纳米药物。
8.具体通过以下技术方案实现:
9.一种铁死亡诱导剂,包括蛭石纳米片。
10.进一步地,所述蛭石纳米片的厚度为1.0-1.3nm。
11.进一步地,所述蛭石纳米片的长度为305-335nm。
12.进一步地,所述蛭石纳米片的宽度为305-335nm。
13.本发明还提供上述铁死亡诱导剂的制备方法,包括获取蛭石纳米片;所述蛭石纳米片由蛭石加入到碱金属离子盐溶液进行插层处理,经剥离得到;其中,每毫克的蛭石加入0.1-10摩尔每升的碱金属盐改性剂。每毫克的蛭石中,加入的碱金属盐改性剂的浓度若低于0.1摩尔每升,则会导致制得的蛭石片厚度变厚;若碱金属改性剂的浓度高于10摩尔每升,则需要更长的洗涤时间将碱金属改性剂洗去。
14.所述蛭石纳米片的具体制备方法包括以下步骤:
15.s1:将蛭石加入到碱金属盐溶液改性剂中,对蛭石进行膨胀;
16.s2:膨胀后进行分离,收集上层胶状浆液;
17.s3:将上层胶状浆液进行超声处理,剥离得到蛭石纳米片。
18.优选地,所述碱金属盐溶液改性剂为锂盐溶液、钾盐溶液或钠盐溶液中的一种或多种。
19.更优选地,所述碱金属盐溶液改性剂为氯化锂溶液、乙二胺四乙酸锂溶液或柠檬酸锂溶液中的一种或多种。采用锂盐改性剂处理得到的化学法膨胀蛭石,与热膨胀或双氧水膨胀的物理法蛭石相比,蛭石片可以剥离地更完全,厚度更薄。乙二胺四乙酸锂,柠檬酸锂改性剂对蛭石的膨胀作用效果最好,可以使蛭石中的蛭石-金云母混层矿物和金云母等晶体的有序度降低,蛭石能够被剥离得更完全。
20.进一步地,步骤s1的条件为在温度为80-90℃下回流加热24-36h。
21.进一步地,步骤s3中,超声处理的时长为0.3-0.6h。
22.本发明还提供上述铁死亡诱导剂作为抗肿瘤药物在调节肿瘤微环境中的应用。
23.本发明的有益效果包括:
24.本发明提供的铁死亡诱导剂具有生物相容性好以及很强的癌细胞杀伤效果,可用于肿瘤治疗药物的合成,具有很好的应用前景。
附图说明
25.为了更清楚地说明本技术实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
26.图1为不同h2o2浓度下tmb的吸收光谱图;
27.图2为不同h2o2浓度下650nm处的吸光度变化情况;
28.图3为不同gsh浓度下dtnb的吸收光谱图;
29.图4为不同gsh浓度下412nm处的吸光度变化情况;
30.图5为实施例4的mc38细胞内铁含量测定结果;
31.图6为实施例5的mc38细胞内gpx4活性检测结果;
32.图7为实施例6的肿瘤组织分析结果。
具体实施方式
33.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
34.实施例1
35.一种铁死亡诱导剂,包括蛭石纳米片。蛭石纳米片由蛭石加入到碱金属离子盐溶液进行插层处理,经剥离得到,其中,每毫克的蛭石加入0.1-10摩尔每升的碱金属盐改性剂。蛭石纳米片的厚度为1.0nm,长度为310nm,宽度为315nm。
36.具体制备方法包括如下步骤:
37.s1:将50mg商用蛭石粉加入到5摩尔每升的氯化锂溶液中,在80℃下回流加热24h,对蛭石粉进行插层处理,使之膨胀;
38.s2:膨胀结束后,以3000rpm的转速离心20分钟,收集上层胶状浆液;
39.s3:对上层胶状浆液进行多次超声处理,超声处理的时长为0.5h,剥离得到蛭石纳米片。
40.本实施例提供的铁死亡诱导剂可作为抗肿瘤药物用于调节肿瘤微环境,实现抗肿瘤的效果。
41.实施例2
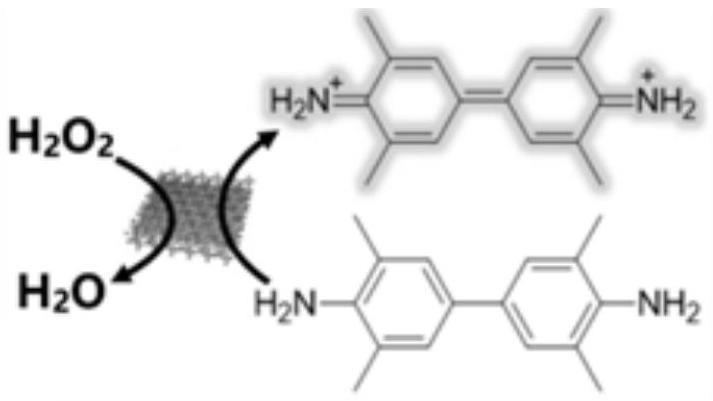
42.一种铁死亡诱导剂,包括蛭石纳米片。蛭石纳米片由蛭石加入到碱金属离子盐溶液进行插层处理得到,其中,每毫克的蛭石加入0.1-10摩尔每升的碱金属盐改性剂。蛭石纳米片的厚度为1.2nm,长度为305nm,宽度为335nm。
43.具体制备方法包括如下步骤:
44.s1:将50mg商用蛭石粉加入到100摩尔每升的乙二胺四乙酸锂溶液中,在85℃下回流加热24h,对蛭石粉进行插层处理,使之膨胀;
45.s2:膨胀结束后,以3500rpm的转速离心30分钟,收集上层胶状浆液;
46.s3:对上层胶状浆液进行多次超声处理,超声处理的时长为0.3h,剥离得到蛭石纳米片。
47.本实施例提供的铁死亡诱导剂可作为抗肿瘤药物用于调节肿瘤微环境,实现抗肿瘤的效果。
48.实施例3
49.一种铁死亡诱导剂,包括蛭石纳米片,蛭石纳米片由蛭石加入到碱金属离子盐溶
液进行插层处理,经剥离得到,其中,每毫克的蛭石加入xx摩尔的碱金属盐改性剂。蛭石纳米片的厚度为1.3nm,长度为335nm,宽度为305nm。
50.具体制备方法包括如下步骤:
51.s1:将50mg商用蛭石粉加入到500摩尔每升的柠檬酸锂溶液中,在90℃下回流加热32h,对蛭石粉进行插层处理,使之膨胀;
52.s2:膨胀结束后,以3000rpm的转速离心25分钟,收集上层胶状浆液;
53.s3:对上层胶状浆液进行多次超声处理,超声处理的时长为0.6h,剥离得到蛭石纳米片。
54.本实施例提供的铁死亡诱导剂可作为抗肿瘤药物用于调节肿瘤微环境,实现抗肿瘤的效果。
55.实验例1蛭石纳米片的过氧化物酶模拟活性评价
56.在温度为37℃、ph为6.5的pbs溶液中,以3,3',5,5'-四甲基联苯胺(tmb)为染色指示剂进行蛭石纳米片(nss)降解h2o2的过氧化物酶模拟活性评价。
57.检测原理为:蛭石纳米片起过氧化物酶的作用,催化tmb产生可溶性蓝色产物,同时将h2o2催化成h2o,tmb的蓝色产物通常可以在620-650nm测定吸光度。
[0058][0059]
tmb溶液(100μg/ml)与h2o2(0、1、2.5、5、10和30mm)混合。加入nss(200μg/ml),在37℃下反应15分钟,进行稳态动力学分析。为此,采集吸光度峰值,并绘制h2o2浓度图。此外,利用ε=39000m-1
cm-1
对oxtmb进行线性lineweaver-burk绘图,以确定km和vmax。
[0060]
结果参见图1和图2,图1中,标号1-6分别代表h2o2浓度为30mm、10mm、5mm、2.5mm、1mm、0mm的测试组的吸光度结果。蛭石纳米片催化过氧化氢降解产生的
·
oh可以氧化tmb,呈现蓝色oxtmb,通过绘制吸光度的底物浓度与反应速率计算值在650nm和拟合到michaelis-menton动力学分析,km和最大反应速度(vmax)为3.4mm和7.97
×
10-8
ms-1
,证明蛭石纳米片的酶活力与现有技术中的过氧化物酶模拟酶具有可比性。
[0061]
实验例2蛭石纳米片的谷胱甘肽氧化酶模拟活性评价
[0062]
蛭石纳米片谷胱甘肽氧化酶模拟活性评价以5'-二硫代二(2-硝基苯甲酸)(dtnb)为指示剂,以谷胱甘肽(gsh)为底物进行蛭石纳米片的谷胱甘肽氧化酶模拟活性评价。
[0063]
检测机理为:蛭石纳米片起谷胱甘肽氧化酶的作用,氧化谷胱甘肽gsh时,dtnb将显黄色。
[0064][0065]
dtnb在dmso(300μg/ml)中与gsh(0,0.0625,0.125,0.25,0.5和1mm)混合。加入nss(200μg/ml),在37℃下反应5分钟,进行稳态动力学分析。采集0-15分钟的吸光度并绘制谷胱甘肽浓度图。此外,利用tnb的ε=13600m-1
cm-1
进行线性lineweaver-burk绘图,以确定km和vmax。
[0066]
结果见图3、4,图3中,标号1-6分别代表gsh浓度为0mm、0.0625mm、0.125mm、0.25mm、0.5mm、1mm的测试组的吸光度结果。通过绘制吸光度的底物浓度与反应速率计算值在412nm和拟合到michaelis-menton动力学分析,km和最大反应速度(vmax)为1.34mm和1.35
×
10-4
ms-1
,证明蛭石纳米片的酶活力与现有技术中的谷胱甘肽氧化模拟酶具有可比性
[0067]
实验例3细胞内铁含量测定
[0068]
采用铁比色试剂盒(applygen,e1042)检测不同处理孵育的mc38细胞内铁含量。在6孔板中加入nss培养基(100μg/ml),然后细胞孵育12h。最后,按照试剂盒使用方法检测铁含量。
[0069]
结果见图5,与pbs(control组)或dcpy组相比,nss相关组检测到更多的铁离子,表明nss诱导细胞内铁超载,诱发铁死亡。
[0070]
实验例4细胞内gpx4活性测定
[0071]
使用细胞过氧化物酶检测试剂盒(beyotime,s0056)检测不同处理孵育的mc38细胞内gpx4活性。将蛭石纳米片培养基(100μg/ml)加入到的6孔板中,然后孵育0-12h。最后,按照试剂盒使用方法检测gpx4活性。
[0072]
结果见图6,谷胱甘肽过氧化物酶4(gpx4)作为铁下垂的中心调控因子,在脂质修复系统中具有重要作用,谷胱甘肽消耗可使gpx4失活,从而诱导铁死亡。nss是一种谷胱甘肽氧化酶模拟酶,导致谷胱甘肽耗竭。此外,nss还可引起细胞内铁超载,诱发铁死亡。使用细胞谷胱甘肽过氧化物酶检测试剂盒检测细胞gpx4活性。与对照组(control组)和dcpy组相比,nss相关组gpx4活性显著降低。这些结果表明,nss通过抑制gpx4活性显著诱导了铁死亡。
[0073]
实验例5肿瘤组织分析
[0074]
设置4组实验,分别是pbs组、pbs+light(光照射)组、nss组和nss+light(光照射)组,gpx4抗体对不同处理的肿瘤切片进行染色。随后用dapi对细胞核进行染色。这些肿瘤切片由olympus显微镜(slideview vs200)拍摄。
[0075]
结果见图7,肿瘤组织切片免疫组化染色结果显示nss组gpx4明显下调(nss组的褐色部分比pbs组明显减少),说明治疗效果显著归因于铁死亡。
[0076]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和
原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1