一种土牛膝抗炎活性提取物的制作方法
一种土牛膝抗炎活性提取物
1.本案为分案申请,具体为申请号:2019109438438,名称为:一种土牛膝抗炎活性提取物及其制备方法,申请日为:2019.09.30的分案申请。
【技术领域】
2.本发明属于医药技术领域,具体涉及一种土牛膝抗炎活性提取物。
背景技术:
3.咽炎为咽部的非特异性炎症,通常分为急性咽炎和慢性咽炎。急性咽炎为咽部黏膜及黏膜下组织的急性炎症,咽淋巴组织常被累及,炎症早期可局限,随病情进展常可涉及整个咽腔,以秋冬及冬春之交较常见。主要表现为咽部干燥,灼热,疼痛,吞咽疼痛明显,咽部充血肿胀等。慢性咽炎又可分为慢性单纯性咽炎、慢性肥厚性咽炎和萎缩性咽炎,其中慢性单纯性咽炎较多见,病变主要在黏膜层,表现为咽部黏膜慢性充血,黏膜及黏膜下结缔组织增生,黏液腺可肥大,分泌功能亢进,黏液分泌增多。患者常咯出咽内黏痰,或感觉咽部有异物感,咯不出,咽不下。病程长,易复发,症状顽固。近年来,随着生活、饮食的多样化发展,不良的生活习惯亦日益渐多,咽炎作为呼吸科及耳鼻喉科的常见疾病,病程较长且症状容易反复,难以治愈,并导致干咳、咽痛、咽痒等症状,影响睡眠与工作质量。
4.粗毛牛膝(achyranthes aspera l.)为苋科牛膝属植物,又名土牛膝,其药用部位主要为根及根茎。生于海拔200-1750m的山坡疏林中,主要分布于我国北自长城,东起台湾地区、福建,西至云南和四川,南达广东和广西。《中华本草》、《全国中草药汇编》等典籍记载,土牛膝具有活血祛瘀,泻火解毒,利尿通淋之功效,主治跌打损伤,风湿关节痛,咽喉肿痛,白喉和水肿。对土牛膝进行系统成分、药效、毒理等研究,证实本品具有抗呼吸道、泌尿系统感染作用。
5.本发明制备的土牛膝抗炎成分的制备与研究,工艺简单,成本低廉,对于土牛膝资源的开发和咽炎的防治具有重要的意义。
技术实现要素:
6.本发明的一种土牛膝抗炎活性提取物,经试验验证对急慢性咽炎具有明显疗效。
7.本发明另一目的是提供一种土牛膝抗炎活性提取物的制备方法。
8.本发明是通过以下技术方案实现的:
9.一种土牛膝抗炎活性提取物的制备方法,包括以下步骤:
10.a、选取粗毛牛膝的根及根茎作为植物原料,将植物阴干粉碎后,通过20目筛网得到细粉,将细粉用70%~100%醇溶液,回流提取2h 后,重复提取3次,在60℃下减压浓缩,在阴暗低温及通风较好的地方晾干,制得甲醇中间提取物;
11.b、将步骤a得到的甲醇中间提取物130g用甲醇充分溶解,与反相硅胶搅拌,水浴锅挥干溶剂,后经ods柱层析(4*10cm),利用醇类
ꢀ‑
水溶液梯度洗脱,其中水、10%醇溶液、30%醇溶液、50%醇溶液、70%醇溶液、90%醇溶液、纯醇溶液、丙酮分别洗脱2.0l,并合并
30%-70%醇溶液洗脱组分得到土牛膝抗炎活性提取物。
12.优选的,所述醇类或醇溶液为甲醇或乙醇,所述提取过程为超声或回流。
13.优选的,所述土牛膝最终抗炎提取物的使用浓度为6.25
‑ꢀ
200μg/ml。
14.优选的,所述水浴锅挥干溶剂过程是在小于等于60℃条件下干燥。
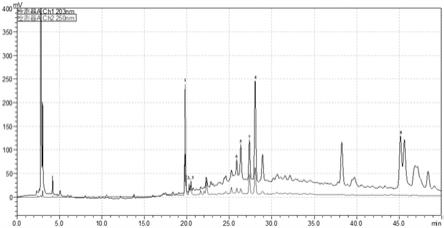
15.优选的,所述甲醇中间提取物分离采用全亲水性材料ods-aq反相柱(用量为与浸膏比0.9~1.5倍,以干燥为准)。
16.优选的,选取粗毛牛膝的根及根茎作为植物原料,将植物阴干粉碎后,通过20目筛网得到细粉,将细粉用70%~100%醇溶液,回流提取 2h后,重复提取3次,在60℃下减压浓缩,在阴暗低温及通风较好的地方晾干,制得甲醇中间提取物,提取物为黑褐色固体,130.33g,产率11.15%;将上述甲醇中间提取物130g用甲醇充分溶解后,与117.5gods-aq全亲水性反相硅胶搅拌,水浴锅挥干溶剂,后经ods柱层析(4*10cm),利用甲醇-水溶液梯度洗脱,其中水、10%甲醇水溶液、30%甲醇水溶液、50%甲醇水溶液、70%甲醇水溶液、90%甲醇水溶液、纯甲醇、丙酮分别洗脱2.0l,各部分减压浓缩后,分别得到水洗物110.5g、10%甲醇洗脱物1.3g、30%甲醇洗脱物2.42、50%甲醇洗脱物2.99g、70%甲醇洗脱物4.37g、90%甲醇洗脱物4.31g、100%甲醇洗脱物3.39g、丙酮洗脱物1.27g。各部分测定活性,并合并30%-70%甲醇洗脱组分共得9.78g,最终收率为0.83%。
17.一种土牛膝抗炎活性提取物,所述提取物中包含蜕皮甾酮、r-牛膝甾酮、s-牛膝甾酮、n-反式阿魏酰酪胺、n-顺式阿魏酰酪胺、n-反式阿魏酰-3-甲氧基酪胺、n-顺式阿魏酰-3-甲氧基酪胺、竹节参皂苷ⅳa八种药效成分。对分离所得单体,通过色谱分析鉴定与文献对比获得确认,上述8中药效组分被证实对咽炎具有抑制作用。
18.一种土牛膝抗炎活性提取物治疗咽炎的应用。
19.与现有技术相比,本发明具有如下优点:
20.1、本发明的一种土牛膝抗炎活性提取物,能够有效地对lps 诱导raw264.7细胞产生的no表现出明显的抑制活性,抗炎效果显著,并以活性模型为指导,对土牛膝抗炎物质进行纯化、去杂质;以 lps刺激小鼠单核巨噬细胞株raw264.7,可以诱导细胞产生多种相关介质和细胞因子,其中,no作为众多炎症介质中的重要因子之一,在调节多种生理功能方面起重要作用,例如血管扩张,神经传递和炎症应答等,raw264.7细胞株经lps刺激向细胞培养液中释放产生的no,其浓度可以用来评价炎症反应的强弱程度;本发明建立在lps诱导 raw264.7小鼠巨噬细胞的体外炎症模型中,通过no检测试剂盒检测被 lps刺激的小鼠巨噬细胞产生的no是否被所制备的药物干预产生抑制作用;
21.2、本发明的一种土牛膝抗炎活性提取物,进一步分析获知其包含主要的八种药效单体组分,并且通过液相色谱分析,对每种单体进行了定性和定量的测定,是对土牛膝抗炎活性提取物有效性的证明,为进一步的产品改进提供了参考;
22.3、本发明的一种土牛膝抗炎活性提取物的制备方法,通过提纯和浓缩步骤,提取到含有8种药效组分的抗炎提取物,作为抗炎消炎主要的药效组分,对土牛膝抗炎活性提取物的作用做了进一步诠释,提取和浓缩方法高效,且对不同条件提取方法进行对比,对于如何提高得料率给出了依据,提取方法相对比较稳定且品质可控,为批量生产广泛推广提供了参考。
23.【说明书附图】
24.图1:提取物液相色谱图
【具体实施方式】
25.结合具体实施例说明本发明的一种土牛膝抗炎活性提取物的制备方法:
26.实施例1-2的制备方法:
27.实施例1:一种土牛膝抗炎活性提取物的制备方法,包括以下步骤:
28.a、粗毛牛膝采集于湖南省永州市马鞍岭种植基地,主要选取植物的根及根茎作为植物原料,将植物阴干粉碎后,通过20目筛得细粉,将细粉用70%~100%醇溶液,回流提取2h后,重复提取3次,在60℃下减压浓缩。在阴暗低温及通风较好的地方晾干,制得甲醇中间提取物,提取物为黑褐色固体,130.33g,产率11.15%;
29.b、将步骤a得到的甲醇中间提取物130g用甲醇充分溶解,与 117.5gods-aq全亲水性反相硅胶搅拌,低于60℃水浴锅挥干溶剂,后经ods柱层析(4*10cm),利用甲醇-水溶液梯度洗脱,其中水、10%甲醇水溶液、30%甲醇水溶液、50%甲醇水溶液、70%甲醇水溶液、90%甲醇水溶液、纯甲醇、丙酮分别洗脱2.0l,各部分减压浓缩后,分别得到水洗物110.5g、10%甲醇洗脱物1.3g、30%甲醇洗脱物2.42、50%甲醇洗脱物2.99g、70%甲醇洗脱物4.37g、90%甲醇洗脱物4.31g、100%甲醇洗脱物3.39g、丙酮洗脱物1.27g;各部分测定活性,并合并30%
‑ꢀ
70%甲醇洗脱组分共得9.78g,最终收率为0.83%。
30.实施例2:一种土牛膝抗炎活性提取物的制备方法,包括以下步骤:
31.取粗毛牛膝61.7g,将细粉70%~100%醇溶液,回流2h提取3次,在60℃下减压浓缩、干燥,制得甲醇中间提取物7.32g,产率11.86%;
32.将甲醇中间提取物溶于甲醇水溶液,与15g ods-aq全亲水性反相硅胶(使用回收)搅拌,低于60℃水浴锅挥干溶剂,后经ods柱层析,甲醇-水溶液梯度洗脱(水、10、30、50、70、90、100%甲醇),各个梯度各洗脱200ml,合并30%-70%甲醇洗脱液,减压浓缩共得 2.64g,最终收率为4.26%。
33.上述土牛膝抗炎活性提取物,通过醇溶液提取后,再通过ods-aq 全亲水性反相硅胶回收,获得纯度较高的提取物,对批量生产作业提供了很好的参考。
34.对上述实施例1所得土牛膝抗炎活性提取物,进行活性单体及活性药效测试:
35.一、活性提取物的特征组分分离、鉴定与液相色谱分析
36.(1)单体分离
37.取制得所得的活性提取物3.0g,用甲醇溶解后,拌硅胶10g、挥干溶剂,过硅胶柱层析(2*20cm),采用二氯甲烷-甲醇(98:2,97:3,96:4, 95:5,90:10,80:20,70:30,2:1,1:1、纯甲醇)梯度洗脱,共获得40组分,其中fr.15(二氯甲烷-甲醇90:10洗脱)组分反复经过硅胶柱层析,二氯甲烷-甲醇9:1洗脱,分离得到化合物1、2、3;
38.fr.9(二氯甲烷-甲醇95:5洗脱)组分,先过ods-a反相色谱柱, 55%甲醇洗脱纯化,得到主要混合物并进一步经过硅胶柱分离(二氯甲烷-甲醇97:3洗脱),获得两个主要组分,组分ⅰ进一步经制备液相色谱(37%乙腈-水溶液)制备纯化,获得化合物4、5。组分ⅱ进一步经制备液相色谱(37%乙腈-水溶液)制备纯化,获得化合物6、7。
39.(2)单体鉴定
40.对分离得到的单体,采用液相色谱或薄层色谱分析纯度,并测定化合物波谱数据
7),7.13(ih,s,h-2),7.07(2h,d,j=7.8hz,h-2',6'),7.04(1h,d,j=7.8, h-6),6.8l(ih,d,j=7.8hz,h-5),6.73(2h,d,j=7.8hz,h-3',5'),6.42(1h,d, j=15.6hz,h-8),3.90(3h,s,3-och3),3.48(2h,t,j=7.2hz,h-8'),2.77(2h, t,j=7.2hz,h-7');
13
c-nmr(150mhz,cd3od):δ169.5(c-9),149.6(c-4), 157.2(c-3),142.4(c-7),128.6(c-1),123.5(c-6),119.0(c-8),116.8(c-5), 111.8(c-2),131.6(c-1'),131.0(c-2',6'),150.1(c-4'),116.6(c-3',5'),56.7(3
‑ꢀ
och3),42.9(c-8'),36.1(c-7');以上波谱数据与文献基本一致,鉴定为n-反式阿魏酰酪胺;
47.化合物5为白色粉末状物质,核磁共振氢谱和碳谱同化合物4基本一致,且两者一同制备分离得到,且化合物5长时间不太稳定,可逐步转化为化合物4;两者的区别在于δ5.83(ih,d,j=12.6hz),6.63(1h,d,j=12.6hz)是一个顺式双键。1h-nmr(600mhz,cd3od):δ7.38(ih,s,h-2),6.94(1h,d,j=7.8,h-6), 6.75(1h,d,j=7.8hz,h-5),6.63(1h,d,j=12.6hz,h-7),5.83(1h,d,j=12.6 hz,h-8),3.85(3h,s,3-och3),7.01(2h,d,j=7.8hz,h-2',6'),6.70(2h, d,j=7.8hz,h-3',5'),3.41(2h,t,j=7.2hz,h-8'),2.71(2h,t,j=7.2hz,h
‑ꢀ
7');
13
c nmr(150mhz,cd3od):δ170.3(c-9),148.5(c-4),156.9(c-3),138.4(c
‑ꢀ
7),131.1(c-1),128.5(c-6),124.8(c-8),115.8(c-5),113.9(c-2),56.3(3-och3), 131.4(c-1'),130.7(c-2',6'),116.2(c-3',5'),148.5(c-4'),42.3(c-8'),35.5(c
‑ꢀ
7');根据以上波谱数据,并与文献基本一致,故鉴定为n-顺式阿魏酰酪胺;
48.化合物6白色粉末,1h-nmr(600mhz,cd3od):δ6.79(1h,s,h-2),6.74(ih, d,j=7.8hz,h-5),6.94(1h,d,j=7.8hz,h-6),2.73(2h,t,j=7.2hz,h-7), 3.44(2h,t,j=7.2hz,h-8),7.38(1h,s,h-2'),6.70(1h,d,j=7.8hz,h-5'), 6.62(1h,m,h-6'),6.62(1h,d,j=12.6hz,h-7'),5.84(1h,d,j=12.6hz,h
‑ꢀ
8'),3.80(3h,s,3-ome),3.84(3h,s,3'-ome);
13
c nmr(150mhz,cd3od):δ 131.9(c-1),113.9(c-2),148.5(c-3),148.9(c-4),124.8(c-5),l16.1(c-6),138.3(c
‑ꢀ
7),121.5(c-8),170.40(c-9),128.5(c-1'),113.4(c-2'),146.0(c-3'),148.5(c
‑ꢀ
4'),122.1(c-5'),115.8(c-6'),36.0(c-7'),42.3(c-8'),56.3(3'-ome),56.2(3
‑ꢀ
ome);以上数据与文献
[3-4]
报道一致,故鉴定为n-顺式阿魏酰-3-甲氧基酪胺。
[0049]
化合物7为白色粉末状物质,核磁共振氢谱和碳谱同化合物6基本一致,且两者一同制备分离得到,且化合物6长时间不太稳定,可逐步转化为化合物7;两者的区别在于化合物7中δ6.33(ih,d,j=15.6hz),7.36(1h,d,j=15.6hz)是一个反式双键。1h-nmr(600mhz,cd3od):δ6.75(1h,s,h-2),6.68(1h,d,j=7.8 hz,h-5),6.60(1h,d,j=7.8hz,h-6),2.70(2h,t,j=7.3hz,h-7),3.42 (2h,t,j=7.3hz,h-8),7.05(1h,s,h-2'),6.72(1h,d,j=8.0hz,h-5'), 6.95(1h,d,j=7.8hz,h-6'),7.36(1h,d,j=15.6hz,h-7'),6.33(1h,d, j=15.6hz,h-8'),3.76(3h,s,3-ome),3.81(3h,s,3'-ome):
13
c nmr(150 mhz,cd3od):δ132.0(c-1),113.4(c-2),149.0(c-3),149.8(c-4),123.2(c-5), 116.4(c-6),142.0(c-7),118.7(c-8),169.2(c-9),128.2(c-1'),111.5(c-2'), 146.0(c-3'),149.3(c-4'),122.3(c-5'),116.1(c-6'),36.2(c-7'),42.4(c-8'),56.3(3'
‑ꢀ
ome),56.3(3-ome);以上数据与文献报道一致,故鉴定为n-反式阿魏酰-3-甲氧基酪胺;
[0050]
化合物8通过与对照品比较,在三种不同高效液相色谱条件下分析,与竹节参皂苷ⅳa对照品一致,故鉴定化合物8为竹节参皂苷ⅳa。
[0051]
(3)产物液相色谱分析
[0052]
将制备所得物通过液相色谱分析:岛津lc-20a液相色谱仪,c
18
色谱柱 (250mm
×
4.6mm,5μm);流动相为乙腈-0.5%磷酸水溶液,梯度洗脱,洗脱程序如下表2所示,柱温室温,流量1.0ml/min;进样量20μl,检测波长采用双波长模式(203、250nm);所含有的8种特征成分如附图1所示。
[0053]
表2梯度洗脱时间程序
[0054][0055][0056]
二、对实施例2所得的土牛膝抗炎活性提取物体外抗炎活性检测
[0057]
1.试剂与仪器
[0058]
小鼠单核巨噬细胞株raw264.7(5中科院上海细胞库);脂多糖 (sigma公司);dmem高糖培养基(6gibco公司);胎牛血清(panseratech公司);mtt(sigma公司);磷酸盐缓冲液(hyclone公司);二甲基亚砜(sigma公司);no检测试剂盒(碧云天);精密电子天平(mettler toledo公司),超净工作台(苏州艾克林净化设备有限公司),二氧化碳培养箱(thermo公司),倒置显微镜(olympus公司),低速冷冻离心机(湖南湘仪实验室仪器开发有限公司),酶标仪 (biotek公司),数显恒温水浴锅(上海齐欣科学仪器有限公司)。
[0059]
2.raw264.7细胞的培养
[0060]
基础培养基为含10%灭活胎牛血清的dmem培养基;培养条件为 37℃,5%co2及饱和湿度;当细胞生长至对数期时,用磷酸盐缓冲液清洗细胞,再低速离心细胞(800rpm,5min),用基础培养基吹散细胞至均匀,以每孔3
×
104个细胞100μl接种于96孔板,以备实验。
[0061]
3.no含量的检测
[0062]
取生长状态良好,处于对数生长期的培养细胞,脱壁后,用含10%灭活胎牛血清的dmem培养基制成单细胞悬液,细胞计数器计数,调节细胞密度为3
×
104个/ml,均匀接种于96孔培养板上,每孔 100μl,置37℃,5%co2培养箱中培养24h。将原培养液弃去,设置正常组,模型组和样品组。正常组不加lps和样品;模型组在培养液中加入lps溶液(终浓度1μg/ml);样品组为6.25、12.5、25、50、 100、200μg/ml的土牛膝提取部位的稀释培养基100μl,每组设置3个复孔。培养24h,取其上清液,按照no检测试剂盒说明书步骤操作,在酶标仪上测定540nm处的吸光度值。根据标准曲线 y=0.0046x+0.0479(r2=0.9993)求出各组no释放量(μm)。
[0063]
实验数据均用平均值
±
标准差(x
±
s)表示,采用spss22.0统计软件对数据进行显著性差异分析,组间比较采用t检验,p《0.05表示差异显著,具有统计学意义。
[0064]
4.数据处理
[0065]
由表3可知,土牛膝醇提取物所分得的各极性部位作用细胞时, no的释放量均有减少;且剂量呈浓度依赖性。50、100μg/ml的浓度下纯水洗脱部分对no释放量无抑制作用(p
》0.05),浓度为200μg/ml的纯水洗脱部分和50、100μg/ml的10%甲醇水溶液洗脱部分对no释放量有抑制作用(p《0.05);其他部分在各浓度下对no释放量具有明显的抑制作用(p《0.01)。其中70%甲醇水溶液洗脱部分在50、100、 200μg/ml的浓度下对no释放量的抑制作用非常明显,no浓度分别为13.46
±
0.16、7.25
±
0.24和0.90
±
0.08μm。
[0066]
表3:土牛膝各洗脱部位(50、100、200μg/ml)对lps诱导raw264.7细胞释放no的影响
[0067][0068]
注:*代表与模型组相比较,有显著性差异(p《0.05);
[0069]
**代表与模型组相比较,有明显的显著性差异(p《0.01)。
[0070]
土牛膝本发明的一种土牛膝抗炎活性提取物,能够有效地对lps 诱导raw264.7细胞产生的no表现出明显的抑制活性,抗炎效果显著,并以活性模型为指导,对土牛膝抗炎物质进行纯化、去杂质;以 lps刺激小鼠单核巨噬细胞株raw264.7,可以诱导细胞产生多种相关介质和细胞因子,其中,no作为众多炎症介质中的重要因子之一,在调节多种生理功能方面起重要作用,例如血管扩张,神经传递和炎症应答等,raw264.7细胞株经lps刺激向细胞培养液中释放产生的no,其浓度可以用来评价炎症反应的强弱程度;本发明建立在lps诱导 raw264.7小鼠巨噬细胞的体外炎症模型中,通过no检测试剂盒检测被 lps刺激的小鼠巨噬细胞产生的no是否被所制备的药物干预产生抑制作用;本发明的一种土牛膝抗炎活性提取物的制备方法,通过提纯和浓缩步骤,提取到含有8种药效组分的抗炎提取物,作为抗炎消炎主要的药效组分,对土牛膝抗炎活性提取物的作用做了进一步诠释,提取和浓缩方法高效,且提取物相对比较稳定且品质可控。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1