鉴定抗原特异性TCR或BCR的方法及应用与流程
鉴定抗原特异性tcr或bcr的方法及应用
技术领域
1.本发明涉及免疫学技术领域,特别是涉及一种鉴定抗原特异性tcr或bcr的方法及应用。
背景技术:
2.在淋巴细胞的成熟过程中,t细胞受体(tcr)和b细胞受体(bcr)会进行基因重排,产生巨大的多样性。基因重排包括v基因片段、d基因片段和j基因片段的自由组合,以及基因片段之间的不定长度的碱基插入和删除。根据理论上评估,t细胞受体的多样性能达到10
18
级,b细胞受体的多样性能达到2
×
10
12
水平(www.imgt.org/)。t细胞受体和b细胞受体上的互补决定区3(complementarity-determining region 3,cdr3)是与抗原直接结合的区域,所以cdr3是最核心的区域。近年来,多种实验捕获方法和高通量测序的出现,使一次性能得到大量的tcr和bcr克隆,大量的tcr和bcr样本数据已经产生。但是,如何解读这些数据,特别地,如何准确的鉴定出抗原特异的tcr和bcr,还没得到很好的解决。
3.鉴定抗原特异性的t细胞或者b细胞,传统的实验有2种方法,一种是体外培养淋巴细胞,将抗原加入,对淋巴细胞进行刺激,与抗原有关的淋巴细胞会大量增殖,分离出增殖的淋巴细胞,对这些细胞进行tcr或者bcr测序,则可检测出增殖的tcr或者bcr克隆,作为抗原特异的序列;另一种是将抗原肽加在人类白细胞抗原(hla)分子上,形成抗原-hla复合物,生物素标记在抗原肽上,使得一个标记荧光素的链亲和素与四个生物素标记的复合物结合形成四聚体(tetramer),在体外培养的淋巴细胞中,加入tetramer,筛选出与复合物中抗原肽结合的t细胞。另外,近年来,由于大量的tcr或者bcr样本测序,出现了一些信息分析方法鉴定抗原特异性克隆,但都是基于多个样本共有tcr或者bcr的原理,即比较实验组和对照组的数据,找出实验组中明显富集的tcr或者bcr克隆,最后利用这些克隆,对样本进行分类,包括交叉验证和独立验证,得到很高的分类准确性,进一步验证了挑选出的克隆为抗原特异性克隆。
4.一方面,传统的实验鉴定抗原特异性克隆的方法,需要培养的淋巴细胞,操作步骤复杂,条件要求高,且通量很低,只能做少数几个样本。另一方面,如对于已有的信息分析方法鉴定特异性克隆,由于原理基于的是样本间共有的克隆,这样就必须要求非常大的样本量,比如至少几百份样本,因为tcr和bcr在样本之间差异非常大,样本量少的时候很难找到共有的克隆;并且,这种方法会存在很多的假阴性,漏掉大量的特异性克隆,因为已有研究报道,与抗原结合的特异性克隆,很多并不是样本间共有的克隆。
技术实现要素:
5.基于此,有必要针对上述问题,提供一种鉴定抗原特异性tcr或bcr的方法,采用该方法,对于tcr或者bcr测序的数据,只需要少量样本,即可利用生物信息分析方法,准确和快速鉴定出抗原特异的tcr或者bcr。
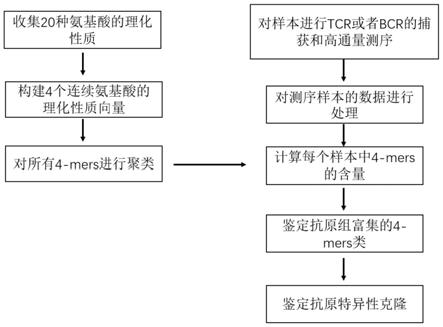
6.一种鉴定抗原特异性tcr或bcr的方法,包括以下步骤:
7.构建氨基酸团理化性质向量:获取20种基本氨基酸的理化性质,将若干个所述基本氨基酸中的氨基酸按照任意次序连接,得到由若干个连续氨基酸组成的标准氨基酸团,并构建各所述标准氨基酸团的理化性质向量;
8.聚类:根据上述氨基酸团的理化性质向量,计算任意两两氨基酸团之间的欧式距离,再对上述氨基酸团进行聚类,得到若干标准氨基酸团类别;
9.抗原特异性数据分析:获取经抗原刺激的抗原样本及对照样本的测序数据,进行v、d、j基因的比对,鉴定得到cdr3区,并将得到的cdr3区核苷酸序列翻译为氨基酸序列;
10.筛选差异氨基酸团:将上述样本中cdr3区氨基酸序列滑动切分为与上述标准氨基酸团中氨基酸个数一致的样本氨基酸团,根据所述标准氨基酸团类别进行分类,计算样本中每类氨基酸团占所有氨基酸团类别中的含量,然后比较抗原样本和对照样本中同类氨基酸团的含量,进行检验,筛选得到具有显著差异并且抗原组含量更高的氨基酸团类别,为差异氨基酸团类;
11.鉴定抗原特异性克隆:根据上述得出的差异氨基酸团类,与上述cdr3区氨基酸序列进行比对,筛选出含有所述差异氨基酸团类中氨基酸团的cdr3序列,与其对应的克隆即为抗原特异性克隆。
12.上述鉴定抗原特异性tcr或bcr的方法,是基于抗原与tcr或者bcr结合的特点:一般情况下,同时与一个抗原肽结合的有多种tcr或者bcr,并且在这些tcr或者bcr的结合区域(与抗原肽结合区大多是固定长度的连续的氨基酸,如4个氨基酸等,作为氨基酸小单元),之间是存在很强的相似性,这个相似性用氨基酸的理化性质去度量,即氨基酸理化性质相似的氨基酸小单元之间,很可能是结合同一个抗原肽的。所以,首先我们将能结合同一个抗原肽的、多个连续氨基酸小单元聚成一个类,再在实验组中的样本找那些含量较高的类,作为最终的抗原特异性tcr或者bcr。
13.在其中一个实施例中,所述构建氨基酸团理化性质向量步骤中,所述理化性质为:极性、二级结构、分子大小、密码多样性和带电性。
14.每种氨基酸具有500多种理化性质,通过对这些理化性质的处理和分析,总结和归纳出5种性质,分别为极性、二级结构、分子大小、密码子多样性和带电性,能够很好的代表每个氨基酸,但维度降低了很多,避免过多的维度无法进行数据处理,使后续数据处理成为可能。其中,分子大小又可以分子容量进行衡量评估。
15.在其中一个实施例中,所述若干个连续氨基酸为4个氨基酸。本发明人在研究分析中发现,通常抗体是用4个氨基酸去结合抗原,因而,采用连续4个氨基酸作为氨基酸团进行分析,能够较好还原免疫反应过程。
16.在其中一个实施例中,所述抗原特异性数据分析步骤中,所述测序数据通过对样本进行tcr或者bcr的捕获和高通量测序得到。
17.在其中一个实施例中,所述抗原特异性数据分析步骤中,所述测序数据通过多重pcr技术、5’race技术、随机标记的umi技术和单细胞测序技术得到。上述技术采用本领域技术人员熟知的常规方法即可。
18.在其中一个实施例中,所述抗原特异性数据分析步骤中,所述抗原刺激为以抗原肽sgivqqqnnllraieaqqhllql进行刺激。可以理解的,上述刺激抗原也可根据需求,采用其他抗原进行刺激,从而鉴定分析得出针对不同抗原特异性的tcr或bcr。
19.在其中一个实施例中,所述构建氨基酸团理化性质向量步骤中,各氨基酸理化性质的数值如下:
[0020][0021]
在其中一个实施例中,所述抗原特异性数据分析步骤中,所述测序数据通过以下方法得到:抽取外周血作为样本,提取rna,并用5’race技术进行tcr的捕获,之后再进行hiseq高通量的测序,测序类型为配对的150bp读长。
[0022]
在其中一个实施例中,所述鉴定抗原特异性克隆步骤中,筛选得到的cdr3序列至少含有2个差异氨基酸团类中的氨基酸团。
[0023]
本发明还公开了上述的鉴定抗原特异性tcr或bcr的方法在制备用于免疫治疗试剂或药物中的应用。
[0024]
可以理解的,肿瘤细胞会产生很多新抗原,免疫细胞的tcr或者bcr会结合这些抗原,进而产生免疫反应去杀死肿瘤细胞。上述方法可以帮助筛选出与新抗原结合的tcr或者bcr,这些tcr或者bcr即可以作为病人治疗的潜在选择之一,从而为精准医疗和/或免疫治疗提供帮助。
[0025]
本发明还公开了一种鉴定抗原特异性tcr或bcr的设备,包括:
[0026]
数据存储装置,用于存储按照上述鉴定抗原特异性tcr或bcr的方法得到的若干标准氨基酸团类别;
[0027]
数据分析装置,用于将样本获取得到的经抗原刺激的抗原样本及对照样本的测序数据,按照上述鉴定抗原特异性tcr或bcr的方法进行分析,获得该样本针对刺激抗原的抗原特异性克隆结果;
[0028]
数据输出装置,用于将上述结果输出。
[0029]
与现有技术相比,本发明具有以下有益效果:
[0030]
本发明的鉴定抗原特异性tcr或bcr的方法,不需要进行体外培养细胞,且对于tcr或者bcr测序的数据,不需要大量样本寻找共有克隆,只需要少量样本,利用信息分析方法,即可准确和快速鉴定出抗原特异的tcr或者bcr。
附图说明
[0031]
图1为实施例1中鉴定抗原特异性tcr或bcr的方法的流程步骤示意图;
[0032]
图2为实施例1中已注射抗原的抗原样本组抗原特异性克隆数示意图;
[0033]
图3为实施例1中对照样本组相应抗原特异性克隆数示意图。
具体实施方式
[0034]
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
[0035]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0036]
以下实施例所用试剂,如非特别说明,均为市售可得,以下实施例所用方法,如非特别说明,均为常规方法可实现。
[0037]
实施例1
[0038]
一种鉴定抗原特异性tcr或bcr的方法,如图1所示,包括以下步骤:
[0039]
1、构建氨基酸团理化性质向量。
[0040]
1.1获取20种基本氨基酸的理化性质。
[0041]
具体数据如下表格。
[0042]
表1.基本氨基酸的理化性质
[0043][0044]
1.2构建4个连续氨基酸的理化性质向量。
[0045]
将氨基酸理化性质构成一个向量,任意的4个氨基酸组成一个序列,称为4-mers(即氨基酸团),且按照任意次序连接,则20种氨基酸则总共可以产生16万种4-mers。每个氨基酸具有5个理化性质,那么,一个4-mers就能构成一个20维的向量。如下所示为2个4-mers向量:
[0046]
acdf:[-0.591
ꢀ‑
1.302
ꢀ‑
0.733 1.57
ꢀ‑
0.146
ꢀ‑
1.343 0.465
ꢀ‑
0.862
ꢀ‑
1.02
ꢀ‑
0.255 1.05 0.302
ꢀ‑
3.656
ꢀ‑
0.259
ꢀ‑
3.242
ꢀ‑
1.006
ꢀ‑
0.59 1.891
ꢀ‑
0.397 0.412]
[0047]
tvvr:[-0.032 0.326 2.213 0.908 1.313
ꢀ‑
1.337
ꢀ‑
0.279
ꢀ‑
0.544 1.242
ꢀ‑
1.262
ꢀ‑
1.337
ꢀ‑
0.279
ꢀ‑
0.544 1.242
ꢀ‑
1.262 1.538-0.055 1.502 0.44 2.897]
[0048]
2、聚类。
[0049]
根据上述氨基酸团的理化性质向量,计算任意两两4-mers(氨基酸团)之间的欧式距离,再通过k-means的聚类算法,对4-mers进行聚类。最后,我们得到了1000个类,每个类平均有160个4-mers。
[0050]
3、抗原特异性数据分析。
[0051]
3.1制备抗原样本及对照样本
[0052]
对10例已注射抗原肽sgivqqqnnllraieaqqhllql(seq id no.1)的恒河猴样本和10例对照恒河猴样本,抽取2ml外周血,即为经抗原刺激的抗原样本及对照样本。
[0053]
3.2测序
[0054]
提取上述样本的rna,并用5’race试剂盒进行tcr的捕获,之后再进行hiseq高通量的测序,测序类型为配对的150bp读长。
[0055]
3.3数据分析
[0056]
获取经抗原刺激的抗原样本及对照样本的测序数据,用软件imonitor进行数据处理和cdr3的鉴定。具体地,低质量的序列(平均测序值小于15)的被丢掉,配对的序列根据中间的交集拼接成一条序列;和重排前的v,d和j基因片段序列(www.imgt.org/)进行比对,确定每条序列的v,d,j基因来源;确定cdr3区域并将序列翻译为氨基酸序列。本实施例中,所有样本的v,j基因比对率都超过了70%。
[0057]
4、筛选差异氨基酸团。
[0058]
4.1计算每个样本中4-mers类的含量。
[0059]
将上述样本中cdr3区氨基酸序列滑动切分为4个氨基酸的氨基酸团,即样本4-mers,按照所述标准氨基酸类别进行分类,并计算分类后样本中各类氨基酸团的含量,部分,如下示例:
[0060]
表2.样本中各类4-mers的含量
[0061][0062]
注:上述c指样本中对应不同标准氨基酸团的类别。
[0063]
4.2鉴定抗原组富集的4-mers类。
[0064]
对于每个4-mers类,有10个实验组样本的含量和10个对照组样本的含量,用检验方法(r语言wilcox.test)检验在两组样本的差异,根据其p-value值,挑选出p值小于0.05且平均值在实验组更高的4-mers类,作为最终鉴定的抗原富集的4-mers类。最终得到24个类。部分结果如下:
[0065]
表3.样本中各类4-mers的含量
[0066]
[0067][0068]
上述筛选得到具有显著差异并且抗原组含量更高的氨基酸团类别,即为差异氨基酸团类;
[0069]
5、鉴定抗原特异性克隆。
[0070]
根据上述鉴定得出的24个差异氨基酸团类,返回抗原样本组的实验数据中,与cdr3区氨基酸序列进行比对,筛选出含有至少2个及以上的4-mers的cdr3序列,与其对应的克隆即为抗原特异性克隆,共45条cdr3序列。结果如下:
[0071]
表4.抗原特异性克隆对应cdr3序列
[0072]
[0073][0074]
6、对鉴定的特异性克隆进行验证。
[0075]
对于10例已注射抗原的样本和10例对照样本,计算鉴定出的45条cdr 3序列在每一个样本中的含量。
[0076]
如图2-3所示,图2为已注射抗原肽的抗原样本组,图3为对照组,从结果中可以看出,已注射抗原组中,每个样本都能找到上述45条特异性cdr3所对应的克隆,大部分在4~8条克隆,但是,在对照组中,只有4个样本能找到克隆,并且最多只有2条。由此可以看出,这45条cdr3序列在两组中含量是存在明显差异的,抗原组明显含量多。因此,也进一步证明了,鉴定出的45条特异性cdr3是抗原有关的。
[0077]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0078]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1