Ozanimod在作为制备治疗肌营养不良症的药物中的应用
ozanimod在作为制备治疗肌营养不良症的药物中的应用
技术领域
1.本发明涉及医药领域,具体涉及ozanimod在作为制备治疗肌营养不良症的药物中的应用。
背景技术:
2.ozanimod(rpc1063,图1)是一种口服生物可利用的s1p受体调节剂,具有潜在的抗炎和免疫调节活性,用于治疗复发性多发性硬化症和炎症性肠病。口服给药后,ozanimod选择性的靶向并结合淋巴细胞上的s1pr1,并诱导s1pr1内化和降解。这导致淋巴细胞在淋巴结中被隔离。通过阻止淋巴细胞的流出,ozanimod减少了循环外周淋巴细胞的数量和淋巴细胞向靶组织的浸润,这可以防止淋巴细胞介导的免疫反应,并可能减少炎症。s1pr1是一种g蛋白偶联受体,在淋巴细胞的迁移中起关键作用。ozanimod对s1pr5的调节可能具有神经保护作用。
3.杜氏肌营养不良症作为一种基因突变导致的遗传性疾病,基因治疗也许最终是杜氏肌营养不良症的有效办法,但是到目前为止基因治疗手段仍处于研究阶段。目前治疗杜氏肌营养不良症的一线手段是激素联合护理,激素治疗虽然有一定效果但是给患者带来一系列的不良反应,包括:胃肠道反应、肥胖等。所以目前急需寻找到激素以外的药物来治疗杜氏肌营养不良症患者肌肉组织中的炎症,氧化应激和纤维化。
技术实现要素:
4.本发明是针对上述存在的技术问题提供了一种s1p受体调节剂ozanimod的新用途。本发明所述的ozanimod是在制备肌营养不良症引起的肌无力和/或肌萎缩的药物中的应用。具体地说,本发明所述的ozanimod是在制备杜氏肌营养不良症和贝氏肌营养不良症引起的肌无力和/或肌萎缩的药物中的应用。ozanimod通过减轻骨骼肌炎症、纤维化,促进肌再生以增加骨骼肌的抓力,最终改善肌营养不良症引起的肌无力和/或肌萎缩。
5.本发明的目的可以通过以下技术方案实现:
6.ozanimod在制备治疗肌营养不良疾病的药物中的用途。
7.本发明技术方案中,所述药物以有效剂量的ozanimod为活性成分,加上药学上可接受的辅料或辅助性成分制备而成的药剂。
8.本发明技术方案中,所述药剂为口服制剂或者注射剂。
9.本发明技术方案中,所述肌营养不良疾病为先天性肌营养不良症、duchenne肌营养不良症、becker肌营养不良症和肢带型肌营养不良症中的至少一种。
10.本发明技术方案中,所述肌营养不良疾病为duchenne肌营养不良症。
11.本发明的有益效果:
12.本发明所述的s1p受体调节剂ozanimod可用于改善肌营养不良症引起的肌无力和/或肌萎缩,为开发治疗肌营养不良症药物提供了理论研究基础。具体地说,ozanimod与现有及技术相比,具有容易合成获得和价格低廉的优点,并且能够减轻骨骼肌炎症、纤维
化,促进肌再生以增加骨骼肌的抓力,最终改善肌营养不良症引起的肌无力和/或肌萎缩。
附图说明
13.图1为ozanimod的结构式。
14.图2为小鼠步态图。
15.图3小鼠骨骼肌横切面he染色。
16.图4小鼠骨骼肌肌纤维fibronectin免疫荧光染色。
17.图5小鼠骨骼肌肌纤维mhc免疫荧光染色。
具体实施方式
18.下面结合实施例对本发明做进一步说明,但本发明的保护范围不限于此:
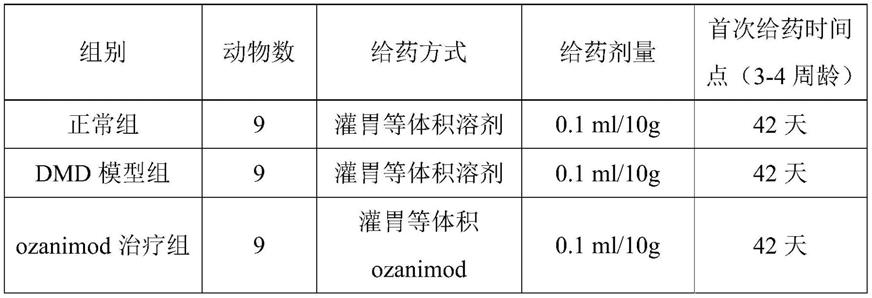
19.实施例1
20.1-动物模型的构建:
21.mdx小鼠是dmd基因缺陷,导致dystrophin蛋白缺失的一种公认用于研究杜氏/贝氏肌营养不良的模型鼠。mdx小鼠与野生对照组相比,肌肉的组织形态异常;肌肉退化的标志物,血清中肌酸激酶和乳酸脱氢酶水平升高;肌肉组织中大量巨噬细胞聚集,并且伴随纤维化和坏死的发生。本发明所用实验动物为mdx转基因小鼠命名为(c57bl/10scsnjnju-dmddmd/nju),购自南京集萃药康公司。
22.2-动物分组及给药
23.本发明对mdx小鼠灌胃给药ozanimod,剂量为1mg/kg/天,给药喂养42天。在给药第40天时测定小鼠的肌抓力,给药第40天测定小鼠悬竿时间,给药第41天对小鼠进行步态分析与统计。
24.3-标准提取与准备
25.给药42天后,隔夜禁食12小时后于第43天安乐死小鼠,并于腹股沟静脉取血,静置并离心后,取上层血清测定血清肌酸激酶和乳酸脱氢酶的含量。随后解剖腓肠肌、胫骨前肌和膈肌,一侧肌肉使用oct包埋剂包埋,另一侧肌肉快速液氮冷冻并于第二天转移至负80摄氏度冰箱备用。包埋好的肌肉于冷冻切片机进行切片,切片厚度为8μm,各组切片分别进行he染料染色、肌纤维mhc免疫荧光染色和肌纤维fibronectin染色。
26.具体方法如下:购买mdx小鼠18只,2-4周龄,雄性;以及同周龄的c57bl/10scsnjnju正常雄性小鼠9只,为正常组,即n=9,mdx小鼠按体重随机分为两组,分别命名为dmd模型组和ozanimod治疗组,ozanimod治疗组给药剂量为1mg/kg/天。具体分组及给药方式如表1所示:
27.表1实验小鼠具体分组及给药剂量和给药方式
[0028][0029]
每天上午9-10时给药,并观察与记录所有动物状态。
[0030]
肌抓力测定;给药第40天进行小鼠前肢抓力测定,采用肌抓力测定仪(yls-13a,济南益延科技发展有限公司)测定各组小鼠前肢最大肌抓力,每只测3次取平均值,结果如表2所示。
[0031]
表2mdx小鼠肌抓力统计结果
[0032]
分组正常组dmd模型组ozanimod治疗组肌抓力(g)275.8
±
49.8195.3
±
20.1
*
359.0
±
71.1
#
[0033]
*p《0.05与正常组相比;#p《0.05与dmd模型组相比。
[0034]
结果表明,给药40天后ozanimod治疗组小鼠较dmd模型组小鼠在前肢肌抓力方面明显优于dmd模型组,表明ozanimod能够增加mdx小鼠骨骼肌的力量,改善mdx小鼠肌无力的症状。
[0035]
悬吊时间测定:
[0036]
给药第41天进行小鼠前、后肢抓力测定,测量神经肌肉运动强度,抓力感受装置是由平行的金属丝(直径5mm)构成的,使其倾斜于地面45
°
,将小鼠置于感受器缓慢旋转180
°
,装置离地面20cm预防小鼠掉落不足以造成伤害,秒表记录小鼠在钢丝抓握的时间,每只测3次取平均值,结果如表3所示。
[0037]
表3 mdx小鼠悬杆实验时间统计结果
[0038]
分组正常组dmd模型组ozanimod治疗组时间(seconds)56.0
±
20.212.2
±
5.2
*
40.1
±
12.0
*#
[0039]
*
p《0.05与正常组相比;
#
p《0.05与模型组相比
[0040]
结果表明,给药41天后ozanimod治疗组较dmd模型组实验小鼠在吊前后肢抓力方面优于模型组,表明ozanimod能够改善mdx小鼠的肌无力。
[0041]
实施例2:
[0042]
步态分析;采用墨汁法于实施例1中给药第41天后的mdx小鼠进行步态分析与统计。分别记录各组小鼠前、后肢的步距和步宽。每只测3次取平均值,结果如表4所示。
[0043]
表4 mdx小鼠步态实验统计结果
[0044]
分组正常组dmd模型组ozanimod治疗组前肢步长(cm)6.5
±
0.55.0
±
0.7
*
6.1
±
0.2
#
后肢步长(cm)6.9
±
0.55.3
±
0.6
*
6.2
±
0.5
#
前肢步宽(cm)2.0
±
0.31.7
±
0.1
*
1.8
±
0.1
#
后肢步宽(cm)2.6
±
0.32.9
±
0.5
*
2.5
±
0.2
#
[0045]
*
p《0.05与正常组相比;
#
p《0.05与dmd模型组相比。
[0046]
结果表明,dmd模型组小鼠前肢步宽变窄,后肢步距变短且步宽变宽;ozanimod给药41天后较dmd模型组相比,步距变长,前肢步宽变宽,后肢步宽变窄,给药ozanimod后mdx小鼠的步态逐渐恢复正常,代表性图片如图2所示。
[0047]
实施例3:
[0048]
给药42天后,隔夜禁食12小时后于第43天安乐死实施例1中mdx小鼠,腹股沟静脉取血,3500转/分钟离心10分钟,取上层血清测定血清肌酸激酶(ck)和乳酸脱氢酶(ldh)含量。随后解剖腓肠肌、胫骨前肌、膈肌并快速液氮冷冻,第二天转移至负80冰箱备用。血清ck、ldh含量和胫骨前几肌肉重量如表5所示。
[0049]
表5 mdx小鼠胫骨前肌重量
[0050]
分组正常组dmd模型组ozanimod治疗组ck(u/l)1942.5
±
550.318900.0
±
7145.6
*
16524.0
±
4122.5
#
ldh(u/l)542.5
±
196.85824.3
±
2019.8
*
2634.3
±
600.3胫骨前肌重量(mg)52.2
±
3.963.3
±
6.8
*
55.3
±
6.5
#
[0051]
*
p《0.05与正常组相比;
#
p《0.05与dmd模型组相比。
[0052]
结果表明,ozanimod给药后能显著降低血清ck和ldh含量。此外,dmd模型鼠胫骨前肌假性肥大,重量较正常组增加;ozanimod给药能够改善模型鼠肌肉的假性肥大。
[0053]
实施例4:
[0054]
苏木精-伊红(he)染色观察实施例3中各组实验鼠骨骼肌病理及形态变化:新鲜的腓肠肌、胫骨前肌和膈肌迅速oct包埋,然后于冷冻切片机进行切片,切片厚度为8μm,各组切片用he染料进行染色,封片后于日本olympus制造的型号为bx53的显微镜下观察、拍照。结果如图3所示。
[0055]
结果表明,dmd模型组小鼠胫骨前肌和膈肌都存在大量炎性细胞浸润,肌纤维变圆,大小不一,细胞核中心化,肌纤维明显丢失。ozanimod给药后能明显改善腓肠肌、胫骨前肌和膈肌的炎症,部分恢复膈肌肌纤维的形态和数量。
[0056]
实施例5:
[0057]
免疫荧光染色考察实施例3中各组小鼠骨骼肌纤维化情况:新鲜胫骨前肌和膈肌迅速oct包埋,然后于冷冻切片机进行切片,切片厚度为8μm,用fibronectin抗体进行染色,4℃冰箱孵育过夜。再用荧光二抗染色,室温孵育1小时,封片后于日本olympus制造的型号为fv1000的激光共聚焦显微镜下观察、拍照。结果如图4所示。
[0058]
结果表明,dmd模型组小鼠腓肠肌、胫骨前肌和膈肌都存在明显纤维化,ozanimod治疗后能够改善mdx小鼠的腓肠肌、胫骨前肌和膈肌纤维化。
[0059]
免疫荧光染色骨骼肌肌纤维:用肌纤维重链,即mhc的特异性标记抗体染色,4℃冰箱孵育过夜。再用荧光二抗染色,室温孵育1小时,封片于日本olympus制造的型号为fv1000的激光共聚焦显微镜下观察、拍照。结果如图5所示。
[0060]
结果表明,dmd模型组小鼠腓肠肌、胫骨前肌存在肌纤维重链丢失的现象,ozanimod治疗后能够显著逆转mdx小鼠肌纤维的缺失。
[0061]
本发明中的实验结果提示,ozanimod治疗组与mdx模型组相比,小鼠的肌抓力增
强,悬竿时间增长,步态也恢复正常,说明ozanimod增强了mdx小鼠的骨骼肌功能;血清中的肌酸激酶和乳酸脱氢酶相较模型组有显著性降低,说明mdx小鼠肌肉损伤情况得到改善;病理组织染色和免疫荧光染色的结果显示,相较于模型组,ozanimod治疗组降低了mdx小鼠的骨骼肌炎症,改善了纤维化,同时促进了骨骼肌再生和肌纤维成熟,为ozanimod开发治疗肌营养不良症引起的肌无力和/或肌萎缩提供了理论研究基础。
[0062]
综合实施例1-5所述,本发明通过国际公认的dmd基因敲除小鼠,即mdx小鼠为肌营养不良的模型,在mdx小鼠上考察ozanimod对肌营养不良引起的肌无力和肌萎缩的治疗效果。从药效学、行为学和分子生物学等方面对ozanimod对肌营养不良症引起的肌无力和肌萎缩的影响做了系统研究,结果显示:ozanimod能够逆转肌纤维的缺失,增强骨骼肌的力量和功能。ozanimod能够减轻骨骼肌炎症、纤维化,增加骨骼肌的抓力。因此,本研究s1p受体调节剂ozanimod开发治疗肌营养不良症引起的肌无力和/或肌萎缩提供了理论研究基础。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1