芒柄花素与天然冰片组合物在制备预防或治疗中枢神经系统疾病药物中的应用的制作方法
1.本发明属于医药技术领域,具体涉及一种芒柄花素与天然冰片组合物在制备预防或治疗中枢神经系统疾病药物中的应用。
背景技术:
2.芒柄花素((formononetin,简写:fmn)为黄酮类化合物,在黄芪、鸡血藤等多种植物中存在,已有研究表明芒柄花素具有保护脑缺血再灌注损伤(yu long,qiyue yang,nose to brain drug delivery-apromising strategy for active components from herbal medicine for treating cerebral ischemia reperfusion[j].pharmacol res.2020sep;159:104795),脑外伤(zhengzhao li,yong wang,increased mir-155and heme oxygenase-1expression is involved in the protective effects of formononetin in traumatic brain injury in rats[j].am j transl res.2017dec15;9(12):5653-5661),抑制神经炎症(xinxin fu,tingting qin,formononetin ameliorates cognitive disorder via pgc-1αpathway in neuroinflammation conditions in high-fat diet-induced mice[j].cns neurol disord drug targets.2019;18(7):566-577)、抑制胶质瘤的增殖和迁移(qi ni,yani fan,in vitro and in vivo study on glioma treatment enhancement by combining temozolomide with calycosin and formononetin[j].j ethnopharmacol.2019oct5;242:111699)等作用。
[0003]
脑卒中是目前中国死亡率排行最高的疾病,具有发病率高、死亡率高、致残率高的特点,也是中国成年人残疾的首要原因(strong k,mathers c,bonita r.preventing stroke:saving lives around the world[j].lancet neurol,2007feb;6(2):182-7.)。脑卒中包括缺血性和出血性卒中,缺血性卒中的发病率高于出血性卒中,占脑卒中总数的60%~70%。很多药物对于治疗脑部疾病具有较好的活性,但由于血脑屏障的存在,药物入脑受到了阻碍,导致许多治疗脑部疾病的药物由于血脑屏障的阻碍作用,未能达到最佳的治疗效果。
[0004]
天然冰片(borneol)在《本草纲目》中记载具有“通诸窍,散郁火”的作用,《本草衍义》记录其“独行则势弱,佐使则有功”。表明天然冰片具有促进药物吸收的作用,也有研究表明天然冰片可以双向调节血脑屏障通透性,防止氧化应激和炎症(sapana bansod,shrilekha chilvery,borneol protects against cerulein-induced oxidative stress and inflammation in acute pancreatitis mice model[j].environ toxicol.2021apr;36(4):530-539.),以及促进脑胶质瘤的凋亡(zeng wang,qinglin li,borneol promotes apoptosis ofhuman glioma cells through regulating hif-1a expression via mtorc1/eif4e pathway[j].j cancer.2020jun 7;11(16):4810-4822.)等。2020年7月30日,一款依达拉奉右莰醇注射用浓溶液——“先必新”,获nmpa批准上市,其以4:1的配比组合依达拉奉和右莰醇,可显著降低急性缺血性脑卒中引发的脑神经损伤。这些例子说明,天
然冰片作为药物吸收的促进剂,通过和治疗脑疾病药物按一定比例混合,可以起到促进药物在脑部的吸收,从而达到增强药物治疗效果的作用。
[0005]
目前的文献报道中,尚未有芒柄花素与冰片组合的相关研究,因此我们将芒柄花素与天然冰片以不同的摩尔比进行组合,利用药代动力学方法筛选最佳配比组合物,并对最佳配比组合物进行脑卒中大鼠预防或治疗作用的评价,以期提供一种较好前景的预防或治疗中枢神经系统疾病的药物组合。
技术实现要素:
[0006]
本发明依托上述研究进行,目的在于提供由芒柄花素和天然冰片组成的组合物在制备预防或治疗中枢神经系统疾病药物中的应用,具体是提供在制备预防或治疗脑卒中药物中的的应用。
[0007]
为了实现上述目的,本发明采用的技术方案如下:
[0008]
本发明的第一方面,提供了由芒柄花素和天然冰片组成的组合物在制备预防或治疗中枢神经系统疾病药物中的应用。
[0009]
优选的,所述芒柄花素和天然冰片的化学结构如式i、ii所示:
[0010][0011]
所述天然冰片主要指右旋龙脑,比旋度为+34
°
~+38
°
。
[0012]
优选的,两种物质的组成含量方面,芒柄花素和天然冰片的摩尔比为1:1~1:2,优选1:1。
[0013]
优选的,预防或治疗中枢神经系统疾病药物中,芒柄花素和天然冰片组合物的含量为0.1%-99.9%。
[0014]
优选的,所述中枢神经系统疾病包括神经退行性疾病、脑卒中、癫痫、脑外伤、休克、hiv痴呆、青光眼、多发性硬化症等。兴奋性神经毒性可引起中枢神经系统病变,包括脑卒中等疾病,脑卒中分为出血性和缺血性脑卒中。
[0015]
所述的神经退行性疾病包括阿尔兹海默症、小脑萎缩症、多发性硬化症、原发性侧索硬化、脊髓性肌萎缩症、帕金森病、亨廷顿氏病、克雅二氏病、牛海绵状脑病、共济失调毛细血管扩张症、肌肉萎缩性侧索硬化症。
[0016]
所述的脑卒中,具体是指缺血性脑卒中。
[0017]
本发明的第二方面,提供了一种预防或治疗中枢神经系统疾病的药物组合物,其活性组分由芒柄花素与天然冰片组成,还包括药学上可接受的载体用作神经保护剂。
[0018]
具体的,提供一种预防或治疗脑卒中的药物组合物,其活性组分由芒柄花素与天然冰片按照摩尔比1~2:1组成,还包括药学上可接受的载体。
[0019]
优选的,药学上可接受的载体如防腐剂、稳定剂、l-氨基酸、填充剂、稀释剂、崩解剂、粘合剂、抗粘着剂、助流剂、润滑剂、包衣、芳香剂、着色剂、甜味剂、栓剂、软膏基质、悬浮剂、增粘剂、硬化剂、ph调节剂、乳化剂、滋润剂、增溶剂、吸附剂、干燥剂、保湿剂、渗透剂等。
[0020]
优选的,药物组合物的制剂形式包括片剂、分散片、含片、口崩片、缓释片、胶囊剂、软胶囊剂、滴丸、丸剂、微囊微球制剂、栓剂、软膏剂、喷雾剂、靶向制剂、颗粒剂、注射剂、粉针剂或气雾剂等药学上可接受的剂型。
[0021]
该药物制剂的给药方式为口服、非肠道、脑内直接给药、鼻腔脑靶向给药、基因工程法、受体介导转运法给药或其它局部途径给药。
[0022]
作用原理方面,天然冰片与芒柄花素组合后,可以促进芒柄花素跨越血脑屏障,增加其在脑部的作用浓度,增强芒柄花素预防或治疗脑部疾病的作用效果。通过实验验证,本发明的芒柄花素和天然冰片组合物能有效减轻缺血性脑卒中损伤,具有神经保护作用。
[0023]
具体实验验证方面,本发明采用大鼠mcao模型、pc-12细胞ogd/r模型、lps诱导bv-2细胞释放no模型、transwell转运法、药代动力学法、western blot实验,充分证明了该配比组合物中天然冰片可以有效促进芒柄花素跨越血脑屏障,从而提高其入脑浓度。
[0024]
本发明中的transwell转运主要使用了caco-2细胞,分离自人的原发性结肠癌,当细胞长满时,表现出典型的肠细胞分化的特征。caco-2细胞模型是一种药物离体口服特性筛选模型,已广泛用于药物在小肠吸收的评价和各种转运机制研究中。特别是在药剂学研究注重在分子水平和细胞水平上发展的今天,caco-2细胞模型可应用于多类药物研究,帮助了解药物的吸收机制,预测体内吸收和药物相互作用。我们利用caco-2细胞长满后紧密连接的特性,将其铺于transwell小室内形成单层细胞层,从而模拟血脑屏障。
[0025]
本发明采用大鼠脑中动脉阻塞模型(mcao模型)进行神经行为学评分和梗死面积检测,实验结果表明芒柄花素和天然冰片以摩尔比1:1组合能显著改善急性缺血性脑损伤,对缺血性脑卒中具有较好的治疗作用,其作用效果好于单独使用芒柄花素。因此,芒柄花素和天然冰片组合可以用作制备抗脑缺血、具有神经保护作用的药物。
[0026]
ogd/r损伤pc-12细胞实验和lps诱导的bv-2细胞no释放抑制实验结果表明,天然冰片对芒柄花素抗缺血性脑损伤作用的增强主要是通过增加芒柄花素在脑组织中的浓度来实现,而非两者药效的加成或协同。
[0027]
caco-2单层细胞透过实验和western blot实验对血脑屏障相关蛋白检测表明,天然冰片促进芒柄花素在脑组织中浓度增加主要原因为天然冰片生理性可逆地增加血脑屏障通透性,抑制血脑屏障相关外排蛋p-gp、紧密连接蛋白occludin表达、增强摄取蛋白oct3的表达。
[0028]
由于采用上述技术方案,本发明具有以下优点和有益效果:
[0029]
本发明提供的一种芒柄花素和天然冰片组合物在制备预防或治疗中枢神经系统疾病药物中的应用,通过体外transwell模拟血脑屏障,表明天然冰片可增加芒柄花素的透过率。同时,采用sd大鼠体内药代动力学实验,表明天然冰片会促进芒柄花素在体内的吸收
和分布,并引药上行,使其在脑组织中的分布增多。通过体内mcao动物实验,表明芒柄花素和天然冰片组合可显著降低脑梗死面积,较好地改善神经行为学评分以保护急性缺血性脑损伤。
[0030]
因此,本发明以芒柄花素为例,利用天然冰片促进药物吸收的作用,提出一种通过天然冰片与治疗脑部疾病药物组合,发现新的治疗脑部疾病药物的方法,对中枢神经系统疾病药物开发提供了较好的借鉴和参考。芒柄花素和天然冰片组合物作为一种潜在的神经保护剂在中枢神经系统疾病的治疗及药物开发中具有较好的应用前景。
附图说明
[0031]
图1为芒柄花素与天然冰片以不同摩尔比组合后,芒柄花素的入血及入脑浓度比较,图1a为入血浓度,图1b为入脑浓度,其中1:1、2:1、3:1、4:1指芒柄花素和天然冰片组合的摩尔比例。
[0032]
图2为芒柄花素及芒柄花素+天然冰片在transwell体外血脑屏障模型中ap-bl及bl-ap的迁移,其中ap:apical side,顶侧;bl:basolateral side,底侧。其中fmn,fmn+borneol分别指芒柄花素单独给药(50μm)和芒柄花素与天然冰片以1:1摩尔比组合给药(50μm+50μm)。
[0033]
图3为芒柄花素及芒柄花素+天然冰片在血浆中48h内的药-时曲线,其中fmn,fmn+borneol分别指芒柄花素单独给药(30mg/kg)和芒柄花素与天然冰片以1:1摩尔比组合给药(30mg/kg+17mg/kg)。
[0034]
图4为芒柄花素及芒柄花素+天然冰片在脑组织中48h内的药-时曲线其中fmn,fmn+borneol分别指芒柄花素单独给药(30mg/kg)和芒柄花素与天然冰片以1:1摩尔比组合给药(30mg/kg+17mg/kg)。
[0035]
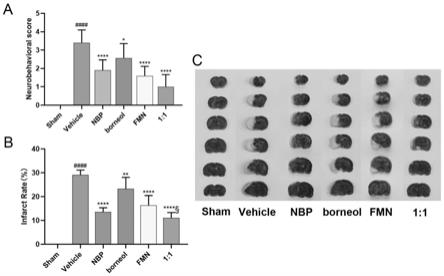
图5为芒柄花素和天然冰片组合物对脑缺血大鼠的保护作用的示意图:图5a为神经行为学评分;图5b为大鼠梗死率统计图;图5c为各组脑梗死示意图。其中sham表示假手术组,vehicle表示mcao模型组,nbp表示阳性药丁苯酞对照组,borneol表示天然冰片单独给药组,fmn表示芒柄花素单独给药组,1:1表示芒柄花素与天然冰片以1:1摩尔比组合给药组。采用单因素方差分析(one-way anova),duncan test检验,p《0.05为差异显著(*,p《0.05;**,p《0.01,***,p《0.001,****,p《0.0001vs.model)。
[0036]
图6为芒柄花素和天然冰片组合物对pc-12细胞ogd/r模型的保护作用的示意图:图6a为芒柄花素、天然冰片及组合物对pc-12细胞的毒性作用,以细胞存活率表示;图6b为ogd/r后各给药组细胞存活率,其中fmn,fmn+borneol分别指芒柄花素单独给药和芒柄花素与天然冰片以1:1摩尔比组合给药。
[0037]
图7为芒柄花素和天然冰片组合物对lps诱导bv-2细胞释放no抑制作用的示意图:图7a为芒柄花素、天然冰片与芒柄花素组合物对bv-2细胞的毒性作用,以细胞存活率表示;图7b-d为lps刺激后各给药组细胞的no释放浓度,其中fmn,borneol,fmn+borneol分别指芒柄花素单独给药,天然冰片单独给药和芒柄花素与天然冰片以1:1摩尔比组合给药。
[0038]
图8为western blot方法所示芒柄花素及天然冰片组合物对于血脑屏障相关外排蛋白,摄取蛋白,紧密连接蛋白的调控,其中a为对照组,b为芒柄花素单独给药组,c为芒柄花素和天然冰片以摩尔比1:1组合给药组,d为mcao模型组,e为模型+芒柄花素单独给药组,
f为模型+芒柄花素和天然冰片以摩尔比1:1组合给药组。
具体实施方式
[0039]
为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
[0040]
实施例1:芒柄花素和天然冰片组合物的制备
[0041]
1、仪器与试剂:
[0042]
芒柄花素(纯度>98%)、天然冰片(纯度>98%)、dmso、聚乙二醇400、无水乙醇(gr级)、pbs、cmc-na、超声波清洗机、涡旋仪。
[0043]
2、实验方法:
[0044]
腹腔注射溶液:制备6mg/ml的芒柄花素和天然冰片组合物50ml,精密称取芒柄花素300mg,天然冰片172mg,加入50μl dmso,超声2min使其溶解,加入混合溶剂(体积比):聚乙二醇400:无水乙醇:pbs=28.55:7.15:14.3至体积为50ml,涡旋1min,超声2min使其溶解。
[0045]
灌胃混悬液:制备6mg/ml的芒柄花素和天然冰片组合物100ml,精密称取芒柄花素600mg,天然冰片345mg,加入100μl dmso,超声2min使其溶解,加入0.5%的cmc-na溶液至体积为100ml,超声10min(期间多次振摇)使其充分混悬。
[0046]
实施例2:芒柄花素与天然冰片组合比例筛选
[0047]
1、仪器与试剂:
[0048]
肝素钠抗凝管、高速离心机、高通量组织研磨机、uplc-ms/ms。
[0049]
2、实验方法:
[0050]
健康sd雄性大鼠180
±
5g 45只,适应性喂养一周,随机分为5组,分别为芒柄花素组,芒柄花素与天然冰片以摩尔比1:1,2:1,3:1,4:1组合组,给药前12h禁食不禁水。按照芒柄花素30mg/kg腹腔注射给药,分别于10,20,40min时摘眼球取血,加入肝素钠抗凝管中,离心取血浆,-80冷冻保存;大鼠立即处死并取脑组织,剥离大血管膜,将脑组织与生理盐水以质量比1:5加入研磨管匀浆,血浆和脑匀浆均用uplc-ms/ms测定其中芒柄花素浓度,并比较每组在40min内入血及入脑最高浓度(每个时间点3只大鼠)。
[0051]
3、实验结果:
[0052]
如图1所示,芒柄花素与天然冰片以摩尔比1:1,2:1组合后给药,均比单独芒柄花素给药入血和入脑浓度高,其中入脑浓度最高的为1:1组合,且其入脑浓度与单独用芒柄花素给药的入脑浓度相比具有显著性差异,表明芒柄花素与天然冰片以摩尔比1:1组合后入血和入脑效果最好,因此选用1:1摩尔比组合进行后续实验。
[0053]
实施例3:transwell单层细胞模型
[0054]
1、仪器与试剂:
[0055]
人结肠癌细胞株(caco-2);dmem培养基、胎牛血清、胰蛋白酶、pbs缓冲液、co2细胞培养箱、costar 3460,12mm嵌套,12孔板、细胞培养超净工作台、低温超速离心机、倒置相差显微镜、微量移液器、uplc-ms/ms。
[0056]
2、实验方法:
[0057]
(1)caco-2细胞体外培养
[0058]
用添加了10%(v/v)胎牛血清、100u/ml青霉素以及100u/ml链霉素的dmem培养基进行培养,在温度37℃、5%co2条件下生长至80%-90%汇合时进行细胞传代。倾倒去除培养器皿内的培养基,用pbs洗涤细胞1次,弃去pbs,根据培养面积加入适量0.1%胰酶溶液消化,37℃放置1min,并在倒置相差显微镜下观察,待到绝大部分细胞变圆并悬浮后弃去胰酶并加入培养基终止消化,吹吸几次以离散成团的细胞,按1:5比例进行细胞传代,传代后的细胞24h后换液一次。
[0059]
(2)transwell单层细胞模型
[0060]
将对数生长期细胞用0.25%胰酶消化下来,调整密度为5
×
105个/ml,接种于transwell嵌套中,嵌套内加入0.5ml细胞悬液,嵌套外加入空白培养基1.5ml,放入37℃、5%co2培养箱中培养,用细胞电阻仪测量一周内的膜内外电阻,在电阻值达到峰值时分别在ap、bl端加入药物,于5min、15min、30min、1h、2h在另一端取出0.1ml转运溶液,uplc-ms/ms测定溶液中芒柄花素的含量。
[0061]
(3)药物的转运
[0062]
其中药物先用dmso配制成10mm的母液,使用时用hbss缓冲液稀释成25μm的工作液。当电阻值达到最高时,弃去原有培养基,用预热的hbss缓冲液洗一遍,并加入hbss缓冲液(transwell嵌套内0.5ml,外1.5ml),于孵箱内平衡30min,弃去hbss,ap-bl在ap端加入0.5ml药物工作液,bl端加入1.5ml空白hbss;bl-ap在bl端加入1.5ml药物工作液,ap端加入0.5ml空白hbss,在不同时间点于空白端取0.1ml转运溶液,用uplc-ms/ms技术测定溶液中芒柄花素的含量。
[0063]
3、实验结果:
[0064]
如图2所示,芒柄花素与天然冰片以摩尔比1:1组合后,其从ap-bl及从bl-ap透过率均高于芒柄花素单独给药组,说明天然冰片有潜在的促进芒柄花素透过血脑屏障的作用。
[0065]
实施例4:芒柄花素和天然冰片组合物的sd大鼠药代动力学
[0066]
1、仪器与试剂:
[0067]
sd雄性大鼠180
±
5g,芒柄花素(纯度>98%),天然冰片,dmso(纯度>98%),cmc-na(使用时加水配制成0.5%工作液)、uplc-ms/ms。
[0068]
2、实验方法:
[0069]
(1)sd雄性大鼠饲养
[0070]
180
±
5g sd雄性大鼠66只随机分为2组,每组33只,一组给予芒柄花素,一组给予芒柄花素与天然冰片摩尔比1:1混合液。不同给药组随机分为11组,每组3只,分别在不同时间点取材。大鼠适应性喂养一周,期间正常喂食,饮水,于给药前12h禁食不禁水,给药前称量体重为210
±
5g,单次灌胃给药。
[0071]
(2)测定血浆和脑中芒柄花素的药物浓度
[0072]
按照称量的体重,以30mg/kg计算给药量和给药体积,1ml注射器吸取适量体积的药物混悬液,将注射器针头换为灌胃针头,因为每只大鼠取血后立即处死取脑,因此可以分批进行,先给1,3,6,12,24,48h取材的大鼠灌胃,并记录给药时间,然后时间间隔较短的可按时间依次进行。在给药后各时间点摘眼球取血,加入肝素钠抗凝管中,离心取血浆,-80
°
冷冻保存;大鼠立即处死并取脑组织,剥离大血管膜,将脑组织与生理盐水以质量比1:5加入研磨管匀浆,血浆和脑匀浆均用uplc-ms/ms测定其中芒柄花素浓度。
[0073]
(3)绘制血药浓度和脑药浓度曲线
[0074]
das2软件输入时间及测得的对应时间点芒柄花素浓度,进行药代动力学计算,绘制血药浓度和脑药浓度曲线,并比较冰片混合药物组与单用芒柄花素组auc等指标。
[0075]
3、实验结果
[0076]
采用das2软件计算相关指标,结果参见表1和表2:
[0077]
表1血药浓度参数
[0078][0079]
由表1中数据及图3可知,芒柄花素与天然冰片组合给药后,各项参数均大于芒柄花素单独给药,药-时曲线下面积(auc)是坐标轴与药-时曲线围成的面积,反映药物进入体循环的相对量,说明天然冰片可以增加芒柄花素进入血液中的相对量,并增加芒柄花素在血液中的滞留时间。
[0080]
表2脑药浓度参数
[0081][0082]
由表2中数据及图4可知,芒柄花素与天然冰片组合给药后,各项参数均大于芒柄花素单独给药组,且加冰片组从一室模型变为二室模型,说明药物在血浆中和组织中的分布平衡速度不同,芒柄花素在天然冰片的作用下可能更易进入脑组织,且芒柄花素与天然冰片混合组auc显著高于芒柄花素单用组,说明天然冰片可以显著增加芒柄花素进入脑组织中的相对量。
[0083]
实施例5:芒柄花素和天然冰片组合物对脑缺血再灌注大鼠的保护作用
[0084]
1、仪器与试剂:
[0085]
mcao线栓(230-260g),手术器材(持针器、弯剪、直剪、眼科镊、缝合针、干棉球、酒精棉球、10%水合氯醛、注射器、碘伏、棉签、记号笔),自制拉钩(皮筋+曲别针+大头针)。sd雄性大鼠250
±
5g,芒柄花素(纯度>98%),天然冰片,丁苯酞(阳性药),注射用植物油。
[0086]
2、实验方法:
[0087]
(1)药物配制
[0088]
芒柄花素及芒柄花素与天然冰片摩尔比1:1混合液均以芒柄花素为准配制成10mg/ml(dmso助溶,加0.5%cmc-na配制成工作液),天然冰片配制成5mg/ml,丁苯酞按照药物说明书,加注射用植物油配制成25mg/ml的工作液。
[0089]
(2)实验分组和给药方案
[0090]
230
±
5g sd雄性大鼠48只随机分为6组,每组8只,分别为对照组、模型组、丁苯酞组(阳性药)、芒柄花素组、天然冰片组、芒柄花素+天然冰片组。大鼠适应性喂养一周,期间正常喂食,饮水,于造模前12h禁食不禁水,造模前称量体重为250
±
5g。
[0091]
(3)大鼠大脑中动脉阻塞(middle cerebral artery occlusion,mcao)再灌注模型
[0092]
用10%水合氯醛(0.3ml/100g)腹腔注射麻醉。于颈前正中位置剃毛、消毒,切开2cm左右切口,钝性分离右侧颈总动脉(common carotid arteries,cca)、颈外动脉(external carotidartery,eca)、颈内动脉(internal carotid artery,ica),用5-0手术线分别结扎eca的远心端,cca的近心端,并于cca的近心端与eca和ica交叉处之间进行活结结扎;以与大鼠体重匹配的栓线自cca结扎处经cca与ica分叉部插入ica颅内段,使栓线上标记过eca和ica交叉处,到达大脑中动脉环,扎紧活结以防止出血和线栓移动。逐层缝合颈部皮肤。阻断2h后,拔出线栓进行再灌注22h。假手术组仅将cca、eca、ica游离出来,不做结扎、插线处理,其他操作同模型组。
[0093]
(4)神经功能缺失体征评分:
[0094]
参考longa的5分制法进行评分:
[0095]
0分:无神经功能损伤;
[0096]
1分:不能完全伸展对侧前肢;
[0097]
2分:不能伸展对侧前肢;
[0098]
3分:轻度向对侧转圈;
[0099]
4分:严重向对侧转圈;
[0100]
5分:对侧肢体偏瘫;
[0101]
分值越高,说明动物行为障碍越严重。
[0102]
(5)四氮唑(2,3,5-triphenyltetrazoliumiides,ttc)法染色:ttc(2,3,5-氯化三苯基四氮唑)是一种脂溶性光敏感的复合物。1894年,首次合成后用来检测种子的生存能力;从1958年开始,可以用来染色后检测哺乳动物组织的缺血性梗塞,是一种呼吸链中吡啶核苷结构酶系统的质子受体,与正常组织中的脱氢酶反应而呈现红色,而缺血的组织内脱氢酶的活性下降,不能进行反应,故不会产生变化而呈现白色。
[0103]
3、实验结果:
[0104]
如图5所示,图5是采用芒柄花素和天然冰片组合对脑缺血大鼠的保护作用的示意
图,图5a表示大鼠神经行为学评分图,图5b表示数理统计脑组织梗塞体积图,图5c表示ttc染色脑组织梗塞体积图。
[0105]
从图5a中可以看出,阳性药丁苯酞、芒柄花素、天然冰片、芒柄花素与天然冰片摩尔比1:1组合物均可改善其神经功能缺失体征评分,芒柄花素与天然冰片1:1组合物改善mcao大鼠神经行为学评分的效果明显好于单独使用芒柄花素或单独使用天然冰片;从图5b和图5c中可以得出,相较于假手术组(control),模型组(mcao)大鼠再灌注后脑缺血体积为29.07
±
2.46%(p《0.001),阳性药丁苯酞、芒柄花素、天然冰片、芒柄花素与天然冰片摩尔比1:1组合物组均可显著降低mcao大鼠再灌注后脑缺血体积,脑缺血体积分别减少至13.58
±
2.87%(p《0.05)、16.32
±
6.19%(p《0.01)、24.28
±
7.26%(p《0.05)和11.08
±
3.64%(p《0.01)。结果表明,芒柄花素与天然冰片摩尔比1:1组合能有效地保护脑组织免于缺血后坏死,具有良好的神经保护活性,芒柄花素与天然冰片摩尔比1:1组合物的作用效果显著强于单独使用芒柄花素及单独使用天然冰片,且强于阳性对强丁苯酞,效果具有显著性差异。
[0106]
实施例7:pc-12细胞ogd/r模型
[0107]
1、仪器与试剂:
[0108]
大鼠肾上腺嗜铬细胞瘤细胞(pc-12);dmem培养基、dmem无糖培养基、胎牛血清、胰蛋白酶、pbs缓冲液、cell counting kit-8(cck-8试剂盒)、co2细胞培养箱、costar3599,96孔板、细胞厌氧培养箱细胞培养超净工作台、低温超速离心机、倒置相差显微镜、微量移液器。
[0109]
2、实验方法:
[0110]
(1)pc-12细胞体外培养
[0111]
用添加了10%(v/v)胎牛血清、100u/ml青霉素以及100u/ml链霉素的dmem培养基进行培养,在温度37℃、5%co2条件下生长至80%-90%汇合时进行细胞传代。倾倒去除培养器皿内的培养基,用pbs洗涤细胞1次,弃去pbs,根据培养面积加入适量0.1%胰酶溶液消化,37℃放置1min,并在倒置相差显微镜下观察,待到绝大部分细胞变圆并悬浮后弃去胰酶并加入培养基终止消化,吹吸几次以离散成团的细胞,按1:2比例进行细胞传代,传代后的细胞24h后换液一次。
[0112]
(2)ogd/r模型
[0113]
将对数生长期细胞用0.25%胰酶消化下来,调整密度为5
×
104个/ml,接种于96孔板中,每孔100μl,放入37℃、5%co2培养箱中培养24h,弃去原有培养基,分别加入不同浓度的芒柄花素或芒柄花素与冰片摩尔比1:1组合物,阴性对照组和模型组加入新的空白培养基,预给药2h后,弃去药物,更换为dmem无糖培养基,置于37℃、5%o2、5%co2厌氧培养箱内,阴性对照组更换一次空白培养基(目的是使每组细胞操纵一致),放入37℃、5%co2培养箱中。8h后将无糖培养基更换为药物或空白培养基,24h后cck-8试剂盒测定细胞存活率。
[0114]
3、实验结果:
[0115]
如图6所示,图6是采用芒柄花素和天然冰片组合对pc-12细胞ogd/r模型的保护作用的示意图,图6a表示芒柄花素、天然冰片和组合物对pc-12细胞的细胞毒性,图6b表示药物对ogd/r模型细胞的保护作用。
[0116]
从图6a中可以看出,芒柄花素、天然冰片、芒柄花素与天然冰片摩尔比1:1组合物在50μm浓度内对pc-12细胞几乎没有毒性;从图6b可以得出,芒柄花素及芒柄花素与天然冰
片摩尔比1:1组合物对ogd/r模型造成的pc-12细胞存活率降低,具有保护作用,但是组合物和芒柄花素单独使用相比,保护作用无显著性差异,表明芒柄花素和天然冰片并无协同作用,侧面证明天然冰片对芒柄花素抗脑缺血作用的增强应是促进芒柄花素入脑浓度增加,而不是二者药效的叠加。
[0117]
实施例8:lps诱导bv-2细胞释放no抑制实验
[0118]
1、仪器与试剂:
[0119]
小鼠小胶质细胞(bv-2);脂多糖(lps)、dmem培养基、dmem无糖培养基、胎牛血清、胰蛋白酶、pbs缓冲液、cell counting kit-8(cck-8试剂盒)、griess试剂盒、co2细胞培养箱、costar 3599,96孔板、低温超速离心机、倒置相差显微镜、微量移液器。
[0120]
2、实验方法:
[0121]
(1)bv-2细胞体外培养
[0122]
用添加了10%(v/v)胎牛血清、100u/ml青霉素以及100u/ml链霉素的dmem培养基进行培养,在温度37℃、5%co2条件下生长至80%-90%汇合时进行细胞传代。倾倒去除培养器皿内的培养基,用pbs洗涤细胞1次,弃去pbs,根据培养面积加入适量0.1%胰酶溶液消化,37℃放置1min,并在倒置相差显微镜下观察,待到绝大部分细胞变圆并悬浮后弃去胰酶并加入培养基终止消化,吹吸几次以离散成团的细胞,按1:2比例进行细胞传代,传代后的细胞24h后换液一次。
[0123]
(2)lps刺激bv-2细胞释放no抑制实验
[0124]
将对数生长期细胞用0.25%胰酶消化下来,调整密度为4
×
105个/ml,接种于96孔板中,每孔100μl,放入37℃、5%co2培养箱中培养4h,弃去原有培养基,分别加入不同浓度的芒柄花素、天然冰片和组合物,除阴性对照组外均加入lps,使其终浓度为2μg/ml。于培养箱中培养24h,吸取上清液,用griess试剂盒测定no释放量。
[0125]
3、实验结果:
[0126]
从图7a中可以看出,芒柄花素、芒柄花素与天然冰片摩尔比1:1组合物在100μm浓度内对bv-2细胞几乎没有毒性;如图7b-d所示,芒柄花素、天然冰片和二者摩尔比1:1组合物,在浓度3μm-100μm之间,均可以显著性降低lps引起的no释放,但组合物相比于芒柄花素及天然冰片单独给药,相同浓度下并无显著性差异,联系pc-12细胞ogd/r实验,进一步表明天然冰片对芒柄花素药效的增强并不是二者药效的叠加,主要影响因素是促进芒柄花素入脑浓度增加。
[0127]
实施例9:western blot法检测血脑屏障相关蛋白表达
[0128]
1、仪器与试剂:
[0129]
大鼠脑组织;牛血清白蛋白(bsa);组织蛋白裂解液;bca蛋白浓度测定试剂盒;sds;pvdf膜;抗体:兔抗人p-gp单克隆抗体、兔抗人oct-3单克隆抗体、鼠occludin单克隆抗体和鼠tubulin单克隆抗体;辣根过氧化物酶标记的山羊抗兔的二抗;低温超速离心机;移液器;sds-page凝胶电泳及转膜仪;全自动酶标仪;odyssey双色红外激光成像系统;-80℃超低温冰箱。
[0130]
2、实验方法:
[0131]
(1)蛋白浓度标准曲线
[0132]
将0.5mg/ml的蛋白标准液按照0,1,2,4,8,12,16,20μl加到96孔板中,加pbs补足
到20μl,每个浓度两个复孔,加入200μl的bca工作液,37℃孵育30min。用酶标仪测定562nm下的紫外吸收,根据标准液浓度及测定的od值绘制标准曲线。
[0133]
(2)脑组织蛋白提取
[0134]
取大鼠视交叉后2~5mm脑组织10mg置于2ml研磨管中,加入ripa裂解液(已预先加入1%pmsf蛋白酶抑制剂)300μl,每管加入一颗研磨珠,在高通量组织研磨仪上55hz研磨300s,取出后4℃冰箱静置裂解20min,12000rpm低温离心15min,取上清,根据标准曲线计算蛋白浓度,用裂解液调为相同浓度,加入5
×
loading buffer稀释,沸水煮10min使蛋白变性,冷却后-20℃保存备用。
[0135]
(3)检测大鼠脑组织中bbb相关蛋白的表达
[0136]
每个样品取80μg蛋白上样,同时在两边孔分别加入2.5μl、1.5μlmarker进行电泳,结束后采用湿转2h至pvdf膜上,脱脂奶粉室温封闭1h,根据分子量大小及marker的位置切膜,分别加入p-gp单克隆抗体(1:500)、oct-3单克隆抗体(1:500)、occludin单克隆抗体(1:5000)和tubulin单克隆抗体(1:100000),4℃摇床孵育过夜,tbst洗膜每5分钟3次,避光加入羊抗鼠、羊抗兔荧光二抗(1:3000),室温避光孵育2h,tbst洗膜3次,每次5分钟,使用odyssey进行暗室发光得到条带。
[0137]
3、实验结果:
[0138]
天然冰片促进芒柄花素跨越血脑屏障与一系列的外排、摄取、紧密连接相关蛋白表达有关,如p-gp、oct3、occludin等。结果如图8所示,图8是采用western blot检测脑组织中外排、摄取、紧密连接相关蛋白的相对表达水平的示意图。
[0139]
图8中,a为对照组,b为芒柄花素单独给药组,c为芒柄花素和天然冰片以摩尔比1:1组合给药组,d为mcao模型组,e为模型+芒柄花素单独给药组,f为模型+芒柄花素和天然冰片摩尔比1:1组合物给药组。从图8可以看出:(1)在健康大鼠给药芒柄花素后,外排蛋白p-gp表达量升高,但芒柄花素与天然冰片组合给药后,p-gp表达量显著降低,说明冰片确实可以降低正常大鼠血脑屏障中外排蛋白p-gp的表达,从而减少药物的外排;在mcao模型大鼠给药后,芒柄花素和与天然冰片组合均会降低p-gp的表达,但效果相比模型组没有显著性差异。(2)在健康大鼠和mcao模型鼠中,芒柄花素和天然冰片组合给药后,摄取蛋白oct3的表达量显著提高,说明天然冰片可以促进摄取蛋白表达量的升高,从而增强对药物的摄取作用。(3)在健康大鼠芒柄花素与天然冰片组合给药后,occludin表达量降低,说明冰片会使血脑屏障的紧密连接暂时打开,增加药物入脑;在mcao模型大鼠,occludin表达量显著降低,说明脑卒中会破坏血脑屏障的紧密连接,但给药后,occludin表达量显著升高,说明芒柄花素有一定的神经保护作用,使血脑屏障的紧密连接恢复,但芒柄花素和与天然冰片组合与单用芒柄花素相比降低了occludin的表达,这与冰片打开紧密连接相吻合。因此,冰片会通过不同途径促使芒柄花素透过血脑屏障,从而提高芒柄花素的入脑浓度。
[0140]
以上所述仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专利的技术人员在不脱离本发明技术方案范围内,当可利用上述提示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1