靶向治疗心肌梗死的锂皂石复合递送材料及其制备与应用
1.本发明属于纳米生物材料技术领域,涉及一种靶向治疗心肌梗死的锂皂石复合递送材料及其制备与应用。
背景技术:
2.心肌梗死是威胁人类生命健康的一大杀手,尽管冠脉搭桥和支架介入已在临床广泛开展,但心肌梗死导致的死亡率依然居高不下。因此,寻找治疗心肌梗死的新型策略迫在眉睫。研究发现,microrna(mirna)在心肌梗死的发病过程中发挥重要的调控作用。多种mirna如mir-1、mir-133a和mir-92a等在心肌梗死组织中的细胞凋亡、氧化应激、血管新生等病理进程中扮演重要角色,有望成为心梗有效的基因治疗手段。而选择一种安全高效的递送系统,是将mirna运载到心梗局部病灶发挥治疗作用的前提。
3.与传统的病毒载体相比,采用纳米载体递送mirna,具有良好的生物安全性和体外靶向性能。但纳米化mirna的体内递送效率并不理想,这是因为mirna在血液循环中半衰期短,且不具备梗死心肌的主动靶向性。
技术实现要素:
4.本发明的目的是提供一种安全、负载量高的缓释型靶向心肌梗死局部的锂皂石基纳米递送材料及其制备与应用。
5.本发明的目的可以通过以下技术方案来实现:
6.靶向治疗心肌梗死的锂皂石复合递送材料,该复合递送材料包括负载microrna的锂皂石以及外部包覆的靶向特异性细胞膜。
7.进一步地,所述的锂皂石包括rd锂皂石、rds锂皂石、xlg锂皂石、xls锂皂石或s482锂皂石中的一种或更多种,所述的microrna包括mir-1、mir-204、mir-133a或mir-92a中的一种或更多种,所述的靶向特异性细胞膜为血小板膜、巨噬细胞膜或外泌体中的一种。
8.进一步地,该复合递送材料中,microrna的质量百分含量为0.01-20%,靶向特异性细胞膜的质量百分含量为0.01-20%。
9.优选地,锂皂石复合递送材料所配置药剂中固体占整个液体质量的比例(质量占比)为0.01-20%。
10.优选地,该复合递送材料还包括溶剂,该溶剂与锂皂石的质量比为4-1000:1。
11.靶向治疗心肌梗死的锂皂石复合递送材料的制备方法,该方法包括以下步骤:
12.1)将microrna溶液与锂皂石混合后,进行交换吸附反应,后经分离得到缓释型microrna-锂皂石复合材料;
13.2)将缓释型microrna-锂皂石复合材料分散在溶剂中,并加入靶向特异性细胞膜,在搅拌下进行吸附包裹反应,后经分离得到所述的靶向治疗心肌梗死的锂皂石复合递送材料。
14.进一步地,步骤1)中,所述的microrna溶液的浓度为0.5wt%-5wt%,交换吸附反
应的温度为0-50℃,时间为0.1-20h。
15.进一步地,步骤2)中,所述的溶剂为水,吸附包裹反应的温度为温度为0-50℃,时间为1-48h。
16.进一步地,步骤2)中,将吸附包裹反应后分离得到的产物加入至溶剂中,配制成溶液。
17.制备过程中,采用离心的方法进行分离,采用冰浴及水浴方式进行控温。
18.复合递送材料在制备靶向治疗心肌梗死的药物中的应用。复合递送材料对缺血心肌局部细胞凋亡、氧化应激、内皮新生血管形成起重要调变作用,消除半衰期较传统药物延长,提高了药物的生物利用率。包覆特异性细胞膜的纳米颗粒在活体成像上显示出更强的心肌靶向性,且对心肌梗死周围弱酸性ph敏感,靶向局部精准释放。
19.靶向治疗心肌梗死的药物,该药物含有所述的复合递送材料。
20.锂皂石是一种人工合成的硅酸盐,具有特定的层状结构。锂皂石纳米层具有各向异性的电荷分布:边缘带正电荷,层外表面带负电荷。锂皂石具有良好的离子交换能力(ph为6~13时可达50~150mmol/100g)、大的比表面积(可达350m2/g)。在水中分散时,锂皂石晶体间靠近,表面电荷会使得彼此相互排斥,使得锂皂石晶体可以在水中均匀分散,易形成牛顿型和低粘度流动的水凝胶或溶胶,具有可调的触变性和流变特性。
21.本发明采用表面积大、生物相容度高、水中分散性好的多孔锂皂石纳米黏土材料作为载体,负载对缺血心肌局部细胞凋亡、氧化应激、内皮新生血管形成起重要调变作用的microrna,再应用生物膜技术外包特异性细胞膜以靶向作用梗死心肌局部,并利用锂皂石ph敏感特性将药物精准释放。本发明中的材料具有制备方法简单、碱量和碱强度可控、药物负载量高、生物安全性强的特点,药物心肌靶向性高并可局部精准释放,且消除半衰期较传统药物延长,提高了药物的生物利用率,为心肌梗死药物递送提供一种可控、缓释、高效的多功能复合平台。
22.与现有技术相比,本发明具有以下特点:
23.1)本发明应用的纳米载体锂皂石具有良好的离子交换能力、大的比表面积,在水中分散时,锂皂石晶体间靠近,表面电荷会使得彼此相互排斥,使得锂皂石晶体可以在水中均匀分散,易形成牛顿型和低粘度流动的水凝胶或溶胶,具有可调的触变性和流变特性,可根据纳米复合物设计需求,进行多样的纳米复合材料合成。
24.2)本发明中的锂皂石复合递送材料结构稳定,是包载mirna的潜在优良载体,能够克服颗粒凝集反应,屏蔽内皮网状系统的识别,使其能长时间在体循环中发挥作用,提高mirna递送率。
25.3)本发明中的锂皂石复合递送材料具有生物体内可降解、生物相容性较好的特点,在递送mirna过程中不易被自体免疫系统清除,且容易穿透血管而不引起血管内皮损伤,保护药物免受酶降解,具有较高的生物安全浓度,可提高mirna递送负载量及心肌局部药物聚集浓度。
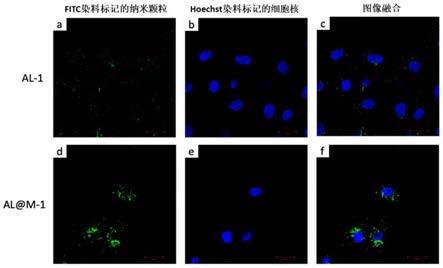
26.4)本发明中的锂皂石复合递送材料利用细胞膜仿生技术,将血小板膜、巨噬细胞膜或外泌体应用于纳米颗粒包覆,使纳米颗粒随细胞膜上的特异性受体或膜蛋白的靶向递送性,定向迁移至缺血心肌局部,具有治疗心肌梗死的精确靶向性,提高作用效率。
27.5)本发明中的锂皂石复合递送材料对缺血心肌局部细胞凋亡、氧化应激、内皮新
生血管形成起重要调变作用。
28.6)本发明中的锂皂石复合递送材料利用锂皂石的层状结构、高负载量、ph值依赖性,可使药物在心梗局部弱酸性条件下缓慢释放,消除半衰期较传统药物延长,提高了药物的生物利用率。
附图说明
29.图1为实施例中荧光显微镜评估心肌细胞对纳米颗粒的摄取和吞噬结果图;
30.图2为实施例中流式细胞术评估纳米颗粒对h2o2刺激下心肌细胞的凋亡影响结果图,其中,a为正常环境下的心肌细胞,b为h2o2刺激后的心肌细胞,c为加入锂皂石纳米复合物al@m-2后的心肌细胞;
31.图3为实施例中离体成像评估纳米颗粒对心肌组织靶向作用结果图。
具体实施方式
32.下面结合附图和具体实施例对本发明进行详细说明。本实施例以本发明技术方案为前提进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
33.本发明提供了一种靶向治疗心肌梗死的锂皂石复合递送材料,该复合递送材料包括负载microrna的锂皂石以及外部包覆的靶向特异性细胞膜。
34.其中,锂皂石包括rd锂皂石、rds锂皂石、xlg锂皂石、xls锂皂石或s482锂皂石中的一种或更多种,microrna包括mir-1、mir-204、mir-133a或mir-92a中的一种或更多种,靶向特异性细胞膜为血小板膜、巨噬细胞膜或外泌体中的一种。该复合递送材料中,microrna的质量百分含量为0.01-20%,靶向特异性细胞膜的质量百分含量为0.01-20%。
35.优选地,该复合递送材料还包括溶剂,该溶剂与锂皂石的质量比为4-1000:1。
36.本发明同时提供了上述复合递送材料的制备方法,该方法包括以下步骤:
37.1)将microrna溶液与锂皂石混合后,进行交换吸附反应,后经分离得到缓释型microrna-锂皂石复合材料;
38.2)将缓释型microrna-锂皂石复合材料分散在溶剂中,并加入靶向特异性细胞膜,在搅拌下进行吸附包裹反应,后经分离得到靶向治疗心肌梗死的锂皂石复合递送材料。
39.步骤1)中,microrna溶液的浓度为0.5wt%-5wt%,交换吸附反应的温度为0-50℃,时间为0.1-20h。
40.步骤2)中,溶剂为水,吸附包裹反应的温度为温度为0-50℃,时间为1-48h。优选地,进一步将吸附包裹反应后分离得到的产物加入至溶剂中,配制成溶液。
41.本发明还提供了上述复合递送材料在制备靶向治疗心肌梗死的药物中的应用。
42.本发明进一步提供了一种靶向治疗心肌梗死的药物,该药物含有上述复合递送材料。
43.实施例1:
44.将含有1.0wt%浓度的microrna(抗mir-1反义寡核苷酸,简称amo-1)溶液与rd型锂皂石(rd-lp)以液固比50:1混合后,在50℃进行交换吸附8.0h,经离心后得到固体产物,多次洗涤离心处理后,得到缓释型[amo-1/rd-lp]-1复合递送材料(简称al-1)。将所得复合
材料加入1.0wt%浓度的血小板膜(pm)水溶液(液固比50:1),于25℃搅拌吸附包裹10.0h,经离心分离,并配成1wt%浓度溶液,即得到靶向治疗心肌梗死的锂皂石复合递送材料[amo-1/rd-lp@pm]-1(简称al@m-1)。
[0045]
通过荧光显微镜定位观察心肌细胞对al-1与al@m-1的吞噬摄取效率以及在细胞内的分布情况。
[0046]
1)预先准备异硫氰酸荧光素(fitc)标记的纳米颗粒(nps)al-1与al@m-1:100mg al-1溶液与100mg al@m-1溶液分别分散于8ml的去离子水之中,加入3ml的fitc乙醇溶液(1ml/mg),避光搅拌6h后4000g离心收集纳米颗粒,清洗3次,过0.45μm的滤膜后,取样定量备用。
[0047]
2)按照5万/孔的细胞浓度,将提取的原代新生大鼠心肌细胞(nrcms)种在24孔板,等待细胞完全贴壁,进行后续实验;
[0048]
3)使用低糖培养基(dmem)将al-1与al@m-1稀释到200μg/ml备用;
[0049]
4)各组细胞根据所描述方案进行模型与给药,孵育3h;
[0050]
5)3h后,将培养基吸去,使用磷酸盐平衡生理盐水(pbs)清洗3次,清除未被吞噬摄取的al-1与al@m-1;
[0051]
6)吸干pbs,每个孔加入0.5ml的多聚甲醛(4%)固定,室温10min;
[0052]
7)pbs清洗3次,清除残留的多聚甲醛固定液;
[0053]
8)每个孔加入150微升的荧光染料hochest3342染色,对细胞核进行上色;
[0054]
9)pbs清洗3次之后,每个孔加入200微升的抗荧光淬灭剂;
[0055]
10)荧光显微镜拍摄观察(激发光:hochest3342-340 nm,fitc-525nm)。
[0056]
荧光显微镜结果如图1显示,al-1与al@m-1均通过与fitc共孵育包被显示绿色荧光,图中fitc(绿色荧光)分别代表al-1与al@m-1在细胞内的摄取和分布。如图1所示,心肌细胞吞噬al@m-1多于al-1。而al-1与al@m-1在心肌细胞中的摄取又进一步通过流式细胞术定量分析。结果显示心肌细胞吞噬al-1的平均免疫荧光强度是4430
±
219;吞噬al@m-1的平均免疫荧光强度是14633+463,吞噬效率明显提高(p《0.001)。
[0057]
实施例2:
[0058]
将含有1.5wt%浓度的microrna(抗mir-133反义寡核苷酸,简称amo-133)溶液与rds型锂皂石(rds-lp)以液固比40:1混合后,在50℃进行交换吸附10.0h,经离心后得到固体产物,多次洗涤离心处理后,得到缓释型[amo-133/rds-lp]-2复合递送材料(简称al-2)。将所得复合材料加入1.5wt%浓度的巨噬细胞膜(mm)水溶液(液固比40:1),于25℃搅拌吸附包裹12.0h,经离心分离,并配成1.5wt%浓度溶液,即得到靶向治疗心肌梗死的锂皂石复合递送材料[amo-133/rds-lp@mm]-1(简称al@m-2)。
[0059]
应用流式细胞annexin v/pi双染色法评估al@m-2对氧化应激状态下心肌细胞凋亡的影响:
[0060]
1)细胞收集:悬浮细胞直接收集到10ml的离心管中,每样本细胞数为(1~5)
×
106/ml,500~1000r/min离心5min,弃去培养液。
[0061]
2)用孵育缓冲液洗涤1次,500~1000r/min离心5min。
[0062]
3)用100ul的标记溶液重悬细胞,室温下避光孵育10~15min。
[0063]
4)500~1000r/min离心5min沉淀细胞孵育缓冲液洗1次。
[0064]
5)加入荧光(sa-flous)溶液4下孵育20min,避光并不时振动。
[0065]
6)流式细胞仪分析:流式细胞仪激发光波长用488nm,用一波长为515nm的通带滤器检测fitc荧光,另一波长大于560nm的滤器检测pi。
[0066]
流式细胞结果如图2显示,对照正常环境下的心肌细胞(图2中a),h2o2刺激后心肌细胞的凋亡明显上调(图2中b),加入锂皂石纳米复合物al@m-2后可明显缓解h2o2刺激后心机细胞的凋亡程度(图2中c)。
[0067]
实施例3:
[0068]
将含有2.0wt%浓度的microrna(抗mir-92a反义寡核苷酸,简称amo-92a)溶液与s482型锂皂石(s482-lp)以液固比40:1混合后,在50℃进行交换吸附10.0h,经离心后得到固体产物,多次洗涤离心处理后,得到缓释型[amo-92a/s482]-3复合递送材料(简称al-3)。将所得复合材料加入2.0wt%浓度的血小板外泌体(plt-ev)水溶液(液固比40:1),于25℃搅拌吸附包裹12.0h,经离心分离,并配成2.0wt%浓度溶液,即得到靶向治疗心肌梗死的锂皂石复合递送材料[amo-92a/s482-lp@plt-ev]-3(简称al@m-3)。
[0069]
通过离体活力成像观察al-3与al@m-3对心脏靶向性及其他脏器分布情况:
[0070]
1)预先准备fitc标记al-3与al@m-3:100mg al-3与100mg al@m-3溶液分别分散于8ml的去离子水之中,加入3ml的fitc乙醇溶液(1ml/mg),避光搅拌6h后,4000g离心收集纳米颗粒,清洗3次,过0.45μm的滤膜后,取样定量备用。每组大鼠分别于测试前6小时给药给予1mg/kg剂量的al-3与al@m-3注射。
[0071]
2)麻醉:每只大鼠称重后给予腹腔注射2%的戊巴比妥钠溶液,300微升/100g;
[0072]
3)待大鼠完全麻醉后,于胸骨左侧3-4肋间横切口切开皮肤,使用止血钳逐层分离各肌层,刺破胸膜后,使用肋骨撑开器撑开肋骨,暴露心包,小心撕开心包膜,暴露心脏;
[0073]
4)仔细剪下心脏,放在预冷的pbs里冲洗干净表面血渍,吸干表面水分;
[0074]
5)放置心脏于黑色背景试纸上,送入小动物活体光学二维成像系统中检测荧光信号fitc:488nm;
[0075]
6)记录数据,成像分析。
[0076]
通过使用fitc标记的al-3与al@m-3对mi/ri大鼠进行了心脏离体活体成像。在mi/ri大鼠静脉注射fitc标记的al-3与al@m-3 6小时后,通过辐射效率定量显示,al@m-3组在损伤组织的摄取比al-3组增加了约5倍(图3)。
[0077]
实施例4:
[0078]
将含有1.5wt%浓度的microrna(抗mir-204反义寡核苷酸,简称amo-204)溶液与xls型锂皂石(xls-lp)以液固比40:1混合后,在50℃进行交换吸附8.0h,经离心后得到固体产物,多次洗涤离心处理后,得到缓释型[amo-204/xls-lp]-4复合递送材料(简称al-4)。将所得复合材料加入1.5wt%浓度的血小板外泌体(plt-ev)水溶液(液固比40:1),于25℃搅拌吸附包裹10.0h,经离心分离,并配成1.5wt%浓度溶液,即得到靶向治疗心肌梗死的锂皂石复合递送材料[amo-204/xls-lp@plt-ev]-4(简称al@m-4)。
[0079]
通过上述荧光显微镜定位及离体活力成像检测观察,心肌细胞对al@m-4的吞噬摄取效率及al@m-4在体对损伤心肌靶向能力均表现出较好的特性。
[0080]
实施例5:
[0081]
将含有1.5wt%浓度的microrna(抗mir-133反义寡核苷酸,简称amo-133)溶液与
rds型锂皂石(rds-lp)以液固比60:1混合后,在50℃进行交换吸附10.0h,经离心后得到固体产物,多次洗涤离心处理后,得到缓释型[amo-133/rds-lp]-5复合递送材料(简称al-5)。将所得复合材料加入1.5wt%浓度的巨噬细胞膜(mm)水溶液(液固比60:1),于25℃搅拌吸附包裹12.0h,经离心分离,并配成1.5wt%浓度溶液,即得到靶向治疗心肌梗死的锂皂石复合递送材料[amo-133/rds-lp@mm]-5(简称al@m-5)。
[0082]
通过上述荧光显微镜定位及免疫流式凋亡检测观察,心肌细胞对al@m-5的吞噬摄取效率及al@m-5对h2o2刺激后心肌细胞的抗凋亡能力表现出较好的特性。
[0083]
实施例6:
[0084]
将含有2.0wt%浓度的microrna(抗mir-1反义寡核苷酸,简称amo-1)溶液与s482型锂皂石(s482-lp)以液固比40:1混合后,在50℃进行交换吸附10.0h,经离心后得到固体产物,多次洗涤离心处理后,得到缓释型[amo-1/s482]-6复合递送材料(简称al-6)。将所得复合材料加入2.0wt%浓度的血小板外泌体(plt-ev)水溶液(液固比40:1),于25℃搅拌吸附包裹12.0h,经离心分离,并配成2.0wt%浓度溶液,即得到靶向治疗心肌梗死的锂皂石复合递送材料[amo-1/s482-lp@plt-ev]-6(简称al@m-6)。
[0085]
应用流式细胞annexin v/pi双染色法评估al@m-6对氧化应激状态下心肌细胞凋亡的影响,结果示al@m-6对h2o2刺激后心肌细胞的抗凋亡能力表现出较好的特性;且在荧光显微镜及离体活力成像检测中表现出优良的细胞吞噬及组织靶向性。
[0086]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1