一种细菌响应性微针贴片及其制备方法和应用
1.本发明属于生物医药领域,具体涉及一种细菌响应性微针贴片及其制备方法和应用。
背景技术:
2.慢性伤口,如糖尿病足、压疮、肿瘤伤口和手术部位感染不愈合,严重危及人们的身心健康,并造成巨大的医疗负担。创伤发生后,机体会产生一系列的生理事件来修复损伤,包括止血、炎症、增殖和重塑,细菌感染后会干扰这四个伤口愈合级联的正常协调过程,且细菌诱导的严重伤口感染往往伴随着生物膜的存在。细菌生物膜已被确定为慢性伤口的主要原因。生物膜是附着在受伤组织表面的细菌集合,它很难被机体的免疫机制清除,且对抗生素治疗不敏感。
3.在“后抗生素时代”的阴影下,虽然许多抗菌策略对浮游细菌有效,但大多数抗菌药物不能处理生物膜。载有抗菌药物的微针贴片(mn)可以实现抗菌治疗和组织再生,被公认为对抗皮肤慢性伤口的最有效方法之一。具有适当长度的mn可以穿透表皮在皮肤中形成通道,同时避免与毛细血管和神经接触,具有微创和无痛的递送策略,可到达皮肤下形成的生物膜。研究人员开发了多种mn,这些mn由抗菌材料组成,例如壳聚糖、抗菌银纳米颗粒、抗菌肽(amp)、和生物活性提取物等。例如,已开发出含有抗菌剂氯霉素的mn,并用于处理细菌生物膜。mn可以穿透生物膜并促进氯霉素响应细菌群落的释放,从而显着降低药物的脱靶毒性。因此,装有活性再生剂和抗菌药物的mn有望对抗感染引起的慢性伤口。
技术实现要素:
4.本发明的目的是提供一种能有效抗菌且促进伤口愈合的细菌响应性微针贴片及其制备方法和应用,将功能性纳米材料与mn结合开发一种由物理惰性聚合物pvp k-30和重组iii型胶原蛋白制成的可降解微针贴片,可将抗菌药物递送至感染慢性伤口的病灶部位。本发明制备的微针贴片具有较好的促伤口愈合效果,在抑菌、细菌感染伤口的光热治疗方面均有广泛的应用前景。
5.为了实现上述目的,本发明采用如下技术方案:
6.本发明提供的细菌响应性微针贴片由微针贴片、细菌响应性载药纳米颗粒amp-cypate@gnp和聚合物基质组成;
7.聚合物基质由生物相容性良好的物理惰性聚合物pvp k-30和重组人iii型胶原蛋白(col iii)组成,其制备方法为:将pvp溶于超纯水中(1g pvp加1ml超纯水),加入col iii 0.20g混合,配置成混合溶液,4℃保存备用。
8.细菌响应性载药纳米颗粒amp-cypate@gnp是由明胶纳米颗粒(gnp)自组装并通过脱水缩合反应与抗菌肽(amp-cypate)耦合形成。明胶纳米颗粒表面含有氨基,抗菌肽序列n端有羧基,通过氨基与羧基脱水缩合反应偶联制得细菌响应性载药纳米颗粒amp-cypate@gnp,具体步骤如下:
9.首先,使用mbha树脂5倍当量的氨基酸,加入hbtu和hobt并在dmf中激活偶联,每次持续45分钟。
10.其次,使用哌啶/dmf(20%,v/v)脱去氨基酸上的fmoc保护基团,每次持续30分钟。重复上述步骤直至序列合成,再使用tfa/tis/dcm(1:5:94)将序列n端的fmoc基团切割掉,n端暴露的氨基与5倍过量的游离cypate在dipea存在的情况下偶联12小时,形成序列amp-cypate。通过tfa、edt、去离子水和tis(94:2.5:2.5:1,v/v/v/v)的裂解混合物将肽链amp-cypate从树脂上切割下来,并通过高效液相进行制备纯化。amp-cypate的分子量通过lc-ms确认:m/z计算为[m+2h]
2+
1076.9,实测值1076.3。
[0011]
最后,将5ml gnp(4mg/ml)、2mg edc和2mg nhs在ph≈7下连续搅拌30分钟,以激活明胶纳米颗粒的羧基。将amp-cypate滴加到gnp溶液中。将ph值调至7后,将混合物超声处理30分钟。最后,将溶液离心除去未反应的amp-cypate,用pbs洗涤3次,冻干得到amp-cypate@gnp。
[0012]
本发明还提供了上述微针贴片的制备方法,具体为:
[0013]
(1)将约0.2ml浓度为10μg/ml载药纳米颗粒(amp-cypate@gnp)的乙醇悬浮液浇注到装载有微针贴片的模具上,将覆盖的模具以2000g离心并在空气流下干燥,该过程重复三遍;
[0014]
(2)将约1ml聚合物基质溶液浇注到微针模具上,将模具以2200g离心15分钟;在37℃的烘箱中干燥48小时后,小心地剥离微针贴片,将所得微针贴片储存在密封的孔板中以供进一步研究。
[0015]
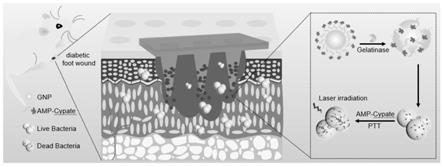
本发明细菌响应性微针贴片由载药纳米颗粒和聚合物基质组成。明胶分子可以自组装并通过脱水缩合反应与抗菌肽耦合,形成amp-cypate@gnp,并与微针贴剂进一步整合。当应用到感染部位时,微针就会穿透eps并物理破坏细菌生物膜的结构。在聚合物微针快速溶解后,gnp暴露于由常驻微生物产生的明胶酶而解离,从而导致接枝的amp-cypate触发释放到细菌生物膜基质中。与传统的amp-cypate局部使用相比,具有新型酶感应基质的智能贴片为慢性伤口感染提供了一种有效的潜在治疗方法。
[0016]
相比现有技术,本发明具有如下有益效果:
[0017]
(1)本发明包含的细菌响应性载药纳米颗粒amp-cypate@gnp是通过fmoc固相合成法制备抗菌肽,并将荧光染料cypate复合偶联在抗菌肽上。抗菌肽amp-cypate合成后,再采用去溶剂法合成gnp,并通过脱水缩合将明胶纳米粒与cypate偶联的肽链结合。载药纳米粒中引入荧光染料cypate进行光热(ptt)抗菌,与抗菌肽(amp)产生协同抗菌作用。
[0018]
(2)本发明微针贴片制备简单,成本低廉,为大规模制备奠定了基础。
[0019]
(3)微针材料包含抗菌颗粒和胶原蛋白,可以穿透细菌生物膜,而负载的抗菌颗粒仅响应细菌群落的活性而释放,非常适用于治疗伤口和其他容易感染的部位。
附图说明:
[0020]
图1为载药纳米颗粒amp-cypate@gnp的透射电子显微镜(tem)照片;
[0021]
图2为微针贴片的数码照片;
[0022]
图3为微针贴片的扫描电子显微镜(sem)图片;
[0023]
图4为罗丹明b(rho)标记的微针贴片装载fitc标记的gnp的荧光倒置显微镜图像。
(明胶纳米粒沉积在微针针尖,显示绿色,微针基质显示红色);
[0024]
图5为载药纳米颗粒amp-cypate@gnp在有或没有激光照射的情况下的杀菌活性测定;
[0025]
图6为近红外激光照射前后与amp-cypate@gnp孵育的金黄色葡萄球菌的活/死染色测定;
[0026]
图7为载药纳米粒的生物相容性测定结果;
[0027]
图8为微针穿刺大鼠足部皮肤的数码图片;
[0028]
图9为微针贴片在体内治疗大鼠足部葡萄球菌感染伤口20天内的伤口愈合照片及感染伤口区域愈合面积的量化图。伤口愈合率的值(原始伤口的百分比)代表来自三个独立实验的平均值;
[0029]
图10为细菌响应性微针贴片应用在金黄色葡萄球菌感染的糖尿病大鼠足部伤口的示意图。
具体实施方式
[0030]
以下结合实施例对本发明进行详细阐述,但这些实施例仅为例示说明之用,而不应被解释为对本发明实施的限制。
[0031]
实施例1载药纳米颗粒amp-cypate@gnp的制备
[0032]
首先,使用mbha树脂5倍当量的氨基酸,加入hbtu和hobt并在dmf中激活偶联,每次持续45分钟。
[0033]
其次,使用哌啶/dmf(20%,v/v)脱去氨基酸上的fmoc保护基团,每次持续30分钟。重复上述步骤直至序列合成,再使用tfa/tis/dcm(1:5:94)将序列n端的fmoc基团切割掉,n端暴露的氨基与5倍过量的游离cypate在dipea存在的情况下偶联12小时,形成序列amp-cypate。通过tfa、edt、去离子水和tis(94:2.5:2.5:1,v/v/v/v)的裂解混合物将肽链amp-cypate从树脂上切割下来,并通过高效液相进行制备纯化。amp-cypate的分子量通过lc-ms确认:m/z计算为[m+2h]
2+
1076.9,实测值1076.3。
[0034]
最后,将5ml gnp(4mg/ml)、2mg edc和2mg nhs在ph≈7下连续搅拌30分钟,以激活明胶纳米颗粒的羧基。将amp-cypate滴加到gnp溶液中。将ph值调至7后,将混合物超声处理30分钟。最后,将溶液离心除去未反应的amp-cypate,用pbs洗涤3次,冻干得到amp-cypate@gnp。
[0035]
实施例2未载药的空白微针贴片制备
[0036]
空白微针主要由物理惰性聚合物pvp k-30和重组人iii型胶原蛋白(col iii)组成的聚合物基质组成,制备方法为:
[0037]
首先,将pvp溶于超纯水中(1g pvp加1ml超纯水),加入col iii 0.20g混合,配置成混合溶液,即聚合物基质溶液;
[0038]
其次,将1ml的聚合物基质溶液浇注到微针模具上,将模具以2200g离心15分钟;最后,在37℃的烘箱中干燥48小时后,小心地剥离微针贴片,将所得微针贴片储存在密封的孔板中以供进一步研究。
[0039]
实施例3细菌响应性微针贴片制备
[0040]
细菌响应性微针贴片由细菌响应型载药纳米颗粒和聚合物基质组成,可将载药纳
米颗粒递送至慢性伤口感染的病灶部位,对糖尿病大鼠足部的慢性伤口愈合显示出出色的治疗效果。该微针贴片的制备方法具体为:
[0041]
首先,将浓度为10μg/ml载药纳米颗粒(amp-cypate@gnp)的乙醇悬浮液(0.2ml)浇注到装载有微针贴片的模具上,将覆盖的模具以2000g离心并在空气流下干燥,该过程重复三遍;
[0042]
其次,将1ml聚合物基质溶液浇注到微针模具上,将模具以2200g离心15分钟;最后,在37℃的烘箱中干燥48小时后,小心地剥离微针贴片,将所得微针贴片储存在密封的孔板中以供进一步研究。
[0043]
实施例4载药纳米颗粒体外抗菌活性测定
[0044]
将250μl amp-cypate@gnp与1ml金黄色葡萄球菌培养物(107cfu/ml)混合并孵育1小时。然后,将金黄色葡萄球菌和amp-cypate@gnp的混合物用nir激光(808nm,1.5w/cm2)照射6分钟,完成后稀释涂板并放入生化培养箱培养后,对琼脂板上的菌落进行计数(n≥3)以评估amp-cypate@gnp的抗菌性能。
[0045]
实施例5细菌live/dead测定
[0046]
通过活/死细菌染色试验验证使用amp-cypate@gnp样品处理并照射前后细菌的活力。首先加入2ml lb液体培养基和50μl样品至nest玻璃底培养皿中,然后加入100μl菌悬液培养24小时。pbs冲洗后用2.5%戊二醛固定1.5小时。所有实验组处理均在室温下与含有3μm syto 9和3μm碘化丙啶(pi)的染料溶液混合30分钟,最后通过共聚焦显微镜(lsm710,carl zeiss)成像。根据制造商的说明,活细菌细胞用syto 9染料(绿色)染色,而死细菌细胞因细胞壁和细胞膜受损而用碘化丙啶染料(红色)标记。
[0047]
实施例6生物相容性测定
[0048]
基于mtt法测定材料的生物相容性,用小鼠成纤维细胞(l929)和人脐静脉内皮细胞(huvec)评估了载药纳米颗粒的细胞毒性。首先,将l929细胞和huvec细胞接种在96孔微孔板(每孔104个细胞)上过夜,并用不同浓度(0、2、4、6、8和10μg/ml)的载药纳米颗粒处理,孵育24小时后,通过用酶标仪测量490nm处的吸光度来评估l929细胞和huvec细胞的活力,以评估载药纳米颗粒的细胞毒性。
[0049]
实施例7创面修复实验
[0050]
具体实验步骤为:
[0051]
(1)糖尿病大鼠足部细菌感染创伤模型
[0052]
糖尿病大鼠(gk,12周,~300g)购自常州凯文斯生物科技有限公司,并在实验室适应2周。动物保持禁食状态,并在accu-chek active血糖仪的帮助下测量血糖水平。选择空腹血糖水平处于15-17mmol/l的那些动物进行研究。
[0053]
为了构建感染的糖尿病大鼠伤口模型,首先使用一次性活检穿孔器在糖尿病大鼠的上背部创建一个贯穿肉膜的椭圆形全层伤口(8mm
×
6mm),然后接种。在伤口处接种细菌(107cfu/ml的s.aureus)并原位培养48小时形成生物膜。造模期间大鼠单笼饲养,放置玩具陪伴,自由饮水、进食。造模结束后,每个大鼠创口无明显区别,细菌感染部位发黄,外周发红,周围组织水肿明显。
[0054]
(2)动物分组
[0055]
将35个大鼠随机分为7组:
[0056]
a组为对照组,给药剂量为200μl pbs/伤口,外敷;
[0057]
b组为gnp,给药剂量为200μl gnp/伤口,外敷;
[0058]
c组为amp-cypate@gnp,给药剂量为200μl/伤口,外敷;
[0059]
d组为amp-cypate@gnp,给药剂量为200μl/伤口,外敷加光照;
[0060]
e组为空白微针贴剂(mn),外敷;
[0061]
f组为载药微针贴剂(mn/amp-cypate@gnp),外敷;
[0062]
g组为载药微针贴剂(mn/amp-cypate@gnp),外敷加光照。
[0063]
(3)在伤口造模后,分别将a组、b组、c组、d组、e组、f组、g组所用的敷料应用到大鼠足部的创口上,并于造模后第1、5、10、15、20日观察每组创面情况(见图9)。
[0064]
经观察,给药治疗后随着修复时间的延长,各组均逐渐呈现伤口缩小的趋势。结果如附图所示,可以看出使用本发明载药微针贴剂糖尿病大鼠足感染伤口部位愈合速度明显大于其他对照组,光照处理后伤口愈合更加明显且瘢痕增生减少。
[0065]
以上述依据本发明的理想实施例为启示,通过上述的说明内容,相关工作人员完全可以在不偏离本项发明技术思想的范围内,进行多样的变更及修改。本项发明的技术性范围并不局限于说明书上的内容,必须要根据权利要求范围来确定其技术范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1