一种改性水性材料及其制备方法和应用
1.本发明涉及材料领域,具体涉及一种蛋白质纳米薄膜在水性材料表面改性的应用、改性水性材料、改性水性材料的制备方法、改性水性材料的组合物及改性接触镜。
背景技术:
2.通过氢键、静电相互作用和范德华相互作用等分子间作用力,涂层与干燥材料表面接触后可以实现立即粘附。然而,这种即时改性对水凝胶等湿表面却很难实现,因为水将涂层和水凝胶表面的分子分开,使涂层与水凝胶之间无法形成持久粘附所必需的相互作用。虽然目前可以通过限制接枝聚合反应仅发生在水凝胶的表面来对水凝胶表面进行改性,但这种方法反应复杂,难以控制涂层厚度、生物相容性差且要求水凝胶表面具有活性位点(例如,被胺基覆盖的表面)。因此,发展一种具有快速反应、生物相容性好、程序简单、通用且温和的改性水凝胶表面同时又保持水凝胶的整体特性的方法仍然是该领域的关键需求和中心挑战。
3.水凝胶的表面改性可以拓宽水凝胶的适用性并丰富水凝胶的性能,使其在接触镜、软电子、药物输送等方面具有广泛的应用。目前主要用于视力矫正和美容目的的接触镜可能是我们社会中水凝胶最普遍的应用。越来越多的研究表明,接触镜是可穿戴电子设备或眼科药物输送系统的独特平台,因为它会持续与我们的泪液接触。接触镜作为眼科药物输送系统(治疗性接触镜)与滴眼液相比,药物在角膜前的残留时间更长、释放更为可控,从而提高了药物的生物利用度,减小了眼表刺激和全身副作用的可能性,治疗更方便有效。虽然有一些制备治疗性接触镜的方法,例如将接触镜简单地浸泡在药物溶液中、在接触镜中包埋载药胶体纳米粒子或分子印迹,但这些方法存在载药时间长、载药量低、药物释放快等限制,最重要的是可能会改变接触镜的力学性能,而力学性能是接触镜实际使用中的重要参数。因此亟待开发一种操作简单、满足治疗需求且不影响实际使用的治疗性接触镜。
技术实现要素:
4.发明目的
5.本发明的目的在于提供一种改性水凝胶/生物组织、蛋白质纳米薄膜、蛋白质纳米薄膜的制备方法、改性水凝胶/生物组织的方法、及它们在接触镜中的应用。
6.本发明采用改性剂诱导蛋白质在气液界面上自组装形成蛋白质薄膜,该蛋白质纳米薄膜暴露在空气的表面可在接触水凝胶/生物组织的瞬间实现对其表面的稳定粘附及改性。
7.解决方案
8.为实现上述目的,本发明提供了如下技术方案:
9.第一方面,本发明提供了一种蛋白质纳米薄膜在水性材料表面改性的应用,所述水性材料的表面粘附有所述蛋白质薄膜,所述蛋白质薄膜为改性剂诱导蛋白质形成的薄膜。
10.进一步地,所述水性材料与气液界面上形成的蛋白质薄膜接触粘附。
11.进一步地,所述蛋白质薄膜的原料包括:2~20mg/ml蛋白质水溶液与15~100mmol/l改性剂的水溶液;可选地,所述蛋白质薄膜的原料包括:5~15mg/ml蛋白质水溶液与40~100mmol/l改性剂的水溶液;可选地,所述蛋白质薄膜的原料包括:7~15mg/ml蛋白质水溶液与40~60mmol/l改性剂的水溶液;可选地,所述改性剂的ph值为5~12。
12.进一步地,所述蛋白质薄膜为蛋白质水溶液和改性剂水溶液在气液界面上自组装形成的蛋白质纳米薄膜;可选地,蛋白质水溶液与改性剂的水溶液的体积比为1:1。
13.第二方面,本发明提供一种改性水性材料的方法,包括:蛋白质水溶液与改性剂的水溶液混合培育后,在气液界面组装形成蛋白质薄膜;将水性材料接触所述蛋白质薄膜表面并粘附,得到粘有所述蛋白质薄膜的改性水性材料;可选地,所述改性水性材料为水凝胶或生物组织。
14.进一步地,所述蛋白质纳米薄膜为2~20mg/ml蛋白质水溶液与15~100mmol/l改性剂的水溶液混合培育后在气液界面组装形成;可选地,蛋白质水溶液浓度为2~15mg/ml,可选地为5~15mg/ml,可选地为7~15mg/ml,可选地为7~10mg/ml,可选地为7mg/ml;可选地,改性剂的浓度为40~100mmol/l,可选地为40~60mmol/l,可选地为50mmol/l。
15.进一步地可选地,所述改性剂的ph值为5~12。
16.进一步可选地,所述蛋白质水溶液与改性剂的水溶液的体积比为1:1。
17.进一步可选地,培育时间为1~12h,可选地为1~3h,可选地为2h。
18.第三方面,提供一种改性水性材料,在水性材料的表面粘附有蛋白质薄膜。
19.进一步地,所述蛋白质薄膜为蛋白质水溶液与改性剂的水溶液混合培育后在气液界面组装形成的纳米薄膜。
20.可选地,所述改性水凝胶/生物组织采用第二方面的方法制得。
21.第四方面,提供一种接触镜,包括接触镜本体和粘附在接触镜本体上的蛋白质薄膜,所述蛋白质薄膜为采用蛋白质水溶液与改性剂的水溶液混合培育后在气液界面组装形成的纳米薄膜;可选地,所述蛋白质纳米薄膜中包载有缓释功能分子。
22.进一步地,所述蛋白质纳米薄膜为2~20mg/ml蛋白质水溶液与15~100mmol/l改性剂的水溶液混合培育后在气液界面组装形成;可选地,蛋白质水溶液浓度为2~15mg/ml,可选地为5~15mg/ml,可选地为7~15mg/ml,可选地为7~10mg/ml,可选地为7mg/ml;可选地,改性剂的浓度为40~100mmol/l,可选地为40~60mmol/l,可选地为50mmol/l。
23.进一步可选地,所述改性剂的ph值为5~12。
24.进一步可选地,所述蛋白质水溶液与改性剂的水溶液的体积比为1:1。
25.进一步可选地,培育时间为1~12h,可选地为1~3h,可选地为2h。
26.第五方面,提供一种改性水性材料的组合物,包括2~20mg/ml蛋白质水溶液和15~100mmol/l改性剂的水溶液;可选地,所述改性水性材料为水凝胶或生物组织。
27.进一步地,包括2~15mg/ml蛋白质水溶液和40~100mmol/l改性剂的水溶液;可选地包括5~15mg/ml蛋白质水溶液和40~100mmol/l改性剂的水溶液;可选地包括7~15mg/ml蛋白质水溶液和40~60mmol/l改性剂的水溶液;可选地包括7~10mg/ml蛋白质水溶液和40~60mmol/l改性剂的水溶液;可选地包括7mg/ml蛋白质水溶液和50mmol/l改性剂的水溶液。
28.进一步地,所述水凝胶的平衡态为吸水饱和状态,以使蛋白质薄膜有效粘附。
29.上述实施例中的原料可以如下:
30.进一步地,蛋白质纳米薄膜中包载有功能分子,可选地,功能分子包括药物、染料分子、荧光分子和纳米颗粒,可选地,药物包括抗生素和/或透明质酸。
31.进一步地,所述的改性剂为强氧化剂或强还原剂;所述的强还原剂为二硫苏糖醇、β-巯基乙醇、三(2-羧乙基)膦盐酸盐、半胱氨酸、还原性谷胱甘肽、二巯基丁二酸、亚硫酸钠中任意一种或多种,所述的强氧化剂为三价钴盐、氯酸盐、高锰酸钾、过硫酸盐、重铬酸钾、浓硫酸、盐酸、硝酸、氢溴酸、氢碘酸、高氯酸、臭氧、双氧水、氟气、氯气、铋酸钠、高碘酸、高铁酸钠、二氧化铅、盐酸胍、尿素、三氟乙醇、六氟异丙醇、三氟乙酸中任意一种或几种;可选地为三(2-羧乙基)膦盐酸盐、半胱氨酸、谷胱甘肽中任意一种或几种;
32.进一步地,所述的蛋白质为人乳铁蛋白、溶菌酶、牛血清白蛋白、胰岛素、α-乳白蛋白、人血清白蛋白、纤维蛋白原、β-淀粉样蛋白、aβ肽、朊蛋白、α-突触核蛋白、胱抑素c、亨廷顿蛋白、免疫球蛋白轻链、乳清白蛋白、β-乳球蛋白、核糖核酸酶a、细胞色素c、α-淀粉酶、辣根过氧化物酶、胃蛋白酶、肌红蛋白、胶原蛋白、角蛋白、大豆蛋白、乳铁蛋白、血红蛋白、dna聚合酶、干酪素、胰蛋白酶、糜蛋白酶、甲状腺球蛋白、转铁蛋白、纤维蛋白原、山羊血清、胎儿小牛血清、小鼠血清、免疫球蛋白、乳蛋白、卵白蛋白、刀豆蛋白、鱼皮胶原蛋白、超氧化物歧化酶、胰脂肪酶、漆酶、组蛋白、胶原酶、纤维素酶、谷蛋白、粘蛋白、转谷氨酰胺酶、β-半乳糖苷酶中任意一种或几种或聚乙二醇化成膜蛋白质包括聚乙二醇化人乳铁蛋白、聚乙二醇化溶菌酶、聚乙二醇化牛血清白蛋白、聚乙二醇化胰岛素、聚乙二醇化α-乳白蛋白、聚乙二醇化人血清白蛋白、聚乙二醇化纤维蛋白原、聚乙二醇化β-淀粉样蛋白、聚乙二醇化aβ肽、聚乙二醇化朊蛋白、聚乙二醇化α-突触核蛋白、聚乙二醇化胱抑素c、聚乙二醇化亨廷顿蛋白、聚乙二醇化免疫球蛋白轻链、聚乙二醇化乳清白蛋白、聚乙二醇化β-乳球蛋白、聚乙二醇化核糖核酸酶a、聚乙二醇化细胞色素c、聚乙二醇化α-淀粉酶、聚乙二醇化辣根过氧化物酶、聚乙二醇化胃蛋白酶、聚乙二醇化肌红蛋白、聚乙二醇化胶原蛋白、聚乙二醇化角蛋白、聚乙二醇化大豆蛋白、聚乙二醇化乳铁蛋白、聚乙二醇化血红蛋白、聚乙二醇化dna聚合酶、聚乙二醇化干酪素、聚乙二醇化胰蛋白酶、聚乙二醇化糜蛋白酶、聚乙二醇化甲状腺球蛋白、聚乙二醇化转铁蛋白、聚乙二醇化纤维蛋白原、聚乙二醇化山羊血清、聚乙二醇化胎儿小牛血清、聚乙二醇化小鼠血清、聚乙二醇化免疫球蛋白、聚乙二醇化乳蛋白、聚乙二醇化卵白蛋白、聚乙二醇化刀豆蛋白、聚乙二醇化鱼皮胶原蛋白、聚乙二醇化超氧化物歧化酶、聚乙二醇化胰脂肪酶、聚乙二醇化漆酶、聚乙二醇化组蛋白、聚乙二醇化胶原酶、聚乙二醇化纤维素酶、聚乙二醇化谷蛋白、聚乙二醇化粘蛋白、聚乙二醇化转谷氨酰胺酶、聚乙二醇化β-半乳糖苷酶;可选地为人乳铁蛋白、牛血清白蛋白、溶菌酶中的任意一种或几种。
33.进一步地,所述蛋白质纳米薄膜形成中还加入交联剂(在需要时加入即可),可选地,交联剂的浓度为0.01-0.5wt%;可选地,交联剂为戊二醛、京尼平、谷氨酰胺转氨酶、碳二亚胺中任意一种或几种。
34.进一步地,所述水性材料为水凝胶或生物组织。
35.进一步地,所述的生物组织为皮肤、肝脏、肌肉、胃、肠中的任意一种;可选地,所述的生物组织为平衡态的生物组织。
36.进一步地,所述的水凝胶为小分子、天然高分子(包括多糖类、多肽类、核酸)和合
成的高分子(包括聚醚类、聚丙烯酸及其衍生物类和聚酯类)中的任意一种或几种形成的水凝胶;可选的,所述小分子包括芴基二肽、八肽、寡肽衍生物中的一种或任意几种;可选地,所述多糖类包括淀粉、纤维素、海藻酸、透明质酸、壳聚糖、k2型角叉菜胶、刺槐豆胶、明胶和琼脂糖中的一种或任意几种,所述多肽类为胶原、血纤蛋白、聚l-赖氨酸和聚l-谷胺酸中的一种或几种,所述聚醚类包括聚氧化丙烯、聚乙二醇、聚氧化乙烯中的一种或任意几种;所述聚丙烯酸及其衍生物类包括聚丙烯酰胺、聚异丙基丙烯酰胺、聚丙烯酸、聚甲基丙烯酸、聚乙烯吡咯烷酮和聚乙烯醇中的一种或几种;所述聚酯类包括聚甲基丙烯酸羟乙酯、聚富马酸丙二醇酯、聚己内酯和聚甲基丙烯酸二甲胺基乙酯中的一种或几种;可选地,所述的水凝胶为平衡态(即水含量饱和状态)的水凝胶;可选地,所述水凝胶为接触镜。
37.进一步地,所述的水凝胶中水可置换为有机溶剂,可选的,有机溶剂包括苯、四氯化碳、1,1-二氯甲烷、1,2-二氯甲烷、三氯甲烷、2-甲氧基乙醇、1,1,2-三氯乙烯、1,2-二甲氧基乙烷、四氢化萘、2-乙氧基乙醇、环丁砜、嘧啶、甲酰胺、正己烷、氯苯、二氧杂环己烷、乙腈、乙烯基乙二醇、n,n-二甲基酰胺、甲苯、甲醇、环己烷、n-甲基吡咯烷酮、戊烷、甲酸、乙酸、乙醚、丙酮、苯甲醚、1-丙醇、2-丙醇、1-丁醇、2-丁醇、戊醇、乙酸丁酯、三丁甲基乙醚、乙酸异丙酯、甲乙酮、二甲亚砜、异丙基苯、乙酸乙酯、甲酸乙酯、乙酸异丁酯、乙酸甲酯、3-甲基-1-丁醇、甲基异丁酮、2-甲基-1-丙醇、乙酸丙酯、1,1-二乙氧基丙烷、1,1-二甲氧基甲烷、2,2-二甲氧基丙烷、异辛烷、异丙醚、甲基异丙酮、甲基四氢呋喃、石油醚、三氯乙酸、三氟乙酸中任意一种或多种。
38.有益效果
39.本发明通过制备蛋白质纳米薄膜蛋白质经改性剂相转变后得到的蛋白质薄膜可在2秒内实现对水凝胶/生物组织表面的稳定粘附及改性。用于改性水凝胶/生物组织的蛋白质纳米薄膜不仅具有良好的稳定性、生物相容性及优异的光学透明度,同时还可以包载功能分子并保持其活性及实现可控释放,用包载功能分子的蛋白质薄膜可改性普通商用接触镜,制备的治疗性接触镜可应用于眼科领域,且其制备过程简单高效、成本低廉、具有良好的应用前景。
附图说明
40.一个或多个实施例通过与之对应的附图中的图片进行示例性说明,这些示例性说明并不构成对实施例的限定。在这里专用的词“示例性”意为“用作例子、实施例或说明性”。这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。
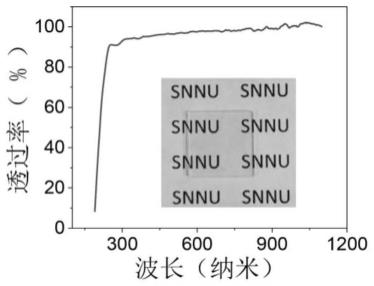
41.图1是本发明实施例1的蛋白质纳米薄膜的可见光透过曲线;
42.图2是本发明的蛋白质纳米薄膜改性水凝胶过程示意图;
43.图3是本发明实施例2的刚果红染色后蛋白质纳米薄膜改性琼脂糖水凝胶后的图片;
44.图4是本发明实施例3中蛋白质纳米膜改性的水凝胶遭受各种苛刻条件前后的图片;
45.图5是本发明实施例4的表面张力仪测试蛋白质薄膜与水凝胶间粘附强度示意图;
46.图6是本发明实施例4的表面张力仪测试的典型的剥离曲线;
47.图7是本发明实施例13的蛋白质薄膜改性接触镜后在接触镜护理液中稳定性粘附
的图片;
48.图8是本发明实施例14的蛋白质纳米薄膜可作为载药平台包载不同质量的药物环孢素a。
49.图9是本发明实施例15的蛋白质纳米薄膜作为载药平台包载药物环孢素a后改性接触镜后制备的治疗性接触镜的药物释放曲线;
50.图10是本发明实施例16的治疗性接触镜的细胞生物相容性表征;
51.图11是本发明实施例17的治疗性接触镜干预治疗干眼症小鼠后的角膜荧光素钠染色图。
具体实施方式
52.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。
53.另外,为了更好的说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在一些实施例中,对于本领域技术人员熟知的原料、元件、方法、手段等未作详细描述,以便于凸显本发明的主旨。
54.以下,对本发明进行详述。
55.本发明实施例中采用的试剂,例如人乳铁蛋白、三(2-羧乙基)膦等都是市售产品。
56.实施例1
57.将0.1433g三(2-羧乙基)膦加入10ml超纯水中,用naoh调节ph值至7.0;将70mg人乳铁蛋白加入10ml超纯水中,配制成7mg/ml的人乳铁蛋白的水溶液;
58.将200μl50mmol/l的三(2-羧乙基)膦的水溶液与200μl 7mg/ml的人乳铁蛋白的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置2h后,混合液表面形成的透明蛋白质薄膜自漂浮于水溶液上(如图1所示),之后用吸水饱和后的琼脂糖水凝胶靠近并接触蛋白质纳米薄膜表面完成粘附(如图2所示)。
59.实施例2
60.因为蛋白质纳米薄膜光学透明,为了使纳米薄膜改性水凝胶的过程更直观,将自漂浮蛋白质纳米薄膜转移到0.1wt%刚果红水溶液中,室温下染色3分钟,然后转移到超纯水中冲洗浮色。然后转移到超纯水上并改性琼脂糖水凝胶(如图3所示)。
61.实施例3
62.将纳米薄膜及纳米薄膜改性水凝胶置于各种极端条件下以测试其稳定性。如图4所示,实施例1中的纳米膜改性水凝胶(a)分别浸泡于有机溶剂乙醇、正己烷、乙醚、三氯甲烷和(b)极酸或极碱溶液(ph=1或ph=12)中12小时,(c)在超纯水中以40khz超声处理30分钟和(d)在0.5wt%聚氧乙烯醚水溶液中以40khz超声处理30分钟后,纳米膜仍稳定的粘附在水凝胶上。
63.实施例4
64.剥离强度测试使用dcat 21仪器进行表征,测试开始时,天平自动归零,平衡施加在涂有生物胶的铜板(面积为0.25cm2)上的力。然后,蛋白质纳米薄膜改性的水凝胶/组织被微型电机向上驱动以接触铜板。一旦铜板接触到纳米薄膜包被的水凝胶/组织,电机就会以0.2毫米/秒的速度再向上移动2毫米,以实现生物胶和纳米薄膜改性的水凝胶/组织之间的充分相互作用;然后,将电机设置为以相同的速度向下移动,从而使蛋白质纳米薄膜和水凝胶/组织分离(如图5所示)。在完全分离的临界点,峰值表明蛋白质纳米薄膜和水凝胶/组织之间的粘附力。在整个接近接触分离过程中记录了典型的剥离曲线,对实施例1的蛋白质纳米薄膜改性的琼脂糖凝胶进行测试,如图6所示,蛋白质纳米薄膜和琼脂糖水凝胶间的剥离力可达0.588n,说明蛋白质纳米薄膜和水凝胶/组织之间的粘附力良好。
65.实施例5
66.将200μl 50mmol/l的三(2-羧乙基)膦的水溶液与200μl 7mg/ml的人乳铁蛋白的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置2h后,混合液表面形成的透明蛋白质薄膜自漂浮于水溶液上,之后用聚丙烯酰胺水凝胶靠近并接触蛋白质纳米薄膜表面完成粘附。
67.实施例6
68.将200μl 50mmol/l的三(2-羧乙基)膦的水溶液与200μl 7mg/ml的人乳铁蛋白的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置2h后,混合液表面形成的透明蛋白质薄膜自漂浮于水溶液上,之后用聚丙烯酸水凝胶靠近并接触蛋白质纳米薄膜表面完成粘附。
69.实施例7
70.将200μl 50mmol/l的三(2-羧乙基)膦的水溶液与200μl 7mg/ml的人乳铁蛋白的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置2h后,混合液表面形成的透明蛋白质薄膜自漂浮于水溶液上,之后用聚乙烯醇水凝胶靠近并接触蛋白质纳米薄膜表面完成粘附。
71.实施例8
72.将200μl 50mmol/l的三(2-羧乙基)膦的水溶液与200μl 7mg/ml的人乳铁蛋白的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置2h后,混合液表面形成的透明蛋白质薄膜自漂浮于水溶液上,之后用聚乙二醇水凝胶靠近并接触蛋白质纳米薄膜表面完成粘附。
73.实施例9
74.将200μl 50mmol/l的三(2-羧乙基)膦的水溶液与200μl 7mg/ml的人乳铁蛋白的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置2h后,混合液表面形成的透明蛋白质薄膜自漂浮于水溶液上,之后用聚甲基丙烯酸羟乙酯水凝胶靠近并接触蛋白质纳米薄膜表面完成粘附。
75.实施例10
76.将200μl 50mmol/l的三(2-羧乙基)膦的水溶液与200μl 7mg/ml的人乳铁蛋白的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置2h后,混合液表面形成的透明蛋白质薄膜自漂浮于水溶液上,之后用dna水凝胶靠近并接触蛋白质纳米薄膜表面完成粘附。
77.实施例11
78.将200μl 50mmol/l的三(2-羧乙基)膦的水溶液与200μl 7mg/ml的bsa的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置2h后,混合液表面形成的透明蛋白质薄膜自漂浮于水溶液上,之后用琼脂糖水凝胶靠近并接触蛋白质纳米薄膜表面完成粘附。
79.实施例12
80.将200μl 50mmol/l的三(2-羧乙基)膦的水溶液与200μl 7mg/ml的bsa的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置2h后,混合液表面形成的透明蛋白质薄膜自漂浮于水溶液上,之后用琼脂糖丙三醇凝胶靠近并接触蛋白质纳米薄膜表面完成粘附。
81.实施例13
82.将200μl 50mmol/l的三(2-羧乙基)膦的水溶液与200μl 7mg/ml的人乳铁蛋白的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置2h后,混合液表面形成的透明蛋白质薄膜自漂浮于水溶液上,之后用商用接触镜(例如,海昌easy day日抛型接触镜)靠近并接触蛋白质纳米薄膜表面完成粘附。将人乳铁蛋白纳米薄膜改性的接触镜浸入10ml商用护理液中,每天更换一次护理液。一年(12个月)后,蛋白质纳米薄膜仍能稳定粘附在接触镜上(如图7所示)。
83.实施例14
84.将0.1433g三(2-羧乙基)膦加入10ml超纯水中,用naoh调节ph值至7.0;将70mg人乳铁蛋白加入10ml超纯水中,配制成7mg/ml的人乳铁蛋白的水溶液;将90mg透明质酸加入10ml超纯水中,配制成9mg/ml的透明质酸的水溶液;将30mg环孢素a加入4ml 50%乙醇水溶液中,配制成7.5mg/ml的环孢素a的溶液。其中透明质酸钠是天然的保湿剂同时可以抗细菌粘附,环孢素a是用于治疗干眼症的药物。
85.将150μl 7mg/ml的人乳铁蛋白的水溶液、150μl 9mg/ml的透明质酸的水溶液与150μl50mmol/l的三(2-羧乙基)膦的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置12小时后,混合液表面形成包载透明质酸的蛋白质薄膜。
86.将150μl 7mg/ml的人乳铁蛋白的水溶液、150μl 9mg/ml的透明质酸的水溶液、150μl50mmol/l的三(2-羧乙基)膦的水溶液与10/20/30/40/50/60μl 7.5mg/ml的环孢素a的溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置12小时后,混合液表面形成了包载透明质酸和不同质量环孢素a的蛋白质薄膜(如图8所示),结果表明,蛋白质薄膜可以良好的包载功能分子——环孢素a,可以克服游离药物稳定性差和利用率低的缺点,包载后的药物可以缓慢释放(如图9所示),减少药物流失,解决现有技术中需要多次大剂量滴加药物滴眼液的问题(因为滴眼液在眨眼、眼泪冲刷等会造成药物流失,需要多次大剂量给药,引起一定的副作用)。
87.实施例15
88.将用实施例14中的蛋白质纳米薄膜改性的接触镜浸入5ml新鲜制备的模拟泪液(stf,成分:nacl 0.67g、nahco
3 0.20g、cacl2·
2h2o 0.008g和100ml超纯水)中,并在37℃下以100rpm的速度摇动进行药物释放实验。stf含有0.5wt%的聚氧乙烯醚(poe),以达到药物漏槽条件。在释放实验过程中,在预定的时间间隔内不断吸取2ml释放的溶液,然后将2ml含有0.5wt%poe的新鲜stf加入释放样品中。环孢素a含量通过紫外方法测定(如图9所示)。
89.实施例16
90.用实施例1和实施例14的纳米薄膜分别以如图2方法改性细胞爬片的表面,并根据纳米薄膜的组成成分和载药量的不同分组为人乳铁蛋白膜、人乳铁蛋白膜包载透明质酸、人乳铁蛋白膜包载透明质酸和21μg环孢素a、人乳铁蛋白膜包载透明质酸和22μg环孢素a、人乳铁蛋白膜包载透明质酸和环孢素25μg a、人乳铁蛋白膜包载透明质酸和34μg环孢素a和人乳铁蛋白膜包载透明质酸和环孢素a49μg。在细胞毒性实验中,为了分别检测人乳铁蛋白蛋白膜本身、人乳铁蛋白膜包载透明质酸和人乳铁蛋白膜包载透明质酸及不同质量环孢素的细胞毒性,将人乳铁蛋白膜、人乳铁蛋白膜/透明质酸以及五种载药量不同的纳米薄膜改性的细胞爬片分别与人角膜上皮细胞共孵育2、4、7、10小时后,加入cck-8检测试剂继续共孵育2-4h。然后用酶标仪测定各组在450nm处的od值,最后经过计算后得出细胞活性,结果显示所有组的样品与人角膜上皮细胞共孵育后,人角膜细胞的活性都在90%(如图10所示)。因此,包载药物后的蛋白质纳米薄膜对哺乳动物细胞的毒性可以忽略,且在眼表应用中具有良好的安全性。
91.实施例17
92.使用改造后的泪液试纸条对干眼症sd大鼠干预治疗后的泪液量进行了测量。首先,泪液试纸条的改造:将荧光素钠眼科泪液试纸条(tianjin jingming new technological development co.,ltd)沿中线剪开,拆分为宽度为2-3mm的两根试纸条。然后,沿荧光素钠指示带将前段翻折,置于sd大鼠下眼睑外侧约1/3处,20s后取出,记录荧光素钠向前移动的距离(mm)。每只眼睛测量3次。干眼症模型大鼠眼表泪液含量极低,随着治疗的进行,包载透明质酸蛋白质薄膜改性的接触镜、包载透明质酸和环孢素a蛋白质薄膜改性的接触镜、市售滴眼液干预治疗组的泪液含量逐渐增加,与对照组差异有统计学意义。其中,包载透明质酸和环孢素a蛋白质薄膜改性的接触镜组大鼠在干预5天后泪液含量恢复最好,甚至高于市售滴眼液组干预7天后泪液含量。如图11所示。
93.本发明的发明人发现,蛋白质薄膜的形成和实现对水凝胶的粘附有一定的条件,例如以下对比例
94.对比例1
95.将200μl 0.5mmol/l的三(2-羧乙基)膦的水溶液与200μl 0.05mg/ml的人乳铁蛋白的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置12h后,混合液表面未形成透明蛋白质薄膜。
96.对比例2
97.将200μl 0.25mmol/l的三(2-羧乙基)膦的水溶液与200μl 0.1mg/ml的人乳铁蛋白的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置12h后,混合液表面未形成透明蛋白质薄膜。
98.对比例3
99.将200μl 50mmol/l的三(2-羧乙基)膦的水溶液与200μl 2mg/ml的溶菌酶的水溶液混合均匀后滴加在18mm*18mm的玻璃片上,室温静置2h后,混合液表面形成透明蛋白质薄膜,但蛋白质薄膜机械性能较差,易碎,无法以如图2所示方法改性水凝胶表面。说明蛋白质薄膜对水凝胶表面改性具有一定的条件和要求。发明人还发现将形成的溶菌酶薄膜转移至浓度为0.01wt%的戊二醛溶液中交联3分钟可提高蛋白质薄膜的机械性能,之后即可以如图2所示方法改性水凝胶表面。
100.最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1