异荭草素联合顺铂在制备逆转肺癌耐药的药物中的应用
1.本发明属于抗肿瘤药物技术领域,具体涉及异荭草素联合顺铂在制备逆转肺癌耐药的药物中的应用。
技术背景
2.肺癌是全球最常见的恶性肿瘤,预后差,这与肺癌患者就诊时多为晚期有关(r.nooreldeen,and h.bach,current and future development in lung cancer diagnosis.int j mol sci 22(2021).;t.sethi,lung cancer.introduction.thorax 57(2002)992-3.)。随着科学技术的快速发展,特别是对于肺癌的致病机制的不断深入了解,针对性的治疗模式不断出现,患者的生存期显著延长。未来几年,可手术肺癌患者的优化诊疗、肺癌患者新的靶向治疗及免疫治疗策略、克服肺癌耐药治疗模式及新的肺癌精准检测手段是未来几年的重要研究方向(h.brody,lung cancer.nature 513(2014)s1)。肺癌有三种主要的组织学亚型:腺癌、鳞状细胞癌和小细胞癌(sclc)。腺癌、鳞状细胞癌又称为非小细胞肺癌(nsclc)。肺癌的治疗包括手术、放化疗、免疫治疗和酪氨酸激酶抑制剂的靶向治疗(f.oberndorfer,and l.mullauer,molecular pathology of lung cancer:current status and perspectives.curr opin oncol 30(2018)69-76;a.roys,x.chang,y.liu,x.xu,y.wu,and d.zuo,resistance mechanisms and potent-targeted therapies of ros1-positive lung cancer.cancer chemother pharmacol 84(2019)679-688.)。其中,化疗已成为临床最常用的肺癌治疗方法,而顺铂(顺-二胺二氯铂,ddp)是肺癌化疗中应用最广泛的药物之一。其药理机制像许多dna烷基化剂一样,作为一种交联剂,抑制dna复制,抑制肿瘤的生长增殖。但是,以顺铂为基础的化疗手段似乎已经达到了一个平台期,因为化疗耐药是一个严重的临床问题,被认为是治疗肺癌的主要障碍。顺铂耐药的机制主要包括转运体的异常表达、药物解毒、dna修复增强和抗凋亡能力增强。然而,在20-30%的获得性耐药病例中,耐药发生的机制尚不清楚(r.rosell,r.v.n.lord,m.taron,and n.reguart,dna repair and cisplatin resistance in non-small-cell lung cancer.lung cancer 38(2002)217-227.;y.huang,l.lei,and y.liu,propofol improves sensitivity of lung cancer cells to cisplatin and its mechanism.med sci monit 26(2020)e919786.;k.ma,s.li,x.huo,m.guo,x.du,c.li,x.liu,j.lv,and z.chen,exploring the mechanism of cisplatin resistance by transcriptome sequencing and reversing the chemoresistance by autophagy inhibition in small cell lung cancer.biochem biophys res commun 533(2020)474-480.)。如何逆转肺癌耐药并阐明其耐药的相关机制是临床亟待解决的问题和现代肿瘤研究的前沿领域。以往的三代耐药逆转剂都没有最终应用于临床,相关的新药研发也无突破性进展。细胞死亡是细胞发育、衰老和组织稳态的基本生理过程,而铁死亡是一种新的由dr.brent r.stockwell 2012年发明的一个术语,用来描述一种依赖于细胞内铁的非凋亡的细胞死亡形式,它在形态学、生化上不同于其他形式的死亡,通过细胞内脂质活性氧(ros)的积累而发生,其标志是磷脂膜通过铁依赖机制进行氧
化修饰,是多种疾病中重要的细胞死亡途径。在某些情况下,肿瘤代谢重编程与铁死亡的敏感性有关,因此更好地了解铁死亡机制可为治疗肿瘤耐药提供了新的治疗策略(x.fang,h.wang,d.han,e.xie,x.yang,j.wei,s.gu,f.gao,n.zhu,x.yin,q.cheng,p.zhang,w.dai,j.chen,f.yang,h.t.yang,a.linkermann,w.gu,j.min,and f.wang,ferroptosis as a target for protection against cardiomyopathy.proc natl acad sci u s a 116(2019)2672-2680.;j.p.friedmann angeli,d.v.krysko,and m.conrad,ferroptosis at the crossroads of cancer-acquired drug resistance and immune evasion.nat rev cancer 19(2019)405-414.j.p.friedmann angeli,d.v.krysko,and m.conrad,ferroptosis at the crossroads of cancer-acquired drug resistance and immune evasion.nat rev cancer 19(2019)405-414.;s.m.elgendy,s.k.alyammahi,d.w.alhamad,s.m.abdin,and h.a.omar,ferroptosis:an emerging approach for targeting cancer stem cells and drug resistance.crit rev oncol hematol 155(2020)103095.)。
3.异荭草素,isoorientin(io)(pubchem cid:114776),也称为homoorientin,化学命名法为2-(3,4-dihydroxyphenyl)-5,7-dihydroxy-6-((2s,3r,4r,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)tetrahydro-2h-pyran-2-yl)-4h-chromen-4-one,分子式为c
21h20o11
,分子量为448.4克/摩尔。能溶于水和乙醇并产生黄色结晶(q.li,t.cheng,y.wang,and s.h.bryant,pubchem as a public resource for drug discovery.drug discov today 15(2010)1052-7.;k.ziqubu,p.v.dludla,e.joubert,c.j.f.muller,j.louw,l.tiano,b.b.nkambule,a.p.kappo,and s.e.mazibuko-mbeje,isoorientin:a dietary flavone with the potential to ameliorate diverse metabolic complications.pharmacol res 158(2020)104867.),已被发现具有多种药理活性而备受关注,据报道,io具有多种药理活性,例如抗癌(l.yuan,x.ren,y.wu,j.wang,h.xiao,and x.liu,isoorientin protects brl-3a rat liver cell against hydrogen peroxide-induced apoptosis by inhibiting mitochondrial dysfunction,inactivating mapks,activating akt and scavenging ros and no.biomedicine&aging pathology 3(2013)153-159.)、抗氧化、抗炎(x.fan,h.lv,l.wang,x.deng,and x.ci,isoorientin ameliorates apap induced hepatotoxicity via activation nrf2 antioxidative pathway:the involvement of ampk/akt/gsk3beta.front pharmacol 9(2018)1334.;y.li,y.zhao,x.tan,j.liu,y.zhi,l.yi,s.bai,q.du,q.x.li,and y.dong,isoorientin inhibits inflammation in macrophages and endotoxemia mice by regulating glycogen synthase kinase 3beta.mediators inflamm 2020(2020)8704146.);中国专利cn103585195b公开了一种网眼瓦韦提取物在制备抗癌药物中的应用,该专利采用网眼瓦韦作为原料,经30~90%乙醇提取、两次大孔树脂纯化得到的提取物中包含蜕皮甾酮、20-羟基蜕皮甾酮、荭草素、荭草苷、异荭草素、牡荆素、异牡荆素,可用于杀伤hepg2、glc、mfc癌细胞,可用于肝癌、肺癌、胃癌药物中,但是该专利并未公开任何关于该提取物对于顺铂耐药性,尤其是在肺癌顺铂耐药性药物中的应用;李原等人公开了凤眼果壳多酚的抗氧化和抗人肺癌细胞a549增殖活性,其通过有机溶剂萃取法得到的提取物中,乙酸乙酯萃取相中鉴定出11种多酚类化合物:分别是表儿茶素、香草酸、异荭草素、阿魏酸、(反)阿魏酸、芦丁、槲
皮苷、杨梅素、三叶苷、槲皮素和山奈酚。此外,该提取物混合物对人肺癌细胞a549的增殖具有剂量依赖性抑制作用,其抑制a549细胞增殖的ec50值为85.70μg/ml,但是该研究并未涉及乙酸乙酯萃取相中各组分分别对于a549细胞增殖活性的抑制效果,因而难以判定是否是所有成分均有该效果,同时,该研究也并未涉及该提取物与顺铂耐药性肿瘤的药效关系,更无法得知其与顺铂联合对于逆转顺铂耐药性肺癌细胞的作用(李原,赵振刚.凤眼果壳多酚的抗氧化和抗人肺癌细胞a549增殖活性[j].现代食品科技,2021,37(4):9.);另外,樊晓烨公开了关于异荭草素通过激活sirt1/sirt6/nrf2途径抑制氧化应激和细胞凋亡减轻顺铂诱导的肾毒性,该报道主要针对是顺铂引起了副作用,虽然其公开了异荭草素对于sirt1/sirt6/nrf2途径的激活减轻顺铂用药后的副作用,但其并未涉及与顺铂联用对于逆转肿瘤的顺铂耐药性,也并未涉及如何逆转该耐药性的机制是否是通过该sirt1/sirt6/nrf2途径(樊晓烨,邓旭明,慈鑫鑫.异荭草素通过激活sirt1/sirt6/nrf2途径抑制氧化应激和细胞凋亡减轻顺铂诱导的肾毒性[c]//中国畜牧兽医学会兽医药理毒理学分会第十五次学术讨论会.0.)。除此之外,还有报道对于代谢性疾病,如高血糖、高脂血症和胰岛素抵抗等并发症有明显的改善作用(k.ziqubu,c.j.f.muller,p.v.dludla,s.x.h.mthembu,n.obonye,j.louw,a.p.kappo,s.silvestri,p.orlando,l.tiano,and s.e.mazibuko-mbeje,impact of isoorientin on metabolic activity and lipid accumulation in differentiated adipocytes.molecules 25(2020).;a.j.alonso-castro,r.zapata-bustos,g.gomez-espinoza,and l.a.salazar,olivo,isoorientin reverts tnf-alpha-induced insulin resistance in adipocytes activating the insulin signaling pathway.endocrinology 153(2012)5222-30.),也有报道对于肠道菌群改善作用(s.he,x.li,c.li,h.deng,y.shao,and l.yuan,isoorientin attenuates benzo[a]pyrene-induced colonic injury and gut microbiota disorders in mice.food res int 126(2019)108599.)。
[0004]
基于上述对现有技术中肺癌及其治疗机制和药物的阐述,如何逆转肺癌治疗中的顺铂耐药已经成为了亟待解决的问题。
技术实现要素:
[0005]
针对上述现有技术中存在的问题,本发明提供了异荭草素联合顺铂在制备逆转肺癌耐药的药物中的应用,本发明的技术方案通过建立a549细胞株及其ddp耐药细胞模型,a549/ddp用于体外细胞药效学研究,同时建立a549/ddp小鼠模型用于体内研究。
[0006]
本发明提供了异荭草素在制备逆转肿瘤顺铂耐药的药物中的应用;
[0007]
本发明提供了异荭草素在制备诱导肿瘤细胞铁死亡的药物中的用途;
[0008]
进一步地,所述铁死亡是经sirt6/nrf2/gpx4途径诱导形成。
[0009]
本发明还提供了组合物在制备抗肿瘤药物中的应用;
[0010]
本发明还提供了组合物在制备肿瘤耐药逆转剂中应用;
[0011]
本发明还提供了组合物在制备逆转肿瘤耐药药物中的应用;
[0012]
进一步地,所述组合物包括异荭草素和顺铂;
[0013]
进一步地,所述肿瘤为肺癌;
[0014]
进一步地,本发明所述药物或逆转剂中异荭草素与顺铂含量比例为1.5~13.5μm:
1~3μm;
[0015]
本发明提供了所述逆转过程中的铁死亡是经gpx4诱导形成,其中可包括直接抑制gpx4或抑制slc7a11从而间接抑制gpx4途径诱导形成;
[0016]
进一步地,所述逆转是经sirt6/nrf2/gpx4途径增强诱导铁死亡。
[0017]
本发明还提供了所述的药物中还可包括异荭草素在药学上可接受的盐、立体异构体及其前药分子、异荭草素衍生物及其药学上可接受的盐、立体异构体及其前药分子中的一种或多种;
[0018]
本发明所述的药物中还可包括黄酮类物质,及其在药学上可接受的盐、立体异构体和前药分子、也可包含黄酮类物质的衍生物及其药学上可接受的盐、立体异构体和前药分子中的一种或多种;
[0019]
进一步地,所述药物还包含药学上可以接受的辅料;
[0020]
更进一步地,所述药物可制备成口服剂、注射剂,但不仅限于所述剂型。
[0021]
本发明所述的异荭草素、组合物不仅限于在制备逆转肺癌耐药性药物中的应用,还可包括乳腺癌、肝癌、胃癌、恶性淋巴癌、鼻咽癌、黑色素瘤、食管癌、肠癌耐药性的逆转。
[0022]
与现有技术相比,本发明的有益效果如下:
[0023]
io与顺铂联用后,a549/ddp耐药细胞活力明显下降,细胞内铁、mda和ros浓度明显上升,gsh浓度明显下降,细胞发生铁死亡;同时,发现nrf2、gpx4和sirt6蛋白的表达水平均下调,io可以增加肿瘤细胞内顺铂的浓度,与顺铂联用能抑制小鼠顺铂耐药性肿瘤的生长。因此,异荭草素可以逆转肿瘤的顺铂耐药,异荭草素联合顺铂作为抗肿瘤治疗药物,增强顺铂的抗肿瘤治疗效果,特别是在针对肺癌以及肺癌的顺铂耐药的治疗中。
附图说明
[0024]
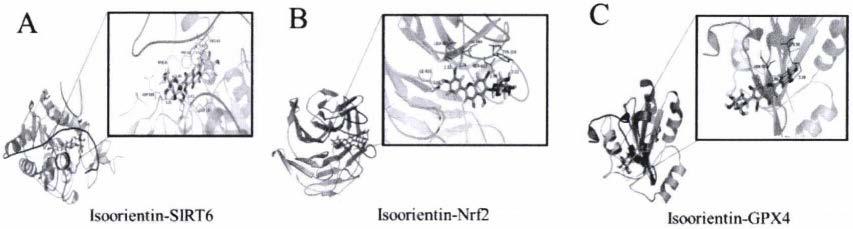
图1中a、b、c分别为io与sirt6、nrf2 and gpx4的分子对接图。
[0025]
图2中a为io的分子结构式、b为io剂量对a549和a549/ddp耐药细胞的细胞活力影响;c为ddp剂量对a549和a549/ddp耐药细胞的细胞活力影响;d为io、ddp以及io+ddp对a549/ddp耐药细胞的集落形成影响;e为细胞集落技术的定量统计;f为不同io剂量处理下的a549/ddp耐药细胞活力。
[0026]
图3中a为io、ddp以及铁死亡抑制剂(fer-1)联用对a549/ddp耐药细胞活力的影响;b为io和ddp对a549/ddp耐药细胞gpx4和slc7a11的mrna表达水平影响;c和d为io和ddp对a549/ddp耐药细胞gpx4和slc7a11的蛋白表达影响;e、f、g、h分别为io和ddp联用对a549/ddp耐药细胞中铁、mda以及gsh表达的影响。
[0027]
图4中a、b、c分别为io和ddp联用对sirt6、nrf2 and gpx4的mrna表达水平影响;d为io和ddp联用对sirt6、nrf2 and gpx4的蛋白表达水平影响;e和f为io和ddp联用处理细胞中的ros水平影响。
[0028]
图5中在a549/ddp耐药细胞构建sirt6低表达的稳转株,a为药物对sirt6表达下调细胞中sirt6、nrf2 and gpx4的mrna表达水平影响;b为药物对sirt6表达下调细胞中sirt6、nrf2 and gpx4的蛋白表达影响;c为药物对sirt6表达下调细胞活力的影响;d、e、f、g分别为药物对sirt6表达下调细胞中mda、铁、gsh以及gsh/gssg的影响。
[0029]
图6中在a549细胞构建sirt6高表达的稳转株,a为io对sirt6表达上调细胞中
sirt6,nrf2 and gpx4的mrna表达水平影响;b为io对sirt6过表达的细胞中sirt6、nrf2 and gpx4的蛋白表达水平影响;c为io对sirt6过表达的细胞活力影响;d、e、f、g为io处理sirt6过表达的细胞中mda、铁、gsh以及gsh/gssg的影响。
[0030]
图7中a为ddp、ddp和io联用分别处理后不同阶段的肿瘤实物图;b为ddp、ddp和io联用对小鼠体重的影响;c为ddp、ddp和io联用对肿瘤体积的影响;d为药物对肿瘤重量的影响;e为药物对肿瘤中ddp浓度的影响。
[0031]
图8中a、b为ddp和io联用对肿瘤组织中sirt6,nrf2 and gpx4的蛋白表达水平影响;c、d、e、f分别为ddp和io联用对肿瘤组织中mda、铁、gsh以及gsh/gssg的影响。
具体实施方式
[0032]
本发明下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。
[0033]
除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。
[0034]
为使本发明的目的、技术方案和优点更加清楚明了,下面结合具体实施方式,对本发明进一步详细说明。应该理解,这些描述只是示例性的,而并非要限制本发明的范围。此外,在以下说明中,省略了对公知结构和技术的描述,以避免不必要地混淆本发明的概念。
[0035]
实施例1本发明的药物在体内、体外药效实验
[0036]
第一部分、体外实验
[0037]
1.1细胞的培养与处理
[0038]
a549细胞维持在rpmi 1640细胞培养基中,a549/ddp细胞的培养液中添加1.5μg/ml的顺铂维持耐药性并作为肺癌细胞耐药实验组。同时补充添加10%热灭活乌拉圭南美胎牛血清fetal bovine serum(prime)(fsp500)、100单位/ml青霉素和100g/ml链霉素(hyclone公司,sv30010-1),细胞在5%co2、37℃培养箱中培养。
[0039]
1.2 cck-8细胞活力测定
[0040]
以5000个细胞/孔的浓度,将a549和a549/ddp细胞接种于96孔板中,不同浓度的ddp和io处理48小时后,加入10μl cck-8试剂(mce),然后加入dmso在37℃下孵育2h,采用分光光度法测定吸光度。
[0041]
1.3细胞克隆形成实验
[0042]
将800个细胞接种到6孔板中,24小时后加入不同浓度的ddp和io作用10天,移弃细胞上清,用pbs(procell,pb180327)洗2遍,除去pbs,用戊二醛(6.0%v/v)固定菌落,1%的结晶紫(0.5%w/v)染色30分钟,随后用无菌蒸馏水去除多余结晶紫溶液,在显微镜下观察拍照,并计数。
[0043]
1.4 western blot分析
[0044]
蛋白浓度采用bca试剂盒测定,等量的蛋白质经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)分离,然后转移到pvdf膜上,用5%脱脂牛奶封闭后,用特异性一抗在4℃条件下过夜,然后在室温下孵育与相应的二抗1小时,用pbst缓冲液冲洗3次,加入超信号化学发光底物显影。
[0045]
1.5 sisirt6瞬时转染
[0046]
将细胞接种在6孔板中培养24小时,当细胞融合度达到70%至80%时进行转染,将5μl 20mm的sirna加入200μl无血清opti-mem中制备溶液a,而将5μl lipofectamine 2000加入200μl无血清opti-mem中作为溶液b,弃去培养基,用pbs洗涤细胞两次后,将600μl无血清培养基和溶液a和溶液b的混合物加入孔中,在37℃和5%的co2下培养4~6小时。随后,在弃去培养基后的孔中加入3ml含10%fbs的培养基,培养细胞24小时,将裂解细胞进行western blot分析。
[0047]
1.6脂质过氧化分析
[0048]
脂质过氧化分析采用特异性比色试剂盒,mda活性检测试剂盒检测细胞mda含量;根据制造商试剂盒的说明书,将对照组的标准物质、空白组的无水乙醇和实验组的样品分别加入检测试剂中,95℃下孵育,离心,取上清液,用分光光度计在532nm处测定吸光度,根据标准曲线计算丙二醛浓度。
[0049]
1.7流式细胞仪ros检测
[0050]
使用荧光探针dcfh-da来测量ros水平,将细胞接种到6孔板中,给药处理8小时后,用pbs清洗细胞两次后,用2
′
,7
′‑
二氯荧光素二乙酸(dcfh-da)探针在37℃下孵育,用流式细胞仪检测其荧光强度。
[0051]
1.8谷胱甘肽检测
[0052]
使用总谷胱甘肽定量试剂盒检测gsh水平,将细胞接种到96孔板中,在37℃、pbs中与一氯联苯(32μm)孵化,酶标仪测量荧光,激发波长为390nm,发射波长为478nm米。
[0053]
1.9不稳定铁池(lip)的含量测定
[0054]
收集经药物处理和未经处理的细胞,用冷的pbs洗涤2次。收集0.5
×
106/ml细胞并加入0.25μm的ca-am,孵育15min后,pbs洗涤2次,取细胞与去铁螯合剂(100μm)孵育1小时。用荧光酶标仪(exc=488nm,em=525)测定各组的荧光值。不稳定铁池(lip)的含量通过荧光的差异来反映。肿瘤组织中不稳定铁池(lip)的含量测定与细胞中lip的测定方法一致。
[0055]
1.10定量实时聚合酶链式(qrt-pcr)反应
[0056]
采用qrt-pcr评估sirt6、gpx4、slc7a11和nrf2的mrna表达,引物序列如下:
[0057]
sirt6(nm_001321062.2):
[0058]
forward primer,sequence(5
′‑
>3
′
),attgttcccgtggggcagtc,
[0059]
reverse primer,sequence(5
′‑
>3
′
),ctctgccagtttgtccctcc;
[0060]
gpx4(nm_001039847.3):
[0061]
forward primer,sequence(5
′‑
>3
′
),ttcccgtgtaaccagttcgg,
[0062]
reverse primer,sequence(5
′‑
>3
′
),gtggagagacggtgtccaaa;
[0063]
slc7a11(nm_014331.4):
[0064]
forward primer,sequence(5
′‑
>3
′
),gcccagatatgcatcgtcct,
[0065]
reverse primer,sequence(5
′‑
>3
′
),ggcagattgccaagatctcaa;
[0066]
nrf2(nm_010902.4):
[0067]
forward primer,sequence(5
′‑
>3
′
),cctctgctgcaagtagcctc,
[0068]
reverse primer,sequence(5
′‑
>3
′
),gctcatagtccttctgtcgct。
[0069]
1.11分子对接分析
[0070]
从pubchem数据库中下载io的结构信息,并在pdb数据库下载sirt6、nrf2和gpx4这三种蛋白的pdb结构,使用ledock软件对小分子药物和受体进行对接,并采用pymol软件进行可视化,使用photoshop软件做出对接图,具体见表1和图1。
[0071]
表1:io与蛋白分子对接结果
[0072][0073]
1.12在a549细胞构建sirt6的稳定高表达细胞系
[0074]
将细胞接种于6孔板。24小时后,转染sirt6表达质粒pcmv-sirt6(pcdh-cmv-sirt6-ef1-copgfp-t2a-puro-coa,guangzhou igebio co.ltd),使用lipofectamine
tm
2000(invitrogen),遵循说明书的规范操作进行转染。转染48h后,通过测定sirt6 mrna和蛋白水平来监测sirt6的过表达。在检测sirt6过表达引起的细胞活力时,转染48h后加入异荭草素,用cck-8法检测细胞活力。空载体与pcmv-sirt6平行转染,作为阴性对照。
[0075]
1.13数据统计分析
[0076]
多次实验的结果均以均数
±
标准差(sd)表示,采用graphpad prism 8软件进行统计分析,使用t检验或单因素方差分析(anova)计算统计显著性差异,有统计学意义表述为:*,p<0.05,**,p<0.01,***,p<0.001。
[0077]
第二部分、体外实验结果
[0078]
3.1isoorientin抑制a549细胞的生长和克隆形成
[0079]
如图2所示,为了研究io是否诱导肺癌细胞a549发生铁死亡,建立了对ddp敏感的肺癌细胞a549,并建立了对1.5μg/ml顺铂耐药的a549/ddp细胞。通过cck-8细胞毒性检测细胞活性,发现单独使用io在a549细胞的ic50=58.51μm,在a549/ddp细胞的ic50=61.12μm(图2中的b),ddp在a549细胞和a549/ddp细胞的ic50分别为2.43μm、31.23μm,a549/ddp细胞对ddp的耐药倍数为12.85(图2中的c)。通过克隆形成试验研究io对a549/ddp细胞的集落形成的影响,经过不同浓度的io联合ddp干预后,io以浓度依赖的方式明显减少了细胞集落的数量(见图2中的d、e)。
[0080]
以上结果表明,io明显抑制了a549/ddp细胞的集落形成能力,而不同浓度io干预后的细胞活性检测表明,1.5μm io、4.5μm io、13.5μm io与不同浓度ddp联用后,ddp在a549/ddp细胞的ic50分别为25.36μm、6.19μm io、2.62μm,增敏倍数为1.27、5.21、12.31(见图2中的f),即io与ddp联用后能够显著增强dpp对于ddp耐药细胞的抑制作用。
[0081]
3.2 isoorientin通过gpx4诱导a549细胞的铁死亡
[0082]
如图3所示,为了研究io诱导细胞是何种死亡方式,本发明采用io干预细胞,并加入铁死亡抑制剂(fer-1)作为对照组进行细胞活性检测,结果显示,相同条件下,加入铁死亡抑制剂组的细胞活性大于未加入组(见图3中的a)。同时,通过qrt-pcr、western blot测定gpx4和slc7a11的mrna和蛋白表达水平,结果可知,io以及io+ddp处理gpx4和slc7a11的
mrna和蛋白表达水平均显著低于空白对照组和ddp组(见图3中的b、c、d)。进一步地,io+ddp处理相比io单独处理组,gpx4的mrna和蛋白表达水平更低,而slc7a11的mrna和蛋白表达水平升高,但都没有统计学差异。因此,io有可能通过gpx4方式使诱导细胞发生铁死亡。
[0083]
脂质过氧化物是铁死亡的主要物质,活性氧(ros)特别是羟基自由基(oh
·
)主要通过过氧化氢(h2o2)与微量的“游离”铁,经fenton/haber-weiss反应循环催化产生。基于以上机理,本发明在固定剂量io诱导条件下,分别测定了细胞内铁的丰度,丙二醛(mda)、gsh和gsh/gssg含量水平(见图3中的e、f、g、h),结果可知,io处理的实验组铁、mda含量大于对照组,gsh含量小于对照组。以上实验证实了io可以诱导细胞通过gpx4发生铁死亡而非其他方式使细胞死亡。
[0084]
3.3 isoorientin通过sirt6/nrf2/gpx4途径增强a549/ddp细胞的铁死亡
[0085]
nrf2是一种关键的转录因子,gpx4已被证实受nrf2调控,顺铂显著增加了耐药细胞中ros、脂质过氧化物和mda的水平,这些指标预示着有可能发生了铁死亡。因此,如图4所示,通过qrt-pcr、western blot分别测定a549及a549/ddp组的sirt6、nrf2和gpx4的mrna和蛋白表达水平,由图4中的a、b、c、d结果可知,a549/ddp组的sirt6、nrf2和gpx4的mrna和蛋白表达水平均高于a549组;a549/ddp组中io干预或io+ddp联合使用后sirt6、nrf2和gpx4的mrna和蛋白表达水平均低于仅ddp处理;为了检测io干预后细胞内ros的含量,我们使用流式细胞仪检测ros含量,由图4中的e、f结果表明,使用io干预后细胞内ros含量显著增加,证明io诱导细胞发生铁死亡。综上所述,说明io介导sirt6/nrf2/gpx4通路,从而增强细胞发生铁死亡。
[0086]
3.4在a549/ddp细胞下调sirt6表达研究sirt6/nrf2/gpx4通路和铁死亡的变化以及isoorientin的影响
[0087]
为了验证sirt6在io诱导细胞发生铁死亡机制中的作用,我们使用小干扰rna(sisirt6)瞬时转染a549/ddp细胞,使sirt6沉默,表达下调(见图5)。通过qrt-pcr、western blot和细胞活性检测,分析sirt6表达下调后sirt6、nrf2和gpx4的mrna和蛋白表达水平及细胞活性,结果显示,小干扰rna瞬时转染后,细胞内sirt6、nrf2和gpx4的mrna和蛋白表达水平及细胞活性均较对照组降低(图5中的a、b、c),推测下调sirt6的表达可能会增强细胞铁死亡。为了更加准确推断此结论,本发明在固定剂量io诱导条件下,分别测定了细胞内铁的丰度,丙二醛(mda)、gsh和gsh/gssg含量水平,由图5中的d、e、f、g结果可知,io处理的实验组中铁、mda含量大于对照组,gsh、gsh/gssg含量小于对照组。由以上实验可得,下调sirt6的表达可能会增强io诱导的细胞发生铁死亡。
[0088]
3.5 sirt6过表达对isoorientin诱导a549细胞铁死亡的影响
[0089]
在a549细胞使用pcmv sirt6质粒转染,使sirt6过表达,分析sirt6表达上调后sirt6、nrf2和gpx4的mrna和蛋白表达水平及细胞活性。如图6中的a、b、c结果显示,表达上调后,io干预后细胞内sirt6、nrf2和gpx4的mrna和蛋白表达水平及细胞活性均较未io干预组无明显差异,推测sirt6过表达后io可能对诱导细胞铁死亡无明显作用。为了更加准确推断此结论,我们在固定剂量io诱导条件下,分别测定了细胞内铁的丰度,丙二醛(mda)、gsh和gsh/gssg含量水平,由图6中的d、e、f、g结果可知,io干预的实验组中铁、mda含量和gsh、gsh/gssg含量较未io干预的组无明显差异。由以上实验可得,sirt6的过表达对抑制io诱导的细胞发生铁死亡无明显影响,并与图5进行相互验证sirt6的表达在io诱导细胞发生铁死
亡机制中的作用。
[0090]
第三部分、体内实验
[0091]
构建balb/c-nu裸鼠耐药荷瘤模型,接种a549/ddp耐药细胞,在裸鼠移植瘤模型上研究异荭草素联合顺铂逆转肺癌耐药的体内药效学作用及作用机制,具体实验步骤如下:
[0092]
在无菌条件下,将肿瘤细胞a549/ddp注射于小鼠右腋皮下(2
×
106个细胞/ml),约6天后,肿瘤平均直径达到0.4-0.6厘米时,随机分组,每组6只裸鼠,腹腔注射(i.p.)给药,分组情况:ddp组(1mg/kg);ddp(1mg/kg)+25mg/kg io组,每2天给药一次,总计给药10次,每次给药前,用游标卡尺测量瘤体的长径(l)和短径(w),依据公式v=1/2
×
l
×
w2计算肿瘤体积,并称量体重,记录生存状态和生存时间;动物处死后称取脾脏及肝脏重量,计算肿瘤抑制率、肝指数及脾指数;用中性甲醛固定肿瘤标本,常规石蜡包埋、切片、染色,作常规病理检查,观察组织的形态学改变和肿瘤坏死;另外,取肿瘤组织采用建立的uplc/ms/ms方法测定ptx的含量,部分肿瘤组织提取蛋白用wb实验分析相关蛋白表达情况。
[0093]
第四部分、体内实验结果
[0094]
4.1 isoorientin抑制体内肿瘤的生长
[0095]
本发明建立了动物模型来验证io能抑制肿瘤的生长,小鼠服用固定浓度的io和ddp作为实验组,与服用固定浓度的ddp作为对照组,如图7中的a、c、d所示,io和ddp联用以时间依赖型抑制肿瘤生长并能减少肿瘤体积和重量;通过质谱分析可知io可增加ddp在肿瘤中的浓度,由图7中的e结果可知,io能增加肿瘤对ddp的敏感性,抑制其耐药,同时,由图7中的b所示,对小鼠体重进行测定无明显变化,证明io对机体无毒性。
[0096]
4.2 isoorientin诱导的体内铁死亡
[0097]
取各小鼠体内肿瘤生物样本,借助western blot分析不同组肿瘤组织sirt6、nrf2和gpx4的蛋白表达水平。由图8中的a、b结果显示,体内sirt6、nrf2和gpx4的蛋白表达水平较对照组减弱,推测io可能在体内诱导肿瘤发生铁死亡。为了准确推测,分别测定了小鼠体内肿瘤生物样本内铁的丰度,丙二醛(mda)、gsh和gsh/gssg含量水平,由图8中的c、d、e、f结果可知,io干预后体内肿瘤中铁、mda含量较未使用io干预时含量增加,gsh、gsh/gssg含量减少。由以上实验可得,io能诱导体内肿瘤发生铁死亡。
[0098]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1