一种梯度缓释型载药微球及其制备方法
1.本发明属于药物载体领域,具体涉及一种梯度缓释型载药微球及其制备方法。
背景技术:
2.外伤或疾病导致的软骨损伤在临床上较为常见,由于软骨无血管且软骨细胞迁徙能力差,致使软骨很难自我修复。此外,软骨损伤通常伴随着无菌性炎症的发生,引发疼痛、积水进而发展成为慢性关节炎,故软骨修复的另外一个关键就是抗炎,只有局部炎症被有效抑制,损伤软骨才有可能逐步修复再生。
3.因此,需要开发一种梯度缓释型新型载药体系,该载药体系可梯度缓释药物,在植入软骨缺损区域后,首先释放抗炎药物发挥抗炎镇痛作用,减缓损伤初期关节肿胀和疼痛症状,避免炎症和积水等的发生;随后稳定缓释促软骨修复药物,持续促进损伤软骨修复再生,从而实现抗炎和促软骨修复一体化治疗。
4.目前,临床上用于软骨修复的药物主要有氨基葡萄糖胶囊、硫酸软骨素、双氯芬酸片、透明质酸等。其中,硫酸软骨素(cs)是一种硫酸化糖胺聚糖类天然多糖,具有促进软骨生长、调控生长因子、加快伤口愈合等多种生物功能,被称为“关节软黄金”。双氯芬酸钠(ds)是一种非甾体抗炎药,通过抑制环氧化酶阻断前列腺素的合成,从而产生显著的镇痛、抗炎和解热作用,其具有用量小、药效强、不良反应轻等特点,常用于骨科各类急慢性疼痛和炎症的治疗。
5.聚乳酸-羟基乙酸(plga)一种可完全生物降解的聚酯共聚物,其具有良好的生物相容性,已被用于临床药物输送系统。利用静电纺丝技术可以容易地把药物包封在plga纤维基体内部,得到具有药物缓释性能的载药plga纳米纤维。但传统静电纺纳米纤维通常以纤维膜的形式用作敷料或者组织工程支架,这极大地限制了其在生物医学领域的应用。
6.现有技术中,例如申请号为201910509664.3、申请号为201710121150.1的专利文献均公开了均质处理技术可以将静电纺纳米纤维膜加工成短纤维,从而实现静电纺纤维可注射化。但是,均质处理之后需要离心筛选等步骤,工艺流程长、效率低,且药物和材料损耗大、产率低,得到的短纤维材料也存在长短不一,混有纤维碎片和长纤维缠结,注射容易造成栓塞等风险。
技术实现要素:
7.基于现有技术中存在的上述不足之处,本发明的目的是提供一种梯度缓释型载药微球及其制备方法,制得的梯度缓释型载药微球可分层次释放抗炎药物ds和促软骨修复药物cs。
8.为了达到上述发明目的,本发明采用以下技术方案:
9.一种梯度缓释型载药微球的制备方法,包括以下步骤:
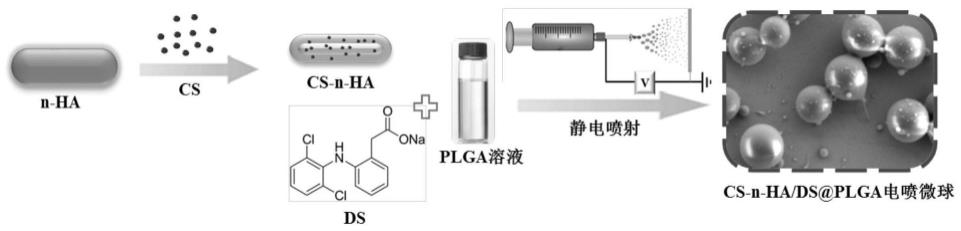
10.(1)将促软骨修复药物硫酸软骨素cs加入到纳米羟基磷灰石n-ha的水溶液中,磁力搅拌、离心、冻干后得到cs-n-ha;
11.(2)将得到的cs-n-ha和抗炎镇痛药物双氯芬酸钠ds加入到plga溶液中,充分搅拌后得到cs-n-ha/ds/plga混合溶液,之后进行静电喷射,产物接收在海藻酸钠水溶液中,离心、冷冻干燥后得到梯度缓释型载药微球。
12.作为优选方案,所述步骤(1)中,硫酸软骨素cs和纳米羟基磷灰石n-ha的质量比为1:(1~3)。
13.作为优选方案,所述步骤(1)中,磁力搅拌的时间为12~36h。
14.作为优选方案,所述步骤(1)中,纳米羟基磷灰石n-ha的水溶液的浓度为10~30mg/ml。
15.作为优选方案,所述步骤(2)中,plga溶液的浓度为8~12wt%。
16.作为优选方案,所述步骤(2)中,混合溶液中各组cs-n-ha、ds、plga的质量比为(2~4):(1~3):20。
17.作为优选方案,所述步骤(2)中,静电喷射的工艺条件为:纺丝电压8~10kv,注射泵流速为0.054~0.088mm/min,接收距离为10~18cm,环境温度30~35℃,湿度37~46%。
18.作为优选方案,所述海藻酸钠水溶液的浓度为3~5wt%。
19.本发明还提供一种如上任一方案所述的制备方法制得的梯度缓释型载药微球。
20.本发明与现有技术相比,有益效果是:
21.(1)本发明通过电喷一步法制备梯度缓释型载药微球,制备工艺简单,药物和材料损耗小、产率高;
22.(2)本发明提供的梯度缓释型载药微球可梯度缓释抗炎药物ds和促软骨修复药物cs,抗炎镇痛药物ds首先释放,减缓损伤初期关节肿胀和疼痛症状,避免炎症和积水等的发生;随后促软骨修复药物cs逐步释放,持续促进损伤软骨修复再生,实现抗炎和促软骨修复一体化治疗;
23.(3)本发明以含有海藻酸钠的水溶液作为接收装置,得到的载药微球表面均匀粘附一层海藻酸钠;注射后微球表面的海藻酸钠首先与机体自身的钙离子(ca
2+
)相结合,形成凝胶层,有利于微球在软骨损伤病灶的粘附,微球释放的药物直接作用于软骨缺损区域,延长药物作用效率和作用时间;同时在药物释放过程中,微球内部包裹的纳米羟基磷灰石(ca
10
(po4)6(oh)2)中的ca
2+
也会逐步渗透释放,与表面的海藻酸钠结合,从而在羟基磷灰石、plga以及软骨表面形成一个独特的药物输送通道,保证了负载药物的稳定释放和高效作用;进一步地,通过海藻酸钠凝胶层贯通连接,将梯度缓释型载药微球与软骨基体有效连接形成一个有机整体,保证了最终软骨修复的连续性。
附图说明
24.图1为本发明实施例1的梯度缓释型载药微球的制备过程示意图;
25.图2为本发明实施例1的纳米羟基磷灰石n-ha和cs-n-ha纳米颗粒的sem图,(a)为n-ha纳米颗粒的sem图,(b)为cs-n-ha纳米颗粒的sem图;
26.图3为本发明实施例1的梯度缓释型载药微球的sem图;
27.图4为本发明实施例1的梯度缓释型载药微球的药物累计缓释曲线图。
具体实施方式
28.为了更清楚地说明本发明实施例,下面将对照附图说明本发明的具体实施方式。显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图,并获得其他的实施方式。
29.实施例1:
30.如图1所示,本实施例的梯度缓释型载药微球的制备方法,包括以下步骤:
31.(1)以纳米羟基磷灰石(n-ha)作为一级药物载体负载促软骨修复药物硫酸软骨素(cs);
32.具体地,取60mg cs加入4ml的纳米羟基磷灰石(n-ha)水溶液中,n-ha水溶液的浓度15mg/ml,缓慢磁力搅拌24h后,8000r/min离心15min,沉淀冷冻干燥后得到cs-n-ha;
33.(2)将0.6g聚乳酸羟基乙酸(plga,ga/la=50:50)溶于1.5ml n,n-二甲基甲酰胺(dmf)和4.5ml四氢呋喃(thf)的混合溶液中,室温下磁力搅拌12h,得到plga溶液;随后plga溶液中加入步骤(1)中得到的cs-n-ha和30mg抗炎镇痛药物双氯芬酸钠(ds),继续磁力搅拌12h,得到cs-n-ha/ds/plga混合溶液。
34.(3)采用10ml注射器吸取步骤(2)中cs-n-ha/ds/plga混合溶液,通过静电喷射制备载药微球,以盛有5wt%海藻酸钠水溶液的玻璃水槽作为接收装置,产物离心、冷冻干燥后得到cs-n-ha/ds@plga梯度缓释型载药微球(也称cs-n-ha/ds@plga电喷微球)。
35.其中,静电喷射的工艺参数:电压10kv,注射泵流速为0.088mm/min,接收距离为12cm,环境温度35℃,湿度38%。
36.本实施例以扫描电子显微镜(sem)、紫外-可见光分光光度计(uv-vis)、高效液相色谱(hplc)以及药物缓释试验表征本实施例制备的cs-n-ha/ds@plga梯度缓释型载药微球的性能。
37.一、扫描电子显微镜测试
38.通过sem表征纳米羟基磷灰石n-ha负载药物前后的形貌和尺寸,sem结果如图2所示,可以看出载药前的n-ha为长度约60~80nm的短棒状颗粒,载药后n-ha的形貌未发生明显变化,cs-n-ha粒径增大至80~100nm。
39.通过sem表征cs-n-ha/ds@plga梯度缓释型载药微球的形貌和尺寸,如图3所示,通过静电喷射可获得单分散微球,微球表面光滑、形貌均匀,微球直径约为0.5~1μm。
40.二、uv-vis、hplc测试
41.通过测试n-ha载药前后溶液中cs浓度,可以计算出n-ha对cs的载药率为85.2%(其中,n-ha、cs的质量比为1:1)。
42.结合药物缓释试验表征结果,如图4所示,cs-n-ha/ds@plga梯度缓释型载药微球具有稳定的药物缓释性能,ds药物缓释周期可以达到12天,cs主要在15天左右开始大量释放出来,可以看出负载药物ds要优于cs先行释放出来,具有明显的梯度缓释效果。
43.对比例1:
44.本对比例中采用与实施例1中相同的药物用量和材料,制备一种梯度缓释型短纤维,具体制备步骤如下:
45.(1)与实施例1中步骤(1)完全相同的步骤获得cs-n-ha,取300mg cs加入20ml的纳
米羟基磷灰石(n-ha)水溶液中,n-ha水溶液的浓度15mg/ml,缓慢磁力搅拌24h后,8000r/min离心15min,沉淀冷冻干燥后得到cs-n-ha;
46.(2)将3g plga溶于3ml n,n-二甲基甲酰胺(dmf)和9ml四氢呋喃(thf)的混合溶液中,室温下磁力搅拌12h,得到plga静电纺丝液,随后向上述plga纺丝液中加入步骤(1)中获得的cs-n-ha和150mg ds,继续磁力搅拌12h,得到cs-n-ha/ds/plga混合纺丝液;
47.(3)选用10ml注射器吸取步骤(2)中配制的cs-n-ha/ds/plga纺丝液进行静电纺丝,静电纺丝工艺参数如下:纺丝电压16kv,注射泵流速为0.088mm/min,接收距离为15cm,环境温度35℃,湿度35%;将静电纺丝得到的纳米纤维膜在45℃条件下真空干燥24h,得到cs-n-ha/ds@plga纳米纤维膜;
48.(4)将步骤(3)得到的cs-n-ha/ds@plga纳米纤维膜,从硅油纸上揭下,并剪成碎片,然后浸泡分散在叔丁醇溶液中,之后利用均质机在转速为14000~16000rpm条件下均质15~60min;均质完成后,对均质后的溶液进行离心筛选处理,首先1000rpm离心2min,弃去沉淀,此时沉淀主要为未破碎的纤维膜碎片,上层溶液3000rpm再次离心5min,收集沉淀,此时沉淀主要为cs-n-ha/ds@plga短纤维片段,将得到的沉淀冷冻干燥获得cs-n-ha/ds@plga短纤维。
49.通过对均质处理后的上清液uv-vis、hplc测试可知,均质过程中由于均质产生的高速剪切力造成了plga内部负载药物的较大损失,随着均质时间的延长,ds的药物损失量约为10~25%,cs的药物损失量也接近10~15%。
50.相比对比例1,本实施例1通过一步电喷法直接获得了单分散梯度缓释载药微球,无需均质破碎处理,不仅简化了制备流程,更避免了负载药物的损失。
51.此外,对比例1中均质后的溶液中仍混有大量纤维膜碎片和缠结纤维,需要通过离心筛选,对比例中采用3g plga进行纺丝和均质处理,最终只能得到270~300mg单分散短纤维,产率不足10%。
52.而本实施例1的静电喷射的方法得到的载药微球,通过离心、冻干的最终产物几乎没有损失,产率接近100%;与对比例1相比具有明显的优势。相比之下本发明具有制备流程短、工艺简单、药物损耗小、产率高等诸多优势。通过对比例1进一步说明本发明中梯度缓释型cs-n-ha/ds@plga载药微球及其制备方法的优势。
53.在上述实施例及其替代方案中,硫酸软骨素cs和纳米羟基磷灰石n-ha的质量比还可以为1:1.5、1:2、1:2.5、1:3等。
54.在上述实施例及其替代方案中,步骤(1)中磁力搅拌的时长还可以为18h、20h、30h、36h等。
55.在上述实施例及其替代方案中,纳米羟基磷灰石n-ha的水溶液的浓度还可以为10mg/ml、20mg/ml、25mg/ml、30mg/ml等。
56.在上述实施例及其替代方案中,plga溶液的浓度还可以为8wt%、9wt%、11wt%、12wt%等。
57.在上述实施例及其替代方案中,混合溶液中各组cs-n-ha、ds、plga的质量比还可以为2:1.5:20、2.5:2:20、3:3:20、4:2.5:20等。
58.在上述实施例及其替代方案中,静电纺丝的工艺条件中,纺丝电压还可以为8kv、8.5kv、9kv、9.5kv等,注射泵流速还可以为0.054mm/min、0.065mm/min、0.007mm/min、
0.085mm/min等,接收距离还可以为10cm、14cm、16cm、18cm等,环境温度还可以为30℃、31℃、32℃、33℃、34℃等,湿度还可以为37%、40%、42%、44%、46%等。
59.在上述实施例及其替代方案中,海藻酸钠水溶液的浓度还可以为3wt%、3.5wt%、4wt%、4.5wt%等。
60.由于本发明方案实施例众多,各实施例实验数据庞大众多,不适合于此处逐一列举说明,但是各实施例所需要验证的内容和得到的最终结论均接近。
61.以上所述仅是对本发明的优选实施例及原理进行了详细说明,对本领域的普通技术人员而言,依据本发明提供的思想,在具体实施方式上会有改变之处,而这些改变也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1