一种用于治疗主动脉夹层和主动脉瘤的离子试剂及制备方法与应用与流程
1.本发明涉及生物技术领域,具体涉及一种用于治疗主动脉夹层和主动脉瘤的离子试剂及制备方法与应用。
背景技术:
2.主动脉夹层/主动脉瘤是一类较为常见的血管类疾病,发病凶险,具有高致死率和致残率,严重威胁人类健康。主动脉夹层是指血管内膜撕裂,血流进入动脉壁层;主动脉瘤是指主动脉呈瘤样扩张,超过正常直径50%。高龄是主动脉夹层和主动脉瘤发生的主要危险因素,年龄大于65岁的男性发病率高达9%。近些年来,降血压药物如β
‑ꢀ
受体阻断剂和血管紧张素转化酶抑制剂、降血脂的他汀类药物、抗生素等药物以及干细胞疗法被相继报道可能具有治疗主动脉夹层/主动脉瘤的效果,但临床治疗效果存在争议,所以目前主动脉夹层/主动脉瘤仍“无药可治”,外科手术治疗是目前最主要的治疗手段,但由于术后的高并发症和高死亡率,因此也极具危险性。因此,探索有效的能明显减缓或抑制主动脉夹层/主动脉瘤的发生、发展和破裂的新方法已成为亟待解决的难题,具有十分重要的研究意义。
3.研究表明,内皮细胞衰老、功能紊乱、巨噬细胞浸润/极化以及平滑肌细胞凋亡是主动脉夹层/主动脉瘤发生所共有的重要病理特征。内皮细胞已被证实在多种血管类疾病中起始动作用,其中一个主要的原因是衰老引起内膜损伤后,大量的炎性细胞浸润并释放炎性因子,导致血管中膜功能退化,引发血管功能障碍。内皮细胞结构和功能的完整性在保护血管免于形成主动脉夹层/主动脉瘤中具有重要作用,而由衰老引起的内皮细胞功能紊乱是主动脉夹层/主动脉瘤发生的重要危险因素。
4.并且,现有的针对心肌梗死的治疗方案,由于心肌梗死和主动脉瘤/主动脉夹层是两种完全不同的疾病。心肌梗死是指冠状动脉堵塞导致的心脏心肌细胞大量凋亡和坏死,是一种心脏疾病。而主动脉瘤 /主动脉夹层是由于主动脉(可能发生的部位包括:主动脉弓、升主动脉、降主动脉和腹主动脉)发生病变,是一种大血管疾病。且从发病机制上,心肌梗死是大量心肌细胞凋亡,而主动脉夹层是主动脉平滑肌细胞凋亡。治疗心肌梗死需要抑制心肌细胞凋亡,而治疗主动脉瘤/主动脉夹层则需要抑制主动脉平滑肌细胞凋亡,虽然都是细胞凋亡,但涉及的是不同细胞类型。现有的针对心肌梗死的治疗方案多采用血管新生的手段,而血管新生是指从已有的毛细血管或毛细血管后静脉发展而形成新的血管,是促进坏死心肌组织中的血管新生;而主动脉瘤/主动脉夹层是由高危因素引起的血管损伤,治疗主动脉瘤/主动脉夹层通过促进血管内皮细胞和平滑肌细胞修复等参与大血管损伤修复,治疗治疗主动脉瘤/主动脉夹层不涉及到促进血管新生的过程,因此,现有的针对心肌梗死的治疗方案无法应用于治疗主动脉瘤 /主动脉夹层。
技术实现要素:
5.为了解决现有技术的缺陷与不足,本发明提供了一种用于治疗主动脉夹层和主动
脉瘤的离子试剂及制备方法与应用。
6.本发明采用的技术解决方案是:一种用于治疗主动脉夹层和主动脉瘤的离子试剂,所述的离子试剂包括具有生物相容性的液体和分散于所述液体中的生物活性离子,所述生物活性离子选自si、sr、mg、 zn、cu、mn、fe、se离子中的一种或几种。
7.所述的具有生物相容性的液体为生理盐水或dmem细胞培养基。
8.所述的sr、mg、zn、cu、mn、fe离子为金属阳离子。
9.所述的si离子和se离子为酸根阴离子。
10.所述的si离子包括偏硅酸根离子sio
32-或原硅酸根离子sio
44-中的一种或几种。
11.所述的se离子包括亚硒酸根离子seo
32-和硒酸根离子seo4
2-。
12.所述的离子试剂中总的si离子的浓度可为0.98~90.62μgml-1
,sr 离子的浓度可为3.63~456.84μgml-1
,mg离子的浓度可为3.63~464.6 μgml-1
,zn离子的浓度可为0.3~17.5μgml-1
,cu离子的浓度可为 0.04~4.77μgml-1
,mn离子的浓度可为0.01~1.48μgml-1
,fe离子的浓度可为0.14~18.36μgml-1
,se离子的浓度可为0.002~0.34μgml-1
。
13.一种用于治疗主动脉夹层和主动脉瘤的离子试剂的制备方法,通过以下步骤制备:将具有生物相容性的液体对含有所述生物活性离子的无机生物材料进行浸提,得到所述离子试剂,所述的生物活性离子选自si、sr、mg、zn、cu、mn、fe、se离子中的一种或几种。
14.所述的无机生物材料选自氯化锶、氯化镁、氯化锌、氯化铜、氯化锰、氯化铁、硅酸钠和亚硒酸钠等可溶性盐或含si、sr、mg、zn、cu、mn、fe、se的无机矿物以及金属氧化物中的至少一种,或其中任意两种以上的组合。
15.一种所述的离子试剂在制备用于主动脉夹层和主动脉瘤受损大血管修复药物上的应用。
16.本发明的有益效果是:本发明提供了一种用于治疗主动脉夹层和主动脉瘤的离子试剂及制备方法与应用,使用本发明的离子试剂培养主动脉内皮细胞、主动脉平滑肌细胞和骨髓来源的巨噬细胞时,能够抑制内皮细胞衰老、促进巨噬细胞向m2型极化和抑制平滑肌细胞凋亡。而且,通过静脉注射所述离子试剂,能够抑制血管衰老、抑制血管炎症和抑制血管凋亡,治疗主动脉夹层/主动脉瘤疾病,可为科学研究及临床治疗提供可行的方法和依据。此外,本发明的离子试剂来源广泛,安全有效,可以促进受损血管功能恢复,为关于主动脉夹层和主动脉瘤的科学实验研究和临床治疗提供了可行的方法和依据。
附图说明
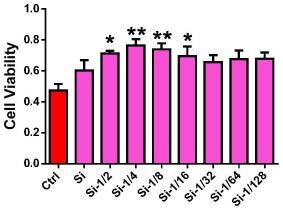
17.图1为含不同浓度si离子浸提液对小鼠主动脉内皮细胞(maecs) 活性的影响。
18.图2为含不同浓度sr离子溶液对小鼠maecs活性的影响。
19.图3为含不同浓度mg离子溶液对小鼠maecs活性的影响。
20.图4为含不同浓度zn离子溶液对小鼠maecs活性的影响。
21.图5为含不同浓度cu离子溶液对小鼠maecs活性的影响。
22.图6为含不同浓度mn离子溶液对小鼠maecs活性的影响。
23.图7为含不同浓度fe离子溶液对小鼠maecs活性的影响。
24.图8为含不同浓度se离子溶液对小鼠maecs活性的影响。
25.图9为si离子dmem浸提液稀释至1/8(4.53
±
0.18μgml-1
)处理3 天后对主动脉内皮
细胞maecs衰老的影响。(a)si离子在此浓度下对maecs衰老相关β-半乳糖苷酶(sa-β-gal)染色图。(b)sa-β-gal 阳性细胞所占所有细胞百分比的统计图。sa-β-gal染色阳性(蓝色) 表示细胞已经衰老。(c)si离子在此浓度下对maecs中衰老蛋白 nad-依赖性去乙酰化酶sirtuin-1(sirt1)蛋白表达免疫印迹代表图。 (d)sirt1蛋白与内参蛋白gapdh表达量的比值统计图。(e)si 离子在此浓度下对maecs中dna损伤标记物γh2a.x蛋白表达免疫印迹代表图。(f)γh2a.x蛋白与内参蛋白gapdh表达量的比值统计图。(g)si离子在此浓度下,γh2a.x在细胞核中表达的免疫荧光代表图。(h)γh2a.x在细胞核中表达的细胞数量占总细胞数量的比例。图a和g比例尺分别代表100μm和50μm。
26.图10为si离子dmem浸提液稀释至1/8(4.53
±
0.18μgml-1
)处理3 天后对骨髓来源的巨噬细胞mbmms极化的影响。(a)si离子在此浓度下对mbmms极化影响的流式代表图。(b)si离子在此浓度下对m2型巨噬细胞极化标记蛋白tgfβ的定量分析统计图。
27.图11为si离子dmem浸提液稀释至1/8(4.53
±
0.18μgml-1
)处理3 天后对masmcs凋亡的影响。(a)si离子在此浓度下对masmcs 凋亡影响的流式代表图。(b)si离子在此浓度下对masmcs凋亡定量分析统计图(以annexin-v
+
细胞的百分比表示)。
28.图12为si离子生理盐水浸提液原液(77.63
±
0.16μgml-1
)对ang ii 诱导的小鼠的生存率、主动脉瘤发生率、腹主动脉直径和胶原沉积的影响。(a)si离子尾静脉注射治疗主动脉瘤的实验流程图。(b)si 离子对小鼠生存率和主动脉瘤发生率的作用。(c)主动脉代表图。(d) si离子对小鼠腹主动脉直径分析统计图。(e)si离子对胶原沉积分析统计图。图c比例尺为5mm。
29.图13为si离子生理盐水浸提液原液(77.63
±
0.16μgml-1
)对β-bapn 诱导的小鼠的生存率、主动脉夹层发生率、主动脉弓直径、胶原沉积和衰老的影响。(a)si离子尾静脉注射治疗主动脉夹层的实验流程图。 (b)si离子对小鼠生存率和主动脉夹层发生率的作用。(c)主动脉代表图。(d)si离子对小鼠腹主动脉直径分析统计图。(e)si离子对胶原沉积分析统计图。图c比例尺为5mm。
具体实施方式
30.以下结合附图和下述实施方式进一步说明本发明,应理解,附图和下述实施方式仅用于说明本发明,而非限制本发明。
31.在此提出“离子疗法”的概念,通过静脉注射活性离子(例如无机生物材料释放的活性离子),调控血管相关内皮细胞衰老和平滑肌细胞凋亡以及免疫相关巨噬细胞极化,从而抑制血管衰老、抑制炎症、抑制凋亡和促进血管损伤修复。
32.本发明一实施方式提供一种能够治疗主动脉夹层/主动脉瘤的离子试剂。该离子试剂中含有生物活性离子,所述生物活性离子可选自 si、sr、mg、zn、cu、mn、fe、se离子中的至少一种。
33.该离子试剂还可含有具有生物相容性的液体,生物活性离子分散于所述具有生物相容性的液体中。
34.该离子试剂中,si离子的存在形式是sio
44-或sio
32-,se离子的存在形式是seo
32-或seo4
2-,金属离子(m,包括sr、mg、zn、cu、 mn、fe)的存在形式可为m
n+
。
35.sr、mg、zn、cu、mn、fe、se离子和si离子类似具有调控血管相关细胞活力的作用,因
此sr、mg、zn、cu、mn、fe、se离子同样能够用于主动脉夹层/主动脉瘤的治疗。
36.所述生物活性离子可以是无机生物材料释放的生物活性离子。所述无机生物材料选自氯化锶、氯化镁、氯化锌、氯化铜、氯化锰、氯化铁、硅酸钠和亚硒酸钠等可溶性盐或含si、sr、mg、zn、cu、mn、 fe、se的无机矿物以及金属氧化物中的至少一种,或其中任意两种以上的混合。
37.一个示例中,所述离子试剂中含有si离子,其中si离子的浓度可为0.98~90.62μgml-1
,优选为5.82~46.88μgml-1
,更优选为 11.76~23.58μgml-1
。在所述离子试剂中,如果si离子的浓度过大,则会有一定的细胞毒性;如果si离子浓度过小,则难以起到治疗主动脉夹层和主动脉瘤的作用。sr离子的浓度可为3.63~456.84μgml-1
, mg离子的浓度可为3.63~464.6μgml-1
,zn离子的浓度可为0.3~17.5 μgml-1
,cu离子的浓度可为0.04~4.77μgml-1
,mn离子的浓度可为 0.01~1.48μgml-1
,fe离子的浓度可为0.14~18.36μgml-1
,se离子的浓度可为0.002~0.34μgml-1
。
38.另外,所述离子试剂中,sr离子的浓度可为3.63~456.84μgml-1
。
39.所述离子试剂中,mg离子的浓度可为3.63~464.6μgml-1
。
40.所述离子试剂中,zn离子的浓度可为0.3~17.5μgml-1
。
41.所述离子试剂中,cu离子的浓度可为0.04~4.77μgml-1
。
42.所述离子试剂中,mn离子的浓度可为0.01~1.48ngml-1
。
43.所述离子试剂中,fe离子的浓度可为0.14~18.36μgml-1
。
44.所述离子试剂中,se离子的浓度可为0.002~0.34μgml-1
。若所述具有生物相容性的液体中含有所述离子,则此浓度是具有生物相容性液体中原有的所述离子和生物材料释放的所述离子的总和。
45.所述具有生物相容性液体优选为液态细胞培养基、或者能够注射到生物体内的液体。例如优选为生理盐水(saline,可购自商用,例如购自四川科伦药业股份有限公司,国药准字:h51021158)或细胞培养基(dmem,可为本领域公知的高糖dmem,购置gibco,型号为11965-092)。选用生理盐水溶液时,可以维持和人体相近的渗透压。选用细胞培养基时,可以为细胞生长提供必要的营养物质。
46.在可选的实施方式中,所述离子试剂是含有无机生物材料释放的生物活性离子的浸提液或由无机盐类配置的离子液体。
47.所述无机生物材料选自氯化锶、氯化镁、氯化锌、氯化铜、氯化锰、氯化铁、硅酸钠和亚硒酸钠等可溶性盐或含si、sr、mg、zn、 cu、mn、fe、se的无机矿物以及金属氧化物中的至少一种。所述生物材料可购自商用或自行制备。其制备方法不限,例如,可以采用共沉淀或溶胶凝胶法制备。
48.本发明一实施方式中,以具有生物相容性的液体为提取试剂,对含有所述生物活性离子的无机生物材料进行浸提,制备离子试剂。即,所述离子试剂可以是具有生物相容性的液体或无机生物材料的浸提液。
49.制备含有si离子浸提液时,可以对生物矿石casio3粉体进行浸提。casio3(例如购自昆山华侨科技新材料有限公司)的纯度为99%以上。casio3陶瓷粒径优选为30~150μm。此粒径范围内的casio3陶瓷易获得,浸提较方便且浸提原液离子浓度适中便于后期原液稀释。
50.制备含其它离子的浸提液时,亦可对含有该离子的无机生物材料/无机盐类进行浸提/配置成相应浓度的离子,在此不再赘述。
51.一个示例中,含不同浓度si离子的浸提液制备方法为:按照iso 10993-5标准制备粉体浸提液,所用提取溶剂为dmem或生理盐水,纯的生物矿石casio3粉体用于制备含si离子浸提液,最后将浸提原液通过dmem或生理盐水梯度配比稀释。
52.另一个示例中,含不同浓度cu离子的浸提液制备方法为:购买商用氯化铜试剂,麦克林,货号:1317-38-0。所用提取溶剂为水,配置成1000倍的母液,最后将浸提原液通过dmem梯度配比稀释。
53.在不影响本发明的目的的情况下,所述离子试剂中还可以含有其它组分。
54.在此公开的离子试剂可用于“离子疗法”,即,将该离子试剂注入人或动物中,可以促进大血管的修复,治疗主动脉夹层/主动脉瘤。注射方式可为静脉注射等。
55.以下,说明获得离子试剂的最优作用浓度的步骤以及“离子疗法”对主动脉夹层/主动脉瘤的治疗效果。
56.在此,通过含不同浓度生物活性离子(例如si离子)浸提液培养细胞的方法,探索生物活性离子促进内皮细胞衰老的效果,发现离子试剂在此浓度下能直接抑制内皮细胞衰老、促进巨噬细胞向m2型极化和抑制平滑肌细胞凋亡,从而修复受损血管。该离子试剂及“离子疗法”具有制备工艺简单易行、成本低廉、且便于推广等优点。
57.一个实施方式中,获得si离子试剂抑制内皮细胞衰老、促进巨噬细胞极化、抑制平滑肌细胞凋亡的作用浓度,具体包括以下步骤。其它离子试剂亦可采用该步骤。
58.(1)含不同浓度的si离子浸提液的制备。
59.(2)将步骤(1)中获得的含si离子浸提液培养maecs,采用 cck8法检测细胞活力,筛选促进maecs活力保持的si浓度范围以及最优浓度。
60.(3)将步骤(2)中获得的促进maecs活力保持的最优离子试剂培养maecs、mbmms和masmcs,采用sa-β-gal染色、免疫印迹和免疫荧光等方法检测maecs细胞衰老的情况。采用流式细胞术、酶联免疫吸附法和免疫印迹等方法检测mbmms极化情况以及 masmcs凋亡情况。进一步的采用动物实验,将离子试剂静脉注射后,检测离子试剂对于小鼠主动脉夹层/主动脉瘤的治疗影响。
61.本发明利用具有生物相容性的液体(如生理盐水或dmem)与生物活性离子(例如si离子)复配,得到了用于治疗主动脉夹层/主动脉瘤的离子试剂,最终实现了主动脉夹层/主动脉瘤的血管修复目的。该方法经过反复实验验证,效果极佳。
62.本发明的有益效果:
63.(1)制备工艺简单易行;(2)成本低廉且便于推广;(3)提出了用于主动脉夹层/主动脉瘤干预治疗的“离子疗法”的新概念;(4) 治疗方法易操作且无二次伤害。
64.本发明为主动脉夹层/主动脉瘤的治疗提供了新的可行方法,“离子疗法”可以用于主动脉夹层/主动脉瘤的临床治疗等。
65.下面进一步列举实施例以详细说明本发明。同样应理解,以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制。本领域的技术人员根据本发明的上述内容做出的一些本质的改进和调整均属于本发明的保护范围。下述示例具体工艺参数等也是适合范围中的一个示例,即本领域技术人员可以通过本文的说明做合适的范围
内选择,而并非要限定于下文示例的具体数值。除非另有定义或说明,本文中所使用的所有专业和科学用于与本领域技术熟练人员所熟悉的意义相同。此外任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。
66.以下实例中,生物矿石casio3陶瓷粉末购置于昆山华侨科技新材料有限公司,纯度为99%以上。casio3陶瓷粒径优选为30~150μm。氯化铜购置麦克林,货号:1317-38-0。dmem购自于gibco,型号为11965-092。生理盐水购置于四川科伦药业股份有限公司,国药准字:h51021158。
67.实施例1:
68.(1)si离子试剂的制备
69.按照iso 10993-5标准制备casio3浸提液。以粉体和dmem或生理盐水体积比200mgml-1
的比例将粉体添加到浸提溶剂中,密封置于37℃恒温摇床中浸提24h,4000rpm离心10min,取上清液并经过0.22μm滤膜过滤后得到200mgml-1
的casio3浸提原液。将200 mgml-1
的casio3浸提原液用dmem稀释至1/2、1/4、1/8、1/16、 1/32、1/64以及1/128,置于冰箱待用,并通过电感耦合等离子体发射光谱仪(icp-oes)测得离子浓度(见表1)。
70.表1梯度稀释si浸提液中的si离子浓度(μgml-1
)
[0071][0072]
(2)铜离子试剂的制备
[0073]
将氯化铜溶液配置成1000倍的母液,即504.5mg氯化铜粉末溶于50ml去离子水中。再将母液按照1:1000的比例稀释至dmem培养基中,即铜离子浓度为10.9μgml-1
,将配置好的氯化铜溶液用 dmem稀释至1/2、1/4、1/8、1/16、1/32、1/64以及1/128,置于冰箱待用。
[0074]
实施例2:
[0075]
(1)硅离子试剂对maecs活力的影响
[0076]
以1.5x104个细胞/孔的密度将maecs接种到96孔细胞培养板中,每个组分设置6个平行孔实验,使用maecs完全培养基培养的对照作为空白对照(control),si离子dmem浸提液作为实验组。细胞贴壁24h后,将培养基换成100μl/孔的梯度稀释的si离子 dmem浸提液完全培养基和空白对照组培养基继续培养,并隔天换液。达到预设时间的3天后,采用cck8法检测细胞活性。
[0077]
图1显示(a)si离子dmem浸提液稀释至1~1/128之间,对照表1,si离子浓度在5.82~46.88μgml-1
能够显著提高maecs活性。而si离子dmem浸提液稀释至1/8具有最强的促进maecs活性的效果,也就是si离子浓度在4.53μgml-1
的dmem浸提液进行接下来的实验研究。
[0078]
(2)锶离子试剂对maecs活力的影响
[0079]
以1.5x104个细胞/孔的密度将maecs接种到96孔细胞培养板中,每个组分设置6个平行孔实验,使用maecs完全培养基培养的对照作为空白对照(control),sr离子dmem配置液作为实验组。细胞贴壁24h后,将培养基换成100μl/孔的梯度稀释的sr离子 dmem配置液完全培养基和空白对照组培养基继续培养,并隔天换液。达到预设时间的3天后,采用cck8法检测细胞活性。
[0080]
图2显示(a)sr离子dmem浸提液稀释至1~1/128之间,即 sr离子浓度在3.63~456.84μgml-1
能够显著提高maecs活性。而sr 离子dmem浸提液稀释至1/8具有最强的促进maecs活性的效果,即sr离子浓度在58.23μgml-1
的dmem浸提液中效果最好。
[0081]
(3)镁离子试剂对maecs活力的影响
[0082]
以1.5x104个细胞/孔的密度将maecs接种到96孔细胞培养板中,每个组分设置6个平行孔实验,使用maecs完全培养基培养的对照作为空白对照(control),mg离子dmem配置液作为实验组。细胞贴壁24h后,将培养基换成100μl/孔的梯度稀释的mg离子 dmem配置液完全培养基和空白对照组培养基继续培养,并隔天换液。达到预设时间的3天后,采用cck8法检测细胞活性。
[0083]
图3显示(a)mg离子dmem浸提液稀释至1~1/128之间,即 mg离子浓度在3.63~464.6μgml-1
能够显著提高maecs活性。而 mg离子dmem稀释至1倍具有最强的促进maecs活性的效果,即 mg离子浓度在464.6μgml-1
。
[0084]
(4)锌离子试剂对maecs活力的影响
[0085]
以1.5x104个细胞/孔的密度将maecs接种到96孔细胞培养板中,每个组分设置6个平行孔实验,使用maecs完全培养基培养的对照作为空白对照(control),zn离子dmem配置液作为实验组。细胞贴壁24h后,将培养基换成100μl/孔的梯度稀释的zn离子 dmem配置液完全培养基和空白对照组培养基继续培养,并隔天换液。达到预设时间的3天后,采用cck8法检测细胞活性。
[0086]
图4显示(a)zn离子dmem浸提液稀释至1/2~1/128之间,即 zn离子浓度在0.3~17.5μgml-1
能够显著提高maecs活性。而zn离子dmem稀释至1/64,即zn离子浓度在0.55μgml-1
具有最强的促进maecs活性的效果。而zn离子dmem稀释至1倍高时,即zn 离子浓度为35μgml-1
时有细胞毒性。
[0087]
(5)铜离子试剂对maecs活力的影响
[0088]
以1.5x104个细胞/孔的密度将maecs接种到96孔细胞培养板中,每个组分设置6个平行孔实验,使用maecs完全培养基培养的对照作为空白对照(control),cu离子dmem配置
液作为实验组。细胞贴壁24h后,将培养基换成100μl/孔的梯度稀释的cu离子 dmem配置液完全培养基和空白对照组培养基继续培养,并隔天换液。达到预设时间的3天后,采用cck8法检测细胞活性。
[0089]
图5显示(a)cu离子dmem浸提液稀释至1~1/128之间,即 cu离子浓度在0.04~4.77μgml-1
能够显著提高maecs活性。
[0090]
(6)锰离子试剂对maecs活力的影响
[0091]
以1.5x104个细胞/孔的密度将maecs接种到96孔细胞培养板中,每个组分设置6个平行孔实验,使用maecs完全培养基培养的对照作为空白对照(control),mn离子dmem配置液作为实验组。细胞贴壁24h后,将培养基换成100μl/孔的梯度稀释的mn离子 dmem配置液完全培养基和空白对照组培养基继续培养,并隔天换液。达到预设时间的3天后,采用cck8法检测细胞活性。
[0092]
图6显示(a)mn离子dmem浸提液稀释至1~1/128之间,即 mn离子浓度在0.01~1.48μgml-1
能够显著提高maecs活性。而mn 离子dmem稀释至1/2,即mn离子浓度在0.74ngml-1
具有最强的促进maecs活性的效果。
[0093]
(7)铁离子试剂对maecs活力的影响
[0094]
以1.5x104个细胞/孔的密度将maecs接种到96孔细胞培养板中,每个组分设置6个平行孔实验,使用maecs完全培养基培养的对照作为空白对照(control),fe离子dmem配置液作为实验组。细胞贴壁24h后,将培养基换成100μl/孔的梯度稀释的fe离子 dmem配置液完全培养基和空白对照组培养基继续培养,并隔天换液。达到预设时间的3天后,采用cck8法检测细胞活性。
[0095]
图7显示(a)fe离子dmem浸提液稀释至1~1/128之间,即 fe离子浓度在0.14~18.36μgml-1
能够显著提高maecs活性。而fe 离子dmem稀释至1/2即fe离子浓度在9.18μgml-1
具有最强的促进maecs活性的效果。
[0096]
(8)硒离子试剂对maecs活力的影响
[0097]
以1.5x104个细胞/孔的密度将maecs接种到96孔细胞培养板中,每个组分设置6个平行孔实验,使用maecs完全培养基培养的对照作为空白对照(control),se离子dmem配置液作为实验组。细胞贴壁24h后,将培养基换成100μl/孔的梯度稀释的se离子 dmem配置液完全培养基和空白对照组培养基继续培养,并隔天换液。达到预设时间的3天后,采用cck8法检测细胞活性。
[0098]
图8显示(a)se离子dmem浸提液稀释至1~1/128之间,即 fe离子浓度在0.002~0.34μgml-1
能够显著提高maecs活性。而se 离子dmem稀释至1倍,即se离子浓度在0.34μgml-1
具有最强的促进maecs活性的效果。
[0099]
(9)si离子试剂对maecs衰老的影响
[0100]
以1.5x104个细胞/孔的密度将maecs接种到6孔细胞培养板中,每个组分设置5个平行孔实验,使用maecs完全培养基培养的对照组作为空白对照(control),si离子dmem浸提液作为实验组。细胞贴壁24h后,将培养基换成1ml/孔梯度稀释的si离子dmem 浸提液完全培养基和空白对照组培养基继续培养,达到预设时间3天后,采用sa-β-gal进行衰老细胞染色。采用蛋白分离和蛋白质印迹法检测maecs中“长寿蛋白”sirt1表达和dna损伤标记物γh2a.x 表达。进一步采用细胞免疫荧光检测γh2a.x在细胞核中的蛋白表达情况。
[0101]
图9显示,si离子在此浓度能够抑制maecs衰老。(a)通过 sa-β-gal染色实验发现,si离子处理三天可以有效抑制maecs中 sa-β-gal阳性细胞的比例和上调sirt1的蛋白表达;(b,c)通过免疫印迹实验发现,si离子处理三天提高sirt1蛋白表达和抑制γh2a.x的蛋白表达,同时增加γh2a.x在细胞核中的表达;(d)通过免疫荧光实验发现,si离子处理三天抑制γh2a.x在maecs细胞核中的表达。进一步说明了si离子浸提液在此浓度能够通过抑制主动脉内皮细胞衰老,从而保护内皮细胞功能紊乱,启动血管自我修复机制。
[0102]
实施例3:
[0103]
si离子试剂对巨噬细胞极化的影响
[0104]
以4.5x103/孔的密度将分离的原代mbmms接种到12孔细胞培养板中,用含10%的l929细胞上清的完全培养基诱导7天后,将培养基换成含si离子的mbmms完全培养基培养和不含si离子的培养基作为空白对照(control),每个组分设置4个平行孔实验,达到预设时间3天后,采用流式细胞术检测mbmms向m2型分化的比例。采用酶联免疫吸附法检测mbmms上清中m2型巨噬细胞表面标记物 tgfβ的分泌总量。
[0105]
图10结果显示si离子在此浓度能够促进mbmms向m2型极化。 (a)通过流式细胞实验发现,si离子处理三天能够增加cd206
+
& f4/80
+
占总细胞的比例;(b)通过酶联免疫吸附实验发现,si离子处理三天能够促进m2型巨噬细胞表面标记蛋白tgfβ的表达。因此, si离子在此浓度能够促进巨噬细胞向m2型极化,进而发挥抗血管炎症的作用。
[0106]
实施例4:
[0107]
si离子对平滑肌细胞凋亡的影响
[0108]
以1.5x104个细胞/孔的密度将masmcs接种到6孔细胞培养板中,每个组分设置5个平行孔实验,将培养基换成含si离子的 masmcs完全培养基培养和不含si离子的培养基作为空白对照 (control),每个组分设置4个平行孔实验,达到预设时间3天后,用流式细胞术检测masmcs凋亡细胞所占总细胞的比例。进一步采用蛋白分离和蛋白质印迹法检测masmcs中凋亡相关蛋白 cleaved-caspase3和cleaved-caspase9蛋白的表达。
[0109]
图11结果显示si离子在此浓度能够抑制masmcs凋亡。(a) 通过流式细胞实验发现,si离子处理三天能够抑制masmcs中 annexinv-fitc
+
占总细胞的比例。(b)蛋白免疫印迹结果显示si离子在此浓度能够抑制masmcs中cleaved-caspase3和 cleaved-caspase9的蛋白表达。因此,si离子在此浓度可以抑制平滑肌细胞凋亡,从而抵抗血管平滑肌层的丢失。
[0110]
实施例5,
[0111]“si离子疗法”对主动脉夹层/主动脉瘤的治疗作用
[0112]
(1)“si离子疗法”对ang ii诱导的小鼠的生存率、主动脉瘤发生率、腹主动脉直径、胶原沉积的影响
[0113]
主动脉动脉瘤小鼠模型通过ang ii灌注28天后诱导。采用静脉注射的方式将si离子生理盐水浸提液(原液,离子浓度见表2)以 100μl/次的量注入小鼠体内,隔天注射一次,一共注射7次(图12, a)。记录整个实验过程中小鼠的死亡率和主动脉主动脉瘤的发生率, 4周后采用腹主动脉超声考察腹主动脉直径。处死小鼠,并对腹主动脉进行冰冻切片,采用masson考察腹主动脉胶原沉积的影响。
[0114][0115]
图12显示出实施例1所得的si离子试剂注射7次对主动脉瘤治疗的动物实验结果。如图所示,si离子试剂注射7次对ang ii诱导后的主动脉瘤有修复作用,包括轻微抑制了小鼠的死亡率,减缓了主动脉瘤的严重程度,抑制了血管扩张,抑制了胶原蛋白的沉积。表明 si离子对主动脉瘤有治疗作用,包括抑制血管扩张和胶原沉积,这种治疗作用是通过抑制血管衰老、炎症和凋亡实现的。
[0116]
(1)“si离子疗法”对β-bapn诱导的小鼠生存率、主动脉瘤发生率、主动脉弓直径和胶原沉积的影响
[0117]
主动脉夹层小鼠模型通过β-bapn饲喂28天后诱导。采用静脉注射的方式将si离子生理盐水浸提液(原液)以100μl/次的量注入小鼠体内,隔天注射一次,一共注射14次(图13,a)。记录整个实验过程中小鼠的死亡率和主动脉夹层的发生率,4周后采用主动脉弓超声考察主动脉弓直径。处死小鼠,并对主动脉弓进行冰冻切片,采用masson染色考察腹主动脉胶原沉积的变化。
[0118]
图13显示出实施例1所得的si离子试剂注射14次对主动脉夹层治疗的动物实验结果。如图所示,si离子试剂对β-bapn诱导后的主动脉夹层有修复作用,抑制了小鼠的死亡率和主动脉夹层的发生率,降低了主动脉夹层的严重程度,抑制了血管扩张,抑制了胶原蛋白的沉积。表明si离子对主动脉夹层有治疗作用,包括降低小鼠死亡率和主动脉夹层发生率,抑制血管扩张和胶原沉积
[0119]
两种小鼠模型均表明si离子有治疗主动脉夹层/主动脉瘤的作用
[0120]
因此,本发明首次阐述和证实了si离子对主动脉夹层/主动脉瘤具有很好的疗效,提示含si的离子在主动脉夹层/主动脉瘤中具有良好的应用前景,为其治疗提供新的选择和药物研发思路。
[0121]
各位技术人员须知:虽然本发明已按照上述具体实施方式做了描述,但是本发明的发明思想并不仅限于此发明,任何运用本发明思想的改装,都将纳入本专利专利权保护范围内。
[0122]
以上所述仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1