一种低密度三苯基膦修饰的体内长循环药物制剂及其制备方法和应用
1.本发明属于药物制剂领域,具体涉及一种低密度三苯基膦修饰的细胞器靶向的药物递送制剂及其制备方法和应用。
背景技术:
2.近年来,纳米医学的发展为改善药物理化性质和建立安全高效的药物递送系统提供了可能,在肿瘤的预防、早期诊断和综合治疗等领域展现出巨大的潜力。与传统化疗药物相比,纳米递送系统具备多个优势,包括较好的药代动力学特性、良好的生物相容性、增强的靶器官蓄积和渗透、易于多功能化修饰等(gharpure k m,wu s y,li c,et al.nanotechnology:future of oncotherapy[j].clinical cancer research,2015,21(14):3121-30)。比如,通过对纳米粒表面进行线粒体靶向基团修饰可以赋予纳米药物亚细胞精准靶向的能力。
[0003]
线粒体在呼吸氧化过程中,将所产生的能量以电化学势能储存于线粒体内膜,导致线粒体内膜两侧存在负电位差(-180mv~-200mv)。在此线粒体膜电位的驱动下,亲脂性阳离子可优先蓄积于线粒体(murphy,m.p.,selective targeting of bioactive compounds to mitochondria.trends in biotechnology 1997,15(8),326-30;murphy,m.p.,targeting lipophilic cations to mitochondria.biochim.biophys.acta.2008,1777(7-8),1028-31)。三苯基膦(triphenylphosphonium,tpp)是最典型、应用最广泛的线粒体靶向基团,其结构中的三个苯环π电子云的离域现象使整个分子带正电荷,由此可在线粒体膜电位的驱动下靶向线粒体。其氨基化衍生物结构式如下:
[0004][0005]
然而,大多数阳离子配体功能化修饰虽然有利于纳米粒的细胞吸收和线粒体积累,但阳离子型纳米粒在血液循环过程中容易吸附血浆蛋白,增加单核吞噬细胞系统对纳米材料的识别,导致其从血液中被快速清除,影响其体循环和肿瘤积蓄(alexis f,pridgen e,molnar l k,et al.factors affecting the clearance and biodistribution of polymeric nanoparticles[j].molecular pharmaceutics,2008,5(4):505-15)。
[0006]
因此,如何确保注射的线粒体靶向的阳离子纳米粒在血液中能够实现长循环是本领域技术人员需要解决的技术问题。
技术实现要素:
[0007]
本发明的目的在于提供一种基于三苯基膦(tpp)修饰的线粒体靶向纳米药物递送系统,克服现有技术中存在的阳离子配体功能化修饰的纳米粒易被免疫系统识别清除的问
题,赋予纳米粒高效的细胞摄取和精准的线粒体递送能力,从而实现亚细胞水平的精准治疗。
[0008]
为实现上述目的,本发明采用如下技术方案:
[0009]
一种低密度三苯基膦修饰的体内长循环药物制剂,包括用于包载药物的载体,所述载体为由三苯基膦修饰的双亲性聚合物和未经三苯基膦修饰的双亲性聚合物混合后共组装形成的纳米颗粒,三苯基膦修饰于纳米颗粒表面,其中三苯基膦修饰的双亲性聚合物的质量百分比为1%~50%。
[0010]
为了确保注射的纳米粒在血液中能够实现长循环,一个“隐形”的粒子表面通常是必不可少的。研究表明,聚乙二醇化的纳米粒可避开免疫系统识别,有助于体内长循环。
[0011]
在本发明中,通过表面修饰低密度的阳离子tpp,设计了一种有别于传统阳离子纳米粒和普通聚乙二醇(peg)化的“隐形”线粒体靶向纳米粒概念,即载体材料中仅有1%~50%部分进行tpp修饰,通过低密度tpp阳离子修饰,在保留传统peg化“隐形”纳米粒长循环特性的同时,赋予纳米粒高效的细胞摄取和精准的线粒体递送能力。
[0012]
三苯基膦通过共价修饰的方式嫁接于载药纳米颗粒。优选的,所述三苯基膦修饰的双亲性聚合物由三苯基膦衍生物与双亲性聚合物的亲水端通过可降解化学键连接而成。三苯基膦基团修饰赋予纳米药物靶向线粒体的性能,使得纳米药物在线粒体富集,细胞环境因子促使可降解化学键断裂释放出活性药物分子。
[0013]
优选的,所述三苯基膦衍生物的结构式如式(i)所示,
[0014][0015]
其中,m=1~8;r表示氨基、羧基、羟基等可反应基团。
[0016]
优选的,所述双亲性聚合物选自但不限于聚乳酸-聚乙二醇(pla-peg)、聚乳酸聚乙醇酸-聚乙二醇(plga-peg)或聚己内酯-聚乙二醇(pcl-peg),其中,聚乙二醇的数均分子量为1000-50000;聚乳酸的数均分子量为1000-50000;聚乳酸聚乙醇酸的数均分子量为1000-50000;聚己内酯的数均分子量为1000-50000。
[0017]
优选的,所述双亲性聚合物的链长大于未经三苯基膦修饰的双亲性聚合物。tpp分子相对于包材来说相对较小,为了让起靶向作用的三苯基膦基团暴露于纳米粒表面,本发明采用分子链长一些的双亲性聚合物作为tpp修饰的基材。
[0018]
优选的,所述可降解化学键选自但不限于酯键、碳酸酯键、二硫键、硫醚键、酰胺键或氨基甲酸酯键。
[0019]
例如,在缩合剂条件下,氨基化三苯基膦衍生物与羧基化双亲性聚合物发生酰胺化反应合成三苯基膦修饰的双亲性聚合物。
[0020]
进一步优选,所述三苯基膦修饰的双亲性聚合物的结构式如式(ⅱ)、式(ⅲ)、或式(ⅳ)所示,
[0021][0022]
其中,m=1~5,n,x指聚合度,n=22~1136,x=13~694;
[0023][0024]
其中,m=1~5,;n,x,y指聚合度,n=22~1136,x=13~694,y=17~862;
[0025][0026]
其中,m=1~5,n,x指聚合度,n=22~1136,x=8~439。
[0027]
优选的,所述未经三苯基膦修饰的双亲性聚合物选自但不限于聚乳酸-聚乙二醇、聚乳酸聚乙醇酸-聚乙二醇或聚己内酯-聚乙二醇,其中,聚乙二醇的数均分子量小于三苯基膦修饰的双亲性聚合物中聚乙二醇的数均分子量,以保证起靶向作用的tpp不被包材遮挡,暴露于纳米粒表面。
[0028]
更为优选,三苯基膦修饰的双亲性聚合物采用pla
8k-peg
6k
、plga
10k-peg
6k
、pcl
10k-peg
6k
,对应的未经三苯基膦修饰的双亲性聚合物采用pla
8k-peg
4k
、plga
10k-peg
4k
、pcl
10k-peg
4k
。
[0029]
优选的,所述药物为紫杉烷类、铂类或喜树碱类药物或其他可作用于线粒体的药物。本发明研究表明,通过线粒体靶向使得紫杉烷类小分子药物选择性作用于肿瘤细胞线粒体微管蛋白,其抗肿瘤效果显著提升。将喜树碱类递送到线粒体可通过作用于线粒体拓扑异构酶阻止dna复制,损伤线粒体基因组,从而诱导细胞凋亡和克服耐药。
[0030]
为了实现纳米粒的血液长循环和肿瘤细胞线粒体靶向性递送,本发明提供了一种低密度三苯基膦修饰的线粒体靶向纳米药物的制备方法。将小分子药物、三苯基膦修饰的双亲性聚合物和未经三苯基膦修饰的双亲性聚合物按一定质量比溶于有机溶剂,使其在去离子水中自组装形成纳米颗粒。双亲性聚合物在自组装过程中将小分子药物包载其中。
[0031]
具体的,所述制备方法包括:首先将药物、三苯基膦修饰的双亲性聚合物和未经三苯基膦修饰的双亲性聚合物溶解于良溶剂中,再采用透析法、溶剂挥发法、薄膜水化法或共沉淀法在水相中形成纳米药物。
[0032]
上述方法中,通过调节三苯基膦修饰的双亲性聚合物占总聚合物基质的质量百分比,实现纳米粒表面不同密度tpp阳离子修饰。所述三苯基膦修饰的双亲性聚合物占总双亲性聚合物的质量百分比为1%~50%。优选的,三苯基膦修饰的双亲性聚合物占比为10~
20%。
[0033]
优选的,所述药物与双亲性聚合物的质量比为1:5~20。
[0034]
优选的,所述良溶剂选用但不限于丙酮。
[0035]
本发明还提供了所述的低密度三苯基膦修饰的体内长循环药物制剂在制备抗肿瘤药物中的应用。
[0036]
优选的,所述纳米药物中包载的药物为卡巴他赛,用于制备治疗耐药宫颈癌的药物。
[0037]
与现有技术相比,本发明具备的有益效果:
[0038]
本发明对纳米药物递送系统的载药纳米颗粒表面进行低密度的tpp阳离子修饰,在保留传统peg化“隐形”纳米粒长循环特性的同时,赋予了纳米粒高效精准的线粒体递送能力,从而实现亚细胞水平的精准治疗。
附图说明
[0039]
图1为实施例1中pla
8k-peg
6k-tpp的合成路线。
[0040]
图2为实施例1中pla
8k-peg
6k-tpp的核磁图。
[0041]
图3为实施例2中plga
10k-peg
6k-tpp的合成路线。
[0042]
图4为实施例3中pcl
10k-peg
6k-tpp的合成路线。
[0043]
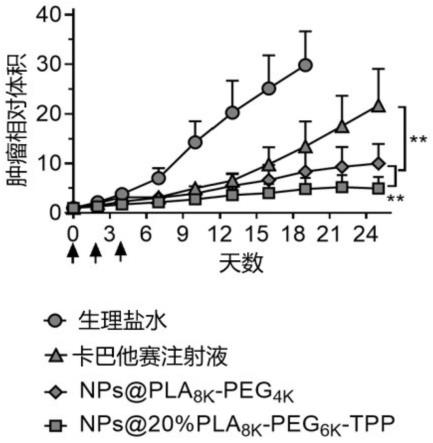
图5为实施例15中荷瘤裸鼠注射游离药物和不同纳米粒后的肿瘤体积变化图。
具体实施方式
[0044]
下面结合具体实施例对本发明做进一步说明。以下实施例仅用于说明本发明,不用来限制本发明的适用范围。在不背离本发明精神和本质的情况下,对本发明方法、步骤或条件所做的修改或替换,均属于本发明的范围。
[0045]
下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
[0046]
pla
8k-peg
6k-cooh、plga
10k-peg
6k-cooh、pcl
10k-peg
6k-cooh购自上海金畔生物科技有限公司;
[0047]
pla
8k-peg
4k
、plga
10k-peg
4k
、pcl
10k-peg
4k
购自济南岱罡生物科技有限公司;
[0048]
3-氨基丙基(三苯基)溴化膦,cas号为89996-01-0;
[0049]
化疗药物卡巴他赛,cas号为183133-96-2,可以按照姚全兴,李娅,朱小锋,李靖,一种卡巴他赛的合成新方法,化学与生物工程2014年第31卷第2期55-57页中提供的方法制备。
[0050]
实施例1 pla
8k-peg
6k-tpp的合成
[0051]
称取pla
8k-peg
6k-cooh(100mg,7.7μmol)、n-羟基琥珀酰亚胺(nhs,1.8mg,15.4μmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(edc,2.4mg,15.4μmol)和n,n-二异丙基乙胺(diea,2.0mg,15.4μmol)溶于3ml无水n,n-二甲基甲酰胺(dmf)中。将反应液加热至45℃搅拌反应4h以活化pla
8k-peg
6k-cooh。
[0052]
再加入3-氨基丙基(三苯基)溴化膦(tpp-nh2,3.4mg,8.5μmol)反应48h。反应过程用薄层色谱分析监测。合成路线如图1所示。
[0053]
反应结束后,用油泵抽干dmf,再用2ml dcm溶解所得产物。用50ml冰乙醚沉淀并过滤回收所得沉淀,重复沉淀三次。真空干燥后得到的白色固体。
[0054]
产量为80.0mg,产率75%。1h nmr图谱如图2所示。
[0055]
实施例2 plga
10k-peg
6k-tpp的合成
[0056]
称取plga
10k-peg
6k-cooh(100mg,6.7μmol)、n-羟基琥珀酰亚胺(nhs,1.8mg,15.4μmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(edc,2.4mg,15.4μmol)和n,n-二异丙基乙胺(diea,2.0mg,15.4μmol)溶于3ml无水n,n-二甲基甲酰胺(dmf)中。将反应液加热至45℃搅拌反应4h以活化plga
10k-peg
6k-cooh。
[0057]
再加入3-氨基丙基(三苯基)溴化膦(tpp-nh2,3.4mg,8.5μmol)反应48h。反应过程用薄层色谱分析监测。合成路线如图3所示。
[0058]
反应结束后,用油泵抽干dmf,再用2ml dcm溶解所得产物。用50ml冰乙醚沉淀并过滤回收所得沉淀,重复沉淀三次。真空干燥后得到的白色固体。
[0059]
产量为76.5mg,产率74%。
[0060]
实施例3 pcl
10k-peg
6k-tpp的合成
[0061]
称取pcl
10k-peg
6k-cooh(100mg,6.7μmol)、n-羟基琥珀酰亚胺(nhs,1.8mg,15.4μmol)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(edc,2.4mg,15.4μmol)和n,n-二异丙基乙胺(diea,2.0mg,15.4μmol)溶于3ml无水n,n-二甲基甲酰胺(dmf)中。将反应液加热至45℃搅拌反应4h以活化plga
10k-peg
6k-cooh。
[0062]
再加入3-氨基丙基(三苯基)溴化膦(tpp-nh2,3.4mg,8.5μmol)反应48h。反应过程用薄层色谱分析监测。合成路线如图4所示。
[0063]
反应结束后,用油泵抽干dmf,再用2ml dcm溶解所得产物。用50ml冰乙醚沉淀并过滤回收所得沉淀,重复沉淀三次。真空干燥后得到的白色固体。
[0064]
产量为90.0mg,产率87%。
[0065]
实施例4 nps@pla
8k-peg
4k
的制备
[0066]
将pla
8k-peg
4k
、化疗药物按质量比19:1溶解在丙酮中,滴加入匀速搅拌的水相中,室温搅拌30min后,减压蒸发混合溶液以除去有机溶剂,得到均匀分散的纳米颗粒nps@pla
8k-peg
4k
。
[0067]
实施例5 nps@1%pla
8k-peg
6k-tpp的制备
[0068]
将pla
8k-peg
4k
、实施例1制备的pla
8k-peg
6k-tpp、化疗药物按质量比18.81:0.19:1溶解在丙酮中,滴加入匀速搅拌的水相中,室温搅拌30min后,减压蒸发混合溶液以除去有机溶剂,得到均匀分散的纳米颗粒nps@1%pla
8k-peg
6k-tpp。
[0069]
实施例6 nps@10%pla
8k-peg
6k-tpp的制备
[0070]
将pla
8k-peg
4k
、pla
8k-peg
6k-tpp、化疗药物按质量比17.1:1.9:1溶解在丙酮中,滴加入匀速搅拌的水相中,室温搅拌30min后,减压蒸发混合溶液以除去有机溶剂,得到均匀分散的纳米颗粒nps@10%pla
8k-peg
6k-tpp。
[0071]
实施例7 nps@20%pla
8k-peg
6k-tpp的制备
[0072]
将pla
8k-peg
4k
、pla
8k-peg
6k-tpp、化疗药物按质量比15.2:3.8:1溶解在丙酮中,滴加入匀速搅拌的水相中,室温搅拌30min后,减压蒸发混合溶液以除去有机溶剂,得到均匀分散的纳米颗粒nps@20%pla
8k-peg
6k-tpp。
[0073]
实施例8 nps@30%pla
8k-peg
6k-tpp的制备
[0074]
将pla
8k-peg
4k
/pla
8k-peg
6k-tpp/化疗药物按质量比13.3:5.7:1溶解在丙酮中,滴加入匀速搅拌的水相中,室温搅拌30min后,减压蒸发混合溶液以除去有机溶剂,得到均匀分散的纳米颗粒nps@30%pla
8k-peg
6k-tpp。
[0075]
实施例9 nps@50%pla
8k-peg
6k-tpp的制备
[0076]
将pla
8k-peg
4k
、pla
8k-peg
6k-tpp、化疗药物按质量比9.5:9.5:1溶解在丙酮中,滴加入匀速搅拌的水相中,室温搅拌30min后,减压蒸发混合溶液以除去有机溶剂,得到均匀分散的纳米颗粒nps@50%pla
8k-peg
6k-tpp。
[0077]
实施例10 nps@80%pla
8k-peg
6k-tpp的制备
[0078]
将pla
8k-peg
4k
、pla
8k-peg
6k-tpp、化疗药物按质量比3.8:15.2:1溶解在丙酮中,滴加入匀速搅拌的水相中,室温搅拌30min后,减压蒸发混合溶液以除去有机溶剂,得到均匀分散的纳米颗粒nps@80%pla
8k-peg
6k-tpp。
[0079]
实施例11 nps@20%plga
10k-peg
6k-tpp的制备
[0080]
将plga
10k-peg
4k
、实施例2制备的plga
10k-peg
6k-tpp、化疗药物按质量比15.2:3.8:1溶解在丙酮中,滴加入匀速搅拌的水相中,室温搅拌30min后,减压蒸发混合溶液以除去有机溶剂,得到均匀分散的纳米颗粒nps@20%plga
10k-peg
6k-tpp。
[0081]
实施例12 nps@20%pcl
10k-peg
6k-tpp的制备
[0082]
将pcl
10k-peg
4k
、实施例3制备的pcl
10k-peg
6k-tpp、化疗药物按质量比15.2:3.8:1溶解在丙酮中,滴加入匀速搅拌的水相中,室温搅拌30min后,减压蒸发混合溶液以除去有机溶剂,得到均匀分散的纳米颗粒nps@20%pcl
10k-peg
6k-tpp。
[0083]
实施例13不同纳米粒线粒体靶向能力测定
[0084]
1、荧光染料dii采用实施例4~10中所述纳米粒制备方法与小分子药物共装载以标记纳米粒,dii等效浓度为2μm。
[0085]
2、将人耐药宫颈癌hela/r细胞按4
×
104个/孔接种于6孔板内,于培养箱过夜培养贴壁。次日加入游离dii、dii标记的纳米粒分别共孵育12h收集细胞,用冰pbs洗涤2次。
[0086]
用玻璃匀浆器在预冷的裂解缓冲液(含蛋白酶抑制剂)中充分研磨细胞。细胞悬液于4℃条件下1000
×
g离心5min,回收上清,重复一次。进一步12000
×
g离心10min。离心后的上清含胞浆成分,用于提取胞浆蛋白。线粒体沉淀在管底。用清洗缓冲液重悬清洗线粒体,最后将线粒体于0.5ml的储存缓冲液中重悬备用。样本过细胞筛,流式上机检测线粒体内dii荧光强度。药物线粒体累积如表1所示。
[0087]
表1.不同纳米粒的线粒体积蓄
[0088]
drug线粒体相对荧光强度未处理组0.8
±
0.5nps@pla
8k-peg
4k
23.5
±
5.8nps@1%pla
8k-peg
6k-tpp22.9
±
7.0nps@10%pla
8k-peg
6k-tpp65.1
±
12.5nps@20%pla
8k-peg
6k-tpp80.7
±
18.7nps@30%pla
8k-peg
6k-tpp84.8
±
22.3nps@50%pla
8k-peg
6k-tpp85.2
±
12.1
nps@80%pla
8k-peg
6k-tpp90.8
±
22.3
[0089]
表1结果显示,由10%及以上含量的线粒体靶向聚合物基质包被形成的纳米粒具有较好的线粒体靶向能力(p《0.01,相较于nps@pla
8k-peg
4k
)。
[0090]
实施例14不同纳米粒体内药代动力学测定
[0091]
使用sd大鼠研究考察纳米制剂的药代动力学特性。将sd大鼠(~200g,每组n=3)随机分组,尾静脉分别注射实施例4~10所制备纳米粒。在5min,30min,1h,2h,4h,7h预设的各时间点眼眶取血。3000
×
g离心10min获得血浆。经乙腈提取药物后,用高效液相色谱法测定血浆药物浓度。结果如表2所示。低密度阳离子tpp修饰(1%~50%)并没有明显损害peg化纳米粒固有的长循环特性。
[0092]
表2.不同纳米粒的药代动力学参数汇总
[0093][0094]
实施例15不同纳米粒体内抗肿瘤效果测定
[0095]
将8
×
105个hela/r细胞接种于balb/c裸鼠右侧腹壁,待肿瘤长至~100mm3时,将裸鼠随机分成6组(n=9)。分别于第0、2、4天尾静脉注射游离药物和不同纳米制剂(ctx等效剂量6mg/kg)。记录裸鼠体重变化并测量小鼠肿瘤长径(l,mm)和宽径(w,mm),以计算肿瘤体积。肿瘤体积(v,mm3)按以下公式计算:v=(l
×
w2)/2。
[0096]
图5为荷瘤小鼠肿瘤体积变化图。结果显示低密度阳离子tpp修饰(20%)的线粒体靶向纳米粒的治疗效果优于游离卡巴他赛和非线粒体靶向的纳米粒。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1