一种用于治疗雄激素性脱发的盐酸西替利嗪脂质体凝胶及其制备方法和应用与流程
1.本发明涉及制药技术领域,尤其是涉及一种用于治疗雄激素性脱发的盐酸西替利嗪脂质体凝胶及其制备方法和应用。
背景技术:
2.近年来,随着生活工作压力的增大,脱发现象越来越普遍,因其带来的精神压力对人们的生活产生了严重的负面影响,因此治疗脱发的需求猛增。从临床诊断来看,脱发主要分为斑秃、雄激素性脱发(aga)、药物诱导的生长期脱发等,其中雄激素性脱发最为常见。目前,指南推荐男性口服非那雄胺和外用米诺地尔,女性口服环丙孕酮、螺内酯和外用米诺地尔。由于雄激素性脱发的治疗周期长,导致患者用药依从性差。长期使用口服药物会作用于全身系统,从而引起严重的不良反应;植发费用高昂且为有创手术;螺内酯引起电解质紊乱、性欲降低;外用米诺地尔为油性药物不易清洗,女性患者使用后出现局部多毛等不良反应。因此,寻找新的药物作用靶点成为当前aga治疗的热点。
3.2017年国外首次报道了局部使用西替利嗪乙醇溶液治疗aga具有良好的疗效,后续多项临床初步试验也验证了西替利嗪对aga的治疗效果。盐酸西替利嗪片是第二代h1受体选择性拮抗剂,作为一种临床使用多年的抗过敏药,盐酸西替利嗪具有优良的安全性。然而,乙醇溶液剂对透皮具有较强的刺激性,且使用不方便;特别是,乙醇溶液剂难以透过头皮角质层且在头皮内的储存作用不大,因此潜在地降低了西替利嗪的疗效。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于提供一种用于治疗雄激素性脱发的盐酸西替利嗪脂质体凝胶及其制备方法和应用,该盐酸西替利嗪脂质体凝胶能够提高西替利嗪在头皮的储存能力,从而延长西替利嗪的作用时间,进而达到优化疗效及提高aga患者使用依从性等目的。
6.本发明提供一种用于治疗雄激素性脱发的盐酸西替利嗪脂质体凝胶的制备方法,包括如下步骤:
7.s1:将大豆卵磷脂和胆固醇溶于有机溶剂后制成药膜;
8.s2:向药膜中加入盐酸西替利嗪溶液后进行水化、分散、整粒,制得盐酸西替利嗪脂质体;
9.s3:将卡波姆-940加水溶胀制成凝胶基质,向凝胶基质中加入盐酸西替利嗪脂质体、保湿剂、防腐剂和蒸馏水,搅拌均匀后调节ph值,制得盐酸西替利嗪脂质体凝胶。
10.上述步骤s1中,大豆卵磷脂与胆固醇的质量比为(3-7):1,优选为(5-7):1,例如(250-350)mg:50mg;研究表明:大豆卵磷脂与胆固醇的质量比高达8:1时会导致脂质体的包封率(ee)下降(ee 50%左右),大豆卵磷脂与胆固醇的质量比为(5-7):1时脂质体的包封率较高(ee 60%以上),因此大豆卵磷脂与胆固醇的质量比优选为(5-7):1。
11.进一步地,步骤s1中,有机溶剂为氯仿;药膜的制备方法包括:在45-55℃的水浴条件下减压旋转蒸发除去氯仿,制得药膜。
12.上述步骤s2中,盐酸西替利嗪溶液的制备方法包括:将盐酸西替利嗪溶于pbs溶液中,制得盐酸西替利嗪溶液;其中,盐酸西替利嗪与pbs溶液的质量体积比为(20-30)mg:(5-15)ml。研究表明:盐酸西替利嗪的用量对脂质体的包封率具有一定的影响作用,脂质体的包封率随盐酸西替利嗪的投药量呈现递增趋势,且盐酸西替利嗪的投药量在5mg时包封率较低(ee 40%左右),盐酸西替利嗪的投药量在30mg时包封率最高(ee60%以上),因此盐酸西替利嗪的用量优选为20-30mg;此外,pbs溶液的用量对脂质体的包封率具有一定的影响作用,结果显示pbs溶液用量为10ml时脂质体包封率最高,用量为20ml时包封率最低(ee40%左右),因此pbs溶液用量优选为5-15ml。
13.进一步地,步骤s2中,在搅拌条件下进行水化,其中搅拌速度为200-300rpm,水化温度为30-70℃,水化时间为0.5-1.5h;在超声条件下进行分散,其中超声功率为2000-2200w,分散时间为4-6min;整粒包括:采用0.45μm的滤膜挤压过滤进行整粒。研究表明:水化温度对脂质体的包封率不具有显著影响,脂质体的包封率没有因为水化温度的增长而产生明显的变化,水化温度具体可以设置为30-70℃;水化时间对脂质体的包封率具有一定的影响作用,结果显示脂质体的包封率随水化时间的增加呈降低趋势,水化时间为0.5-1.5h具有较高的包封率,因此水化时间优选为0.5-1.5h。
14.优选地,盐酸西替利嗪脂质体的制备方法包括:将大豆卵磷脂250mg与胆固醇50mg溶于10ml氯仿中,然后于水浴条件下减压旋转蒸发除去氯仿制得药膜;将5ml溶有25mg盐酸西替利嗪的pbs溶液加入上述药膜中,在50℃水浴中磁力搅拌水化30min,之后冷却至室温,超声分散后再用0.45μm的滤膜挤压过滤进行整粒,得到盐酸西替利嗪脂质体。
15.上述步骤s3中,凝胶基质的制备方法包括:向卡波姆-940中加入蒸馏水,搅拌2-4h后,于3-5℃下充分溶胀20-28h,制得凝胶基质;其中,凝胶基质中卡波姆-940的质量含量为3-5%。
16.进一步地,步骤s3中,保湿剂为甘油,凝胶基质与甘油的质量比为5g:(1.8-2.2)g,优选为5g:2g;防腐剂为尼泊金乙酯,凝胶基质与尼泊金乙酯的质量比为5g:(15-20)mg,优选为5g:(15-17)mg,进一步优选为5g:16mg。
17.此外,步骤s3中,凝胶基质与盐酸西替利嗪脂质体的质量体积比为(2.5-5)g:10ml,优选为(4.5-5)g:10ml,进一步优选为5g:10ml;盐酸西替利嗪脂质体凝胶中卡波姆-940的质量含量为0.5-1%,优选为1%。研究表明:当卡波姆-940的质量分数为1%左右时,脂质体凝胶的分散性较好、粘度适宜、成型性好且易于涂展;而当卡波姆-940的质量分数为0.25%左右时存在成型性差的问题,当卡波姆-940的质量分数为1.5%左右时存在出现结块、较粘稠,不易涂展的问题。特别是,本发明在凝胶基质制备过程中先制备高卡波姆含量(如4%)的空白凝胶基质,再取适量制备脂质体凝胶,得到卡波姆含量为1%的脂质体凝胶,避免制备过程中凝胶基质损耗,提高了制备效率。
18.进一步地,步骤s3中,调节ph值包括:滴加三乙醇胺调节ph值至6.5。研究表明:凝胶的粘稠度随着ph值的增加而增加,当ph值为7.5时,凝胶的粘稠度过高而难以涂展开,且出现结团现象,盐酸西替利嗪脂质体不易分散开,凝胶整体质量较差;当凝胶的ph值为4.5时,凝胶的粘度较低,质地较稀,不易粘附在皮肤上;当凝胶的ph值为6.5时,凝胶粘度适中,
凝胶整体外观均匀细腻,易于涂展,且该ph值与皮肤表面ph值接近,可降低外用凝胶制剂对皮肤的刺激性。
19.优选地,盐酸西替利嗪脂质体的制备方法包括:向5g 4%的凝胶基质中加入10ml盐酸西替利嗪脂质体、2g甘油和16mg尼泊金乙酯,再加蒸馏水至总质量为20g,搅拌均匀,最后加入适量三乙醇胺调节ph至6.5,搅拌均匀,制得盐酸西替利嗪脂质体凝胶。
20.上述制备方法制备的盐酸西替利嗪脂质体呈淡黄色半透明状的半固体制剂,细腻均匀且无成团颗粒;ph值稳定在6.5,且该ph对人体皮肤刺激性小;离心后外观均匀,没有分层或凝聚现象;在不同温度下放置后均无凝固或分层现象,脂质体性质较为稳定。此外,盐酸西替利嗪脂质体的包封率》50%;盐酸西替利嗪脂质体的载药量》5%。
21.本发明还提供一种用于治疗雄激素性脱发的盐酸西替利嗪脂质体凝胶,按照上述制备方法制得。
22.本发明还提供上述盐酸西替利嗪脂质体凝胶在制备用于治疗雄激素性脱发的药物中的应用。
23.本发明将盐酸西替利嗪脂质体凝胶剂作为外用制剂治疗雄激素性脱发(aga),可提高局部用药浓度,减少不良反应发生率;同时,凝胶剂使用方便,容易清洗,可有效增加患者用药依从性,治疗效果显著。
24.本发明的实施,至少具有以下优势:
25.1、本发明针对乙醇溶液剂的缺点,以易穿透皮肤角质层、安全无毒的脂质体为载体,并借助凝胶剂生物相容性好、无刺激易清洗等优点,制备了一种新型的使用方便、安全无毒、皮肤靶向的盐酸西替利嗪脂质体凝胶剂,为其临床应用提供了前期制剂研究基础;
26.2、本发明建立了稳定可靠的脂质体凝胶制备方法与质量评价体系,提高了脂质体包封率及脂质体凝胶的透皮吸收率,该脂质体凝胶能够提高西替利嗪在头皮的储存能力,从而延长西替利嗪的作用时间,达到优化疗效,提高aga患者使用依从性的目的。
附图说明
27.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
28.图1为本发明实施例1制备的盐酸西替利嗪脂质体的电镜图;
29.图2为本发明实施例1制备的盐酸西替利嗪脂质体的粒径图及电位分布图;其中:a:粒径图;b:电位分布图;
30.图3为本发明实施例1制备的盐酸西替利嗪脂质体凝胶的稳定性试验结果;
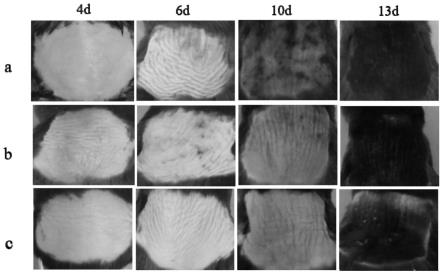
31.图4为本发明试验例3小鼠皮肤颜色变化图;其中:a:盐酸西替利嗪脂质体凝胶组,b:米诺地尔组,c:空白对照组。
具体实施方式
32.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常
理解的相同含义。
33.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也包括复数形式,此外,还应当理解的是,当在本说明中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
34.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
35.实施例1
36.本实施例的用于治疗雄激素性脱发的盐酸西替利嗪脂质体凝胶的制备方法,步骤如下:
37.1)制备盐酸西替利嗪脂质体
38.精密称取大豆卵磷脂250mg与胆固醇50mg,加10ml氯仿溶解于茄形瓶中,然后于50℃水浴条件下减压旋转蒸发10min左右除去氯仿得药膜,将5ml溶有25mg盐酸西替利嗪原料药的pbs加入药膜中,在50℃水浴中250rpm磁力搅拌水化0.5h,之后冷却至室温,2100w超声5min分散纳米粒子均匀脂质体,再用0.45μm的滤膜挤压过滤进行整粒,得到盐酸西替利嗪脂质体粗品,于4℃保存备用。
39.2)制备盐酸西替利嗪脂质体凝胶
40.精密称取2.0g卡波姆-940粉末至锥形瓶中,加蒸馏水至50g,于磁力搅拌器上搅拌3h后置于4℃冰箱中使其充分溶胀24h,得到质量分数为4%的空白凝胶基质。
41.精密称取5g上述制备好的4%空白凝胶基质于烧杯中,加10ml盐酸西替利嗪脂质体溶液,加2g甘油作为保湿剂,再加16mg尼泊金乙酯作为防腐剂,加蒸馏水至20g,搅拌均匀,最后加适量三乙醇胺调节ph值至6.5,搅拌均匀,即制得盐酸西替利嗪脂质体凝胶,该脂质体凝胶的分散性较好、粘度适宜、成型形好且易于涂展。
42.按照如下方法测定盐酸西替利嗪脂质体的包封率及载药量:
43.hplc含量测定:
44.色谱条件:色谱柱:c18(4.6
×
250mm,5μm);流动相:乙腈:水=40:60);流速:1ml/min;柱温:25℃;紫外检测波长为:232.11nm;进样量:20μl。以峰面积(a)对盐酸西替利嗪对照品的质量浓度(c)进行线性回归,得到盐酸西替利嗪标准曲线的回归方程为a=34.21*c+25.85,相关系数r2=0.9996。
45.脂质体包封率(ee)及载药量(dl)的测定:
46.精密吸取100μl盐酸西替利嗪脂质体溶液,加900μl甲醇溶液涡旋5min,超声5min后于12000r/min离心30min,离心后精密吸取上清液20μl于hplc进样,按照1.1项下的色谱条件于hplc中进样测得所制备脂质体中包封药物的总量w2;精密吸取盐酸西替利嗪脂质体溶液1000μl,于12000r/min离心30min,离心后取上清液100μl,加甲醇定容至1000μl,涡旋5min,取20μl于hplc进样,按照1.1的色谱条件于hplc中进样测得所制备脂质体中包封药物的游离药量w1。
47.按照以下公式计算包封率(%)和载药量(%):
48.包封率(%)=(w2-w1)/w2
×
100%
49.载药量(%)=(w2-w1)/w3
×
100%
50.上述公式中:w3为材料总量和药物总量之和。
51.盐酸西替利嗪脂质体的包封率和载药量测定结果见表1、表2。
52.实施例2
53.本实施例的用于治疗雄激素性脱发的盐酸西替利嗪脂质体凝胶的制备方法,步骤如下:
54.1)制备盐酸西替利嗪脂质体
55.精密称取大豆卵磷脂250mg与胆固醇50mg,加10ml氯仿溶解于茄形瓶中,然后于45℃水浴条件下减压旋转蒸发10min左右除去氯仿得药膜,将5ml溶有20mg盐酸西替利嗪原料药的pbs溶液加入药膜中,在70℃水浴中200rpm磁力搅拌下水化0.5h,之后冷却至室温,2200w超声5min分散纳米粒子均匀脂质体,再用0.45μm的滤膜挤压过滤进行整粒,得到盐酸西替利嗪脂质体粗品,于4℃保存备用。
56.2)制备盐酸西替利嗪脂质体凝胶
57.精密称取2.0g卡波姆-940粉末至锥形瓶中,加蒸馏水至50g,于磁力搅拌器上搅拌2h后置于4℃冰箱中使其充分溶胀28h,得到质量分数为4%的空白凝胶基质。
58.精密称取5g上述制备好的4%空白凝胶基质于烧杯中,加10ml盐酸西替利嗪脂质体溶液,加2g甘油作为保湿剂,再加16mg尼泊金乙酯作为防腐剂,加蒸馏水至20g,搅拌均匀,最后加适量三乙醇胺调节ph值至6.5,搅拌均匀,即制得盐酸西替利嗪脂质体凝胶。
59.按照实施例1方法测定盐酸西替利嗪脂质体的包封率,结果见表1。
60.实施例3
61.本实施例的用于治疗雄激素性脱发的盐酸西替利嗪脂质体凝胶的制备方法,步骤如下:
62.1)制备盐酸西替利嗪脂质体
63.精密称取大豆卵磷脂350mg与胆固醇50mg,加10ml氯仿溶解于茄形瓶中,然后于45℃水浴条件下减压旋转蒸发10min左右除去氯仿得药膜,将15ml溶有25mg盐酸西替利嗪原料药的pbs溶液加入药膜中,在70℃水浴中200rpm磁力搅拌下水化0.5h,之后冷却至室温,2200w超声5min分散纳米粒子均匀脂质体,再用0.45μm的滤膜挤压过滤进行整粒,得到盐酸西替利嗪脂质体粗品,于4℃保存备用。
64.2)制备盐酸西替利嗪脂质体凝胶
65.精密称取2.0g卡波姆-940粉末至锥形瓶中,加蒸馏水至50g,于磁力搅拌器上搅拌3h后置于4℃冰箱中使其充分溶胀24h,得到质量分数为4%的空白凝胶基质。
66.精密称取5g上述制备好的4%空白凝胶基质于烧杯中,加10ml盐酸西替利嗪脂质体溶液,加2g甘油作为保湿剂,再加16mg尼泊金乙酯作为防腐剂,加蒸馏水至20g,搅拌均匀,最后加适量三乙醇胺调节ph值至6.5,搅拌均匀,即制得盐酸西替利嗪脂质体凝胶。
67.按照实施例1方法测定盐酸西替利嗪脂质体的包封率,结果见表1。
68.实施例4
69.本实施例的用于治疗雄激素性脱发的盐酸西替利嗪脂质体凝胶的制备方法,步骤如下:
70.1)制备盐酸西替利嗪脂质体
71.精密称取大豆卵磷脂300mg与胆固醇50mg,加10ml氯仿溶解于茄形瓶中,然后于55℃水浴条件下减压旋转蒸发10min左右除去氯仿得药膜,将5ml溶有25mg盐酸西替利嗪原料药的pbs溶液加入药膜中,在30℃水浴中300rpm磁力搅拌水化1.5h,之后冷却至室温,2000w超声5min分散纳米粒子均匀脂质体,再用0.45μm的滤膜挤压过滤进行整粒,得到盐酸西替利嗪脂质体粗品,于4℃保存备用。
72.2)制备盐酸西替利嗪脂质体凝胶
73.精密称取2.0g卡波姆-940粉末至锥形瓶中,加蒸馏水至50g,于磁力搅拌器上搅拌4h后置于4℃冰箱中使其充分溶胀20h,得到质量分数为4%的空白凝胶基质。
74.精密称取5g上述制备好的4%空白凝胶基质于烧杯中,加10ml盐酸西替利嗪脂质体溶液,加2g甘油作为保湿剂,再加16mg尼泊金乙酯作为防腐剂,加蒸馏水至20g,搅拌均匀,最后加适量三乙醇胺调节ph值至6.5,搅拌均匀,即制得盐酸西替利嗪脂质体凝胶。
75.按照实施例1方法测定盐酸西替利嗪脂质体的包封率,结果见表1。
76.实施例5
77.本实施例的用于治疗雄激素性脱发的盐酸西替利嗪脂质体凝胶的制备方法,步骤如下:
78.1)制备盐酸西替利嗪脂质体
79.精密称取大豆卵磷脂350mg与胆固醇50mg,加10ml氯仿溶解于茄形瓶中,然后于50℃水浴条件下减压旋转蒸发10min左右除去氯仿得药膜,将5ml溶有30mg盐酸西替利嗪原料药的pbs加入药膜中,在50℃水浴中250rpm磁力搅拌水化1h,之后冷却至室温,2100w超声5min分散纳米粒子均匀脂质体,再用0.45μm的滤膜挤压过滤进行整粒,得到盐酸西替利嗪脂质体粗品,于4℃保存备用。
80.2)制备盐酸西替利嗪脂质体凝胶
81.精密称取2.0g卡波姆-940粉末至锥形瓶中,加蒸馏水至50g,于磁力搅拌器上搅拌3h后置于4℃冰箱中使其充分溶胀24h,得到质量分数为4%的空白凝胶基质。
82.精密称取5g上述制备好的4%空白凝胶基质于烧杯中,加10ml盐酸西替利嗪脂质体溶液,加2g甘油作为保湿剂,再加16mg尼泊金乙酯作为防腐剂,加蒸馏水至20g,搅拌均匀,最后加适量三乙醇胺调节ph值至6.5,搅拌均匀,即制得盐酸西替利嗪脂质体凝胶。
83.按照实施例1方法测定盐酸西替利嗪脂质体的包封率,结果见表1。
84.对照例1
85.本对照例除盐酸西替利嗪脂质体的制备方法不同之外,其余与实施例4基本相同。
86.本对照例的盐酸西替利嗪脂质体的制备方法如下:
87.精密称取大豆卵磷脂150mg与胆固醇50mg,加10ml无水乙醇溶解于烧杯中,取10mg盐酸西替利嗪原料药溶解于10ml的pbs溶液中,于50℃预热,再用注射器吸取上述乙醇溶液快速注入pbs液面下,50℃恒温磁力搅拌一定时间,将无水乙醇挥干,之后冷却至室温,超声5min分散纳米粒子均匀脂质体,再用0.45μm的滤膜挤压过滤进行整粒,得盐酸西替利嗪脂质体粗品,于4℃保存备用。
88.按照实施例1方法测定盐酸西替利嗪脂质体的包封率,结果见表1。
89.表1盐酸西替利嗪脂质体的包封率测定结果
90.盐酸西替利嗪脂质体包封率(%)实施例174.14实施例274.06实施例369.35实施例465.39实施例563.03对照例141.54
91.表1结果显示:
92.相比于对照例1的常规制备方法,本发明各实施例制备方法制备的盐酸西替利嗪脂质体的包封率较高。
93.试验例1
94.一、盐酸西替利嗪脂质体制备重现性考察
95.采用实施例1的方法平行制备三批盐酸西替利嗪脂质体样品,并以包封率和载药量为考察指标,考察制剂重现性,结果见表2。
96.表2盐酸西替利嗪脂质体制备方法重现性考察
97.序号ee(%)dl(%)174.915.13272.795.14374.625.10
98.表2结果显示:
99.按照本发明制备方法制备的三批盐酸西替利嗪脂质体溶液的包封率平均值为74.11%,rsd值为1.55%;载药量的平均值为5.12%,rsd值为0.41%。由此说明,本发明的制备方法工艺简单合理,结果稳定可靠。
100.二、盐酸西替利嗪脂质体理化性质的考察
101.1、脂质体的形态
102.取少量实施例1制备的盐酸西替利嗪脂质体,用pbs稀释后滴加在铜片上,用1%的磷钨酸钠溶液进行负染并晾干后,通过透射电子显微镜(tem)对盐酸西替利嗪脂质体的微观形态进行观察,结果见图1。
103.由图1的电镜图可知,在tem下观察到的脂质体均匀分布,表面光滑,外观均为类圆,且可观察到明显的磷脂双分子层结构,内部呈现阴影,可见脂质体成功包裹盐酸西替利嗪。
104.2、脂质体的粒径与电势
105.分别吸取实施例1制备好的三批盐酸西替利嗪脂质体溶液适量,稀释适当倍数后采用动态光散射仪测定其粒径分布及zeta电位、多分散系数,结果见图2。
106.图2结果表明,测得的脂质体粒径为(174.6
±
1.2)nm,多分散系数(pdi)为0.263
±
0.013,zeta电位为(-43.2
±
1.6)mv。
107.三、盐酸西替利嗪脂质体凝胶的稳定性因素考察
108.1、外观性状考察
109.取实施例1制备的三批盐酸西替利嗪脂质体凝胶适量于透明小烧杯中,对其外观
进行观察,结果见图3。
110.图3结果表明,盐酸西替利嗪脂质体凝胶呈淡黄色半透明状的半固体制剂,细腻均匀且无成团颗粒。
111.2、凝胶的ph
112.取实施例1制备的三批盐酸西替利嗪脂质体凝胶各1g,加20ml蒸馏水搅拌均匀,使凝胶充分分散于蒸馏水中,于ph测定仪测定其ph值。结果表明,测得盐酸西替利嗪脂质体凝胶ph值均在6.5左右,较为稳定,且该范围的ph对人体皮肤刺激性小。
113.3、离心实验
114.取实施例1制备的三批盐酸西替利嗪脂质体凝胶各1g,置于2ml离心管中,3500r/min离心30min,取出观察。图3结果表明,盐酸西替利嗪脂质体凝胶离心后外观均匀,没有分层或凝聚现象。
115.4、温度实验
116.取实施例1制备的三批盐酸西替利嗪脂质体凝胶剂适量于-20℃、25℃放置48小时以及于60℃放置6小时之后,取出观察。图3结果表明,制备的三批盐酸西替利嗪脂质体凝胶于-20℃、25℃、60℃放置相应时间后取出观察均无凝固或分层现象,说明所制备的脂质体凝胶剂性质较为稳定。
117.试验例2刺激性考察
118.1、试验中所用药物制备
119.采用实施例1方法制备盐酸西替利嗪脂质体凝胶,密封后,常温放置,备用。
120.2、新西兰兔皮肤准备
121.取动物实验中心的实验用健康新西兰大白兔6只,分别用手术剪将兔背部局部兔毛剪短,然后用电动动物剃毛仪对兔背部脊柱两侧进行剃毛(剃毛面积为3cm
×
3cm),要求可清晰观察到背剃毛部区域兔的皮肤裸露。完整皮肤组需要观察24h后剃毛区域是否出现红肿或破损情况,若出现上述情况则不能用于完整皮肤组的皮肤刺激性试验。破损皮肤组在剃毛后,用无菌注射器针头对剃毛区域划“井”字直至有血渗出。
122.3、单次给药皮肤刺激性试验
123.试验主要依据:《化学药物刺激性、过敏性和溶血性研究的技术指导原则》。
124.新西兰大白兔6只,随机分为完整皮肤组和破损皮肤组,每组3只。设赋形剂对照,采用同体左右侧自身对照。取盐酸西替利嗪脂质体凝胶直接涂布一侧;另一侧涂赋形剂(空白凝胶)对照,后用医用纱布覆盖,再用胶布固定,每只兔子单笼饲养,贴敷时间不少于4h,在4h后,除去纱布和胶布,再用温水清洁给药部位并擦干后分别在1、24、48和72h肉眼观察并记录涂敷部位有无红斑或水肿等情况。
125.4、多次给药皮肤刺激性试验
126.在单次给药皮肤刺激性试验完成的基础上,按照同样的分组,设赋形剂对照,采用同体左右侧自身对照。取盐酸西替利嗪脂质体凝胶直接涂布一侧;另一侧涂赋形剂(空白凝胶)对照,后用医用纱布覆盖,再用胶布固定,每只兔子单笼饲养,贴敷时间不少于4h,在4h后,除去纱布和胶布,再用温水清洁给药部位并擦干,然后观察给药部位是否出现红斑及水肿,连续给予盐酸西替利嗪脂质体凝胶和赋形剂7天。
127.5、结果评价
128.单次给药皮肤刺激性试验,计算每一观察时间点各组受试物及赋形剂或溶媒皮肤反应积分的平均分值,按皮肤刺激反应评分标准对其刺激强度进行评价。多次给药皮肤刺激性试验,首先计算每一观察时间点各组积分均值,然后计算观察期限内每天每只动物刺激积分均值,按照皮肤刺激强度评价标准进行刺激强度评价。
129.6、评分标准
130.皮肤刺激反应评分标准:无红斑、轻度红斑、中度红斑、重度红斑及紫红色红斑至轻度焦痂形成分别计0,1,2,3,4分;无水肿、轻度水肿、中度水肿、重度水肿和严重水肿分别计0,1,2,3,4分。
131.刺激分值=(红斑积分+水肿积分)/动物只数。
132.皮肤刺激强度评价标准见表3。
133.表3皮肤刺激强度评价标准
[0134][0135][0136]
7、统计方法
[0137]
采用graphpad prism 8软件对实验数据进行统计分析。相关数据用表示,多组间比较采用单因素方差分析,组间两两比较采用tukey检验。检验水准α=0.05,p<0.05即差异有统计学意义。
[0138]
8、试验结果
[0139]
皮肤刺激性试验结果见表4。
[0140]
表4盐酸西替利嗪脂质体凝胶皮肤刺激性结果
[0141][0142]
表4实验结果表明:
[0143]
在单次给药和多次给药后,新西兰兔完整皮肤组受试部位均未见明显异常现象;破损皮肤组在进行划痕建模后出现轻微红斑,在单次给药后1h观察到在划痕部位有两只出现轻微水肿和一只出现轻微红斑,但是持续时间短,在给药后24小时观察时水肿消散,破损皮肤组在连续用药7天后均未出现红斑及水肿。
[0144]
试验例3盐酸西替利嗪脂质体凝胶的药效考察
[0145]
1、建立脱发模型
[0146]
将购买的4周龄的24只spf级c57bl/6健康小鼠饲养于南部战区总医院动物实验中心的spf级环境中(温度25
±
1℃、湿度为50
±
5%),饲养2-3周,饲养过程中小鼠正常饮食、进水,使实验小鼠适应该实验环境,期间密切观察小鼠饮食是否异常。当24只实验小鼠周龄达到7周龄时候则可进行后续实验。
[0147]
实验开始前一天,对24只背部毛发生长无异常的雄性c57bl/6健康小鼠进行背部脱毛处理,先用动物电动脱毛仪对小鼠背部中央区的毛发进行剔除,然后再用脱毛膏按照操作说明对背部剩余绒毛进一步处理干净,脱毛面积约为2
×
2cm2。为避免脱毛膏长时间粘附刺激小鼠背部皮肤,使用脱毛膏后应及时用生理盐水对脱毛部位进行清洗,再用无菌棉球将小鼠背部擦干。对小鼠进行脱毛过程中应该谨慎操作,避免电动脱毛仪刮伤实验用小鼠的背部皮肤,背部皮肤破损会影响背部毛发的生长从而影响实验结果的观察。
[0148]
2、实验分组
[0149]
选取背部已经脱毛且脱毛部位皮肤无破损的c57bl/6雄性健康小鼠24只,进行随机分为3组,每组8只,分别为空白对照组、米诺地尔组和盐酸西替利嗪脂质体凝胶组(采用实施例1方法制备),然后根据剪趾法对每笼里的8只小鼠进行标记。
[0150]
3、盐酸西替利嗪脂质体凝胶的制备
[0151]
采用实施例1方法制备盐酸西替利嗪脂质体三批。
[0152]
4、治疗给药
[0153]
小鼠脱毛24小时后开始实验治疗给药。取实施例1制备好的盐酸西替利嗪脂质体凝胶涂于小鼠背部脱毛部位,然后对给药部位用保鲜膜封包处理,每次封包30min后用生理盐水清洗擦干,每日1g/次;米诺地尔组使用外用5%米诺地尔酊,每日1ml/次;空白组使用生理盐水外涂背部脱毛处,每日1ml/次。三组皆连续给药18天,实验期间小鼠饲养于温度(25
±
1)℃,相对湿度湿度(50
±
5)%,并按照正常生活习性摄食、喂养。
[0154]
5、观察指标
[0155]
实验过程中观察小鼠背部脱毛部位皮肤颜色变化及毛发生长情况,每天进行拍照记录。并且在给药过程中,密切观察小鼠给药部位皮肤是否出现红肿、水疱或溃烂等接触性皮炎症状,同时注意小鼠生活习性等方面是否有改变。
[0156]
6、统计方法
[0157]
采用graphpad prism 8软件对实验数据进行统计分析。相关数据用表示,多组间比较采用单因素方差分析,组间两两比较采用tukey检验。检验水准α=0.05,p<0.05即差异有统计学意义。
[0158]
7、实验结果
[0159]
盐酸西替利嗪脂质体凝胶对小鼠皮肤颜色变灰及毛发生长时间的影响见表5及图4。
[0160]
表5小鼠皮肤颜色变化时间
[0161][0162]
由表5结果可知,盐酸西替利嗪脂质体凝胶组相对比于米诺地尔组及空白对照组,小鼠皮肤颜色变灰及毛发长出的时间皆有统计学差异(p<0.05),说明盐酸西替利嗪对小鼠毛发生长有促进作用。在给药过程中小鼠均未出现红肿、水疱或溃烂等接触性皮炎症状。
[0163]
由图4拍照观察结果可知,连续给药5-6天后,盐酸西替利嗪脂质体凝胶组小鼠开始出现较大面积的灰色皮肤,米诺地尔组也出现较浅灰色斑块,空白组小鼠基本未出现灰色皮肤。在连续给药9天后,盐酸西替利嗪脂质体凝胶组小鼠皮肤基本全部变灰且有较多绒毛长出;米诺地尔组小鼠背部皮肤也基本全变灰;空白组小鼠背部出现灰色皮肤但不均匀,且其中四只小鼠背部仍有较大面积的浅红色皮肤。
[0164]
由此可见,以本发明制备的盐酸西替利嗪脂质体凝胶剂作为外用制剂,可提高局部用药浓度,减少不良反应发生率,有效增加患者用药依从性,对aga治疗效果显著。
[0165]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进
行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1