一种集成光学相干断层成像的冲击波球囊导管及系统的制作方法
1.本发明属于医疗器械技术领域,尤其涉及一种集成光学相干断层成像的冲击波球囊导管及系统。
背景技术:
2.血管内冲击波碎石(isl)技术是近年来的新兴技术,在国外已经应用于临床。是通过导丝将冲击波球囊递送至血管钙化病变部位,然后对冲击波球囊进行低压扩张,然后启动血管内冲击波治疗仪向冲击波球囊释放高压电脉冲,使其产生冲击波,击碎血管腔浅表和深层的钙化斑块,使血管的管腔得到充分扩张,从而达到显著改善血管顺应性的目的。
3.在使用冲击波球囊进行血管钙化病变预处理前,首先使用光学相干断层成像(oct)导管进行检测,获取目标血管的管腔内径等数据,然后根据血管的管腔数据,选择合适规格尺寸的冲击波球囊,以确保冲击波治疗的效果最优。进行冲击波治疗后,再次使用光学相干断层成像(oct)导管进行检测,检查钙化病变是否断裂、血管的管腔是否扩大、血管是否可以进行支架植入等。所以在使用冲击波球囊进行血管钙化病变处理之前和之后,均需要进行光学相干断层成像(oct)导管的检测,需要多次手术完成,对患者的伤害较大,也增加了手术的风险。
技术实现要素:
4.针对以上技术问题,本发明公开了一种集成光学相干断层成像的冲击波球囊导管及系统,集成了oct检测和冲击波治疗两种重要功能于一体,可以在一次手术中进行oct检测和冲击波治疗,缩短了治疗时间,减轻了手术对病人的伤害,降低了多次手术带来的风险。
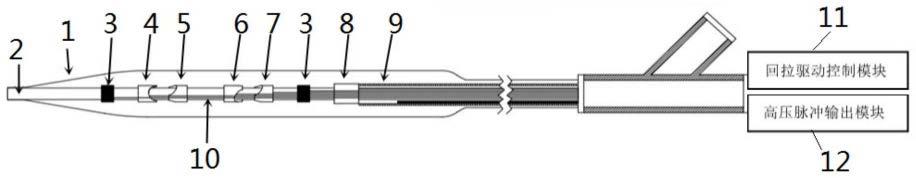
5.对此,本发明采用的技术方案为:一种集成光学相干断层成像的冲击波球囊导管,其包括球囊、内管、成像组件和若干对电极对,所述内管贯穿所述球囊的内部,所述球囊的两端与所述内管固定连接;所述电极对位于所述内管的外表面,且通过导线与高压脉冲输出模块电连接,每一所述电极对的两电极相对且间隔设置;所述成像组件与所述内管活动连接,所述成像组件与用于连接回拉驱动控制模块的弹簧管、光纤连接;所述球囊内填充导电液体;所述内管的表面设有若干显影环。
6.采用此技术方案,将光纤与oct模块进行连接,导线与高压脉冲输出模块连接,弹簧管与回拉驱动控制模块连接,集成了oct检测和冲击波治疗两种重要功能于一体。在冲击波治疗,通过高压脉冲输出模块输出高压脉冲给电极对,使电极对进行放电,高压脉冲击穿电极对处的导电液体,定向发射冲击波,对血管内的钙化组织进行破碎,实现冲击波治疗的效果。在冲击波治疗后,可以通过回拉驱动控制模块驱动弹簧管,带动成像组件以内管为轴心进行旋转运动以及回拉运动,根据成像组件的反馈信息,检查钙化病变是否断裂、血管的管腔是否扩大、血管是否可以进行支架植入等,将两次手术过程减为一次,缩短了治疗时
间,减轻了手术对患者的伤害。
7.作为本发明的进一步改进,所述成像组件包括:成像探头和固定座,所述成像探头固定在所述固定座上,所述固定座与所述内管活动连接,所述固定座与所述弹簧管固定连接。
8.作为本发明的进一步改进,所述固定座的一端与所述弹簧管固定连接;所述固定座上设有通孔,所述内管通过所述通孔贯穿所述固定座。进一步的,所述弹簧管套在内管外。进一步优选的,所述固定座的外侧与所述弹簧管通过激光焊接进行连接,连接稳固,可靠性高,更好的支持成像探头进行以内管为轴心的旋转运动和回拉运动。
9.作为本发明的进一步改进,所述固定座的表面设有限位槽,与成像探头连接的光纤位于所述限位槽内。进一步的,所述限位槽为凹槽或缺口。采用此技术方案,可以在运动过程中对光纤进行限位,避免对其造成损伤。
10.作为本发明的进一步改进,所述内管的表面设有凹槽,所述导线位于所述凹槽内。采用此技术方案,导线可以隐藏在内管的表面凹槽内,减少内管的外部直径,也可以对导线进行适当的限位,并可更好地与所述球囊固定连接。
11.作为本发明的进一步改进,所述内管为多层薄壁管。
12.作为本发明的进一步改进,所述内管和所述导线外套有固定管,所述固定管的壁厚为0.005-0.5mm。进一步优选的,所述固定管为热缩管或者薄壁管。采用此技术方案,可以对所述导线和所述内管进一步固定,避免检测过程中所述导线与所述内管相脱离。
13.作为本发明的进一步改进,所述弹簧管为单层或者多层结构,所述弹簧管套于所述固定管外,也就是位于内管、导线的外侧。进一步的,所述弹簧管从成像组件处到导管的近端,一直贯通这部分集成光学相干断层成像的冲击波球囊导管的内部。
14.作为本发明的进一步改进,所述电极对为一对或多对,每对电极对分别通过导线与高压脉冲输出模块电连接,多对电极对并联或者串联连接,且间隔分开设置。进一步的,所述电极对的数量为2,两对电极对并联或者串联连接。所述电极对固定于所述内管的外表面,用导线与高压脉冲输出模块连接,所述导线依附于所述内管的表面,贯穿所述集成光学相干断层成像的冲击波球囊导管的内部。
15.作为本发明的进一步改进,所述显影环的数量为2,两个显影环分别位于两对电极对的两侧。
16.作为本发明的进一步改进,所述导电液体为生理盐水、造影剂或生理盐水和造影剂的混合溶液。
17.本发明还公开了一种集成光学相干断层成像的冲击波球囊导管系统,其包括:高压脉冲输出模块、oct光源模块、oct图像采集和处理模块、回拉驱动控制模块和上任一项所述的光学相干断层成像冲击波球囊导管,所述电极对通过导线与所述高压脉冲输出模块电连接,所述成像组件通过光纤与所述oct光源模块连接,所述弹簧管与回拉驱动控制模块连接;所述高压脉冲输出模块用于释放高压电脉冲;所述oct光源模块用于给所述成像模块提供光源,所述oct图像采集和处理模块对所述成像组件传输过来的图像进行处理,并可视化输出;所述回拉驱动控制模块用于驱动成像组件以所述内管为轴心进行旋转运动以及
回拉运动。
18.作为本发明的进一步改进,所述高压脉冲输出模块的输出电压范围为500v-5000v,脉冲脉宽为1-100微秒。
19.与现有技术相比,本发明的有益效果为:采用本发明的技术方案,突破了传统冲击波球囊导管的单一功能,创新性的加入了光学相干断层成像组件,将两者成功集成于一体,在一次手术中既可以对病变血管进行光学相干断层成像,也可以进行冲击波治疗,减少了手术医疗器械的使用,显著地简化了冲击波治疗的手术流程,方便操作,缩短了患者治疗时间,减轻了手术对患者的伤害,也降低了多次手术的风险,提高了手术的安全性,进一步造福了广大患者。
附图说明
20.图1是本发明实施例1的一种集成光学相干断层成像的冲击波球囊导管的结构示意图。
21.图2是本发明实施例1的成像组件的结构示意图。
22.附图标记包括:1-球囊,2-内管,3-显影环,4-第一电极,5-第二电极,6-第三电极,7-第四电极,8-成像组件,9-弹簧管,10-导线,11-回拉驱动控制模块,12-高压脉冲输出模块,81-成像探头,82-固定座,83-光纤。
具体实施方式
23.下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
24.需要说明的是,当元件被称为“固定于”或“设置于”另一个元件,它可以直接在另一个元件上或者间接在该另一个元件上。当一个元件被称为是“连接于”另一个元件,它可以是直接连接到另一个元件或间接连接至该另一个元件上。
25.需要理解的是,术语“长度”、“宽度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、
ꢀ“
水平”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
26.在具体实施方式中所描述的各个具体技术特征和各实施例,在不矛盾的情况下,可以通过任何合适的方式进行组合,例如通过不同的具体技术特征/实施例/实施方式的组合可以形成不同的实施方式,为了避免不必要的重复,本发明中各个具体技术特征/实施例/实施方式的各种可能的组合方式不再另行说明。
27.附图所示的每一组件的尺寸和厚度是任意示出的,本发明并没有限定每个组件的
尺寸和厚度。为了使图示更清晰,附图中部分夸大部件的尺寸。
28.实施例1如图1所示,一种集成光学相干断层成像的冲击波球囊导管,其包括球囊1以及位于球囊1内的内管2、若干电极对、成像组件8,所述内管2贯通球囊1的内部,所述电极对固定于所述内管2的外表面,且通过导线10与高压脉冲输出模块12电连接;所述导线10依附于所述内管2的表面,与所述内管2一起贯穿所述球囊1的内部,所述球囊1的两端与所述内管2固定连接。所述球囊1的内部填充导电液体。所述成像组件8与所述内管2活动连接,所述成像组件8与弹簧管9、光纤83连接;所述内管2的表面设有显影环3。所述显影环3可以为一个或多个,根据检测区域的大小进行相应设定,本实施例中所述显影环设为两个,两个显影环3分别位于所述电极对的两侧,起到均匀显影的作用。所述导电液体可以为生理盐水、造影剂或生理盐水和造影剂的混合溶液。
29.具体而言,本实施例中,所述电极对为两对,包括第一电极4、第二电极5、第三电极6和第四电极7。所述第一电极4和第二电极5相对间隔设置,构成一电极对;所述第三电极6和第四电极7相对间隔设置,构成另一电极对。所述第一电极4、第二电极5、第三电极6和第四电极7分别通过导线10连接至所述高压脉冲输出模块12。两对电极对间隔分开设置。本实施例中,第一电极4、第二电极5、第三电极6和第四电极7沿内管2的轴向依次设置。在进行冲击波治疗时,高压脉冲输出模块12输出高压脉冲通过导线10传导至第一电极4、第二电极5、第三电极6和第四电极7,高压脉冲击穿两对电极对处的导电液体,定向发射冲击波,就可以对血管内的钙化组织进行破碎。
30.进一步的,所述内管2为多层薄壁管。所述内管2的表面设有凹槽,所述导线10隐藏于所述凹槽内。所述内管2和所述导线10的外侧设有固定管,所述固定管为热缩管或薄壁管,可以对导线10进行进一步固定。进一步的,所述热缩管或薄壁管的壁厚为0.005-0.2mm,壁薄且固定性能优。
31.如图2所示,所述成像组件8包括成像探头81和固定座82,所述固定座82上设有通孔,所述内管2通过所述通孔贯穿所述固定座82。所述成像探头81固定于固定座82的外侧,所述弹簧管9与所述固定座82的一端通过激光焊接进行固定连接,从而支持成像探头81进行以内管2为轴心的旋转运动和回拉运动,进行光学相干断层成像。进一步的,所述弹簧管9为单层或者多层结构,所述弹簧管9被配置于内管2、导线10和固定管的外层,并用于与所述回拉驱动控制模块11进行连接。所述回拉驱动控制模块11通过驱动弹簧管9旋转和回拉运动,带动固定座82以及位于固定座82上的成像探头81进行以内管2为轴心的旋转运动和回拉运动,从而进行光学相干断层成像。
32.实施例2一种集成光学相干断层成像的冲击波球囊导管系统,其包括高压脉冲输出模块、oct光源模块、oct图像采集和处理模块、回拉驱动控制模块和如实施例1所述的光学相干断层成像冲击波球囊导管,所述电极对通过导线与所述高压脉冲输出模块电连接,所述成像组件通过光纤与所述oct光源模块连接,所述弹簧管与回拉驱动控制模块连接;所述高压脉冲输出模块用于释放高压电脉冲;所述oct光源模块用于给所述成像模块提供光源,所述oct图像采集和处理模块对所述成像组件传输过来的图像进行处理,并可视化输出;
所述回拉驱动控制模块用于驱动成像组件以所述内管为轴心进行旋转运动以及回拉运动。
33.其中,所述高压脉冲输出模块的输出电压范围为500v-5000v,脉冲脉宽为1-100微秒。
34.本实施例的集成光学相干断层成像的冲击波球囊导管,在传统冲击波球囊导管的基础上,增加光学相干断层成像组件,既可以对病变处进行光学相干断层成像,也可以进行冲击波治疗。
35.在进行冲击波治疗前,首先通过数字减影血管造影(dsa),初步判断患者的钙化病变位置、钙化血管直径等参数。然后选取合适直径、工作长度的光学相干断层成像冲击波球囊导管。在数字减影血管造影(dsa)的导航下,把本实施例的集成光学相干断层成像的冲击波球囊导管置入钙化病变位置附近区域,进行光学相干断层成像,获得钙化病变的详细数据。然后在光学相干断层成像的指引下,把冲击波电极精确放置于钙化病变区域,扩张球囊,对钙化病变进行冲击波治疗。冲击波治疗过后,收缩球囊,再次进行光学相干断层成像,判断钙化病变是否打开,是否适合进行后续的支架植入等操作。
36.采用本实施例的集成光学相干断层成像的冲击波球囊导管,可以显著地简化冲击波治疗手术流程,方便操作,缩短手术时间,减轻手术对患者的伤害。使用所述光学相干断层成像冲击波球囊导管,进一步减少不必要的手术医疗器械的使用,减轻患者经济负担,为社会带来巨大的经济效益。
37.以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1