一种微透镜及其应用
1.本发明属于光学技术领域,具体涉及一种微透镜及其应用。
背景技术:
2.利用光学手段实时监测细胞内外状态变化对理解生理过程并快速诊断细胞病变具有重要的意义。微球辅助技术具有的应用便捷性和优异的光学性能,使其广泛的应用于光学实验的探究中,该技术不光帮助传统光学显微镜在可见光波段实现实时无标记的超分辨成像,还能够对多种光学成像信号进行收集增强。
3.然而,随着成像与探测技术应用在生物环境中的需求和标准日益提高,将微球辅助技术应用于生物环境中进行长周期的成像和探测,其生物兼容性成为挑战。现有微球辅助技术中,常用到的微球材料多为固态介质微球(如sio2、聚苯乙烯、batio3、tio2等),这些微球材料稳定的固体特性和低降解性,使得应用于生物样品观察时具有较低的生物兼容性,在长周期的使用过程可能会对生物活性造成影响。
技术实现要素:
4.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出脂质颗粒在制备微透镜中的应用,具有完全生物兼容性的优势,可以直接应用到生物环境中进行细胞内部和外部的微结构成像探测。
5.本发明还提出一种微透镜。
6.本发明还提出一种具有上述微透镜的应用。
7.本发明还提出一种细胞成像的方法。
8.根据本发明的一个方面,提出了脂质颗粒在制备微透镜中的应用。
9.根据本发明的第二方面,提出了一种微透镜,所述微透镜包括从细胞内部提取的脂质颗粒。
10.在本发明的一些实施方式中,所述细胞为可生成微米尺寸脂质颗粒的细胞;优选地,所述细胞为脂肪细胞、视锥细胞、星状细胞中的一种。
11.在本发明的一些实施方式中,所述从细胞内部提取的脂质颗粒具体包括以下步骤:将脂肪细胞或视锥细胞用细胞缓冲液冲洗后加入无菌水或者是带有0.1
‑
1%的细胞裂解液(triton
‑
x100)的无菌水,静置10
‑
30分钟后,即得。
12.在本发明的一些实施方式中,所述微透镜的粒度为1~40μm。
13.根据本发明的第三方面,提出了上述微透镜的应用,所述应用为在制备细胞微光学元件中的应用。
14.在本发明的一些实施方式中,上述微透镜在生物成像中的应用。
15.一种细胞成像的方法,所述方法包括以下步骤:将上述微透镜内化至待测细胞中,利用所述微透镜进行荧光成像。
16.在本发明的一些实施方式中,所述微透镜在细胞中的存留时间为12~96h。
17.在本发明的一些实施方式中,所述细胞结构包括内部和外部的微结构。
18.根据本发明的实施方式,至少具有以下有益效果:本发明方案通过将脂质颗粒作为微光学元件用于制备微透镜,这是一种内源性的细胞器,并且比周围的细胞质环境有较高的折射率,制备方法简单,不需要进行额外的加工,脂质颗粒能够作为细胞内部的光学元件发挥光学作用并具有完全生物兼容性;同时脂质颗粒天然生成于细胞内部,与细胞内部的微结构(亚细胞结构)具有天然的位置靠近关系,可以在近场收集和重定位微结构的光学信号,提高光学显微镜的细胞微结构成像质量;且脂质颗粒能够将入射的激发光光束汇聚至细胞外部环境,利用此效应可以实现利用细胞内部脂质颗粒对细胞外部环境进行成像观察;脂质颗粒还可结合光镊操控技术实现细胞内部灵活的脂质颗粒移动成像。并且脂质颗粒还能够通过简易的方法进行提取并应用到其他类型的细胞中,拓展了微透镜的应用范围。
附图说明
19.下面结合附图和实施例对本发明做进一步的说明,其中:
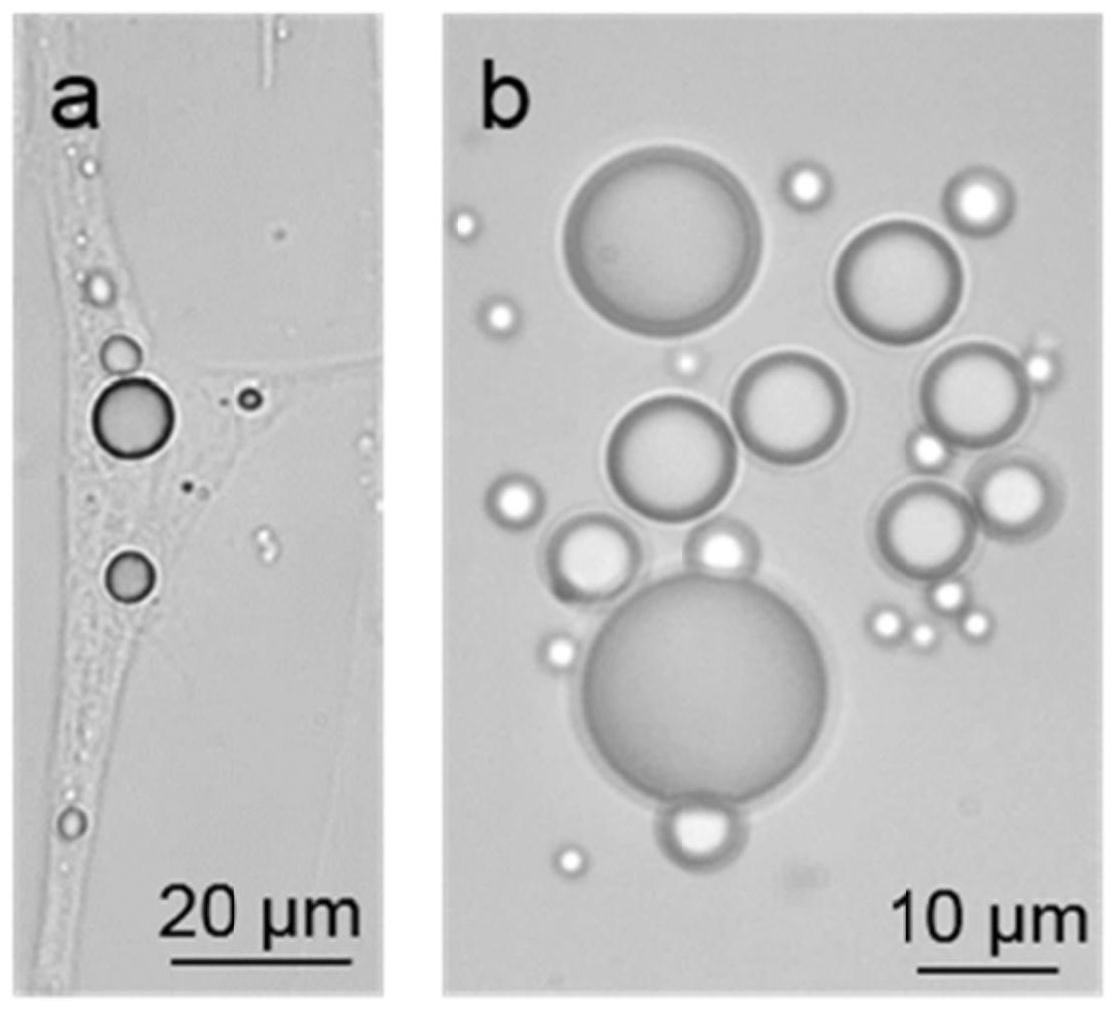
20.图1为本发明实施例1中的脂质颗粒和成熟脂肪细胞进行光学显微镜检测图,其中a为成熟脂肪细胞的光学显微图像;b为成熟脂肪细胞中提取的不同大小脂质颗粒的光学显微图像;
21.图2为本发明实施例1中的脂质颗粒的可见光至近红外波段(400nm
‑
1000nm)的透射光谱图;
22.图3为本发明测试例中的微透镜对荧光纳米金刚石进行荧光成像观察结果图,其中;a实验样品明场与荧光光学显微叠加图;a1为玻璃载玻片上的荧光纳米金刚石团簇的明场与荧光光学显微叠加图;a2为脂质颗粒(直径9μm)的明场与荧光纳米金刚石团簇信号增强后的荧光的叠加图;b为图a中荧光信号的强度三维图;b1为荧光纳米金刚石原始荧光强度三维图(对应图a1);b2为荧光纳米金刚石增强后荧光强度三维图(对应a2);c为微透镜的激发光功率降低率图;
23.图4为本发明测试例中的微透镜对细胞内部的亚细胞结构的观察图,其中,a为成熟脂肪细胞的细胞微丝荧光图像;a1为目标细胞微丝在最佳焦平面的荧光图像;a2为在微透镜的虚像面获得的目标细胞微丝的荧光图像;b为在a中获得的目标观察的细胞微丝的强度分布归一化曲线;c为细胞内脂质颗粒对细胞内溶酶体的增强成像的荧光和光学显微图像;c1,c2分别为聚焦在细胞表面和聚焦在微透镜(直径:11.3μm)虚像面的荧光图,c3为聚焦在微透镜(直径:11.3μm)虚像面的明场光学图;
24.图5为本发明测试例中的成熟脂肪细胞内部的脂质颗粒对液体中白血病细胞荧光信号的增强结果图,其中,a为实验z轴位置关系示意图,b为实验观察的仰视图,a1为流体中的白血病细胞在没有进入脂质颗粒聚焦光束的范围的观察图,b1为线粒体荧光成像图;a2为白血病细胞逐渐进入脂质颗粒的成像范围的观察图;b2为荧光信号被脂质颗粒收集时的荧光成像图;a3为白血病细胞完全进入脂质颗粒的聚焦光束轴向中心时的观察图,b3为荧光信号被脂质颗粒收集时的荧光成像图;
25.图6为本发明测试例中不同直径的脂质颗粒通过生物胞吞的方式内化至吞噬细胞和肿瘤细胞中的观察结果图,其中,a1和a2为脂质颗粒进入吞噬细胞的观察结果图;b1和b2
为脂质颗粒进入肿瘤细胞的观察结果图。
具体实施方式
26.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
27.实施例1
28.本实施例制备了一种微透镜,具体包括以下步骤:
29.1、脂肪细胞的培养
30.成熟脂肪细胞的培养:前体肝脏脂肪细胞(前体皮下脂肪细胞)以1
×
10
3~4
cell/cm2的密度接种在玻璃底培养皿(35mm)上,添加前体脂肪细胞完全培养基进行培养,并放置在37℃和5%co2的细胞培养箱中增殖36小时。当前体脂肪细胞100%相互接触时,进行诱导分化。将前体脂肪细胞完全培养基更换为脂肪细胞诱导分化完全培养基,并在2天更换一次完全培养基。6天后,可得到诱导分化完成的成熟脂肪细胞(成熟脂肪细胞的光学显微图像如图1a所示)。成熟脂肪细胞可以在脂肪完全培养基中进行培养5
‑
8天,而成熟脂肪细胞中的球形脂质颗粒能够在细胞内部长时间存在(5
‑
8天),与细胞生长周期变化相同。
31.2、提取细胞内部的脂质颗粒
32.将装有成熟脂肪细胞的培养皿中的细胞培养基去除,并用细胞缓冲液(dulbecco'sphosphate buffered saline,dpbs)3ml冲洗3次,后在其中加入1ml无菌水或者是带有0.5%的细胞裂解液(triton
‑
x100)的无菌水,静置20分钟后,溶液中出现漂浮的脂质颗粒。通过对上清液的提取和重悬,获得脂质颗粒水溶液(成熟脂肪细胞中提取的不同大小脂质颗粒的光学显微图像如图1b所示)。
33.对制备得到的微透镜和成熟脂肪细胞进行光学显微镜检测,结果如图a和b所示,从图中可以看出,本发明方案成功制备了微透镜;微透镜的可见光至近红外波段(400nm
‑
1000nm)的透射光谱如图2所示,从图中可以看出,本发明方案制备的微透镜在500nm出有最大的透光率。
34.测试例
35.1、脂质颗粒的体外光学成像特性
36.对从实施例1中提取出的脂质颗粒进行光学成像性能的体外测试。将脂质颗粒放入甘油溶液与水的折射率匹配溶液(匹配细胞质折射率1.36)中进行光学成像性能的测试。在实验中,观察用到的是倒置显微成像光学系统配合光镊操控系统。将不易发生荧光淬灭的荧光样品(荧光纳米金刚石,量子点微球)置于样品腔的上方,通过红绿蓝发光二极管(led)光源的相应波长(红:590
‑
650nm,绿:540
‑
580nm,蓝:465
‑
495nm)的激发光照射,对比荧光样品原始亮度与利用脂质颗粒成像之后的亮度。
37.实验中依次将直径为1~40μm的脂质颗粒用光镊操控移动到目标荧光样品的正下方进行成像观察。实验结果如图3所示,从图中可以看出,在脂质颗粒的帮助下能够有效提高显微镜观察到的荧光样品的荧光成像质量,能够帮助降低实验中用到的激发光功率。
38.2、利用提取的脂质颗粒对荧光纳米金刚石进行荧光成像观察
39.采用实施例1制备的微透镜对荧光纳米金刚石团簇进行观察,将荧光纳米金刚石样品置于样品腔内,放置在带有游离脂质颗粒的折射率匹配液(甘油与无菌水的混合溶液,折射率为1.36,50μl)上方。利用发光二极管(led)光源(激发光波长:540
‑
580nm)进行荧光纳米金刚石的荧光激发,激发光的光功率保持不变,在~2.8mw。
40.实验结果如图3所示,其中a1为玻璃载玻片上的荧光纳米金刚石团簇的明场与荧光光学显微叠加图像,b1为荧光纳米金刚石原始荧光强度三维图,a2为脂质颗粒(直径9μm)的明场与荧光纳米金刚石团簇在脂质颗粒成像后的荧光的叠加图像,b2为荧光纳米金刚石增强后荧光强度三维图,利用倒置显微镜观察,直接从荧光纳米金刚石团簇的位置仅检测到非常微弱的红色荧光成像信号(如a1和b1所示)。为了增强荧光信号的检测强度,将直径为9.0μm的脂质颗粒移动到荧光纳米金刚石团簇的下方,进行荧光信号的收集和增强(如a2所示)。将显微镜的成像面调整至脂质颗粒的成像虚面。由此,观察到放大增强的荧光成像图像(如b2所示)。
41.3、细胞内部脂质颗粒对细胞外部微环境信号进行成像探测
42.细胞内部的脂质颗粒形成的入射光束的聚焦光束能够实现在细胞外部的汇聚。实验中,利用熔融拉锥法制作了壁厚为1
‑
5μm,内径为10
‑
45μm的毛细管玻璃微流管模拟生物体中的毛细血管,并将其紧贴放置在成熟脂肪细胞表面,模拟组织内毛细血管和脂肪细胞的位置关系。毛细血管中心与细胞内的脂质颗粒(直径>10μm)对齐,使得与物镜的观察中心统一。激发光通过倒置的物镜(放大倍数60倍,数值孔径1)照射到细胞内的脂质颗粒,并由其汇聚至毛细管内形成强的局部激发光分布。在毛细管中以一定速度通入带有荧光标记的目标观察细胞的流体,流体由左向右流动,目标观察对象随之移动。利用显微镜观察目标对象在移动时发生的图像变化。当目标对象逐渐进入脂质颗粒的成像探测范围时,其成像质量逐渐提升,到达脂质颗粒汇聚光束的轴向中心时,成像信号最强。
43.4、对细胞内部亚细胞结构进行荧光成像观察
44.利用细胞内部的脂质颗粒对细胞内部的亚细胞结构进行荧光成像。对目标观察的亚细胞结构进行荧光标记,使其在实验中能够被特异性识别。低激发光功率下观察(1
‑
2mw),在显微镜下找到目标观察对象,并利用光镊操控系统生成的光势阱(波长:1064nm,功率:5mw
‑
100mw)捕获脂质颗粒(直径:1
‑
8μm)进行移动观察或是直接利用脂质颗粒(直径:1
‑
40μm)进行原位观察。
45.5、利用细胞内部的脂质颗粒对细胞内部的亚细胞结构进行观察增强
46.本测试例利用实施例1制备得到的脂质颗粒分别对细胞内部的微结构(微丝和溶酶体)进行成像观察。
47.前体肝脏脂肪细胞以1
×
104cell/cm2的密度接种在玻璃底培养皿(35mm)上,添加前体脂肪细胞完全培养基进行培养,并放置在37℃和5%co2的细胞培养箱中增殖36
‑
48小时。当前体脂肪细胞100%相互接触时,进行诱导分化。将前体脂肪细胞完全培养基更换为脂肪细胞诱导分化完全培养基,并在2
‑
3天更换一次完全培养基。
48.(1)细胞微丝观察
49.将分化7天后的成熟脂肪细胞样品进行微丝结构的荧光标记(染料:sir
‑
actin,浓度:0.5μm,染色时间:30min)与标记后的多次冲洗(dpbs缓冲液,每次1ml,2
‑
3次)。完成染色后,将细胞样品放置在倒置显微镜上进行荧光成像观察(如图4中a1和a2所示),所用激发光
波长为540
‑
580nm,功率保持在2mw。如图4中的a1所示,细胞内部目标观察微丝在此激发光功率下成像效果模糊无法分辨结构。添加单个光势阱(波长:1064nm,功率:20mw)捕获细胞内部直径为7.7μm的脂质颗粒,使其移动至目标观察微丝的位置,并将显微镜焦面调整至脂质颗粒的虚像面处。此时通过脂质颗粒的辅助可以看到细胞微丝清晰的结构。
50.(2)细胞溶酶体观察
51.将分化12天后的成熟脂肪细胞样品进行溶酶体的荧光标记(染料:lyso
‑
tracker,浓度:0.5μm,染色时间:30min)与标记后的多次冲洗(dpbs缓冲液,每次1ml,2
‑
3次)。完成染色后,将细胞样品放置在倒置显微镜上进行荧光成像观察,所用激发光波长为,功率保持在1.5mw。
52.实验结果如图4所示,从图中可以看出,a为成熟脂肪细胞的细胞微丝荧光图像,a1为目标细胞微丝在最佳焦平面的荧光图像;a2为在细胞内脂质颗粒的虚像面获得的目标细胞微丝的荧光图像;b为在a中获得的目标观察的细胞微丝的强度分布归一化曲线,i曲线为a1细胞微丝原始的强度曲线,ii曲线为a2细胞内脂质颗粒增强成像后获得的细胞微丝强度曲线;c为细胞内脂质颗粒对细胞内溶酶体的增强成像的荧光和光学显微图,c1,c2分别为聚焦在细胞表面和聚焦在脂质颗粒(直径:11.3μm)虚像面的荧光图片,c3为聚焦在细胞内脂质颗粒(直径:11.3μm)虚像面的明场光学图片;如c1所示,显微镜直接对焦在细胞表面时,细胞内部溶酶体由于信号微弱,无法直接在显微镜下观察到。选择细胞内部直径为11.3μm的脂质颗粒,并将显微镜对焦平面调整至该脂质颗粒的虚像面进行观察,可以在荧光(c2)和明场(c3)成像模式下都观察到清晰溶酶体图像。
53.6、利用细胞内部的脂质颗粒对细胞外部的流体中信号进行观察增强
54.本测试例中利用毛细玻璃管模拟生长在细胞周围的血管,流动在其中的癌细胞作为目标观察对象,利用脂质颗粒的长激发光汇聚能力探测毛细管中癌细胞的荧光信号。
55.前体肝脏脂肪细胞以1
×
104cell/cm2的密度接种在玻璃底培养皿(35mm)上,添加前体脂肪细胞完全培养基进行培养,并放置在37℃和5%co2的细胞培养箱中增殖36
‑
48小时。当前体脂肪细胞100%相互接触时,进行诱导分化。将前体脂肪细胞完全培养基更换为脂肪细胞诱导分化完全培养基,并在2
‑
3天更换一次完全培养基。分化12天后的成熟脂肪细胞中直径较大的脂质颗粒(直径>10μm)可细胞外的光束汇聚作为探测工具。
56.白血病细胞以1
×
104cell/cm2的密度接种在培养瓶(25ml)中,添加完全培养基(imdm+胎牛血清10%+青霉素链霉素溶液1%)进行培养,并放置在37℃和5%co2的细胞培养箱中增殖24
‑
48小时。取出1ml的白血病细胞悬浮液加入mito
‑
tracer荧光染料(0.1μl,5μm)进行30分钟的静置染色。染色后,将白血病细胞悬浮溶液进行离心处理(转速:1000转/分钟,时间:5分钟)后去除上清液,重新加入完全培养基(1ml)重悬细胞。
57.利用熔融拉制法制备微流元件来模拟生物体的毛细血管。首先将毛细管(内径约0.9mm,壁厚约0.1mm,长度约12cm)平行放置于酒精灯上方火焰外焰处,静置约30秒,待玻璃管发生软化时,借助双手以6mm/s的速度将软化的部分向两端口的方向快速拉伸,拉制成壁厚为4μm,内径为45μm的玻璃毛细管。以毛细管细长方向为实验区域(长度为50um范围)。
58.将上述制备好的玻璃毛细管细长部分放置在白血病细胞的悬浮液中,在毛细力的作用下毛细管细长部分能够充满细胞溶液。将毛细管细长部分紧贴放置在成熟脂肪细胞(贴壁细胞)表面,模拟组织内血管和脂肪细胞的位置关系(如4a所示),毛细血管的中心与
脂肪细胞内的脂质颗粒中心(直径=20.0μm)对齐以匹配显微镜的观察中心。用针管(1ml)吸取白细胞悬浮液(0.1ml),注射少量悬浮液至玻璃毛细管粗头部分,使毛细管中产生流体由左向右的流动,进而带动白血病细胞的移动。
59.成熟脂肪细胞内部的脂质颗粒对液体中白血病细胞荧光成像结果如图5所示,从图中可以看出,在倒置显微镜下观察,流体中的白血病细胞在没有进入脂质颗粒聚焦光束的范围时(如a1所示),观察到的线粒体荧光图像微弱(如b1所示)。当白血病细胞逐渐进入脂质颗粒的成像范围时(如a2所示),其荧光信号被脂质颗粒收集,在显微镜上观察到图像质量逐渐增强(如b2所示)。当白血病细胞完全进入脂质颗粒的聚焦光束轴向中心时(如a3所示),其荧光成像质量得到明显的提升(如b3所示)。即白血病细胞逐渐由脂质颗粒的投影范围外侧(如a1和b1所示)流动至边缘(如a2和b2所示)再到中心(如a3和b3所示),此过程其荧光信号强度随之变化。
60.7、将脂质颗粒内化至其他类型的细胞中
61.从实施例1制备的脂质颗粒悬浮溶液中取出0.1ml,加入到其他类型细胞(能够发生细胞胞吐的细胞种类)所适用的完全培养基溶液中(2
‑
5ml),对上清液进行提取和完全培养基的再添加重复3次后获得带有脂质颗粒的完全培养基溶液。将目标细胞培养在培养皿(35mm)中,达到60~90%的培养密度时,将其原有完全培养基换为混合有脂质颗粒的完全培养基。将脂质颗粒与目标细胞放置在37℃和5%co2的细胞培养箱中共同培养36小时。之后利用倒置显微镜观察脂质颗粒内化的现象和比例。内化后的脂质颗粒在其他类型细胞中的存留时间可达12
‑
96小时。
62.8、将提取出的脂质颗粒内化至吞噬细胞核肿瘤细胞中
63.将实施例1制备的脂质颗粒,利用生物胞吞的方式引入其他的类型的细胞中作为微光学元件,以吞噬细胞和癌细胞为例。
64.吞噬细胞(ana
‑
1)以1
×
104cell/cm2的密度接种在培养瓶(25ml)中,添加完全培养基(rpmi1640+胎牛血清10%+青霉素链霉素溶液1%)进行培养,并放置在37℃和5%co2的细胞培养箱中增殖24
‑
36小时。
65.癌细胞(c127)以1
×
104cell/cm2的密度接种在玻璃底培养皿(35mm)上,添加完全培养基(dmem+胎牛血清10%+青霉素链霉素溶液1%)进行培养并放置在37℃和5%co2的细胞培养箱中增殖36
‑
48小时。
66.前体肝脏脂肪细胞以1
×
104cell/cm2的密度接种在玻璃底培养皿(35mm)上,添加前体脂肪细胞完全培养基进行培养,并放置在37℃和5%co2的细胞培养箱中增殖36
‑
48小时。当前体脂肪细胞100%相互接触时,进行诱导分化。将前体脂肪细胞完全培养基更换为脂肪细胞诱导分化完全培养基,并在3天更换一次完全培养基。分化后12天获得成熟的脂肪细胞。将装有成熟脂肪细胞的培养皿中的细胞培养基去除,并用细胞缓冲液3ml进行3次的冲洗,后在其中加入1ml无菌水,静置30分钟后,溶液中出现漂浮的脂质颗粒。
67.取两管脂质颗粒悬浮溶液(0.1ml)分别加入吞噬细胞完全培养基和癌细胞完全培养基(2ml),对上清液进行提取和完全培养基的再添加重复3次后获得带有脂质颗粒的完全培养基溶液,将此溶液分别加入吞噬细胞的培养瓶和癌细胞的培养皿中,放置在37℃和5%co2的细胞培养箱中共同培养24小时。一段时间的共培养后,在倒置显微镜下观察,提取出的脂质颗粒成功实现通过胞吞作用进入吞噬细胞和癌细胞内部。
68.脂质颗粒与吞噬细胞和癌细胞共培养显微镜的观察结果如图6所示,从图中可以看出,不同直径的脂质颗粒(a1(5μm);a2(7.5μm);b1(3.3μm);b2(5.8μm))都可通过生物胞吞的方式内化至吞噬细胞(如a1和a2所示)和癌细胞中(如b1和b2所示所示),作为微透镜,对细胞内微结构的荧光成像信号进行放大。
69.上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1