一种热分解法制备双金属碳化物复合材料的方法与流程
本发明涉及一种热分解法制备双金属碳化物复合材料的方法。
(二)
背景技术:
在目前所有的人工能源中,氢能源由于其反应产物是水,对环境无污染,是一种具有重大发展潜力的清洁能源。而氢能大部分依然是从传统的化石燃料中制取,因此如何高效、持续的制备氢气已成为科研工作者研究的重点对象。研究出高效、稳定的催化剂来降低析氢过电位对于解决上述所提到的能源危机将具有重大指导意义。
热分解法是在高温下使得金属化合物分解生成金属单质以及其他化合物的方法,在反应中只需要控制温度、时间、气体气氛即可得到不同结构以及形貌的化合物,通过调控这些因素便可调控催化剂的析氢性能,特别是在高温下还原碳化条件下制备碳化物时,这种方法非常实用。
过渡金属碳化物因具有类铂催化行为而得到广泛关注,而利用不同金属间的协同效应与合金效应的多元金属碳化物则被认为能发挥更好的电催化析氢性能,但其合成条件复杂且不易控制。目前国内外针对金属碳化物的研究主要集中在将单金属掺杂到各种碳化物中,但通过杂多酸与有机胺混合后一步煅烧制备出含原子级别预混合的立方相的双金属碳化物复合材料且拥有电解水制氢反应,目前尚未有此类报道。
(三)
技术实现要素:
本发明的目的在于提供一种工艺简单、成本低廉含co6w6c双金属碳化物复合材料的制备方法。本发明通过将杂钨酸与有机胺进行阳离子交换,得到的前驱体在氮气和氢气混合气氛下煅烧,即可制得该复合材料。
本发明的技术方案如下:
一种制备双金属碳化物复合材料的方法,所述方法为:
(1)将杂钨酸na10[co4(h2o)2(pw9o34)2]·27h2o溶于去离子水,得到杂钨酸溶液;将十八烷基三甲基氯化铵(c21h46cln,简称stac)溶于去离子水,得到有机胺溶液;搅拌条件下,将杂钨酸溶液滴加至有机胺溶液中,滴完后继续搅拌1h,之后离心,去离子水洗涤,干燥,得到前驱体固体粉末((sta)10{co4p2w18},浅紫色)备用;
所述杂钨酸na10[co4(h2o)2(pw9o34)2]·27h2o与十八烷基三甲基氯化铵的物质的量之比为1:15~25,优选1:20;
所述杂钨酸溶液的浓度在0.002~0.005mol/l;
所述有机胺溶液的浓度在0.1~0.3mol/l;
(2)将步骤(1)所得前驱体固体粉末进行煅烧处理,所述煅烧的程序为:首先在n2气氛下,以2℃/min的升温速率从室温(20~30℃)升至410℃并保温1h;再于n2:h2=85:15至95:5(体积比)、h2流速在5~15ml/min的煅烧气氛下,以5℃/min的升温速率升至750~850℃并保温3h;最后在n2气氛下冷却至室温,得到所述双金属碳化物复合材料(黑色粉末);
具体的,所述煅烧在管式炉中进行,所述前驱体固体粉末平铺于瓷舟内,将瓷舟放置于石英舟内,将石英舟放置于管式炉中进行程序升温煅烧。
本发明中,所述杂钨酸na10[co4(h2o)2(pw9o34)2]·27h2o可根据现有技术进行合成,例如“afastsolublecarbon-freemolecularwateroxidationcatalystbasedonabundantmetals”所公开的。
本发明所述的热分解法制备双金属碳化物复合材料的方法的技术效果主要体现在:
1、本发明提供一种制备高效电解水析氢的双金属碳化物的方法;
2、本发明制备的双金属碳化物纳米粒子尺寸均一并具有高度分散性;
3、本发明制备的双金属碳化物中co6w6c的摩尔比例为50%-60%之间;
4、本发明制备的双金属碳化物纳米粒子外部具有3-5nm的碳包覆,可有效防止在析氢过程中电解液对催化剂的腐蚀作用;
5、本发明制备工艺简单、操作简便、反应温度要求较低、效率高,在工业化应用方面具有广阔的应用前景。
(四)附图说明
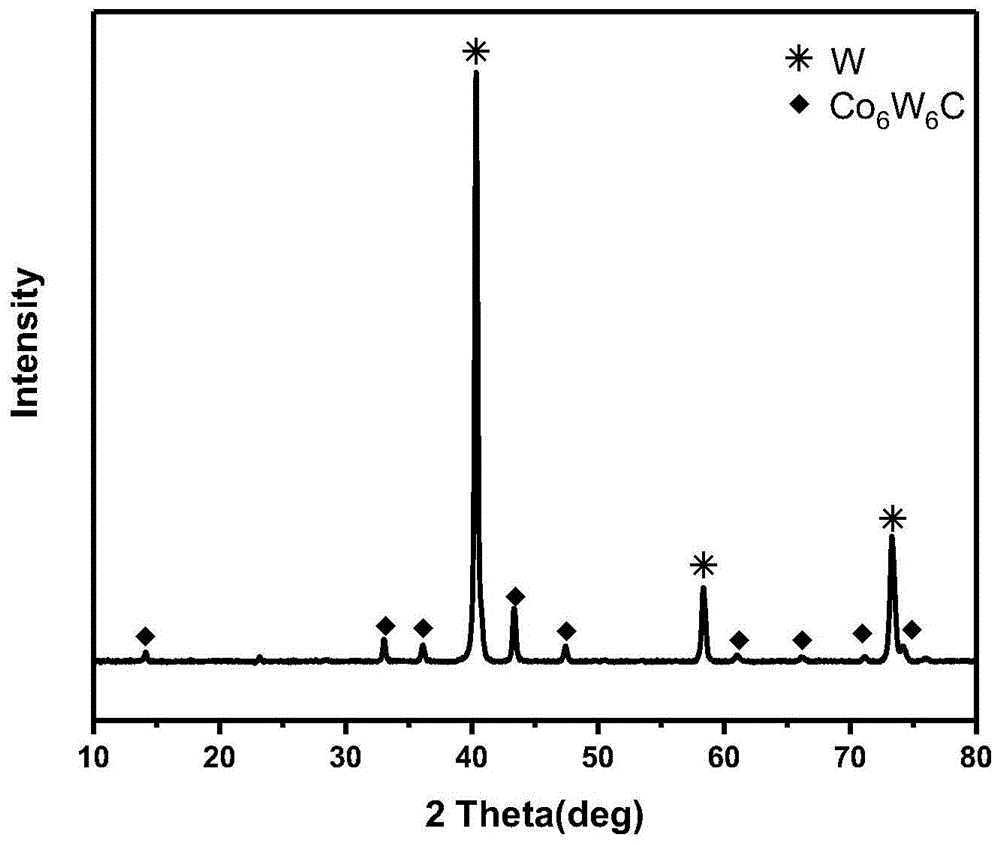
图1为实施例1样品xrd图谱;
图2为实施例1样品表面扫描电子显微镜图;
图3为实施例1样品表面透射电子显微镜图;
图4为实施例1样品在1mkoh中电化学析氢测试图;
图5为实施例1样品在1mkoh中电化学析氢稳定性测试图;
图6为实施例2样品xrd图谱;
图7为实施例3样品xrd图谱;
图8为实施例4样品xrd图谱。
(五)具体实施方式
下面通过具体实施例对本发明作进一步的描述,但本发明的保护范围并不仅限于此。
实施例1
将杂钨酸na10[co4(h2o)2(pw9o34)2]·27h2o(0.54g,0.1mmol)溶于去离子水(30ml),得到杂钨酸溶液;将十八烷基三甲基氯化铵(0.7g,2.01mmol)溶于去离子水(10ml),得到有机胺溶液;搅拌条件下,将杂钨酸溶液滴加至有机胺溶液中,滴完后继续搅拌1h,之后离心,去离子水洗涤,干燥,得到前驱体固体粉末,研磨后储存于干燥器中备用;
将前驱体固体粉末平铺于瓷舟内,将瓷舟放置于石英舟内,将石英舟放置于管式炉中进行程序升温煅烧,所述煅烧的程序为:首先在n2气氛下,以2℃/min的升温速率从室温升至410℃并保温1h;再于n2:h2=85:15、h2流速在15ml/min的气氛下,以5℃/min的升温速率升至750℃并保温3h;最后在n2气氛下冷却至室温,取出瓷舟收集其中的黑色粉末。
实施例2
将杂钨酸na10[co4(h2o)2(pw9o34)2]·27h2o(0.54g,0.1mmol)溶于去离子水(30ml),得到杂钨酸溶液;将十八烷基三甲基氯化铵(0.7g,2.01mmol)溶于去离子水(10ml),得到有机胺溶液;搅拌条件下,将杂钨酸溶液滴加至有机胺溶液中,滴完后继续搅拌1h,之后离心,去离子水洗涤,干燥,得到前驱体固体粉末,研磨后储存于干燥器中备用;
将前驱体固体粉末平铺于瓷舟内,将瓷舟放置于石英舟内,将石英舟放置于管式炉中进行程序升温煅烧,所述煅烧的程序为:首先在n2气氛下,以2℃/min的升温速率从室温升至410℃并保温1h;再于n2:h2=90:10、h2流速在10ml/min的气氛下,以5℃/min的升温速率升至750℃并保温3h;最后在n2气氛下冷却至室温,取出瓷舟收集其中的黑色粉末。
实施例3
将杂钨酸na10[co4(h2o)2(pw9o34)2]·27h2o(1.08g,0.2mmol)溶于去离子水(40ml),得到杂钨酸溶液;将十八烷基三甲基氯化铵(1.4g,4.02mol)溶于去离子水(20ml),得到有机胺溶液;搅拌条件下,将杂钨酸溶液滴加至有机胺溶液中,滴完后继续搅拌1h,之后离心,去离子水洗涤,干燥,得到前驱体固体粉末,研磨后储存于干燥器中备用;
将前驱体固体粉末平铺于瓷舟内,将瓷舟放置于石英舟内,将石英舟放置于管式炉中进行程序升温煅烧,所述煅烧的程序为:首先在n2气氛下,以2℃/min的升温速率从室温升至410℃并保温1h;再于n2:h2=95:5、h2流速在5ml/min的气氛下,以5℃/min的升温速率升至750℃并保温3h;最后在n2气氛下冷却至室温,取出瓷舟收集其中的黑色粉末。
实施例4
将杂钨酸na10[co4(h2o)2(pw9o34)2]·27h2o(1.08g,0.2mmol)溶于去离子水(40ml),得到杂钨酸溶液;将十八烷基三甲基氯化铵(1.4g,4.02mmol)溶于去离子水(20ml),得到有机胺溶液;搅拌条件下,将杂钨酸溶液滴加至有机胺溶液中,滴完后继续搅拌1h,之后离心,去离子水洗涤,干燥,得到前驱体固体粉末,研磨后储存于干燥器中备用;
将前驱体固体粉末平铺于瓷舟内,将瓷舟放置于石英舟内,将石英舟放置于管式炉中进行程序升温煅烧,所述煅烧的程序为:首先在n2气氛下,以2℃/min的升温速率从室温升至410℃并保温1h;再于n2:h2=90:10、h2流速在10ml/min的气氛下,以5℃/min的升温速率升至800℃并保温3h;最后在n2气氛下冷却至室温,取出瓷舟收集其中的黑色粉末。
对比例
据文献(three-dimensionalhollowporousco6mo6cnanoframeasanhighlyactiveanddurableelectrocatalystforwatersplitting)可知,co6mo6c-g的合成需要三步完成,第一,将na3co(no2)60.5h2o、(nh4)6mo7o244h2o与go分散液混合搅拌,将上述溶液通过旋转蒸发仪干燥得到前驱体;第二,将前驱体在氩气保护气氛下在900℃下高温煅烧两小时;第三,将得到的固体粉末置于5mol/lhcl中后处理得到最终产品。以上合成步骤复杂且需要高温条件煅烧,后处理则还需要用到hcl,相对较危险。相较于产品性能来说,此样品只在酸性体系下具有较好的电催化析氢性能,在碱性体系下则不太理想。本发明制备的双金属碳化物在碱性体系下则具有非常优秀的电催化性能,在10macm-2仅需要85mv。
电解水析氢性能,达到10macm-2的电流密度下仅需要85mv,相较于w(486mv)有很大程度的提升且非常接近于20%pt/c,并且经过4000圈cv测试性能稳定,在20macm-2的电流密度下可稳定析氢15h以上。
以上所述仅为本发明的优选实施例,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!