仿贝壳结构织构生物陶瓷及制备方法和其在成骨方面的应用
本发明涉及一种仿贝壳结构织构生物陶瓷及制备方法和其在成骨方面的应用,属生物材料领域。
背景技术:
大自然存在大量无机织构结构,例如骨骼、牙齿、贝壳等。上述天然材料由于具有织构结构而具备人工材料无可比拟的优异特性。近年来一系列织构陶瓷的制备方法被提出。其中,冰模板法易于进行层状结构的制备与微观调控,但是冰晶生长限制织构在纳米尺度范围内的调控,也难以制得宏观尺寸材料;陶瓷自组装虽然可以实现大尺寸织构陶瓷复合物的制备,但是该方法需要利用陶瓷片的取向特性,故该方法仅适用于二维陶瓷片。
技术实现要素:
针对上述问题,本发明提供一种仿贝壳结构织构生物陶瓷及制备方法和其在成骨方面的应用。所述仿贝壳结构织构生物陶瓷模拟天然骨的织构结构和生长,能够实现陶瓷结构纳米级别的精细调控,有望用于多种陶瓷织构结构的制备。
第一方面,本发明提供一种仿贝壳结构织构生物陶瓷。所述仿贝壳结构织构生物陶瓷具有每层由石墨烯与基体陶瓷交替排列形成的层状结构;所述基体陶瓷为羟基磷灰石、氧化铝、氧化锆中、钛酸钡的至少一种。其中,石墨烯占仿贝壳结构织构生物陶瓷的质量百分比为0.5-30%。石墨烯的含量控制在上述范围内,可以避免石墨烯团聚导致由于石墨烯分布不均匀使得织构陶瓷的力学性能下降,也可以防止石墨烯含量过低而无法充分发挥基体陶瓷的负载作用从而无法形成层状的织构结构。石墨烯占仿贝壳结构织构生物陶瓷的质量百分比优选为0.5-3%。
较佳地,所述层状结构为双层或者双层以上结构,优选为双层结构。层状结构能够使得材料在断裂时出现更长的断裂路径,从而产生更大的能量吸收,进而利于应力分散,以提升仿贝壳结构织构生物陶瓷的力学性能,尤其是抗弯强度、断裂功和断裂韧性。
较佳地,层状结构的每层厚度为200nm-1μm。层厚控制在上述范围内,可以促使仿贝壳结构织构生物陶瓷由脆性断裂向韧性断裂转变,断裂路径延长,裂纹偏转延伸增大,断裂处吸收更多的能量。以上均利于仿贝壳结构织构生物陶瓷的力学性能提升。
本发明的仿贝壳结构织构生物陶瓷不仅具有取向分布的织构形貌还具有适宜的晶体学取向。所述仿贝壳结构织构生物陶瓷的001取向为沿着石墨烯片层的方向。
较佳地,所述仿贝壳结构织构生物陶瓷的抗弯强度为30-170mpa,杨氏模量为7-22gpa,断裂功为50-600j·m-2,断裂韧性为1-2.3mpa·m1/2。
第二方面,本发明提供上述任一项所述的仿贝壳结构织构生物陶瓷的制备方法。所述制备方法包括以下步骤:
(1)制备前驱体浆料:将至少包含基体陶瓷的金属源与石墨烯的碱性溶液在室温搅拌反应进行矿化以形成前驱体浆料;
(2)抽滤自组装:以层状微孔滤膜作为抽滤膜,将前驱体浆料经过抽滤形成坯体;
(3)烧结:将坯体干燥后烧结以获得所述仿贝壳结构织构生物陶瓷。
较佳地,步骤(1)中,所述基体陶瓷的金属源包括钙的无机盐、铝的无机盐、锆的无机盐、钛的无机盐、钡的无机盐和所述无机盐对应水合物中的至少一种。
较佳地,碱性溶液的ph值为9-11;优选地,石墨烯与基体陶瓷的金属源的质量比为1:(5-80);更优选地,所述碱性溶液还包括壳聚糖,其中石墨烯与壳聚糖的质量比为1:(1-2)。
较佳地,步骤(3)中,所述烧结为放电等离子烧结,最高烧结温度为600-1200℃,烧结压力为10-40mpa,烧结时间为5-10min。
第三方面,本发明提供上述任一项所述的仿贝壳结构织构生物陶瓷在成骨方面的应用。
附图说明
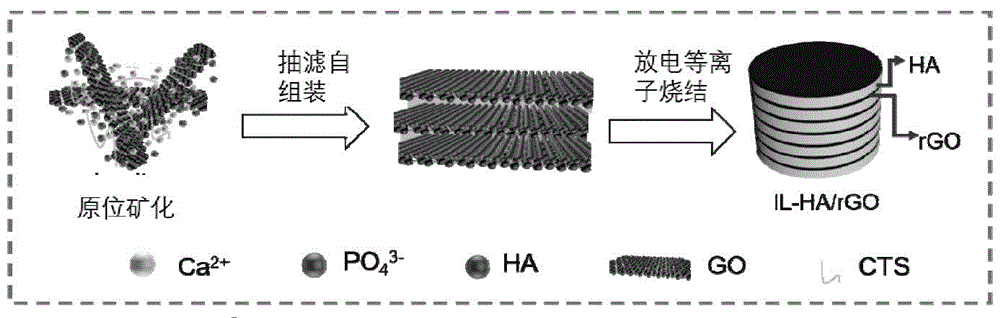
图1是本发明一实施方式羟基磷灰石织构生物陶瓷的制备流程图;
图2中的(a)为天然贝壳的扫描电镜图,(b)为仿贝壳结构织构生物陶瓷(il-85%ha/rgo)的低倍数扫描电镜图,(c)为仿贝壳结构织构生物陶瓷(il-85%ha/rgo)的高倍数扫描电镜图,(d)为仿贝壳结构织构生物陶瓷(il-85%ha/rgo)的透射式电子背散射衍射图(t-ebsd),(e)为织构生物陶瓷(il-85%ha/rgo)的反极图,(f)为织构氧化铝生物陶瓷的扫描电镜图,(g)为织构氧化锆生物陶瓷的扫描电镜图,(h)为织构钛酸钡生物陶瓷的扫描电镜图;
图3中的(a)、(b)、(c)、(d)、(e)、(f)是织构羟基磷灰石生物陶瓷的扫描电镜图,羟基磷灰石的含量分别为70%、80%、85%、90%、97.5%、100%;(g)、(h)、(i)、(j)、(k)、(l)分别是(a)、(b)、(c)、(d)、(e)、(f)的放大倍数图像;(m)、(n)、(o)、(p)、(q)、(r)是非原位织构羟基磷灰石生物陶瓷的扫描电镜图,羟基磷灰石含量分别为70%、80%、90%、97.5%、100%;(s)、(t)、(u)、(v)、(w)、(x)分别是(m)、(n)、(o)、(p)、(q)、(r)的放大倍数图像;
图4为无序原位羟基磷灰石非织构陶瓷(id-ha/rgo)、仿贝壳结构羟基磷灰石织构生物陶瓷(即原位羟基磷灰石织构陶瓷,il-ha/rgo)、非原位羟基磷灰石织构陶瓷(el-ha/rgo)的力学性能对比;(a)是抗弯强度和杨氏模量,(b)是断裂韧性和断裂功;1代表id-97.5%ha/rgo,2代表il-80%ha/rgo,3代表il-85%ha/rgo,4代表il-90%ha/rgo,5代表il-97.5%ha/rgo,6代表i-100%ha,7代表el-80%ha/rgo,8代表el-85%ha/rgo,9代表el-90%ha/rgo,10代表el-97.5%ha/rgo,11代表e-100%ha,其中的百分比对应ha(羟基磷灰石)在材料中的质量分数;
图5是无序原位羟基磷灰石非织构陶瓷(id-ha/rgo)、仿贝壳结构羟基磷灰石织构生物陶瓷(即原位羟基磷灰石织构陶瓷,il-ha/rgo)、非原位羟基磷灰石织构陶瓷(el-ha/rgo)的抗弯应力应变曲线,其中百分比对应ha(羟基磷灰石)在材料中的质量分数;
图6中的(a)是传统植入材料(磷酸钙、生物玻璃、羟基磷灰石、有机玻璃、皮质骨、镁黄长石、皮质骨和钛合金)与本发明的仿贝壳结构羟基磷灰石织构生物陶瓷的抗弯强度和杨氏模量对比,(b)是不同羟基磷灰石基材料的力学性能和织构生物陶瓷人工骨性能的比较;其中ha/cf是羟基磷灰石/碳纤维,ha/cnt是羟基磷灰石/碳纳米管,ha/go是羟基磷灰石/氧化石墨,ha/2%bnnp是羟基磷灰石/2%纳米氮化硼纳米片,ha/5%tio2是羟基磷灰石/5%二氧化钛,ha/40%catio3是羟基磷灰石/40%钛酸钙,ha/10%al2o3是羟基磷灰石/10%氧化铝,ha/15%al2o3-zro2是羟基磷灰石/15%氧化铝-氧化锆,ha/uhmwpe是羟基磷灰石/超高分子量聚乙烯,ha/peek是羟基磷灰石/聚醚醚酮,ha/collagen是羟基磷灰石/胶原,ha/hpmc是羟基磷灰石/羟丙基甲基纤维素,nanoha是纳米羟基磷灰石;
图7是不同生物陶瓷的表面扫描电镜图以及与人间充质干细胞共培养细胞生长情况;(a)是i-100%ha陶瓷表面,(b)是细胞在i-100%ha培养生长示意图,(c)是细胞在i-100%ha材料上培养3天后的扫描电镜图像的低倍数图像,(d)为细胞在i-100%ha材料上培养3天后的扫描电镜图像的高倍数图像,(e)是细胞(绿色)在i-100%ha材料上培养3天后的共聚焦显微镜图像;(f)是id-97.5%ha/rgo陶瓷表面,(g)是细胞在id-97.5%ha/rgo培养生长示意图,(h)是细胞在id-97.5%ha/rgo材料上培养3天后的扫描电镜图像的低倍数图像,(i)为细胞在id-97.5%ha/rgo材料上培养3天后的扫描电镜图像的高倍数图像,(j)是细胞(绿色)在id-97.5%ha/rgo材料上培养3天后的共聚焦显微镜图像;(k)是il-97.5%ha/rgo陶瓷表面,(l)是细胞在il-97.5%ha/rgo培养生长示意图,(m)是细胞在il-97.5%ha/rgo材料上培养3天后的扫描电镜图像的低倍数图像,(n)为细胞在il-97.5%ha/rgo材料上培养3天后的扫描电镜图像的高倍数图像,(o)是细胞(绿色)在il-97.5%ha/rgo材料上培养3天后的共聚焦显微镜图像;
图8中的(a)是空白样、i-100%ha、id-97.5%ha/rgo和il-97.5%ha/rgo的表面细胞增殖情况,(b)是空白样、i-100%ha、id-97.5%ha/rgo和il-97.5%ha/rgo的成骨相关基因表达情况;
图9是兔子体内股骨植入的模型示意图;
图10是在兔子体内股骨植入人工骨三个月后的成骨情况ct分析数据;(a1)为空白组的二维图像的横切面,(a2)为空白组的二维图像的纵切面,(a3)为空白组的三维图像的横切面,(a4)为空白组的三维图像的纵切面,(b1)为植入i-100%ha的二维图像的横切面,(b2)为植入i-100%ha的二维图像的纵切面,(b3)为植入i-100%ha的三维图像的横切面,(b4)为植入i-100%ha的三维图像的纵切面,(c1)为植入id-97.5%ha/rgo的二维图像的横切面,(c2)为植入id-97.5%ha/rgo的二维图像的纵切面,(c3)为植入id-97.5%ha/rgo的三维图像的横切面,(c4)为植入id-97.5%ha/rgo的三维图像的纵切面,(d1)为植入il-97.5%ha/rgo的二维图像的横切面,(d2)为植入il-97.5%ha/rgo的二维图像的纵切面,(d3)为植入il-97.5%ha/rgo的三维图像的横切面,(d4)为植入il-97.5%ha/rgo的三维图像的纵切面;
图11是为空白样、i-100%ha、id-97.5%ha/rgo和il-97.5%ha/rgo的ct对成骨量的定量统计;
图12是空白样、i-100%ha、id-97.5%ha/rgo和il-97.5%ha/rgo的切片染色结果;其中(a)、(c)、(e)、(g)为低倍数图像,(b)、(d)、(f)、(h)为高倍数图像。
具体实施方式
通过下述实施方式进一步说明本发明,应理解,下述实施方式仅用于说明本发明,而非限制本发明。在没有特殊说明的情况下,各百分含量指质量百分含量。
本发明提出一种仿贝壳结构织构生物陶瓷。所述仿贝壳结构织构生物陶瓷具有每层由石墨烯与基体陶瓷交替排列形成的层状结构。所述仿贝壳结构织构生物陶瓷(参见图2中的(b)和(c))具有与贝壳(参见图2中的(a))具有相似的织构形貌。两者的层厚度相似,均为200nm-1μm左右。另外,还可以看出石墨烯紧密复合在基体陶瓷内部。以上说明本发明的仿贝壳结构织构生物陶瓷实现层厚在纳米级别的精确调控,这利于改善仿贝壳织构陶瓷的性能。图2中的(e)可以看出羟基磷灰石的001方向为石墨烯层的排列方向。上述晶体取向织构证明本发明的生物陶瓷具有定向排列的形貌织构。即、羟基磷灰石等基体陶瓷的取向方向001方向和石墨烯的排列方向相同,由此呈现为晶体织构。
本发明还可以通过调控石墨烯占织构生物陶瓷的含量来进一步调控织构生物陶瓷的力学性能。石墨烯占仿贝壳结构织构生物陶瓷的质量百分比优选为0.5-30%,进一步优选为2.5%。一些实施方式中,所述石墨烯的片层厚度可为1-10nm。
通过体外细胞实验发现本发明的仿贝壳结构织构生物陶瓷能够诱导细胞形态,有效促进细胞的粘附增殖以及成骨基因的表达。体内动物实验发现仿贝壳结构织构生物陶瓷的骨整合性能良好,能够有效地促进成骨。综上,本发明的仿贝壳结构织构陶瓷具有承重骨的力学性能,更有利于细胞的粘附和增殖以及分化效果,具有更好的体内成骨活性,适合于大块承重骨缺损的修复。
以下示例性说明本发明所述仿贝壳结构织构生物陶瓷的制备方法。该方法利用矿化-组装-烧结的新设计,成功实现制备厚度可适应性调整的织构生物陶瓷。该织构生物陶瓷可用作人工骨,不仅具有优异的力学性能,而且具有良好的生物活性,尤其是促成骨性能。
制备前驱体浆料。将至少包含石墨烯、基体陶瓷的金属源的碱性溶液在室温搅拌反应进行矿化以形成前驱体浆料。所述基体陶瓷的金属源包括钙的无机盐、铝的无机盐、锆的无机盐、钛的无机盐、钡的无机盐和所述无机盐对应水合物中的至少一种。所述碱性溶液还可以进一步包含壳聚糖,以增加石墨烯的矿化点位。
当以羟基磷灰石为基体陶瓷时,具体操作为:将石墨烯的水分散液(1-3mg/ml)与四水硝酸钙混合、溶解20-50min,作为前驱体溶液a。其中,石墨烯和硝酸钙的质量比为1:(5-80)。将壳聚糖的乙酸溶液(1-5mg/ml)与磷酸二氢铵混合溶解20-50min,作为前驱体溶液b。其中,壳聚糖与磷酸二氢铵的质量比为1:(2.5-40);硝酸钙与磷酸二氢铵的摩尔比为(2-10):3,进一步优选为5:3。将两种前驱体溶液混合搅拌处理2h使得充分分散,并用氨水作为ph调节剂调节ph值为9-11,在室温下充分搅拌反应5-10h,得到前驱体浆料。在该过程中,羟基磷灰石原位生成于二维石墨烯片上。
当以氧化铝或者氧化锆为基体陶瓷时,具体操作为:将石墨烯的水分散液(1mg/ml)与氯化铝或者氯化锆混合并搅拌30min,在该混合溶液中加入壳聚糖的乙酸溶液(1-5mg/ml)并搅拌溶解30min使得充分分散,随后继续加入氨水,在室温充分搅拌反应10h以形成前驱体浆料。其中,石墨烯和氯化铝或者氯化锆的质量比为1:(5-80),石墨烯和壳聚糖的质量比为(0.5-1.5):1。
当以钛酸钡为基体陶瓷时,具体操作为:氯化钛在低温下加入到石墨烯/壳聚糖溶液中水解得到tiocl2混合溶液,之后将二水合氯化钡与之混合得到混合液。将反应液加热到80℃加入naoh调节ph为13,搅拌反应2h以形成前驱体浆料。其中,石墨烯和钛酸钡的质量比为1:(5-80),石墨烯和壳聚糖的质量比为(0.5-1.5):1。
将前驱体浆料于空气湿度50%的环境中,采用双层微孔滤膜抽滤瓶进行抽滤处理24h,得到坯体。该坯体为石墨烯、基体陶瓷和壳聚糖的复合坯体。复合坯体可为块状。抽滤压力为0.03-0.05kpa。将坯体干燥以除去水分。例如将坯体于60℃烘箱干燥2-6h,优选为5h。
将坯体烧结得到仿贝壳结构织构陶瓷。烧结的目的是提高基体陶瓷的结晶度。烧结方式包括但不限于热压烧结、等静压烧结、放电等离子烧结中的一种。优选为放电等离子烧结。最高烧结温度为600-1200℃,烧结压力为10-40mpa,烧结时间为5-10min。
本发明的制备方法首选通过原位合成将羟基磷灰石等基体陶瓷均匀负载于石墨烯上,然后利用石墨烯的二维特性,使得负载基体陶瓷的石墨烯在抽滤的单方向作用下形成定向排列的织构特征。不仅如此,石墨烯表面有大量羟基,还还可以通过壳聚糖在石墨烯表面引入更多羟基,上述羟基基团作为陶瓷矿化位点,促进基体陶瓷在石墨烯表面矿化。以上均利于本发明生物陶瓷的力学性能和生物性能的提升。尤其是羟基磷灰石等基体陶瓷在壳聚糖等有机物上的生长存在取向即001方向取向生长,在自组装过程中,使得壳聚糖携带的羟基磷灰石等基体陶瓷发生了定向排列,从而导致了羟基磷灰石等基体陶瓷的取向方向001方向和石墨烯的排列方向相同,由此呈现为晶体织构。
下面进一步例举实施例以详细说明本发明。同样应理解,以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容作出的一些非本质的改进和调整均属于本发明的保护范围。下述示例具体的工艺参数等也仅是合适范围中的一个示例,即本领域技术人员可以通过本文的说明做合适的范围内选择,而并非要限定于下文示例的具体数值。
实施例1
将石墨烯的水分散液(1mg/ml)与四水硝酸钙混合并搅拌30min,作为前驱体溶液a。石墨烯和四水硝酸钙的质量比为1:(5-80)。将壳聚糖的乙酸溶液(1-5mg/ml)与磷酸二氢铵搅拌溶解30min,作为前驱体溶液b。壳聚糖和磷酸二氢铵的质量比为1:(2.5-40)。将两种前驱体溶液搅拌处理2h使得充分分散,并用氨水调节其ph值为9-11,在室温充分搅拌反应10h以形成前驱体浆料。将所述浆料于空气湿度50%的环境中,采用双层微孔滤膜抽滤瓶抽滤24h后,置于60℃烘箱干燥5h获得坯体。将坯体置于放电等离子烧结设备中烧结。烧结程序为:第一阶段以100℃/min升温至300℃,此时不施加加压力,第二阶段以20℃/min从300℃升温至600℃,第三阶段以100℃/min从600℃升温至800℃,第四阶段开始逐渐增加压力,以100℃/min从800℃升温至950℃,在950℃时压力增至40mpa,并在950℃保温保压5min,烧结结束后室温冷却。采用与此相同的方法,仅调控反应体系中硝酸钙与磷酸氢二铵加入量,获得分别标记为il-70%ha/rgo、il-80%ha/rgo、il-85%ha/rgo、il-90%ha/rgo、il-97.5%ha/rgo的织构羟基磷灰石生物陶瓷。
实施例2
将石墨烯的水分散液(1mg/ml)与氯化铝混合并搅拌30min,石墨烯和氯化铝的质量比为1:(5-80)。在混合溶液中加入壳聚糖乙酸溶液(1-5mg/ml)并搅拌溶解30min使得充分分散,随后继续加入氨水作为反应物,氯化铝与氨水的摩尔比为1:3,在室温充分搅拌反应10h以形成前驱体浆料。将所述浆料于空气湿度50%的环境中,采用双层微孔滤膜抽滤瓶抽滤24h后,置于60℃烘箱干燥5h获得坯体。将坯体置于放电等离子烧结设备中烧结。烧结程序为:第一阶段以100℃/min升温至300℃,此时不施加加压力,第二阶段以20℃/min从300℃升温至600℃,第三阶段以100℃/min从600℃升温至1100℃,第四阶段开始逐渐增加压力,以100℃/min从1100℃升温至1200℃,在1200℃时压力增至40mpa,并在1200℃保温保压5min,烧结结束后室温冷却。
实施例3
将石墨烯的水分散液(1mg/ml)与氯化锆混合并搅拌30min,石墨烯和氯化锆的质量比为1:(5-80),在该混合溶液中加入壳聚糖的乙酸溶液(1-5mg/ml)并搅拌溶解30min使得充分分散,随后继续加入氨水作为反应物,氯化锆与氨水摩尔比为1:4,在室温充分搅拌反应10h以形成前驱体浆料。将所述浆料于空气湿度50%的环境中,采用双层微孔滤膜抽滤瓶抽滤24h后,置于60℃烘箱干燥5h,获得坯体。将坯体置于放电等离子烧结设备中烧结。烧结程序为:第一阶段以100℃/min升温至300℃,第二阶段以20℃/min从300℃升温至600℃,第三阶段以100℃/min从600℃升温至1100℃,第四阶段开始逐渐增加压力,以100℃/min从1100℃升温至1250℃,在1250℃时压力增至40mpa,并在1250℃保温保压5min,烧结结束后室温冷却。
实施例4
将石墨烯的水分散液(1mg/ml)与壳聚糖的乙酸溶液(1-5mg/ml)搅拌溶解30min使得充分分。ticl4在低温(0℃)下加入到石墨烯/壳聚糖溶液中水解得到tiocl2混合溶液,之后将bacl2·2h2o与之混合得到混合液。将反应液加热到80℃加入naoh调节ph为13,搅拌反应2h形成前驱体浆料。将所述浆料于空气湿度50%的环境中,采用双层微孔滤膜抽滤瓶抽滤24h后,置于60℃烘箱干燥5h,获得坯体。将坯体置于放电等离子烧结设备中烧结。烧结程序为:第一阶段以100℃/min升温至300℃,第二阶段以20℃/min从300℃升温至600℃,第三阶段以100℃/min从600℃升温至800℃,第四阶段开始逐渐增加压力,以100℃/min从800℃升温至1000℃,在1000℃时压力增至40mpa,并在1000℃保温保压5min,烧结结束后室温冷却。
对比例1
i-100%ha的制备:将水与四水硝酸钙混合并搅拌30min,作为前驱体溶液a。将壳聚糖的乙酸溶液(1-5mg/ml)与磷酸二氢铵搅拌溶解30min,作为前驱体溶液b。壳聚糖和磷酸二氢铵的质量比为1:(2.5-40)。将两种前驱体溶液搅拌处理2h使得充分分散,并用氨水调节其ph值为9-11,在室温充分搅拌反应10h以形成前驱体浆料。将所述浆料于空气湿度50%的环境中,采用双层微孔滤膜抽滤瓶抽滤24h后,置于60℃烘箱干燥5h获得坯体。将坯体置于放电等离子烧结设备中烧结。烧结程序为:第一阶段以100℃/min升温至300℃,此时不施加加压力,第二阶段以20℃/min从300℃升温至600℃,第三阶段以100℃/min从600℃升温至800℃,第四阶段开始逐渐增加压力,以100℃/min从800℃升温至950℃,在950℃时压力增至40mpa,并在950℃保温保压5min,烧结结束后室温冷却。
对比例2
无序原位非织构陶瓷(id-ha/rgo)的制备:将石墨烯的水分散液(1mg/ml)与四水硝酸钙混合并搅拌30min,作为前驱体溶液a。石墨烯和四水硝酸钙的质量比为1:(5-80)。将壳聚糖的乙酸溶液(1-5mg/ml)与磷酸二氢铵搅拌溶解30min,作为前驱体溶液b。壳聚糖和磷酸二氢铵的质量比为1:(2.5-40)。将两种前驱体溶液搅拌处理2h使得充分分散,并用氨水调节其ph值为9-11,在室温充分搅拌反应10h以形成前驱体浆料。将所述浆料放置在-80℃冰箱进行冷冻,之后进行冷冻干燥处理,得到ha、go、壳聚糖的混合粉体。将混合粉体置于放电等离子烧结设备中烧结。烧结程序为:第一阶段以100℃/min升温至300℃,此时不施加加压力,第二阶段以20℃/min从300℃升温至600℃,第三阶段以100℃/min从600℃升温至800℃,第四阶段开始逐渐增加压力,以100℃/min从800℃升温至950℃,在950℃时压力增至40mpa,并在950℃保温保压5min,烧结结束后室温冷却。
对比例3
非原位织构陶瓷(el-ha/rgo)的制备:将石墨烯的水分散液(1mg/ml)与羟基磷灰石粉体混合并搅拌30min,作为前驱体溶液a。石墨烯和羟基磷灰石粉体的质量比为1:(2.3-39)。将壳聚糖的乙酸溶液(1-5mg/ml)作为前驱体溶液b。壳聚糖和羟基磷灰石粉体的质量比为1:(1.15-19.5)。将两种前驱体溶液搅拌处理2h使得充分分散,并用氨水调节其ph值为9-11,在室温充分搅拌反应10h以形成前驱体浆料。将所述浆料于空气湿度50%的环境中,采用双层微孔滤膜抽滤瓶抽滤24h后,置于60℃烘箱干燥5h获得坯体。将坯体置于放电等离子烧结设备中烧结。烧结程序为:第一阶段以100℃/min升温至300℃,此时不施加加压力,第二阶段以20℃/min从300℃升温至600℃,第三阶段以100℃/min从600℃升温至800℃,第四阶段开始逐渐增加压力,以100℃/min从800℃升温至950℃,在950℃时压力增至40mpa,并在950℃保温保压5min,烧结结束后室温冷却。
织构生物陶瓷人工骨的性能评价,包括力学性能、体外生物活性、动物体内成骨性。通过sem对仿贝壳织构陶瓷的形貌结构进行表征。
从图2看出本发明制备出的织构生物陶瓷与贝壳结构相似,都具有层状结构和晶体学织构,且层厚在1μm左右。
从图3看出通过改变矿化液中无机物的含量可以制备出不同结构的织构生物陶瓷。力学性能评价表明织构结构有利于材料力学性能的提升。
其中仿贝壳织构生物陶瓷进行抗弯强度和断裂韧性评价。力学测试在万能试验机上(instron-5566,usa)进行。采用三点抗弯测试获得抗弯强度、杨氏模量、断裂功。样品的尺寸为3×3×15mm,加载的速度为0.5mmmin-1,跨距为10mm。应力应变曲线最高值为最终的强度,斜率代表模量、单位断裂面积下应力应变曲线积分面积为断裂功(公式1)。其中,r代表断裂功,u以及a分别代表应力应变曲线下的面积以及试样断裂面积。
通过单缺口弯曲测试(senb)对于断裂韧性测试。首先在垂直于层方向利用切刀形成1.5mm深的缺口,之后利用剃须刀片在缺口上形成小裂口以制备试样。断裂韧性(kic)的计算公式如下公式(2)(3):
其中pic代表断裂过程最大的力,s代表跨距,b,w以及a分别指的是厚度、宽度以及样品开槽深度。
从图4可以看出,当织构生物陶瓷中羟基磷灰石的含量为97.5wt%,织构陶瓷抗弯强度以及断裂韧性较高。
从图5可以看出具有织构结构的材料在受力时具有更大的应变。
从图6可以看出本发明的织构生物陶瓷人工骨相较于ha材料拥有更好的力学性能,并且其相较于传统的植入材料拥有和骨相更加匹配的力学特性。
织构生物陶瓷人工骨与兔子骨髓基质干细胞的相互作用
为了探究织构人工骨的生物活性,将人骨髓间充质干细胞(hbmscs)分别接种到i-100%ha、id-97.5%ha/rgo、il-97.5%ha/rgo表面3天,以探究材料的细胞相容性。细胞接种在48孔板当中数量为2×104/孔。培养结束后进行sem观察,利用质量百分数4%的戊二醛溶液进行固定1h之后,再进行体积百分数30%、50%、60%、70%、80%、90%、95%、100%的乙醇水溶液进行梯度脱水,最后再利用六甲基二硅氮烷进行干燥处理。最后进行共聚焦显微镜观察:首先将细胞利用质量百分数4wt%多聚甲醛固定30min,之后进行细胞骨架染色;利用硫氰酸荧光素(fitc)染细胞质20min,然后吸出fitc染料利用pbs溶液清洗3次,每次清洗时间为5min;清洗结束后将pbs吸出;再进行细胞核染色利用4',6-二脒基-2-苯基吲哚(dapi)进行细胞染色5min,结束之后进行pbs溶液清洗,清洗3次,每次清洗时间为5min;清洗结束后利用激光共聚焦显微镜进行观察。
为了探究细胞在材料上的增殖活性,将hbmscs分别接种在不同的材料i-100%ha、id-97.5%ha/rgo、il-97.5%ha/rgo上,分别检测1天、4天、7天的细胞数量。使用cck8法,具体步骤为:在培养结束后,于培养板孔中加入cck8溶液(培养基:cck8的体积比=10:1)使其浸没过材料;之后在培养基中孵育4h,,孵育完成后从每孔中吸取100μl上清液到96孔板中,转移途中不要产生气泡;最后采用酶标仪在450nm波长处测量吸光度(od值)。od值大小则定性地反映细胞的数量。
探究织构人工骨促进hbmscs向成骨方向分化的能力。将hbmscs分别接种在100%ha、id-97.5%ha/rgo、il-97.5%ha/rgo三种材料上7天后,利用trizol试剂(invitrogenptyltd,australia)提取出rna,之后利用实时定量聚合物链反应技术(rt-qpcr)测量成骨基因(runx2、bmp-2、col-1、ocn)表达情况。
将骨髓基质细胞种分别接种(密度为20000/孔)在纯羟基磷灰石陶瓷(i-100%ha)、无序非织构生物陶瓷(id-97.5%ha/rgo)和织构生物陶瓷人工骨(il-97.5%ha/rgo)上,培养3天后用扫描电镜观察细胞的形貌,并采用cck8法检测细胞1、4、7天的增殖能力。通过rt-pcr测试骨髓基质干细胞在陶瓷支架上及支架浸提液内的基因表达。
从图7可以看出织构结构能够显著拉长细胞骨架,重排细胞方向。
从图8可以看出骨髓基质干细胞能够在四种支架材料上进行很好得黏附和增殖。织构生物陶瓷人工骨相较于纯羟基磷灰石陶瓷以及无序非织构生物陶瓷,织构结构有利于细胞的重排并拉长细胞骨架,更能促进骨髓基质干细胞的成骨相关的基因表达。说明织构生物陶瓷具有很好的诱导骨髓基质干细胞的成骨分化能力。
以上可知织构生物陶瓷具有优异的体内外成骨活性,以及因而具备促进体内成骨的能力。
评价织构生物陶瓷人工骨在动物体内的成骨与骨整合能力。将尺寸
- 还没有人留言评论。精彩留言会获得点赞!