一种通过玻璃管尖端内壁硅烷化形成稳定的微纳米液/液界面的方法
1321.)。而且,使用aptes的甲苯溶液灌注-离心-硅烷化的制备方法存在操作困难,试剂毒性较大,可控性及重复性较差等问题。华中科技大学的陈威小组4,5使用不同浓度和不同比例的aptes和[(3-三乙氧基硅基)丙基]琥珀酸酐(tesp-sa)的乙醇溶液,在室温下对纳米玻璃管进行一定时间的硅烷化(liu,g.-c.;gao,m.-j.;chen,w.;hu,x.-y.;song,l.-b.;liu,b.;zhao,y.-d.,ph-modulatedion-current rectification in a cysteine-functionalized glass nanopipette.electrochemistry communications 2018,97,6-10.liu,g.-c.;chen,w.;gao,m.-j.;song,l.-b.;hu,x.-y.;zhao,y.-d.,ion-current-rectification-based customizable ph response in glass nanopipettes via silanization.electrochemistry communications 2018,93,95-99.)。相较于pourmand小组,陈威小组使用的试剂毒性更小,但是功能化玻璃的化学反应更复杂,存在成功率不高等问题。美国uiuc的mei shen小组6使用化学气相沉积的方法将三甲基氯硅烷(tmcs)接枝到纳米玻璃管的内壁上,使其实现疏水化(colombo,m.l.;sweedler,j.v.;shen,m.,nanopipet-based liquid-liquid interface probes for the electrochemical detection of acetylcholine,tryptamine,and serotonin via ionic transfer.anal chem 2015,87(10),5095-100.)。但该方法所采用的装置较复杂,也无法防止玻璃管外壁被硅烷化。
[0006]
因此,有必要提供一种使用试剂毒性小,制备方法简单,对仪器设备要求不高,且成功率也高的微纳米玻璃管内壁硅烷化方法。
技术实现要素:
[0007]
为了克服上述现有技术的不足,本发明提出了一种通过玻璃管尖端内壁硅烷化形成稳定的微纳米液/液界面的方法,仅需硅烷化玻璃管尖端部分的内壁即可达到良好的疏水效果,所需设备简单,原料廉价易得,低毒,操作简单快速。
[0008]
为了实现上述目的,本发明所采用的技术方案是:
[0009]
本发明提供了一种通过玻璃管尖端内壁硅烷化形成稳定的微纳米液/液界面的方法,该方法包括以下步骤:
[0010]
s1、首先用食人鱼溶液浸泡毛细玻璃管,然后用水将玻璃管冲洗至ph=7,烘干后拉制成微纳米级玻璃管电极;
[0011]
s2、将拉制好的微纳米玻璃管电极浸泡在盐酸溶液中,经冲洗、烘干后再浸泡在三甲基氯硅烷的甲醇溶液中,当观察到管尖有溶液进入时,取出微纳米玻璃管电极放置12-24h,最后用甲醇冲洗玻璃管外壁后经烘干即得。
[0012]
本发明提供一种简单快速有效地对微(纳)米级硼硅玻璃管内壁进行硅烷化处理的方法,制备疏水亲油内壁的微(纳)米玻璃管。硅烷化玻璃管的管径可控,管径为600nm~20μm,适用于液/液界面电化学测试,生物电化学微界面测试等。本发明利用盐酸做前处理,以使玻璃表面形成更高密度的羟基,以利于与三甲基氯硅烷反应,形成更多的硅氧键,从而提高硅烷化的密度,使疏水效果更好;本发明的原料廉价易得,操作简单,对设备的要求不高,有效避免了仪器搭建、操作复杂等问题。目前硅烷化微纳米玻璃管只有完全硅烷化整根玻璃管内壁的方法。与已有方法相比,本发明中的微米玻璃管仅仅需硅烷化尖端部分的内壁即可达到良好的疏水效果,并通过微型液/液界面离子转移电化学及基于微型液/液界面
的单颗粒电化学进行了验证。此外,本发明中的硅烷化方法可拓展到次微米及纳米玻璃管。
[0013]
相对于其他现有的玻璃管硅烷化技术,本发明利用了三甲基氯硅烷(tmcs)作为硅烷化试剂,相比起其他硅氧烷毒性更弱,从而降低了实验的危险性。美国uiuc的mei shen小组虽然也使用了三甲基氯硅烷进行硅烷化,但需要使用复杂的装置以实现气相化学反应,以达到硅烷化整根玻璃管内壁的效果;而本发明经研究发现,得到稳定的液/液界面的关键是玻璃管口的硅烷化,即不需要对整根玻璃管的内壁进行硅烷化。
[0014]
优选地,管尖溶液的进入高度为1cm~2cm。
[0015]
优选地,所述毛细玻璃管包括硼硅毛细玻璃管。
[0016]
优选地,三甲基氯硅烷的甲醇溶液中,三甲基氯硅烷与甲醇的体积比为1:1。
[0017]
优选地,盐酸溶液的摩尔浓度为1mol/l,盐酸溶液的浸泡时间为30-50min。
[0018]
优选地,步骤s1和s2所涉及的浸泡,均为将管尖斜30
°
向下插入溶液中。
[0019]
优选地,所述食人鱼溶液由98%浓硫酸和30%过氧化氢以3:1的体积比混配而成。
[0020]
优选地,食人鱼溶液的浸泡时间为1-3h。
[0021]
优选地,采用电热丝拉制仪或激光拉制仪拉制微纳米级玻璃管电极。
[0022]
与现有技术相比,本发明的有益效果是:
[0023]
(1)本发明提供了一种微米玻璃管尖端内壁硅烷化的制备方法,所需设备简单,原料廉价易得,低毒,操作简单快速:无需灌注及离心,只需通过简单的毛细作用即可在微米尺度把液体吸进管内一定高度进行硅烷化,也无需过多复杂的化学修饰,更无需化学气相沉积的专用设备等。
[0024]
(2)传统的微纳米玻璃管内壁硅烷化方法是硅烷化整根玻璃管的内壁,但本发明发现,实现稳定的液/液界面的只需在玻璃管的尖端内壁硅烷化即可保证水不能进入玻璃管内部,而尖端之后的玻璃管内壁即使没有被硅烷化,从玻璃管后面(非尖端)开口处灌注的有机液体也可以与管口接触的水溶液形成一个稳定的液/液界面,这从液/液界面的离子转移循环伏安图(图1-3)就能反映出来。即本发明中的玻璃管内壁硅烷化不需要对整根管子内壁进行硅烷化,只需要尖端的内壁硅烷化就可以达到疏水并实现稳定液/液界面的效果。
[0025]
(3)本发明方法可拓展到次微米及纳米玻璃管,只需在另一端(非尖端)接上负压装置(如真空泵、油泵等)即可。
[0026]
(4)本发明中得到的硅烷化微米玻璃管应用广泛,可在多种实验体系中使用,包括但不限于微纳米液/液界面,还可实现单细胞分析与成像、单颗粒计数以及电生理/神经科学研究中涉及单一实体的机理研究。
附图说明
[0027]
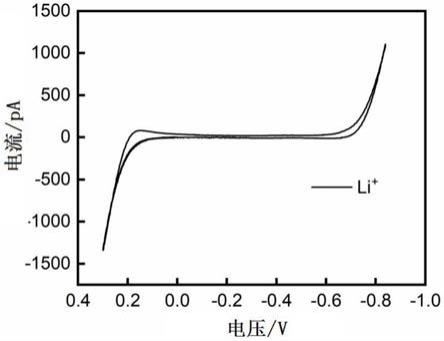
图1为微型液/液界面离子转移电化学的可极化电势窗的循环伏安曲线(cv);
[0028]
图2为微型液-液界面促k
+
转移电化学的cv;
[0029]
图3为微型液/液界面bf4-转移电化学的cv;
[0030]
图4为硅烷化微米玻璃管的微型液/液界面单颗粒碰撞电化学测量结果(a为使用cell i在
–
0.6v vs.ag/agcl下记录的代表性电流
–
时间(i
–
t)曲线;b、c分别为图a的i
–
t曲线中在115
–
170秒、140
–
146秒和152.8
–
153.4秒不同分辨率时的放大范围;d为通过电化学
碰撞获得的脂质体粒径分布(灰色直方图)和由动态光散射(dls)测量的(红线)的对比图)。
具体实施方式
[0031]
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
[0032]
下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的试验材料,如无特殊说明,均为可通过常规的商业途径购买得到。
[0033]
实施例1一种通过玻璃管尖端内壁硅烷化形成稳定的微纳米液/液界面的方法
[0034]
(1)在培养皿中用98%浓硫酸和30%过氧化氢以3:1的体积比配制食人鱼溶液(注意:食人鱼溶液具有高度腐蚀性,务必在敞口容器中加入浓硫酸后再往里缓慢滴加过氧化氢,二者混合过程会放出大量热,操作不当可能会引起爆炸);
[0035]
(2)小心地用镊子将硼硅毛细玻璃管(外径/内径=1.0mm/0.58mm,长10cm,有芯,美国sutter仪器公司)以30
°
的倾斜度插入盛有食人鱼溶液的培养皿中,待溶液快要充满内管时,轻轻地松开镊子,使整根玻璃管浸入溶液当中。
[0036]
(3)在食人鱼溶液中浸泡1h后,用镊子从培养皿中取出玻璃管,置入盛满去离子水的烧杯中浸泡后,用去离子水多次冲洗,直至冲洗玻璃管后的去离子水的ph=7时,即完成清洗,然后把玻璃管放入100℃的烘箱烘干待用。
[0037]
(4)拉制微米玻璃管:拉制采用日本产pc-100电热丝拉制仪(narishige instrument)进行,将步骤(3)的硼硅毛细玻璃管放入pc-100加热室内,使其处于电热丝的中央,并使电热丝刚好处于玻璃管长度的中间位置,保证受热均匀和重复性。然后进行以下操作:
[0038]
①
首次设置1号加热器(no.1heater)的数值为50,点击“start”拉制,此时玻璃管融化但没被拉开;
[0039]
②
然后设置1号加热器(no.1heater)的数值为47,点击“start”拉制,如此重复3-4次步骤
②
,即可拉断,制备出两根几乎一样的微米玻璃管,待用。注:也可以使用p-97电热丝拉制仪/p-2000激光拉制仪(美国sutter仪器公司)制备微米玻璃管。
[0040]
(5)配置1mol/l盐酸溶液,盛于培养皿中,用镊子钳着拉制好的玻璃管,管尖斜30
°
向下缓慢插入溶液中,并缓慢将整根玻璃管浸入盐酸中,务必使管尖不能碰到培养皿底部。
[0041]
(6)在盐酸溶液中浸泡40min后,小心用镊子把玻璃管从溶液中取出,用大量去离子水冲洗30s后,放置于100℃的烘箱烘干待用。
[0042]
(7)配制1:1体积比的三甲基氯硅烷的甲醇溶液(注意:该操作须佩戴护目镜在通风橱中完成,甲醇和三甲基氯硅烷混合可能会产生盐酸白雾)。
[0043]
(8)将配制好的三甲基氯硅烷的甲醇溶液置于培养皿中,用镊子钳着拉制好的玻璃管,管尖斜30
°
向下缓慢插入溶液中,并缓慢将整根玻璃管浸入溶液中,当观察到管尖有溶液进入1cm~2cm时,小心用镊子把玻璃管从溶液中取出,务必使管尖不能碰到容器底部,将玻璃管放入盒子保存过夜,用甲醇冲洗玻璃管外壁后放置于100℃的烘箱烘干,制得硅烷化好的微米玻璃管。
[0044]
用本实施例硅烷化好的微米玻璃管(尖端内径=6.8μm)测定液/液界面离子转移
电化学的可极化电势窗的cv。管内为油相——5mm双(三苯基亚膦基)四(五氟苯基)硼酸铵(batb)的三氟甲苯(tft)溶液,管外是水相——10mm licl溶液,扫描速度为20mvs
–1,即可得到微型液/液界面离子转移电化学的可极化电势窗cv。如图1所示,可极化电势窗口达0.9v(
–
0.7~+0.2v)左右,说明形成了稳定的液/液界面,cv的电势与电流方向符合极谱法的惯例。
[0045]
实施例2一种通过玻璃管尖端内壁硅烷化形成稳定的微纳米液/液界面的方法
[0046]
硅烷化微米玻璃管的制备同实施例1。
[0047]
用本实施例硅烷化好的微米玻璃管(尖端内径=1.6μm)测定促k
+
转移的cv。管内为油相——5mm batb+10mm db18c6的1,2-二氯乙烷(dce)溶液,管外是水相——10mm licl+0.5mm kcl的混合液,扫描速度为20mv s
–1,即可得到微型液/液界面促k
+
转移电化学的cv。如图2所示,在电势窗口内得到了一个s形稳态伏安图,其正向和反向曲线几乎是重叠的,说明充电电流很小,这是伏安法中微纳电极的特性。cv的促k
+
转移电化学与电流方向符合极谱法的惯例。
[0048]
实施例3一种通过玻璃管尖端内壁硅烷化形成稳定的微纳米液/液界面的方法
[0049]
硅烷化微米玻璃管的制备同实施例1。
[0050]
用本实施例硅烷化好的微米玻璃管(尖端内径=6.7μm)测定bf4–
转移电化学的cv。管内为油相——5mm batb的tft溶液,管外是水相——10mm licl+0.5mm libf4的混合液,扫描速度为20mv s
–1,即可得到微型液/液界面bf4–
转移电化学的cv。如图3所示,在电势窗口内(靠近正端)得到了一个近s形的稳态bf4–
转移伏安图,cv的bf4–
转移电化学与电流方向符合极谱法的惯例。
[0051]
实验例1微型液/液界面单颗粒碰撞电化学测量
[0052]
用实施例3硅烷化好的微米玻璃管(尖端内径=6.3μm)插入分散着负载10mm钾离子的脂质体的10mm氯化锂水溶液中,在恒电位-0.6v下(电位选择参见图2)进行微型液/液界面单颗粒碰撞电化学的i
–
t测量(时长:300s,采样间隔:5ms),即管外负载钾的脂质体碰撞到内径为6.3μm的毛细玻璃管口支持的微型液/液界面上。实验体系为celli:ag|agcl|20mm db18c6+5mm batb+dce(毛细玻璃管内)||10mm licl+181pm liposomes(hydrated by 10mm kcl)|agcl|ag。
[0053]
图4显示了使用电化学cell i从负载钾离子的脂质体与微型液/液界面碰撞获得的典型碰撞i
–
t迹线。图4a中,在300si
–
t轨迹中总共检测到159个尖峰。通过碰撞电化学获得的脂质体粒径分布与通过dls测量获得的尺寸分布基本一致(700nm vs.600nm)。负载k
+
的脂质体悬浮液的浓度通过实验碰撞频率结合斯托克斯-爱因斯坦方程计算为~181pm。该实验证明了通过本发明的内壁硅烷化方法制得的微米玻璃管支撑的液/液界面可以对脂质体进行单颗粒分辨率的粒径和浓度测量。
[0054]
以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1