甘油发酵为有机酸的制作方法
本专利申请涉及通过使用遗传改造的微生物的发酵从甘油产生有机酸。
背景技术:
已经建立大规模的工艺并在商业上用于将脂肪酸的甘油酯(又称作甘油酯、单甘油酯、甘油二酯和甘油三酯)转变为甲醇、乙醇或其他醇的甘油酯。所产生的脂肪酸酯(脂肪酸甲酯又称作FAME,脂肪酸乙酯又称作FAEE)通常称作“生物柴油”,这是因为它们自身或与常规烃类的混合物可用作柴油发动机的燃料。用于所述生物柴油合成的原材料可包括植物油、动物脂肪和丢弃的烹饪油。生物柴油工艺主要体积的副产品是甘油(又称作丙三醇(glycerin或glycerine))。对于产生的每千克生物柴油,产生大约0.1千克的甘油副产品。
当用于生物柴油合成的催化剂是氢氧化钠或者氢氧化钾时,甘油副产品通常是以重量计约80%至90%的甘油,副产品的剩余部分主要是水、甲醇或乙醇(取决于哪种醇被用于酯基转移反应)、多种盐和低水平的其他有机化合物。未处理的甘油副产品是碱性的和粘稠的,因此通常用硫酸、盐酸或其他酸将其中和至pH降至约4或5,这降低了粘性并出现所产生的盐如氯化钠、硫酸钠、氯化钾、硫酸钾等,其确切的组成显然取决于过程中所使用的化合物。通过蒸馏通常能从粗甘油中除去并回收大部分或者全部的醇。在这一类过程中使用的氢氧化钠或氢氧化钾催化剂被称为均相催化剂。
另一种产生生物柴油的过程依赖于“多相催化剂”。这种催化剂的一个例子被称为Esterfip-H,由法国公司Axens商业化。该催化剂的确切特征是专有的,但据报道其是两种非贵金属的尖晶石混合氧化物,且据报道其产生比均相催化剂的甘油副产品纯净得多的甘油副产品。据报道,多相催化剂的甘油副产品的纯度为98%且不含盐(Ondrey,2004)。
随着生物柴油行业的发展,甘油副产品的体积必然平行增长。来自生物柴油工业的粗甘油副产品中的一些通过蒸馏被纯化,并被用于多种已经传统使用甘油作为原料的工业中,而来自生物柴油工业的甘油的剩余部分被认为是烦累的废品。结果,在近几年粗甘油的价格已经直降至0.05美元/磅或更低(De Guzman,2010)。因此,甘油已经成为糖和其他碳水化合物如葡萄糖、果糖、蔗糖、麦芽糖、淀粉和菊粉的潜在的廉价替代品,作为用于产生燃料和化学品的发酵原料(Clomburg和Gonzalez,2010;Yazdani和Gonzalez,2007)。在本文撰写之时,葡萄糖和蔗糖的价格约为0.15美元至0.25美元/磅,因此,可用甘油代替其他糖的发酵过程可带来实质性的经济优势。
已经开发出许多微生物,用于通过使用可再生糖的发酵商业产生有用化学品。能够使用多种糖作为碳源以显著量产生有机酸的大肠杆菌(E.coli)菌株在本领域是熟知的。例如,美国专利申请公开号2009/0148914提供大肠杆菌菌株作为生物催化剂用于产生化学纯的乙酸盐和/或丙酮酸盐。美国专利号7,629,162提供了为产生乳酸而构建的大肠杆菌KO11菌株的衍生物。在专利合作条约下公布的国际专利申请号WO2008/115958和WO2010/115067提供了经改造以在含有葡萄糖作为碳源的基本盐培养基中以pH受控制的分批发酵法产生琥珀酸盐和苹果酸盐的微生物。美国专利U.S.7,241,594和U.S.7,470,530以及国际专利申请公布号WO2009/024294提供了在使用糖作为碳源发酵产生琥珀酸中有用的瘤胃细菌产琥珀酸曼氏溶血杆菌(mannheimia succiniproducens)。美国专利号5,000,000、5,028,539和5,424,202提供了用于产生乙醇的大肠杆菌菌株。美国专利号5,482,846、5,916,787和6,849,434提供了用于产生乙醇的革兰氏阳性微生物。美国专利号7,098,009提供了用于产生L(+)乳酸的杆菌属(Bacillus)菌株。美国专利号7,223,567、7,244,610、7,262,046和7,790,416提供了用于产生琥珀酸的大肠杆菌菌株。
目前在生物技术工业中使用的用于产生燃料和化学品的大多数微生物都具有用于甘油利用的专用代谢途径。然而,这些工业微生物均未曾显示出具有以对商业化生产有吸引力的生产参数使用甘油作为原料的能力。工业微生物的这种在有用化学品制造中利用甘油作为商业原料的无能归因于在微生物细胞内起作用的某些调节代谢反馈控制机制。
微生物对甘油的摄入和代谢已经被充分研究,特别是在大肠杆菌中(Lin,1996;Gonzalez等,2008)。如图1所示,在大肠杆菌中,甘油通过由glpF基因编码的易化扩散蛋白进入细胞。在“经典的”甘油代谢途径中,甘油被由glpK基因编码的甘油激酶磷酸化以产生甘油-3-磷酸(G3P)。然后G3P被由glpD编码的G3P脱氢酶或者被由glpABC编码的三-亚基G3P脱氢酶还原成磷酸二羟丙酮。GlpK-GlpD/GlpABC途径被认为是呼吸途径,因为其需要电子受体,并据信是在有氧条件下或在备选电子受体如硝酸盐或延胡索酸盐存在时运转。
微生物细胞内甘油代谢的另一个途径称作非经典途径,并被认为是在厌氧条件下运转(Gonzalez等,2008)。在这个第二途径中,转运至细胞内的甘油被由gldA编码的甘油脱氢酶还原为二羟基丙酮。然后二羟基丙酮被由dhaKLM编码的磷酸烯醇丙酮酸依赖的二羟基丙酮激酶磷酸化。由这些途径中的任何一个产生的磷酸二羟丙酮都可通过由tpi编码的磷酸丙糖异构酶进入糖酵解途径。磷酸丙糖异构酶将磷酸二羟丙酮转变为甘油醛-3-磷酸,其能够在转变为甘油酸1,3-二磷酸后进入三羧酸循环途径,甘油酸1,3-二磷酸依次转变为磷酸烯醇式丙酮酸。
有几份报道公开了通过发酵从甘油微生物产生多种化合物。通常,通过微生物发酵从甘油产生的化学品,包括琥珀酸盐、乙醇、1,2-丙二醇、氢和甲酸盐,以看起来并没有高到足以与用于产生那些化合物的其他已知商业过程相竞争的滴度被产生出来(Gonzalez等,2008;Durnin等,2009;Yazdani和Gonzalez,2008)。
Blankenschein等(2010)描述了改造的大肠杆菌菌株,其含有ΔadhE、Δpta、ΔpoxB、ΔldhA、Δppc和来自乳酸乳球菌(Lactococcus lactis.)的过表达丙酮酸羧化酶的质粒pZS-pyc。用由所述ΔadhE、Δpta、ΔpoxB、ΔldhA、Δppc、[pZS-pyc]菌株中的单独的载体表达的GldA-DhaKLM的初步实验未显示对产生琥珀酸盐有改善。大肠杆菌的此甘油利用菌株具有某些不利之处。此未被给予具体名称的菌株在72小时内仅产生14g/l的琥珀酸盐,产量为0.69g/g甘油。此外,质粒pZS-pyc需要氯霉素用来维持和无水四环素用来诱导,这两点对于大规模发酵来说都是不希望的。
Yazdani和Gonzalez(2008)描述了两种大肠杆菌菌株SY03和SY04,分别被设计用来产生乙醇加氢或甲酸盐。这两个菌株也需要质粒pZSKLMGldA。这一质粒被设计用来过表达大肠杆菌dhaKLM操纵子和gldA,其可能通过“非经典”的甘油途径增加通量。在所给出的最优选的例子中,含有pZSKLMGldA的SY04在100小时内从约22g/l甘油产生约10g/l乙醇和9g/l甲酸盐。这些发酵参数对于有竞争力的商业过程来说并不足够高。此外,pZSKLMGldA质粒需要氯霉素用于维持和无水四环素用来诱导,这两点对于大规模发酵来说都是不希望的。
国际专利申请公布号WO2010/051324公开了具有分别过表达glpK和glpD基因以产生D-乳酸盐和L-乳酸盐的质粒LA01(pZSglpKglpD)和LA20(pZSglpKglpD)。
Zhang等人(2010)已经描述了经改造的大肠杆菌菌株XZ721,其在pck基因(被称为pck*)的启动子区中含有突变,ΔptsI和ΔpflB。在发酵罐中,菌株XZ721使用甘油作为碳源在6天内产生12g/l琥珀酸盐,产量为0.80mol/mol使用的甘油,其等价于1.02g/g使用的甘油。在pck*背景中缺失gldA或dhaM导致更高的琥珀酸盐滴度(分别为13.2g/l和12.7g/l),表明GldA-DhaKLM途径在所使用的发酵条件下可能并非用于产生琥珀酸盐的最优途径。
Scholten等人最近已经在巴斯德氏菌科(Pasteurellaceae)中分离出新的反刍细菌,被命名为DD1或Basfia succiniciproducens。DD1细菌从甘油厌氧产生琥珀酸盐(美国专利申请2011/0008851)。然而,Basfiasucciniciproducens在没有添加的营养物的基本培养基上不生长,且以甘油作为唯一碳源的最大报道滴度是35g/l的琥珀酸盐。如果在培养基中添加麦芽糖,滴度被提高至58g/l,但是大量的甘油剩下未用。
Trinh和Srienc(2009)报道通过使用元件模式分析以设计最优大肠杆菌菌株来改善从甘油产生乙醇。然后构建了最优菌株TCS099,基因型为Δzwf、Δndh、ΔsfcA、ΔmaeB、ΔldhA、ΔfrdA、ΔpoxB、Δpta和Δmdh。在代谢进化后,含有表达运动发酵单孢菌(Zymomonas mobilis)乙醇产生基因的质粒pLOI297的TCS099能够以高达97%的理论产量和约17g/l至40g/l甘油的滴度从甘油产生乙醇。然而,与其他现有过程相比,这一过程将再次不具有经济竞争力。如在1970就已知(Zwaig等人,1970),作者指出甘油激酶中的突变能够提高菌株在甘油上的比生长速度,他们还提出他们的经进化的菌株可能已经通过经突变的甘油激酶发生通量增加,但是他们未对在他们的经进化的菌株中的甘油激酶基因进行测序或表征,并且他们未建议,以甘油作为碳源,谨慎导入经突变的甘油激酶会增加乙醇产生速度或导致更高的乙醇滴度。
由于工业规模微生物产生生物燃料和有机化学品是在厌氧发酵条件下实施,激活微生物细胞内部的厌氧甘油利用途径以使微生物利用甘油作为原料是符合逻辑的。但如前所述,厌氧甘油利用途径的基因操作在使用甘油作为唯一碳源产生所需化学品中还未取得预期的改善。现有技术已经公开了glpK的反馈抗性等位基因以及通过由glpR基因编码的阻遏蛋白调节有氧甘油利用途径中甘油利用基因的表达。然而对于通过用反馈抗性glpK等位基因替换生产菌株中的野生型glpK等位基因,或通过缺失甘油利用的阻遏物如大肠杆菌glpR基因,或通过这两种途径的组合,来改善从甘油产生商业上有用的化学品尚未进行过任何努力。本发明人已经令人惊讶地发现通过改造用于甘油利用的GlpK-GlpD/GlpABC途径和随后的在选择用于产生琥珀酸的微生物细胞中的代谢进化过程,在保留原始的琥珀酸产生能力的同时,赋予利用甘油作为碳源的能力是可能的。尽管用适合于使用甘油作为碳源商业上产生琥珀酸的大肠杆菌菌株的构建详细地讲解了本发明,但本发明的一般主题和精神能够适用于在微生物发酵过程中使用甘油作为碳源产生许多其他商业上有用的化学品的微生物菌株的构建。
发明简述
本发明提供了用于使用甘油作为碳源通过生物发酵产生一种或多种有商业利益的化学品的微生物和方法。使用甘油作为碳源以及本发明的微生物和方法,能够制造多种有商业利益的化学品包括但不限于琥珀酸、乳酸、苹果酸、延胡索酸、1,2-丙二醇、1,3-丙二醇、1,4-丁二醇、乙醇和乙酸。
在优选的实施方案中,适用于本发明的甘油源自生物柴油工业。在最优选的实施方案中,本发明使用污染化合物已被从中除去的源自生物柴油工业的甘油。在一个方面,源自生物柴油工业的甘油不含污染化合物如甲醇和乙醇。在本发明的另一个方面,源自生物柴油工业的甘油不含污染离子,所述污染离子包括但不限于钠、钾、钙、镁、铵、氯、硫酸盐、磷酸盐及其混合物。
在另一个实施方案中,本发明提供适用于使用甘油作为碳源制造一种或多种有商业利益的化学品的微生物,其中所述微生物包含去调节的甘油利用途径,且所述甘油利用途径包含易化扩散体、甘油激酶和甘油-3-磷酸脱氢酶。
在本发明的一个方面,甘油利用途径的去调节涉及在glpR基因或其他调节基因中导致阻遏物的活性实质性降低的突变,所述阻遏物负向调节甘油利用基因的表达。
在本发明的另一个方面,甘油利用途径的去调节涉及用会充当组成型启动子的DNA序列替换glpK、glpF、glpD和glpABC基因的启动子区。
在又一个实施方案中,本发明提供使用甘油作为碳源产生一种或多种有商业利益的化学品的微生物,其中所述微生物在glpK基因中或在其他编码甘油激酶的基因中具有突变,所述突变赋予对反馈抑制的抗性。
在一个方面,本发明提供在glpK基因中包含突变的微生物,所述突变导致甘油激酶比活性实质性抵抗果糖-1,6-二磷酸的抑制。
在另一个方面,本发明提供在glpK基因中包含突变的微生物,所述突变导致甘油激酶比活性实质性抵抗磷酸转移酶系统的非磷酸化的酶IIAGlc的抑制。
在又一个方面,本发明提供包含两种或更多种突变的微生物,其中一种所述突变导致阻遏物的活性实质性降低,所述阻遏物负向调节甘油利用基因的表达,并且另一种所述突变导致甘油激酶比活性实质性抵抗果糖-1,6-二磷酸的抑制和/或磷酸转移酶系统的非磷酸化的酶IIAGlc的抑制。
在另一个实施方案中,本发明提供使用甘油作为碳源产生一种或多种有商业利益的化学品的方法,其中所述方法包括微曝气。
在一个方面,本发明提供使用甘油作为碳源产生有商业利益的化学品的方法,其中提供每升发酵肉汤每分钟少于0.15升的氧气给发酵肉汤。
在另一个方面,本发明提供使用甘油作为碳源产生有商业利益的化学品的方法,其中提供每升发酵肉汤每小时至少20mg的氧气给发酵肉汤。
附图简述
图1.微生物中甘油利用的代谢途径。甘油从外部环境输入到微生物细胞内被由glpF基因编码的易化扩散蛋白所介导。一旦在细胞内,甘油可被代谢成磷酸二羟丙酮。两个代谢途径中被认为是在厌氧条件下运转的一个涉及由gldA和dhaKLM基因编码的蛋白质。这一途径在图中用虚线表示。微生物细胞内甘油代谢的另一个途径通常被认为在有氧条件下或在备选电子受体如硝酸盐或延胡索酸盐存在时是活性的,且被称作甘油利用的经典途径。微生物细胞内甘油利用的经典途径在图中用实线表示。基因glpF、glpK、glpD和glpABC编码参与经典途径运转的蛋白质。glpX基因在图中未示出,其与glpF和glpK一起在操纵子(glpFKX操纵子)中,且其编码当细胞依赖甘油生长时对糖异生有贡献的果糖-1,6-二磷酸磷酸酶。图中还显示控制参与甘油代谢经典途径运转的蛋白质的调节机制。由glpR基因编码的阻遏蛋白控制glpFKXX、glpABC和glpD基因/操纵子的转录。由glpK基因编码的甘油激酶也经历由果糖-1,6-二磷酸(FBP)和非磷酸化形式的EIIAglc的反馈抑制,所述EIIAglc是磷酸转移酶糖转运系统的组分。磷酸二羟丙酮,甘油代谢的终产物,通过由tpi基因编码的磷酸丙糖异构酶的作用转变为甘油醛-3-磷酸。甘油醛-3-磷酸在微生物细胞内担当产生生物燃料和有机酸的起始点。
图2.从KJ122大肠杆菌菌株构建甘油利用RY819J-T14菌株。本图提供构建大肠杆菌菌株RY819J-T14所遵循的步骤。在构建RY819J-T14的第一阶段中,用含有两个点突变的突变体形式的glpK基因替换KJ122菌株中的野生型glpK基因,导致两个氨基酸替换。在第二阶段,插入卡那霉素抗性基因盒使glpR基因失活,导致大肠杆菌RY819J菌株产生。在第三阶段,对大肠杆菌的RY819J菌株进行代谢进化以获得大肠杆菌RY819J-T14菌株。获得RY819J-T14的RY819J的代谢进化涉及如本说明书所述的十四次转移。
图3.构建甘油利用大肠杆菌菌株MH28。对代谢进化结束时获得的大肠杆菌RY819J-T14菌株的glpFK区进行DNA测序显示,在glpK基因的开放阅读框内有两个氨基酸替换(Ala55Thr;Arg157His),和在glpF基因的开放阅读框内有一个氨基酸替换(Pro274Leu)。glpF区内的突变通过两步过程治愈。在第一步,具有所述氨基酸替换(Pro274Leu)的glpF基因通过插入cat-sacB基因盒而失活。在下一步,将cat-sacB基因盒用野生型glpF基因序列替换,导致大肠杆菌菌株MH28菌株产生。存在于glpF和glpK中的三个突变也存在于供体菌株BB14-20中。
图4.含琥珀酸发酵肉汤的代表性HPLC谱图。按照本说明书所述的步骤处理从大肠杆菌菌株MH28菌株获得的发酵肉汤,所述菌株在标称含有10%(w/w)甘油的培养基中生长。在配备BioRad Aminex HPX-87H柱的HPLC设备上运行经处理的样品(参见实施例2)。
图5.大肠杆菌KJ122菌株甘油利用动力学。在如本说明书所述的微有氧条件下在7L发酵罐中含有10%(w/w)甘油的基本培养基中生长所述KJ122菌株。运行发酵罐52小时,且用本说明书所述的HPLC装置监测甘油消耗以及琥珀酸、丙酮酸和乙酸的积累。
图6.大肠杆菌MH28菌株甘油利用动力学。在如本说明书所述的微有氧条件下在7L发酵罐中含有10%(w/w)甘油的基本培养基中生长所述MH28菌株。运行发酵罐52小时,且用本说明书所述的HPLC装置监测甘油消耗以及琥珀酸、延胡索酸、丙酮酸和乙酸的积累。
优选实施方案的详述
利用本发明可以制造许多有商业利益的工业上有用的化学品。这些有商业利益的化学品大部分是微生物代谢的中间产物。在本发明中,适当操作微生物基因组和生长条件以商业上成功的方式以显著量产生这些微生物中间产物中的一种或多种。此类化学品的实例包括但不限于乙醇、丁醇、乳酸盐、琥珀酸盐、延胡索酸盐、苹果酸盐、苏氨酸、甲硫氨酸和赖氨酸。由于有机酸可作为游离酸和作为盐(例如但不限于钠、钾、镁、钙、铵盐等)存在,化学名称如琥珀酸、延胡索酸、苹果酸、天冬氨酸、苏氨酸、甲硫氨酸和赖氨酸应当意图包括游离酸及其任何盐。类似地,任何盐如琥珀酸盐、延胡索酸盐、苹果酸盐、天冬氨酸盐等也应当意图包括游离酸。
本发明将特定的基因修饰技术与代谢进化过程组合,以获得在厌氧或微有氧生长条件下在具有甘油作为碳源的基本盐培养基中显示琥珀酸生产高产量、滴度和体积生产率的菌株。
出于描述本发明的目的,应当使用以下定义。
如本发明中所用,术语“滴度”意指发酵肉汤中特定化合物的克/升或摩尔浓度。因而在本发明用于生产琥珀酸的发酵过程中,琥珀酸滴度100mM意指发酵肉汤在测量时含有每升发酵肉汤100毫摩尔琥珀酸或每升发酵肉汤11.8克琥珀酸(g/l)。
如本发明中所用,术语“产量”指在发酵过程期间每摩尔消耗的碳源所产生的特定化合物的摩尔数,或在发酵过程期间每克消耗的碳源所产生的特定化合物的克数。因而在使用甘油作为碳源生产琥珀酸的发酵过程中,术语产量指每克消耗的甘油所产生的琥珀酸的克数。
如本发明中所用,术语“体积生产率”指每单位体积每单位时间以克计产生的特别的化合物的量。因而琥珀酸的体积生产率值0.9gL-1h-1将意指在1小时生长期间在1升发酵液中积累0.9克琥珀酸。
如本发明中所用,术语“基因”包括DNA序列的开放阅读框以及上游和下游调节序列。上游调节序列区也称作基因的启动子区。下游调节序列也称作终止子序列区。
短语“功能上相似”广义地意指来自任何生物的任何野生型或突变的DNA序列、基因、酶、蛋白质,其具有与通过本文中公开的方法在相同或者不同的生物中找到的任何野生型或突变的DNA序列、基因、酶、蛋白质等同或相似的生物学功能。功能相似不需要要求序列同源性。“等位基因”是特定基因的DNA序列的两种或多种形式中的一种。通过突变,每个基因能具有不同的等位基因。当与具有突变的相应基因相比时,没有任何突变的基因称作野生型等位基因。
同源物是与从共同祖先DNA序列遗传的第二基因相关的基因。术语同源物可以适用于因物种形成事件而分离的基因之间的关系或适用于因遗传重复事件而分离的基因之间的关系。直向同源物是不同物种中通过物种形成从共同祖先基因进化而来的基因。正常情况下,直向同源物在进化的过程中保留相同的功能。直向同源物的鉴定对于新测序基因组中基因功能的可靠预测是重要的。物种形成是新物种的起源,所述新物种能够从产生所述新物种的物种中以新方式生存。作为该过程的部分,它也已经获得一些与亲本物种遗传交换的屏障。旁系同源物是因基因组内部重复而相关的基因。直向同源物在进化的过程中保留相同的功能,而旁系同源物进化出新的功能,即便这些新的功能与原始功能相关。
将具有“改变的活性”的基因或蛋白质广义地定义为,当与相关的野生型基因或蛋白质相比时,在可度量属性方面产生可度量差异的基因或蛋白质。改变的活性可能以一般方式通过增加或减少含有改变的基因或蛋白质的菌株的生长速率或琥珀酸盐生产效率而自我表现。其他可度量的属性包括但不限于酶活性、酶的底物特异性、酶的动力学参数如底物亲和力或速率、酶稳定性、酶的调节性能、基因表达水平、多种条件下对基因表达的调节、对一种或多种抑制剂的敏感度等。
如本发明中所用,术语突变指对基因(包括开放阅读框、上游调节区和下游调节区)所做的基因修饰。基因突变能导致该基因开放阅读框转录的上调或下调或完全抑制或由该突变的基因编码的蛋白质活性的改变。通过缺失基因的整个编码区或一部分编码性核苷酸序列或通过导入移框突变、错义突变和插入,或通过导入终止密码子或其组合实现基因突变。突变可在编码直接参与生物学功能如酶反应或有机分子跨细胞膜转运的蛋白质的结构基因中出现。备选地,突变可在编码这样的蛋白质的调节基因中出现,其中所述蛋白质控制编码直接参与生物学功能的蛋白质的基因的表达。控制其他基因表达的蛋白质称作调节蛋白并且编码这些调节蛋白的基因称作调节基因。
“突变”还应当包括DNA序列中相对于相关野生型生物的任何变化。例如,见于菌株KJ122中的突变是在DNA序列中当已突变区域的DNA序列与亲本野生型菌株,大肠杆菌C(又称作ATCC8739)的DNA序列比较时可以找到的任何变化。突变可以是具有任何数目的碱基对的额外DNA的插入或具有任何数目的碱基对的DNA的缺失。特定类型的插入突变是基因重复。基因可以因自发突变事件而重复,其中该基因的第二拷贝可以毗邻于原始拷贝存在,或基因可以因基因工程操作而重复,其中该基因的第二拷贝可以位于基因组中远离原始拷贝的位点处。突变可以从一种碱基类型变化成另一种碱基类型,例如从腺嘌呤变化成鸟嘌呤碱基。在遗传学的术语中,突变可以是错义(其通过密码子改变编码的氨基酸)、无义(其改变密码子成终止密码子)、移框(其是不为3的倍数的多个碱基的插入或缺失,并且改变开放阅读框并从该突变下游起改变所编码的氨基酸序列,并且通常在该突变下游通常导入终止密码子),或倒位(其因DNA序列极性转换产生,而不是因缺失产生)。在基因名之前的符号“Δ”表明该基因的编码序列已经全部或部分被消除且该基因是功能性失活的。
“无效突变(null mutation)”是这样的突变,其赋予基本上与缺失相关基因的整个开放阅读框的表型相同的表型,或消除相关基因的全部可度量活性。
“突变体”是其基因组含有一个或多个突变的微生物。
如本发明中所用,术语“外源的”意图意指源自细胞外部的分子或活性被导入宿主微生物中。在外源核酸分子被导入微生物细胞中的情况下,导入的核酸可以作为独立质粒存在或可以整合至宿主染色体DNA中。编码蛋白质的外源核酸可以以具有自身调节序列如启动子和终止子序列的可表达形式导入微生物细胞中。备选地,该外源核酸分子可以整合至宿主染色体DNA中并且可以处于宿主调节序列的控制下。术语“内源的”指存在于宿主细胞内部的分子和活性。当谈及生物合成活性使用时,术语“外源的”指导入宿主参考生物中的活性。来源可以是例如导入宿主微生物后表达所指活性的同源的或异源的编码核酸。如果从该微生物的相同物种获得编码蛋白质的核酸,则该核酸称作同源DNA。如果核酸源自不同的微生物物种,则该核酸称作异源DNA。无论DNA的性质是什么,它是否为同源的或异源的,当导入宿主细胞中时,从所导入DNA衍生的DNA以及活性称作外源的。因此,本发明的编码核酸的外源表达可以利用异源和同源编码核酸中的任一者或两者。
本发明提供可使用甘油作为碳源制造商业上有用的化学品的微生物。尽管本发明使用大肠杆菌进行说明,但本发明可以应用于宽范围的细菌物种,包括弗氏柠檬酸细菌(Citrobactor freundii)、氧化葡糖杆菌(Gluconobacter oxydans)、浅井氏葡糖杆菌(Gluconobacter asaii)、带马瓦无色杆菌(Achromobacter delmarvae)、粘无色杆菌(Achromobacter viscosus)、乳无色杆菌(Achromobacter lacticum)、根癌农杆菌(Agrobacterium tumefaciens)、放射形农杆菌(Agrobacterium radiobacter)、粪产碱菌(Alcaligenes faecalis)、柠檬节杆菌(Arthrobacter citreus)、肿胀节杆菌(Arthrobacter tumescens)、石蜡节杆菌(Arthrobacter paraffineus)、裂烃谷氨酸节杆菌(Arthrobacter hydrocarboglutamicus)、氧化节杆菌(Arthrobacter oxydans)、天牛金杆菌(Aureobacterium saperdae)、印度固氮菌(Azotobacter indicus)、产氨短杆菌(Brevibacteriumammoniagenes)、divaricatum、乳发酵短杆菌(Brevibacterium lactofermentum)、黄短杆菌(Brevibacterium flavum)、Brevibacterium globosum、暗褐短杆菌(Brevibacterium fuscum)、酮戊二酸短杆菌(Brevibacterium ketoglutamicum)、Brevibacterium helcolum、极小短小杆菌(Brevibacterium pusillum)、需土金杆菌(Brevibacterium testaceum)、玫瑰色短杆菌(Brevibacterium roseum)、Brevibacterium immariophilium、扩展短杆菌(Brevibacterium linens)、Brevibacterium protopharmiae、嗜乙酰棒杆菌(Corynebacterium acetophilum)、谷氨酸棒状杆菌(Corynebacterium glutamicum)、美棒杆菌(Corynebacterium callunae)、嗜乙酰乙酸棒杆菌(Corynebacterium acetoacidophilum)、醋谷棒杆菌(Corynebacterium acetoglutamicum)、产气肠杆菌(Enterobacter aerogenes)、解淀粉欧文氏菌(Erwinia amylovora)、胡萝卜软腐欧文氏菌(Erwinia carotovora)、草生欧文氏菌(Erwinia herbicola)、菊欧文氏菌(Erwinia chrysanthemi)、奇异黄杆菌(Flavobacterium peregrinum)、染色黄杆菌(Flavobacterium fucatum)、橙色黄杆菌(Flavobacterium aurantinum)、莱菌黄杆菌(Flavobacterium rhenanum)、塞沃尼黄杆菌(Flavobacterium sewanense)、短黄杆菌(Flavobacterium breve)、脑膜脓毒性黄杆菌(Flavobacterium meningosepticum)、微球菌属物种(Micrococcus sp.)CCM825、摩氏摩根氏菌(Morganella morganii)、灰暗诺卡氏菌(Nocardia opaca)、粗糙诺卡氏菌(Nocardia rugosa)、Planococcus eucinatus、雷氏变形菌(Proteus rettgeri)、谢氏丙酸杆菌(Propionibacterium shermanii)、类黄假单胞菌(Pseudomonas synxantha)、氮假单胞菌(Pseudomonas azotoformans)、荧光假单胞菌(Pseudomonas fluorescens)、卵状假单胞菌(Pseudomonas ovalis)、施氏假单胞菌(Pseudomonas stutzeri)、食酸假单胞菌(Pseudomonas acidovolans)、霉味假单胞菌(Pseudomonas mucidolens)、睾丸酮假单胞菌(Pseudomonas testosteroni)、铜绿假单胞菌(Pseudomonas aeruginosa)、红串红球菌(Rhodococcus erythropolis)、玫瑰色红球菌(Rhodococcus rhodochrous)、红球菌属物种(Rhodococcus sp.)ATCC15592、红球菌属物种(Rhodococcus sp.)ATCC19070、脲芽孢八叠球菌(Sporosarcina ureae)、金黄色葡萄球菌(Staphylococcus aureus)、麦氏弧菌(Vibrio metschnikovii)、干酪弧菌(Vibrio tyrogenes)、马杜拉放线菌(Actinomadura madurae)、紫产色放线菌(Actinomyces violaceochromogenes)、Kitasatosporia parulosa、天蓝色链霉菌(Streptomyces coelicolor)、浅黄链霉菌(Streptomyces flavelus)、浅灰链霉菌(Streptomyces griseolus)、浅青紫链霉菌(Streptomyces lividans)、橄榄链霉菌(Streptomyces olivaceus)、田无链霉菌(Streptomyces tanashiensis)、弗吉尼亚链霉菌(Streptomyces virginiae)、抗菌素链霉菌(Streptomyces antibioticus)、可可链霉菌(Streptomyces cacaoi)、淡紫灰链霉菌(Streptomyces lavendulae)、绿色产色链霉菌(Streptomyces viridochromogenes)、杀鲑气单胞菌(Aeromonas salmonicida)、短小芽孢杆菌(Bacillus pumilus)、环状芽孢杆菌(Bacillus circulans)、解硫胺素芽孢杆菌(Bacillus thiaminolyticus)、地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌(Bacillus subtilis)、解淀粉芽孢杆菌(Bacillus amyloliquifaciens)、凝结芽孢杆菌(Bacillus coagulans)、弗氏埃希氏菌(Escherichia freundii)、嗜氨微杆菌(Microbacterium ammoniaphilum)、粘质沙雷氏菌(Serratia marcescens)、鼠伤寒沙门氏菌(Salmonella typhimurium)、薛氏沙门氏菌(Salmonella schottmulleri)、产酸克雷伯氏菌(Klebsiella oxytoca)、肺炎克雷伯氏菌(Klebsiella pneumonia)和柑桔黄单胞菌(Xanthomonas citri)。本发明也用于赋予那些被选择用于生产商业上有用的化学品的酵母菌株中使用甘油作为碳源的能力,所述酵母菌株例如但不限于选自下述属的酵母菌:酵母属(Saccharomyces)、克鲁维酵母属(Kluyveromyces)、假丝酵母属(Candida)、结合酵母属(Zygosaccharomyces)、球拟酵母属(Torulopsis)、有抱圆酵母属(Torulospora)、拟威尔酵母属(Williopsis)、伊萨酵母属(Issatchenkia)、毕赤酵母属(Pichia)、裂殖酵母属(Schizosaccharomyces)、法夫酵母属(Phaffia)、隐球酵母属(Cryptoccus)、亚罗酵母属(Yarrowia)、覆膜孢酵母属(Saccharomycopsis)等。
在本发明中作为原料使用的甘油可源自生物柴油工业。优选在产生商业上有用的化学品的发酵过程中使用之前除去源自生物柴油工业的甘油中的污染物。在优选的实施方案中,甘油源自使用多相催化剂的生物柴油工业,其导致产生具有最少污染组分的甘油。污染物中的一些如乙醇和甲醇可通过蒸馏除去。稀释原始的甘油储液是减少污染物影响的又一个方法。
已知来自生物柴油制造的甘油副产品含有某些少量污染化合物如水、甲醇或乙醇以及盐离子如钠、钾、镁、钙、铵、氯、硫酸盐和磷酸盐离子。如果这一“粗”甘油被稀释约五倍至十倍,那么污染化合物会被稀释至微生物包括本发明的微生物应当容忍的浓度。虽然如此,优选在发酵前至少部分地除去所述污染化合物。因为甘油是大体积的副产品,且可能源自不止一个生物柴油制造工厂,在批次间可能有某些不可预知的可变性,因此可能在某些或很多批次中污染物的水平可能是不希望的。另外,在发酵前除去离子污染物与在发酵后除去离子污染物相比可能花费更少。在需要所需产品(例如有机酸)不含一种或多种污染物的情况下,所述污染物必须在发酵前或后被除去。例如,如果产生的有机酸一定会被化学修饰(例如氢化)和/或聚合成塑料,那么为了保护催化剂免于中毒,所有形式的硫和磷都必须被至少部分地除去。又如,在聚合期间,甲醇或乙醇也可能作为链终止子,因为他们仅具有一个活性基团。
低级醇如甲醇和乙醇可通过蒸馏和/或减压被除去。离子污染物可通过离子交换树脂被除去。由于甘油在非极端pH下是不带电的,粗甘油可经过开始为氢(H+)形式的阳离子交换树脂,随后通过开始为羟基(OH-)形式的阴离子交换树脂,反之亦然。备选地,粗甘油可经过含有这两类树脂混合物的混合床离子交换树脂。串联使用这两个不同的树脂比使用混合床更好,因为那样树脂的再生更容易。可以用柱子或分批进行离子交换。甘油应该不被任一类树脂所束缚,而离子应该被树脂保留。
也可通过其他熟知的方法如电渗析或通过带电或者不带电的膜过滤从粗甘油中除去离子,所述膜能够区别甘油和不希望的污染物。也可通过蒸馏或真空蒸馏纯化甘油。
适用于产生商业上有用的化学品的微生物可以以许多不同的方式获得。根据优选的实施方案,将通过基因工程和代谢进化的组合过程获得的、使用除甘油之外的碳源例如葡糖糖产生特定的商业上有用的化学品的微生物细胞用作亲本菌株。例如,可将已被详细描述的大肠杆菌KJ122菌株(Jantama等,2008a;Jantama等,2008b;Zhang等,2009a;Zhang等,2009b)用作亲本菌株以获得能够使用甘油作为碳源商业上产生琥珀酸的菌株。在生成用于使用甘油作为碳源产生琥珀酸的菌株的第一阶段中,对KJ122菌株进行特定的基因操作以提高甘油的摄入和代谢。在甘油代谢途径基因操作后可进行代谢进化过程以获得具有对使用甘油作为碳源产生琥珀酸有商业吸引力的产量、滴度和生产率的细菌菌株。
基于我们目前对微生物细胞内部甘油代谢途径的理解,可以确定甘油代谢途径内基因操作的合适靶点。图1提供了我们目前对微生物细胞内甘油代谢途径的理解的总结。
由glpF基因编码的易化扩散蛋白介导甘油从培养基中进入微生物细胞内。一旦进入细胞内部,甘油通过两个不同的途径被代谢导致磷酸二羟丙酮形成。在一个被认为是在厌氧条件下有活性的途径中,甘油被由gldA基因编码的甘油脱氢酶作用。甘油被甘油脱氢酶氧化产生二羟基丙酮,伴随着NADH的形成。在下一步,二羟基丙酮被由dhaKLM编码的磷酸烯醇丙酮酸-依赖的或ATP-依赖的二羟基丙酮激酶磷酸化。这一磷酸化反应导致磷酸二羟丙酮形成。甘油代谢的这一途径被称作甘油代谢的非经典途径。
在微生物细胞内甘油代谢的另一个途径中,甘油被磷酸化产生甘油-3-磷酸,该途径被认为在有氧条件下或在备选电子受体如硝酸盐或延胡索酸盐存在的厌氧条件下运转。在下一步,甘油-3-磷酸被由GlpD或GlpABC编码的甘油-3-磷酸脱氢酶氧化导致磷酸二羟丙酮形成。甘油代谢的这一途径被称作甘油代谢的经典途径。
甘油代谢的经典和非经典途径两者产生的二羟基丙酮被磷酸丙糖异构酶作用导致甘油醛-3-磷酸形成。如此形成的甘油醛-3-磷酸可经过剩余的糖酵解途径并最终进入三羧酸循环,基于已发生于糖酵解、发酵和三羧酸循环途径中的基因改变的性质,导致一种或其他代谢中间产物的积累。
除参与的酶和辅酶的性质不同外,甘油代谢的经典和非经典途径在控制这两个甘油代谢途径运转的调节的性质上也彼此不同。
经典的甘油途径以两种不同的方式被调节。首先,在中间产物G3P存在下,glpF、glpK、glpD和glpABC的表达全部被由glpR编码的蛋白质所阻遏。其次,GlpK酶被果糖-1,6-二磷酸抑制,和被磷酸转移酶系统(PTS)组分的非磷酸化形式,酶IIAGlc(也称为EIIAGlc且以前称为酶IIIGlc或EIIIGlc)抑制,在大肠杆菌的情况下,所述酶IIAGlc由crr基因编码。这些调节机制的结果是当培养基中存在葡萄糖时甘油利用被强有力地抑制。当细胞在葡萄糖存在下生长时,GlpK的两种抑制剂的浓度都升高。出于本专利申请的目的,GlpK活性被果糖-1,6-二磷酸或EIIAGlc抑制被称作反馈抑制或负向调节机制。术语“去调节的甘油途径”被定义为这样的甘油利用途径,其中一种或多种运转甘油利用途径的负向调节机制通过在宿主生物中的基因改变已被降低功能或已被整个除去。此种基因改变包括但不限于:1)降低或消除阻遏物例如GlpR的功能;2)通过代谢中间产物如果糖-1,6-二磷酸或通过蛋白质如磷酸转移酶系统(PTS)组分的非磷酸化形式如酶IIAGlc减轻甘油激酶如GlpK的一些或全部抑制;3)降低甘油利用的葡萄糖抑制,例如通过降低细胞输入或代谢葡萄糖的能力;和/或4)将甘油利用基因或操纵子如glpD、glpFKX和/或glpABC替换为更强的或更多的不受由glpR基因编码的GlpR蛋白阻遏的组成型启动子。许多组成型活性启动子在本领域是熟知的,且他们中的任何一种在本发明中都可被用于替换在野生型细菌细胞中受GlpR蛋白质控制的glpFKX、glpD和glpABC基因/操纵子的天然启动子。用组成型活性启动子替换任何基因的天然启动子可使用在微生物基因工程中熟知的一种或其他基因工程技术来完成,如实施例6中描述的两步等位基因替换方法,其中通过插入cat,sacB盒替换天然启动子,随后又用本领域熟知的组成型活性启动子替换cat,sacB盒。
有几份glpK的突变体等位基因抵抗G3P或非磷酸化的酶IIAGlc或两者的反馈抑制的报道(Bell,1974;Pettigrew等,1996)。这些等位基因中的一些最初由Cronan和Bell(Cronan和Bell,1974a;Cronan和Bell,1974b)在名为BB20-14和BB26-36的菌株中分离出来,该菌株通过选择在葡萄糖加甘油上生长的G3P营养缺陷体而获得。假定这些菌株含有反馈抗性甘油激酶。来自那些菌株的glpK基因的DNA序列迄今为止还未公布。在美国康涅狄格州纽黑文市耶鲁大学的Coli遗传库存中心(Coli Genetic Stock Center(CGSC))可提供这两种菌株,且管理者已将这两种菌株中的等位基因分别命名为glpK15(fbR)和glpK14(fbR)。为简便,在本说明书中,我们分别称这些等位基因glpKi15(fbR)和glpKi14(fbR),其中上标“i”代表对反馈抑制不敏感。
名为glpKi22的glpK的另一个反馈抗性等位基因,首先由Zwaig和Lin在名为Lin43的菌株中分离出来(Zwaig和Lin,1966),且之后由Pettigrew等(1996)表征和测序。该突变体因其在葡萄糖存在下吸收放射性甘油的能力而被识别。
分离glpK反馈抗性等位基因遵循的另一个途径是选择某些PTS突变的抑制(Berman和Lin,1971)。这一途径产生菌株Lin225,其含有抵抗果糖-1,6-二磷酸的抑制的甘油激酶,但是来自该菌株的glpK基因从未被表征过。菌株Lin225中的glpK等位基因被耶鲁大学的Coli遗传库存中心(Coli Genetic Stock Center)命名为glpKi31。
监测获得和固定在适应基于甘油的生长培养基期间表达选择性生长优势的突变的大肠杆菌全基因组测序已在甘油激酶基因中识别出一系列的突变(Iberra等,2002;Herring等,2006;Honisch等,2004)。来自表达突变体glpK基因的细胞的部分被纯化的蛋白质显示甘油激酶的反应速度比野生型高51%-133%,且该突变体中的一些显示减少的果糖-1,6-二磷酸对甘油激酶的抑制(Herring等,2006)。
出于本发明的目的,反馈抗性甘油激酶被定义为在果糖-1,6-二磷酸存在下、或在来自同一生物的磷酸转移酶系统(PTS)组分的非磷酸化的形式,酶IIAGlc存在下、或在两个抑制剂都存在下,比相关的野生型酶具有更高的比活性的甘油激酶。反馈抗性属性可以在讨论甘油激酶、编码甘油激酶的基因或甘油激酶的等位基因中被引用。
因此,本领域已知四种用于分离反馈抗性glpK等位基因的方法:(1)选择在葡萄糖加甘油上生长的G3P营养缺陷体;(2)在葡萄糖存在下摄入放射性甘油;(3)PTS酶I突变体的抑制;(4)选择在基本甘油培养基中更快速生长(Bell,1974;Zwaig和Lin,1966;Berman和Lin,1971;Honisch等,2006)。该四种方法中的任何一种均可在本发明中被用于分离反馈抗性glpK等位基因。尽管本发明给出的实例基于大肠杆菌,但是在任何细菌物种中并且特别是在克雷伯氏菌属(Klebsiella)、沙门氏菌属(Salmonella)、肠杆菌属(Enterobacter)沙雷氏菌属(Serratia)和柠檬酸菌属(Citrobacter)中的任何其他细菌物种中也可以遵循类似的方法。
这些glpK反馈抗性等位基因中的任何一种均可用于替换在已经开发用于产生特定的商业上重要的化学品的细菌菌株中的野生型glpK基因。在已经开发用于商业上产生琥珀酸的大肠杆菌KJ122菌株中的野生型glpK基因可用抵抗反馈抑制的突变体glpK等位基因替换。备选地,用glpK的突变体等位基因替换野生型glpK基因可在野生型大肠杆菌中完成,且获得的具有glpK突变体等位基因的细菌菌株可用作开发用于商业上产生琥珀酸的菌株的亲本菌株。
用glpK突变体等位基因替换野生型glpK等位基因可通过使用在微生物基因工程中熟知的一种或其他基因工程技术来完成。通常,亲本菌株中的野生型glpK基因首先通过在该座位处插入抗生素标记基因而被替换。在第二阶段,抗生素标记基因被glpK的突变体等位基因替换。使用噬菌体介导的转导过程,可将该glpK的突变体等位基因从被报道具有glpK的突变体等位基因的菌株转移至受体菌株。备选地,可使用聚合酶链反应将突变体等位基因从受体菌株克隆至质粒载体中或直接克隆至染色体中。随后,可使用具有突变体glpK等位基因的质粒载体来转化受体细菌菌株。在本发明的另一个方面,当在核苷酸水平上已知glpK基因中突变体的性质时,可使用以合成的寡核苷酸进行的体外诱变以在质粒载体中生成突变体glpK等位基因。来自质粒载体的突变体glpK等位基因可通过转化随后双重重组用于替换野生型glpK等位基因。备选地,在线状DNA片段上含有的突变体glpK等位基因可通过转化随后双重重组用于替换野生型glpK等位基因。
在本发明的另一个实施方案中,通过克服由glpR基因编码的阻遏蛋白GlpR对glpF、glpK和glpABC基因表达的阻遏而赋予甘油途径的去调节。GlpR蛋白的阻遏效应可通过两种不同的方式克服。在第一种方法中,改变glpR基因的序列以使该GlpR蛋白在阻遏glpF、glpK和glpABC基因的表达中不再起作用。在优选的实施方案中,抑制GlpR蛋白自身的合成。GlpR蛋白合成的抑制可通过glpR基因序列的插入失活而实现。例如,可将抗生素标记盒插入到glpR开放阅读框中以使GlpR蛋白不再产生。在最优选的实施方案中,该glpR开放阅读框被准确地除去且在该座位没有剩余外来的核苷酸序列。
为了确保微生物细胞内的甘油利用途径被完全地去调节,除了完全地消除功能性glpR基因,优选含有反馈抗性glpK等位基因。这两种基因修饰可在野生型细菌菌株中实施以产生具有完全去调节的甘油利用途径的亲本菌株。随后可对该具有完全的去调节甘油利用途径的亲本菌株进一步进行特定的基因修饰和代谢进化以获得以高产量和产率产生特定的代谢产品例如琥珀酸或乳酸的细菌菌株。在优选的实施方案中,glpR基因的失活和glpK反馈抗性等位基因的导入在已经被遗传改造并代谢进化用于产生特定的商业上有用的化学品的菌株中实施。例如glpR基因的失活和glpK基因的反馈抗性等位基因的导入可在已经开发用于使用葡萄糖作为碳源产生琥珀酸的大肠杆菌KJ122菌株中实施。
在另一个实施方案中,GlpR介导的glpF、glpK和glpABC基因表达的阻遏通过将易受GlpR阻遏蛋白调节的glpF、glpK和glpABC基因的天然启动子区用不易受GlpR阻遏蛋白阻遏的组成型启动子替换而克服。在优选的实施方案中,在具有不易受GlpR阻遏的组成型启动子的细菌菌株中,将glpK基因的野生型等位基因用反馈抗性glpK等位基因替换。这两种导致甘油利用途径去调节的基因修饰可在野生型细菌菌株中实施,导致具有去调节的甘油利用途径的亲本菌株形成。可对此种具有去调节的甘油利用途径的亲本菌株进一步进行基因操作和代谢进化以产生能够使用甘油作为碳源产生商业上有用的化学品的细菌菌株。备选地,将glpF、glpK和glpABC基因的天然启动子用已知的组成型活性启动子替换和将glpK野生型等位基因用反馈抗性glpK等位基因替换可在已经开发用于商业上产生特定化学品的细菌菌株中实施。
本发明的微生物在微曝气的发酵培养基中生长。在本发明中优选的氧气供应速度(在3L的起始体积中以空气形式40ml/分钟)是约0.0026/分钟,基于发酵罐中培养基的起始体积,这相当于约228mg/升-小时的氧气。这一速度实质低于Trinh和Srienc(2009)的现有技术所建议的声称为0.15/分钟的最优速度,且实质高于Gonzalez和Campbell(WO/2010/051324)的现有技术所建议的被报道为1和20mg/升-小时之间的最优速度。
如本文所用的术语“遗传改造的的”或“基因工程的”指通过操作微生物的基因组DNA或质粒而改变微生物中一种或多种酶表达的实践。基因组操作包括改变、添加或从基因组DNA中移走特定的DNA序列。基因操作还包括将外来DNA序列插入该微生物的基因组DNA序列中。在本发明的最优选的实施方案中,通过从该微生物的基因组DNA中移走特定的DNA序列而不导入任何外来DNA,完成某些基因操作。对使编码特定蛋白质产物的基因的表达失活所必需的某些基因操作要求将外来DNA序列插入微生物的基因组中。在本发明的最优选的实施方案中,最终从微生物的基因组DNA移去导入的外源DNA序列,从而该微生物在基因工程过程结束时在其原始基因组DNA中将没有外源DNA。完成本发明优选实施方案的目标所必需的多项技术,包括代谢进化过程,已经在Jantama等(2008a,2008b)中详细描述。美国专利号7,629,162和美国专利申请公开号US2009/0148914及在专利合作条约下以国际公布号WO2008/115958和WO2010/115067公布的国际专利申请也描述了用于实施本发明多种实施方案的基因工程技术。出于为用于本发明的基因工程技术提供细节的目的,将这些引用的科学发表物以及专利文献通过引用方式并入本文。
实施例1
在菌株KJ122中除去甘油摄入和利用的负向调节
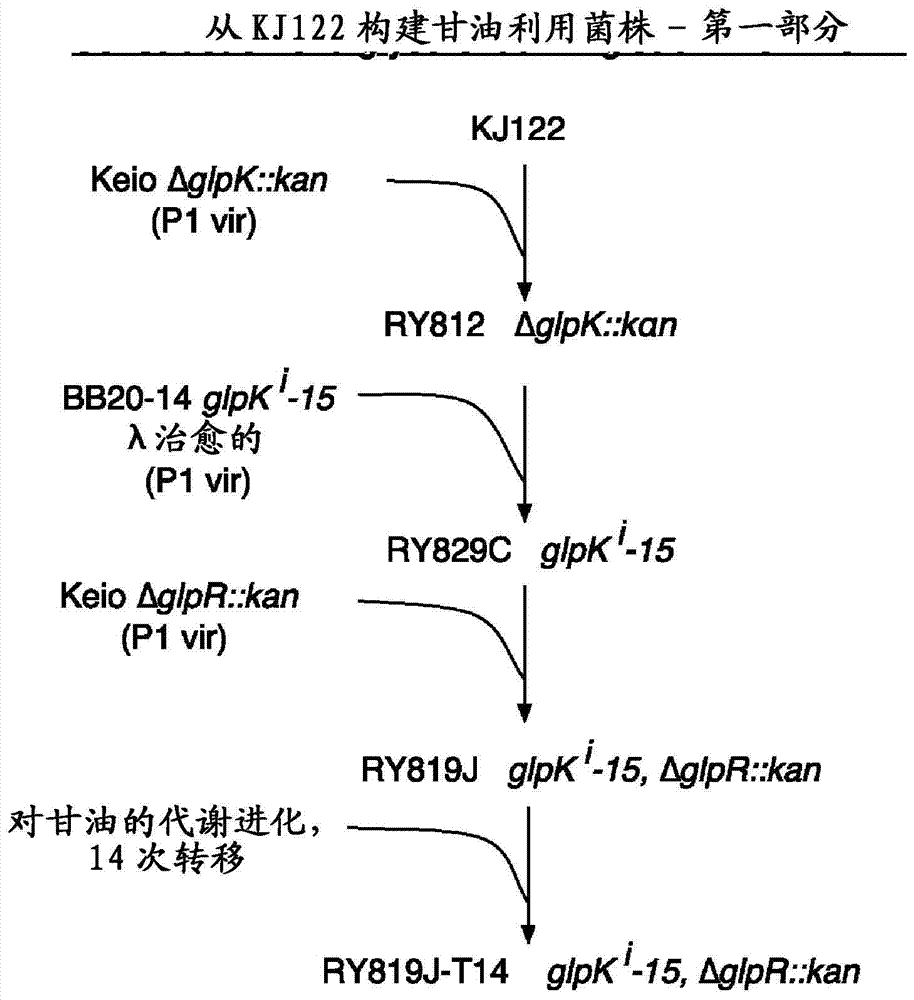
可使用三种不同的基本培养基用于平板选择细菌菌株、在试验管中产生琥珀酸盐或在pH受控制的发酵罐中产生琥珀酸盐。基本培养基在表1中列出。丰富肉汤或平板为Luria Broth,又称作“LB”(10g/l胰蛋白胨、5g/l酵母提取物、5g/l氯化钠)。从美国康涅狄格州纽黑文市耶鲁大学的Coli遗传库存中心(Coli Genetic Stock Center(CGSC))获得下述菌株:JW3386-1(ΔglpR::kan)和JW3897-1(ΔglpK::kan)。用P1vir使用普遍性噬菌体转导,来自JW3897-1的ΔglpK::kan等位基因被安置在KJ122中,使用在LB加上25mM柠檬酸钠中的50mg/l硫酸卡那霉素选择卡那霉素抗性,且通过在具有甘油作为唯一碳源的基本平板上缺乏生长确认ΔglpK::kan的正确安置(图2)。产生的菌株被命名为RY812。平行地,存在于菌株BB20-14(获自John Cronan,伊利诺伊州伊利诺伊大学香槟分校)中的野生型λ前噬菌体通过来自作为供体的、含有包括用于选择的N::kan的缺陷的λ前噬菌体的菌株TAP106(又称作ATCC47075)P1vir转导治愈,以通过如上所述的卡那霉素抗性选择产生菌株RY808。在第二步,来自RY808的含有glpKi15等位基因的glpK区被转导至RY812中,选择在基本SS甘油平板(参见表1)上生长且确认卡那霉素抗性丢失,以产生菌株RY829C。在第三步,JW3386-1的ΔglpR::kan等位基因被转导至RY829C中,如上所述选择卡那霉素抗性,以产生菌株RY819J,其是显示保留附近pck*等位基因的分离株(Zhang等,2009a;Zhang等,2009b)。
实施例2
在试验管中从甘油产生琥珀酸盐
菌株KJ122和RY819J在Luria Broth中有氧生长过夜,然后接种至在15ml有螺帽的聚丙烯试验管中的含有20g/l甘油的12.5ml的NBS培养基中以产生0.05OD600。将试管加盖盖紧并将其在New Brunswick Scientific滚式鼓上在37℃以大约60rpm转动48小时。通过Costar旋转过滤器离心除去细胞制备培养样品,必要时将培养样品在0.008M硫酸中稀释,并使用配备BioRad Aminex HPX-87H柱的Agilent Model1200装置通过高压液相色谱(HPLC)分析培养样品。在50℃、用0.008M硫酸作为溶剂运行柱,且通过折光率和在210nm处的吸收两者进行检测。分析样品中琥珀酸、甘油、葡萄糖、乙酸盐和其他副产品的浓度。使用源自纯的商业化合物的标准曲线计算每种化学品的浓度。KJ122产生0.06g/l琥珀酸盐,而RY819J产生0.61g/l琥珀酸盐,比起始菌株有明显改善。
实施例3
RY819J的代谢进化
菌株RY819J在含有10g/l葡萄糖和10g/l甘油的NBS培养基中有氧生长过夜,然后接种至500ml工作体积的有盖发酵罐中,所述发酵罐包含含有50g/l甘油和50g/l葡萄糖的300ml AM1培养基(参见表1),以产生0.2的起始OD600。将发酵罐用磁力搅拌器以150rpm搅拌,但不提供有意曝气。这样,发酵罐不是严格厌氧的,因为一些空气会在取样过程中和从碱添加导入。通过添加3M碳酸钾将pH控制在6.5,将温度保持在40℃。产生琥珀酸盐约48小时,甘油和葡萄糖被平行地消耗,但48小时之后,一部分甘油被剩下。最终的细胞密度约为3.0OD600。使用来自第一发酵罐的样品接种第二发酵罐至0.2的起始OD600,使用相同的培养基,并继续生长和生产琥珀酸盐。这一再接种步骤在本说明书中应被称为“转移”。在琥珀酸盐产生停止后,如上将接种物第二次转移至第三发酵罐,随后再进行几次转移。在最初的几次转移期间,培养基中含有葡萄糖以刺激生长。一般来说,在最初几次转移中生长是缓慢的,除非存在若干葡萄糖或硝酸钾,因此为了获得用于随后转移的充分生长,将若干葡萄糖或硝酸盐在多个时期添加到发酵罐以促进生长。最初的四次转移以50g/l葡萄糖加上50g/l甘油开始。第5到9次转移仅以50g/l甘油开始,没有葡萄糖,但为了获得用于下次转移的充分生长,在发酵期间添加10g/l葡萄糖。第10次转移首先补充1g/l硝酸钾,且稍后补充10g/l葡萄糖。表2中给出了添加剂和添加到发酵罐的时间的总结。从第11次转移开始,培养基中不加葡萄糖或硝酸盐;唯一的碳源是50g/l甘油。虽然如此,生长最终对进行转移是充分的。如上所述通过HPLC在多个时期对样品进行分析。在第11次转移,384小时后,所有的甘油均已被消耗且琥珀酸盐的滴度是425nM,其用碱稀释后经计算给出的产量为每克消耗的甘油1.08克琥珀酸盐。再进行三次转移,但菌株在产生琥珀酸方面的性能没有进一步显著的改善。从第14次转移分离单菌落,且将该分离株命名为RY819J-T14(图2)。
实施例4
多种glpK等位基因的DNA测序
从其获得本文所用的许多菌株的大肠杆菌C(ATCC8739)和大肠杆菌K-12的glpFKX操纵子的野生型DNA序列能够在位于美国国家卫生研究院(the National Institutes of Health)的GenBank数据库中找到,登录号分别为NC_010468和NC_000913。
使用来自下述大肠杆菌菌株的基因组DNA,通过聚合酶链反应(PCR)扩增被约一半glpF基因和一半glpX基因围绕的glpK基因:BB20-14、BB26-36、Lin225和Lin298。后三个菌株均从美国康涅狄格州纽黑文市耶鲁大学的Coli遗传库存中心(Coli Genetic Stock Center(CGSC))获得。根据CGSC,这四种菌株,即BB20-14、BB26-30、Lin225和Lin298,在其他突变中分别含有glpKi15、glpKi14、glpKi31和glpKi22。这其中,仅glpKi22已被测序,显示G304S氨基酸改变(Pettigrew等,1996;Honisch等2004)。然而,该序列源自从CGSC无法获得的菌株Lin43。因而本发明人使用能够获得的且被报告是源自Lin43的Lin298。用于扩增的PCR引物是BY19(SEQ ID no.1)和BY44(SEQ ID No.2)。PCR和测序引物的DNA序列在表3中给出。PCR试剂是来自New England BioLabs的Phusion Master Mix,其因供应商推荐而使用。从BB20-14、BB26-30、Lin225和Lin298获得的平末端DNA片段被凝胶纯化并克隆至pRY521(SEQID No.10)的Eco RV位点,以分别产生质粒pMH4-20、pMH4-26、pMH4-225和pMH4-298。
通过Sanger链终止法使用测序引物BY15(SEQ ID No.3)、BY16(SEQ ID No.4)、BY19(SEQ ID No.1)、BY30(SEQ ID No.6)和BY44(SEQ ID No.2)对来自这些质粒中的每一个的glpK基因和侧翼序列测序。四个质粒中的三个在glpK编码区含有突变。本说明书所给出的全部DNA序列坐标将开放阅读框的第一个碱基算作1且全部氨基酸坐标将起始密码子算作1。三字母氨基酸代码参见2007-2008New England BioLabs Catalog第361页。pMH4-20在glpK中具有两个点突变(G163A;Ala55Thr和G470A;Arg157His)且出乎意料地在glpF中具有单个点突变(C821T;Pro274Leu)。
pMH4-26在glpK中具有单个点突变(C164T;Ala55Val)且出乎意料地在glpF中具有单个点突变(G724A;Val242Ile)。pMH4-225在glpK中具有单个点突变(C176A;Ser59Tyr)但在glpF中没有突变。pMH4-298在已测序的区域中没有突变。该后一结果与已发表的文献相矛盾,所述已发表的文献暗示菌株Lin298应具有与Lin43(参见上文)相同的glpK突变。我们使用的Lin298的分离株不知为何似乎已经缺失了glpKi22等位基因,或我们的分离株事实上并非菌株Lin298,或Lin298事实上并非源自Lin43。
上述结果的最可能的解释是,glpK基因中的点错义突变导致编码的GlpK酶的已被证明或推断的反馈抗性。因为glpKi15等位基因含有两个单独的突变,有可能任何一个突变其自身都可赋予反馈抗性表型,但无论如何,发明人可推断两个突变的组合对于BB20-14中甘油激酶的反馈抗性表型是足够的。
除上述质粒之外,从KJ122和RY819J的glpK区构建了两个类似的质粒,以分别产生pMH4-KJ和pMH4-RY819。克隆的插入片段的DNA序列正如所预期。pMH4-KJ含有野生型glpK和glpF序列,而pMH4-RY819含有与pMH4-20的相同的序列,包括在glpK中的两个点突变和在glpF中的单个点突变。
实施例5
从RY819J-T14除去卡那霉素抗性基因
菌株RY819J-T14含有从菌株JW3386-1转导的ΔglpR::kan等位基因,菌株JW3386-1是“Keio Collection”(Baba等,2006)中的一员。这样,可通过将辅助质粒pCP20经过菌株除去卡那霉素抗性基因kan,剩下短DNA“痕(scar)”(Datsenko和Wanner,2000)。这一过程在RY819J-T14上进行以产生卡那霉素敏感衍生物,菌株MH23。
实施例6
在RY819J和派生物的glpF基因中发现的突变的矫正
在菌株BB20-14的glpF基因中发现点突变,且因为这一突变与glpK基因紧密连锁,其在RY819J中安置且向下传递给菌株MH23(参见实施例1和5)。通过使用与Jantama等(2008a,2008b)所描述的方法相似的两步基因替换方法,用野生型DNA序列替换该区而治愈glpF中的突变。在第一步,使用pCA2(SEQ ID No.11)作为模板以及引物BY71(SEQ ID No.6)和BY72(SEQ ID No.7)通过PCR扩增cat,sacB盒。将产生的3.2千碱基对的DNA片段转化至含有辅助质粒pKDE46的菌株MH23中(Datsenko和Wanner,2000),在LB加30mg/l氯霉素上选择氯霉素抗性,以产生菌株MH27(glpF::cat,sacB)。第二步,使用大肠杆菌C(ATCC8739)DNA作为模板以及引物BY73(SEQ ID No.8)和BY74(SEQ ID No.9)通过PCR扩增野生型glpF区。将获得的1.7千碱基对的DNA片段转化至MH27中,在LB加6%蔗糖上选择蔗糖抗性,并在LB加30mg/l氯霉素上确认氯霉素敏感性。获得的菌株在pKD46治愈后被命名为MH28(图3)。将MH28的glpF和glpK区测序以确认野生型glpF已经被安置且glpK中反馈抗性突变已经通过菌株构建的步骤被保留。
实施例7
在pH受控制的发酵罐中通过KJ122和MH28从甘油产生琥珀酸盐
在7升New Brunswick Scientific发酵罐中评估起始菌株KJ122和衍生菌株MH28产生琥珀酸盐,起始体积为3.15升,包括接种体(图5和6)。150ml接种体使用含有20g/l甘油和0.1M MOPS缓冲剂、pH7.0的NBS培养基(参见表1)在摇瓶中有氧生长过夜。将接种体加入到含有3升发酵培养基的发酵罐中,所述培养基标称包括120g/l甘油(A.C.S.级,Mallinckrodt Chemicals,目录号5092-02,CAS号56-81-5)作为唯一碳源(参见表1)。在时间零和发酵结束时测量的甘油浓度见表4。温度保持在39℃,且通过在需要时泵入3M碳酸钾将pH保持在7.0。通过以40ml/分泵入空气恒定微曝气,通过系统地改变曝气速度显示40ml/分足以以有吸引力的水平产生琥珀酸。叶轮速度是750rpm。
取样品并使用HPLC如上所述分析有机酸和甘油。通过48小时,甘油已经被菌株MH28完全消耗,但未被亲本菌株KJ122完全消耗(参见表4)。MH28产生84.3g/l琥珀酸盐,产量为1.0g/g消耗的甘油。唯一显著的副产品是3.3g/l的乙酸盐。相比之下,起始菌株KJ122在48小时仅产生18.9g/l琥珀酸盐且在最后的培养肉汤中剩余83.5g/l甘油,琥珀酸盐产量为0.6g/g消耗的甘油。显然,在测试条件下,菌株MH28产生琥珀酸盐与菌株KJ122相比有很大改善。
本领域技术人员将能够使用本文描述的方法构建与MH28相似的、但含有编码反馈抗性甘油激酶的glpK基因的其他等位基因的菌株。上文提到了多种可能的等位基因,包括glpKi14、glpKi22和glpKi31等位基因,以及Honisch等(2004)描述的等位基因。例如,导致甘油激酶中下述氨基酸改变的突变可被用于赋予反馈抗性表型:Gln28Pro、Trp54Gly、Val62Leu、Asp73Ala、Asp73Val、Gly231Asp,和235GlyGlyLys插入。
本领域技术人员还将意识到本文公开的方法可被用来构建将甘油发酵成其他有商业利益的有机酸如乳酸盐、苹果酸盐和延胡索酸盐的菌株。
尽管在本说明书中给出的具体实例使用大肠杆菌作为生产生物,并且实例中使用的基因使用大肠杆菌命名法(例如glpR(甘油-3-磷酸依赖阻遏物)、glpK(甘油激酶)、glpABC(甘油-3-磷酸脱氢酶)以及glpF(甘油易化扩散体)),本领域技术人员会了解,可以按照本说明书的教导改造来自其他微生物的这些组分的功能类似物和结构同源物的基因和蛋白质,以通过在其他微生物中的发酵实现提高的利用甘油产生有商业利益的化学品。
参考文献
本文列出全部的参考文献以方便读者。每一篇都全文引入。
美国专利号5,000,000
美国专利号5,028,539
美国专利号5,424,202
美国专利号5,482,846
美国专利号5,916,787
美国专利号6,849,439
美国专利号7,098,009
美国专利号7,223,567
美国专利号7,241,594
美国专利号7,244,610
美国专利号7,262,046
美国专利号7,470,530
美国专利号7,629,162
美国专利号7,790,416
美国专利申请公布号US2009/0176285
美国专利申请公开号US2009/0186392
美国专利申请公开号US2009/0148914
美国专利申请公开号US2010/0184171
美国专利申请公开号US2011/0008851
国际专利申请公布号WO/2007/115228
国际专利申请公布号WO2008/115958
国际专利申请公布号WO2009/024294
国际专利申请公布号WO2009/048202
国际专利申请公布号WO2010/051324
国际专利申请公布号WO2010/092155
国际专利申请公布号WO2010/115067
Baba,T.,Ara,T.,Hasegawa,M.,Takai,Y.,Okumura,Y.,Baba,M.,Datsenko,K.A.,Tomita,M.,Wanner,B.L.,and Mori,H.(2006)Construction of Escherichia coli K-12in-frame,single-gene knockout mutants:the Keio collection.Mol Syst Biol2:20060008.
Bell,R.M.(1974)Mutants of Escherichia coli defective in membrane phospholipid synthesis:macromolecular synthesis in an sn-glycerol3-phosphate acyltransferase Km mutant.J Bacteriol117:1065-1076.
Berman,M.,and Lin,E.C.(1971)Glycerol-specific revertants of a phosphoenolpyruvate phosphotransferase mutant:suppression by the desensitization of glycerol kinase to feedback inhibition,J Bacteriol105:113-120.
Blankschien,M.D.,Clomburg,J.M.,and Gonzalez,R.(2010)Metabolic engineering of Escherichia coli for the production of succinate from glycerol.Metab Eng12:409-419.
Chen,Z.,Liu,H.,Zhang,J.,and Liu,D.(2010)Elementary mode analysis for the rational design of efficient succinate conversion from glycerol by Escherichia coli.J Biomed Biotechnol2010:,518743.
Clomburg,J.M.,and Gonzalez,R.(2010)Biofuel production inEscherichia coli:the role of metabolic engineering and synthetic biology.Appl Microbiol Biotechnol86:419-434.
Clomburg,J.M.,Gonjalez,R.(2010)Metabolic Engineering of Escherichia coli for the production of1,2-propanediol from glycerol.Biotech.Bioeng.:108:867-879.
Cronan,J.E.,Jr.,and Bell,R.M.(1974a)Mutants of Escherichia coli defective in membrane phospholipid synthesis:mapping of the结构基因for L-glycerol3-phosphate dehydrogenase.J Bacteriol118:598-605.
Cronan,J.E.,Jr.,and Bell,R.M.(1974b)Mutants of Escherichia coli defective in membrane phospholipid synthesis:mapping of sn-glycerol 3-phosphate acyltransferase Km mutants.J Bacteriol120:227-233.
Datsenko,K.A.,and Wanner,B.L.(2000)One-step inactivation of chromosomal genes in Escherichia coli K-12using PCR products.Proc Natl Acad Sci U S A97:6640-6645.
De Guzman,D.(2010)ICIS Chemical Business,Volume18,p.48
Durnin,G.,Clomburg,J.,Yeates,Z.,Alvarez,P.J.,Zygourakis,K.,Campbell,P.,and Gonzalez,R.(2009)Understanding and harnessing the microaerobic metabolism of glycerol in Escherichia coli.Biotechnol Bioeng103:148-161.
Gonzalez,R.,Murarka,A.,Dharmadi,Y.,and Yazdani,S.S.(2008)A new model for the anaerobic fermentation of glycerol in enteric bacteria:trunk and auxiliary pathways in Escherichia coli.Metab Eng10:234-245.
Herring,C.D.,Raghunathan,A.,Honisch,C.,Patel,T.,Applebee,M.K.,Joyce,A.R.,Albert,T.J.,Blattner,F.R.,van den Boom,D.,Cantor,C.R.,and Palsson,B.O.(2006)Comparative genome sequencing of Escherichia coli allows observation of bacterial evolution on a laboratory timescale.Nat Genet38:1406-1412.
Honisch,C.,Raghunathan,A.,Cantor,C.R.,Palsson,B.O.,and vanden Boom,D.(2004)High-throughput mutation detection underlying adaptive evolution of Escherichia coli-K12.Genome Res14:2495-2502.
Jantama,K.,Haupt,M.J.,Svoronos,S.A.,Zhang,X.,Moore,J.C.,Shanmugam,K.T.,and Ingram,L.O.(2008)Combining metabolic engineering and metabolic evolution to develop nonrecombinant strains of Escherichia coli C that produce succinate and malate.Biotechnol Bioeng99:1140-1153.
Jantama,K.,Zhang,X.,Moore,J.C.,Shanmugam,K.T.,Svoronos,S.A.,and Ingram,L.O.(2008)Eliminating side products and increasing succinate yields in engineered strains of Escherichia coli C.Biotechnol Bioeng101:881-893.
Ibarra,R.U.,Edwards,J.S.,and Palsson,B.O.(2002)Escherichia coli K-12undergoes adaptive evolution to achieve in silico predicted optimal growth.Nature420:186-189.
Lin,E.C.(1996),in Escherichia coli and Salmonella:cellular and molecular biology,2nd ed.,ASM Press,Washington,D.C.,pp325-326.
Ondrey,G.(2004)Chemical Engineering,October,2004,p.13).
Palsson,B.O.(2011)Adaptive Laboratory Evolution,Microbe6,69-74.
Pettigrew,D.W.,Liu,W.Z.,Holmes,C.,Meadow,N.D.,and Roseman,S.(1996)A single amino acid change in Escherichia coli glycerol kinase abolishes glucose control of glycerol utilization in vivo.J Bacteriol 178.2846-2852.
Trinh,C.T.,and Srienc,F.(2009)Metabolic engineering of Escherichia coli for efficient conversion of glycerol to ethanol.Appl Environ Microbiol75.6696-6705.
Yazdani,S.S.,and Gonzalez,R.(2007)Anaerobic fermentation of glycerol:a path to economic viability for the biofuels industry.Curr OpinBiotechnol18:213-219.
Yazdani,S.,and Gonzalez,R..(2008)Engineering Escherichia coli for the efficient conversion of glycerol to ethanol and co-products.Metabolic Engineering10:340-351.
Zhang,X.,Jantama,K.,Moore,J.C.,Jarboe,L.R.,Shanmugam,K.T.,and Ingram,L.O.(2009)Metabolic evolution of energy-conserving pathways for succinate production in Escherichia coli.Proc Natl Acad Sci U S A106:20180-20185.
Zhang,X.,Jantama,K.,Shanmugam,K.T.,and Ingram,L.O.(2009)Reengineering Escherichia coli for Succinate Production in Mineral Salts Medium.Appl Environ Microbiol75:7807-7813.
Zhang,X.,Shanmugam,K.T.,and Ingram,L.O.(2010)Fermentation of glycerol to succinate by metabolically engineered strains of Escherichia coli.Appl Environ Microbiol76:2397-2401.
Zwaig,N.,and Lin,E.C.(1966)Feedback inhibition of glycerol kinase,a catabolic enzyme in Escherichia coli.Science153:755-757.
Zwaig,N.,Kistler,W.S.,and Lin,E.C.(1970)Glycerol kinase,the pacemaker for the dissimilation of glycerol in Escherichia coli.J Bacteriol102:753-759.
*中和碱是a:1.2M KOH+2.4M K2CO3;b:3M K2CO3
- 还没有人留言评论。精彩留言会获得点赞!