ASGPR抗体及其用途的制作方法
本发明总体上涉及对脱唾液酸糖蛋白受体(ASGPR)特异的抗体和它们用于选择性递送影响细胞活性的效应子部分的用途。此外,本发明涉及编码这类抗体的多核苷酸和包含这类多核苷酸的载体及宿主细胞。本发明还涉及用于产生本发明抗体的方法,以及涉及在治疗疾病时使用它们的方法。
背景
脱唾液酸糖蛋白受体(ASGPR)是由两个亚基H1和H2组成的跨膜受体。据信这些亚基通过它们的胞外茎区寡聚化。ASGPR是C型凝集素家族(钙离子依赖性凝集素)的成员并介导广泛类型的去唾液酸化糖蛋白的内吞和降解。ASGPR 选择性地在肝实质细胞(肝细胞)上表达,这使得它成为肝特异性疗法的有吸引力靶。许多肝病,例如肝炎、肝硬化或肝细胞癌(HCC),可能因病毒性感染如乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV)感染直接或间接引起。HCV慢性感染是肝硬化和HCC的主要病因之一。类似地,慢性HBV感染在美国占慢性肝病和肝硬化的5-10%。用于HBV和HCV感染的已批准疗法包括干扰素(IFN),如干扰素α。但是,在许多情况下,副作用已经阻碍这些疗法的开发和广泛使用。认为这类IFN相关的副作用部分归因于全身暴露于IFN后在外周血细胞中诱导干扰素刺激的基因(ISG)。因此,为了使得与肝病IFN疗法相关的副作用最小化并且还为了增进常规干扰素的抗病毒效果,希望向肝脏选择性递送IFN。已经将ASGPR视为肝细胞上用于这类选择性递送的潜在靶分子。例如,WO 92/22310描述一个通过重组IFN与脱唾液酸糖蛋白缀合将干扰素靶向肝脏的方案。在相似的方案中,已经修饰干扰素分子本身以产生与ASGPR结合的脱唾液酸-干扰素(Eto和Takahashi,Nat Med 5,577-581(1999))。最近,已经描述了一个基于抗ASGPR单一可变域(dAb)抗体的方案(WO 2011/086143)。
但是,这些方案迄今均未显示临床上成功,并且仍需要改进的靶向分子用于向肝脏选择性递送治疗性分子,例如干扰素。本发明的抗体组合了几个有利特性,这使得它们特别合适靶向效应子部分如干扰素至表达ASGPR的细胞,例如用于治疗肝病。
发明概述
在一个方面,本发明提供一种能够与脱唾液酸糖蛋白受体(ASGPR)特异性结合的抗体,其中抗体包含a)SEQ ID NO:16的重链可变区序列和SEQ ID NO: 14的轻链可变区序列;b)SEQ ID NO:4的重链可变区序列和SEQ ID NO:2的轻链可变区序列;c)SEQ ID NO:8的重链可变区序列和SEQ ID NO:6的轻链可变区序列;d)SEQ ID NO:12的重链可变区序列和SEQ ID NO:10的轻链可变区序列;e)SEQ ID NO:20的重链可变区序列和SEQ ID NO:18的轻链可变区序列;f)SEQ ID NO:24的重链可变区序列和SEQ ID NO:22的轻链可变区序列;g)SEQ ID NO:28的重链可变区序列和SEQ ID NO:26的轻链可变区序列; h)SEQ ID NO:4的重链可变区序列和SEQ ID NO:30的轻链可变区序列;i)SEQ ID NO:4的重链可变区序列和SEQ ID NO:32的轻链可变区序列;j)SEQ ID NO: 4的重链可变区序列和SEQ ID NO:34的轻链可变区序列;或k)SEQ ID NO:24 的重链可变区序列和SEQ ID NO:22的轻链可变区序。
在一个具体实施方案中,抗体包含SEQ ID NO:16的重链可变区序列和 SEQ ID NO:14的轻链可变区序列。在另一个具体实施方案中,抗体包含SEQ ID NO:4的重链可变区序列和SEQ ID NO:2的轻链可变区序列。
在又一个方面,本发明提供一种能够与ASGPR特异性结合的抗体,其中该抗体与包含SEQ ID NO:16的重链可变区序列和SEQ ID NO:14的轻链可变区序列的抗体竞争与ASGPR的表位的结合。在一个实施方案中,所述抗体识别ASGPR茎区中的表位。在一个实施方案中,所述抗体是包含SEQ ID NO:16 的重链可变区序列和SEQ ID NO:14的轻链可变区序列的抗体的亲和力成熟变体。在一个实施方案中,所述抗体包含至少约96%、97%、98%或99%与SEQ ID NO:16的序列同一的重链可变区序列和至少约96%、97%、98%或99%与 SEQ ID NO:14的序列同一的轻链可变区序列。在一个实施方案中,所述抗体包含SEQ ID NO:14的具有一个、两个、三个、四个、五个、六个或七个、特别地两个、三个、四个或五个氨基酸置换的轻链可变区序列。在一个实施方案中,所述抗体包含SEQ ID NO:16的具有一个、两个、三个、四个、五个、六个或七个、特别地两个、三个、四个或五个氨基酸置换的重链可变区序列。
在仍然又一个方面,本发明提供一种能够与ASGPR特异性结合的抗体,其中该抗体与包含SEQ ID NO:4的重链可变区序列和SEQ ID NO:2的轻链可变区序列的抗体竞争与ASGPR的表位的结合。在一个实施方案中,所述抗体识别ASGPR的糖识别结构域(CRD)中的表位。在一个实施方案中,所述抗体是包含SEQ ID NO:4的重链可变区序列和SEQ ID NO:2的轻链可变区序列的抗体的亲和力成熟变体。在一个实施方案中,所述抗体包含至少约96%、97%、 98%或99%与SEQ ID NO:4的序列同一的重链可变区序列和至少约96%、 97%、98%或99%与SEQ ID NO:2的序列同一的轻链可变区序列。在一个实施方案中,所述抗体包含SEQ ID NO:2的具有一个、两个、三个、四个、五个、六个或七个、特别地两个、三个、四个或五个氨基酸置换的轻链可变区序列。在一个实施方案中,所述抗体包含SEQ ID NO:4的具有一个、两个、三个、四个、五个、六个或七个、特别地两个、三个、四个或五个氨基酸置换的重链可变区序列。在一个实施方案中,所述抗体包含a)SEQ ID NO:4的重链可变区序列和SEQ ID NO:36的轻链可变区序列;b)SEQ ID NO:4的重链可变区序列和 SEQ ID NO:38的轻链可变区序列;c)SEQ ID NO:4的重链可变区序列和SEQ ID NO:40的轻链可变区序列;d)SEQ ID NO:4的重链可变区序列和SEQ ID NO:42的轻链可变区序列;e)SEQ ID NO:4的重链可变区序列和SEQ ID NO: 44的轻链可变区序列;f)SEQ ID NO:4的重链可变区序列和SEQ ID NO:46的轻链可变区序列;或g)SEQ ID NO:4的重链可变区序列和SEQ ID NO:48的轻链可变区序列。
在一个实施方案中,本发明的抗体能够与人ASGPR和食蟹猴ASGPR特异性结合。在一个实施方案中,作为Fab片段通过表面等离子体共振法(SPR)测量时,抗体以小于1μM、特别地小于100nM、更特别地小于1nM的解离常数(KD) 与人ASGPR结合。在一个实施方案中,作为IgG1通过荧光共振能量转移法 (FRET)测量时,抗体以小于1μM、特别地小于500nM、更特别地小于100nM 或甚至小于10nM的KD与人ASGPR结合。在一个实施方案中,抗体不与 ASGPR的天然配体竞争结合于ASGPR。在一个具体实施方案中,所述ASGPR 的天然配体是脱唾液酸胎球蛋白。在一个实施方案中,抗体不与CLEC10A、特别是不与人CLEC10A可检测地结合。在一个实施方案中,抗体不与缺少ASGPR 表达的细胞、特别地人细胞、更特别地人血细胞特异性结合。在一个实施方案中,一旦抗体与表达ASGPR的细胞的表面上的ASGPR结合,抗体内化至所述细胞中。在一个具体实施方案中,抗体按照大致与它内化至所述细胞中的相同速率再循环返回所述细胞的表面。在一个实施方案中,一旦抗体与所述细胞表面上的ASGPR结合,抗体不显著地引起细胞表面处ASGPR表达的下调。
在一个实施方案中,本发明的抗体是人抗体。在一个实施方案中,抗体包含人Fc区、特别地IgG Fc区、更特别地IgG1 Fc区。在一个实施方案中,抗体是全长抗体。在一个实施方案中,抗体是IgG类抗体,特别地是IgG1亚类抗体。在一个实施方案中,抗体在Fc区中包含减少抗体对Fc受体、特别地对Fcγ受体的结合亲和力的修饰。在一个具体实施方案中,所述Fc受体是活化性Fc受体。在又一个具体实施方案中,所述Fc受体选自FcγRIIIa(CD16a)、FcγRI (CD64)、FcγRIIa(CD32)和FcαRI(CD89)。在一个更具体的实施方案中,所述 Fc受体是FcγRIIIa,特别地是人FcγRIIIa。在一个实施方案中,抗体在选自 P329、L234和L235(EU编号)的位置包含Fc区内的氨基酸置换。在一个实施方案中,抗体在Fc区中包含氨基酸置换P329G、L234A和L235A(EU编号)。在又一个实施方案中,抗体在Fc区中包含促进两条不相同抗体重链异二聚化的修饰。在一个具体实施方案中,所述修饰是隆突入穴(knob-into-hole)修饰,包括在抗体重链之一中的隆突修饰和在两条抗体重链的另一条重链中的穴修饰。在一个实施方案中,抗体包含在CH3域中两条抗体重链之间界面内部的修饰,其中i)在一条重链的CH3域中,将氨基酸残基替换为具有更大侧链体积的氨基酸残基,因而在一条重链的CH3域中的界面内部产生突出部分(“隆突”),所述突出部分可安置于另一条重链的CH3域中界面内部的空腔(“穴”)中,和ii)在另一条重链的CH3域中,将氨基酸残基替换为具有更小侧链体积的氨基酸残基,因而在第二CH3域中的界面内部产生空腔(“穴”),在所述空腔内部可安置第一 CH3域中界面内部的突出部分(“隆突”)。在一个实施方案中,抗体在抗体重链之一中包含氨基酸置换T366W和任选地氨基酸置换S354C,并且在另一条抗体重链中包含氨基酸置换T366S、L368A、Y407V和任选地Y349C。
在一个方面,本发明提供一种根据任一个以上实施方案能够与ASGPR特异性结合的抗体,其中效应子部分与抗体连接。在一个实施方案中,不多于一个效应子部分与抗体连接。在一个实施方案中,所述效应子部分是细胞因子分子。在一个实施方案中,所述细胞因子分子在其氨基端氨基酸与抗体重链之一的羧基端氨基酸融合,任选地通过肽接头融合。在一个实施方案中,所述细胞因子分子是人细胞因子。在一个实施方案中,所述细胞因子分子是干扰素分子。在一个具体实施方案中,所述干扰素分子是干扰素α,特别地是人干扰素α,更特别地是人干扰素α2(参见SEQ ID NO:138)或人干扰素α2a(参见SEQ ID NO: 139))。在细胞因子分子是干扰素分子的一个实施方案中,抗体在细胞表面上表达ASGPR的细胞中具有抗病毒活性。在一个具体实施方案中,抗体在细胞表面上不表达明显水平的ASGPR的细胞中没有抗病毒活性。在又一个具体实施方案中,所述抗病毒活性选自抑制病毒性感染、抑制病毒复制、抑制细胞杀伤和诱导干扰素刺激的基因。
本发明还提供编码本发明抗体的多核苷酸。还提供载体,特别是表达载体,其包含本发明的多核苷酸。在另一个方面,本发明提供了包含本发明多核苷酸或载体的宿主细胞。本发明也提供一种用于产生本发明抗体的方法,包括步骤(i) 在适于表达所述抗体的条件下培养本发明的宿主细胞,和(ii)回收所述抗体。还提供通过所述方法产生的能够与ASGPR特异性结合的抗体。
在一个方面,本发明提供一种包含本发明抗体和可药用载体的药物组合物。还提供本发明抗体或药物组合物用作药物和用于治疗或预防肝病、特别地是病毒性感染、更特别地是肝炎病毒感染、尤其是乙型肝炎病毒(HBV)感染。还提供本发明的抗体或药物组合物用于治疗或预防癌症、特别地是肝癌、更特别地是肝细胞癌(HCC)。进一步提供本发明抗体用于制造在有需求的个体中治疗疾病的药物和治疗个体疾病的方法,所述方法包含向所述个体施用治疗有效量的组合物,所述组合物包含处于可药用形式的本发明抗体。在一个实施方案中,所述疾病是肝病。在一个更具体的实施方案中,所述肝病是病毒性感染。在一个甚至更具体的实施方案中,所述肝病是肝炎病毒感染,特别是HBV感染。在另一个实施方案中,所述疾病是癌症。在一个更具体的实施方案中,所述癌症是肝癌。在一个甚至更具体的实施方案中,所述肝癌是肝细胞癌(HCC)。在一个实施方案中,所述个体是哺乳动物,特别是人。在又一个方面,提供本发明的抗体用于靶向个体中表达ASGPR的细胞。还提供用于靶向个体中表达ASGPR 的细胞的方法,包括向所述个体施用组合物,所述组合物包含处于可药用形式的本发明抗体。在一个实施方案中,所述细胞是肝脏细胞,特别地是肝细胞。在一个实施方案中,所述个体是哺乳动物,特别是人。
附图简述
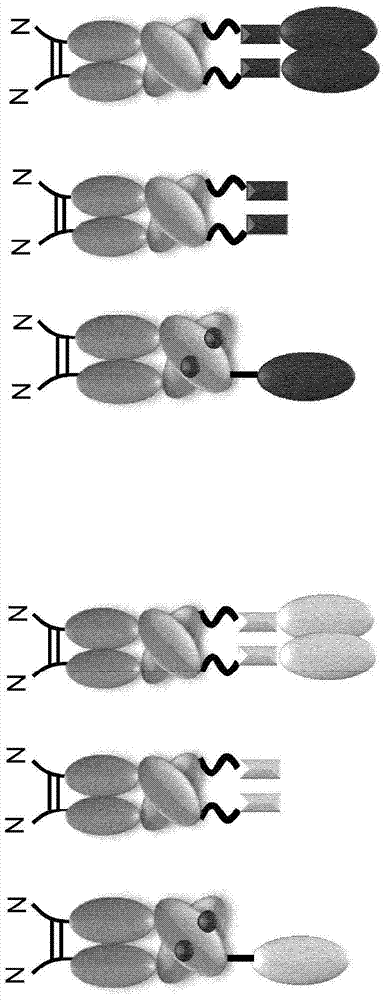
图1.产生的抗原构建体的示意图。全部抗原的核苷酸序列与人衍生的IgG1 Fc序列的C末端融合。ASGPR1衍生的和CLEC10A衍生的CRDs与编码Fc(穴) 片段的序列融合并且与编码Fc(结)片段的序列共表达,导致每个Fc二聚体展示单聚体。从左至右:Fc-CRD(ASGPR1)、Fc-茎(ASGPR1)、Fc-茎-CRD (ASGPR1)、Fc-CRD(CLEC10A)、Fc-茎(CLEC10A)、Fc-茎-CRD(CLEC10A)。粗弯曲线:(G4S)3接头;粗直线:Xa和IgAse切割位点。
图2.产生在重链和轻链的CDR3区内随机化的类属性Fab文库的概略图。在第一步骤中,产生三个PCR片段,它们随后通过(由重叠延伸法剪接;SOE) PCR融合。将最终片段进行凝胶纯化,用NcoI/NheI消化,同时类似地处理接纳体噬菌粒,连接并转化至细菌中。PCR1(A、B、C):(1)LMB3;(2)(A) VI_3_19_L3r_V/(B)VI_3_19_L3r_HV/(C)VI_3_19_L3r_HLV。PCR2:(3) RJH80;(4)DP47CDR3_ba(mod)。PCR3(A、B、C):(5)(A)DP47v44/(B) DP47v46/(C)DP47v48;(6)fdseqlong。
图3.选择的抗人ASGPR H1特异性克隆作为人IgG1抗体对HepG2细胞的结合分析。抗体浓度是30μg/ml。同种型对照抗体充当阴性对照。
图4.对表达铽标记的跨膜ASGPR H1-SNAP标签融合蛋白的瞬时转染细胞的FRET分析。通过以下方式进行分析:以范围50-0.39nM的浓度添加抗体,随后添加抗人Fc-d2(最终的200nM每孔)作为接纳分子。3小时后测量特异性 FRET信号并计算KD值(KD51A12=200nM,KDR7F12=22nM,KDR9E10=6.2nM, KDR5C2=5.9nM,KD4F3=4.5nM)。
图5和图6.脱唾液酸胎球蛋白(ASGPR的天然配体)和抗ASGPR H1抗体的竞争。在稀释列中添加所示抗体至细胞之前,将HepG2细胞用标记的脱唾液酸胎球蛋白预温育。通过FACS分析法分析两种组分与细胞的结合。(A)抗体检测; (B)脱唾液酸胎球蛋白检测。
图7.作为IgG的两种抗人ASGPR H1抗体克隆51A12和4F3的内化分析。 (A)将抗体与HepG2细胞在4℃温育以防止内化并且在4℃洗涤,之后将细胞在预温的培养基中培养并在37℃温育多达120分钟。将样品在指示的时间点取出,在冰上用第二抗体标记并使用PFA固定。(B)如(A)下所述那样进行相同步骤,不过将抗体在37℃与细胞温育,从而允许ASGPR内化。(C)如(A)下所述那样进行相同步骤,不过使用直接FITC标记的抗体。使用PE缀合的抗Fc抗体检测细胞表面结合的抗体。(D)如(C)下所述那样进行相同实验,不过显示代表表面暴露的抗体和内化抗体的FITC信号。
图8.克隆51A12的LCDR3区的随机化策略。显示(A)亲本克隆51A12的 LCDR3蛋白质序列,(B)充当无半胱氨酸和糖基化序列的文库模板的质粒的 LCDR3蛋白质序列,和(C)LCDR3中的随机化位置。在产生文库期间,三核苷酸引物允许排除编码半胱氨酸或有助于糖基化位点形成的氨基酸的三联体。
图9.产生在模板51A12(A82G、C112S、C113S、S116A)(SEQ ID NO:33) 的LCDR3中随机化的亲和力成熟文库的概略图。在第一步骤中,产生两个PCR 片段,它们随后通过(SOE)PCR融合。将最终片段进行凝胶纯化,用NcoI/PstI 消化,同时类似地处理接纳体噬菌粒,连接并转化至细菌中。PCR1:(1)LMB3, (2)LCDR3rev。PCR2:(3)LCDR3rand,(4)fdseqlong。
图10.亲和力成熟的51A12衍生克隆作为人Fab片段对HepG2细胞的结合分析。使用Fab浓度:10、3.3和1.1μg/ml。亲本克隆51A12(SEQ ID NO:2和 4)、51A12(S116A)(SEQ ID NO:4和30)(缺少糖基化序列的克隆)和 51A12(A82G、C112S、C113S、S116A)(SEQ ID NO:4和34)(亲和力成熟文库的模板克隆)充当对照。
图11.亲和力成熟的51A12衍生克隆作为作为人IgG1抗体对HepG2细胞的结合分析。使用范围从0.01至20μg/ml的稀释列中的浓度。亲本克隆51A12(SEQ ID NO:2和4)充当对照(A)。作为阴性对照以浓度10μg/ml使用,对Hela细胞的结合分析(B)。
图12.产生的抗体-细胞因子缀合物的示意图。编码干扰素-α2a的基因与包含隆突修饰的ASGPR H1特异性抗体重链的C末端融合。尽管通过共表达相应的包含穴修饰的ASGPR H1特异性重链和轻链((A),2:1价态)实现抗体-细胞因子蛋白的二价ASGPR结合作用,但是Fc(穴)片段序列的表达产生了每分子仅具有一个ASGPR H1特异性结合位点的单体抗体-细胞因子缀合物((B),1:1价态)。小黑点:防止FcγR结合的修饰(例如L234A L235A P329G)。大黑点:促进异二聚化的修饰(例如隆突入穴)。
图13-19.选择的抗体-IFNα免疫缀合物的纯化和分析性表征(图13:51A12 kih IgG-IFNα;图14:4F3 kih IgG-IFNα;图15:51A12(C7)kih IgG-IFNα;图16:51A12(C1)kih IgG-IFNα;图17:51A12(E7)kih IgG-IFNα;图18:同种型对照kih IgG-IFNα;图19:单价的51A12 kih IgG-IFNα)。纯化方法涉及亲和步骤(蛋白质A)(A),随后大小排阻层析(Superde x 200,GE Healthcare)(B)。分析并通过分析性大小排阻层析(Superde x 200柱)(C)和微流体蛋白质分析 (Caliper)或SDS-PAGE(D)表征终产物。
图20.ASGPR特异性IgG kih IFNα融合构建体51A12(A)和4F3(B)的结合选择性。将HepG2、人原代肝细胞、Huh-7细胞、A549细胞、Hela细胞和293T 细胞与1μg/ml 51A12-IFNα(A)或4F3-IFNα(B)在冰上温育45分钟。在三次洗涤后,将细胞用山羊抗人IgG第二抗体在冰上染色30分钟并且将细胞洗涤3次,之后使用Calibur流式细胞仪分析。使用 R-藻红蛋白人IgG标记试剂盒根据制造商的说明书,通过使用1μg/ml直接标记的51A12 IgG kih IFNα(A) 和4F3 IgG kih IFNα(B)进行与人PBMC的结合,分别使用同种型IgG kih IFNα和CD81mAb作为阴性对照和阳性对照。
图21.ASGPR mAb 4F3-IFNα在人原代肝细胞和HepG2细胞上的结合饱和曲线。ASGPR mAb 4F3-IFNα在衍生自三位不同供体的人肝细胞(A-C)和 HepG2细胞(D)上的结合饱和作用。将细胞与连续稀释的4F3 IgG kih IFNα在冰上温育45分钟。在三次洗涤后,将细胞用山羊抗人IgG第二抗体在冰上染色 30分钟并且再洗涤3次,之后使用Calibur流式细胞仪分析。
图22.分析ASGPR在特异性抗体存在下随时间推移的表面暴露水平。将 HepG2细胞与ASGPR特异性克隆51A12 IgG或相应的单价或二价抗体-细胞因子缀合物温育。直至5小时后取得细胞样品并且通过检测抗体(A)或细胞因子(B) 测量IgG构建体对ASGPR的结合。使用抗CD20抗体(GA101)作为阴性对照。
图23.克隆51A12抗体-细胞因子缀合物的快速内化。将Alexa488标记的 51A12 IgG kih IFNα构建体与HepG2细胞温育并且通过共聚焦显微术在10堆栈范围内将ASGPR介导的构建体内化记录1小时(z-水平)。抗体-细胞因子缀合物在细胞表面上的结合以簇集方式发生,而非均一分布(A)。一旦与细胞表面结合,缀合物非常迅速地内化于小泡中,所述小泡转运至细胞体中(B,包围的单个细胞)。小泡随后再循环返回细胞的顶面(未显示)。
图24.ASGPR mAb-IFNα分子和其他对照IFN分子在EMCV CPE(A)测定法和HCV复制子(B)测定法中的抗病毒活性。(A)将Hela细胞用连续稀释的IFN 分子预处理3小时,之后添加EMCV病毒。将细胞培养24小时,并通过添加 CellTiter Glo测量细胞生存力。(B)将Huh-72209复制子细胞用连续稀释的IFN 分子处理并在3日后测量萤光素酶活性。
图25.多种肝细胞和非肝细胞中ISG受51A12-IFNα诱导。将肝细胞(原代肝细胞(B)和HepG2(A))和非肝细胞(人PBMC(D)和Hela(C))用多种连续稀释的 IFNα分子处理6小时,提取总RNA并且将TaqMan RT-PCR用来对ISG MX1 (A、C)和Rsad2(B、D)基因表达定量。显示的数据来自三个或更多个实验。
图26.人原代肝细胞(PHH)(B)和Huh7(A)细胞中ISG受51A12-IFNα和 4F3-IFNα持久诱导。将人原代肝细胞(PHH)和Huh7细胞用连续稀释的IFNα分子处理6小时(左侧)和72小时(右侧),提取总RNA并且将TaqMan RT-PCR 用来对ISG MX1(A)和Rsad2(B)基因表达定量。
图27.猴肝脏样品中的代表性ISG表达。通过微阵列分析来自四个剂量组的在不同时间点采集的猴肝脏样品。以3D图显示4个代表性ISG基因的表达。指示4个剂量组。对于每种剂量组,从左至右,棒代表在3只猴的第-5日、第 2日、第4日和第8日时的ISG倍数诱导作用。
图28.血液和肝脏基因表达热图(IFN模块M3.1)。对血液PBMC样品和肝脏活组织检查样品进行mRNA微阵列分析,并且用从血液转录组学研究确定的基因模块分析它们的IFNα响应(Chaussabel等人,(2008),Immunity 29,150-64)。在小图(A)中,使用R统计学软件包(www.r-project.org),将干扰素模块M3.1 的基因距基线(参见插图)的倍数变化表达值以热图形式对血液样品和肝脏样品作图。肝脏干扰素诱导的基因的非监督式层次聚类揭示在10μg/kg剂量的51A12 时受高度诱导的子集(划虚线的矩形),但是在第1日和第3日同种型-IFNα化合物并非如此。(B)将这个基因子集对肝脏和血液作图。对这个子集作非监督式层次聚类,揭示血液和肝脏之间的差异性表达模式,其中热图的上半部分显示在 10μg/kg剂量时51A12于肝脏中诱导表达,但是同种型-IFNα不诱导表达,并且下半部分中显示在高剂量时血液中仅同种型-IFNα诱导表达。
发明详述
定义
除非下文中另外定义,否则术语如本领域通常所用那样在本文使用。
“脱唾液酸糖蛋白受体”,缩写为ASGPR,指来自任何脊椎动物来源的任何天然ASGPR,其中除非另外说明,否则所述脊椎动物来源包括哺乳动物,如灵长类(例如人)、非人灵长类(例如食蟹猴)和啮齿类(例如小鼠和大鼠)。本术语涵盖“全长”、未加工的ASGPR以及因细胞中加工而产生的任何形式的ASGPR。本术语还涵盖ASGPR的天然存在变体,例如,剪接变体或等位变体。在一个实施方案中,本发明的抗体能够特异性结合至人ASGPR、特别地人ASGPR H1,更特别地人ASGPR H1的胞外结构域。
人ASGPR H1(也称作CLEC4H1)的氨基酸序列以UniProt (www.uniprot.org)登录号P07306(131版)或NCBI(www.ncbi.nlm.nih.gov/) RefSeq NP_001662.1显示。人ASGPR H1的胞外结构域(ECD)从氨基酸位置62 延伸至氨基酸位置291。与人Fc区融合的人ASGPR H1 ECD的核苷酸序列和氨基酸序列分别在SEQ ID NO:129和130中显示。ASGPR H1 ECD包含茎区,其从全序列的氨基酸位置62延伸至约氨基酸位置160(SEQ ID NO:123和124 显示与人Fc区融合的人ASGPR H1茎区的核苷酸序列和氨基酸序列),和糖识别结构域(CRD),其从全序列的氨基酸位置161延伸至约氨基酸位置278(SEQ ID NO:117和118显示与人Fc区融合的人ASGPR H1 CRD区的核苷酸序列和氨基酸序列)。
在一个实施方案中,抗体还能够结合至食蟹猴ASGPR、特别地食蟹猴 ASGPR H1,更特别地食蟹猴ASGPR H1的胞外结构域。食蟹猴ASGPR H1的序列以NCBI GenBank登录号EHH57654.1显示。SEQ ID NO:131和132分别显示与人Fc区融合的食蟹猴ASGPR H1 ECD的核苷酸序列和氨基酸序列。
“人CLEC10A”意指以UniProt登录号Q8IUN9(86版)描述的蛋白质,特别地指所述蛋白质的胞外结构域,其从全序列的氨基酸位置61延伸至氨基酸位置 316。SEQ ID NO:133和134分别显示与人Fc区融合的人CLEC10A ECD的核苷酸序列和氨基酸序列。
如本文所用,术语“缀合物”指包括一个效应子部分和又一种肽分子(特别地是抗体)的融合多肽分子。抗体和效应子部分的融合蛋白称作“免疫缀合物”。如本文提到的(免疫)缀合物是融合蛋白,即(免疫)缀合物的组分彼此通过肽键直接连接或借助肽接头连接。
“表位”是抗原中被抗体结合的区域。本术语涉及在多肽大分子上与抗体结合,形成抗体-抗原复合物的部位(例如一段连续氨基酸或由不同区域的不连续氨基酸构成的构象构型)。
“与参考抗体竞争结合某表位的抗体”指在竞争测定法中50%或更大地阻断参考抗体与其抗原的结合作用的抗体,并且反过来,参考抗体在竞争测定法中 50%或更大地阻断该抗体与其抗原的结合作用。本文提供示例性竞争测定法。
如本文所用,术语“特异性结合”意指结合作用对抗原具有选择性并且可以与不想要的或非特异的相互作用区别。抗体与特定抗原结合的能力可以通过酶联免疫吸附测定(ELISA)或本领域技术人员熟悉的其他技术,例如表面等离子体共振(SPR)技术(在BIAcore仪上分析)(Liljeblad等人,Glyco J 17,323-329(2000)) 和常规结合测定法(Heeley,Endocr Res 28,217-229(2002))测量。在一个实施方案中,抗体与不相关蛋白质结合的程度小于抗体与抗原结合的程度约10%,如通过SPR所测量。在某些实施方案中,与抗原结合的抗体具有≤1μM、≤100nM、≤10nM、≤1nM、≤0.1nM、≤0.01nM、或≤0.001nM(例如10-8M或更小、例如从10-8M至10-13M、例如从10-9M至10-13M)的解离常数(KD)。
“亲和力”或“结合亲和力”指分子(例如抗体)的单一结合位点及其结合配偶物(例如抗原)之间非共价相互作用的强度总和。除非另外指出,否则如本文所用,“结合亲和力”指反映结合对子的成员(例如,抗体和抗原)之间1:1相互作用的固有结合亲和力。分子X对其配偶物Y的亲和力可以通常由解离常数(KD)代表,解离常数是解离速率常数和缔合速率常数(分别是koff和kon)的比例。因此,等同亲和力可以包含不同的速率常数,只要速率常数的比例保持相同。亲和力可以由本领域已知的常见方法测量,包括本文所述的那些方法。用于测量亲和力的具体方法是表面等离子体共振法(SPR)。
“减少的结合作用”,例如减少的Fc受体结合作用,指相应相互作用的亲和力下降,如通过例如SPR测量。为清晰起见,该术语还包括亲和力减少到零(或低于分析方法的检测限),即相互作用完全消除。相反地,“增加的结合作用”指相应相互作用的结合亲和力增加。
“内化”意指分子因所述分子的摄取从细胞的表面移入胞内空间。一个特定形式的内化是受体介导的内吞作用,这在配体或抗体与细胞表面(跨膜)受体结合时通过含有受体和结合的配体或抗体的质膜小泡向内芽状凸起发生。可以使用现有已知的技术评估内化。本文实施例中描述了一种基于通过FACS确定细胞表面上蛋白质水平的方法。
如本文所用,术语“再循环”指在分子先前内化入细胞后,该分子在所述细胞的表面上再出现。再循环提示当内化时,分子在细胞内部未降解。如果再循环按照与内化相同的速率出现,则达到动态稳态,其中分子在细胞表面上的数目保持基本上恒定。可以通过本领域熟知的技术检测到再循环,例如通过借助 FACS或使用如下文实施例中所述的(共聚焦)显微方法确定细胞表面上的蛋白质水平。
“下调”意指在细胞内部或在其表面处某种蛋白质(例如细胞表面受体)的拷贝数减少。如本文所用的下调特别指细胞表面处存在的细胞表面蛋白的拷贝数例如因内化和/或降解或表达减少而减少。可以通过本领域建立的多种方法检测蛋白质水平的下调,所述方法包括例如蛋白质印迹法(用于总蛋白水平)或 FACS(用于表面蛋白水平)。
如本文所用,术语“效应子部分”指影响细胞活性(例如通过信号转导或其他细胞的途径)的分子,特别是多肽分子(例如蛋白质或糖蛋白)。因此,效应子部分可以与受体介导的信号传导过程相关,其中所述信号传导过程传播来自细胞膜外部的信号以调节携带该效应子部分的一种或多种受体的细胞中的反应。在一个实施方案中,效应子部分可以在携带该效应子部分的一种或多种受体的细胞中激发细胞毒反应。在另一个实施方案中,效应子部分可以在携带该效应子部分的一种或多种受体的细胞中激发增殖反应。在另一个实施方案中,效应子部分可以在携带该效应子部分的受体的细胞中激发分化。在另一个实施方案中,效应子部分可以在携带该效应子部分的受体的细胞中改变(即上调或下调)内源细胞蛋白的表达。效应子部分的非限制性例子包括小分子、细胞因子、生长因子、激素、酶、底物和辅因子。效应子部分可以与处于多种构型的抗体缔和。
术语“连接”包括通过任何种类的相互作用(包括化学键或肽键)连接。
“融合的”指由肽键直接连接或借助一个或多个肽接头连接的组分。
如本文所用,术语“细胞因子”指介导和/或调节生物学功能或过程或细胞功能或过程(例如免疫力、炎症和造血)的分子。如本文所用的术语“细胞因子”包括淋巴因子、趋化因子、单核因子和白介素。细胞因子的例子包括但不限于 GM-CSF、IL-1α、IL-1β、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-10、 IL-12、IFN-α、IFN-β、IFN-γ、MIP-1α、MIP-1β、TGF-β、TNF-α和TNF-β。具体的细胞因子是干扰素(IFN),特别地是IFN-α。在具体的实施方案中,细胞因子是人细胞因子。作为具体细胞因子的人IFNα2和IFNα2a的序列分别以SEQ ID NO:138和139显示。
“干扰素刺激的基因”(ISG)指其在细胞中的表达可以通过使所述细胞与干扰素分子、尤其IFNα分子接触来刺激的基因。一般地,ISG包含干扰素激活的一种或多种信号传导分子(例如STAT)可以与之结合,因而导致ISG表达增强的识别序列(例如干扰素刺激的反应元件(ISRE))。ISG的例子包括MX1(粘液病毒抗性1,也称作干扰素诱导的蛋白p78)、RSAD2(含有自由基S-腺苷酰甲硫氨酸结构域2,也称作巨细胞病毒诱导的基因5)、HRASLS2(HRAS样阻抑蛋白2)、 IFIT1(具有三角形四肽(tetratricopeptide)重复序列的干扰素诱导的蛋白1)和 IFITM2(干扰素诱导的跨膜蛋白2)。
如本文所用,术语“单链”指包含由肽键线性连接的氨基酸单体的分子。在一个实施方案中,效应子部分是单链肽分子。单链效应子部分的非限制性例子包括细胞因子、生长因子、激素、酶、底物和辅因子。当效应子部分是细胞因子并且目的细胞因子正常情况下作为多聚体在自然界中存在时,则多聚体细胞因子的每个亚基依次由效应子部分的单链编码。因此,可用单链效应子部分的非限制性例子包括GM-CSF、IL-1α、IL-1β、IL-2、IL-3、IL-4、IL-5、IL-6、 IL-7、IL-8、IL-10、IL-12、IL-15、IFN-α、IFN-β、IFN-γ、MIP-1α、MIP-1β、 TGF-β、TNF-α和TNF-β。
如本文所用,术语“效应子部分受体”指能够与效应子部分特异性结合的多肽分子。在效应子部分与多于一种受体特异性结合的情况下,与效应子部分特异性结合的全部受体均是该效应子部分的“效应子部分受体”。例如,在IFNα是效应子部分的情况下,与IFNα分子(例如与IFNα融合的抗体)结合的效应子部分受体是IFNα受体1或2(参见人IFNα受体1的UniProt登录号P17181(121 版)和NCBI RefSeq NP_000620.2,和人IFNα受体2的UniProt登录号 P48551(131版)和NCBI RefSeq NP_997467.1和NP_997468.1)。
术语“抗体”在本文中以最广意义使用并且涵盖多种抗体结构物,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们显示出所需的抗原结合活性。
“抗体片段”指不同于完整抗体的分子,所述分子包括完整抗体的一部分,该部分结合完整抗体所结合的抗原。抗体片段的例子包括但不限于Fv、Fab、 Fab'、Fab’-SH、F(ab')2、双体抗体、线性抗体、单链抗体分子(例如scFv)和单一结构域抗体。关于某些抗体片段的综述,参见Hudson等人,Nat Med 9, 129-134(2003)。关于scFv片段的综述,参见例如Plückthun,引自The Pharmacology of Monoclonal Antibodies,第113卷,Rosenburg和Moore编著, Springer-Verlag,New York,第269-315页(1994);还参见WO 93/16185;和美国专利号5,571,894和5,587,458。关于包含救援受体(salvage receptor)结合表位残基和具有增加的体内半寿期的Fab和F(ab')2片段的讨论,见美国专利号 5,869,046。双体抗体是具有两个抗原结合位点的抗体片段,其可以是双价或双特异性的。参见例如,EP 404,097;WO 1993/01161;Hudson等人,Nat Med 9, 129-134(2003);和Hollinger等人,Proc Natl Acad Sci USA 90,6444-6448(1993)。三体抗体和四体抗体还在Hudson等人,Nat Med 9,129-134(2003)中描述。单一结构域抗体是包含抗体的全部或一部分重链可变域或全部或一部分轻链可变域的抗体片段。在某些实施方案中,单一结构域抗体是人单一结构域抗体 (Domantis,Inc.,Waltham,MA;参见例如美国专利号6,248,516B1)。可以通过多种技术产生抗体片段,所述多种技术包括但不限于蛋白酶解消化完整抗体以及由重组宿主细胞产生(例如,大肠杆菌或噬菌体),如本文所述。
术语“全长抗体”、“完整抗体”和“整个抗体”在本文中可互换地用来指一种抗体,所述抗体具有基本上与天然抗体结构相似的结构或具有含有如本文定义的Fc区的重链。
“天然抗体”指具有变化的结构的天然存在的免疫球蛋白分子。例如,天然 IgG类抗体是由二硫键结合的两条轻链和两条重链组成的约150,000道尔顿的异四聚体糖蛋白。从N端至C端,每条重链具有一个可变区(VH),也称作可变重链域或重链可变域,随后是三个恒定域(CH1、CH2和CH3),也称作重链恒定区。类似地,从N端至C端,每条轻链具有一个可变区(VL),也称作可变轻链域或轻链可变域,随后一个轻链恒定域(CL),也称作轻链恒定区。抗体重链可以归属5个类型之一,称作α(IgA)、δ(IgD)、ε(IgE)、γ(IgG)或μ(IgM),其中某些类型可以划分成亚类,例如γ1(IgG1)、γ2(IgG2)、γ3(IgG3)、γ4(IgG4)、α1(IgA1) 和α2(IgA2)。抗体的轻链可以基于其恒定域的氨基酸序列而划分成两种类型之一,称作κ和λ。IgG类抗体基本上由借助免疫球蛋白铰链区连接的两个Fab 片段和一个Fc结构域组成。
如本文所用,“Fab片段”指包含轻链片段的抗体片段,所述轻链片段包含轻链的VL结构域和恒定域(CL)以及重链的VH域和第一恒定域(CH1)。
抗体或免疫球蛋白的“类”指其重链拥有的恒定域或恒定区的类型。存在五个大类的抗体:IgA、IgD、IgE、IgG和IgM,并且这些类别中的几种可以进一步划分成亚类(同种型),例如,IgG1、IgG2、IgG3、IgG4、IgA1和IgA2。与不同类别抗体或免疫球蛋白相对应的重链恒定域分别称作α、δ、ε、γ和μ。
术语“可变区”或“可变域”指抗体重链或轻链的参与抗体结合抗原的结构域。天然抗体重链和轻链的可变域(分别是VH和VL)通常具有相似的结构,每种结构域包含四个保守的构架区(FR)和三个高变区(HVR)。参见例如,Kindt等人,Kuby Immunology,第6版,W.H.Freeman and Co.,第91页(2007)。单个VH域或VL结构域可能足以赋予抗原结合特异性。
如本文中使用的,术语“超变区”或“HVR”指抗体可变结构域中序列高度变化和/或形成结构定义的环(“超变环”)的每个区域。通常,天然4链抗体包含六个HVR;VH中三个(H1、H2、H3)和VL中三个(L1、L2、L3)。HVR通常包含来自高变环和/或来自互补决定区(CDR)的氨基酸残基,后者具有最高序列变异性和/或参与抗原识别。示例性高变环存在于第26-32(L1)、50-52(L2)、 91-96(L3)、26-32(H1)、53-55(H2)和96-101(H3)氨基酸残基处(Chothia和Lesk, J.Mol.Biol.196,901-917(1987))。示例性CDR(CDR-L1、CDR-L2、CDR-L3、 CDR-H1、CDR-H2和CDR-H3)存在于L1的第24-34位、L2的第50-56位、 L3的第89-97位、H1的第31-35B位、H2的第50-65位和H3的第95-102位氨基酸残基(Kabat等人,Sequences of Proteins of Immunological Interest,第5 版,Public Health Service,National Institutes of Health,Bethesda,MD(1991))。例外是VH中的CDR1,CDR通常包含形成高变环的氨基酸残基。CDR还包含“特异性决定残基”或“SDR”,它们是接触抗原的残基。SDR含于CDR区域内部,称作缩写的-CDR或a-CDR。示例性a-CDR(a-CDR-L1、a-CDR-L2、 a-CDR-L3、a-CDR-H1、a-CDR-H2和a-CDR-H3)存在于L1的第31-34位氨基酸残基、L2的第50-55位氨基酸残基、L3的第89-96位氨基酸残基、H1的第 31-35B位氨基酸残基、H2的第50-58位氨基酸残基和H3的第95-102位氨基酸残基处(参见Almagro和Fransson,Front.Biosci.13,1619-1633(2008))。除非另外说明,否则可变域中的HVR残基和其他残基(例如,FR残基)在本文中根据上文Kabat等人编号(称作“Kabat编号”)。
“构架”或“FR”指除高变区(HVR)残基之外的可变域残基。可变域的FR通常由以下4个FR结构域组成:FR1、FR2、FR3和FR4。因此,HVR序列和 FR序列通常按以下序列存在于VH(或VL)中: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4。
“亲和力成熟的”抗体指在一个或多个高变区(HVR)中存在一个或多个改变的抗体,其中与不拥有这些改变的亲本抗体相比,这类改变导致抗体对抗原的亲和力改善。
术语“亲本抗体”在本文中指充当制备抗体变体的起点或基础的抗体。在一个实施方案中,亲本抗体是人源化或人抗体。
“人抗体”是这样一种抗体,其拥有对应于人或人细胞产生的抗体的氨基酸序列或从利用人抗体库或其他编码人抗体的序列的非人来源衍生。人抗体的这种定义特别排除包含非人抗原结合残基的人源化抗体。
如本文中所用的术语“单克隆抗体”指从基本上均一的抗体群体所获得的抗体,即,组成该群体的各个抗体是相同的和/或结合相同的表位,除了可能的变体抗体之外(例如,含有天然存在突变或在产生单克隆抗体制备物期间出现),这类变体通常以微小的量存在。与一般包括针对不同决定簇(表位)的不同抗体的多克隆抗体制备物相反,单克隆抗体制备物的每种单克隆抗体针对抗原上的单一决定簇。因此,修饰语“单克隆的”指示该抗体的特征为从基本上同质的抗体群体获得,并且不得解释为要求通过任何特定方法产生该抗体。例如,可以通过多种技术产生根据本发明待使用的单克隆抗体,所述技术包括但不限于杂交瘤方法、重组DNA方法、噬菌体展示方法和利用含有全部或部分的人免疫球蛋白基因座的转基因动物的方法,本文中描述了用于产生单克隆抗体的这类方法和其他示例性方法。
术语“Fc结构域”或“Fc区”在本文中用来定义抗体重链的含有至少一部分恒定区的C端区域。该术语包括天然序列Fc区和变体Fc区。IgG Fc区包含IgG CH2域和IgG CH3域。人IgG Fc区的“CH2域”通常从约位置231处的氨基酸残基延伸至约位置340处的氨基酸残基。在一个实施方案中,糖链与CH2域连接。本文中的CH2域可以是天然序列CH2域或变体CH2域。“CH3域”包含一段在Fc区中CH2域C末端的残基(即从IgG的约位置341处的氨基酸残基延伸至约位置447处的氨基酸残基)。本文中的CH3区可以是天然序列CH3域或变体CH3域(例如在其一条链中具有引入的“突出部分”(“隆突”)和在其另一条链中具有引入的相应“空穴”(“穴”)的CH3域;参见US专利号5,821,333,所述文献通过引用的方式明确并入本文)。这类变体CH3域可以用来促进如本文所述的两条不相同抗体重链的异二聚化。在一个实施方案中,人IgG重链Fc区从Cys226 或从Pro230延伸至重链的羧基端。然而,Fc区的C端赖氨酸(Lys447)可以存在或可以不存在。除非本文中另外说明,否则Fc区或恒定区中的氨基酸残基的编号根据如Kabat等人,Sequences of Proteins of Immunological Interes,第5版, Public Health Service,National Institutes of Health,Bethesda,MD,1991中所述的EU编号体系,也称作EU索引。
术语“效应子功能”指随抗体同种型变动的归因于抗体Fc区的那些生物学活性。抗体效应子功能的例子包括:C1q结合和补体依赖的细胞毒性(CDC)、Fc 受体结合作用、抗体依赖的细胞介导的细胞毒性(ADCC)、抗体依赖的细胞吞噬作用(ADCP)、细胞因子分泌、免疫复合物介导的抗原呈递细胞摄取抗原、下调细胞表面受体(例如B细胞受体)和B细胞活化。
“活化性Fc受体”是这样的Fc受体,其中由抗体Fc区接合后,所述Fc受体激发了刺激携带受体的细胞执行效应子功能的信号传导事件。活化性Fc受体包括FcγRIIIa(CD16a)、FcγRI(CD64)、FcγRIIa(CD32)和FcαRI(CD89)。具体的活化性Fc受体是人FcγRIIIa(参见UniProt登录号P08637(141版))。
术语“肽接头”指包含一个或多个氨基酸、一般约2-20个氨基酸的肽。本领域已知或本文中描述了肽接头。合适的无免疫原性接头肽例如包括(G4S)n、(SG4)n或G4(SG4)n肽接头。“n”通常是1和10之间、一般2和4之间的数字。
“促进异二聚化的修饰”是对肽主链的操作或对多肽例如抗体重链的翻译后修饰,其减少或防止多肽与相同多肽缔合以形成同型二聚体。如本文所用的促进异二聚化的修饰特别地包括对形成二聚体所需的两种多肽的每一种所做的独立修饰,其中所述修饰彼此互补从而促进两种多肽缔合。例如,促进异二聚化的修饰可以改变形成二聚体所需的两种多肽中一种或两种多肽的结构或电荷,从而使得它们的缔合分别在空间上或静电上有利。在两种不相同多肽如两条抗体重链之间发生异二聚化,其中与每条重链连接的其他组分(例如效应子部分) 不相同。在本发明的抗体中,促进异二聚化的修饰在Fc结构域中,特别地在 CH3域中。在一些实施方案中,促进异二聚化的修饰包含氨基酸突变,特别地是氨基酸置换。在一个具体实施方案中,促进异二聚化的修饰包含在两条抗体重链的每条链中分别的氨基酸突变,特别地是氨基酸置换。
“隆突入穴修饰”指在CH3域中两条抗体重链之间界面内部的修饰,其中i) 在一条重链的CH3域中,将氨基酸残基替换为具有更大侧链体积的氨基酸残基,因而在一条重链的CH3域中的界面内部产生突出部分(“隆突”),所述突出部分可安置于另一条重链的CH3域中界面内部的空腔(“穴”)中,和ii)在另一条重链的CH3域中,将氨基酸残基替换为具有更小侧链体积的氨基酸残基,因而在第二CH3域中的界面内部产生空腔(“穴”),在所述空腔内部可安置第一CH3域中界面内部的突出部分(“隆突”)。在一个实施方案中,“隆突入穴修饰”在抗体重链之一中包含氨基酸置换T366W和任选地氨基酸置换S354C,并且在另一条抗体重链中包含氨基酸置换T366S、L368A、Y407V和任选地Y349C。
氨基酸“置换”指在多肽中将一个氨基酸替换为另一个氨基酸。在一个实施方案中,将氨基酸替换为具有相似结构特性和/或化学特性的另一个氨基酸,例如,保守性氨基酸替换。可以基于所涉及残基的极性、电荷、溶解度、疏水性、亲水性和/或两性本质的相似性进行“保守性”氨基酸置换。例如,非极性(疏水性) 氨基酸包括丙氨酸、亮氨酸、异亮氨酸、缬氨酸、脯氨酸、苯丙氨酸、色氨酸及甲硫氨酸;极性中性氨基酸包括甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺及谷氨酰胺;带正电荷(碱性)的氨基酸包括精氨酸、赖氨酸及组氨酸;并且带正电荷(酸性)的氨基酸包括天冬氨酸和谷氨酸。非保守性置换将使这些分类之一的成员交换为另一个分类的成员。例如,氨基酸置换还可以导致将一个氨基酸替换为具有不同结构特性和/或化学特性的另一个氨基酸,例如,将来自一个组(例如,极性)的氨基酸替换为来自不同基团(例如,碱性)的另一种氨基酸。可以使用本领域熟知的遗传方法或化学方法产生氨基酸置换。遗传方法可以包括位点定向诱变、PCR、基因合成等。构思了也可以使用通过除基因工程之外的方法(如化学修饰法)改变氨基酸侧链基团的方法。多种名称可以在本文中用来指示相同的氨基酸置换。例如,从Fc结构域第329位置处的脯氨酸置换成甘氨酸可以显示为329G、G329、G329、P329G或Pro329Gly。
相对于参考多肽序列,将“氨基酸序列同一性百分数(%)”定义为对齐序列并根据需要引入空位以实现最大序列同源性百分数并且不考虑任何保守性置换作为序列同一性的部分之后,候选序列中与参考多肽序列中的氨基酸残基相同的氨基酸残基的百分数。为了确定氨基酸序列同一性百分数的比对可以按本领域能力范围内的多种方式实现,例如,使用可公开获得的计算机软件如BLAST、 BLAST-2、ALIGN或Megalign(DNASTAR)软件。本领域技术人员可以确定用于比对序列的适宜参数,包括为实现正在比较的全长序列范围内最大比对所需要的任何算法。然而,出于本文目的,使用序列比较计算机程序ALIGN-2产生氨基酸序列同一性%值。ALIGN-2序列比较计算机程序由Genentech,Inc.授权,并且源代码已经随用户文档提交至华盛顿特区美国版权办公室,在那里它以美国版权登记号TXU510087登记。ALIGN-2程序从Genentech,Inc.,South San Francisco,加利福尼亚州可公开获得或可以从源代码汇编。应当将ALIGN-2程序汇编在UNIX操作系统(包括数字式UNIX V4.0D)上使用。全部序列比较参数由ALIGN-2程序设定并且不变动。在使用ALIGN-2比较氨基酸序列的情况下,如下计算给定氨基酸序列A与、同或针对给定氨基酸序列B(这可以备选地描述为与、同或针对给定氨基酸序列B具有或包含某个氨基酸序列同一性%的给定氨基酸序列A)的氨基酸序列同一性%是:
100乘以分数X/Y
在X是由序列比对程序ALIGN-2在该程序的A和B比对结果中评定为相同匹配的氨基酸残基的数目,并且其中Y是B中氨基酸残基的总数。将可以理解在氨基酸序列A的长度不等于氨基酸序列B的长度时,A相对于B的氨基酸序列同一性%将不等于B相对于A的氨基酸序列同一性%。除非另外特别声明,否则本文所用的全部氨基酸序列同一性值%如紧接前段中所述那样使用 ALIGN-2计算机程序获得。
如本文中可互换使用的“多核苷酸”或“核酸”指任何长度的核苷酸聚合物,并且包括DNA和RNA。核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、修饰的核苷酸或碱基和/或其类似物,或可以由DNA或RNA聚合酶或通过合成反应掺入聚合物的任何底物。多核苷酸可以包含修饰的核苷酸,如甲基化核苷酸及其类似物。核苷酸的序列可以被非核苷酸组分打断。多核苷酸可以包含合成后所做的修饰,如与标记物缀合。
如本文所用,术语“载体”指能够增殖与其连接的另一种核酸的核酸分子。该术语包括作为自我复制型核酸结构的载体以及并入宿主细胞的基因组中的载体,其中已经向所述细胞中引入所述载体。某些载体能够指导与它们有效连接的核酸表达。此类载体在本文中称作“表达载体”。
术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”互换使用并且指已经向其中引入外源核酸的细胞,包括这类细胞的子代。宿主细胞包括“转化体”和“转化的细胞”,这包括原代转化的细胞和从其衍生的子代,而无论传代次数是多少。子代可以在核酸含量方面不与亲本细胞完全相同,反而可以含有突变。本文中包括突变子代,所述突变子代具有与最初转化的细胞中所筛选或选择的子代相同的功能或生物学活性。宿主细胞是可以用来产生本发明抗体的任何类型的细胞系统。宿主细胞包括培养的细胞、例如培养的哺乳动物细胞、如CHO 细胞、BHK细胞、NS0细胞、SP2/0细胞、YO骨髓瘤细胞、P3X63小鼠骨髓瘤细胞、PER细胞、PER.C6细胞或杂交瘤细胞、酵母细胞、昆虫细胞和植物细胞,这里仅提到一些宿主细胞;宿主细胞还包括包含于转基因动物、转基因植物或培养的植物组织或动物组织内部的细胞。
药剂的“有效量”指在对其施用该药物的细胞或组织中产生生理变化所需的量。
药剂(例如,药物组合物)的“治疗有效量”指以需要的剂量并持续需要的时间段,有效实现所需治疗结果或预防结果的量。药剂的治疗有效量例如消除、减少、延迟、最小化或防止疾病的不良作用。
“个体”或“受试者”是哺乳动物。哺乳动物包括但不限于驯化动物(例如,奶牛、绵羊、猫、犬和马)、灵长类(例如,人和非人灵长类如猴)、兔和啮齿类(例如,小鼠和大鼠)。特别地,个体或受试者是人。
术语“药物组合物”指一种制备物,所述制备物处于允许其中所含的有效成分的生物学活性有效的形式,并且不含有对于将会施用该制剂的受试者不可接受地有毒的额外组分。
“可药用载体”指药物组合物中除有效成分之外的对受试者无毒的成分。可药用载体包括但不限于缓冲剂、赋形剂、稳定剂或防腐剂。
如本文所用,“治疗”(和其语法变型如“进行治疗”或“正在治疗”)指意欲改变正在治疗的个体中疾病的天然过程的临床介入,并且可以为了预防或在临床病理学过程期间进行。想要的治疗效果包括但不限于防止疾病出现或复发、减轻症状、减小疾病的任何直接或间接病理学后果、防止转移、降低病情进展速率、改善或缓和疾病状态,以及缓解或预后改善。在一些实施方案中,本发明的抗体用来延缓疾病发展或用来减慢疾病的进展。
本发明的抗体
本发明提供与脱唾液酸糖蛋白受体(ASGPR)结合的新抗体,特别地单克隆抗体。
在第一方面,本发明提供一种能够与脱唾液酸糖蛋白受体(ASGPR)特异性结合的抗体,其中抗体包含a)SEQ ID NO:16的重链可变区序列和SEQ ID NO: 14的轻链可变区序列;b)SEQ ID NO:4的重链可变区序列和SEQ ID NO:2的轻链可变区序列;c)SEQ ID NO:8的重链可变区序列和SEQ ID NO:6的轻链可变区序列;d)SEQ ID NO:12的重链可变区序列和SEQ ID NO:10的轻链可变区序列;e)SEQ ID NO:20的重链可变区序列和SEQ ID NO:18的轻链可变区序列;f)SEQ ID NO:24的重链可变区序列和SEQ ID NO:22的轻链可变区序列;g)SEQ ID NO:28的重链可变区序列和SEQ ID NO:26的轻链可变区序列; h)SEQ ID NO:4的重链可变区序列和SEQ ID NO:30的轻链可变区序列;i)SEQ ID NO:4的重链可变区序列和SEQ ID NO:32的轻链可变区序列;j)SEQ ID NO: 4的重链可变区序列和SEQ ID NO:34的轻链可变区序列;或k)SEQ ID NO:24 的重链可变区序列和SEQ ID NO:22的轻链可变区序。
本发明的一种具体抗体根据包含SEQ ID NO:16的重链可变区序列和SEQ ID NO:14的轻链可变区序列。这种抗体克隆命名为4F3。本发明的另一种具体抗体根据包含SEQ ID NO:4的重链可变区序列和SEQ ID NO:2的轻链可变区序列。这种抗体命名为51A12。
本发明提供能够与ASGPR特异性结合并与抗体4F3竞争结合至ASGPR 表位的抗体。在一个实施方案中,这种抗体与4F3相同的表位结合。4F3抗体识别ASGPR茎区中的表位。因此,在一个实施方案中,这种抗体识别ASGPR 茎区中的表位。本发明还构思了4F3抗体的亲和力成熟变体。在一个实施方案中,这种抗体包含至少约96%、97%、98%或99%与SEQ ID NO:16的序列同一的重链可变区序列和至少约96%、97%、98%或99%与SEQ ID NO:14的序列同一的轻链可变区序列。在一个实施方案中,这种抗体包含SEQ ID NO:14 的具有一个、两个、三个、四个、五个、六个或七个、特别地两个、三个、四个或五个氨基酸置换的轻链可变区序列。在一个实施方案中,这种抗体包含SEQ ID NO:16的具有一个、两个、三个、四个、五个、六个或七个、特别地两个、三个、四个或五个氨基酸置换的重链可变区序列。4F3抗体的变体还可以包含与 4F3的重链可变区相同的重链可变区,以及变异轻链可变区,或反之亦然。
本发明还提供能够与ASGPR特异性结合并与抗体51A12竞争结合至 ASGPR表位的抗体。在一个实施方案中,这种抗体与51A12相同的表位结合。 51A12抗体识别在ASGPR的糖识别结构域(CRD)中的表位。因此,在一个实施方案中,这种抗体识别ASGPR的CRD中的表位。本发明还构思了51A12抗体的亲和力成熟变体、尤其通过轻链CDR3或51A12的随机化所获得的51A12抗体。在一个实施方案中,这种抗体包含至少约96%、97%、98%或99%与SEQ ID NO:4的序列同一的重链可变区序列和至少约96%、97%、98%或99%与SEQ ID NO:2的序列同一的轻链可变区序列。在一个实施方案中,这种抗体包 含SEQ ID NO:2的具有一个、两个、三个、四个、五个、六个或七个、特别地 两个、三个、四个或五个氨基酸置换的轻链可变区序列。在一个实施方案中, 这种抗体包含SEQ ID NO:4的具有一个、两个、三个、四个、五个、六个或七 个、特别地两个、三个、四个或五个氨基酸置换的重链可变区序列。51A12抗 体的变体还可以包含与51A12的重链可变区相同的重链可变区,以及变异轻链 可变区,或反之亦然。在一个实施方案中,这种抗体包含a)SEQ ID NO:4的重 链可变区序列和SEQ ID NO:36的轻链可变区序列;b)SEQ ID NO:4的重链可 变区序列和SEQ ID NO:38的轻链可变区序列;c)SEQ ID NO:4的重链可变区 序列和SEQ ID NO:40的轻链可变区序列;d)SEQ ID NO:4的重链可变区序列 和SEQ ID NO:42的轻链可变区序列;e)SEQ ID NO:4的重链可变区序列和 SEQ ID NO:44的轻链可变区序列;f)SEQ ID NO:4的重链可变区序列和SEQ ID NO:46的轻链可变区序列;或g)SEQ ID NO:4的重链可变区序列和SEQ ID NO:48的轻链可变区序列。
优选地,本发明的抗体是人抗体,即抗体包含人可变区和恒定区。在一个实施方案中,抗体包含人Fc区,特别地人IgG Fc区,更特别地人IgG1Fc区。本发明的具体抗体是全长抗体,特别地是全长IgG类抗体,更特别地是全长IgG1亚类抗体。备选地,抗体可以是抗体片段。在一个实施方案中,抗体是Fab片段或scFv片段。在一些实施方案中,抗体包含由免疫球蛋白铰链区、特别地人 IgG铰链区、更特别地人IgG1铰链区连接的Fab片段和Fc区、特别地人IgG Fc 区,更特别地人IgG1Fc区。具体而言,抗体可以包含由免疫球蛋白铰链区连接的Fab片段和Fc区,其中不存在其他Fab片段。在这类实施方案中,抗体基本上是全长抗体,缺少一个Fab片段。
与天然Fc区相比,包含于本发明抗体中的Fc区可以包含多个修饰。
尽管Fc结构域向抗体赋予有利的药代动力学特性,包括促进在靶组织中良好蓄积和有利组织-血液分布率的长血清半寿期,但它同时可以导致抗体不利地靶向表达Fc受体的细胞,而非优选的携带抗原的细胞。另外,Fc受体信号传导途径的共激活可以导致细胞因子释放,尤其在连接有效应子部分(例如细胞因子)的抗体中,这导致细胞因子受体的过度激活和全身性施用时严重的副作用。因此,在一些实施方案中,与包含未修饰的Fc区的相应抗体相比,抗体在Fc区内包含减少抗体对Fc受体、特别对Fcγ受体的结合亲和力的修饰。可以使用标准仪器如BIAcore仪器(GE Healthcare)和如可以通过重组表达获得的Fc受体,例如通过ELISA或通过表面等离子体共振法(SPR)容易地确定与Fc受体的结合作用。在下文中描述用于测量结合亲和力的具体示意性和示例性实施方案。根据一个实施方案,在25℃,配体(Fc受体)固定在CM5芯片上的情况下,使用 T100仪(GE Healthcare),通过表面等离子体共振法测量Fc受体的结合亲和力。简而言之,根据供应商说明书,用N-乙基-N'-(3-二甲氨基丙基)- 碳二亚胺盐酸盐(EDC)和N-羟基琥珀酰亚胺(NHS)活化羧甲基化葡聚糖生物传感器芯片(CM5,GE Healthcare)。重组配体用10mM乙酸钠,pH 5.5稀释至 0.5-30μg/ml,之后,按流速10μl/分钟进样以实现大约100-5000响应单位(RU) 的偶联蛋白质。在配体上样后,注入1M乙醇胺以封闭未反应的基团。对于动力学测量,将3倍至5倍抗体连续稀释物(范围约0.01nM至300nM之间)在25℃于HBS-EP+(GE Healthcare,10mM HEPES,150mM NaCl,3mM EDTA, 0.05%表面活性剂P20,pH 7.4)中按大约30-50μl/分钟流速上样。使用简单一对一朗缪尔结合模型( T100评价软件1.1.1版),通过同时拟合缔合和解离传感图(sensorgram),计算缔合速率(kon)和解离速率(koff)。将平衡解离常数 (KD)计算为koff/kon比。参见例如,Chen等人,J Mol Biol 293,865-881(1999)。备选地,可以使用已知表达特定的Fc受体的细胞系,如表达FcγIIIa受体的NK 细胞,评价抗体对Fc受体的结合亲和力。
修饰包含减少抗体对Fc受体的结合亲和力的一个或多个氨基酸突变。一般地,相同的一个或多个氨基酸突变存在于Fc结构域中的两条抗体重链的每条重链内。在一个实施方案中,所述氨基酸突变减少抗体对Fc受体的结合亲和力至少2倍、至少5倍或至少10倍。于存在多于一个减少抗体对Fc受体的结合亲和力的氨基酸突变的实施方案中,这些氨基酸突变的组合可以减少抗体对Fc受体的结合亲和力至少10倍、至少20倍或甚至至少50倍。在一个实施方案中,与包含未修饰的Fc结构域的抗体相比,抗体显示出小于20%、特别地小于10%、更特别地小于5%的Fc受体结合亲和力。
在一个实施方案中,Fc受体是活化性Fc受体。在一个具体实施方案中, Fc受体是Fcγ受体,更特别地是FcγRIIIa、FcγRI或FcγRIIa受体。优选地,对这些受体中每种的结合作用减低。在一些实施方案中,对补体组分的结合亲和力、尤其对C1q的结合亲和力也减低。在一个实施方案中,对新生Fc受体 (FcRn)的结合亲和力不减低。当抗体显示大于约70%的未修饰形式抗体与FcRn 的结合亲和力时,实现基本上相似的FcRn结合作用,即保留抗体对所述受体的结合亲和力。本发明的抗体可以显示出大于约80%和甚至大于约90%的这类亲和力。在一个实施方案中,氨基酸突变是氨基酸置换。在一个实施方案中,抗体在Fc区内的位置P329处(EU编号)包含氨基酸置换。在一个更具体的实施方案中,氨基酸置换是P329A或P329G,特别地是P329G。在一个实施方案中,抗体在Fc区内选自S228、E233、L234、L235、N297和P331的位置包含进一步的氨基酸置换。在一个更具体的实施方案中,所述进一步的氨基酸置换是 S228P、E233P、L234A、L235A、L235E、N297A、N297D或P331S。在一个具体实施方案中,抗体在Fc区内位置P329、L234和L235处包含氨基酸置换。在一个更具体的实施方案中,抗体包含氨基酸突变L234A、L235A和P329G (LALA P329G)。氨基酸置换的这种组合几乎完全消除人IgG抗体的Fcγ受体结合作用,如通过引用方式完整并入本文的PCT专利号申请号PCT/EP 2012/055393中所述。PCT专利号申请号PCT/EP 2012/055393还描述了制备这类修饰抗体的方法和用于确定其特性如Fc受体结合作用或效应子功能的方法。
可以使用本领域熟知的遗传方法或化学方法,通过氨基酸缺失、置换、插入或修饰,制备在Fc区包含修饰的抗体。遗传方法可以包括DNA编码序列的位点特异性诱变、PCR、基因合成等。可以例如通过测序,验证正确的核苷酸变化。
与未修饰的相应抗体相比,包含减少Fc受体结合作用的修饰的抗体通常具有减低的效应子功能,特别是减低的ADCC。在一些实施方案中,抗体具有减低的ADCC。在特定的实施方案中,减低的ADCC是小于由包含未修饰Fc区的相应抗体引起的ADCC的20%。可以通过通过本领域已知的方法测量抗体的效应子功能。评估目的分子的ADCC活性的体外测定法的例子在美国专利号 5,500,362;Hellstrom等人,Proc Natl Acad Sci USA 83,7059-7063(1986)和 Hellstrom等人,Proc Natl Acad Sci USA 82,1499-1502(1985);美国专利号 5,821,337;Bruggemann等人,J Exp Med 166,1351-1361(1987)中描述。备选地,可以使用非放射性分析方法(参见例如,用于流式细胞术的ACTITM非放射性细胞毒性测定法(CellTechnology,Inc.Mountain View,CA);和非放射性细胞毒性测定法(Promega,Madison,WI))。用于此类测定法的效应细胞包括外周血单核细胞(PBMC)和天然杀伤(NK)细胞。备选地或额外地,可以在体内,例如,在动物模型中,如在Clynes等人,Proc Natl Acad Sci USA 95, 652-656(1998)公开中的动物模型中,评估目的分子的ADCC活性。在一些实施方案中,抗体对补体组分、尤其对C1q的结合作用也减低。因此,补体依赖的细胞毒性(CDC)也可以减低。可以实施C1q结合测定法以确定抗体是否能够结合C1q并因此具有CDC活性。参见例如,WO 2006/029879和WO 2005/100402 中的C1q和C3c结合ELISA。为了评估补体激活,可以进行CDC测定法(参见例如,Gazzano-Santoro等人,J Immunol Methods 202,163(1996);Cragg等人,Blood 101,1045-1052(2003);和Cragg和Glennie,Blood 103,2738-2743 (2004))。
除上文和PCT专利号申请号PCT/EP 2012/055393中所述的抗体之外,Fc 受体结合作用和/或效应子功能减低的抗体还包括置换Fc区残基238、265、269、 270、297、327和329中一者或多者的那些抗体(美国专利号6,737,056)。这类 Fc突变体包括在氨基酸位置265、269、270、297和327的两个或更多个位置处具有置换的Fc突变体,包括残基265和297置换成丙氨酸的所谓“DANA”Fc 突变体(美国专利号7,332,581)。
与IgG1抗体相比,IgG4抗体显示减低的Fc受体结合亲和力和减低的效应子功能。因此,在一些实施方案中,本发明的抗体是IgG4亚类抗体,特别地是人IgG4亚类抗体。在一个实施方案中,IgG4抗体在Fc区中的位置S228处包含氨基酸置换,特别是氨基酸置换S228P。为了进一步减低其Fc受体结合亲和力和/或其效应子功能,在一个实施方案中,IgG4抗体在位置L235处包含氨基酸置换,特别是氨基酸置换L235E。在另一个实施方案中,IgG4抗体在位置P329 处包含氨基酸置换,特别是氨基酸置换P329G。在一个具体实施方案中,IgG4抗体在位置S228、L235和P329处包含氨基酸置换,特别是氨基酸置换S228P、 L235E和P329G。这类修饰的IgG4抗体和它们的Fcγ受体结合特性在通过引用方式完整并入本文的PCT专利号申请号PCT/EP 2012/055393中描述。
本发明的抗体可以具有效应子部分如连接的细胞因子。在具体的实施方案中,抗体仅包含与两条抗体重链之一融合的一个单个效应子部分,因此这些抗体包含两条不相同的多肽链。类似地,本发明的抗体可以是全长抗体,缺少Fab 片段之一,因此包含完整抗体重链和缺少VH域和CH1域的抗体重链。这些多肽的重组共表达和随后的二聚化产生了两种多肽的几种可能组合,其中仅两种不相同多肽的异二聚体有用。为了改善重组产生中这类抗体的产率和纯度,因此可能有利的是在抗体的Fc区中引入下述修饰,所述修饰阻碍两种相同多肽(例如包含效应子部分的两条多肽,或缺少效应子部分的两条多肽)形成同型二聚体和/或促进包含效应子部分的多肽和缺少效应子部分的多肽形成异二聚体。因此,在一些实施方案中,本发明的抗体在Fc区中包含促进两条不相同抗体重链异二聚化的修饰。人IgG抗体的两条重链之间最广泛存在的蛋白质-蛋白质相互作用的位点在Fc区的CH3域中。因此,在一个实施方案中,所述修饰在Fc区的 CH3域中。在一个具体实施方案中,所述修饰是隆突入穴(knob-into-hole)修饰,包括在抗体重链之一中的隆突修饰和在两条抗体重链的另一条重链中的穴修饰。隆突入穴技术是例如在US5,731,168;US7,695,936;Ridgway等人,Prot Eng 9,617-621(1996)和Carter,J Immunol Meth 248,7-15(2001)中描述。通常,该方法涉及在第一多肽的界面处引入突出部分(“隆突”)并在第二多肽的界面中引入相应空穴(“洞”),从而可以将突出部分安置在空穴中,从而促进异二聚体形成并阻碍同型二聚体形成。通过将源自第一多肽界面小氨基酸侧链替换为较大侧链(例如酪氨酸或色氨酸),构建突出部分。通过将大氨基酸侧链替换为较小侧链 (例如,丙氨酸或苏氨酸),在第二多肽的界面中产生与突出部分具有相同或相似尺寸的互补“空穴”。因此,在一个实施方案中,抗体包含在CH3域中两条抗体重链之间界面内部的修饰,其中i)在一条重链的CH3域中,将氨基酸残基替换为具有更大侧链体积的氨基酸残基,因而在一条重链的CH3域中的界面内部产生突出部分(“隆突”),所述突出部分可安置于另一条重链的CH3域中界面内部的空腔(“穴”)中,和ii)在另一条重链的CH3域中,将氨基酸残基替换为具有更小侧链体积的氨基酸残基,因而在第二CH3域中的界面内部产生空腔(“穴”),在所述空腔内部可安置第一CH3域中界面内部的突出部分(“隆突”)。突出部分和空穴可以通过改变编码多肽的核酸产生,例如通过位点特异性诱变或通过肽合成产生。在一个具体实施方案中,隆突修饰包含两条抗体重链之一中的氨基酸置换T366W(EU编号),并且穴修饰包含两条抗体重链的另一条重链中的氨基酸置换T366S、L368A和Y407V(EU编号)。在又一个具体实施方案中,包含隆突修饰的抗体重链额外地包含氨基酸置换S354C,并且包含穴修饰的抗体重链额外地包含氨基酸置换Y349C。这两个半胱氨酸残基的引入导致Fc区内两条抗体重链之间形成二硫键,进一步稳定二聚体(Carter,J Immunol Methods 248, 7-15(2001))。在一个备选实施方案中,促进两条不相同抗体重链异二聚化的修饰包括介导静电转向效应的修饰,例如如PCT公开WO 2009/089004中所述。通常,这种方法涉及将两条抗体重链的界面处的一个或多个氨基酸残基替换为带电荷的氨基酸残基,从而同型二聚体形成在静电上变得不利,而异二聚化在静电上有利。在其中抗体具有与之连接的效应子部分的一个具体实施方案中,该效应子部分与包含隆突修饰的抗体重链的氨基端或羧基端氨基酸融合。不希望受理论约束,效应子部分与含有隆突的重链融合将进一步使包含两个效应子部分的同型二聚抗体的产生最小化(两个含有隆突的多肽的立体位阻)。类似地,在其中抗体仅包含与Fc区融合的单个Fab片段的实施方案中,Fab片段优选地与包含隆突修饰的Fc区的重链融合。
本发明的抗体组合了特别有利(例如有利于治疗性应用)的许多特性。例如,抗体与人和食蟹猴交叉反应,这使得在人类使用之前例如在食蟹猴中体内研究成为可能。因此,在一个实施方案中,本发明的抗体能够与人ASGPR和食蟹猴ASGPR特异性结合。另外,本发明的抗体以特别强的亲和力和/或亲合力结合ASGPR。在一个实施方案中,作为Fab片段通过表面等离子体共振法(SPR) 测量时,抗体以小于1μM、特别地小于100nM、更特别地小于1nM的解离常数(KD)与人ASGPR结合。本文描述了一种通过SPR测量结合亲和力的方法。具体而言,在25℃的温度进行测量。在一个实施方案中,在25℃使用ProteOn XPR36仪(Biorad),用借助中性亲和素捕获作用固定在NLC芯片上的生物素酰化单价-(avi-Fc-人ASGPR H1 CRD,SEQ ID NO:118)或二价(avi-Fc-人ASGPR H1茎-CRD,SEQ ID NO:130)ASGPR H1抗原,通过SPR测量作为Fab片段的抗体的亲和力(KD)。在示例性方法中,用于固定的抗原以PBST(10mM磷酸盐,150mM NaCl pH 7.4,0.005%吐温20)稀释至10μg/ml,并且以30μl/分钟在不同接触时间上样,以在垂直方向实现200、400或800响应单位(RU)的固定水平。随后,将分析物(抗体)上样。对于单触发动力学测量,将上样方向改变为水平方向,并且将两倍稀释系列的纯化Fab片段(浓度范围在100nM和6.25nM 之间变动)按50、60或100μl/分钟沿着独立通道1-5同时上样,缔合时间为150 秒或200秒并且解离时间为240秒或600秒。将缓冲液(PBST)沿着第六通道上样以提供供参照的“内嵌”空白。用ProteOn管理v3.1软件中的简单一对一朗缪尔结合模型,通过同时拟合缔合传感图和解离传感图计算缔合速率常数(kon)和解离速率常数(koff)。将平衡解离常数(KD)计算为koff/kon比。使用10mM甘氨酸, pH1.5以流速100μl/分钟持续接触时间30秒,在水平方向进行再生。在另一个实施方案中,作为IgG1通过荧光共振能量转移法(FRET)测量时,抗体以小于1 μM、特别地小于500nM、更特别地小于100nM或甚至小于10nM的KD与人 ASGPR结合。本文描述了一种通过FRET测量结合亲和力(或亲合力)的方法。在一个实施方案中,通过如下方式进行测量:使表达FRET供体分子标记的全长ASGPR蛋白的细胞与抗体接触并且通过用合适的FRET接纳分子标记的第二抗体检测结合的抗体。在示例性方法中,编码SNAP标签的DNA序列(质粒购自Cisbio)由PCR扩增并连接至含有全长人ASGPR H1序列(Origene)的表达载体中。所得到的融合蛋白包含带有C末端SNAP标签的全长ASGPR H1。使用脂质转染胺2000作为转染试剂,将HEK293细胞用10μg DNA转染。在20 小时温育时间后,将细胞用PBS洗涤并且在37℃于含有100nM SNAP-Lumi4Tb(Cibsio)的LabMed缓冲液(Cisbio)中温育1小时,导致特异性标记SNAP标签。随后,将细胞用LabMed缓冲液洗涤4次以移走未结合的染料。通过与缓冲液相比在615nm测量铽发射,确定标记效率。细胞随后可以冷冻贮藏在-80℃达6个月。通过以下方式测量亲合力:以50-0.39nM的浓度添加ASGPR-特异性抗体至标记的细胞(100个细胞/孔),接着添加抗人 Fc-d2(Cisbio,终浓度200nM/孔)作为FRET的接纳分子。在室温3小时温育时间后,使用荧光读数仪(Victor3,Perkin Elmer)测定接纳体染料(665nm)的发射以及供体染料(615nm)的发射。计算接纳体对供体发射的比例并且扣减背景对照的比例(具有抗人Fc-d2的细胞)。可以在GraphPad Prism5软件中分析曲线并计算KD值。本发明抗体的又一个优点是它们不与受体的天然配体(脱唾液酸糖蛋白,例如脱唾液酸胎球蛋白)竞争结合ASGPR,即抗体结合不受ASGPR配体的存在影响并且不干扰ASGPR的天然功能。在一个实施方案中,抗体不与 ASGPR的天然配体竞争结合于ASGPR。在一个具体实施方案中,所述ASGPR 的天然配体是脱唾液酸胎球蛋白。可以通过本领域熟知的方法测量竞争。在一个实施方案中,通过FACS测量与ASGPR天然配体的竞争,例如使用表达 ASGPR的细胞系、荧光标记的配体并用具有不同荧光标记物的第二抗体检测结合的抗体。在示例性方法中,使用肝细胞癌细胞系HepG2。将96孔圆底平板中的0.2mio细胞/孔在4℃与40μl Alexa488标记的脱唾液酸胎球蛋白(来自胎牛血清,Sigma Aldrich#A4781,终浓度100μg/ml)温育30分钟。结合过程在钙存在下进行,因为配体与ASGPR的结合是钙依赖性的。通过用含有0.1%BSA 的HBSS洗涤细胞1次移除未结合的蛋白质。随后将40μl抗ASGPR抗体(终浓度30、6和1.25μg/ml)在100μg/ml脱唾液酸胎球蛋白存在下添加至细胞。将细胞在4℃温育30分钟并且通过洗涤细胞1次移除未结合的蛋白质。使用APC 缀合的AffiniPure山羊抗人IgG Fcγ片段特异性第二F(ab’)2片段(Jackson ImmunoResearch#109-136-170;含有0.1%BSA的HBSS中1:50工作液)作为第二抗体。在4℃温育30分钟后,通过洗涤移除未结合的第二抗体。将细胞使用1%PFA固定并且使用BD FACS CantoII(软件BD DIVA)分析配体以及抗体的结合作用。本发明抗体的主要优点是它们对ASGPR的高特异性。例如,尽管它们与人ASGPR H1强力结合,但是抗体不与CLEC10A可检测地结合,后者被鉴定为人ASGPR H1的最接近同源物。在一个实施方案中,抗体不与CLEC10A、特别是不与人CLEC10A可检测地结合。具体而言,在通过SPR 测量结合作用的情况下(如本文所述),抗体不与CLEC10A可检测地结合。另外,抗体与不表达ASGPR的细胞结合仅达到与相应非靶向抗体(同种型对照)相似的程度。因此,在一个实施方案中,抗体不与缺少ASGPR表达的细胞、更特别地人细胞、更特别地人血细胞特异性结合。缺少ASGPR表达的示例性细胞包括Hela细胞(衍生自宫颈癌的人细胞系)、A459人非小细胞肺癌细胞、人胚肾 (HEK)细胞和(人)PBMC。可以例如通过FACS轻易确定与特定细胞结合或缺少结合作用。这类方法是本领域充分建立的并且还在本文实施例中描述。抗 ASGPR抗体的一个重要特征是它们的内化特征。例如,如果抗体待用于将效应子部分靶向表达ASGPR的细胞,则合乎需要的是抗体在细胞表面上存在足够长的时间以激活效应子部分受体。一旦与ASGPR结合,本发明的抗体内化至表达ASGPR的细胞中,然而,它们在细胞内部不降解的情况下再循环返回细胞表面。因此,在一个实施方案中,一旦抗体与表达ASGPR的细胞的表面上的ASGPR结合,抗体内化至所述细胞中。在一个具体实施方案中,抗体按照大致与它内化至所述细胞中的相同速率再循环返回所述细胞的表面。可以通过建立的方法如FACS或(共聚焦)显微术轻易测量细胞表面蛋白或与之结合的抗体的内化和再循环。在一个实施方案中,通过FACS测量内化和/或再循环。对于具有持续效果的抗体,重要的是它的靶抗原以基本上恒定水平存在。经常地,与靶抗原结合的抗体引起后者下调,导致抗体的效力减低。然而,本发明的抗体没有这种作用。在一个实施方案中,一旦抗体与所述细胞表面上的ASGPR 结合,抗体不显著地引起细胞表面处ASGPR表达下调。可以通过建立的方法如FACS容易地测定细胞表面处抗原表达的水平。
连接有效应子部分的抗体
特别有用的本发明抗体是连接有效应子部分(例如细胞因子)的抗体。与效应子部分如细胞因子融合的抗体在本文中也称作免疫缀合物。连接有效应子部分的抗体可以单独或组合地并入上文相对于本发明抗体所述的任何特征。
因此,在一个方面,本发明提供一种根据任一个以上实施方案能够与 ASGPR特异性结合的抗体,其中效应子部分与抗体连接。在一个实施方案中,不多于一个效应子部分与抗体连接。不存在其他效应子部分可以减少抗体靶向到其中呈递相应效应子部分受体的部位,因而改善靶向其中呈递该抗体的实际靶抗原ASGPR的部位并在此处的蓄积。另外,不存在相应效应子部分受体的亲合力影响可以在静脉内施用抗体时减少外周血中效应子部分受体阳性细胞的活化。用于本发明中的效应子部分通常是(例如通过信号转导途径)影响细胞活性的多肽。因此,可用于本发明中的效应子部分可以与受体介导的信号传导关联,所述信号传导传播来自细胞膜外部的信号以调节细胞内部的反应。例如,效应子部分可以是细胞因子。在具体的实施方案中,效应子部分是人类的。在具体的实施方案中,效应子部分是肽分子并且通过肽键与抗体融合(即,抗体和效应子部分形成融合蛋白)。在一个实施方案中,效应子部分是单链肽分子。在又一个实施方案中,效应子部分在其氨基端氨基酸处与抗体重链之一的羧基端氨基酸融合,任选地通过肽接头融合。合适的无免疫原性的肽接头例如包括(G4S)n、 (SG4)n或G4(SG4)n肽接头。“n”通常是1和10之间、一般2和4之间的数字。在其中抗体如上文所述那样在Fc区中包含隆突入穴修饰的实施方案中,优选的是将效应子部分与包含隆突修饰的抗体重链融合。
在一个实施方案中,所述效应子部分是细胞因子分子。有用的细胞因子的例子包括但不限于GM-CSF、IL-1α、IL-1β、IL-2、IL-3、IL-4、IL-5、IL-6、 IL-7、IL-8、IL-10、IL-12、IL-21、IFN-α、IFN-β、IFN-γ、MIP-1α、MIP-1β、 TGF-β、TNF-α和TNF-β。在一个实施方案中,所述细胞因子分子在其氨基端氨基酸与抗体重链之一的羧基端氨基酸融合,任选地通过肽接头融合。在一个实施方案中,所述细胞因子分子是人细胞因子。在一个实施方案中,所述细胞因子分子是干扰素分子。在一个具体实施方案中,所述干扰素分子是干扰素α,特别地是人干扰素α,更特别地是人干扰素α2(参见SEQ ID NO:138)或人干扰素α2a(参见SEQ ID NO:139)。已知干扰素α具有抗病毒活性。因此,干扰素分子与本发明抗体的连接特别可用于靶向病毒感染的表达ASGPR的细胞。在细胞因子分子是干扰素分子的一个实施方案中,抗体在细胞表面上表达ASGPR 的细胞中具有抗病毒活性。在一个实施方案中,所述细胞是肝脏细胞,特别地是肝细胞,更特别地是人肝细胞。在一个实施方案中,所述抗病毒活性具有选择性。在一个具体实施方案中,抗体在细胞表面上不表达明显水平的ASGPR 的细胞中没有抗病毒活性。在一个实施方案中,所述细胞是血细胞,特别是人血细胞。在一个实施方案中,所述抗病毒活性。与本发明的抗ASGPR抗体连接的干扰素分子的这种选择性与非靶向的干扰素分子相反,后者不区分开任何预期靶细胞(例如肝细胞)和不应当受影响的细胞(例如血细胞),并且对于无重大毒性问题情况下可能的治疗性用途至关重要。在又一个具体实施方案中,所述抗病毒活性选自抑制病毒性感染、抑制病毒复制、抑制细胞杀伤和诱导一个或多个干扰素刺激的基因。在一个具体实施方案中,一个或多个干扰素刺激的基因选自MX1(粘液病毒抗性1,也称作干扰素诱导的蛋白p78)、RSAD2(含有自由基S-腺苷酰甲硫氨酸结构域2,也称作巨细胞病毒诱导的基因5)、 HRASLS2(HRAS样阻抑蛋白2)、IFIT1(具有三角形四肽重复序列的干扰素诱导的蛋白1)和IFITM2(干扰素诱导的跨膜蛋白2)。在一个实施方案中,与不连接干扰素分子的相应抗体所致的诱导作用相比,对一个或多个干扰素刺激的基因的诱导作用在mRNA水平上至是少1.5倍、特别地至少2倍,更特别地至少5 倍诱导作用。可以通过本领域充分建立的方法测量mRNA水平上的基因诱导作用,包括定量性逆转录(RT)PCR或微阵列分析,如本文所述。可以例如通过病毒保护测定法法测定对细胞杀伤的抑制作用,其中细胞与测试化合物预温育,随后添加病毒并对温育后的活细胞定量。在实施例中描述了这个示例性测定法。将Madin-Darby牛肾(MDBK)细胞与抗体和对照预温育1-4小时。随后添加水泡性口炎病毒持续额外16-24小时。在这个温育步骤结束时,将活细胞用结晶紫染色溶液(0.5%)染色并且使用微量平板读数仪在550-600nm以参比波长690 nm进行活细胞定量。还在实施例中提供评估病毒复制的示例性测定法。这个测定法使用Huh7衍生的肝癌细胞系,所述细胞系用双顺反子丙型肝炎病毒(HCV) 复制子稳定转染,其中所述复制子的受HCV IRES驱动的第一可读框含有与新霉素磷酸转移酶基因(NPTII)融合的海肾萤光素酶基因,并且受EMCV IRES驱动的第二可读框含有衍生自NK5.1复制子主链的HCV非结构基因NS3、NS4a、 NS4b、NS5A和NS5B。将细胞在37℃于含有5%CO2的湿润气氛下在补充有 GlutamaxTM和100mg/ml丙酮酸钠的DMEM中培养。将该培养基进一步用10%(v/v)FBS、1%(v/v)青霉素/链霉素和1%(v/v)遗传霉素补充。将含有5%(v/v) FBS的DMEM中的细胞以90μl体积中的5000个细胞/孔铺种在96孔板中。在铺种后24小时,将抗体(或作为对照的培养基)以体积10μl按照12个孔范围内 3倍稀释度(0.01-2000pM)添加至细胞,从而添加抗体后的终体积是100μl。在添加抗体后72小时,使用海肾萤光素酶测定系统(Promega,#E2820)读取海肾萤光素酶报道分子信号。EC50值计算为与对照样品相比(在抗体不存在的情况下) 观察到海肾萤光素酶报道分子水平下降50%的化合物浓度。通过使用XLfit4程序(ID Business Solutions Ltd.,Surrey,UK)获得剂量-反应曲线和EC50值。在一个具体实施方案中,本发明的抗体是包含SEQ ID NO:16的重链可变区序列和 SEQ ID NO:14的轻链可变区序列的全长人IgG1抗体,所述抗体在Fc区内包含减少抗体对FcγRIIIa的结合亲和力的修饰和隆突入穴修饰,所述隆突入穴修饰包含在抗体重链之一中包含隆突修饰并且在另一条抗体重链中包含穴修饰,并且所述抗体具有在N端氨基酸经肽接头与抗体重链之一的C端氨基酸融合的 IFNα2分子。在一个具体实施方案中,减少抗体对FcγRIIIa的结合亲和力的所述修饰包含在每条抗体重链中的氨基酸置换L234A、L235A和P329G(EU编号)。在又一个具体实施方案中,所述隆突修饰包含氨基酸置换T366W并且穴修饰包含氨基酸置换T366S、L368A和Y407V。在仍然又一个具体实施方案中,所述IFNα2分子与包含隆突修饰的抗体重链融合。在一个甚至更具体的实施方案中,所述抗体包含多肽序列SEQ ID NO:68、SEQ ID NO:70和SEQ ID NO: 72或其保留功能性的变体。
在另一个具体实施方案中,本发明的抗体是包含SEQ ID NO:4的重链可变区序列和SEQ ID NO:2的轻链可变区序列的全长人IgG1抗体,所述抗体在Fc 区内包含减少抗体对FcγRIIIa的结合亲和力的修饰和隆突入穴修饰,所述隆突入穴修饰包含在抗体重链之一中包含隆突修饰并且在另一条抗体重链中包含穴修饰,并且所述抗体具有在N端氨基酸经肽接头与抗体重链之一的C端氨基酸融合的IFNα2分子。在一个具体实施方案中,减少抗体对FcγRIIIa的结合亲和力的所述修饰包含在每条抗体重链中的氨基酸置换L234A、L235A和P329G (EU编号)。在又一个具体实施方案中,所述隆突修饰包含氨基酸置换T366W并且穴修饰包含氨基酸置换T366S、L368A和Y407V。在仍然又一个具体实施方案中,所述IFNα2分子与包含隆突修饰的抗体重链融合。在一个甚至更具体的实施方案中,所述抗体包含多肽序列SEQ ID NO:50、SEQ ID NO:52和SEQ ID NO:54或其保留功能性的变体。
在仍然另一个具体实施方案中,本发明的抗体是包含SEQ ID NO:4的重链可变区序列和选自SEQ ID NO:36、SEQ ID NO:38、SEQ ID NO:40、SEQ ID NO:42、SEQ ID NO:44、SEQ ID NO:46和SEQ ID NO:48的轻链可变区序列的全长人IgG1抗体,所述抗体在Fc区内包含减少抗体对FcγRIIIa的结合亲和力的修饰和隆突入穴修饰,所述隆突入穴修饰包含在抗体重链之一中包含隆突修饰并且在另一条抗体重链中包含穴修饰,并且所述抗体具有在N端氨基酸经肽接头与抗体重链之一的C端氨基酸融合的IFNα2分子。在一个具体实施方案中,减少抗体对FcγRIIIa的结合亲和力的所述修饰包含在每条抗体重链中的氨基酸置换L234A、L235A和P329G(EU编号)。在又一个具体实施方案中,所述隆突修饰包含氨基酸置换T366W并且穴修饰包含氨基酸置换T366S、 L368A和Y407V。在仍然又一个具体实施方案中,所述IFNα2分子与包含隆突修饰的抗体重链融合。在一个甚至更具体的实施方案中,所述抗体包含多肽序列SEQ ID NO:52、SEQ ID NO:54和选自SEQ ID NO:96、SEQ ID NO:98、 SEQ ID NO:100、SEQ ID NO:102、SEQ ID NO:104、SEQ ID NO:106、SEQ ID NO:108的多肽序列或其保留功能性的变体。
在又一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO:92、SEQ ID NO:52和SEQ ID NO:54或其保留功能性的变体。在另一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO:94、SEQ ID NO:52和SEQ ID NO:54或其保留功能性的变体。在仍然又一个实施方案中,本发明的抗体包含多肽序列 SEQ ID NO:56、SEQ ID NO:58和SEQ ID NO:60或其保留功能性的变体。在又一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO:62、SEQ ID NO: 64和SEQ ID NO:66或其保留功能性的变体。在又一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO:74、SEQ ID NO:76和SEQ ID NO:78或其保留功能性的变体。在又一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO: 80、SEQ ID NO:82和SEQ ID NO:84或其保留功能性的变体。在又一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO:86、SEQ ID NO:88和SEQ ID NO:90或其保留功能性的变体。
在一个备选实施方案中,本发明的抗体是缺少两个Fab片段之一并且包含 SEQ ID NO:16的重链可变区序列和SEQ ID NO:14的轻链可变区序列的全长人IgG1抗体,所述抗体在Fc区内包含减少抗体对FcγRIIIa的结合亲和力的修饰和隆突入穴修饰,所述隆突入穴修饰包含在抗体重链之一中包含隆突修饰并且在另一条抗体重链中包含穴修饰,并且所述抗体具有在N端氨基酸经肽接头与抗体重链之一的C端氨基酸融合的IFNα2分子。在一个具体实施方案中,减少抗体对FcγRIIIa的结合亲和力的所述修饰包含在每条抗体重链中的氨基酸置换L234A、L235A和P329G(EU编号)。在又一个具体实施方案中,所述隆突修饰包含氨基酸置换T366W并且穴修饰包含氨基酸置换T366S、L368A和 Y407V。在仍然又一个具体实施方案中,所述IFNα2分子与包含隆突修饰的抗体重链融合。在一个甚至更具体的实施方案中,所述抗体包含多肽序列SEQ ID NO:68、SEQ ID NO:70和SEQ ID NO:116或其保留功能性的变体。
在另一个备选实施方案中,本发明的抗体是缺少两个Fab片段之一并且包含SEQ ID NO:4的重链可变区序列和SEQ ID NO:2的轻链可变区序列的全长人IgG1抗体,所述抗体在Fc区内包含减少抗体对FcγRIIIa的结合亲和力的修饰和隆突入穴修饰,所述隆突入穴修饰包含在抗体重链之一中包含隆突修饰并且在另一条抗体重链中包含穴修饰,并且所述抗体具有在N端氨基酸经肽接头与抗体重链之一的C端氨基酸融合的IFNα2分子。在一个具体实施方案中,减少抗体对FcγRIIIa的结合亲和力的所述修饰包含在每条抗体重链中的氨基酸置换L234A、L235A和P329G(EU编号)。在又一个具体实施方案中,所述隆突修饰包含氨基酸置换T366W并且穴修饰包含氨基酸置换T366S、L368A和 Y407V。在仍然又一个具体实施方案中,所述IFNα2分子与包含隆突修饰的抗体重链融合。在一个甚至更具体的实施方案中,所述抗体包含多肽序列SEQ ID NO:50、SEQ ID NO:52和SEQ ID NO:116或其保留功能性的变体。
在仍然另一个备选实施方案中,本发明的抗体是缺少两个Fab片段之一并且包含SEQ ID NO:4的重链可变区序列和选自SEQ ID NO:36、SEQ ID NO: 38、SEQ ID NO:40、SEQ ID NO:42、SEQ ID NO:44、SEQ ID NO:46和SEQ ID NO:48的轻链可变区序列的全长人IgG1抗体,所述抗体在Fc区内包含减少抗体对FcγRIIIa的结合亲和力的修饰和隆突入穴修饰,所述隆突入穴修饰包含在抗体重链之一中包含隆突修饰并且在另一条抗体重链中包含穴修饰,并且所述抗体具有在N端氨基酸经肽接头与抗体重链之一的C端氨基酸融合的IFNα2 分子。在一个具体实施方案中,减少抗体对FcγRIIIa的结合亲和力的所述修饰包含在每条抗体重链中的氨基酸置换L234A、L235A和P329G(EU编号)。在又一个具体实施方案中,所述隆突修饰包含氨基酸置换T366W并且穴修饰包含氨基酸置换T366S、L368A和Y407V。在仍然又一个具体实施方案中,所述IFNα2 分子与包含隆突修饰的抗体重链融合。在一个甚至更具体的实施方案中,所述抗体包含多肽序列SEQ ID NO:52、SEQ ID NO:116和选自SEQ ID NO:96、 SEQ ID NO:98、SEQ ID NO:100、SEQ ID NO:102、SEQ ID NO:104、SEQ ID NO:106、SEQ ID NO:108的多肽序列或其保留功能性的变体。
在又一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO:92、SEQ ID NO:52和SEQ ID NO:116或其保留功能性的变体。在另一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO:94、SEQ ID NO:52和SEQ ID NO:116 或其保留功能性的变体。在仍然又一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO:56、SEQ ID NO:58和SEQ ID NO:116或其保留功能性的变体。在又一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO:62、SEQ ID NO: 64和SEQ ID NO:116或其保留功能性的变体。在又一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO:74、SEQ ID NO:76和SEQ ID NO:116或其保留功能性的变体。在又一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO:80、SEQ ID NO:82和SEQ ID NO:116或其保留功能性的变体。在又一个实施方案中,本发明的抗体包含多肽序列SEQ ID NO:86、SEQ ID NO:88和 SEQ ID NO:116或其保留功能性的变体。
本发明的抗体包括具有下述序列的那些抗体,其中所述序列是与SEQ ID NO:2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、 70、72、74、76、78、80、82、84、86、88、90、92、94、96、98、100、102、 104、106、108和116中所述序列至少约80%、85%、90%、95%、96%、97%、 98%、99%或100%同一的序列,包括其功能性片段或变体。本发明还涵盖了包含具有保守性氨基酸置换的这些序列的抗体。
多核苷酸
本发明还提供编码如本文所述的抗体或其抗原结合部分的多核苷酸。
本发明的多核苷酸包括与SEQ ID NO:1、3、5、7、9、11、13、15、17、 19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、 53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85、 87、89、91、93、95、97、99、101、103、105、107、109和117中所述的序列至少约80%、85%、90%、95%、96%、97%、98%、99%或100%同一的那些多核苷酸,包括其功能性片段或变体。
编码本发明抗体的多核苷酸可以作为编码完整抗体的单一多核苷酸表达或作为共表达的多个(例如,两个或更多个)多核苷酸表达。由共表达的多核苷酸编码的多肽可以经例如二硫键或其他方式缔和以形成功能抗体。例如,抗体的轻链部分可以由来自抗体重链部分的分立的多核苷酸编码。当共表达时,重链多肽将与轻链多肽缔和以形成抗体。在另一个例子中,包含效应子部分的抗体的重链部分可以由来自该抗体另一个重链部分的分立的多核苷酸编码。当共表达时,重链多肽将(与轻链多肽一起)缔和以形成功能抗体。
在一个实施方案中,本发明涉及编码抗体或其抗原结合部分的多核苷酸,其中多核苷酸包含了编码如SEQ ID NO:2、4、6、8、10、12、14、16、18、 20、22、24、26、28、30、32、34、36、38、40、42、44、46或48中所示可变区序列的序列。在另一个实施方案中,本发明涉及编码抗体或其抗原结合部分的多核苷酸,其中多核苷酸包含了编码如SEQ ID NO:50、52、54、56、58、 60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、 94、96、98、100、102、104、106、108或116中所示多肽序列的序列。在另一个实施方案中,本发明还涉及编码抗体或其抗原结合部分的多核苷酸,其中多核苷酸包含了与SEQ ID NO:1、3、5、7、9、11、13、15、17、19、21、23、 25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、 59、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、 93、95、97、99、101、103、105、107、109或117中所示核酸序列至少约80%、 85%、90%、95%、96%、97%、98%或99%同一的序列。在另一个实施方案中,本发明涉及编码抗体或其抗原结合部分的多核苷酸,其中多核苷酸包含了 SEQ.ID.NO:1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、 33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、 67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97、99、 101、103、105、107、109或117中所示的核酸序列。在另一个实施方案中,本发明涉及编码抗体或其抗原结合部分的多核苷酸,其中多核苷酸包含下述序列,所述序列编码与SEQ ID NO:2、4、6、8、10、12、14、16、18、20、22、24、 26、28、30、32、34、36、38、40、42、44、46或48的氨基酸序列至少约80%、 85%、90%、95%、96%、97%、98%或99%同一的可变区序列。在另一个实施方案中,本发明涉及编码抗体或其抗原结合部分的多核苷酸,其中多核苷酸包含下述序列,所述序列编码与SEQ ID NO:50、52、54、56、58、60、62、 64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、 98、100、102、104、106、108或116的氨基酸序列至少80%、85%、90%、 95%、96%、97%、98%或99%同一的多肽序列。本发明涵盖编码抗体或其抗原结合部分的多核苷酸,其中多核苷酸包含这样的序列,所述序列编码具有保守性氨基酸置换的SEQ ID NO:2、4、6、8、10、12、14、16、18、20、22、 24、26、28、30、32、34、36、38、40、42、44、46或48的可变区序列。本发明还涵盖编码本发明抗体或其抗原结合部分的多核苷酸,其中多核苷酸包含这样的序列,所述序列编码具有保守性氨基酸置换的SEQ ID NO:50、52、54、56、58、60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、 90、92、94、96、98、100、102、104、106、108或116的多肽序列。
在某些实施方案中,多核苷酸或核酸是DNA。在其他实施方案中,本发明的多核苷酸是RNA,例如,处于信使RNA(mRNA)形式。本发明的RNA可以是单链的或双链的。
重组方法
本发明的抗体可以例如通过固态肽合成(例如Merrifield固相合成)或重组生产获得。为了重组生产,将编码抗体(片段)的一个或多个多核苷酸(例如,如上文所述)分离并插入一个或多个载体中以便进一步在宿主细胞中克隆和/或表达。使用常规方法,可以轻易地分离这种多核苷酸并将其测序。在一个实施方案中,提供包含本发明的一种或多种多核苷酸的载体,优选地表达载体。本领域技术人员熟知的方法可以用来构建表达载体,所述表达载体含有抗体(片段)的编码序列,以及适宜的转录/翻译控制信号。这些方法包括体外重组DNA技术,合成技术和体内重组/遗传重组。参见例如在Maniatis等人,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory,N.Y.(1989)和Ausubel等人,Current Protocols in Molecular Biology,Greene Publishing Associates and Wiley Interscience,N.Y(1989)中描述的技术。表达载体可以是质粒、病毒的部分,或可以是核酸片段。表达载体包括将编码抗体(片段)的多核苷酸(即编码区) 以与启动子和/或其他转录或翻译控制元件有效连接的方式克隆的表达盒。如本文所用,“编码区”是由翻译成氨基酸的密码子组成的核酸的一部分。虽然“终止密码子”(TAG、TGA或TAA)不翻译成氨基酸,但是如果存在的话,可以将它视为编码区的部分,但是任何侧翼序列,例如启动子、核糖体结合位点、转录终止子、内含子、5'和3'非翻译区等,均不是编码区的部分。两个或更多个编码区可以存在于单一多核苷酸构建体中存在,例如存在于单一载体上或存在于分立的多核苷酸构建体中,例如存在于分立(不同)的载体上。另外,任何载体可以含有单个编码区,或可以包含两个或更多个编码区,例如,本发明的载体可以编码一种或多种多肽,所述多肽借助蛋白酶剪切作用以翻译后方式或以共翻译方式分离成最终的蛋白质。此外,本发明的载体、多核苷酸或核酸可以编码异源编码区,所述异源编码区与编码本发明抗体(片段)的多核苷酸或变体或其衍生物融合或不融合。异源编码区包括但不限于专用元件或基序,如分泌信号肽或异源功能性结构域。有效连接是以下情况,此时基因产物(例如多肽)的编码区与一种或多种调节序列以如此方式连接,从而将基因产物的表达置于调节序列的影响或控制下。如果启动子功能的诱导导致编码所需基因产物的mRNA转录并且如果两个DNA片段之间连接的性质不干扰表达调节序列指导基因产物表达的能力或不干扰DNA模板被转录的能力,则这两个DNA片段(如多肽编码区和与之连接的启动子)是“有效连接”的。因而,如果该启动子能够实现该核酸的转录,则启动子区与编码多肽的核酸有效连接。启动子可以是指导DNA仅在预定细胞中大量转录的细胞特异性启动子。除启动子之外的其他转录控制元件,例如增强子、操纵基因、阻遏蛋白和转录终止信号,可以与多核苷酸有效连接以指导细胞特异转录。本文中公开了合适的启动子和其他转录控制区。多种转录控制区是本领域技术人员已知的。这些包括但不限于,在脊椎动物细胞中发挥功能的转录控制区,如,但不限于,来自巨细胞病毒(例如立即早期启动子,连同内含子-A一起)、猴病毒40(例如早期启动子)和逆转录病毒(例如罗斯肉瘤病毒)的启动子和增强子区段。其他转录控制区包括源自脊椎动物基因如肌动蛋白,热休克蛋白,牛生长激素和兔α-珠蛋白的那些转录控制区,以及能够控制真核细胞中基因表达的其他序列。额外的合适转录控制区包括组织特异性启动子和增强子以及诱导型启动子(例如四环素诱导型启动子)。类似地,多种翻译控制元件是本领域普通技术人员已知的。这些包括但不限于核糖体结合位点、翻译起始和终止密码子和源自病毒系统的元件(特别是内部核糖体进入位点,或IRES,也称作CITE序列)。表达盒也可以包括其他特征如复制起点,和/或染色体整合元件如逆转录病毒长末端重复序列(LTR)或腺相关病毒(AAV)反向末端重复序列(ITR)。
本发明的多核苷酸和核酸编码区可以与编码分泌肽或信号肽的额外编码区连接,所述分泌肽或信号肽指导由本发明多核苷酸编码的多肽分泌。例如,如果需要分泌抗体,则可以将编码信号序列的DNA置于编码本发明抗体或其抗原结合部分的核酸上游。根据信号假设,由哺乳动物细胞分泌的蛋白质具有一旦已经启动正在增长的蛋白质链跨粗面内质网输出则从成熟蛋白切下的信号肽或分泌前导序列。本领域普通技术人员知晓由脊椎动物细胞分泌的多肽通常具有与多肽N末端融合的信号肽,所述信号肽从翻译的多肽被切下以产生分泌或“成熟”形式的多肽。在某些实施方案中,使用天然信号肽,例如免疫球蛋白重链或轻链信号肽,或该序列的功能衍生物,所述功能衍生物保留指导与该序列有效连接的多肽分泌的能力。备选地,可以使用异源哺乳动物信号肽或其功能衍生物。例如,野生型前导序列可以用人组织纤维蛋白溶酶原激活物(TPA)或小鼠β- 葡糖醛酸糖苷酶的前导序列替换。分泌信号肽的示例性氨基酸序列在SEQ ID NO:135-137中显示。
可以在编码抗体(片段)的多核苷酸的末端内部或末端处包括编码短蛋白质序列的DNA,所述短蛋白质序列可以用来促进稍后的纯化(例如组氨酸标签)或辅助标记抗体。
在又一个实施方案中,提供了包含一种或多种本发明多核苷酸的宿主细胞。在某些实施方案中,提供了包含一种或多种本发明载体的宿主细胞。多核苷酸和载体可以分别相对于多核苷酸和载体,单独或以组合方式合并本文中所述的任一特征。在一个这样的实施方案中,宿主细胞包含载体(例如已经用所述载体转化或转染),所述载体包含编码本发明抗体(部分)的多核苷酸。如本文所用,术语“宿主细胞”指可以工程化以产生本发明抗体或其片段的任何种类的细胞系统。适于复制和支持抗体表达的宿主细胞是本领域熟知的。根据需要,这类细胞可以用特定表达载体转染或转导,并且可以培育大量含有载体的细胞用于接种大规模发酵器以获得足够量的抗体用于临床应用。合适的宿主细胞包括原核微生物,如大肠杆菌,或多种真核细胞,如中国仓鼠卵巢细胞(CHO)、昆虫细胞等。例如,可以在细菌中产生多肽,尤其当不需要糖基化时。在表达后,多肽可以从可溶性级分中的细菌细胞糊分离并且可以进一步纯化。除原核生物之外,真核微生物如丝状真菌或酵母是编码多肽的载体的合适克隆宿主或表达宿主,包括其糖基化途径已经“人源化”的真菌和酵母菌株,导致产生具有部分或完全人类糖基化模式的多肽。见Gerngross,Nat Biotech 22,1409-1414(2004)和 Li等人,Nat Biotech 24,210-215(2006)。用于表达(糖基化)多肽的合适宿主细胞还源自多细胞生物(无脊椎动物和脊椎动物)。无脊椎动物细胞的例子包括植物细胞和昆虫细胞。已经鉴定了可以与昆虫细胞一起使用、尤其用于转染草地贪夜蛾(Spodoptera frugiperda)细胞的众多杆状病毒毒株。也可以利用植物细胞培养物作为宿主。参见例如美国专利号5,959,177、6,040,498、6,420,548、7,125,978 和6,417,429(描述在转基因植物中产生抗体的PLANTIBODIESTM技术)。也可以使用脊椎动物细胞作为宿主。例如,适应于悬浮培育的哺乳动物细胞系可以是有用的。有用的哺乳动物宿主细胞系的其他例子是由SV40转化的猴肾CV1 系(COS-7);人胚肾系(293或293T细胞,如Graham等人,J Gen Virol 36,59 (1977)中所述那样)、幼仓鼠肾细胞(BHK)、小鼠支持细胞(TM4细胞如在例如 Mather,Biol Reprod 23,243-251(1980)中所述那样)、猴肾细胞(CV1)、非洲绿猴肾细胞(VERO-76)、人宫颈癌细胞(HELA)、犬肾细胞(MDCK)、布法罗大鼠肝脏细胞(BRL 3A)、人肺细胞(W138)、人肝脏细胞(Hep G2)、小鼠乳腺瘤细胞 (MMT060562)、TRI细胞(如在例如Mather等人,Annals N.Y.Acad Sci 383, 44-68(1982中所述那样))、MRC5细胞和FS4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(CHO)细胞,包括dhfr-CHO细胞(Urlaub等人,Proc Natl Acad Sci USA 77,4216(1980));和骨髓瘤细胞系如YO、NS0、P3X63和 Sp2/0。关于适于产生蛋白质的某些哺乳动物宿主细胞系的综述,参见例如, Yazaki和Wu,Methods in Molecular Biology,第248卷(B.K.C.Lo编著, Humana Press,Totowa,NJ),第255-268页(2003)。宿主细胞包括培养的细胞,例如,培养的哺乳动物细胞、酵母细胞、昆虫细胞、细菌细胞和植物细胞,这里仅提到一些宿主细胞;宿主细胞还包括包含于转基因动物、转基因植物或培养的植物组织或动物组织内部的细胞。在一个实施方案中,宿主细胞是真核细胞,优选地是哺乳动物细胞,如中国仓鼠卵巢(CHO)细胞、人胚肾(HEK)细胞或淋巴样细胞(例如,Y0、NS0、Sp20细胞)。
本领域已知在这些系统中表达外来基因的标准技术。表达包含抗体重链或轻链的多肽的细胞可以如此工程化,从而还表达其他抗体链,因而表达产物是具有重链和轻链的抗体。
在一个实施方案中,提供一种产生本发明抗体的方法,其中所述方法包括在适于表达抗体的条件下培养如上文提供的包含编码抗体的多核苷酸的宿主细胞,并且从宿主细胞(或宿主细胞培养物)回收该抗体。
在抗体与效应子部分融合的情况下,这些组分以遗传方式彼此融合。可以如此设计抗体,从而其组件彼此直接融合或通过接头序列间接融合。接头的组成和长度可以根据本领域熟知的方法确定并且可以测试功效。根据需要,也可以包括额外的序列以并入切割位点以便分隔融合物的各种组分,例如内肽酶识别序列。
在某些实施方案中,本发明的抗体至少包含能够与ASGPR结合的抗体可变区。可变区可以形成天然或非天然存在的抗体和其片段的一部分并且从所述抗体和其片段衍生。产生多克隆抗体和单克隆抗体的方法是本领域熟知的(见例如Harlow和Lane,"Antibodies,a laboratory manual",Cold Spring Harbor Laboratory,1988)。非天然存在的抗体可以使用固相肽合成法构建,可以重组产生(例如,如美国专利号4,186,567中所述)或可以例如通过筛选包含可变重链和可变轻链的组合文库获得(见例如授予McCafferty的美国专利号5,969,108)。
任何动物物种的抗体可以用于本发明中。可用于本发明中的非限制性抗体可以是鼠源、灵长类源或人源的。如果抗体意图用于人类,则可以使用嵌合形式的抗体,其中该抗体的恒定区来自人类。也可以根据本领域熟知的方法制备人源化或全人形式的抗体(见例如授予Winter的美国专利号5,565,332)。可以通过多种方法实现人源化,所述方法包括但不限于(a)在保留或不保留关键构架残基(例如对保留良好抗原结合亲和力或抗体功能重要的那些残基)的情况下,将非人类(例如,供体抗体)CDR移植到人类(例如受体抗体)构架和恒定区上,(b)仅将非人类特异性决定区(SDR或a-CDR;对抗体-抗原相互作用至关重要的残基) 移植到人构架和恒定区上,或(c)移植整个非人类可变域,但是通过更换表面残基用人样部分“掩蔽”它们。人源化抗体和制造它们的方法例如在Almagro和 Fransson,Front Biosci 13,1619-1633(2008)中综述,并且例如还在Riechmann 等人,Nature 332,323-329(1988);Queen等人,Proc Natl Acad Sci USA 86, 10029-10033(1989);美国专利号5,821,337、7,527,791、6,982,321和7,087,409; Jones等人,Nature 321,522-525(1986);Morrison等人,Proc Natl Acad Sci 81, 6851-6855(1984);Morrison和Oi,Adv Immunol 44,65-92(1988);Verhoeyen 等人,Science 239,1534-1536(1988);Padlan,Molec Immun 31(3),169-217 (1994);Kashmiri等人,Methods 36,25-34(2005)(描述SDR(a-CDR)移植); Padlan,Mol Immunol 28,489-498(1991)(描述“表面重塑”);Dall'Acqua等人, Methods 36,43-60(2005)(描述“FR改组”);和Osbourn等人,Methods 36,61-68 (2005)和Klimka等人,Br J Cancer 83,252-260(2000)(描述针对FR改组的“导向选择”方案)中描述。本发明的具体抗体是人抗体。人抗体和人可变区可以使用本领域已知的多种技术产生。人抗体总体上在van Dijk和van de Winkel,Curr Opin Pharmacol 5,368-74(2001)和Lonberg,Curr Opin Immunol 20,450-459 (2008)中描述。人可变区可以形成通过杂交瘤方法产生的人单克隆抗体的部分并且从所述人单克隆抗体衍生(见例如Monoclonal Antibody Production Techniques and Applications(单克隆抗体生产技术及应用),第51-63页(Marcel Dekker,Inc.,New York,1987))。人抗体和人可变区也可以通过施用免疫原至转基因动物制备,其中所述转基因动物已经被修饰以应答于抗原攻击产生完整人抗体或具有人可变区的完整抗体(见例如Lonberg,Nat Biotech 23,1117-1125 (2005)。也可以通过分离从人衍生的噬菌体展示文库中选择的Fv克隆可变域序列产生人抗体和人可变区(见例如,Hoogenboom等人,引自Methods in Molecular Biology 178,1-37(O'Brien等人编著,Human Press,Totowa,NJ, 2001);和McCafferty等人,Nature 348,552-554;Clackson等人,Nature 352, 624-628(1991))。噬菌体一般将抗体片段展示为单链Fv(scFv)片段或展示为Fab 片段。可以在实施例中找到通过噬菌体展示制备抗体的详细描述。
在某些实施方案中,根据例如在PCT公开WO 2011/020783(参见涉及亲和力成熟的实施例)或美国专利申请公开号2004/0132066中公开的方法,将本发明的抗体工程化以具有增强的结合亲和力,所述文献的完整内容因而通过引用的方式并入。本发明的抗体与特定抗原决定簇结合的能力可以通过酶联免疫吸附测定(ELISA)或本领域技术人员熟悉的其他技术,例如表面等离子体共振技术 (Liljeblad等人,Glyco J 17,323-329(2000))和常规结合测定法(Heeley,Endocr Res 28,217-229(2002))测量。竞争测定法可以用来鉴定与参考抗体竞争结合至特定抗原的抗体,例如,与51A12抗体竞争结合ASGPR的抗体。在某些实施方案中,这种竞争性抗体与参考抗体结合的相同表位(例如线性表位或构象表位) 结合。用于定位与抗体结合的表位的详细示例性方法在Morris(1996)“Epitope Mapping Protocols(表位定位法)”,引自Methods in Molecular Biology第66卷(Humana Press,Totowa,NJ)中提供。在示例性竞争测定法中,将固定的抗原(例如ASGPR)在溶液中温育,所述溶液包含与该抗原结合的第一标记抗体(例如 51A12抗体)和正在测试与第一抗体竞争结合至该抗原的能力的第二未标记抗体。第二抗体可以存在于杂交瘤上清液中。作为对照,将固定的抗原在包含第一标记抗体但是不包含第二未标记抗体的溶液中温育。在允许第一抗体与该抗原结合的条件下温育后,移除过多的未结合的抗体,并且测量与固定抗原结合的标记物的量。如果与固定抗原结合的标记物的量在测试样品中相对于对照样品实质降低,则这表示第二抗体正在与第一抗体竞争结合至该抗原。参见Harlow 和Lane(1988)Antibodies:A Laboratory Manual第14章(Cold Spring Harbor Laboratory,Cold Spring Harbor,NY)。
如本文所述那样制备的抗体可以通过现有已知的技术如高效液相色谱、离子交换层析、凝胶电泳、亲和层析、大小排阻层析等纯化。用来纯化特定蛋白质的实际条件将部分取决于诸多因素,如净电荷、疏水性、亲水性等并且将是本领域技术人员显而易见的。对于亲和层析纯化,可以使用与抗体结合的抗体、配体、受体或抗原。例如,对于本发明抗体的亲和层析纯化,可以使用具有蛋白A或蛋白G的基质。基本上如实施例中所述,依次的蛋白A或G亲和层析和大小排阻层析可以用来分离抗体。抗体的纯度可以由多种熟知分析方法的任一种方法确定,所述熟知分析方法包括凝胶电泳、高压液相色谱等。例如,显示如实施例中所述那样表达的重链融合蛋白是完整的并且正确装配,如还原性 SDS-PAGE所展示(参见例如图13-19)。
组合物、制剂和施用途径
在又一个方面,本发明提供了包含本文提供的任何抗体的药物组合物,例如,用于下述任一种治疗方法中。在一个实施方案中,药物组合物包含本文提供的任何抗体和可药用载体。在另一个实施方案中,药物组合物包含本文提供的任何抗体和至少一种额外的治疗剂,例如,如下文描述。
进一步提供一种产生处于适合体内施用形式的本发明抗体的方法,所述方法包括(a)获得本发明的抗体,并且(b)将抗体用至少一种可药用载体制剂,由此配制抗体制备物用于体内施用。
本发明的药物组合物包含治疗有效量的溶解或分散于可药用载体中的一种或多种抗体。短语“可药用或药理学可接受的”指在使用的剂量和浓度通常对接受者无毒,即施用至动物(根据需要,例如施用至人)时不产生不良、变应性或其他不利反应的分子实体和组合物。根据本公开,制备含有至少一种抗体和任选地含有额外有效成分的药物组合物是本领域技术人员已知的,如Remington's Pharmaceutical Sciences,第18版,Mack Printing Company,1990所例举,所述文献通过引用方式并入本文。另外,对于动物(例如,人类)施用,应当理解制品应当满足如FDA生物学标准办公室或其他国家的相应权力机关所要求的无菌性、致热原性、总体安全性和纯度标准。优选的组合物是冻干制剂或水溶液剂。如本文所用,“可药用载体”包括任何和全部溶剂、缓冲剂、分散介质、包衣、表面活性剂、抗氧化剂、防腐剂(例如,抗菌剂、抗真菌剂)、等渗剂、吸收延迟剂、盐、防腐剂、抗氧化剂、蛋白质、药物、药物稳定剂、聚合物、凝胶、粘合剂、赋形剂、崩解剂、润滑剂、甜味剂、矫味剂、染料、这类相似材料及其组合,这是本领域普通技术人员已知的(见例如,Remington's Pharmaceutical Sciences,第18版,Mack Printing Company,1990,第1289-1329页,所述文献通过引用方式并入本文)。除了任何常规载体与有效成分不相容的情况下之外,构思了所述载体在治疗组合物或药物组合物中的使用。
该组合物可以包含不同类型的载体,这取决于它是否将以固态、液态或气溶胶形式施用及作为注射剂对这类施用途径而言它是否需要是无菌的。可以将本发明的抗体(和任何额外的治疗剂)按静脉内、真皮内、动脉内、腹腔内、病灶内、颅内、关节内、前列腺内、脾内、肾内、胸膜内、气管内、鼻内、玻璃体内、阴道内地、直肠内、瘤内、肌内、腹腔内、皮下、结膜下的、囊内、粘膜、心包内、脐内、眼球内、口服、局部地、局限地、通过吸入(例如气溶胶吸入)、注射、输注、连续输注、直接局限化灌流浸浴靶细胞、通过导管、通过灌洗、在奶油中、在液体组合物中(例如脂质体)或通过其他方法或前述方法的任何组合施用,这是本领域普通技术人员已知的(参见例如Remington's Pharmaceutical Sciences,第18版,Mack Printing Company,1990,通过引用方式并入本文)。肠胃外施用,尤其静脉内注射,最常使用于施用多肽分子,如本发明的抗体。
肠胃外组合物包含设计成通过注射例如皮下、真皮内、病灶内、静脉内、动脉内肌内、鞘内或腹膜内注射施用的那些组合物。对于注射剂,可以将本发明的抗体在水溶液中、优选地在生理相容性缓冲液如Hank溶液、林格液或生理盐水中配制。所述溶液可以含有配制剂如助悬剂、增溶剂、稳定剂和/或分散剂。备选地,抗体可以处于粉末形式,用于在使用前与合适的运载体(例如,无菌无热原水)构成。通过以下方式制备无菌可注射溶液剂:将本发明抗体按要求的量,根据需要连同下文列举的多种其他成分一起并入适宜的溶剂中。可以例如通过借助无菌滤膜过滤轻易地实现无菌性。通常,通过将多种消毒的有效成分并入无菌运载体中来制备分散体,所述无菌运载体含有基础分散介质和/或其他成分。在用于制备无菌可注射溶液剂、混悬剂或乳剂的无菌粉末情况下,优选的制备方法是真空干燥或冷冻干燥技术,所述技术产生有效成分的粉末,外加来自其事先无菌过滤的液体介质中的任何额外所需成分。根据需要,应当合适地缓冲液体介质并且首先用足够的盐水或葡萄糖使液体稀释剂在注射之前等渗。组合物必须在制造和储存条件下是稳定的;并且免遭微生物如细菌和真菌的污染作用。可以理解应当保持内毒素污染最小化地处于安全水平,例如,小于0.5ng/mg蛋白质。合适的可药用载体包括但不限于:缓冲剂如磷酸盐、柠檬酸和其他有机酸;抗氧化剂(包括抗坏血酸和甲硫氨酸);防腐剂(如十八烷基二甲基苄基氯化铵;六甲氯铵;苯扎氯铵、苯扎溴铵;苯酚、丁醇或苄醇;烷基尼泊金酯如尼泊金甲酯或丙酯;儿茶酚;雷琐辛;环己醇;3-戊醇和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水聚合物如聚乙烯吡咯烷酮;氨基酸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他糖包括葡萄糖、甘露糖或糊精;螯合剂如EDTA;糖如蔗糖、甘露糖、海藻糖或山梨糖醇;形成盐的反离子如钠;金属复合物(例如,Zn-蛋白质复合物)和/或非离子表面活性剂如聚乙二醇(PEG)。水性注射混悬剂可以含有增加混悬剂黏度的化合物,如羧甲基纤维素钠、山梨糖醇或葡聚糖等。任选地,混悬剂也可以含有合适的稳定剂或增加化合物的溶解度以允许制备高度浓缩的溶液剂的物质。另外,活性化合物的混悬剂可以制备为适宜的油性注射混悬剂。合适的亲脂溶剂或运载体包括脂肪油如芝麻油,或合成的脂肪酸酯,如油酸乙酯或甘油三酯,或脂质体。
有效成分可以包埋于例如分别通过凝聚技术或界面聚合制备的微胶囊(例如,羟甲基纤维素微胶囊或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊)、胶态药物递送系统(例如,脂质体、白蛋白微球体、微乳液、纳米粒子和纳米胶囊)或粗乳状液中。这类技术在Remington's Pharmaceutical Sciences(第18版,Mack Printing Company,1990)中公开。可以制备持续释放制品。持续释放制品的合适例子包括含有多肽的固态疏水性聚合物半通透性基质,所述基质处于成型制品 (例如,薄膜或微胶囊)形式。在具体的实施方案中,可以通过在可注射组合物中使用延迟吸收的物质例如单硬脂酸铝、明胶或其组合,引起组合物的吸收延长。
除先前所述的组合物之外,也可以将所述抗体配制为贮库制备物。这种长效制剂可以通过(例如皮下或肌内)植入或通过肌内注射施用。因此,例如,可以将抗体用合适的聚合材料和疏水材料(例如作为可接受油中的乳液)或离子交换树脂配制或配制为微溶性衍生物,例如微溶性盐。
包含本发明抗体的药物组合物可以通过常规的混合、分散、乳化、包封、埋入或冻干方法制造。药物组合物可以使用一种或多种促进蛋白质加工成可以按药学方式使用的制品的生理可接受载体、稀释剂、赋形剂或辅助剂以常规方式配制。合适的制剂取决于所选的施用途径。
可以将抗体以游离酸或碱、中性或盐形式配制到组合物中。可药用盐是基本上保留游离酸或碱的生物学活性的盐。这些盐包括酸加成盐,例如,与蛋白质组合物的游离氨基形成的或与无机酸例如氢氯酸或磷酸或这类有机酸如乙酸、草酸、酒石酸或扁桃酸形成的那些盐。与游离羧基形成的盐也可以源自无机碱例如,氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁或这类有机碱如异丙胺、三甲胺、组氨酸或普鲁卡因。药用盐在含水溶剂和其他质子溶剂中倾向于比相应的游离碱形式更可溶。
治疗方法和组合物
本文提供的任何抗体可以用于治疗方法中。
为了用于治疗方法中,本发明的抗体将以符合良好医学实践的方式配制、投与和施用。在这种情况下考虑的因素包括正在治疗的具体病症、正在治疗的具体哺乳动物、个体患者的临床状况、病症原因、送递药物的部位、施用方法、施用计划和医疗执业者已知的其他因素。
在一个方面,提供用作药物的本发明抗体。在其他方面,提供用于治疗疾病的本发明抗体。在某些实施方案中,提供用于治疗方法中的本发明抗体。在一个实施方案中,本发明提供如本文所述的抗体用于治疗有需求的个体中的疾病。在某些实施方案中,本发明提供抗体用于治疗患有疾病的个体的方法中,所述方法包括向该个体施用治疗有效量的抗体。在某些实施方案中,待治疗疾病是肝病。示例性肝病包括肝炎、肝硬化或肝癌如肝细胞癌。在一个具体实施方案中,疾病是病毒性感染,特别地是肝炎病毒感染,更特别地是HBV感染。在另一个具体实施方案中,疾病是癌症,特别地是肝癌,更特别地是肝细胞癌 (HCC)。在某些实施方案中,该方法还包括向个体施用治疗有效量的至少一种额外的治疗剂,例如,如果待治疗疾病是病毒性感染,所述额外的治疗剂是抗病毒剂,或如果待治疗疾病是癌症,所述额外的治疗剂是抗癌剂。根据以上任一个实施方案的“个体”是哺乳动物,优选地是人。
在又一个方面,本发明提供本发明的抗体在制造或制备治疗有需求的个体中疾病的药物中的用途。在一个实施方案中,该药物用于治疗疾病的方法中,所述方法包括向患有该疾病的个体施用治疗有效量的药物。在某些实施方案中,待治疗疾病是肝病。在一个具体实施方案中,疾病是病毒性感染,特别地是肝炎病毒感染,更特别地是HBV感染。在其他实施方案中,待治疗疾病是癌症。在一个具体实施方案中,疾病是肝癌,特别是肝细胞癌(HCC)。在一个实施方案中,该方法还包括向个体施用治疗有效量的至少一种额外的治疗剂,例如,如果待治疗疾病是病毒性感染,所述额外的治疗剂是抗病毒剂,或如果待治疗疾病是癌症,所述额外的治疗剂是抗癌剂。根据以上任一个实施方案的“个体”是哺乳动物,优选地是人。
在又一个方面,本发明提供一种用于个体中治疗疾病的方法,所述方法包括向所述个体施用治疗有效量的本发明抗体。在一个实施方案中,将组合物施用至所述个体,所述组合物包含处于可药用形式的本发明抗体。在某些实施方案中,待治疗疾病是肝病。在一个具体实施方案中,疾病是病毒性感染,特别地是肝炎病毒感染,更特别地是HBV感染。在其他实施方案中,待治疗疾病是癌症。在一个具体实施方案中,疾病是肝癌,特别是肝细胞癌(HCC)。在某些实施方案中,该方法还包括向个体施用治疗有效量的至少一种额外的治疗剂,例如,如果待治疗疾病是病毒性感染,所述额外的治疗剂是抗病毒剂,或如果待治疗疾病是癌症,所述额外的治疗剂是抗癌剂。根据以上任一个实施方案的“个体”是哺乳动物,优选地是人。
本发明的抗体还可用作诊断试剂。抗体与抗原决定簇的结合可以通过与抗体连接的标记物或通过使用对本发明抗体特异的标记第二抗体轻易地检测到。
在一些实施方案中,将有效量的本发明抗体施用至细胞。在其他实施方案中,将治疗有效量的本发明抗体施用至个体以治疗疾病。
为了预防或治疗疾病,本发明抗体的适宜剂量(当单独或与一种或多种其他额外的治疗剂组合使用时)将取决于待治疗疾病的类型、施用途径、患者体重、抗体的类型、疾病的严重性和过程、抗体是否出于预防或治疗目的施用、既往或伴同治疗性介入、患者的临床史和对抗体的反应以及主治医师的决定。在任何情况下,负责施用的执业者将决定用于单个受试者的组合物中的有效成分浓度及适宜剂量。本文中构思了多种施用方案,包括但不限于单次或在多个时间点多次施用、快速浓注施用和脉冲输注。
将抗体适当地按一次或经过一系列治疗施用至患者。取决于疾病的类型和严重性,约1μg/kg至15mg/kg(例如0.1mg/kg-10mg/kg)抗体可以是向患者施用的初始候选剂量,无论是否例如通过一个或多个单独施用或通过连续输注来施用。取决于上文提到的因素,一个常见的每日剂量可能是从约1μg/kg至100 mg/kg或更多。对于在几日或更长时间范围内重复施用,取决于疾病,治疗通常将持续直至所需的疾病症状抑制作用出现。抗体的一个示例性剂量处于约 0.005mg/kg至约10mg/kg范围内。在其他非限制性例子中,剂量还可以包括每次施用约1μg/kg体重、约5μg/kg体重、约10μg/kg体重、约50μg/kg体重、约100μg/kg体重、约200μg/kg体重、约350μg/kg体重、约500μg/kg体重、约1mg/kg体重、约5mg/kg体重、约10mg/kg体重、约50mg/kg体重、约 100mg/kg体重、约200mg/kg体重、约350mg/kg体重、约500mg/kg体重至约1000mg/kg体重或更多;以及其中可推导的任何范围。在从本文中列出的数值可推导的范围的非限制性例子中,基于上文描述的数值,可以施用约5mg/kg 体重至约100mg/kg体重、约5μg/kg体重至约500mg/kg体重等的范围。因此,可以向患者施用约0.5mg/kg、2.0mg/kg、5.0mg/kg或10mg/kg的一种或多种剂量(或其任意组合)。这类剂量可以断续地施用,例如,每周或每3周(例如,从而,患者接受从约2个至约20个或例如约6个剂量的抗体)。可以施用较高的初始负荷剂量,随后是一个或多个较低剂量。然而,可以使用其他剂量方案。通过常规技术和测定法容易地监测这种疗法的进程。
本发明的抗体通常将按有效实现预期目的量使用。为了用来治疗或预防疾病状态,以治疗有效量施用或施加本发明的抗体或其药物组合物。确定治疗有效量完全处于本领域技术人员的能力范围内,尤其是根据本文所提供的详细公开内容。
对于全身性施用,可以从体外测定法初步估计治疗有效剂量,如细胞培养测定法。可以在动物模型中配制某个剂量以实现包括IC50的循环浓度范围,如细胞培养物中所测定。这种信息可以用来更精确地确定用于人类中的剂量。
也可以使用本领域熟知的技术,从体内数据(如动物模型)估计初始剂量。本领域普通技术人员可以基于动物数据轻易地优化对人类施用。
可以逐一调整剂量数量和间隔时间以提供足以维持治疗效果的抗体血浆水平。注射施用的患者常规剂量是约0.1至50mg/kg/日,一般约0.5至1mg/kg/ 日。治疗有效的血浆水平可以通过每日施用多个剂量实现。可以测量血浆中的水平,例如,通过HPLC测量。
在局部施用或选择性摄入的情况下,抗体的有效局部浓度可以与血浆浓度不相关。本领域技术人员将能够在无需过多实验的情况下优化治疗有效的局部剂量。
本文所述的抗体的治疗有效剂量通常将在不造成实质毒性的情况下提供治疗益处。可以通过标准药学流程在细胞培养物或实验动物中确定抗体的毒性和治疗功效。细胞培养测定法和动物研究可以用来测定LD50(对50%群体致死的剂量)和ED50(50%群体中治疗有效的剂量)。毒性作用和治疗作用之间的剂量比是治疗指数,它可以表示为LD50/ED50比。优选显示出大治疗指数的抗体。在一个实施方案中,本发明的抗体显示高治疗指数。从细胞培养物测定法和动物研究中获得的数据可以在配制适用于人类中的剂量范围时使用。该剂量优选地位于毒性低或无毒性情况下包括ED50的循环浓度范围内。剂量可以在这个范围内部变动,这取决于多种因素,例如,所用的剂型、所用的施用途径、受试者状况等。确切的制剂、施用途径和剂量可以由各位医师根据患者的状况选择(参见例如Fingl等人,1975,引自:The Pharmacological Basis of Therapeutics,第1章, 第1页,所述文献通过引用方式完整并入本文)。
用本发明抗体治疗的患者的主治医生将知道如何和何时因所致毒性、器官功能障碍等而终止、中断或调节施用。反过来,如果临床反应不充分(不包括毒性),主治医师也会知道将治疗调整到更高的水平。治疗目的病状时所施用剂量的大小将随待治疗病状的严重性、随施用途径等变动。病状的严重性可以例如部分地通过标准预后评价方法进行评价。另外,剂量和或许施用频率也将根据各位患者的年龄、体重和反应而变动。
其他药剂和治疗
本发明的抗体可以在疗法中与一种或多种其他药剂组合施用。例如,本发明的抗体可以与至少一种额外的治疗剂共施用。术语“治疗剂”涵盖为了治疗需要这种治疗的个体中的症状或疾病所施用的任何药剂。这类种额外的治疗剂可以包括适于正在治疗的特定适应症的任何有效成分,优选地具有互补活性的彼此无不利影响的那些有效成分。在某些实施方案中,额外的治疗剂是抗病毒剂。在其他实施方案中,额外的治疗剂是抗癌剂。
此类其他药剂适当地以有效用于预期目的的量存在。这类其他药物的有效量取决于所用抗体的量、疾病类型或疗法和上文讨论的其他因素。这些抗体通常以与本文所述相同的剂量并且采用与本文所述相同的施用途径使用,或以约 1%至99%的本文所述剂量使用,或以经验地/临床上确定适宜的任何剂量和任何途径使用。
上文所示的这类联合疗法涵盖联合施用(其中在相同或独立的组合物中包含两种或更多种治疗剂),和独立施用,在这种情况下,本发明抗体的施用可以在施用额外的治疗剂和/或辅助剂之前、同时和/或之后进行。
制造品
在本发明的另一个方面,提供制造品,所述制造品含有上文描述的可用于治疗、预防和/或诊断疾病的物质。该制造品包含容器和或在该容器上或与之结合的标签或包装物插页。合适的容器例如包括瓶、小药瓶、注射器、静脉内输液袋等。容器可以从多种材料如玻璃或塑料形成。该容器容纳了本身或与另一种组合物组合时有效治疗、预防和/或诊断病症的组合物并且可以具有无菌接入口(例如该容器可以是静脉内输液袋或是具有皮下注射针头可穿透的瓶塞的小药瓶)。组合物中的至少一种活性物质是本发明的抗体。标签或包装插页说明该组合物用于治疗选择的病状。另外,制造品可以包含(a)其中含有组合物的第一容器,其中所述组合物包含本发明的抗体;和(b)其中含有组合物的第二容器,其中所述组合物包含进一步的治疗剂。在本发明的这个实施方案中制造品还可以包含指示组合物可以用来治疗特定疾病的包装物插页。备选地或额外地,该制造品可以还包含第二(或第三)容器,其包含可药用缓冲剂,如抑菌注射用水 (BWFI)、磷酸盐缓冲盐水、林格液和葡萄糖溶液。它可以还包括从商业和用户观点看受欢迎的其他材料,包括其他缓冲剂、稀释剂、滤器、针头和注射器。
实施例
以下是本发明方法和组合物的例子。应当理解,鉴于上文提供的一般表述,可以实施多种其他实施方案。
重组DNA技术
如Sambrook,J.等人,Molecular cloning:A laboratory manual;Cold Spring Harbor Laboratory press,Cold spring Harbor,New York,1989中所述的标准方法用来操作DNA。根据制造商的说明书使用分子生物学试剂。
关于人免疫球蛋白轻链和重链的核苷酸序列的一般信息在Kabat,E.A.等人, (1991)Sequences of Proteins of Immunological Interest,第5版,NIH出版编号 91-3242中给出。
DNA测序
通过双链测序法测定DNA序列。
基因合成
根据需要,使用适宜的模板通过PCR产生目的基因区段或在Geneart AG (雷根斯堡,德国)从合成的寡核苷酸和PCR产物通过自动化基因合成来合成目的基因区段。在精确基因序列不可获得的情况下,基于来自最接近同源物的序列设计寡核苷酸引物并且通过RT-PCR从源自适宜组织的RNA分离基因。将旁侧分布有单一限制性核酸内切酶切割位点的基因区段克隆至标准克隆/测序载体中。从转化的细菌纯化出质粒DNA并且通过紫外光谱法测定浓度。通过DNA 测序证实亚克隆基因片段的DNA序列。基因区段设计成具有合适的限制性位点以允许亚克隆至相应的表达载体中。全部构建体均设计成具有编码前导肽的5' 末端DNA序列,所述前导肽在真核细胞中引导蛋白质分泌。SEQ ID NO: 135-137给出示例性前导肽。
抗原表达载体的克隆
将编码目的抗原的已扩增DNA片段符合可读框地插入哺乳动物受体载体中,位于充当溶解和纯化标签的人IgG1 Fc编码片段下游(图1)。具有野生型Fc 序列(SEQ ID NO:123、125、127、129、131、133)的抗原-Fc融合物的表达产生同型二聚分子(avi-Fc-人ASGPR H1茎:SEQ ID NO:124,avi-Fc-食蟹猴 ASGPR H1茎:SEQ ID NO:126,avi-Fc-人ASGPR H1茎CRD:SEQ ID NO: 130,avi-Fc-食蟹猴ASGPR H1茎CRD:SEQ ID NO:132)。蛋白质CLEC10A 被鉴定为ASGPR H1的最接近同源物,并且表达构建体avi-Fc-人CLEC10A茎 (SEQ ID NO:128)和avi-Fc-人CLEC10A茎CRD(SEQ ID NO:134)以检验所选择的结合物的特异性。为了表达单聚体状态的抗原,将DNA片段与含有“穴突变的Fc部分(SEQ ID NO:117、119)融合并且与Fc-“隆突”(SEQ ID NO:121)对应物(Fc-人ASGPR H1CRD:SEQ ID NO:118和122,avi-Fc-人CLEC10A CRD:SEQ ID NO:120和122)共表达。抗原表达一般由MPSV启动子驱动并且通过位于CDS下游的合成的聚腺苷酸化信号序列终止转录。此外,全部构建体均含有允许与Bir A生物素连接酶共表达期间特异性生物素酰化的N端Avi 标签。除表达盒之外,每种载体还含有用于在表达EBV-EBNA的细胞系中自主复制的EBV oriP序列。
抗原和抗体的产生和纯化
将抗原和抗体瞬时转染至稳定表达EBV衍生蛋白EBNA的HEK293细胞中。同时共转染的编码生物素连接酶Bir A的质粒允许在体内Avi标签特异性生物素酰化。随后使用蛋白A柱,接着用凝胶过滤纯化蛋白质。
类属性λFab文库的产生
基于人种系基因使用以下V结构域配对,生成Fab样式的类属性λ抗体文库:Vl3_19λ轻链以及VH3_23重链,产生DP47-λ文库。将该文库在轻链(L3) 的CDR3和重链(H3)的CDR3中随机化并且通过“重叠延伸剪接”(SOE)PCR从三个片段装配出来。片段1包含了包括随机化L3的抗体基因5'末端,片段2是涵盖L3末端至H3始端的中央恒定片段,而片段3包含随机化的H3和Fab片段的3’部分。以下引物组合用来为文库产生文库片段:片段1(LMB3(SEQ ID NO:146)-Vl_3_19_L3r引物(SEQ ID NO:143-145))、片段2(RJH80(SEQ ID NO:148)-DP47CDR3_ba(mod)(SEQ ID NO:149))、片段3(DP47-v4引物(SEQ ID NO:140-142)-fdseqlong(SEQ ID NO:147)(表1)。用于产生文库片段的PCR 参数是在94℃初始变性5分钟,25个下述循环:60秒94℃,60秒55℃,60 秒72℃并且在72℃终末延伸10分钟。使用等摩尔比例的3个片段作为模板时,对于装配PCR,参数是在94℃初始变性3分钟和5个以下循环:60秒94℃, 60秒55℃,120秒72℃。在这个阶段,添加外引物并且执行额外20个循环,之后在72℃终末延伸10分钟(图2)。在装配足够量的全长随机化Fab片段后,将它们用NcoI/NheI消化,同时类似地处理接纳体噬菌粒载体。15μg Fab文库插入物与13.3μg噬菌粒载体连接。纯化的连接物用于60次转化,产生1.5x109个转化体。将展示Fab文库的噬菌粒粒子拯救并通过PEG/NaCl纯化法纯化,以用于选择。
表1.用于产生类属性λ文库的引物的序列
从类属性λFab文库选择抗人ASGPR H1结合物
使用HEK293表达的与人IgG1抗体Fc-部分(SEQ ID NO:118、120、124、 126、128、130、132、134)融合的单聚体或二聚体人ASGPR蛋白质片段,选择人ASGPR H1的完整胞外结构域或胞外结构域(ECD)片段。尽管使用Fc“隆突入穴法”样式将ASGPR H1 CRD和CLEC10A CRD表达为单体Fc融合物(仅一个Fc携带C端融合的CRD),全部茎片段和整个ECD表达为同型二聚体Fc融合蛋白(图1)。借助N末端avi标签通过共表达生物素连接酶Bir A,使抗原酶促生物素酰化。在溶液中根据以下样式进行淘洗循环:(1)使用以10μg/ml包被到NUNC maxisorp板上的人IgG1预净化约1012个噬菌粒粒子以避免Fc-结合物,(2)来自预净化反应上清液的不结合Fc的噬菌粒粒子与100nM生物素酰化抗原蛋白在总体积1ml中结合0.5小时,(3)通过添加5.4x 107个链霉亲和素包被的磁珠10分钟,捕获生物素酰化抗原和连接的特异性结合噬菌体,(4)使用5 x 1ml PBS/吐温20和5x 1ml PBS洗涤磁珠,(5)通过添加1ml 100mM三乙胺 (TEA)洗脱噬菌体粒子10分钟并且通过添加500μl 1M Tris/HCl pH 7.4中和, (6)用上清液中的噬菌体粒子再感染对数期大肠杆菌TG1细胞,用辅助噬菌体VCSM13感染并随后PEG/NaCl沉淀噬菌粒粒子,以用于后续的选择轮次。使用恒定或减少的(10-7M至2x 10-9M)抗原浓度实施3-5轮选择。在第2轮中,使用中性亲和素平板而非使用链霉亲和素珠,捕获抗原-噬菌体复合物。通过 ELISA如下鉴定特异性结合物:将100μl 50nM生物素酰化的人Fc-茎-CRD、 Fc-CRD或Fc-茎/孔包被在中性亲和素平板上。添加含有Fab的细菌上清液,并且通过使用抗Flag/HRP第二抗体借助它们的Flag-标签,检测结合的Fab。将显示明显高于背景的信号的克隆提交测序(SEQ ID NO:1、3、5、7、9、11、13、 15、17、19、21、23、25和27)和进一步分析。
Fab的纯化
纯化来自细菌培养物的Fab(可变域的蛋白质序列作为SEQ ID NO:2、4、6、 8、10、12、14、16、18、20、22、24、26和28列出)用于确切分析动力学参数。对于每种克隆,将500ml培养物用携带相应噬菌粒的细菌接种并且在OD6000.9 用1mM IPTG诱导。此后,将培养物在25℃温育过夜并且通过离心收获。在 25ml PPB缓冲液(30mM Tris-HCl pH 8,1mM EDTA,20%蔗糖)中温育重悬的沉淀物20分钟后,再次离心细菌并收获上清液。用25ml 5mM MgSO4溶液重复这个温育步骤1次。将两个温育步骤的上清液合并、过滤并加载于IMAC 柱(His gravitrap,GE Healthcare)上。随后,将柱用40ml洗涤缓冲液(500mM NaCl,20mM咪唑,20mM NaH2PO4pH 7.4)洗涤。在洗脱(500mM NaCl,500 mM咪唑,20mM NaH2PO4pH 7.4)后,使用PD10柱(GE Healthcare)再缓冲洗脱物。随后通过SPR分析(Proteon XPR36,Biorad)在范围从200nM至6.25nM 的稀释度系列内研究纯化的Fab的动力学参数。
通过SPR测定亲和力
在25℃使用ProteOn XPR36仪(Biorad),用借助中性亲和素捕获作用固定在NLC芯片上的生物素酰化单价-(avi-Fc-人ASGPR H1 CRD,SEQ ID NO:118) 或二价(avi-Fc-人ASGPR H1茎-CRD,SEQ ID NO:130)ASGPR H1抗原,通过表面等离子体共振法测量选定的Fab克隆的亲和力(KD)。固定重组抗原(配体):抗原以PBST(10mM磷酸盐,150mM NaCl pH 7.4,0.005%吐温20)稀释至10μg/ml,随后以30μl/分钟在不同接触时间上样,以在垂直方向实现200、400或800响应单位(RU)的固定水平。分析物上样:对于单触发动力学测量,将上样方向改变为水平方向,将两倍稀释系列的纯化Fab(浓度范围在100nM和 6.25nM之间变动)按50、60或100μl/分钟沿着独立通道1-5同时上样,缔合时间为150秒或200秒并且解离时间为240秒或600秒。将缓冲液(PBST)沿着第六通道上样以提供供参照的“内嵌(in-line)”空白。用ProteOn管理v3.1软件中的简单一对一朗缪尔结合模型,通过同时拟合缔合传感图和解离传感图计算缔合速率常数(kon)和解离速率常数(koff)。将平衡解离常数(KD)计算为koff/kon比。使用10mM甘氨酸,pH1.5以流速100μl/分钟持续接触时间30秒,在水平方向进行再生。发现两个克隆51A12(SEQ ID NO:002和004)及52C4(SEQ ID NO: 006和008)对ASGPR H1 CRD特异。令人瞩目地,克隆51A12揭示出亚纳摩尔范围内的亲和力。针对ASGPR H1的茎区或茎和CRD之间的界面产生克隆5A4 (SEQ ID NO:010和012)、4F3(SEQ ID NO:014和016)、R5C2(SEQ ID NO:018 和020)、R9E10(SEQ ID NO:022和024)和R9E10(SEQ ID NO:026和028)。对其相应的人和食蟹猴表位的亲和力是相似的。与之相反,未检测到与avi-Fc- 人CLEC10A茎CRD(SEQ ID NO:134)结合,从而显示这些结合物的高度特异性。令人感兴趣的是,克隆5A4展示与茎抗原而不是茎-CRD强烈结合。全部测量的动力学数据和热动态数据汇总于表2中。
表2.抗ASGPR H1 Fab的动力学参数和热动态参数。
克隆可变抗体结构域至表达载体中
通过SPR显示与其相应抗原特异性结合的全部Fab均转变成IgG1/λ抗体。因此,将重链和轻链v域的PCR扩增DNA片段符合可读框地插入含有人IgG1恒定重链或人恒定λ轻链的相应接纳体哺乳动物表达载体中。抗体表达由MPSV 启动子驱动并且通过位于CDS下游的合成的聚腺苷酸化信号序列终止转录。除表达盒之外,每种载体还含有用于在表达EBV-EBNA的细胞系中自主复制的 EBV oriP序列。
抗体与HepG2细胞的结合分析
通过FACS测量人IgG1抗ASGPR抗体与肝细胞癌细胞系HepG2的结合。简而言之,将96孔圆底平板中的0.2mio细胞/孔在4℃按300μl与浓度30μg/ml 的抗ASGPR抗体温育30分钟。通过用含有0.1%BSA的PBS洗涤细胞,移除未结合的抗体。用FITC缀合的AffiniPure山羊抗人IgG Fcγ片段特异性第二 F(ab’)2片段(Jackson ImmunoResearch#109-096-098;在PBS,0.1%BSA中的 1:20工作液)检测结合的抗体。在4℃温育30分钟后,通过洗涤移除未结合的抗体并且使用1%PFA固定细胞。使用BD FACS CantoII(Software BD DIVA) 分析细胞(图3)。全部抗体均显示与HepG2细胞强烈结合。
荧光共振能量转移测定法
通过荧光共振能量转移(FRET)分析测定IgG与表达ASGPR的细胞上其表位的亲合力。对于这项分析,编码SNAP标签的DNA序列(质粒购自Cisbio)由 PCR扩增并连接至含有全长人ASGPR H1序列(Origene)的表达载体中。所得到的融合蛋白包含带有C末端SNAP标签的全长ASGPR H1。使用脂质转染胺 2000作为转染试剂,将HEK293细胞用10μg DNA转染。在20小时温育时间后,将细胞用PBS洗涤并且在37℃于含有100nM SNAP-Lumi4Tb(Cibsio)的 LabMed缓冲液(Cisbio)中温育1小时,导致特异性标记SNAP标签。随后,将细胞用LabMed缓冲液洗涤4次以移走未结合的染料。通过与缓冲液相比在615 nm测量铽发射,确定标记效率。细胞随后冷冻贮藏在-80℃至多6个月。通过以下方式测量亲合力:以50-0.39nM的浓度添加ASGPR-特异性抗体至标记的细胞(100个细胞/孔),接着添加抗人Fc-d2(终浓度200nM/孔)作为FRET的接纳分子。在室温3小时温育时间后,使用荧光读数仪(Victor3,Perkin Elmer) 测定接纳体染料(665nm)的发射以及供体染料(615nm)的发射。计算接纳体对供体发射的比例并且扣减背景对照的比例(具有抗huFc-d2的细胞)。在GraphPad Prism5中分析曲线并计算KD值(图4)。尽管克隆4F3对ASGPR H1茎-CRD显示由SPR测量的最低亲和力(表2),但是作为IgG与细胞表面结合的强度受强亲合力驱动,使得4F3是在低浓度时具有最强结合强度的克隆。与之相反,与 CRD结合的克隆51A12在低抗体浓度对细胞显示比SPR研究中的纯化抗原显著更弱的结合强度。
与天然ASGPR配体的结合竞争
使用肝细胞癌细胞系HepG2,分析ASGPR抗体与作为ASGPR的天然配体的去唾液酸化糖蛋白(如脱唾液酸胎球蛋白)的竞争。将96孔圆底平板中的0.2 mio细胞/孔在4℃与40μl Alexa488标记的脱唾液酸胎球蛋白(来自胎牛血清, Sigma Aldrich#A4781,终浓度100μg/ml)温育30分钟。结合过程在钙存在下进行,因为配体与ASGPR的结合是钙依赖性的。通过用含有0.1%BSA的HBSS 洗涤细胞1次移除未结合的蛋白质。随后将40μl抗ASGPR抗体(终浓度30、6 和1.25μg/ml)在100μg/ml脱唾液酸胎球蛋白存在下添加至细胞。将细胞在4℃温育30分钟并且通过洗涤细胞1次移除未结合的蛋白质。使用APC缀合的 AffiniPure山羊抗人IgG Fcγ片段特异性第二F(ab’)2片段(Jackson ImmunoResearch#109-136-170;在含有0.1%BSA的HBSS中的1:50工作液) 作为第二抗体。在4℃温育30分钟后,通过洗涤移除未结合的第二抗体。使用1%PFA固定细胞并使用BD FACS CantoII(软件BD DIVA)分析。对CRD特异性抗体和茎-CRD-特异性抗体的分析均揭示抗体与脱唾液酸胎球蛋白存在无关地结合至ASGPR H1,并且反之亦然,没有发生结合竞争作用。(图5和图6)。
内化研究
已知与ASGPR结合后去唾液酸化糖蛋白向肝脏细胞中的摄取非常迅速地发生。在这种受体介导的内吞作用期间,内体腔变酸,从而引起受体-配体复合物解离。尽管将配体靶向用于在溶酶体中降解,然而显示ASGPR再循环返回细胞表面。为了分析抗体在细胞表面上的停留时间,使用肝细胞癌细胞系HepG2 分析ASGPR-抗体复合物的内化。将ASGPR阳性HepG2细胞在细胞培养基中转变至4℃以抑制内化。在摇床上在4℃与抗体(30μg/ml)温育45分钟后,通过用冷PBS洗涤2次移除未结合的抗体,并且将细胞重悬并在37℃于预温的培养基中培养以再活化细胞代谢,包括受体介导的内吞作用。立即取得一个等分试样并储存在冰上,这代表时间点零。将剩余细胞在37℃温育并且在5、15、 30和120分钟后,取得额外的样品并用冷PBS洗涤以停止进一步内化。使用 PE缀合的AffiniPure山羊抗人IgG Fcγ特异性第二F(ab’)2抗体片段(Jackson ImmunoResearch#109-116-170,1:50工作液)检测细胞表面结合的抗体。在4℃温育30分钟后,通过用含有0.1%BSA的PBS洗涤移除未结合的抗体。使用 1%PFA固定细胞并使用BD FACS CantoII(软件BD DIVA)分析。图7A显示克隆4F3和51A12的示例性细胞表面暴露的抗体水平。令人感兴趣的是,胞外抗体信号在第一个30分钟期间显著降低(至60%信号下降),但是随后下降在剩余的时间过程延迟。这个结果表示抗体非常高效地内化,但是随后最终再循环返回细胞表面,导致恒定内化和再循环的动态稳态状态。为了支持这种假设,进行相同的实验,但是细胞与抗体温育在37℃在细胞培养基中进行45分钟。这些条件允许受体-抗体复合物在整个温育时间期间形成并内化,最终导致恒定内吞和再循环稳态。此后,通过用温PBS洗涤2次移除未结合的抗体并且细胞重悬于温培养基中。立即取得一份样品并储存在冰上,这代表时间点零。将剩余细胞在37℃温育并且在5、15、30和120分钟后,取得额外的样品并用冷 PBS洗涤以停止进一步内化。如上文所述进行表面暴露的抗体的检测。FACS 分析揭示,在37℃而非4℃温育后,信号强度的下降在实验时程期间较不明显,显示在37℃温育抗体产生抗体-受体复合体内化和再循环的平衡(图7B)。为了进一步赞同恒定内化和再循环假设,使用一套FITC直接标记的抗体,进一步分析ASGPR H1-特异性抗体的内化。如前所述,将标记的抗体在允许抗体与 ASGPR H1结合而非内化的4℃与HepG2细胞温育。在摇床上在4℃与抗体(30 μg/ml)温育45分钟后,通过用冷PBS洗涤2次移除未结合的抗体,并且将细胞重悬并在37℃于预温的培养基中培养以再活化细胞代谢,包括受体介导的内吞作用。在0、5、15、30和120分钟后取得细胞等分试样并用冷PBS洗涤以停止进一步内化。使用PE缀合的AffiniPure山羊抗人IgG Fcγ特异性第二F(ab’)2抗体片段(Jackson ImmunoResearch#109-116-170,1:50工作液)检测细胞表面结合的抗体。如之前所见,表面暴露的抗体的检测水平在前30分钟期间显著地降低,之后它稳定化(图7C)。但是,通过代表表面暴露的抗体和内化抗体的FITC 信号对IgG的检测揭示,抗体总量随时间推移保持恒定(图7D)。这个结果有力支持以下发现:抗体处于恒定内化和再循环的动态稳态状态。
产生基于克隆51A12的L3亲和力文库
抗体序列的分析揭示出51A12轻链的CDR3区中的两个热点,即两个毗邻半胱氨酸和一个糖基化位点(图8)。为了产生51A12衍生的无半胱氨酸和糖基化的克隆,产生在LCDR3中随机化的成熟文库。使用克隆51A12(A82G、C112S、 C113S、S116A)(SEQ ID NO:33)的序列作为随机化模板。将编码位置“RDISSNRAVRN”的三联体在整个区段范围内随机化。为了产生文库,将从两个片段重叠PCR产物产生的DNA部分克隆至噬菌体载体中。为了产生片段1,使用引物组合LCDR3rand(SEQ ID NO:151)和fdseqlong(SEQ ID NO:147) (表1和表3),使用克隆51A12(A82G、C112S、C113S、S116A)作为模板。扩增条件包括5分钟94℃初始温育步骤,随后25个循环,每个循环由30秒94℃变性、30秒60℃复性和90秒72℃延伸步骤组成,随后10分钟72℃终末延伸步骤。在琼脂糖凝胶上纯化所产生的片段。用引物组合LCDR3rev(SEQ ID NO:150)和LMB3(SEQ ID NO:146)(表1和表3)产生片段2。扩增条件包括5 分钟94℃初始温育步骤,随后25个循环,每个循环由30秒94℃变性、30秒60℃复性和30秒72℃延伸步骤组成,随后10分钟72℃终末延伸步骤。为了装配两种片段,使用等摩尔量的片段1和片段2。扩增条件包括5分钟94℃初始温育步骤,随后在无引物情况下5个循环,每个循环由1分钟94℃变性、1 分钟60℃复性和120秒72℃延伸步骤组成。在添加外引物LMB3和fdseqlong 后,使用相同参数进行20个额外循环。最后,进行10分钟72℃终末温育步骤。将所得到的凝胶纯化的DNA片段和克隆51A12(A82G、C112S、C113S、S116A) (SEQ ID NO:33)二者均用NcoI/PstI消化(图9)。为了产生文库,用10μg插入物和30μg载体进行连接。通过电穿孔将纯化的连接产物转化至TG1细菌中,产生3x 109个转化体。将展示Fab文库的噬菌粒粒子拯救并通过PEG/NaCl纯化法纯化,以用于选择。
表3.用于产生L3亲和力成熟文库的引物的序列。
选择无半胱氨酸和糖基化位点的51A12衍生的亲和力成熟克隆
使用标准方案(Silacci等人,(2005),Proteomics 5,2340-50),通过噬菌体展示法实施LCDR3内部无半胱氨酸和糖基化位点的51A12衍生的亲和力成熟Fab 的产生。在第一淘洗轮次,根据以下程序在溶液中实施选择:(1)在总体积1ml 中约1012个噬菌粒粒子与10nM生物素酰化Fc-CRD结合0.5小时,(2)通过添加5.4x 107个链霉亲和素包被的磁珠10分钟,捕获生物素酰化的Fc-CRD和特异性结合的噬菌体粒子,(3)使用5x 1ml PBS/吐温20和5x 1ml PBS洗涤珠, (4)通过添加1ml 100mM TEA洗脱噬菌体粒子10分钟并且通过添加500μl 1M Tris/HCl pH 7.4中和,(5)再感染对数生长的大肠杆菌TG1细菌,和(6)用辅助噬菌体VCSM13感染并随后PEG/NaCl沉淀在后续选择轮次中待用的噬菌粒粒子。使用(从10x10-9M至0.5x10-9M)减少的抗原浓度实施3轮选择。在第2轮和第3轮中,使用中性亲和素平板而非链霉亲和素珠,捕获抗原-噬菌体复合物。此外,将中性亲和素平板在2升PBS中洗涤3小时。通过ELISA如下鉴定特定结合物:将100μl 50nM生物素酰化Fc-CRD/孔包被在中性亲和素平板上。添加含有Fab的细菌上清液,并且通过使用抗Flag/HRP第二抗体借助它们的Flag- 标签,检测结合的Fab。ELISA阳性克隆按96孔样式用细菌表达为可溶性Fab 片段,并且通过SPR分析,使用Proteon XPR36,对上清液进行动力学筛选实验。鉴定了表达具有最高亲和力常数的Fab的克隆,并且将相应噬菌粒的轻链测序(51A12_C1、SEQ ID NO:35;51A12_C7、SEQ ID NO:37;51A12_E7、 SEQ ID NO:39;51A12_H3、SEQ ID NO:41;51A12_A6、SEQ ID NO:43; 51A12_D1、SEQ ID NO:45;51A12_H6、SEQ ID NO:47)。全部克隆均缺少轻链CDR3区中的任何关键氨基酸。
通过SPR测定基于51A12的亲和力成熟克隆的亲和力
在25℃使用ProteOn XPR36仪(Biorad),用借助中性亲和素捕获作用固定在NLC芯片上的生物素酰化单价(avi-Fc-人ASGPR H1 CRD,SEQ ID NO:118) 或二价(avi-Fc-人ASGPR H1茎-CRD,SEQ ID NO:130)ASGPR H1抗原,通过表面等离子体共振法测量纯化的51A12衍生的Fab片段的亲和力(KD),所述 Fab片段由亲本重链(SEQ ID NO:4)和亲和力成熟轻链(51A12_C1,SEQ ID NO: 36;51A12_C7,SEQ ID NO:38;51A12_E7,SEQ ID NO:40;51A12_H3,SEQ ID NO:42;51A12_A6,SEQ ID NO:44;51A12_D1,SEQ ID NO:46;51A12_H6, SEQ ID NO:48)组成。固定重组抗原(配体):抗原以PBST(10mM磷酸盐,150 mM NaCl pH 7.4,0.005%吐温20)稀释至10μg/ml,随后以30μl/分钟在不同接触时间上样,以在垂直方向实现200、400或800响应单位(RU)的固定水平。分析物上样:对于单触发动力学测量,将上样方向改变为水平方向,将两倍稀释系列的纯化Fab(浓度范围在12.5nM和0.78nM之间变动)按100μl/分钟沿着独立通道1-5同时上样,缔合时间为150秒或200秒并且解离时间为3600秒。将缓冲液(PBST)沿着第六通道上样以提供供参照的“内嵌”空白。用ProteOn管理 v3.1软件中的简单一对一朗缪尔结合模型,通过同时拟合缔合传感图和解离传感图计算缔合速率常数(kon)和解离速率常数(koff)。将平衡解离常数(KD)计算为 koff/kon比。使用10mM甘氨酸,pH1.5以流速100μl/分钟持续接触时间30秒,在水平方向进行再生。尽管大部分选定的克隆显示与亲本克隆相似的亲和力,但是克隆51A12_A6(SEQ ID NO:44)显示显著改善的亲和力(表4)。
表4.亲和力成熟抗ASGPR1Fab的动力学参数和热动态参数。
亲和力成熟的51A12衍生物对HepG2细胞的结合分析
通过FACS测量选定的亲和力成熟的51A12衍生物对ASGPR阳性肝细胞癌细胞系HepG2的结合。作为阴性对照,使用ASGPR阴性细胞系Hela。将 96孔圆底平板中的0.2mio细胞/孔在4℃在300μl中与纯化的Fab片段(1.1、 3.3和10μg/ml)或人IgG1转变的抗体(0.01、0.04、0.1、0.4、1.1、3.3和10μg/ml) 温育30分钟。通过用含有0.1%BSA的PBS洗涤细胞,移除未结合的分子。用FITC缀合的AffiniPure山羊抗人F(ab’)2片段特异性第二F(ab’)2片段(Jackson Immuno Research Lab#109-096-097)或FITC缀合的AffiniPure山羊抗人IgG Fcγ片段特异性第二F(ab’)2片段(Jackson ImmunoResearch#109-096-098,在 PBS,0.1%BSA中1:20的工作液)检测结合的分子。在4℃温育30分钟后,通过洗涤移除未结合的抗体并且使用1%PFA固定细胞。使用BD FACS CantoII (Software BD DIVA)分析细胞。分析与HepG2细胞结合的Fab揭示全部克隆的强烈结合作用(图10)。变体51A12_A6(SEQ ID NO:44)在SPR分析和细胞结合研究中均是最强烈的结合物。对于全部克隆,作为IgG1转变抗体的克隆变体与 HepG2细胞的结合分析产生强度相似的结合模式(图11A),而在最高抗体浓度时与Hela细胞的结合非常弱或不可检测到(图11B),凸显这些克隆变体的特异性。
IgG-IFNαDNA构建体的产生
基于ASGPR H1-抗体51A12、51A12(S116A)、51A12(A82G、S116A)、52C4、 5A4、4F3、R5C2、R9E10、R7E12、51A12_C1、51A12_C7、51A12_E7、51A12_H3、 51A12_A6、51A12_D1和51A12_H6产生了编码靶向ASGPR H1的IgG-IFNα融合蛋白的DNA序列,其中一个干扰素-α2a(IFNα)与一个异二聚体重链的C 末端融合,如图12A中所示。通过二价抗体Fab区域(亲合效应)实现靶向其中 ASGPR H1选择性表达的肝细胞。通过应用隆突入穴(kih)技术实现了导致单个 IFNα存在的异二聚化。为了使同型二聚体IgG-细胞因子融合物的产生最小化,通过(G4S)3接头将细胞因子与含有隆突的IgG重链的C末端(C末端Lys残基缺失)融合。抗体-细胞因子融合物具有IgG样特性。为了减少FcγR结合/效应子功能并防止FcR共激活,在Fc域中引入P329G L234A L235A(LALA)突变。但是,FcRn结合作用不受损。编码这些免疫缀合物的DNA序列在SEQ ID NO:49、 51和53(51A12)、SEQ ID NO:55、57和59(52C4)、SEQ ID NO:93、51和53 (51A12A82G、S116A)、SEQ ID NO:91、51和53(51A12、S116A)、SEQ ID NO: 61、63和65(5A4)、SEQ ID NO:67、69和71(4F3)、SEQ ID NO:73、75和 77(R5C2)、SEQ ID NO:79、81和83(R9E19)、SEQ ID NO:85、87和89(R7E12)、 SEQ ID NO:95、51和53(51A12_C1)、SEQ ID NO:97、51和53(51A12_C7)、SEQ ID NO:99、51和53(51A12_E7)、SEQ ID NO:101、51和53(51A12_H3)、 SEQ ID NO:103、51和53(51A12_A6)、SEQ ID NO:105、51和53(51A12_D1)、 SEQ ID NO:107、51和53(51A12_H6)中给出。此外,产生其中VH域和CH1 域均缺失的备选的穴-重链(SEQ ID NO:115)。所得到的Fc片段能够与全长隆突重链异二聚化,产生具有单个细胞因子融合物的单价抗体(图12B)。作为功能测定法的阴性对照,产生相应的DNA构建体,所述DNA构建体编码其中IgG不与特定的靶结合的对照DP47GS/DPL16非靶向的IgG-IFNa蛋白。在SEQ ID NO:109、111和113中给出这种同种型免疫缀合物的DNA序列。
抗体-细胞因子构建体的表达和纯化
使用磷酸钙转染法,通过用哺乳动物表达载体共转染指数生长的 HEK293-EBNA细胞产生免疫缀合物。备选地,用相应的表达载体通过聚乙烯亚胺(PEI)转染悬浮生长的HEK293-EBNA细胞。随后,通过下述方法从上清液纯化IgG-细胞因子融合蛋白,所述方法由一个亲和步骤(蛋白A)接着大小排阻层析(Superdex200,GE Healthcare)组成。蛋白A柱(HiTrap ProtA,GE Healthcare)在20mM磷酸钠,20mM柠檬酸钠pH 7.5中平衡。在装载上清液后,将该柱首先用20mM磷酸钠,20mM柠檬酸钠,pH 7.5洗涤并随后用13.3 mM磷酸钠,20mM柠檬酸钠,500mM氯化钠,pH 5.45洗涤。将IgG-细胞因子融合蛋白用20mM柠檬酸钠,100mM氯化钠,100mM甘氨酸,pH 3洗脱。将级分中和、合并并在最终配制缓冲液(25mM磷酸钾,125mM氯化钠, 100mM甘氨酸pH6.7或20mM组氨酸,140mM NaCl,pH 6.0)中通过大小排阻层析(HiLoad16/60Superdex200,GE Healthcare)纯化。通过使用基于氨基酸序列计算的摩尔消光系数,在280nm测量光密度(OD)确定纯化蛋白质样品的蛋白质浓度。在还原剂(5mM 1,4-二硫苏糖醇)存在和不存在下通过SDS-PAGE或 Caliper分析免疫缀合物的纯度和分子量。根据制造商的说明书使用预制凝胶系统(Invitrogen)(4-20%Tris-甘氨酸凝胶或3-12%Bis-Tris)。在25℃使用Superdex 20010/300GL大小排阻分析柱(GE Healthcare)在2mM MOPS, 150mM NaCl,0.02%NaN3,pH 7.3运行缓冲液中分析免疫缀合物样品的聚集物含量。在图13(51A12 kih IgG IFNα,SEQ ID NO:50、52、54)、图14(4F3 kih IgG IFNα,SEQ ID NO:68、70、72)、图15(51A12_C1 kih IgG IFNα,SEQ ID NO:96、52、54)、图16(51A12_E7kih IgG IFNα,SEQ ID NO:100、52、54)、图17(51A12_C7 kih IgG IFNα,SEQ ID NO:98、52、54)、图18(非靶向的kih IgG IFNα,SEQ ID NO:110、112、114)和图19(单价51A12 kih IgG IFNα,SEQ ID NO:50、52、116)中显示了选定克隆的分析数据总结。
通过SPR测定IgG-IFNα免疫缀合物对ASGPR H1的亲和力
在ProteOn XPR36仪(Biorad)上通过表面等离子体共振法(SPR)测定作为示例性IgG-IFNα免疫缀合物使用的克隆51A12和克隆52C4的ASGPR H1结合活性并且将它与相应的未修饰IgG抗体比较。生物素酰化的avi-Fc人ASGPR H1 CRD抗原借助中性亲和素捕获作用固定在NLC芯片上。固定重组抗原(配体):抗原以PBST(10mM磷酸盐,150mM氯化钠pH 7.4,0.005%吐温20) 稀释至10μg/ml,随后以30μl/分钟在不同接触时间上样,以在垂直方向实现400 响应单位(RU)的固定水平。分析物上样:对于单触发动力学测量,将上样方向改变为水平方向,将两倍稀释系列的纯化IgG、单价抗体-细胞因子融合物和二价抗体-细胞因子融合物(浓度范围在50nM和3.25nM之间变动)以50μl/分钟沿着独立通道1-5同时上样,缔合时间为120秒或200秒并且解离时间为300秒。将缓冲液(PBST)沿着第六通道上样以提供供参照的“内嵌”空白。用ProteOn管理v3.1软件中的简单一对一朗缪尔结合模型,通过同时拟合缔合传感图和解离传感图计算缔合速率常数(kon)和解离速率常数(koff)。将平衡解离常数(KD)计算为 koff/kon比。使用10mM甘氨酸,pH1.5以流速100μl/分钟持续接触时间30秒,在水平方向进行再生。数据显示–在该方法的误差范围内–基于克隆51A12的免疫缀合物(SEQ ID NO:50、52、54)和基于克隆52C4的免疫缀合物(SEQ ID NO: 56、58、60)均保留对人ASGPR H1的亲和力(单价展示)和亲合力(二聚体展示)(表 5)。
表5.克隆51A12和克隆52C4对ASGPR H1的单价结合样式和二价结合样式的动力学参数和热动态参数。
IgG-IFNα免疫缀合物与ASGPR阳性细胞和阴性细胞的结合
为了表征抗体缀合物的特异性,将抗体-细胞因子缀合物与ASGPR阳性细胞和阴性细胞温育,并且通过FACS分析法测量特异性结合作用。为此目的,将人原代肝细胞(来自3位供体;购自Celsis In Vitro Technologies(Baltimore, MD))、Huh-7细胞、HepG2细胞、A549细胞、Hela细胞和293T细胞(各自1x105个细胞)与1μg ASGPR H1特异性IgG kih IFNα样品在冰上温育45分钟。在洗涤后,将细胞与标记的山羊抗人IgG第二抗体(BD Biosciences,San Diego,CA) 在冰上温育30分钟。在三次洗涤后,使用Calibur流式细胞仪,通过FACS分析法分析染色的细胞。在全部FACS测定法中,同种型对照缀合物(非靶向的kih IgG IFNα,SEQ ID NO:110、112、114)用来确定背景,所述背景从测试抗体的 MFI值扣减。根据制造商的说明书,通过使用直接标记的抗体缀合物( R- 藻红蛋白人IgG标记试剂盒,Life Technologies),进行人外周血单核细胞(PBMC) 的结合分析。结合分析揭示,克隆51A12 IgG kih IFNα(SEQ ID NO:50、52、 54)和4F3 IgG kih IFNα(SEQ ID NO:68、70、72)显示高度特异性结合至ASGPR 阳性细胞,而ASGPR阴性细胞上的信号与同种型对照缀合物可比较(图20)。此外,分析克隆4F3 IgG kih IFNα的结合饱和曲线。为此目的,将抗体-IFNα缀合物与人原代肝细胞(来自3位供体)按范围从0.0001至6.7μg/ml的稀释列温育,并且通过FACS分析法记录结合强度。如图21中所示,在0.25-0.74μg/ml抗体浓度达到人原代肝细胞上以及对照细胞系HepG2上的结合饱和,并且更高的抗体浓度没有进一步显著增加结合信号。
随时间推移HepG2细胞上表面暴露的ASGPR水平的分析
已知与ASGPR结合后非常迅速地发生去唾液酸化糖蛋白向肝脏细胞中的摄取。在这种受体介导的内吞作用期间,内体腔变酸,从而引起受体-配体复合物解离。尽管在溶酶体中将配体靶向用于降解,然而显示ASGPR再循环返回细胞表面。由于显示几种受体在受体结合随后内化时触发受体表达下调,因此随时间推移测量在抗ASGPR H1抗体存在下表面暴露的ASGPR的水平。对于这个实验,将HepG2细胞与作为IgG或作为单价或二价抗体-IFNα融合蛋白的克隆51A12衍生型抗体温育直至5小时。作为阴性对照,使用不特异性结合 HepG2细胞的不相关抗体(GA101)(全部抗体均处于30μg/ml)。在37℃温育期间,将样品在30、60、120、180和300分钟后取出并用冷PBS洗涤。使用APC 缀合的山羊抗人IgG Fcg片段特异性F(ab’)2片段(Jackson Immuno Research Lab,1:50工作液)检测细胞表面结合的抗体。在4℃温育30分钟后,通过用含有0.1%BSA的PBS洗涤移除未结合的抗体。使用1%PFA固定细胞并使用BD FACS CantoII(软件BD DIVA)分析。为了验证抗体-细胞因子融合物的完整性,还检测IFNα的存在。将细胞在4℃与针对人干扰素α的小鼠单克隆抗体 (MMHA-1,#21105-1,R&D Systems,5μg/ml)温育30分钟。通过用含有0.1% BSA的PBS洗涤移除未结合的抗体,并且使用FITC缀合的抗小鼠F(ab')2片段 (Serotec,STAR105F;1:50工作液)作为第二抗体。使用1%PFA固定细胞并使用BD FACS CantoII(软件BD DIVA)分析。在图22中显示的结果表明,恒定水平的表面暴露的抗体随测量的时间段推移在无任何结合诱导的受体下调情况下与ASGPR结合。值得注意地,单聚IgG-IFNα构建体产生最强烈的信号,这很可能归因于以下事实:每个ASGPR复合物可以结合2倍数目的单体 IgG-IFNα分子(图22A)。
共聚焦显微术
通过共聚焦显微术进行ASGPR介导的抗体-细胞因子融合构建体内化的三维及时间分辨分析。对于这项分析,将HepG2细胞在细胞培养箱中的玻璃底平皿(Nunc)上培育至50-60%汇合度。随后将平皿用预温的PBS(37℃)淋洗2次以将培养基替换为PBS并迅速置于显微镜载物台上(在37℃,5%CO2)。对于这个实验,将克隆51A12 kih IgG IFNα用Alexa488直接标记。将标记的构建体(20 μg/ml)直接添加至显微镜载物台处的HepG2细胞。使用旋转盘共聚焦显微镜在抗体添加后5分钟开始探测。在覆盖整个细胞厚度的10个堆叠(stack)(z水平) 上每3秒采集数据持续1小时(100x放大率)。抗体-细胞因子构建体与表面暴露的ASGPR的结合不是同等分布的,而发现是簇集的(图23A)。簇集物在整个表面扩散。这个实验的时间分辨分析清楚地揭示抗体-细胞因子融合构建体数分钟内立即内化(图23B)。IgG-细胞因子构建体在小泡中内化后,该蛋白质随后被转运返回细胞顶面上的表面(数据未显示)。
通过SPR测定IgG-IFNα免疫缀合物与干扰素-α受体2的亲和力
在ProteOn XPR36仪(Biorad)上通过表面等离子体共振法(SPR)测定 IgG-IFNα免疫缀合物与高亲和力干扰素-α受体2(IFNAR2)的结合活性并且与罗夫仑(Roferon)比较。通过标准胺偶联法,将市售IFNAR2-Fc融合蛋白(R&D Systems)以垂直方向固定在传感器表面上。对于单触发动力学测量,将上样方向改变为水平方向,将两倍稀释系列的纯化抗体-细胞因子融合物(浓度范围在50 nM和3.25nM之间变动)以50μl/分钟沿着独立通道1-5同时上样,缔合时间为 120秒或200秒并且解离时间为300秒。将缓冲液(PBST)沿着第六通道上样以提供供参照的“内嵌”空白。用ProteOn管理v3.1软件中的简单一对一朗缪尔结合模型,通过同时拟合缔合传感图和解离传感图计算缔合速率常数(kon)和解离速率常数(koff)。将平衡解离常数(KD)计算为koff/kon比。使用10mM甘氨酸,pH1.5 以流速100μl/分钟持续接触时间30秒,在水平方向进行再生。抗体-细胞因子融合蛋白的测量亲和力是约(kon1.57x1061/Ms;koff6.15x10-31/s;KD 4nM)并且因此与重组产生的蛋白罗夫仑的已发表亲和力可比较,这表明IFNα与IgG的C 末端融合不影响对IFNAR2的结合亲和力。
测定ASGPR mAb-IFNα的抗病毒活性
为了分析IFNα作为IgG-细胞因子融合物的组成部分的功能活性并且为了将它与罗夫仑比较,在病毒保护测定法中测试IFNα融合构建体的生物学活性。对于这项研究,将MDBK细胞与罗夫仑或抗体-细胞因子融合物预温育1-4小时。随后添加水泡性口炎病毒额外温育16-24小时。在这个温育步骤结束时,将活细胞用结晶紫染色溶液(0.5%)染色并且使用微量平板读数仪在550-600nm以参比波长690nm进行活细胞定量。用4参数对数拟合函数,在全剂量-反应曲线分析中针对标准化罗夫仑溶液测定全部IgG-细胞因子构建体的生物学活性。如表 6中所示,抗体-IFNα融合构建体显示与约5%罗夫仑活性对应的活性,与抗体的结合价态无关。由于IFNα与IgG的C末端融合不影响对IFNAR2的结合亲和力(上文显示),因此与低亲和力干扰素-α受体1(IFNAR1)的相互作用可能在空间上受损,最终导致IFNAR全复合物的信号传导降低。
表6.抗体-细胞因子缀合物与罗夫仑相比的功能IFNα活性。
ASGPR特异性IgG-IFNα缀合物在HCV复制子测定法和EMCV CPE测定法中的抗病毒活性
为了表征IgG-IFNα融合蛋白的功能活性并且与市售罗夫仑和Pegasys (PEG化干扰素-α2a)比较,使用ASGPR阳性细胞(Huh7-2209-3)和ASGPR阴性细胞(Hela)研究抗病毒活性。
为了在ASGPR阴性细胞上分析化合物的抗病毒活性,将Hela细胞以15,000 个细胞/孔接种在96孔不透明壁平板中。在过夜培养后,将孔抽真空并添加50μl 稀释于EMEM(含10%FBS)中的抗体-细胞因子缀合物。将Hela细胞在37℃用 IgG-IFNα构建体预处理3小时,然后将50μl EMCV(VR-1762,ATCC)加入到每个孔(EMEM中2,000TCID50/孔)。感染后24小时使用CellTiter-Glo试剂盒 (G7572,Promega)测量活细胞。将100μl CellTiter-Glo试剂添加至每个孔并在室温温育10分钟,伴以温和振摇。随后使用Berthold Mithras光度计(Berthold Technologies),记录发光信号。结果代表幸存细胞百分数(图24A),并且全部 EC50值以及实验重复次数汇总于表7中。在ASGPR阴性Hela细胞上,罗夫仑的EC50值小于其他化合物如4F3 IgG kih IFNα达75倍,这表明这种化合物功能活性比测试的其他化合物高得多。与之相反,Pegasys的活性与ASGPR特异性IgG kih IFNα缀合物的那些活性可比较。
通过稳定转染双顺反子HCV复制子形成ASGPR阳性Huh7衍生的肝癌细胞系2209-23,其中所述复制子的受HCV IRES驱动的第一可读框含有与新霉素磷酸转移酶基因(NPTII)融合的海肾萤光素酶基因,并且受EMCV IRES驱动的第二可读框含有衍生自NK5.1复制子主链的HCV非结构基因NS3、NS4a、 NS4b、NS5A和NS5B。将细胞在37℃于含有5%CO2的湿润气氛下在补充有 GlutamaxTM和100mg/ml丙酮酸钠(#10569-010)的DMEM中培养。将该培养基进一步用10%(v/v)FBS(#10082-139)、1%(v/v)青霉素/链霉素(#15140-122) 和1%(v/v)遗传霉素补充。全部试剂均从Invitrogen获得。
将含有5%(v/v)胎牛血清的DMEM中的Huh72209-23细胞以90μl体积中的5000个细胞/孔铺种在96孔板中。在铺种后24小时,将抗体-细胞因子缀合物(或作为对照的培养基)以体积10μl按照12个孔范围内3倍稀释度(0.01-2000 pM)添加至细胞。在添加化合物后,终体积是100μl。在添加化合物后72小时,使用海肾萤光素酶测试系统(Promega,#E2820)读取海肾萤光素酶报道分子信号。EC50值计算为与对照样品相比(在化合物不存在的情况下)观察到海肾萤光素酶报道分子水平下降50%的化合物浓度。通过使用XLfit4程序(ID Business Solutions Ltd.,Surrey,UK)获得剂量-反应曲线和EC50值。尽管暴露于ASGPR 阴性细胞时抗体-细胞因子构建体的抗病毒活性降低(表6和图24A),但是与 ASGPR阳性细胞系Huh7 2209-23温育,克隆51A12 IgG kih IFNα和4F3 IgG kih IFNα在保护细胞免于病毒感染和增殖方面比Rofero更强效(图24B和表7)。与之相反,同种型对照(非靶向的IgG kih IFNα)的效力显著较低,凸显IgG kih IFNα缀合物靶向至ASGPR H1的积极结果。
表7.多种ASGPR H1-特异性抗体-IFNα缀合物的抗病毒活性总结。
ASGPR特异性IgG-IFNα缀合物在肝细胞和非肝细胞中的IFNα活性
IFNα通过诱导数百个IFN刺激的基因(ISG)而发挥其抗病毒活性。为了验证抗病毒活性并进一步证实ASGPR靶向作用介导IFNα活性增强,我们测定肝细胞和非肝细胞中的ISG表达。将肝细胞(原代肝细胞和HepG2)和非肝细胞(人 PBMC和Hela)用多种连续稀释的IFNα分子处理6小时,并且使用5PRIME RNA提取试剂盒(#FP2302530,5PRIME,Gaithersburg,MD),从细胞提取总 RNA。
订制设计用于ISG基因MX1和RSAD2的TaqMan(实时PCR)测定法。选定测定法位于Affymetrix目的探针序列内部或位于目的参比mRNA的3’编码序列内部。
在ABI 序列检测系统(Applied Biosystems)上进行全部基因表达分析。每个反应的PCR混合物由10μl qPCR FastMix、 ROXTM(Quanta)、1μl TaqMan或0.06μl IDT测试物和2μl DEPC处理的水 (Ambion,Applied Biosystems)组成。将cDNA样品在无RNA酶的水(Ambion,Applied Biosystems)中稀释成10ng/μl,并将7μl添加至含有13μl预先分布的 PCR测试混合物的384孔光学平板(Applied Biosystems)。用针对一个靶基因的一份测试物或针对内源对照基因18S、GAPDH(恒河猴)、ACTB(恒河猴)和GUSB(恒河猴)(TaqMan Gene Expression Assays,Applied Biosystems)的一份测试物检查全部样品。每种测量一式三份进行。使用以下PCR条件:45℃2分钟,随后95℃3分钟,随后如下40个循环:95℃15秒和60℃45秒。
针对18S、ACTB、GAPDH和GUSB的几何平均值归一化靶基因的表达水平并表示为相对表达(E),E=2(ΔCt),其中ΔCt是参比基因循环和靶基因循环之间扩增超过任意阈的差值。如图25中所示,在全部细胞中同种型IgG kih IFNα对照显示为与罗夫仑相比而言ISG诱导作用减少,与Pegasys(PEG-IFNα)活性相似。在ASGPR阴性Hela细胞和PBMC细胞中,克隆51A12 IgG kih IFNα还显示降低的活性,与同种型对照相似。但是,在ASGPR阳性肝细胞HepG2 和人原代肝细胞中,与同种型对照相比,克隆51A12 IgG kih IFNα显示增强的 IFNα活性,与罗夫仑的水平相似。这个结果证实了51A12抗体-IFNα缀合物的上述增强的抗病毒活性。
为了理解这些靶向ASGPR的IFNα分子是否具有持久IFNα活性,我们监测在Huh-7和原代肝细胞中的ISG表达直至72小时。如图26中所示,两种靶向ASGPR的IFNα分子51A12 IgG kih IFNα和4F3 IgG kih IFNα均在处理后72小时显示持久的ISG诱导作用,而Pegasys和罗夫仑在72小时显示显著减少的ISG诱导作用。
食蟹猴单次施用的PK/PD研究
受到以下体外结果鼓舞:基于ASGPR抗体的靶向的IFNα分子在非肝细胞中显示减少的IFNα活性并且在肝细胞中显示增强的IFNα活性(肝靶向的IFNα效应),设计食蟹猴研究以在体内证实肝靶向的IFNα效应。因为ASGPR特异性克隆51A12以相同亲的和力与人ASGPR和猴ASGPR结合并且人IFNα在猴中具有相似的活性,所以可以使用猴作为肝靶向的IFNα概念验证研究的PK/PD 模型。在猴研究中,我们直接比较51A12 IgG kih IFNα和同种型IgG kih IFNα对照。两种分子均以1μg/kg或10μg/kg剂量水平皮下注射,在施用之前和之后采集猴血液样品和肝脏活组织检查样品,并监测它们的PK(药代动力学)和 PD(药效动力学)。表8中列出剂量组。
表8.将12只食蟹猴分成如下文显示的4个组。
样品采集、转运和储存
在施用之前5日和在注射后2、6、12、24、48、72、96、168和336小时从每只动物采集血液(大约1ml)。将用于药代动力学的样品收集至无抗凝血药的管中。在采集药效动力学用血液之前采集用于药代动力学的血液。
对于基因表达研究,在施用之前5日和在注射后2、6、12、24、48、72、 96、168和336小时从每只动物采集血液(大约2.5ml)。将样品收集至PAXgeneTM血液RNA采集管中并且将管颠倒8-10次混合。PAXgeneTM血液RNA采集管是静脉切开放血术系列中最后拔出的管(即在临床病理学和药代动力学采集后)。
在第-5日和在第2日、第4日和第8日通过腹腔镜手术从每只动物的肝脏中两个分立位置采集肝组织(至少25mg/样品)。将每份组织样品切下并立即置于预称重和标记的独立低温冻存管中并在液氮中快速冷冻。因为需要立即冷冻,所以采集肝脏样品后,样品小瓶不称重。对于第-5日和第2日,每只动物的第一肝组织等分试样取自肝左侧叶,并且每只动物的第二肝组织等分试样取自肝右侧叶。对于第4日和第8日,每只动物的第一肝组织等分试样取自肝左中叶,并且每只动物的第二肝组织等分试样取自肝右中叶。肝脏活组织检查样品在2 ml管中急冻。将干冰上预冷的RNAlater-ICE(P/N 7031,Ambion)添加至冷冻的组织并贮存在-80℃。根据研究方案在PAXgene管中接收血液样品并在加工之前贮存在-80℃。
测量猴血清样品中的克隆51A12 IgG kih IFNα和同种型IgG kih IFNα对照
使用夹心ELISA测定法,对食蟹猴血清等分试样分析施与的化合物,所述夹心ELISA测定法使用抗IFNα抗体(批号34495-28,Roche Nutley,NJ,美国) 作为捕获试剂并使用HRP标记的抗人Fc抗体(批号Wbr72_MM_090602,Roche Diagnostics,Penzberg,德国)作为检测试剂。在室温用抗IFNα抗体包被平板1 小时后,将平板用2%BSA封闭缓冲液处理1小时。在洗涤后,将HRP标记的抗人Fc抗体添加至每个孔并温育1小时,伴以温和振摇。在洗涤后,添加100μl/ 孔TMB底物溶液(#11484281001,Roche Diagnostics,Penzberg,德国),反应约20分钟。随后通过添加50μl/孔2N HCl终止反应。在2分钟内在450nm 用参比波长650nm读取平板。这种方法的定量下限(LLOQ)是10ng/ml。该测定法的精度(%CV)和准确度(%相对误差)达到验收标准。表9中显示了测试性能,这是通过分析随样品一起分析的QC样品而监测的。表10-13中显示血清浓度。以10μg/kg单次注射同种型IgG kih IFNα在血液中产生明显的暴露量,所述暴露量在约100ng/ml达到峰值持续1周。与之相反,在相同的剂量水平, 51A12 IgG kih IFNα在任何时间点低于定量水平。在1μg/kg剂量水平时血液中检测不到两种分子。PK参数汇总于表14中。
表9.食蟹猴血清中克隆51A12 IgG kih IFNα质量控制样品的分析性能
表10.1μg/kg同种型IgG kih IFNα的血清浓度(ng/ml)
表11:1μg/kg 51A12 IgG kih IFNα的血清浓度(ng/ml)
表12.10μg/kg 51A12 IgG kih IFNα的血清浓度(ng/ml)
表13.10μg/kg同种型IgG kih IFNα时的血清浓度(ng/ml)
表14.10μg/kg同种型-IFNα的食蟹猴血清PK参数
RNA提取
使用Qiagen RNeasy微量试剂盒(P/N 74104),从96份肝脏活组织检查样品 (48只动物x2份活组织检查样品/采样)提取总RNA并在Nanodrop 8000上定量。在Caliper LabChip GX上评估肝脏样品的总RNA质量。来自全部样品的RNA 具有足以进行qPCR和基于微阵列的基因表达测量的数量和质量。
在Expression Analysis(Raleigh,NC)从120份血液样品分离并定量总RNA 分离。在Agilent Bioanalyzer 2100上评估血液样品的总RNA质量。来自全部样品的RNA具有足以进行qPCR和基于微阵列的基因表达测量的数量和质量。
微阵列分析
两个独立方案用来将总RNA转化成cDNA:Affymetrix GeneChip HT 3' IVT Express(P/N 901225)和NuGEN Ovation RNA扩增系统V2(P/N 3100-60)。
血液
根据制造商的操作方案,使用GeneChip HT 3'IVT表达试剂盒,将来自肝脏活组织检查样品的100ng总RNA转化成双链cDNA和扩增的RNA(aRNA)。杂交混合物含有12.5μg aRNA、2x杂交混合物(P/N 900720)、DMSO、20x杂交对照和寡聚B2对照。
肝脏
遵循制造商的操作方案,使用NuGEN Ovation RNA扩增系统V2试剂盒,将来自血液样品的50ng总RNA转化成单链cDNA。杂交混合物含有3μg SPIA 扩增的cDNA、2x杂交混合物(P/N 900720)、DMSO、20x杂交对照和寡聚B2 对照。
将肝脏样品和血液样品的杂交混合物与Affymetrix GeneChip人类基因组 U133 Plus 2.0阵列杂交。染色步骤和洗涤步骤如制造商(Affymetrix)建议那样进行。用GeneChip扫描仪30007G(Agilent/Affymetrix)扫描每个杂交的 Affymetrix GeneChip阵列。用Affymetrix GCOS软件进行图像分析。使用标准化质量控制度量方法评估所得到的.cel文件。将数据归一化并且使用标准数据分析包确定表达值计算/差异性表达。
在图27中,将猴肝脏样品中4个代表性ISG:HRASLS2、ITI44、IFIT1 和IFITM2的表达作图。与施与同种型IgG kih IFNα的猴相比,施与51A12 IgG kih IFNα的猴中存在更稳健的对这4个ISG表达的诱导作用。
IFN基因表达分析(M3.1热图)
为了更广泛地分析IFNα分子引起的IFNα刺激的基因表达,用IFN基因模块分析IFNα反应,所述IFN基因模块从血液转录组学研究确定(Chaussabel等人,(2008),Immunity 29,150-64)。如图28A中所示,使用R统计学软件包 (www.r-project.org),将干扰素模块M3.1的基因距基线的倍数变化表达值以热图形式对血液样品和肝脏样品作图。肝脏干扰素诱导的基因的非监督式层次聚类揭示在10μg/kg剂量的51A12时受高度诱导的子集(划虚线的矩形),但是在第1日和第3日同种型IFNα化合物未揭示所述受高度诱导的子集。非监督式层次聚类这个子集揭示了血液和肝脏之间的差异性表达模式,其中在10μg/kg剂量,一些基因在肝脏中更显著地受51A12诱导,但不受同种型IFNα诱导,并且在高剂量,其他基因在血液中更显著地受同种型IFNα诱导(图28B)。
总之,与同种型IFNα对照相比,靶向ASGPR的IFNα分子51A12 IgG kih IFNα在血液中显示不可检出的暴露量,并且在血液中显示较低的IFNα活性 (ISG表达刺激作用),但是在猴肝脏中显示较高的IFNα活性。
虽然已经出于清晰理解目的,以说明和举例方式某种程度地详细描述了前述发明,但是这些说明和例子不应当解释为限制本发明的范围。本文中援引的全部专利和科学文献的公开内容通过引用方式明确地完整并入本文作为参考。
- 还没有人留言评论。精彩留言会获得点赞!