琼胶寡糖水解酶及通过使用该琼胶寡糖水解酶从琼脂糖中生成3,6-脱水-L-半乳糖和半乳糖的方法与流程
本发明涉及一种对琼胶寡糖具有水解活性的新型β-琼胶寡糖水解酶,且还涉及一种通过使用β-琼胶寡糖水解酶从琼脂糖中生成3,6-脱水-L-半乳糖和半乳糖的方法。
背景技术:
相比于最近在诸多领域中使用的植物生物量,藻类具有含量较低的难以利用的成分,如所使用的木质素。因此,藻类的优点在于,它们可以更为容易地转化成作为用来生成生物能源和生化物的基底的单糖。此外,通过不去使用食物资源,藻类则不存在使用食物资源来生成能源的问题。基于这些原因,在生成包括有可替代能源的生化物质上,藻类作为重要生物量而备受关注。
在藻类中,尤其,红藻(如,石花菜(Gelidium amansii))不仅是生成这种生物能源和生化物质的原材料,据报道,它还含有琼胶寡糖(agarooligosaccharides),而被用作成分的琼胶寡糖显示出优异的生理活性,如抗氧化、抗炎、抗癌、抗过敏、美白和保湿性,从而在制药和化妆品领域中红藻被有效使用(U.S. Patent No. 76622291 by Tomono et al. (2009); U.S. Patent No. 691143282 by Enoki et al. (2005))。
红藻包含作为主要组成的琼脂糖,琼脂糖为以新琼脂二糖(neoagarobiose)(即,通过α-1,3-键相结合的3,6-脱水-L-半乳糖和D-半乳糖)作为基本单元的聚合物,其中作为基本单元的新琼脂二糖与其他单元通过β-1,4-键相连。本发明的发明人以实验为依据证明了3,6-脱水-L-半乳糖的生理功能起源于包含有新琼脂二糖的琼胶寡糖(Yun et al (2013) Appl Microbiol Biotechnol. 97(7):2961-70)的这一事实。此外,据报道,关于3,6-脱水-L-半乳糖的生成,有一种通过温和的化学预处理和酶糖化制备3,6-脱水-L-半乳糖和D-半乳糖的过程,来替代产率极低且具有水解过度的可能性高的化学处理方法(Jol et al (1999) Anal Biochem. 268, 213-222; Kim et al (2010) Bull Korean Soc. 31(2) 511-514)。
待经过化学预处理后,琼脂糖被外切型Aga50D酶解聚成作为主要反应产物的新琼脂二糖和琼脂三糖(agarotriose)(D-半乳糖-β-1,4键-3,6-脱水-L-半乳糖-α-1,3键-D-半乳糖)。然后,新琼脂二糖被作为α-琼脂二糖水解酶的SdNABH最终水解成3,6-脱水-L-半乳糖和D-半乳糖(韩国专利号10-1293668)。期间,在温和条件下的化学预处理对提高所述Aga50D酶的反应性来说是不可或缺的。然而,通过使用经化学预处理的基底,所生成的琼脂三糖最终无法被分解成3,6-脱水-L-半乳糖和D-半乳糖,反而作为反应剩余物被残留下来。
如果所残留的琼脂三糖最终可以被分解成3,6-脱水-L-半乳糖和D-半乳糖时,能够预期的是,3,6-脱水-L-半乳糖和D-半乳糖的产量将得到更大的提高。由于内切型和外切型β-琼胶酶无法水解如琼脂三糖的基底,也尝试过另一种通过利用β-半乳糖苷酶将琼脂三糖分解成D-半乳糖和新琼脂二糖的方法,然而可商购的β-半乳糖苷酶并没有展示出对琼脂寡糖的水解活性。
技术实现要素:
技术问题
本发明在于,提供一种通过使用新型酶提高琼脂糖糖化的效率的方法,且所述新型酶对琼脂寡糖具有水解活性。
本发明还在于,提供一种通过使用新型酶生成半乳糖的方法,且所述新型酶对琼脂寡糖具有水解活性。
技术方案
为了实现上述目的,本发明提供一种用于琼脂糖糖化的组合物,该组合物包含:琼胶酶;对琼脂三糖具有水解活性且以氨基酸序列SEQ ID NO:1表示的β-琼胶寡糖水解酶;和α-琼脂二糖水解酶。
本发明还提供一种通过使基底与本发明的用于琼脂糖糖化的组合物进行反应来糖化琼脂糖的方法,其中所述基底选自琼脂糖、琼脂三糖和新琼脂二糖。
本发明还提供一种用于生成半乳糖的组合物,该组合物包含β-琼胶寡糖水解酶,且所述β-琼胶寡糖水解酶对琼脂三糖、琼脂戊糖(agaropentaose)或琼脂庚糖(agaroheptaose)具有水解活性并被表示为氨基酸序列SEQ ID NO:1。
此外,本发明提供一种通过使基底与本发明的β-琼胶寡糖水解酶反应来生成半乳糖的方法,其中所述基底选自琼脂三糖、琼脂戊糖和琼脂庚糖。
有益效果
通过利用能将琼脂三糖水解成半乳糖和新琼脂二糖上表现出活性的β-琼胶寡糖水解酶,本发明有效地提高了来自琼脂糖的3,6-脱水-L-半乳糖和D-半乳糖的产量,也就是说,有效地改善了糖化产量。
附图说明
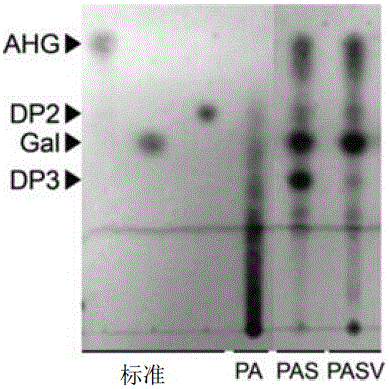
图1为用于各种酶(PA:经预处理的琼脂糖;PAS:相对于所述经预处理的琼脂糖的Aga50D和SdNABH的反应产物;PASV:相对于所述经预处理的琼脂糖的Aga50D、SdNABH与附加弧菌EJY3初始提取物时的反应产物)的反应产物的TLC照片。
图2以柱形图总结并展示了通过DNS试验对图1的PAS和PASV的还原当量。
图3为本发明的经提纯的β-琼胶寡糖水解酶的SDS-PAGE照片。
图4展示了本发明的β-琼胶寡糖水解酶的最佳温度的pH结果。图4A展示了所述β-琼胶寡糖水解酶相对于琼脂三糖基底的最佳pH,而图4B展示了所述β-琼胶寡糖水解酶相对于琼脂三糖基底的最佳温度(M:蛋白标记;第1道:通过HisTrap HP柱经过第一次提纯的β-琼胶寡糖水解酶:第2道:通过HisTrap Q FF柱经过第二次提纯的β-琼胶寡糖水解酶)。
图5证明了本发明的β-琼胶寡糖水解酶对琼脂三糖基底的酶活性。图5A为随着所述β-琼胶寡糖水解酶与琼脂三糖基底之间的各反应时间所显示的所述基底和产物的变化的HPLC结果,而图5B为随着所述β-琼胶寡糖水解酶和α-琼脂二糖水解酶与琼脂三糖基底之间的各反应时间所显示的所述基底和产物的变化的HPLC结果。
图6展示了本发明的β-琼胶寡糖水解酶相对于琼脂三糖、琼脂戊糖和琼脂庚糖基底的酶活性。图6A通过利用TLC展示了所述β-琼胶寡糖水解酶相对于每种基底的反应产物,而图6B通过利用TLC展示了所述β-琼胶寡糖水解酶和α-琼脂二糖水解酶相对于每种基底的反应产物。
图7展示了本发明的β-琼胶寡糖水解酶相对于各种基底(使用葡萄糖和半乳糖作为基底)的酶活性。
图8展示了源自大肠杆菌的β-半乳糖苷酶相对于各种基底(使用葡萄糖和半乳糖作为基底)的酶活性。图8A展示了分别相对于乳糖、乳糖-N-新四糖、乳果糖、4-β-半乳糖和α-1,3-β-1,4-半乳二糖的酶的反应的结果,而图8B展示了分别相对于琼脂三糖、琼脂戊糖和琼脂庚糖的酶的反应的结果。
图9为通过使用本发明的β-琼胶寡糖水解酶(β-AOH)所展示的琼脂糖糖化过程的示意图。
具体实施方式
下面,将具体说明本发明的构成。
本发明涉及一种用于琼脂糖糖化的组合物,该组合物包含:琼胶酶;对琼脂三糖具有水解活性且以氨基酸序列SEQ ID NO:1表示的β-琼胶寡糖水解酶;和α-琼脂二糖水解酶。
本发明的用于琼脂糖糖化的组合物的特征在于,通过在琼脂糖糖化中利用能够水解琼脂三糖的β-琼胶寡糖水解酶来有效地分解那些过去在常规领域中不能水解而残留下来的琼脂三糖,其中β-琼胶寡糖水解酶能使作为琼脂寡糖的产物的琼脂三糖水解成新琼脂二糖和D-半乳糖,从而显著地改善来自琼脂糖的3,6-脱水-L-半乳糖和D-半乳糖的产率(即,琼脂糖糖化的效率)。
根据本发明的一个实施例,通过DNS方法所确认的还原当量的结果表明,当仅预处理琼脂糖时糖化率为约20%,而当采用常规酶处理(即,用琼胶酶与新琼脂二糖水解酶进行的处理)时所述比率会增加到50%。反之,在所述酶处理期间,当另外再处理β-琼胶寡糖水解酶来水解琼脂三糖时,所述糖化率为70%。
所述β-琼胶寡糖水解酶并未展示由已报道的β-半乳糖苷酶所显示的活性。反之,通过作用于琼脂三糖及各种如琼脂戊糖和琼脂庚糖的琼脂寡糖(n)的未还原端,所述β-琼胶寡糖水解酶可将琼脂寡糖水解成D-半乳糖和新琼脂二糖(n-1)。
所述β-琼胶寡糖水解酶可以源自弧菌EJY3(Vibrio sp. EJY3),但不限于此。
所述β-琼胶寡糖水解酶不仅包括以SEQ ID NO: 1表示的氨基酸序列,且还包括蛋白质,该蛋白质作为所述酶经过取代、缺失、转位、添加等中的一种或多种的变异蛋白并在本发明的酶的范围内对琼脂三糖具有水解活性,而且,所述β-琼胶寡糖水解酶优选地包括与SEQ ID NO: 1所公开的所述氨基酸序列具有80%或以上、85%或以上、90%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上、以及99%或以上的序列相同性的氨基酸序列(也被指为'AOH')。
在本发明中,一种多肽相对于其他序列具有特定百分比(如,80%、90%、95%或99%)的序列相同性,这表示,当比对并比较所述两种序列时,所述两种序列中占上述比例的氨基酸残基彼此相同。所述比对和百分比同源性(或相同性)可通过使用本领域熟知的软件程序,如在文献(CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F. M. Ausubel et al. (eds) 1987 Supplement 30 section 7.7.18))中公开的软件程序来确定。优选程序包括GCG Pileup程序、FASTA(Pearson et al. 1988 Proc. Natl Acad. Sci USA 85:2444-2448)和BLAST(BLAST Manual, Altschul et al., Natl. Cent. Biotechnol. Inf., Natl Lib. Med. (NCIB NLM NIH), Bethesda, MD, and Altschul et al. 1997 NAR25:3389-3402)。其他优选的比对程序为ALIGN Plus (Scientific and Educational Software, PA),此程序使用默认参数。其他可利用的序列软件程序为TFASTA数据检索程序,此程序可在Sequence Software Package Version 6.0(Genetics Computer Group, University of Wisconsin, Madison, WI)中使用。
在本发明中,“蛋白质”与“多肽”在本文中可互换使用。此时,氨基酸残基使用常规的单字母代码或三字母代码。
在本发明中,当涉及到细胞、核酸、蛋白质或载体时,术语“重组”表示,通过引入异源核酸或蛋白质或者通过天然核酸或蛋白质的改变进行的修饰来对所述细胞、核酸、蛋白质或载体进行修饰,又或者,所述术语可以指源自所修饰细胞的细胞。换言之,例如,重组细胞会表达该细胞的固有形式中未被发现的基因,又或者,它会表达经过异常表达或根本未被表达的原始基因。
在本发明中,“核酸”包括单链或双链DNA、RNA及它们的变形体。“核酸”和“多核苷酸”可以在本文中互换使用。由于遗传密码被兼并(degeneracy),一种或多种遗传密码子可被用来编码特定的氨基酸,且本发明包括能编码特定氨基酸序列的多核苷酸。
用于将核酸序列插入于细胞的术语,“导入”,是指“转染”、“转化”或“转导”,还包括一种将所述核酸序列融进真核或原核细胞内的说法。此时,所述核酸序列被融进所述细胞的基因组(如,染色体、质粒、质体和线粒体DNA)内,而被转化成自主复制子或者被瞬时表达。
所述β-琼胶寡糖水解酶不仅在酶的编码区中上游或下游段内进行转录或翻译,且所述β-琼胶寡糖水解酶还通过与单个编码片段之间包含有间插序列的多肽的形成有关的DNA片段,即编码基因,进行转录或翻译。例如,所述转录或翻译可以通过序列SEQ ID NO: 2来实现,但并不限于此。
所述β-琼胶寡糖水解酶可从弧菌EJY3培养基的上清液中分离并提纯,且通过利用重组基因工程技术,可利用弧菌EJY3以外的菌株、人工化学合成方法等来生成并分离所述β-琼胶寡糖水解酶。
当利用重组技术时,为了使通常的重组蛋白易于表达,会使用一些因子,如抗生素对抗性基因及可用于亲和柱层析的报告蛋白或多肽等,且这种技术在本发明所属技术领域的技术人员可容易实施的范畴内。此外,例如,经转化的大肠杆菌(E. coli)的培养基上清液可代替本发明的β-琼胶寡糖水解酶而被使用。
通过使用HisTrap HP柱和HisTrap FF柱,可提纯所述β-琼胶寡糖水解酶。根据一个实施例,SDS-PAGE分析结果表明,所提纯的β-琼胶寡糖水解酶的分子量可以为约90 kDa。
所述β-琼胶寡糖水解酶为一种属于GH家族2的酶,当与GH家族2内的其他β半乳糖苷酶做活性比较时,已被报道的常用的β-半乳糖苷酶没有显示出能使琼胶三糖水解成D -半乳糖和新琼脂二糖的酶活性。然而,只有本发明的源自弧菌EJY3的β-琼胶寡糖水解酶才显示出琼胶三糖水解活性。
所述β-琼胶寡糖水解酶可以在约30-40℃的温度范围和约5-9.6的pH范围内对琼胶三糖显示最佳水解活性。
此外,用于本发明的琼脂糖糖化的组合物包含琼胶酶,琼胶酶能将琼脂寡糖水解成琼胶三糖和作为二塘的新琼脂二糖。
作为所述琼胶酶,可以使用一种能使琼脂糖中的D-半乳糖与3,6-脱水-L-半乳糖之间的β-1,4-糖苷键断裂的酶(被指作“ga50D”)。
所述琼胶酶不仅包括以SEQ ID NO: 3表示的氨基酸序列,还包括蛋白质,该蛋白质作为所述酶经过取代、缺失、转位、添加等中的一种或多种的变异蛋白并在本发明的酶的范围内具有琼胶寡糖水解活性,而且,所述琼胶酶优选地包括与SEQ ID NO:3所表示的所述氨基酸序列具有80%或以上、85%或以上、90%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上、以及99%或以上的序列相同性的氨基酸序列。
所述酶可源自Saccharophagus degradans 2-40T,但不限于此。
所述琼胶酶可以从Saccharophagus degradans 2-40T的培养基上清液中分离并提纯,且通过利用重组基因工程技术,可利用Saccharophagus degradans 2-40T以外的菌株、人工化学合成方法等来生成并分离所述琼胶酶。
当利用重组技术时,可以使用食用菌株如经转发的酵母的培养基上清液,来代替所述琼胶酶。
此外,本发明的用于琼脂糖糖化的组合物包含α-琼脂二糖水解酶(被指为“sdNABH”),α-琼脂二糖水解酶可以将新琼脂二糖水解成3,6-脱水-L-半乳糖和D-半乳糖。
所述α-琼脂二糖水解酶不仅包括以SEQ ID NO: 4表示的氨基酸序列,还包括蛋白质,该蛋白质作为所述酶经过取代、缺失、转位、添加等中的一种或多种的变异蛋白并在本发明的酶的范围内具有新琼脂二糖水解活性,而且,所述α-琼脂二糖水解酶优选地包括与SEQ ID NO:4所表示的所述氨基酸序列具有80%或以上、85%或以上、90%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上、以及99%或以上的序列相同性的氨基酸序列。
所述酶可源自Saccharophagus degradans 2-40T,但不限于此。
所述α-琼脂二糖水解酶可以从Saccharophagus degradans 2-40T的培养基上清液中分离并提纯,且通过利用重组基因工程技术,可利用Saccharophagus degradans 2-40T以外的菌株、人工化学合成方法等来生成并分离所述α-琼脂二糖水解酶。
当利用重组技术时,可代替使用食用菌株如经转化的酵母的培养基上清液。
本发明的用于琼脂糖糖化的组合物,可通过使经预处理的琼脂糖与所述琼胶酶、所述β-琼胶寡糖水解酶和α-琼脂二糖水解酶的酶混合物反应,或者通过使所述琼胶酶、所述β-琼胶寡糖水解酶和α-琼脂二糖水解酶相继与所述经预处理的琼脂糖反应,而从琼脂糖中生成3,6-脱水-L-半乳糖和D-半乳糖。
本发明还涉及一种通过使基底与本发明的用于琼脂糖糖化的组合物来糖化琼脂糖的方法,其中所述基底选自琼脂糖、琼脂三糖和新琼脂二糖。
本发明的用于糖化琼脂糖的方法的特征在于,使琼胶酶(即,外切型β-琼脂糖酶)、β-琼胶寡糖水解酶和α-琼脂二糖水解酶与经预处理的琼脂糖反应而生成3,6-脱水-L-半乳糖和D-半乳糖。
所述经处理的琼脂糖是指一种经弱酸处理时会生成琼脂寡糖的琼脂糖。
所述弱酸可以为乙酸、甲酸、琥珀酸、柠檬酸、苹果酸、马来酸、草酸等中的一种或多种。
考虑到生产成本及经所述弱酸进行中和后的盐分离,所述弱酸优选使用0.5-60 % (w/v)的浓度范围。更具体地,所述弱酸可使用20-40 % (w/v)法人浓度范围。
所述琼脂糖与所述弱酸的反应可在40-150℃的温度范围和100 -200 rpm的条件下持续进行30分钟至6小时。当满足所述范围时,可以最大程度减少当利用所述弱酸时琼脂糖的过量水解产物。
所得反应产物为琼脂寡糖,是通过清洗和干燥去处所残留的弱酸和过量水解产物来获得的。
所述清洗溶剂可以为具有1-6个碳原子的低级醇,但不限于此。
为了对所得琼脂寡糖进行酶水解,会使用外切型琼胶酶、β-琼胶寡糖水解酶和α-琼脂二糖水解酶。
所述琼胶酶能将琼脂寡糖水解成琼脂三糖和新琼脂二糖,所述β-琼胶寡糖水解酶能将琼脂三糖水解成D-半乳糖和新琼脂二糖,且所述α-琼脂二糖水解酶能将新琼脂二糖水解成D-半乳糖和3,6-脱水-L-半乳糖。
因此,过去在琼脂寡糖的常规酶水解中残留下来所述琼脂三糖会被所述β-琼胶寡糖水解酶水解,从而提高了D-半乳糖和3,6-脱水-L-半乳糖的产率。
通过使所述经预处理的琼脂糖与所述琼胶酶、所述β-琼胶寡糖水解酶和α-琼脂二糖水解酶的酶混合物反应,或者通过使所述琼胶酶、所述β-琼胶寡糖水解酶和α-琼脂二糖水解酶相继与所述经预处理的琼脂糖反应,可以生成3,6-脱水-L-半乳糖和D-半乳糖。
琼脂寡糖与所述酶混合物之间的反应、或琼脂寡糖与所述酶之间的连续反应可在20-40℃的温度范围和0-200 rpm的条件下连续进行30分钟至7天。更具体地,这些反应可在25-35℃的温度范围和100-150 rpm的条件下连续进行1-4天。
当所述琼脂寡糖为粉状时,可将它溶解于通常的缓冲液中而进行使用,但不限于此。
本发明还涉及一种用于生成半乳糖的组合物,该组合物包含对琼脂三糖、琼脂戊糖或琼脂庚糖具有水解活性且以氨基酸序列SEQ ID NO:1表示的β-琼胶寡糖水解酶。
此外,本发明提供一种通过使基底与本发明的β-琼胶寡糖水解酶进行反应而生成半乳糖的方法,其中所述基底选自琼脂三糖、琼脂戊糖和琼脂庚糖。
所述β-琼胶寡糖水解酶可以源自弧菌EJY3,但不限于此。
由于所述β-琼胶寡糖水解酶能从琼脂三糖、琼脂戊糖或琼脂庚糖中生成D-半乳糖和新琼脂二糖,所述β-琼胶寡糖水解酶可以用来生成D-半乳糖。
所述酶反应可在约20-40℃的温度范围和约5-9.6的pH范围内进行。
下面,通过参考示例性实施例,将具体描述本发明。然而,以下示例性实施例只意在举例说明本发明,并不会限制本发明的范围。
实施例
<实施例1> 从弧菌EJY3的初始酶提取物中β-琼胶寡糖水解酶的酶活性的确定
为了确认弧菌EJY3对所述琼脂三糖的水解具有酶活性,获得初始提取物并对所述活性进行评估。
为了获得所述初始提取物,使弧菌EJY3在含有海盐的培养基内生长到中期指数阶段,然后离心分离40 mL的培养基,通过使用超声器使细胞破裂,从而获得初始提取物。通过使用作为所述基底的琼脂糖,利用TLC来观察(TLC溶剂的组成:容量比为3:1:1的正丁醇:乙醇:水)通过β琼胶酶的分解产物。
基于3,6-脱水-L-半乳糖、半乳糖、新琼脂二糖的标准,在图1中展示了用于各种酶的反应产物的TLC结果。PA表示通过与3%醋酸在130℃下反应30分钟来进行预处理的琼脂糖,PAS为从所述经预处理的琼脂糖与外切型β琼胶酶(Aga50D)及α-琼脂二糖水解酶(SdNABH)进行反应而获得的产物,且PASV为将弧菌EJY3初始提取物(或初始酶)加入到所述PAS中而获得的产物。
如图1中所示,将弧菌EJY3初始酶被附加加入到所述反应中时,观察到琼脂三糖有减少。由此可确定,所述弧菌EJY3初始酶含有能水解琼脂三糖的酶。
此外,使琼脂三糖完全水解,且通过还原糖定量方法(DNS法:50μl DNS试剂与稀释25倍的100μl酶反应产物混合,在95℃下处理5分钟,然后在540 nm测量吸光度),测量还原当量。
如图2中所示,确认了3,6-脱水-L-半乳糖和半乳糖的产率有增加。当只进行预处理时糖化率为约20%,然而当进行酶的预处理时该糖化率增加到50%。对此,通过用弧菌EJY3初始酶进行附加处理,致使糖化率变为70%,认为这是因为琼脂三糖最终被水解而引起的。
<实施例2> 在弧菌EJY3的酶候选物中对β-琼胶寡糖水解酶的研究
在有关弧菌EJY3的报告中所涉及的酶中,克隆那些在报告中对琼胶酶和β-半乳糖苷酶具有活性的8种酶,以生成重组菌株,然后评估每种初始酶对琼脂三糖的活性。其中,发现只有一种酶(VEJY3_09170)对琼脂三糖具有水解活性。通过在UniProt(http://www.uniprot.org)中确认并基于由本发明的发明人第一次揭示的弧菌EJY3全基因组序列数据,鉴定结果表明,VEJY3_09170为一种基于碱基序列被分类为β-半乳糖苷酶的酶,且VEJY3_09170属于具有诸多其他β-半乳糖苷酶的GH家族2。然后,将大肠杆菌Rosetta(DE3)用作所述重组菌株的宿主,且将pET-21a用作载体。将接种于具有50 μg/mL的氨苄西林浓度的固体培养基上并通过转化而获得的菌落再次接种在含有50 μg/mL氨苄西林的LB(卢里亚肉汤)中,然后在37℃和220 rpm下孵化12小时(两个20ml的容量)。然后,分别在两个3 L锥形瓶中进行孵化,这两个3 L锥形瓶各含有1 L的LB肉汤,在相同条件下进行3小时(OD= 0.8)震荡培养,用冰冷却1小时,而后加入0.1 mM IPTG,以在16℃和120rpm的条件下诱导表达12小时。所述培养基通过离心分离(6000 rpm, 4℃, 15分钟)回收细胞,而后所收回的细胞被悬浮在20 mM的Tris缓冲液(Tris-HCl, 1 M NaCl pH 8)中并利用超声器使之破裂,然后所述悬浮液通过离心分离从上清液中分离出β-琼胶寡糖水解酶,再利用HisTrap HP柱和HisTrap Q FF柱(GE Healthcare, Piscataway, NJ, USA)进行提纯,而后通过8 % SDS-PAGE进行观察。
图3为经提纯的β-琼胶寡糖水解酶的SDS-PAGE照片。M表示蛋白标记,第1道表示通过HisTrap HP柱被第一次提纯的β-琼胶寡糖水解酶,且第2道表示HisTrap Q FF柱被第二次提纯的β-琼胶寡糖水解酶。
如图3中所示,在相当于约90 kDa相的位置处发现了所述β-琼胶寡糖水解酶。
<实施例3> β-琼胶寡糖水解酶的最佳反应条件的确认
对β-琼胶寡糖水解酶的仅由温度和pH组成的最佳条件进行确认。作为所述基底使用琼脂三糖(Aglyco, 中国北京),且在10、20、30、35、40、45和50℃的温度及pH 4、5、6、7、8、9和10下确定结果。
图4展示了本发明的β-琼胶寡糖水解酶的最佳温度及pH结果。图4A展示了相对于琼脂三糖基底的β-琼胶寡糖水解酶的最佳pH,而图4B展示了相对于琼脂三糖基底的β-琼胶寡糖水解酶的最佳温度。
如图4中所示,琼脂三糖的相对活性达到50%的温度范围为约30-40℃,且所述pH的范围在5-9.6。在35℃和pH7上达到最佳酶活性。
<实施例4> 所述最佳条件下的β-琼胶寡糖水解酶的生化活性的确定
在所述实施例3中被确认为最佳条件的35℃和pH7的条件下,对相对于琼脂三糖、琼脂戊糖和琼脂庚糖的β-琼胶寡糖水解酶活性进行测试。
通过HPLC (KS-802柱)和TLC(TLC溶剂条件:正丁醇:乙醇:水=3:1:1)分析,当观察随着所述β-琼胶寡糖水解酶与所述琼脂三糖基底之间的反应时间发生在所述基底和产物中的变化时,可见所述β-琼胶寡糖水解酶通过水解能使一个分子的琼脂寡糖分解成一个分子的新琼脂寡糖和一个分子的D-半乳糖(图5 A)。
此外,通过HPLC,当分析随着所述β-琼胶寡糖水解酶与所述琼脂三糖基底之间的反应时间发生在所述基底和产物中的变化时,可见通过组合使用β-琼胶寡糖水解酶和α-琼脂二糖水解酶,最终会从琼脂寡糖中生成3,6-脱水-L-半乳糖和D-半乳糖(图5B)。
图6展示了本发明的β-琼胶寡糖水解酶相对于琼脂三糖、琼脂戊糖和琼脂庚糖基底的活性的TLC结果。如图6A中所示,β-琼胶寡糖通过水解酶水解琼脂三糖、琼脂戊糖和琼脂庚糖而生成D-半乳糖,然而,当组合使用β-琼胶寡糖水解酶和α-琼脂二糖水解酶时,所观察到的最终产物为3,6-脱水-L-半乳糖和D-半乳糖(图6B)。
<实施例5> β-琼胶寡糖水解酶和源自大肠杆菌的β-半乳糖苷酶的活性对比
当与其他属于GH家族2中的β-半乳糖苷酶作活性比较时,发现源自弧菌EJY3的所述β-琼胶寡糖水解酶为一种属于GH家族2的酶,但显示出有别于先前有被报道的β-半乳糖苷酶的新活性。测试源自大肠杆菌的β-半乳糖苷酶的活性(Sigma-Aldrich, 3050 spruce street, USA)相对于每个基底的活性,然后测试β-琼胶寡糖水解酶相对于上述相同的基底的活性。
图7展示了β-琼胶寡糖水解酶相对于各种基底的活性的结果。针对乳糖、乳糖-N-新四糖、乳果糖、4-β-半乳糖和α-1,3-β-1,4-半乳二糖分别进行酶反应性测试,结果表明,相对于任何的所述基底均没有反应性。
图8展示了源自大肠杆菌的β半乳糖苷酶水解酶相对于各种基底的活性的结果。针对于乳糖、乳糖-N-新四糖、乳果糖、4-β-半乳糖和α-1,3-β-1,4-半乳二糖分别进行酶反应性的测试,从而确认β-半乳糖苷酶的已知活性(图8A)。此外,分别测试相对于琼脂三糖、琼脂戊糖和琼脂庚糖的酶反应性,且其结果确认了所述源自大肠杆菌的β-半乳糖苷酶无法水解琼脂寡糖(图8B)。
上述结果能够证明,通过使用β半乳糖苷酶水解酶,本发明可以提高琼脂糖糖化的产率和效率,且图9展示了所述糖化过程的示意图。
工业应用性
本发明的3,6-脱水-L-半乳糖和D-半乳糖可用作食品、化妆品和药物领域中的有益材料。
- 还没有人留言评论。精彩留言会获得点赞!