通过基于链侵入的扩增的核酸检测的制作方法
本发明涉及在至少一种能够与单链DNA结合的蛋白的存在下,检测样品中靶核酸序列的方法,其中使用包含荧光团、猝灭剂和与所述靶核酸序列互补的区域的寡核苷酸探针用于检测。所述寡核苷酸探针的序列包含至少20%的RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸。本发明还涉及适用于该方法的寡核苷酸探针、组合物和试剂盒,及其用于诊断病原体感染的用途。
背景技术:
已使用包含荧光团/猝灭剂对的DNA探针来进行靶核酸序列的检测。这类探针在与靶核酸结合时表现出猝灭活性的改变,使得能够定量检测靶标。探针可用于实时监测DNA扩增,并且通过在用于待检测靶标的各探针上使用不同的荧光团/猝灭剂对,可在同一反应中检测不同的靶标,因此允许多重化。之前的用于检测DNA扩增的探针系统的实例包括在结合靶标时表现出构象改变的杂交探针(US7241596)、分子信标(US5925517)、Taqman化学(US6214979)和内切核酸酶可切割的探针(US7435561和US20050214809)。依赖于上游引物、下游引物和链侵入系统的等温DNA扩增方法记载于WO 2009/150467中。
技术实现要素:
本发明在某种程度上基于对在检测试验中与使用DNA探针相关的问题的认识,在所述检测试验中存在能够与单链DNA结合的蛋白。本发明人发现,在能够与单链DNA结合的蛋白的存在下,DNA探针不能提供特异的、依赖模板的信号,并且实际上甚至在不存在模板的情况下产生信号。这一问题引导本发明人去研究在能够与单链DNA结合的蛋白的背景下可提供可靠的依赖模板的DNA扩增检测的解决方案。本发明人出乎意料地发现,与相应的完全DNA探针相比,在标记有荧光团和猝灭剂的寡核苷酸探针的序列中掺入RNA核苷酸、经修饰的RNA核苷酸和/或肽核酸(PNA)核苷酸可抵抗能够与单链DNA结合的蛋白对荧光信号的破坏。
本发明提供了在至少一种能够与单链DNA结合的蛋白的存在下检测样品中靶核酸序列的方法,包括使所述样品与至少一种包含荧光团、猝灭剂和与所述靶核酸序列互补的区域的寡核苷酸探针接触,其中所述寡核苷酸探针的序列包含至少20%的RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸。
本发明还提供了包含荧光团、猝灭剂和与靶核酸序列互补的区域的寡核苷酸探针,其中所述寡核苷酸探针的序列包含至少20%的RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸。本发明还提供了组合物和试剂盒,其均包括本发明的寡核苷酸探针,以及包含与所述靶核酸序列互补的区域的链侵入寡核苷酸和/或至少一种能够与单链DNA结合的蛋白。本发明还提供了在受试者中诊断疾病的方法,包括在来自受试者的样品中实施本发明的检测核酸序列的方法以检测与所述疾病相关的靶核酸序列。
附图说明
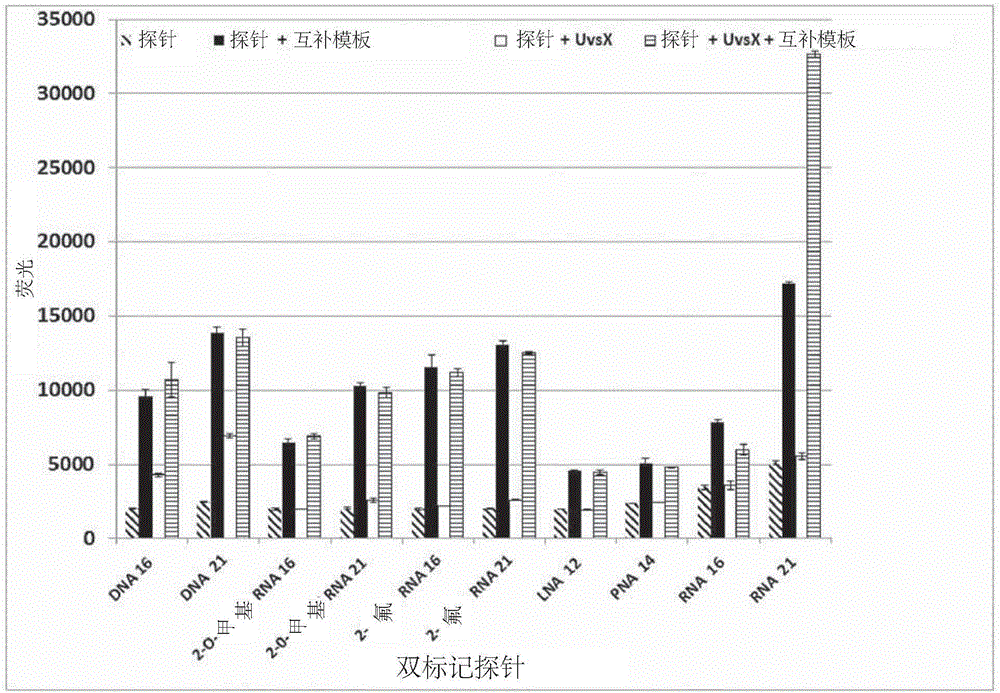
图1示出了(A)重组酶、(B)单链DNA结合蛋白(gp32)、(C)基于链侵入的扩增的试剂混合物、(D)大肠杆菌(E.coli)重组酶RecA和(E)单链DNA结合蛋白ET-SSB对来自包含荧光团和猝灭剂的探针的信号的影响。(A)和(B)的X轴:从左至右——各测试探针的四种条件(仅探针;探针与互补模板;探针与蛋白;探针与蛋白和互补模板)。(C)的X轴:从左至右——各测试探针的两种条件(探针和试剂组合物;探针、试剂组合物和互补模板)。(D)和(E)的X轴:从左至右——各测试探针的两种条件(仅探针;探针与蛋白)。测试探针为DNA 16(SEQ ID NO:1)、DNA 21(SEQ ID NO:2)、2’-O-甲基RNA 16(SEQ ID NO:5)、2’-O-甲基RNA 21(SEQ ID NO:6)、2’-氟RNA 16(SEQ ID NO:7)、2’-氟RNA 21(SEQ ID NO:8)、LNA 12(SEQ ID NO:9)、PNA 14(SEQ ID NO:10)、RNA 16(SEQ ID NO:3)和RNA 21(SEQ ID NO:4)。各图的Y轴:荧光(任意单位)。
图2示出了通过基于链侵入的扩增的靶DNA扩增。A)引物、探针、链侵入/中间体寡核苷酸(IO)和靶DNA的构象。B)通过使用SYBR Green实时监测被检测的扩增。C)使用2’-氟RNA探针SB-2FLUORO(SEQ ID NO:17)实时监测被检测的扩增。D)使用LNA探针(SB-LNA SEQ ID NO:18)实时监测被检测的扩增。E)使用天然DNA探针(SB-DNA SEQ ID NO:16)实时监测被检测的扩增。在B)至E)中,NTC=无模板对照,示出模板的稀释度。反应平行进行两次。X轴:时间(分钟)。各图的Y轴:荧光(任意单位)。
图3示出了使用包含2’-氟RNA碱基的探针实时监测扩增,所述包含2’-氟RNA碱基的探针标记有允许检测多个DNA靶标的不同的荧光团和猝灭剂。(A)通过使用用于艰难梭茵(Clostridium difficile)靶序列的Cy5和Iowa Black标记的探针(SC-2FLURO,SEQ ID NO:25)和用于人工靶序列的ROX和BHQ2标记的探针(SB2-FLURO,SEQ ID NO:17)扩增和检测两种DNA靶标。X轴:时间(分钟)。各图的Y轴:荧光(任意单位)。(B)使用Sybr Green I扩增后对靶标的熔解分析。X轴:温度(摄氏度)。Y轴:-(d(荧光)/d(温度),任意单位)。(C)使用2’-氟RNA探针扩增后对靶标的熔解分析。X轴和Y轴如图3(B)。
图4示出了通过添加切割探针的RNase H2引起的2’-氟RNA探针的信号增强。(A)在存在或不存在RNase H2试剂混合物的情况下,用互补DNA孵育双标记探针。X轴:从左至右——各测试探针的四种条件(探针与试剂混合物;探针与互补模板和试剂混合物;探针与试剂混合物和RNase H2;探针与互补模板、试剂混合物和RNase H2)。测试探针为LNA 12(SEQ ID NO:9)、PNA 14(SEQ ID NO:10)、SB-2’-O-甲基RNA 16(SEQ ID NO:32)、SB-DNA 16(SEQ ID NO:1)和SB-2’-氟RNA 16(SEQ ID NO:17)。各图的Y轴:荧光(任意单位)。(B)使用2’-氟RNA探针SC-2FLURO(SEQ ID NO:24)在存在或不存在RNase H2的情况下艰难梭茵靶序列扩增的实时监测。X轴:时间(分钟)。Y轴:荧光(任意单位)。
图5示出了用于使用系列稀释的105至10个拷贝的鼠伤寒沙门氏茵(Salmonella typhimurium)基因组DNA检测鼠伤寒沙门氏茵的基于链侵入的扩增试验的灵敏度。使用2’-氟RNA探针实时监测扩增。使用的探针为SM-2FLURO(SEQ ID NO:30)。X轴:时间(分钟)。Y轴:荧光(任意单位)。NTC=无模板对照,示出了模板的稀释度。
图6示出了(A)在不存在RNase H2的情况下和(B)在存在RNase H2的情况下2’-氟RNA探针既未扩增也未检测到不依赖于引物的靶标。示出了各迹线的反应条件。在存在或不存在同源反向引物(SEQ ID NO:12)或假引物SPU(SEQ ID NO:33)的情况下进行反应。通过检测来自探针SB-2FLURO(SEQ ID NO:17)或SYBR Green的ROX荧光团实时监测扩增。X轴:时间(分钟)。Y轴:荧光(任意单位)。
图7示出了使用双功能2’-氟RNA引物/探针和天然DNA引物,通过基于链侵入的扩增的靶DNA扩增。(A)正向引物、反向探针引物、链侵入/中间体寡核苷酸(IO)和靶DNA的构象。B)使用SYBR Green实时监测被检测的人工模板的扩增。所使用的引物为DNA引物SB-R20(SEQ ID NO:12)、2’-氟RNA引物SBFLURO1-RNA(SEQID NO:13)和2’-氟RNA/DNA引物SBFLURO2-RNA(SEQ IDNO:14)。C)使用标记有内部荧光团(FAM)和5’猝灭剂的SB-R20(SEQ ID NO:12)或2’-氟RNA探针-引物(SB-2FLURO 2,SEQ ID NO:19)实时监测被检测的人工模板的扩增。使用SYBR Green检测使用DNA引物(SEQ ID NO:12)的扩增;经由FAM通道(未添加SYBR Green)检测使用2’-氟RNA探针引物(SEQ ID NO:19)的扩增。NTC=无模板对照,示出了模板的稀释度。X轴:时间(分钟)。各图的Y轴:荧光(任意单位)。
图8示出了在不存在互补模板的情况下,重组酶UvsX和单链结合蛋白T4-gp32对具有DNA和RNA碱基(DNA/RNA或DNA/2’-氟RNA或DNA/2’-O-甲基RNA)的双标记嵌合探针的信号的影响。A)UvsX的影响。B)T4-gp32的影响。C)使用其他系列探针的额外的UvsX测定。D)使用其他系列探针的额外的T4gp32测定。所测试的探针为DNA 21(SEQ ID NO:2)、DNA 16+RNA5(SEQ ID NO:35)、DNA 10+RNA 11(SEQ ID NO:36)、DNA5+RNA16(SEQ ID NO:37)、RNA21(SEQ ID NO:4)、DNA16+2-氟RNA5(SEQ ID NO:38)、DNA10+2-氟RNA11(SEQ ID NO:39)、DNA 5+2-氟RNA 16(SEQ ID NO:40)、2-氟RNA21(SEQ ID NO:8)、DNA16+2-O-甲基RNA5(SEQ ID NO:41)、DNA10+2-O-甲基RNA11(SEQ ID NO:42)、DNA5+2-O-甲基RNA16(SEQ ID NO:43)、2-O-甲基RNA21(SEQ ID NO:6)、DNA20+RNA1(SEQ ID NO:45)、DNA19+RNA2(SEQ ID NO:46)、DNA18+RNA3(SEQ ID NO:47)、DNA17+RNA4(SEQ ID NO:48)。Y轴:荧光增加的倍数(存在UvsX或T4-gp32的情况下的荧光除以不存在UvsX或T4-gp32的情况下的荧光),任意单位。
序列描述
SEQ ID NO:1是DNA探针的核苷酸序列。
SEQ ID NO:2是DNA探针的核苷酸序列。
SEQ ID NO:3是RNA探针的核苷酸序列。
SEQ ID NO:4是RNA探针的核苷酸序列。
SEQ ID NO:5是2’-O-甲基RNA探针的核苷酸序列。
SEQ ID NO:6是2’-O-甲基RNA探针的核苷酸序列。
SEQ ID NO:7是2’-氟RNA探针的核苷酸序列。
SEQ ID NO:8是2’-氟RNA探针的核苷酸序列。
SEQ ID NO:9是LNA探针的核苷酸序列。
SEQ ID NO:10是PNA探针的序列。
SEQ ID NO:11是DNA引物的核苷酸序列。
SEQ ID NO:12是DNA引物的核苷酸序列。
SEQ ID NO:13是2’-氟RNA引物的核苷酸序列。
SEQ ID NO:14是混合的DNA/2’-氟RNA引物的核苷酸序列。
SEQ ID NO:15是DNA链侵入寡核苷酸的核苷酸序列。
SEQ ID NO:16是DNA探针的核苷酸序列。
SEQ ID NO:17是2’-氟RNA探针的核苷酸序列。
SEQ ID NO:18是LNA探针的核苷酸序列。
SEQ ID NO:19是混合的DNA/2’-氟RNA探针/引物的序列。
SEQ ID NO:20人工DNA靶核酸序列的核苷酸序列。
SEQ ID NO:21是DNA引物的核苷酸序列。
SEQ ID NO:22是DNA引物的核苷酸序列。
SEQ ID NO:23是DNA链侵入寡核苷酸的核苷酸序列。
SEQ ID NO:24是2’-氟RNA探针的核苷酸序列。
SEQ ID NO:25是2’-氟RNA探针的核苷酸序列。
SEQ ID NO:26来自艰难梭菌(C.difficile)ATCC BAA 1382的靶DNA核苷酸序列。
SEQ ID NO:27是DNA引物的核苷酸序列。
SEQ ID NO:28是DNA引物的核苷酸序列。
SEQ ID NO:29是DNA链侵入寡核苷酸的核苷酸序列。
SEQ ID NO:30是2’-氟RNA探针的核苷酸序列。
SEQ ID NO:31是来自鼠伤寒沙门氏茵(S.typhimurium)ATCC 14028的靶DNA核苷酸序列。
SEQ ID NO:32是2’-O-甲基RNA探针的核苷酸序列。
SEQ ID NO:33是DNA引物的核苷酸序列。
SEQ ID NO:34是SEQ ID NO 1至8的探针的互补靶DNA核苷酸序列。
SEQ ID NO:35至43表示嵌合的DNA/RNA、DNA/2’-氟RNA和DNA/2’-O-甲基RNA探针的寡核苷酸序列。
SEQ ID NO:44是SEQ ID NO 9和10的探针的互补靶DNA核苷酸序列。
SEQ ID NO:45至48表示嵌合的DNA/RNA探针的核苷酸序列。
具体实施方式
应理解,所公开的方法的不同应用可根据本领域中的特定需要进行调整。还应理解,本文所使用的术语仅用于描述本发明的具体实施方案的目的,并且不意欲进行限制。此外,除非上下文中另有明确说明,本说明书和所附权利要求书中所使用的单数形式“一”、“一个”和“所述”包括复数指代对象。因此,例如,提及“一个寡核苷酸”包括两个或更多个这样的寡核苷酸,等等。本文所引用的所有出版物、专利和专利申请,无论在上文或在下文,都以引用的形式全文纳入本文。
靶核酸序列的检测方法
样品
可使用任何样品来检测靶核酸序列,只要可从所述样品获得或衍生出核酸。所述样品可以是例如环境样品、参照样品或临床样品。当本发明的方法用于通过检测靶核酸序列诊断疾病时,所述样品通常为临床样品,例如从疑似患有或患有所述疾病的患者中获得的样品。临床样品的适合类型随着存在于或疑似存在于受试者中的疾病或感染的特定类型而变化。所述样品可以是唾液、痰、血液、血浆、血清、尿或粪便样品。所述样品可以是细胞或组织样品。在优选的实施方案中,所述样品取自动物受试者,例如哺乳动物受试者。所述样品通常取自人类受试者,但是本发明通常也适用于家养动物、牲畜、鸟类和鱼。例如,本发明可应用于兽医或农业环境。在本发明检测艰难梭茵和鼠伤寒沙门氏茵感染的实施方案中,所述样品优选为粪便样品。所述粪便样品可取自患有胃肠道感染的受试者。所述感染可存在于患有腹泻的患者中。
所述样品包含核酸,其可以是DNA或RNA。如果核酸以允许进行本发明的检测的适合形式存在于样品中,则可直接使用所述样品。但是,通常,核酸衍生自、获自或提取自所述样品。处理含核酸的样品、提取核酸和/或纯化核酸以用于检测方法的方法是本领域中公知的。可分离总核酸,或单独地分离DNA或RNA。
通常,以适当的方式处理样品,以使得以便于与寡核苷酸探针和单链DNA结合蛋白和任选的其他核酸组分接触的形式提供核酸。如果所述核酸是DNA,则所述DNA通常以双链形式提供。如果所述核酸是RNA,则通常使用逆转录酶或具有逆转录酶活性的聚合酶将其转换为cDNA。RNA可用于细菌检测,因为细菌细胞中存在着非常大量的核糖体,其有效地增加了靶序列的浓度。除了核糖体RNA(rRNA)外,其他形式的RNA,例如转移RNA(tRNA)、信使RNA(mRNA)、小干扰RNA(siRNA)、小核核糖核酸(snRNA)、microRNAs(miRNA)也可用于原核生物和真核生物检测。
靶核酸序列
可检测任何来源的任何靶核酸序列。所述靶核酸序列可以是人、哺乳动物、细菌或病毒的靶核酸序列。所述靶核酸序列可以是基因的区域或染色体的区域。优选地,所述靶核酸序列对待检测的基因型或生物体(例如病原体)是特异性的。所述靶核酸序列可以是特定物种的基因组所特有的。因此,用于检测特定物种的靶核酸序列通常区别于相关物种中的任何同源核酸序列。通常,所述靶核酸序列包含与相关物种中的同源核酸序列的若干错配。所述靶核酸序列可以是细菌的特定菌株或病毒的特定血清型、分离株或进化枝(clade)所特有的序列。所述靶核酸序列对艰难梭茵的产毒菌株或鼠伤寒沙门氏茵的菌株是特异性的。
待检测的靶核酸序列可以是任何大小并具有任何序列。所述靶核酸序列包含与寡核苷酸探针互补的区域。通常,所述靶核酸序列在扩增的同时被探针检测,因此其还包含与引物互补的区域。在等温条件下通过基于链侵入的扩增来扩增靶核酸序列(或扩增子)时,该靶核酸序列通常具有足够的长度以提供对靶基因型或生物体的特异检测,并且使上游和下游引物与链侵入寡核苷酸以适合的方式杂交。优选地,如从所述上游引物的5’结合位点到所述下游引物的5’结合位点所测量的,在等温条件下用于基于链侵入的DNA扩增的扩增子的长度为至少45个核苷酸,更优选长度为至少50、至少55或至少60个核苷酸。
用于检测产毒艰难梭茵的适合的靶核酸序列的实例为SEQ ID NO 26。用于检测鼠伤寒沙门氏茵的适合的靶序列的实例为SEQ ID NO 31。
通过提供两种或更多种各自对不同的靶核酸序列具有特异性的寡核苷酸探针,可在本发明的方法中检测多于一种靶核酸序列。通常,用不同的荧光团/猝灭剂对标记与不同靶核酸序列结合的寡核苷酸探针,因此允许多重化。可检测至少2、3、4、5、10或更多种不同的靶序列。可检测来自同一生物体的多于一种靶核酸序列。或者,可检测对至少2、3、4、5、10或更多种不同的基因型、生物体或病原体具有特异性的靶核酸序列。
寡核苷酸探针
所述寡核苷酸探针包含与靶核酸序列互补的区域、荧光团和猝灭剂。所述寡核苷酸探针的序列包含至少20%的RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸。换言之,存在于所述寡核苷酸探针中的至少20%的核苷酸是RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸。所述寡核苷酸可包括RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸的混合物,例如RNA核苷酸和经修饰的RNA核苷酸的混合物。或者,所述寡核苷酸探针的序列可包含DNA核苷酸和至少20%的RNA核苷酸,DNA核苷酸和至少20%的经修饰的RNA核苷酸,或DNA核苷酸和至少20%的PNA核苷酸。
更优选地,所述寡核苷酸探针的序列包含至少25%、至少30%、至少35%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸。
当所述寡核苷酸探针的长度为12至25或15至25个核苷酸时,所述寡核苷酸通常包含至少5个RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸,更优选至少6个、至少7个、至少8个、至少9个或至少10个RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸。长度最多达20个核苷酸(例如长度为10至20或12至20个核苷酸)的寡核苷酸探针通常包含至少4个RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸,更优选至少6个、至少7个、至少8个、至少9个或至少10个RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸。长度为20至25个核苷酸的寡核苷酸探针可包含至少12个、至少15个或至少18个RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸。长度为8至12个核苷酸的寡核苷酸探针可包含至少3个、至少4个或至少6个RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸。所述寡核苷酸探针的序列包含足够的RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸以在存在能够与单链DNA结合的蛋白、不存在互补模板序列的情况下阻止来自探针的荧光信号。
在特别优选的实施方案中,所述寡核苷酸探针的核苷酸序列仅由核糖核苷酸(其可以是天然核糖核苷酸或经修饰的核糖核苷酸)组成或仅由PNA核苷酸组成。所述探针的核苷酸序列可仅由天然核糖核苷酸组成、仅由经修饰的核糖核苷酸组成或由天然和经修饰的核糖核苷酸的混合物组成。所述寡核苷酸探针可具有RNA核苷酸和PNA核苷酸的混合主链或经修饰的RNA核苷酸和PNA核苷酸的混合主链。优选的经修饰的核糖核苷酸包括2’-氟核糖核苷酸、2’-O-甲基核糖核苷酸和LNA(锁核酸)核苷酸,及其组合。上述任何百分含量或最小数目的经修饰的RNA核苷酸可尤其适用于探针中的2’-氟核糖核苷酸、2’-O-甲基核糖核苷酸或LNA核苷酸的比例。或者,所述探针可仅由2’-氟核糖核苷酸、2’-O-甲基核糖核苷酸或LNA核苷酸组成。其他适合的经修饰的核糖核苷酸包括2’-O-甲氧基-乙基和其他2’-取代。
在一些实施方案中,如果所述寡核苷酸探针包含至少20%的RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸,它还可包含脱氧核糖核苷酸,其可以是天然脱氧核糖核苷酸或经修饰的脱氧核糖核苷酸。当所述寡核苷酸探针的长度为25个或更少核苷酸时,其通常包含少于20个、更优选少于18个、少于15个、少于12个或少于10个脱氧核糖核苷酸。所述寡核苷酸探针可包含1至5、1至8、1至10或1至15个脱氧核糖核苷酸。当所述寡核苷酸探针包含脱氧核糖核苷酸或经修饰的脱氧核糖核苷酸时,这些脱氧核糖核苷酸可存在于核糖核苷酸或经修饰的核糖核苷酸序列的5’和/或3’端。所述寡核苷酸探针可在其5’和/或3’端例如包含1、2、3、4或5个脱氧核糖核苷酸或经修饰的脱氧核糖核苷酸。或者,所述脱氧核糖核苷酸或经修饰的脱氧核糖核苷酸可散布在核糖核苷酸序列中。
所述寡核苷酸探针的长度通常为约8至约25个核苷酸。所述探针的长度通常为至少8个核苷酸,或长度少于30个核苷酸,更优选长度少于25个核苷酸。所述探针的长度可以为至少10个、至少12个或至少15个核苷酸。所述探针的长度可以为约10至约20、约12至约25、约15至约25、或约12至约22个核苷酸。所述探针的长度根据在所使用的条件下与靶序列的区域特异性或选择性杂交的需求进行选择,并且可根据用于扩增靶序列的引物的长度进行选择,如以下所讨论的。
特异性或选择性杂交是指当特定核苷酸序列存在于样品(例如包括总的细胞和外源DNA或RNA的复合生物混合物)中的核酸中时,在给定条件下寡核苷酸(例如探针或引物)仅与该核苷酸序列结合。适合的杂交条件是本领域中已知的。参见,例如,Sambrook、Fritsche和Maniatis,“Molecular Cloning:A Laboratory Manual”,第二版,Cold Spring Harbor Press(1989),其以引用的方式全文纳入本文。以下实施例中也提供了适合的杂交条件。如技术人员所已知的,适合的杂交条件可随着探针长度及其碱基组成而改变。杂交通常在与扩增温度相同的温度下进行,因此也依赖用于扩增的酶(包括依赖扩增方法而可适用的聚合酶和重组酶)的活性谱。
所述探针的核苷酸序列可部分或完全与靶核酸序列的区域互补。长度少于25个核苷酸的寡核苷酸探针通常包含长度为至少10个、至少15个或至少20个核苷酸的区域,其与所述靶核酸序列的区域互补。所述寡核苷酸探针还可在所述互补区域的5’或3’端包含长度为1、2、3、4、5、8或10个核苷酸的侧翼区,所述侧翼区不与所述靶核酸序列互补。所述寡核苷酸探针可在所述互补序列侧翼的5’和3’端包含共1、2、3、4或5、8或10个核苷酸,这些核苷酸不与所述靶核酸序列互补。所述侧翼区可以是自身互补的,产生发夹结构。
所述寡核苷酸探针和所述靶核酸序列之间可存在错配,然而仍然允许特异性检测所述靶核酸序列,特别是当使用对所述靶序列具有特异性的上游和下游引物扩增所述靶核酸序列时。探针的结合与特异性扩增一起将特异性地检测所述靶序列。在所述寡核苷酸探针的互补区域和所述靶核酸序列的相应区域之间可存在1、2、3、4或5个错配。在所述探针序列中的任何错配优选间隔至少4个、至少5个、至少8个或至少10个核苷酸。
优选地,所述探针与所述靶核酸序列的区域完全互补。
所述寡核苷酸探针可具有二级结构区,该二级结构区的构象在与所述靶核酸序列结合时发生改变。因此,所述寡核苷酸探针可包含通过探针的5’和3’端的自身互补区域形成的发夹茎(stem)和包含靶序列的互补区的环形区域。在这样的实施方案中,荧光团和猝灭剂通常位于探针的5’和3’端,在茎区域彼此紧密邻近,使得在不存在靶核酸序列时荧光被猝灭。所述寡核苷酸探针可以是分子信标探针。在其他实施方案中,所述寡核苷酸探针不具有任何二级结构区或不是分子信标探针。
所述寡核苷酸探针可同时具有探针和引物功能。因此,所述寡核苷酸探针可以能够引发其靶核酸序列的扩增。作为引物的寡核苷酸探针可仅由RNA、经修饰的RNA或PNA组成。或者,作为引物的寡核苷酸探针可包含1至5、1至8、1至10或1至15个脱氧核糖核苷酸。作为引物的寡核苷酸探针在其3’端可包含至少1个脱氧核糖核苷酸,更优选在其3’端可包含至少两个或至少3个脱氧核糖核苷酸。所述寡核苷酸探针可以是针对其靶核酸序列的上游或下游引物。具有引物功能的寡核苷酸探针具有游离的3’端并且在探针序列的内部位置处包含荧光团和猝灭剂之一或两者。具有引物功能的寡核苷酸探针可在5’端具有荧光团并且在内部位置处具有猝灭剂,或在3’端具有猝灭剂并且在内部位置处具有荧光团。本发明的寡核苷酸探针作为引物的用途在下文中有更详细的描述。
可用任何荧光团和任何猝灭剂标记所述寡核苷酸探针。选择荧光团和猝灭剂,以使猝灭剂的吸收光谱与荧光团的发射光谱重叠。还将进一步选择荧光团和猝灭剂并将其在所述探针中定位,使得在与靶模板杂交时,由于猝灭效应降低,所述荧光团产生的信号增加。
所述猝灭剂可以是非荧光的,例如非荧光生色团。所述猝灭剂可以是暗猝灭剂。或者,所述猝灭剂可发出具有不同于荧光团的发射光谱的荧光,使得当特异性地监测荧光团或猝灭剂的荧光时,任一信号的改变可报告与靶模板的杂交。荧光团和猝灭剂优选定位于所述探针的5’和3’末端,特别是在不需要依赖聚合酶的探针的延伸的实施方案中。所述荧光团可位于探针的5’末端,并且所述猝灭剂位于探针的3’末端。或者,所述猝灭剂可位于探针的5’末端,并且所述荧光团位于探针的3’末端。所述荧光团和/或猝灭剂也可位于探针的内部位置,例如距离探针的5’或3’末端10个或更少核苷酸处。例如,在长度少于25个核苷酸的探针中,荧光团或猝灭剂可位于距离探针的5’或3’末端1至3、1至5、1至8或1至10个核苷酸处。优选地,荧光团和猝灭剂中仅有一个位于内部位置,所述对中的另一个成员位于5’或3’末端。
所述荧光团和猝灭剂在探针序列中的位置通常间隔至少8个核苷酸,更优选间隔至少10个或至少12个核苷酸,这取决于探针的长度。当探针长度为15至25个核苷酸时,所述荧光团和猝灭剂可间隔至少8个、至少10个、至少12个、至少15个或至少20个核苷酸。所述荧光团和猝灭剂可位于5’和3’末端,这是探针中可间隔的最大距离。选择荧光团和猝灭剂之间的距离,使得当探针与靶核酸序列(处于开放或线性构象)杂交时由猝灭剂导致的荧光团的猝灭减少,产生表示存在靶核酸序列的可检测信号。荧光团和猝灭剂之间的适合的距离可通过经验来优化。
所述荧光团可以是任何荧光部分,通常为荧光有机染料。所述猝灭剂可以是使荧光团的荧光猝灭的任何部分,通常为发色分子,例如有机染料。技术人员能够根据公知常识来选择适合寡核苷酸探针的荧光团-猝灭剂对。适合的配对论述于例如以下文献中:Marras SE:Selection of Fluorophore and Quencher Pairs for Fluorescent Nucleic Acid Hybridization Probes.In:Fluorescent Energy Transfer Nucleic Acid Probes.Edited by Didenko V,vol.335:Humana Press;2006:3-16;和Didenko VV:DNA probes using fluorescence resonance energy transfer(FRET):designs and applications.Biotechniques 2001,31(5):1106-1116,1118,1120-1101。
适合的荧光团包括但不限于荧光素和荧光素衍生物,例如羧基荧光素(FAM,包括6-FAM、5-FAM、dT FAM),VIC,六氯-6-羧基荧光素(HEX)和JOE,5-(2′-氨乙基)氨基萘-1-磺酸(EDANS),香豆素和香豆素衍生物例如3-苯基-7-异氰酰基香豆素、荧光黄、NED、德克萨斯红、四甲基罗丹明、羧基四甲基罗丹明(TAMRA)、6-羧基-X-罗丹明(ROX)、5-羧基罗丹明、N-(对-2-苯并噁唑基)苯基)马来酰亚胺,花青染料例如CY5,罗丹明染料,吨染料,萘胺,吖啶类,苯并噁二唑,芪类和芘类。适合的猝灭剂包括但不限于DABSYL、4′-(4-二甲基氨基苯基偶氮)苯甲酸(DABCYL)、4-二甲基氨基苯基偶氮苯基-4′-马来酰亚胺(DABMI)、四甲基罗丹明、羧基四甲基罗丹明(TAMRA)、黑洞猝灭剂1、黑洞猝灭剂2、暗猝灭剂1、暗猝灭剂2、Iowa Black RQ、Iowa Black FQ。
优选的荧光团/猝灭剂配对包括:
-TAMRA和黑洞猝灭剂2;
-ROX和黑洞猝灭剂2;
-ROX和DABCYL;
-FAM(例如dT-FAM)和Iowa Black FQ;
-FAM(例如dT-FAM)和DABCYL;
-ROX和Iowa Black FQ;
-CY5和Iowa Black RQ。
荧光团和猝灭剂通常与探针共价连接。所述荧光团和猝灭剂可通过任何适合的接头与探针序列中存在的一个或多个核苷酸连接。技术人员能够根据公知常识来选择任何适合的接头。适合的接头论述于例如AgrawalS(ed.):Protocols for Oligonucleotides and Analogs:Synthesis andProperties:Humana Press;1993中。
本文提供的特定的寡核苷酸探针与产毒艰难梭茵和鼠伤寒沙门氏茵中的核酸靶序列互补。所述探针的优选实例为用于产毒艰难梭菌的SEQID NO 24和25,以及用于鼠伤寒沙门氏茵的SEQ ID NO:30。本发明还提供了SEQ ID NO 3至10、17至19、32、35至43和48的探针和探针-引物。
还提供了作为本发明一部分的SEQ ID NO 3至10、17至19、24、25、30、32、35至43和48的变体。SEQ ID NO 3至10、17至19、24、25、30、32、35至43和48的变体包括具有与原始探针的序列相应的核苷酸序列但是包含替代荧光团和/或猝灭剂的探针。以上变体可包含来自本文所述的荧光团和猝灭剂的任何适合的荧光团-猝灭剂对。
SEQ ID NO3至10、17至19、24、25、30、32、35至43和48的变体也可具有与原始探针的序列相应的核苷酸序列,其由不同模式的天然核糖核苷酸、经修饰的核糖核苷酸或PNA核苷酸组成。例如,SEQ ID NO 24、25和30的原始探针由2’-氟核糖核苷酸组成。其变体的核苷酸序列可包含天然核糖核苷酸或仅由天然核糖核苷酸组成。其其他变体可包含替换2’-氟核糖核苷酸的替代的经修饰的核糖核苷酸,或天然和经修饰的核糖核苷酸的混合物。优选的替代的经修饰的核糖核苷酸包括2’-O-甲基核糖核苷酸和LNA(锁核酸)核苷酸。因此,例如,SEQ ID NO 24、25和30的变体可由2’-氟核糖核苷酸和1至8、1至5或1至3个天然核糖核苷酸组成,或由2’-氟核糖核苷酸和1至8、1至5或1至3个2’-O-甲基核糖核苷酸组成。SEQ ID NO 24、25和30的变体可包含至少20%的相应的LNA或PNA核苷酸,或仅由相应的LNA或PNA核苷酸组成。
变体探针也可以是嵌合探针,其包含1至10、1至5或1至3个脱氧核糖核苷酸或经修饰的脱氧核糖核苷酸以替换SEQ ID NO 3至10、17至19、24、25、30、32和35至43的序列中相应的核糖核苷酸或PNA核苷酸。本发明还提供了SEQ ID NO:16的DNA探针的变体,其包含至少20%的RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸。
SEQ ID NO 3至10、17至19、24、25、30、32、35至43和48的变体也可以是长度小于25个核苷酸的寡核苷酸,其包含与相应的原始探针序列的至少8个连续核苷酸部分或完全互补的区域。优选地,所述变体包含与相应的原始探针序列的至少9个、至少10个、至少12个或至少14个连续核苷酸部分或完全互补的区域。以上变体可包含与原始探针序列(以及因此与靶序列)的相应区域具有1、2、3、4或5个错配(置换)的区域,因此与其部分互补。因此,例如,所述变体可包含长度至少为12个核苷酸的区域,其与原始探针序列的至少12个核苷酸的相应区域具有1、2或3个错配。任何错配优选间隔至少4个、至少5个或至少8个核苷酸。
SEQ ID NO 3至10、17至19、24、25、30和32的变体也可以是长度小于25个核苷酸的寡核苷酸,其与相应的原始探针序列具有至少70%的序列同一性,优选至少75%、至少80%,更优选至少85%、至少90%或至少95%的序列同一性。
以上变体探针可包含与原始探针部分或完全互补的区域的5’和/或3’侧翼区。所述5’和/或3’侧翼区可包含与靶核酸序列不互补的序列,或与靶核苷酸序列中位于原始探针结合区的侧翼的区域互补的序列。例如,在SEQ ID NO 24、25和30的变体中,5’侧翼区可包含长度为1-10或1-5个核苷酸的序列,其与SEQ ID NO:26或SEQ ID NO:31的相关靶核酸序列中的探针结合区5’端的1-10或1-5个核苷酸互补。
信号的检测
可通过任何适合的检测荧光的方法进行来自探针的信号的检测。所述探针可用于检测靶核酸序列,之前不用进行任何DNA扩增。更通常地,所述探针可用于在靶核酸序列扩增之后或扩增过程中检测靶核酸序列。优选地,在扩增所述靶核酸序列的同时实时监测来自探针的信号。
可检测来自针对单一靶序列的一个探针的单一信号。或者,可使用检测不同的靶序列的探针,其中在不同的荧光波长处的各信号提供多重检测。可使用两种或更多种(例如,3、4、5、6、8、10或更多种)不同的探针用于在单一反应中多重检测若干不同的靶序列。
也可同时使用嵌入有扩增的DNA的染料以及寡核苷酸探针以检测DNA扩增,所述染料例如SYBR绿和噻唑橙。
也可同时使用针对相同或替代靶序列的DNA寡核苷酸探针以及寡核苷酸探针。
本发明也提供了增强来自探针的信号的方法。可使待进行靶核酸序列检测的样品与RNase H酶(例如RNase H2)接触。优选的RNase H2酶是Thermococcus gammatolerans RNase H2。如由本发明人所表明的,RNase H酶能够增强来自探针的信号。认为RNase H酶切割寡核苷酸探针与靶核酸序列杂交时形成的双链体,从而使猝灭减少。
更通常地,可使样品与任何能够特异性地降解寡核苷酸探针/靶核酸序列双链体的核酸酶接触。
靶核酸序列的扩增
当本发明的方法包括靶核酸序列的扩增时,可使用任何适合的DNA扩增方法。通常,在等温条件下进行DNA扩增。所述DNA扩增方法可包括基于链侵入的扩增、滚环扩增(RCA)、链置换扩增(SDA)、重组酶聚合酶扩增(RPA)。优选基于链侵入的扩增(SIBA)。以上扩增方法通常要求存在能够结合单链DNA的蛋白,因此本发明的寡核苷酸探针便利地允许检测所述方法中的扩增。
因此,本发明提供了在至少一种能够与单链DNA结合的蛋白的存在下检测样品中靶核酸序列的扩增的方法,包括在促进所述靶核酸序列扩增的条件下使所述样品与本发明的寡核苷酸探针接触。
所述条件通常包括存在一种或多种引物和DNA聚合酶。技术人员能够根据待使用的DNA聚合酶的类型选择适用于特定靶序列的引物。当所述DNA聚合酶是RCA酶(例如phi29)时,可使用扩增靶核酸序列的随机引物或单一种类(species)的引物。更通常地,所述扩增条件包括存在针对靶核酸序列的上游引物和下游引物。
如以上所讨论的,所述寡核苷酸探针可提供引物功能,因此扩增条件可包括存在作为下游引物的寡核苷酸探针和单独的上游引物(以及任选的无其他下游引物),或存在作为上游引物的寡核苷酸探针和单独的下游引物(以及任选的无其他上游引物)。
当使用SIBA时,所述条件通常还包括存在链侵入寡核苷酸。SIBA扩增的优选的引物和链侵入寡核苷酸的特征在下文中更详细地描述。
用于扩增靶核酸序列的适合的条件还包括本领域已知的用于提供聚合酶活性的任何条件。所述条件通常包括存在全部四种dNTP——dATP、dTTP、dCTP和dGTP或其类似物,适合的缓冲剂/pH,以及酶性能或稳定性所需的其他因素。所述条件可包括存在洗涤剂和稳定剂。所使用的温度通常是等温,即在整个扩增过程中是恒定的。所使用的温度通常取决于聚合酶和其他酶组分的性质,也反映引物和链侵入寡核苷酸所需的杂交温度。
所使用的聚合酶通常具有链置换活性。本文使用术语“链置换”来描述DNA聚合酶(任选地与辅助蛋白联合)在DNA合成过程中在遇到双链DNA区域时置换互补链的能力。适合的DNA聚合酶包括来自大肠杆菌(E.coli)、枯草芽孢杆菌(B.subtilis)或嗜热脂肪芽孢杆菌(B.stearothermophilus)的polI及其功能性片段或变体,以及T4和T7DNA聚合酶及其功能性片段或变体。优选的聚合酶为Bsu DNA聚合酶或其功能性片段或变体。
所述扩增条件包括存在能够结合单链DNA的蛋白。所述能够结合单链DNA的蛋白可以是在不存在互补模板的情况下引起标记有荧光团和猝灭剂的寡核苷酸探针的荧光信号改变并且能够结合于单链DNA的任何蛋白。所述蛋白可以是任何单链结合蛋白(SSB)或任何能够结合单链DNA的蛋白,并且也具有另一种功能活性。所述能够结合单链DNA的蛋白可以是重组酶或重组酶辅助蛋白或辅因子。所述能够结合单链DNA的蛋白可以是嗜温的或嗜热的。
所述扩增条件优选包括存在重组酶。任何重组酶系统可用于本发明的方法中。所述重组酶系统可以是原核生物来源或真核生物来源的,并且可以是细菌、酵母、噬菌体或哺乳动物来源的。所述重组酶可以5’-3’方向或3’-5’方向聚合到单链寡核苷酸上。所述重组酶可获自肌病毒科(myoviridae)噬菌体,例如T4、T2、T6、Rb69、Aeh1、KVP40,不动杆菌属(Acinetobacter)噬茵体133,气单胞茵属(Aeromonas)噬茵体65,噬蓝藻体(cyanophage)P-SSM2,噬蓝藻体PSSM4,噬蓝藻体S-PM2、Rbl4、Rb32,气单胞茵属噬茵体25,弧茵属(Vibrio)噬茵体nt-1、phi-1、Rbl6、Rb43,噬茵体31,噬茵体44RR2.8t,Rb49,噬茵体Rb3或噬茵体LZ2。在一个优选的实施方案中,使用T4重组酶UvsX(登录号:P04529)或其功能变体或片段。也可使用真核生物的Rad系统或大肠杆菌的recA-Reco系统或其他原核生物系统。所述重组酶可以是大肠杆菌RecA。
所述条件还可包括存在重组酶辅助蛋白,例如单链结合蛋白(例如,T4gp32,登录号P03695)和重组酶载剂(loading agent)(例如,UvsY,登录号NP_049799.2)。在一个优选的实施方案中,所述条件包括存在T4gp32、UvsX和UvsY蛋白。所述重组酶(例如UvsX),以及(如果使用的话)重组酶载剂(例如UvsY)和单链DNA结合蛋白(例如gp32),均可来自相同或不同的肌病毒科噬茵体来源的天然、杂合或突变蛋白。天然蛋白可以是蛋白的野生型或天然变体。
或者,能够结合单链DNA的蛋白可以是用于在DNA扩增方法中提供单链结合活性的任何蛋白。所述扩增方法可以是PCR。所述能够结合单链DNA的蛋白可以是极高热稳定性单链DNA结合蛋白(ET-SSB),其可获自新英格兰Biolabs。
所述条件还可包括用于增强重组酶效率的其他因子,例如用于调控DNA相互作用的化合物,例如,脯氨酸、DMSO或已知增强重组酶加载到DNA上的拥挤试剂(crowding agent)(Lavery P.et al.J.Biol.Chem.1992,267,(13),9307-9314)。
所述条件也可包括存在ATP再生系统。多种ATP再生系统是本领域技术人员已知的,包括糖酵解酶。ATP再生系统的适合组分可包括磷酸肌酸、肌酸激酶、肌激酶、焦磷酸酶、蔗糖和蔗糖磷酸化酶中的一种或多种。所述条件可还包括存在ATP。
也可包括其他组分,例如镁离子、DTT或其他还原剂、盐类、BSA/PEG或其他拥挤试剂。
可以不同的浓度提供上述各种组分以进行DNA扩增。技术人员能够在实践中选择所述各种组分的适合的工作浓度。当寡核苷酸探针与上游或下游引物的序列重叠时,通过使用更低浓度的探针或重叠区减小的探针(例如,从3’端比较,长度比反向引物更短的探针)可使在引物的结合和探针的结合之间观察到的任何竞争最小化。
基于链侵入的扩增(SIBA)
用于扩增靶核酸序列的优选方法SIBA的特征在下文中讨论。本发明提供了在至少一种能够与单链DNA结合的蛋白的存在下检测样品中靶核酸序列的扩增的方法,包括在促进所述靶核酸序列扩增的条件下使所述样品与至少一种本发明的寡核苷酸探针、至少一种上游引物、至少一种下游引物和至少一种链侵入寡核苷酸接触。如以上所讨论的,所述寡核苷酸探针自身可作为上游引物或下游引物,或者提供单独的上游和下游引物以及寡核苷酸探针。所述引物、所述探针和所述链侵入寡核苷酸均包含与所述靶核酸序列互补的区域。所述链侵入寡核苷酸使至少一部分靶核酸序列成为单链以允许结合各所述引物和所述探针。
针对SIBA的引物
根据目的靶核酸序列,以及考虑链侵入寡核苷酸的结合位点,选择适合的上游和下游引物,所述链侵入寡核苷酸使至少一部分靶核酸序列成为单链以允许结合上游引物和下游引物。所述上游和下游引物包含与靶序列部分或完全互补的序列,以及任选的5’和/或3’侧翼非互补序列。或者,所述上游和下游引物可全部由与靶序列部分或完全互补的序列组成。与所述靶序列互补的引物序列的长度足以提供与所述靶核酸序列的特异性杂交。互补序列的长度通常为至少10个核苷酸,更优选至少15、至少16或至少17个核苷酸。互补序列的长度可以为10-25、15-25、10-30或15-30个核苷酸。
应理解,以上序列长度是指部分或完全与靶核酸序列互补的引物的部分。在特定的位置可存在引物和靶序列之间的错配,而仍允许靶序列的特异性扩增和检测,特别是考虑到为实现扩增而组合使用上游和下游引物以及链侵入寡核苷酸的情况。在引物的互补区域和靶序列的对应区域之间可存在1、2、3、4或5个错配。
通常上游和下游引物的总长度少于30个核苷酸,更优选长度少于25个核苷酸,例如长度为15至25或15至23个核苷酸。当重组酶用于链侵入时,特别优选使用长度少于30个核苷酸的引物。这样的引物不能作为重组酶的底物。
所述上游(或正向)引物在靠近链侵入寡核苷酸的5’结合位点或与该链侵入寡核苷酸的5’结合位点重叠的位置结合于双链体靶核酸序列中的一条链的5’区。所述下游(或反向)引物在靠近链侵入寡核苷酸的3’结合位点或与该链侵入寡核苷酸的3’结合位点重叠的位置结合于双链体靶核酸序列中的相对链的5’区。所述上游和下游引物的5’结合位点在双链体靶序列上通常间隔至少45个核苷酸,更优选至少50个、至少55个或至少60个核苷酸。
所述上游和/或下游引物可具有与所述链侵入寡核苷酸序列的序列重叠区。所述序列重叠区的长度通常为1-8个核苷酸,长度可以是至少5个或至少6个核苷酸。所述下游引物也可具有与链侵入寡核苷酸序列重叠长度为1-8个核苷酸的序列区。或者,所述上游和/或下游引物和所述链侵入寡核苷酸之间可没有序列重叠,引物转而结合于靶序列中靠近链侵入寡核苷酸的结合位点的位置。
当引物结合于链侵入寡核苷酸附近时,链侵入寡核苷酸的相关结合位点和引物的5’端之间通常有25个核苷酸或更少,更优选20个核苷酸或更少、15个核苷酸或更少,或10个核苷酸或更少。这确保所述引物能够与通过链侵入寡核苷酸的结合而产生的单链区杂交。
优选地,设计各引物以允许特异性检测特定的靶核酸序列,例如存在于特定的靶标(例如特定的生物体或特定的病原体)中的特定的基因型或核酸序列。因此,各引物通常与仅存在于靶标中的互补序列特异性或选择性地杂交。但是,各引物也可与其他序列(例如存在于其他物种中的序列)杂交,条件是当各引物与第二引物、链侵入寡核苷酸和寡核苷酸探针组合使用时获得所述靶核酸序列的特异性检测。
本文提供了用于扩增产毒艰难梭茵和鼠伤寒沙门氏茵中的靶核苷酸序列的适合的上游和下游引物的具体实例。本发明提供了SEQ ID NO 21和22或其变体的引物用于扩增产毒艰难梭菌的靶核酸序列(例如SEQ ID NO:26),以及SEQ ID NO 27和28或其变体的引物用于扩增鼠伤寒沙门氏茵的靶核酸序列(例如SEQ ID NO:31)。
SEQ ID NO 21、22、27和28的变体可以是长度最多达30个核苷酸的寡核苷酸,其包含与SEQ ID NO:21、22、27和28的相应原始引物序列的至少10个连续核苷酸部分或完全互补的区域。优选地,所述变体包含与SEQ ID NO:21、22、27和28的相应原始引物序列的至少11、12、13、14或15个连续核苷酸部分或完全互补的区域。当所述原始引物序列的长度大于16个核苷酸(例如长度最多达21个核苷酸(例如SEQ ID NO:21))时,所述变体可相应地包含与其16、17、18、19或20个连续核苷酸部分或完全互补的区域。
以上变体可包含与所述原始引物序列(以及因此与靶序列)的相应区域具有1、2、3、4或5个错配(置换)的区域,因此与其部分互补。因此,例如,所述变体可包含长度为至少10个核苷酸的区域,所述区域与所述相应原始引物序列的至少10个连续核苷酸的相应区域具有1、2或3个错配,例如1或2个错配。所述变体可包含长度为至少13、14或15个核苷酸的区域,所述区域与所述相应原始引物序列中等效长度的相应区域具有1、2、3、4或5个错配,例如1-3个错配。所述变体引物序列中的任何错配可间隔至少2个、至少4个、至少5个或至少10个核苷酸。
或者,所述变体可包含长度至少为10、11、12、13、14或15个核苷酸的区域,其与所述原始引物序列完全互补。
SEQ ID NO 21、22、27和28的变体也可以是长度最多达30个核苷酸的寡核苷酸,其与所述相应原始引物序列具有至少70%的序列同一性,优选至少75%、至少80%,更优选至少85%、至少90%、至少95%的序列同一性。
此外,所述变体引物可包含部分或完全与所述原始引物序列互补的区域的5’和/或3’侧翼核苷酸序列。所述5’和/或3’侧翼序列可以是与靶核酸序列非互补的,或可与位于所述靶核酸序列中原始引物的结合区侧翼的区域(例如所述靶核酸序列中原始引物的结合区的5’和/或3’端的5-10个核苷酸)序列互补。
用于SIBA的链侵入寡核苷酸
基于目的靶核酸序列,并且考虑上游和下游引物的结合位点以及链侵入寡核苷酸使靶核酸序列在相关区域成为单链以允许结合上游引物和下游引物的需要,选择适合的链侵入寡核苷酸。
所述链侵入寡核苷酸包含与靶标互补的序列和任选的其他侧翼非互补序列。与所述靶标互补的序列的长度可由技术人员根据经验确定,并且其足以提供对所述靶核酸序列的有效链侵入,任选地在等温条件下。所述互补序列可包含RNA-DNA互补碱基配对和经修饰的核苷酸。通常,互补序列的长度为至少25或至少27个核苷酸,通常至少30个核苷酸,例如至少32个、至少33个或至少35个核苷酸,更优选长度为至少36、37、38、39或40个核苷酸或更多。互补序列的长度可以是30-50、32-50、35-50、40-50、35-48、35-46、38-45或40-45个核苷酸。
应理解,以上序列长度是指可部分或完全与靶核酸序列互补的链入侵寡核苷酸的一部分。在特定的位置可在链侵入寡核苷酸和靶序列之间存在错配,而仍允许靶序列的特异性扩增和检测,特别是考虑到为实现扩增而组合使用上游和下游引物以及链侵入寡核苷酸的情况。链侵入寡核苷酸的互补区域和靶序列的相应区域之间可存在1、2、3、4、5、6、7或8个错配,这取决于互补序列的总长度。
所述链侵入寡核苷酸的互补序列与靶序列插入上游和下游引物的结合区之间(并且通常与上游和下游引物的一种或更多种重叠)的一部分杂交。所述链侵入寡核苷酸与上游和/或下游引物可具有长度为1-8个核苷酸的重叠区,例如长度为至少5个或至少6个核苷酸的区域。所述链侵入寡核苷酸的互补序列的5’部分通常在距离待熔解的双链体靶核苷酸序列(扩增子)的5’边界的25个核苷酸或更少核苷酸、更优选20个核苷酸或更少核苷酸以内结合。
所述链侵入寡核苷酸任选地还包含所述靶标的非互补序列区,所述非互补序列区位于互补序列区域侧翼。所述链侵入寡核苷酸可包含非互补5’区,其可以具有任何核苷酸序列。所述5’非互补区的长度通常为至少3个核苷酸,更通常的长度为至少6个、至少8个、优选至少10个、至少12个或至少14个核苷酸。所述5’非互补区可辅助重组酶的结合。所述链侵入寡核苷酸可包含长度通常为1-3个核苷酸的3’非互补区,其包含阻断聚合酶延伸的核苷酸(例如invdT)。
当重组酶与寡核苷酸联合使用时,所述链侵入寡核苷酸的长度通常为至少30个核苷酸。所述链侵入寡核苷酸的长度优选为至少35个、至少40个或至少45个核苷酸,更优选为至少50个,并且长度可以为至少55个核苷酸或更多。所述链侵入寡核苷酸的长度可以是40-70、45-70、45-70、50-70、55-70、45-65、50-65、50-60或55-65个核苷酸。
通常,所述链侵入寡核苷酸具有不可延伸的3’末端,使得其不能充当DNA扩增的底物,然后仅在特异性的上游和下游引物进一步结合时才扩增所述靶序列。这避免了非特异性扩增产物的形成。所述链侵入寡核苷酸在其3’区(例如在距离3’末端10-15或10-20个核苷酸内)可包含1、2、3、4、5、6、7、8或更多个经修饰的核苷酸。所述链侵入寡核苷酸可包含对3’末端核苷酸的3’修饰,并且可以是双脱氧核苷酸,或可包含3’氨基-烯丙基、3’碳间隔基(spacer)、3’磷酸、3’生物素、3’唾液酰基或3’巯基。所述3’核苷酸可以是通过3’-3’键反向掺入的核苷酸。可选地或另外地,所述链侵入寡核苷酸的3’区可包含具有差的DNA聚合酶底物能力的核苷酸,例如PNA(肽核酸)核苷酸、LNA(锁核酸)、2’-5’连接的DNA或2’-O-甲基RNA,或其组合。
当所述链侵入寡核苷酸是完全由PNA组成的PNA寡聚体时,这样的寡核苷酸在不存在重组酶时可使双链体DNA不稳定并侵入。因此,当使用PNA寡核苷酸时,可在不存在重组酶的情况下进行本发明的方法。
本文提供了用于产毒艰难梭茵和鼠伤寒沙门氏茵中靶核苷酸序列的适合的链侵入寡核苷酸的具体实例。本发明提供了SEQ ID NO:23或其经修饰的衍生物或变体的链侵入寡核苷酸,用于扩增产毒艰难梭茵的靶核酸序列(例如SEQ ID NO:26);以及SEQ ID NO 29或其经修饰的衍生物或变体的链侵入寡核苷酸,用于扩增鼠伤寒沙门氏茵的靶核酸序列(例如SEQ ID NO:31)。
如以上所讨论的,优选本发明中所使用的链侵入寡核苷酸在其3’区包含一个或多个经修饰的寡核苷酸以阻止其用作聚合酶底物。因此,SEQ ID NO:23或29的经修饰的衍生物在其3’区(通常在距离3’末端10-15或10-20个核苷酸内)可包含1、2、3、4、5、6、7、8或更多个经修饰的核苷酸。所述修饰可选自以上讨论的那些中的任一种。所述经修饰的衍生物可以是SEQ ID NO:23或29的相应序列的PNA寡聚体。
SEQ ID NO 23和29的变体通常是长度大于30个核苷酸,更优选至少35个、至少40个或至少45个核苷酸的寡核苷酸,其包含与SEQ ID NO:23或29中存在的相应原始靶互补序列的至少30个连续核苷酸部分或完全互补的区域。优选地,所述变体包含与SEQ ID NO:23或29中存在的靶互补序列的至少32、35、37、40、42或45个连续核苷酸部分或完全互补的区域。
以上变体可包含与SEQ ID NO:23或29的原始链侵入寡核苷酸的相应靶互补区(以及因此与靶序列)具有1、2、3、4、5、6、7或8个错配(置换)的区域,因此与其部分互补。因此,例如,所述变体可包含长度为至少30个核苷酸的区域,其与相应的原始链侵入寡核苷酸的至少40个连续核苷酸的相应区域具有1、2、3或4个(例如1-4或1-3个)错配。所述变体可包含长度为至少35、40、42或45个核苷酸的区域,其与相应的原始链侵入寡核苷酸中等效长度的相应区域具有1、2、3、4、5或6个(例如1-5或1-3个)错配。所述变体链侵入寡核苷酸序列中的任何错配可间隔至少2个、至少4个、至少5个或至少10个核苷酸。
或者,所述变体可包含长度为至少32、35、37、40、42或45个核苷酸的区域,其与原始链侵入寡核苷酸的靶互补区完全互补。
SEQ ID NO 23和29的变体也可以是包含靶互补区域的长度大于30个核苷酸的寡核苷酸,所述靶互补区域与相应的原始链侵入寡核苷酸的靶互补序列具有至少70%的序列同一性,优选至少75%、至少80%,更优选至少85%、至少90%、至少95%的序列同一性。
所述变体链侵入寡核苷酸可包含与所述原始链侵入寡核苷酸序列部分或完全互补的区域的5’和/或3’侧翼核苷酸序列。所述5’和/或3’侧翼序列可以是与靶核酸序列非互补的,或可与位于所述靶核酸序列中原始链侵入寡核苷酸的结合区侧翼的区域(例如,所述靶核酸序列中原始链侵入寡核苷酸的结合区的5’和/或3’端的5-10或5-15个核苷酸)的序列互补。
所述变体链侵入寡核苷酸的其余序列通常与靶序列无关,并且也通常与原始链侵入寡核苷酸无关。
所述变体链侵入寡核苷酸在其3’区还包含一个或多个经修饰的寡核苷酸,例如2、3、4、5、6、7、8或更多个经修饰的寡核苷酸,其可在距离3’末端的10-15或10-20个核苷酸内。所述修饰可选自以上讨论的那些中的任一种。
靶核苷酸序列的检测
本发明提供了用于检测靶核苷酸序列的上游和下游引物、寡核苷酸探针和链侵入寡核苷酸的特定组合。因此,本发明提供了在至少一种单链DNA结合蛋白的存在下检测样品中产毒艰难梭茵的靶核酸序列的方法,包括在促进所述靶核酸序列扩增的条件下,使所述样品与上述SEQ ID NO:24或25或其任一种的变体的寡核苷酸探针、上述SEQ ID NO:21或其变体的上游引物、上述SEQ ID NO:22或其变体的下游引物,以及上述SEQ ID NO:23或其经修饰的衍生物或变体的链侵入寡核苷酸接触。所述方法可包括检测SEQ ID NO:26的靶核酸序列。
本发明还提供了在至少一种单链DNA结合蛋白的存在下检测样品中鼠伤寒沙门氏菌的靶核酸序列的方法,包括在促进所述靶核酸序列扩增的条件下,使所述样品与上述SEQ ID NO:30或其变体的寡核苷酸探针、上述SEQ ID NO:27或其变体的上游引物、上述SEQ ID NO:28或其变体的下游引物,以及上述SEQ ID NO:29或其经修饰的衍生物或变体的至少一种链侵入寡核苷酸接触。所述方法可包括检测SEQ ID NO:31的靶核酸序列。
本发明还提供了在至少一种单链DNA结合蛋白的存在下检测样品中SEQ ID NO:20的靶核酸序列的方法,包括在促进所述靶核酸序列扩增的条件下,使所述样品与上述SEQ ID NO:13或14或其变体的寡核苷酸探针、SEQ ID NO:11或其变体的上游引物、SEQ ID NO:12或其变体的下游引物,以及SEQ ID NO:15或其经修饰的衍生物或变体的至少一种链侵入寡核苷酸接触。可根据上述用于SEQ ID NO 21、22、27和28的变体的相同标准,选择SEQ ID NO 11和12的变体。可根据上述用于SEQ ID NO 23和29的变体的相同标准,选择SEQ ID NO 15的变体和经修饰的衍生物。
本发明也提供了在至少一种单链DNA结合蛋白的存在下检测样品中SEQ ID No:34的靶核酸序列的方法,包括使所述样品与SEQ ID NO 3至10或其变体中任一种的寡核苷酸探针接触。
本发明的产品
核酸
本发明还提供了作为产品本身的寡核苷酸探针,其包含荧光团、猝灭剂和与靶核酸序列互补的区域。所述寡核苷酸探针的序列包含至少20%的RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸。本发明的寡核苷酸探针产品可以是用于本发明方法的上述任何寡核苷酸探针。本发明也具体提供了上述SEQ ID NO:3至10、13、14、24、25或30或其任一种的变体的寡核苷酸探针。
组合物
本发明也提供了包含本发明的寡核苷酸探针的组合物和制剂。所述组合物可以是,例如,溶液、冻干物、悬浮液或在油性或水性载体中的乳液。所述组合物还可包含一种或多种选自上游引物、下游引物和链侵入寡核苷酸的寡核苷酸组分。所述组合物还可包含一种或多种选自DNA聚合酶、能够结合单链DNA的蛋白、重组酶和重组酶辅助蛋白的蛋白。所述组合物优选包含寡核苷酸探针以及(i)包含与靶核酸序列互补的区域的链侵入寡核苷酸和/或(ii)至少一种能够结合单链DNA的蛋白。分别设计所述组合物的探针、引物和链侵入寡核苷酸组分,用于检测靶核酸序列。
所述组合物可包含SEQ ID NO:24或25或其变体的寡核苷酸探针,以及(i)SEQ ID NO:21或其变体的上游引物,(ii)SEQ ID NO:22或其变体的下游引物和/或(iii)SEQ ID NO:23或其变体的链侵入寡核苷酸。另外地或可选地,所述组合物可包含SEQ ID NO:30或其变体的寡核苷酸探针,以及(i)SEQ ID NO:27或其变体的上游引物,(ii)SEQ ID NO:28或其变体的下游引物和/或(iii)SEQ ID NO:29或其变体的链侵入寡核苷酸。另外地或可选地,所述组合物可包含SEQ ID NO 17至19和32或其变体中任一种的寡核苷酸探针,以及(i)SEQ ID NO:11或其变体的上游引物,(ii)SEQ ID NO:12或其变体的下游引物和/或(iii)SEQ ID NO:15或其变体的链侵入寡核苷酸。
试剂盒
本发明还提供了包括本发明的至少一种寡核苷酸探针的试剂盒。所述试剂盒任选地还包括用于本发明的方法的使用说明。所述试剂盒可包括检测所扩增的DNA的工具。所述试剂盒可包括上游引物和/或下游引物。所述试剂盒可包括链侵入寡核苷酸。可在所述试剂盒中以混合物的形式或在分开的容器中提供以上各寡核苷酸。
所述试剂盒或组合物任选地包括DNA聚合酶、重组酶和重组酶辅助蛋白中的一种或多种。优选地,所述DNA聚合酶是Bsu聚合酶。优选地,所述重组酶是细茵噬茵体T4UvsX,其任选地与重组酶辅助蛋白UvsY和gp32组合。所述试剂盒或组合物可还包括dNTP、适合的缓冲液和上述本发明方法中的DNA扩增所需的其他要素。
所述试剂盒可包括与本发明的方法和组合物有关的上述寡核苷酸探针、上游引物、下游引物和/或链侵入寡核苷酸的任何组合。
用于检测靶核酸序列的应用
本发明的方法可用于需要检测靶核酸序列的任何应用。
诊断方法
本发明在医学环境下是特别有利的。本发明的检测方法提供高度特异性的检测以允许确定临床样品是否包含靶核酸序列。所述方法可应用于一系列疾病环境中。本发明提供了在受试者中诊断疾病的方法,包括在来自所述受试者的样品中实施本发明的检测靶核酸序列的方法以检测与所述疾病相关的靶核酸序列。
所述方法可用于在受试者中诊断病原体感染,包括检测来自所述病原体的靶核酸序列。可以在患者中存在或疑似存在任何疾病或病痛的背景下确定是否存在病原体。所述疾病可包括由病原体存在引起的、与其存在相关或因其存在而恶化的那些疾病。因此,患者可表现出指示病原体存在的症状,并且可从所述患者中获得样品以通过上述方法确定病原体的存在。
可检测任何病原体。所述病原体可以是病毒或细菌或寄生虫。所述病原体例如,但不限于,真菌;病毒,包括人乳头瘤病毒(HPV)、HIV、HSV2/HSV1、流感病毒(A型、B型和C型)、脊髓灰质炎病毒、RSV病毒、鼻病毒、轮状病毒、甲型肝炎病毒、诺沃克病毒类、肠病毒、星状病毒、麻疹病毒、副流感病毒、腮腺炎病毒、水痘带状疱疹病毒、巨细胞病毒、EB病毒、腺病毒、风疹病毒、人T细胞淋巴瘤I型病毒(HTLV-I)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、丁型肝炎病毒、痘病毒、马尔堡病毒和埃博拉病毒;细菌,包括结核分枝杆茵(Mycobacterium tuberculosis)、衣原体属(Chlamydia)、淋病奈瑟氏球菌(Neisseria gonorrhoeae)、志贺茵属(Shigella)、沙门氏茵属(Salmonella)、霍乱弧茵(Vibrio cholerae)、苍白密螺旋体(Treponema pallidum)、假单胞茵属(Pseudomonas)、百日咳博德特氏菌(Bordetella pertussis)、布鲁杆菌属(Brucella)、土拉弗氏茵(Franciscella tularensis)、幽门螺杆菌(Helicobacter pylori)、肾脏钩端螺旋体(Leptospira interrogans)、嗜肺军团病杆菌(Legionellapneumophila)、鼠疫耶尔森氏茵(Yersinia pestis)、链球菌属(Streptococcus)(A型和B型)、肺炎球菌(Pneumococcus)、脑膜炎球菌(Meningococcus)、流感嗜血杆菌(Haemophilus influenza)(b型)、鼠弓形体(Toxoplasma gondii)、弯曲茵(Campylobacteriosis)、粘膜炎莫拉茵(Moraxella catarrhalis)、腹股沟肉芽肿(Donovanosis)和放线茵(Actinomycosis);真菌病原体,包括念珠茵病(Candidiasis)和曲霉菌病(Aspergillosis);寄生病原体,包括绦虫属(Taenia)、吸虫(Flukes)、蛔虫(Roundworms)、阿米巴病(Amoebiasis)、贾第虫病(Giardiasis)、隐孢子虫属(Cryptosporidium)、血吸虫属(Schistosoma)、卡氏肺囊虫(Pneumocystis carinii)、滴虫病(Trichomoniasis)和旋毛虫病(Trichinosis)。
特定的目的病原体包括产毒艰难梭茵和鼠伤寒沙门氏茵,适于诊断这些病原体感染的方法和寡核苷酸的组合在上文中描述。
本发明的一个特别优选的实施方案是鉴定具有胃肠道感染(特别是具有腹泻症状)的患者中存在的产毒艰难梭茵。
因此,本发明提供了胃肠道疾病(例如,由产毒艰难梭茵和鼠伤寒沙门氏菌引起的腹泻)的诊断方法。所述诊断方法还可包括检测抗生素抗性标记物和毒力标记物。所述方法显著改善了患者的胃肠道疾病管理,因为它允许对给定患者进行最佳治疗学治疗。因此,所述测试将缩短住院时长、降低再入院的频率并降低费用。
基于获自患者样品的核酸可便利地进行所述诊断方法,为临床医生提供关于胃肠道疾病是否可归因于产毒艰难梭茵或鼠伤寒沙门氏茵感染的指示。例如,所述诊断方法可提供关于艰难梭茵的毒素型和毒力以及艰难梭茵是否对任何抗生素具有抗性的指示。然后根据所述测试的结果可优化医学治疗,例如通过使用抗生素。
鼠伤寒沙门氏茵的检测
在更广泛的方面,本发明提供用于检测样品的鼠伤寒沙门氏茵的方法,所述方法包括在促进扩增包含SEQ ID NO:31的靶核酸序列的条件下,使所述样品与至少一种上游引物、至少一种下游引物和至少一种链侵入寡核苷酸接触,其中各所述引物和所述链侵入寡核苷酸包含与所述靶核酸序列互补的区域;并且其中所述链侵入寡核苷酸使所述靶核酸序列的至少一部分成为单链以允许结合所述上游引物和下游引物。
优选地,所述方法还包括使所述样品与至少一种寡核苷酸探针接触,所述寡核苷酸探针包含荧光团、猝灭剂和与所述靶核酸序列互补的区域。通常,所述寡核苷酸探针包含至少20%的RNA核苷酸、经修饰的RNA核苷酸和/或PNA核苷酸,因此是上述本发明的寡核苷酸探针。通常,在至少一种能够与单链DNA结合的蛋白的存在下实施所述检测鼠伤寒沙门氏茵的方法。通常,所述能够结合单链DNA的蛋白是重组酶。
优选地,所述上游引物包含SEQ ID NO:27或其变体的序列,所述下游引物包含SEQ ID NO:28或其变体的序列,所述链侵入寡核苷酸包含SEQ ID NO:29或其变体的序列。
以下实施例举例说明本发明。
实施例
实施例1——不同的寡核苷酸对单链DNA结合蛋白的亲和力
研究了能够结合单链DNA的蛋白对包含荧光团和猝灭剂的单链寡核苷酸探针产生的信号的影响。所述寡核苷酸探针由天然DNA或RNA或经修饰的核酸(例如,2’-氟RNA、2’-O-甲基RNA)、PNA或LNA组成。与其他探针(长度为16-21个碱基)相比,LNA和PNA探针的长度分别为12和14个碱基。使用更短的LNA和PNA探针,这是由于它们的熔解温度更高。亲和测定中寡核苷酸探针的浓度为100nM,PNA除外,其为800nM。
在包含20mM Tris-乙酸盐pH 8.0、10mM乙酸镁、2mM ATP、60mM Tris-磷酸肌酸和0.025U/μl肌酸激酶的缓冲液中,在存在或不存在200nM互补模板(对于具有SEQ ID NO 1-8的探针,为SEQ IDNO:34;或者对于具有SEQ ID NO 9或10的探针,为SEQ ID NO:44)和5μM UvsX的情况下,孵育寡核苷酸探针。在40℃孵育20分钟后,测量荧光。
与不存在互补模板的情况下产生的信号相比,所有的寡核苷酸探针与其互补模板的孵育导致荧光信号增加(图1a)。然而,在不存在互补模板的情况下,细菌噬茵体T4UvsX的存在也导致天然DNA寡核苷酸探针(SEQ ID NO:1和2)的荧光信号显著增加,如图1a所示。对这一观察的可能的解释是,UvsX使DNA探针的二级构象不稳定,导致探针和猝灭剂之间的距离增大,即使在不存在互补模板的情况下探针信号也增加。当在包含UvsX的反应中监测DNA扩增时,预期这种探针的非特异性激活将导致差的信号背景比。
相比之下,在UvsX存在下,具有相同序列但是由RNA(SEQ IDNO:3和4)或经修饰的RNA(SEQ ID NO:5、6、7、8)或LNA(SEQID NO:9)或PNA(SEQ ID NO:10)组成的寡核苷酸探针仍然被猝灭,仅在互补模板存在的情况下信号显著增加。
也说明了单链DNA结合蛋白——细菌噬茵体T4gp32(新英格兰Biolabs)对与UvsX一起使用的相同寡核苷酸探针的信号的影响。在包含20mM Tris-乙酸盐pH 7.9、50mM乙酸钾、10mM乙酸镁和1mM DTT的缓冲液中,在存在或不存在0.25mg/ml gp32和200nM互补模板(对于具有SEQ ID NO 1-8的探针,为SEQ ID NO:34;或者对于具有SEQ ID NO 9或10的探针,为SEQ ID NO:44)的情况下孵育寡核苷酸探针,其浓度与和UvsX一起使用的那些寡核苷酸探针的浓度相似。
在不存在互补模板的情况下,gp32的存在再次导致DNA探针(SEQ ID NO:1和2)的信号显著增加,如图1b所示。当存在gp32时,在存在或不存在互补模板的情况下DNA探针产生的信号之间也没有显著差异。因此,在包含T4gp32的反应中,双标记的天然DNA探针不适合用于靶标检测。
相比之下,在存在T4gp32的情况下,RNA(SEQ ID NO:3和4)或经修饰的RNA(SEQ ID NO:5、6、7、8)、LNA(SEQ ID NO:9)和PNA(SEQ ID NO:10)探针表现出荧光的少许增加或无显著增加。
采用在利用单链结合蛋白和重组酶二者用于扩增的等温的基于链侵入的扩增方法中所使用的试剂条件来测试寡核苷酸探针。反应中的试剂组分为10mM Tris-乙酸盐pH 8.0、10mM乙酸镁、5%DMSO、5%PEG 1000、4mM DTT、0.5mM EDTA、0.1mg/ml BSA、150mM蔗糖、2mM ATP、200μM DNTP’s、1∶100000SYBR Green I、60mMTris-磷酸肌酸。反应中的蛋白为250ng/μl gp32、5μM UvsX、0.0625U/μl BSU、0.0125U/μl蔗糖磷酸化酶和0.025U/μl肌酸激酶(Sigma-Aldrich St.Louis,MO,U.S.A)。引物和链侵入寡核苷酸的浓度为200nM。除非另有说明,所使用的探针的浓度为200nM。
配制所有反应物,而不含有靶DNA或乙酸镁。然后,通过添加适量的在乙酸镁中配制的靶DNA或仅使用乙酸镁来开始反应。在40℃下在96孔板中实时检测反应中产生的荧光信号。
在以上试剂组合物(没有引物和链侵入寡核苷酸)与DNA探针(SEQ ID NO 1和2)一起孵育时,在存在或不存在互补模板的情况下产生的信号没有差异(图1c)。因此,不希望将包含天然DNA的探针用于使用单链结合蛋白和/或重组酶的DNA扩增反应。相比之下,显示RNA(SEQ ID NO:3和4)或经修饰的RNA(SEQ ID NO:5、6、7、8)、LNA(SEQ ID NO:9)和PNA(SEQ ID NO:10)探针仅在存在互补模板时产生信号增加。因此,RNA、经修饰的RNA、LNA和PNA探针适合于使用单链结合蛋白和/或重组酶的DNA扩增反应。
也说明了大肠杆菌重组酶RecA(新英格兰Biolabs)对来自寡核苷酸探针的信号的影响(图1d)。在含有70mM Tris-HCl pH 7.6、10mM MgCl2、5mM DTT和10mM ATP的缓冲液中,在存在或不存在100μg/ml RecA的情况下孵育寡核苷酸探针,其浓度与图1a和图1b中所使用的探针的浓度类似。RecA的存在也导致包含天然DNA的探针的信号增加(图1d,DNA21[SEQ ID NO:2])。但是,所述增加并没有像采用T4UvsX所观察到的增加那样高。然而,如采用T4UvsX所观察到的,采用包含RNA(RNA21SEQ ID NO:4)、2’-氟RNA(2-氟RNA21,SEQ ID NO:8)、2’-O-甲基RNA(2-O-甲基RNA21,SEQID NO:6)、LNA(SEQ ID NO:9)或PNA(SEQ ID NO:10)的探针孵育RecA并不导致信号的任何显著增加。
此外,说明了极高热稳定性单链DNA结合蛋白——ET-SSB(新英格兰Biolabs)对这些寡核苷酸探针的影响(图1e)。与如果在50℃以上的温度下使用则丧失活性的T4-gp32不同,ET-SSB在95℃仍保持其活性。因此,如果在高温下进行的反应(例如聚合酶链式反应(PCR)或DNA测序)中需要单链结合蛋白,则ET-SSB是适合的选择。在含有20mM Tris-乙酸盐pH 7.9、50mM乙酸钾、10mM乙酸镁和1mM DTT的缓冲液中,在存在或不存在50μg/ml ET-SSB的情况下孵育寡核苷酸探针,其浓度与图1a和图1b中所使用的探针的浓度类似。ET-SSB的存在也导致包含天然DNA的探针的信号显著增加(图1e,DNA21SEQ ID NO:2)。因此,仅包含天然DNA的双标记探针不适于包含ET-SSB的反应。相比之下,包含RNA(RNA21,SEQ ID NO:4)、2’-氟RNA(2-氟RNA21,SEQ ID NO:8)、2’-O-甲基RNA(2-O-甲基RNA21,SEQ ID NO:6)、LNA(SEQ ID NO:9)或PNA(SEQ ID NO:10)的探针对ET-SSB更具抗性。因此,这些经修饰的探针更适于在单链结合蛋白如ET-SSB的存在下进行的反应。
实施例2——使用不同的寡核苷酸探针检测基于链侵入的扩增(SIBATM)
测试了由天然DNA(SEQ ID NO:16)、2’-氟DNA(SEQ ID NO:17)和LNA(SEQ ID NO:18)组成三种探针,它们均标记有荧光团和猝灭剂。图2a中概述了正向引物(SEQ ID NO:11)、反向引物(SEQ ID NO:12)、探针、链侵入寡核苷酸(SEQ ID NO:15)和靶核酸序列(SEQ ID NO:20)的构象。设计所述探针以与所述反向引物(SEQ ID NO:12)的下游区域部分重叠,因此所述探针与所述反向引物结合于靶模板上的相同区域。
在如实施例1中所述,在基于链侵入的扩增反应中,使用探针、引物和链侵入寡核苷酸实时扩增并检测了人工靶DNA(SEQ ID NO:20)。只有在含有靶DNA的反应中获得靶DNA的扩增,而无模板对照(NTC)不产生扩增,如在使用SYBR Green I染料检测的反应中所显示的(图2b)。也观察到对依赖于模板的扩增的特异性检测,其中分别使用SEQ ID NO 17和18的2’-氟RNA或LNA探针(图2c和2d)。由于反向引物和探针之间的竞争,在采用含有2’-氟RNA或LNA的探针检测的样品中观察到扩增开始的稍许延迟。通过降低探针的浓度可进一步使这种竞争最小化。
相比之下,DNA探针(SEQ ID NO:16)不能在靶模板的存在下检测任何扩增(图2e)。这是由于反应中存在的单链结合蛋白即使在不存在复制子的情况下也导致探针信号的显著增加。因此,发现DNA探针不适合用于在其试剂方案中包含DNA结合蛋白的方法。
实施例3——使用RNA寡核苷酸探针对SIBA的多重检测
在实施例1中所述的链侵入扩增反应条件下,同时纳入标记有Cy5和Iowa black的2’-氟RNA探针(SEQ ID NO:25)或标记有ROX和BHQ2的2’-氟RNA探针(SEQ ID NO:17)。平行检测艰难梭茵靶序列(SEQ ID NO:26)和人工靶序列(SEQ ID NO:20)的扩增。
用于扩增艰难梭茵基因的所述靶序列的正向引物、反向引物和链侵入寡核苷酸分别为SEQ ID NO:21、SEQ ID NO:22和SEQ ID NO:23。用于扩增所述人工靶标的正向引物、反向引物和链侵入寡核苷酸分别为SEQ ID NO:11、SEQ ID NO:12和SEQ ID NO:15。分别使用10,000和107个拷贝的艰难梭茵基因组DNA和人工靶DNA来进行反应。图3a示出通过使用包含2’-氟RNA碱基的探针同时实现对DNA靶标的扩增的实时监测。使用标记有Cy5和Iowa black的2’-氟RNA探针(SEQ ID NO:25)检测来自艰难梭茵的靶序列,同时使用标记有ROX和BHQ2的2’-氟RNA探针(SEQ ID NO:17)检测所述人工靶序列。使用SYBR Green I(图3b)或2’-氟RNA探针(图3c)的熔解分析进一步确认,两个反应都是特异性的并且在相同的反应管中发生。2’-氟RNA探针也可代替SYBR Green充当熔解分析的工具,因为所述探针在反应中不水解。
实施例4——用于增强信号产生的RNA探针的RNase H切割
在实施例1中所述的链侵入DNA扩增反应条件下,在存在或不存在其互补靶模板的情况下将天然DNA、经修饰的RNA、LNA和PNA探针用或不用10μg/ml Thermococcus gammatolerans RNase H2孵育。如之前实验所显示的,所有的探针(除了包含天然DNA的那些)在其靶序列存在时产生信号的增加(图4a)。但是,在RNase H2存在的反应条件中,检测到2’-氟RNA探针(SEQ ID NO:17)的信号的进一步增加,这是由来自RNA探针和靶DNA的双链体上的RNA碱基的切割造成的。其他探针DNA(SEQ ID NO:16)、PNA(SEQ ID NO:10)、LNA(SEQ ID NO:9)和2’-O-甲基RNA(SEQ ID NO:32)不被RNase H2切割。
在以上反应条件下,在存在或不存在RNase H2的情况下也使用SEQ ID NO:24的2’-氟RNA探针检测艰难梭茵的靶序列的扩增。图4b示出了RNase H2对于从探针产生信号而言不是必需的。但是,RNase H2的存在进一步增强信号。
实施例5——通过基于链侵入的扩增和RNA寡核苷酸探针检测鼠伤寒沙门氏菌
使用2’-氟RNA探针(SEQ ID NO:30)检测低拷贝的靶DNA。在检测鼠伤寒沙门氏茵靶基因的试验中,在实施例1中所述的基于链侵入的扩增反应条件下纳入2’-氟RNA探针。用于扩增的正向引物、反向引物和链侵入寡核苷酸分别为SEQ ID NO:27、SEQ ID NO:28和SEQ ID NO:29。
通过使用系列稀释的105到10个拷贝的鼠伤寒沙门氏茵基因组DNA来评估所述测试的灵敏度。所述探针能够检测最小为10个拷贝的基因组DNA样品(图5)。无模板对照(NTC)未产生任何可检测的信号,证实了2’-氟RNA探针是高度特异性的。
实施例6——具有连接于3’端的猝灭剂的RNA寡核苷酸探针不作为聚合酶延伸的底物
设计上述RNA探针以与反向引物的下游区域重叠,所述探针因此可与反向引物竞争结合靶序列。使用实施例2中所述的人工系统来研究SEQ ID NO:17的探针是否能够作为引发DNA扩增的底物。图6a示出了所述探针由于存在连接于3’端的猝灭剂而不作为引物。靶序列的扩增仅在互补的反向引物(SEQ ID NO:12)的存在下发生。当单独使用所述探针而无同源的反向引物,或与非同源反向引物或假反向引物SPU R-引物(SEQ ID NO:33)一起使用所述探针时,未发生扩增。此外,在无反向引物的样品中,在存在RNase H2的情况下,未观察到扩增(图6b)。这表明所述探针在扩增过程中是惰性的并且仅参与靶扩增子的结合。
实施例7——具有双引物/探针功能的RNA寡核苷酸
使用实施例2中所述的人工系统研究了包含2’-氟RNA的寡核苷酸是否能够同时充当探针和引物(图7a)。SEQ ID NO:12的反向引物中的部分或全部天然DNA核苷酸被2’-氟RNA替换以产生SEQ ID NO:13和14的寡核苷酸。这些2’-氟RNA引物能够扩增人工靶DNA,其扩增效率与天然DNA反向引物一样好(图7b)。所述在3’端保留一些天然DNA碱基的2’-氟RNA引物(SEQ ID NO:14)的效率稍微更高一些。
然后,推断荧光团和猝灭剂可被添加到2’-氟RNA引物中以提供探针功能,只要3’端是游离的用于延伸靶序列。进一步假定这样的构象仍然对DNA结合蛋白对探针信号的干扰具有抗性,因此仍允许对扩增的特异性检测。用内部荧光团和5’猝灭剂(SEQ ID NO 19)标记所述2’-氟RNA引物。图7c示出了在基于链侵入的扩增反应中SEQ ID NO:19能够扩增并检测人工靶DNA(SEQ ID NO:20)。
实施例8——嵌合的DNA-RNA双标记探针对DNA结合蛋白的亲和力
研究了通过修饰天然DNA探针的序列以部分地掺入RNA或经修饰的RNA碱基而提供对DNA结合蛋白的抗性的能力。双标记探针、UvsX和T4-gp32的浓度与实施例1中所使用的那些相同。
图8示出了包含DNA和RNA(SEQ ID NO:35、36、37)碱基,或DNA和2’-氟RNA(SEQ ID NO:38、39、40)碱基,或DNA和2’-O-甲基RNA(SEQ ID NO:41、42、43)碱基的混合物的双标记探针也表现出对DNA结合蛋白UvsX和T4-gp32的抗性。由于添加UvsX或T4-gp32,结果显示为荧光增加的倍数。抗性的程度主要取决于存在于所述双标记探针中的RNA碱基的量。双标记探针对DNA结合蛋白的抗性随着探针中存在的RNA碱基的量的增加而增加。
用含有不同比例的DNA-RNA、DNA-2’-氟RNA和2’-O-甲基RNA的21碱基双标记探针孵育UvsX(图8a)。在所有的情况下,含有5个RNA或2’-氟RNA或2’-O-甲基RNA碱基和15个DNA碱基的21碱基双标记探针比仅含有DNA碱基的20碱基双标记探针对UvsX的抗性更强。采用T4-细茵噬茵体gp32(单链结合蛋白)进行了类似的实验(图8b)。同样,对DNA结合蛋白的抗性主要取决于双标记探针中存在的RNA碱基的量。含有5个RNA或2’-氟RNA或2’-O-甲基RNA碱基和15个DNA碱基的21碱基双标记探针足以表现出对T4-gp32的抗性。因此,嵌合的DNA-RNA或DNA-2’-氟-RNA或DNA-2’-O-甲基RNA双标记探针也适合用于包含DNA结合蛋白的反应。
进一步研究了嵌合探针中所包含的RNA碱基的数目与能够结合单链DNA的蛋白对探针信号的破坏的抗性之间的关系。图8c示出了采用包含不同比例的DNA-RNA的其他一系列21碱基双标记探针孵育UvsX的结果。图8d示出了采用相同系列的探针以及采用gp32孵育的结果。如实施例1中的描述进行测定。发现在DNA探针中至少约20%的碱基被RNA碱基取代(参见,例如,探针DNA 17+RNA 4)的情况下观察到对探针信号干扰的一致减少。
- 还没有人留言评论。精彩留言会获得点赞!