用于产生β-葡聚糖聚合物的方法及用于此方法的遗传修饰微生物与流程
背景技术:
已知β-葡聚糖是几种微生物(尤其是真菌和酵母)细胞壁中非常保守的成分。
大量密切相关的β-葡聚糖显示相似的分枝模式,如裂褶菌素、小核菌聚糖、pendulan、cinerian、昆布多糖、蘑菇多糖和pleuran,它们全都显示β-D-(1-3)-吡喃葡糖基(glucopyranosyl)单位的线性主链,单个β-D-吡喃葡糖基单位(1-6)连接至线性主链的β-D-吡喃葡糖基单位,平均分枝度为约0.3。
WO 2014/006088涉及能够产生聚合物的遗传修饰微生物,该聚合物由β-D-(1-3)-吡喃葡糖基单位的线性主链组成,具有(1-6)连接至线性主链的β-D-吡喃葡糖基单位的单个β-D-吡喃葡糖基单位,平均分枝度为约0.3,其特征在于,与对应的同一菌株的未修饰对照微生物相比,该遗传修饰微生物过量表达(i)编码具有1,3-β-D-葡聚糖合酶活性的多核苷酸和/或(ii)具有1,3-β-D-葡聚糖合酶活性的多肽。
WO 2010/123350涉及超过200种多肽的表达水平提高或降低的真菌或蘑菇。在实施例4中,描述了hom2基因敲除,其产生径向菌落生长而无蘑菇形成的表型。
发明详述
在第一实施方案中,本发明涉及用于产生聚合物的方法,该聚合物由β-D-(1-3)-吡喃葡糖基单位的线性主链组成,具有(1-6)连接至线性主链的β-D-吡喃葡糖基单位的单个β-D-吡喃葡糖基单位,平均分枝度为约0.3, 该方法包括步骤:
(i)在允许遗传修饰微生物产生聚合物的条件下,在培养基中培养能够产生该聚合物的该微生物,该聚合物由β-D-(1-3)-吡喃葡糖基单位的线性主链组成,具有(1-6)连接至线性主链的β-D-吡喃葡糖基单位的单个β-D-吡喃葡糖基单位,平均分枝度为约0.3,其中与同一菌株的未修饰对照微生物相比,该修饰赋予降低的hom2基因产物活性;
(ii)可选地从该培养基回收该聚合物。
hom2基因产物是由hom2基因编码的同源域蛋白。Ohm等2010,Genome sequence of the model mushroom Schizophyllum commune,Nature Biotechnology 28:957-963中描述了hom2基因产物的优选多肽序列(蛋白质ID 257987),其在SEQ ID NO:3中公开。
另一优选的hom2基因产物在SEQID NO:4中公开。
BLAST检索结果一般包含同源域蛋白。除同源框外具有同源序列的实例可见于灰盖鬼伞(Coprinopsis cinerea)、双色蜡蘑(Laccaria bicolor)、褐腐菌(Postia placenta)、干朽菌(Serpula lacrymans)、Phanerochaete carnosa、双孢蘑菇(Agaricus bisporus)中。
具有赋予降低的hom2基因产物活性的修饰的遗传修饰微生物应指通过内源或外源因子处理以最终降低对应的基因产物活性的微生物。
这可能在不同水平进行,例如在DNA水平、在RNA水平和在蛋白质水平。
在DNA水平,可以通过在微生物基因组中部分或完全缺失hom2基因来达到降低对应的基因产物活性。如果不存在hom2基因的其他等位基因或拷贝,则hom2的完全缺失(也称为敲除)可以导致hom2基因产物在该微生物中完全消失。在双核体中,完全缺失指两个核中hom2基因的双敲除。可以通过仅缺失hom2基因的片段(部分)或通过在携带其他hom2基因的基因组中仅缺失一个等位基因或拷贝来达到hom2基因的部分缺失。如果仅缺失hom2基因的片段,则取决于缺失片段的位置和/或长度,可能保持hom2基因产物的残余活性。但是,也可能通过部分缺失导致hom2基 因产物活性的完全消失,例如通过缺失导致翻译过程中移码的单个碱基对。
在RNA水平,也可能通过RNA干扰(RNAi)减少基因表达,可以通过其来抑制hom2基因的基因表达。这可以通过构建micro RNA(miRNA)或小干扰RNA(siRNA)来达到,其结合从hom2基因转录的mRNA,并抑制或破坏此mRNA。
在RNA水平,也可能通过使用遗传元件来减少基因表达,如弱或瞬时启动子、增强子、终止子和其他调节元件替换强或永久启动子、增强子、终止子和其他调节元件,其允许该基因的基因表达更低或仅瞬时表达。
另一种可能性是去稳定化各基因产生的RNA转录物,以实现每单位时间内可用于翻译的转录物数目的降低。
在蛋白质方面干扰的另一种可能性是基因的密码子选择。如果使用具有该微生物中的稀有密码子的密码子选择,则与未修饰微生物相比,产生更低的翻译速率,导致活性蛋白质减少。
在本发明的背景中,术语“遗传修饰微生物”应以广义理解;不仅“基因”和“遗传元件”(如启动子)为术语“遗传修饰微生物”所涵盖,通过使用紧密结合操纵子从而失活基因表达的分子(阻遏物)来阻遏基因调节也理解为本发明的遗传修饰微生物。
Hom2基因产物活性的降低是与未修饰微生物相比。这是指,除实现hom2基因产物活性降低的测量外,两种微生物(修饰和未修饰)都具有相同的遗传背景,且应在相同的生理条件下处理。例如,在裂褶菌(S.commune)中敲除hom2基因的情况下,未修饰参考生物应是除hom2基因敲除外具有相同的遗传背景且在与敲除生物相同的条件下处理的裂褶菌生物。
适合用作本发明的遗传修饰的起始生物的微生物的非限制性实例是以下属的微生物:裂褶菌属(Schizophyllum),尤其是裂褶菌(Schizophyllum commune);菌核属(Sclerotium),尤其是齐整小核菌(Sclerotium rolfsii)、Sclerotium glucanicum、翠雀小核菌(Sclerotium delphinii);小盘孔菌属(Porodisculus),尤其是悬垂小盘孔菌(Porodisculus pendulus);葡萄孢属(Botrytis),尤其是灰葡萄孢(Botrytis cinerea);昆布属(Laminaria),尤其是 昆布属物种(Laminaria sp.);Lentinula,尤其是Lentinula edoles;及链核盘菌属(Monilinia),尤其是果生链核盘菌(Monilinia fructigena)。
用于本发明方法的优选微生物是可从公共保藏中心获得的裂褶菌,例如:
DSM-1024、DSM-1025、DSM-1026、DSM-11223;
编号204191、编号MYA-2104、编号26890、编号26892、编号62873、编号38229;
编号32746、编号MYA-4819、编号52396;
编号MYA-1128、编号42093、编号18246;
编号MYA-1124、编号38230、编号26889;
编号26262、编号52398、编号MYA-1123。
在另一实施方案中,本发明涉及用于通过培养上文公开的任意遗传修饰微生物来产生上文公开的聚合物的方法。
本发明的遗传修饰微生物可以通过已知的重组DNA技术产生,如描述于例如Sambrook等,Molecular Cloning–A Laboratory Manual,Cold Spring Harbor Laboratory,Cold Spring Harbor,New York(1989)或Current Protocols in Molecular Biology 1-3卷,John Wiley&Sons,Inc.(1994-1998))中的重组DNA技术。用于构建遗传修饰微生物的其他实例在实验部分中公开。
用于培养微生物的方法如发酵方法为本领域已知,且还在本文中描述和示例(Kumari,Bioresource Technol(2008),99:1036-1043;Reyes,J Natural Studies(2009),7(2),1月-6月)。在本发明的背景中,这类方法允许各微生物生长,并产生本文所描述和示例的希望得到的β-葡聚糖。适宜的培养基可以包括例如Reyes,上文中所述的椰子水。此外,如本领域已知,存在几种尤其适合用于具体微生物的培养基。
例如,同样在本发明的背景中,适合用于培养裂褶菌的培养基包括CYM培养基(每升水25g琼脂(Difco)、20g葡萄糖(Sigma)、2g胰化酪蛋白胨(trypticase peptone,Roth)、2g酵母提取物(Difco)、0.5g MgSO4 x 7 H2O(Roth)、0.5g KH2PO4和1g K2HPO4(都来自Riedel-de))(尤其用于固体支持物上的培养),或也在本文中描述和示例的每升水包含30g葡萄糖(Sigma)、3g酵母提取物(Difco)、1g KH2PO4(Riedel-de)、0.5g MgSO4 x 7H2O(Roth)的培养基(尤其用于液体培养物)。
在本发明的背景中,术语“平均分枝度约0.3”可以指10个β-D-(1-3)-吡喃葡糖基单位中平均约有3个(1-6)链接至单个β-D-吡喃葡糖基单位。在此背景中,术语“约”可以指平均分枝度可以在0.1至0.5的范围内,优选0.2至0.4,更优选0.25至0.35,更优选0.25至0.33,更优选0.27至0.33,最优选0.3至0.33。它还可以是0.3或0.33。裂褶菌素、小核菌聚糖、pendulan、cinerian、昆布多糖、蘑菇多糖和pleuran全都具有0.25至0.33之间的平均分枝度;例如,小核菌聚糖和裂褶菌素具有0.3至0.33的平均分枝度(Survase,上文;Novak,上文)。β-葡聚糖的平均分枝度可以通过本领域已知的方法测定,例如通过定期氧化分析、甲基化糖分析和NMR(Brigand,Industrial Gums,Academic Press,New York/USA(1993),461-472)。
在本发明的一个实施方案中,要产生的聚合物选自裂褶菌素、小核菌聚糖、pendulan、cinerian、昆布多糖、蘑菇多糖和pleuran。例如,该聚合物可以是褶菌多糖或小核菌聚糖,尤其是裂褶菌素。
从发酵产物回收聚合物可以通过生物技术中已知的许多常规技术如沉淀和离心来进行。
用于制备β-葡聚糖的方法包括培养和发酵能够合成这类生物聚合物的微生物。例如,EP 271 907 A2、EP 504 673 A1和DE 40 12 238 A1公开了制备方法,即通过伴随搅拌和通气分批发酵真菌裂褶菌来实现制备。培养基主要包含葡萄糖、酵母提取物、磷酸二氢钾、硫酸镁和水。EP 271 907 A2描述了用于分离多糖的方法,其中首先离心培养物悬液,并用异丙醇从上清沉淀多糖。第二种方法包括加压过滤后超滤所获得的溶液,方法详情未公开。“Udo Rau,“Biosynthese,Produktion und Eigenschaften von Pilz-Glucanen”,Habilitationsschrift,Technical University of Brunswick,1997,70至95页”和"Udo Rau,Biopolymers,Editor A.Steinbüchel,6卷,63至79页,WILEY-VCH Publishers,New York,2002"描述了通过连续或分批发酵制备裂褶菌素。“GIT Fachzeitung Labor 12/92,1233-1238页”描述了用细胞再循环制备分枝的β-1,3-葡聚糖。WO 03/016545 A2公开了用齐整小核菌制备小核菌聚糖的连续方法。
此外,出于经济原因,β-葡聚糖水溶液的浓度应尽可能高,以确保用于将葡聚糖水溶液从生产地点运输至使用地点的运输工作(effect)尽可能小。为了此目的,通常在运输前通过干燥、冷冻干燥和/或沉淀来浓缩β-葡聚糖溶液,以减小其重量。
与对应的未修饰对照微生物相比,本发明的遗传修饰微生物能够产生至少1.5倍、更优选至少多1.8倍、更优选至少多2.0倍和最优选至少多2.2倍的β-葡聚糖聚合物。在此背景中,产生例如“多”1.5倍的β-葡聚糖聚合物可以指,与对应的未修饰对照微生物在相同条件下在相同时间内产生的β-葡聚糖聚合物的量相比,遗传修饰微生物产生的β-葡聚糖聚合物的量高1.5倍。备选地,产生例如“多”1.5倍的β-葡聚糖聚合物可以指,遗传修饰微生物在相同条件下产生与对应的未修饰对照生物相同量的β-葡聚糖聚合物,但快1.5倍。产生的β-葡聚糖聚合物的量可以通过本领域已知且还在本文中描述的方法来测量。
实验部分
表1.所用菌株
用于实施例1的菌株和培养条件
双核裂褶菌菌株(表1)从点接种起在基本培养基(MM)琼脂(1.5%)平板上25℃避光培养7天(Dons JJM等(1979).Characterization of the genome of the basidiomycete Schizophyllum commune.Biochimica et Biophysica Acta 563:100-112.)。在韦林搅切器中在50ml液体MM中全速匀浆1/4个菌落30秒。在250ml锥形瓶中25℃和200转/分钟避光孵育50ml匀浆。24小时后,匀浆预培养物(参见上文),并将2ml离心。弃上清,测定沉淀的湿重。据此,计算包含0.2g湿重菌丝体的匀浆体积。使用MM和250ml锥形瓶,用此体积接种100ml液体震荡培养物。培养物按一式三份或甚至更多重复在25℃和200转/分钟避光培养。
用于实施例2的菌株和培养条件
双核菌株H4-8和Δhom2Δhom2从点接种起在MM琼脂平板上避光培养7天。从这些菌落的中央区带切下2×3cm2的小片。尽可能多地去除琼脂,用T 25数字ULTRA-TURRAX(IKA)按6,000转/分钟在15ml DHSV培养基(33g l-1一水合葡萄糖、0.5g l-1 MgSO4·7H2O、0.9g l-1 KH2PO4、0.1g l-1 K2HPO4、0.5g l-1柠檬酸、50g l-1尿素、pH 5.8。在这其中补充孢子元素:20mg l-1 FeSO4·7H2O、50mg l-1 Titriplex III(Merck Millipore)、1mg l-1 ZnSO4·7H2O、0.3mg l-1 MnSO4·4H2O、3mg l-1 H3BO3、2mg l-1CoCl2·6H2O、0.1mg l-1 CuCl2·2H2O、0.2mg l-1 NiCl2·6H2O、0.3mg l-1Na2MoO4·2H2O;及维生素:0.0105mg l-1生物素、0.0045mg l-1叶酸、2.31mg l-14-氨基苯甲酸、0.18mg l-1核黄素、0.825mg l-1泛酸钙、1.8mg l-1烟酰胺、0.135mg l-1盐酸吡哆醇、4.2mg l-1肌醇、1.605mg l-1盐酸硫胺素)中匀浆菌丝体1分钟。用2.5ml匀浆接种每个菌株的2瓶50ml预培养物。为此,在100ml锥形瓶中加入50ml DHSV培养基。培养物在30℃和180转/分钟避光培养72小时。将培养物9,935g离心10分钟,混合每个菌株的沉淀。收集上清,按上文所述测量葡萄糖和葡聚糖。在25ml DHSV中再次匀浆混合的沉淀(参见上文)。使用100ml锥形瓶,用2.5ml匀浆接种50ml DHSV培养物。培养物按一式三份在30℃和180转/分钟避光培养3、8或10天。
用于实施例1的培养基的黏度
通过5,000g离心10分钟或在Miracloth上过滤来收集培养基。加入甲酸(4g l-1终浓度)以稳定培养基,并测量黏度。为此,用培养基装满在其喷嘴处附着Greiner Bio One蓝吸头(1000μl)的10ml BD Plastipak注射器。用8ml流体流出注射器(培养基的上部水平从10ml标记位置至2ml标记位置)所耗费的时间作为黏度的测量。此方法与HAAKE Rheostress 1 Rotational Rheometer 1(Thermo Fischer)测量结果相关。测量结果以超过0.95的皮尔逊相关系数相关。
实施例1和/或2的葡聚糖、尿素、乙醇和生物量测量
为了测定SPG产生,将10ml培养物吸入50ml离心管(Falcon tube),用3g l-1ACTICIDE BW20(Thor)稳定,并用10ml l-1来自绳状青霉NS(Penicillium funiculosum NS)的Submers β-葡聚糖酶在40℃处理24小时。3,400g离心30分钟后,以5mM H2SO4(Roth)作为洗脱液,按0.5ml/分钟流速在30℃运行,用HPLC阳离子交换(Aminex HPX-87H,Bio-Rad)测量上清中的乙醇和葡萄糖浓度。培养基中的尿素浓度也通过HPLC测量。为此,用水作为洗脱液,按1ml/分钟流速在70℃运行,使用100×7.8mm(Biorad)快速糖柱。
为了测定培养物中产生的生物量,将3,400g离心30分钟(参见上文)后获得的沉淀重悬在30ml H2O中,并剧烈震荡。3,400g离心30分钟后,再次通过震荡将沉淀悬浮在30ml H2O中,并放置在Whatman滤纸上,用50ml水漂洗两次,然后真空干燥。用Mettler Toledo HB43-S卤素水分分析仪进一步干燥并称重样品。扣除滤纸的重量(在将菌丝体放置在滤纸上之前测定)。
实施例1
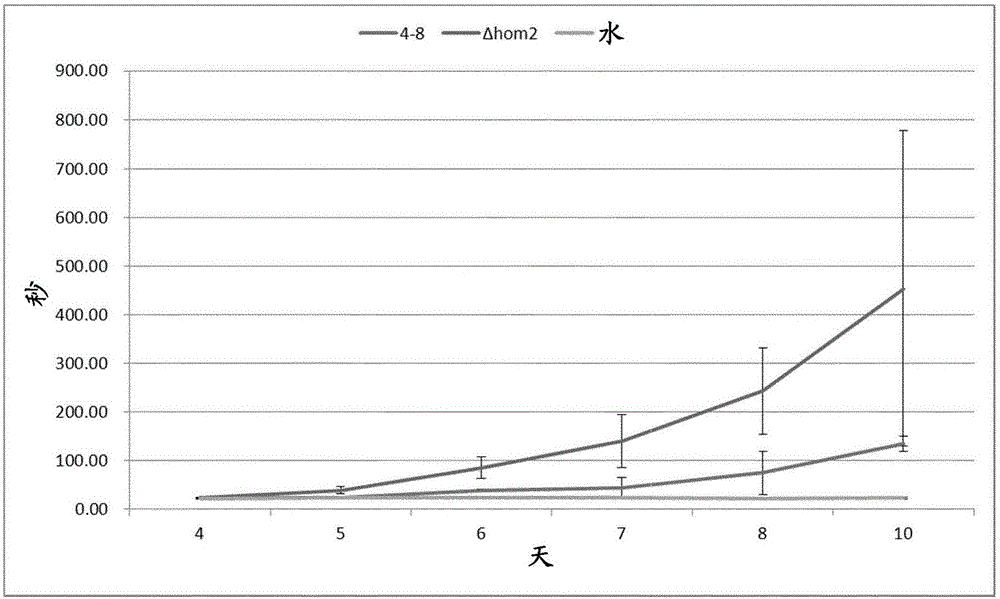
在10天的培养期期间测量野生型H4-8×H4-8b双核体及其衍生的Δhom2Δhom2菌株的液体震荡培养物的黏度。如分别通过培养基流出注射器的流速降低(图1)及通过旋转流变仪1(图2)所显示,从第5天和第6天起,与野生型相比,Δhom2Δhom2菌株的培养基的黏度更高。培养基的黏 度与通过葡聚糖分析获得的SPG产生相关。为此,对培养物进行葡聚糖酶降解,并通过HPLC分析定量所产生的葡萄糖(图3)。分别在培养Δhom2Δhom2菌株和野生型菌株8天和10天后检测葡聚糖酶活性的葡萄糖释放。10天后,Δhom2Δhom2菌株中的葡萄糖水平高5倍。概括而言,如通过黏度和葡聚糖酶实验所显示,Δhom2Δhom2菌株产生更多的SPG。
还测量了ΔWC2ΔWC2和Δfst4Δfst4菌株及两个补偿Δhom2Δhom2菌株的培养基的黏度(图4、5)。全部四个菌株的培养基的黏度与野生型菌株培养基的黏度没有显著不同。概括而言,这些数据确认,Hom2的缺乏增加裂褶菌素产生。相反,虽然有这些菌株像Δhom2Δhom2菌株一样不能产生子实体的事实,但Fst4和WC2的缺乏不影响SPG产生。
实施例2
定量Δhom2Δhom2和野生型裂褶菌双核体的3、8和10天培养物中的黏度、葡聚糖、葡萄糖(作为碳源加入)、尿素、乙醇和生物量(图6、7和8)。如通过流变仪所测量,在第8和10天,Δhom2Δhom2菌株的培养基比野生型的培养基更黏(图6)。培养10天后,与野生型菌株相比,Δhom2Δhom2菌株中通过葡聚糖释放的葡萄糖的量显著更高(图7)。Δhom2Δhom2菌株在第8天时显示更少的乙醇产生(与野生型有2倍差异),且此代谢物在10天后甚至缺乏(图8)。相反,野生型在第8-10天具有超过2倍量的乙醇(图8)。在第10天,在Δhom2Δhom2双核体的情况下葡萄糖和尿素完全消耗,但野生型的情况并非这样(图8)。与野生型相比,Δhom2Δhom2菌株中每生物量的SPG的产率高20%(图9)。但是,Δhom2Δhom2菌株产生每葡萄糖比野生型多3.7倍的SPG。我们得出结论,与亲本相比,在产生SPG中,裂褶菌Δhom2双核体更优。
附图简述
图1.通过通过注射器的流速测量的裂褶菌的野生型和Δhom2Δhom2双核体的液体震荡培养物的培养基的黏度。
图2.裂褶菌的野生型和Δhom2Δhom2双核体的液体震荡培养物的培养基的黏度(mPa·s)。使用与图1中相同的样品,用流变仪测量黏度。
图3.来自裂褶菌的野生型和Δhom2Δhom2双核体的液体培养物的培养基的葡聚糖分析。通过测量源自葡聚糖酶处理的葡萄糖释放来定量葡聚糖。样品与图1和2的样品相同。
图4.双核野生型菌株H4-8×H4-8b及双核敲除菌株Δhom2Δhom2、ΔWC2ΔWC2和Δfst4Δfst4的10天液体培养物中每克生物量的SPG产生。
图5.双核野生型菌株H4-8×H4-8b、双核敲除菌株Δhom2Δhom2及在亲本核之一中再引入hom2的两个补偿Δhom2Δhom2菌株的10天液体培养物中每克生物量的SPG产生。
图6.裂褶菌的野生型和Δhom2Δhom2双核体的液体震荡培养物的培养基的黏度(mPa·s)。用流变仪测量黏度。
图7.来自裂褶菌的野生型和Δhom2Δhom2双核体的液体培养物的培养基的葡聚糖分析。通过测量源自葡聚糖酶处理的葡萄糖释放来定量葡聚糖。样品与图6的样品取自相同的培养物。
图8.裂褶菌的野生型和Δhom2Δhom2双核体的液体震荡培养物的培养基中的葡萄糖、尿素和乙醇水平。样品与图6的样品相同。
图9.裂褶菌的双核野生型菌株及其衍生的Δhom2Δhom2菌株的每生物量(克/克)和每葡萄糖(克/克)的SPG产率。
SEQ ID NO:1是用于实验部分的来自裂褶菌的hom2基因的多核苷酸序列。
SEQ ID NO:2是与SEQ ID NO:1中公开的序列略有不同的来自裂褶菌的hom2基因的多核苷酸序列。
SEQ ID NO:3是从SEQ ID NO:1翻译的来自裂褶菌的hom2基因的多肽序列。
SEQ ID NO:4是从SEQ ID NO:2翻译的来自裂褶菌的hom2基因的多肽序列。
参考文献
Dons JJM,de Vries OMH,Wessels JGH(1979).Characterization of the genome of the basidiomycete Schizophyllum commune.Biochimica et Biophysica Acta 563:100-112.
Niederpreum DJ,Marshall C,Speth JL(1977).Control of extracellular slime accumulation in monokaryons and resultant dikaryons of Schizophyllum commune.Sabouraudia 15:283-295.
Ohm RA,de Jong JF,Lugones LG,Aerts A,Kothe E,Stajich JE,de Vries RP,Record E,Levasseur A,Baker SE,Bartholomew KA,Coutinho PM,Erdmann S,Fowler TJ,Gathman AC,Lombard V,Henrissat B,Knabe N,Kües U,Lilly WW,Lindquist E,Lucas S,Magnuson JK,Piumi F,Raudaskoski M,Salamov A,Schmutz J,Schwarze FWMR,vanKuyk PA,Horton JS,Grigoriev IV,HAB(2010a).Genome sequence of the model mushroom Schizophyllum commune.Nature Biotechnology 28:957-963.
Ohm RA,de Jong JF,Berends E,Wang F,HAB,Lugones LG(2010b).An efficient gene deletion procedure for the mushroom-forming basidiomycete Schizophyllum commune.World Journal of Microbiology&Biotechnology 10:1919-1923.
Ohm RA,de Jong JF,de Bekker C,HAB,Lugones LG(2011).Transcription factor genes of Schizophyllum commune involved in regulation of mushroom formation.Molecular Microbiology 81:1433-1445.
Ohm RA,Aerts D,HA,Lugones LG(2013).The blue light receptor complex WC-1/2 of Schizophyllum commune is involved in mushroom formation and protection against phototoxicity.Environmental Microbiology 15:943-955.
- 还没有人留言评论。精彩留言会获得点赞!