新的二元有机酸生产菌株及其制备和应用的制作方法
本发明涉及生物技术和生物工程领域。具体地,本发明涉及一种新的生产二元有机酸的工程菌,以及利用其制备二元有机酸的方法。
背景技术:
鉴于石油基化学品或燃料需求的飞速增长,以及它们日益升高的成本,同时考虑到地缘政治的不稳定对原油价格的影响以及温室气体排放对全球气候的影响,急需开发一种可再生、可持续的绿色新型工艺来生产这些石油基化学品或燃料。这些因素都大大的促进了利用来源于储量巨大的生物质来生产化学品或燃料的研究,尤其是非粮可再生资源为原料的应用(第二代生物炼制)。
目前,生物质利用的常用工艺多分为生物质预处理、酶解和发酵三个部分。其中预处理过程仍需要高温、高压、酸碱处理等高能耗、高污染工艺。另外,尽管纤维素水解酶的产量已经达到100g/L以上水平,但酶解中所应用的纤维素酶的成本仍然过高,而且在整个工艺成本中占有极大比重,不符合工业大规模生产的基本要求。在实际应用过程中,生物质基产品的生产工艺更绿色、更可持续、更符合现代工业发展的趋势,但其生产成本远远高于石油基产品,经济因素严重地制约着生物炼制产业的发展。
有机二元酸,以苹果酸为例,传统生产基于石油基材料化工催化合成,生产的产品为DL-苹果酸,限制了其在医药和食品行业的应用,需通过光学拆分来得到L-苹果酸,以微生物发酵生产单一旋光性的L-苹果酸受到人们广泛关注和高度重视。
目前,苹果酸发酵仍存在着不少问题,例如苹果酸所需的发酵温度低,常规发酵过程由于产热过多,因此需要在冷却后才能继续发酵反应,这不仅制约了发酵效率,而且对能源也造成了浪费;又如,底物是葡萄糖,成本较高,而廉价的底物并不能获得生产量的苹果酸。
因此,本领域迫切需要开发一种利用廉价底物就能有效获得有机二元酸,尤其是苹果酸的方法。
技术实现要素:
本发明提供了一种新的用于高产率合成二元有机酸的工程菌株及其制备方法和应用。
本发明第一方面,提供了一种遗传改造的用于二元有机酸合成的工程菌株,所述的工程菌株在25-60℃的发酵温度下,以聚糖和/或植物生物质为底物发酵获得二元有机酸,
其中,所述工程菌株的出发菌株为毁丝酶属菌株(Myceliophthora);
且所述的二元有机酸包括苹果酸、琥珀酸、富马酸。
在另一优选例中,所述的二元酸还包括草酰乙酸、戊二酸、己二酸。
在另一优选例中,所述的底物还包括单糖、多糖或其组合。
在另一优选例中,所述的工程菌株导入了外源性二元有机酸合成正调控基因,和/或下调了二元有机酸合成负调控基因,且所述的工程菌株与其出发菌株相比,二元有机酸生产能力显著提高。
在另一优选例中,所述的聚糖包括纤维素、结晶纤维素、半纤维素、淀粉(优选为玉米,木薯,小麦)或其组合;
所述的植物生物质包括农作物秸秆、林业废弃物、能源植物或其部分或全部分解产物;其中,所述农作物秸秆包括玉米秸秆,小麦秸秆,水稻秸秆,高粱秸秆,大豆秸秆,棉花秸秆,甘蔗渣,玉米芯;所述林业废弃物包括枝叶,锯末;所述能源植物包括甜高粱,柳枝稷,芒草,芦苇或其组合。
在另一优选例中,所述的底物仅含有聚糖和/或植物生物质。
在另一优选例中,所述的发酵温度是40-55℃、较佳地45-53℃、更佳地48-50℃。
在另一优选例中,所述的二元有机酸为苹果酸。
在另一优选例中,所述的二元有机酸为C4-C6的二元酸。
在另一优选例中,所述的二元有机酸生产能力为工业生产级。
在另一优选例中,所述工程菌株的毁丝霉属菌株包括嗜热毁丝霉(Myceliophthora thermophila),或异梭毁丝霉(Myceliophthora heterothallica);优选为嗜热毁丝霉。
在另一优选例中,所述出发菌株基因组中之间,每个相应的二元有机酸合成正和/或负调控基因具有至少92%,较佳地至少95%,更佳地至少98%、99%的同源性。
在另一优选例中,所述的显著提高是指,工程菌株与其野生型相比,二元有机酸发酵产量按每升发酵液的体积计,至少超过10克/升,较佳地至少10-50克/升;更佳地,至少50-300克/升;和/或
所述的显著提高是指,所述工程菌株与其野生型相比,二元有机酸生产能力增强或提高了至少10%;较佳地至少10-50%;更佳地,至少50%-500%。
在另一优选例中,所述的正调控基因的表达产物包括一种或多种选自下组的多肽或其衍生多肽:天冬氨酸氨基转移酶、谷氨酸-天冬氨酸转运蛋白;和/或
所述的负调控基因的表达产物包括一种或多种选自下组的多肽或其衍生多肽:琥珀酰辅酶A合酶、苹果酸-α酮戊二酸转运蛋白。
在另一优选例中,所述的天冬氨酸氨基转移酶如SEQ ID NO.:4所示。
在另一优选例中,谷氨酸-天冬氨酸转运蛋白如SEQ ID NO.:6所示。
在另一优选例中,苹果酸脱氢酶如SEQ ID NO.:10所示。
在另一优选例中,琥珀酰辅酶A合酶如SEQ ID NO.:2所示。
在另一优选例中,苹果酸-α酮戊二酸转运蛋白如SEQ ID NO.:8所示。
在另一优选例中,所述的工程菌株同时导入了外源性二元有机酸合成正调控基因,并下调了二元有机酸合成负调控基因。
在另一优选例中,所述的正调控基因表达产物还包括一种或多种选自下组的多肽或其衍生多肽:C4-二羧酸转运蛋白、丙酮酸羧化酶、苹果酸脱氢酶或其组合。
在另一优选例中,所述的工程菌株通过以下方法获得:
向出发菌株中导入外源性二元有机酸合成正调控基因;和/或下调出发菌株中 二元有机酸合成负调控基因。
在另一优选例中,所述的多肽或其衍生多肽选自下组:
(I)SEQ ID NO.:2、4、6、8、10、12、14、16、18、20、22、或26所示的序列的一种或多种;
(II)将SEQ ID NO.:2、4、6、8、10、12、14、16、18、20、22、或26所示的序列经一个或几个氨基酸的缺失、添加或取代而形成的、能使工程菌株具有二元有机酸生产能力的一种或多种由(I)衍生的多肽;和
(III)氨基酸序列与SEQ ID NO.:2、4、6、8、10、12、14、16、18、20、22、或26所示序列的同源性≥90%(较佳地≥95%、更佳地≥98%)、能使工程菌株具有二元有机酸生产能力的一种或多种多肽。
在另一优选例中,编码所述多肽或其衍生多肽的多核苷酸序列包括:
(i)编码SEQ ID NO.:2、4、6、8、10、12、14、16、18、20、22、或26所示序列的多核苷酸;
(ii)SEQ ID NO.:1、3、5、7、9、11、13、15、17、19、21、或25所示序列的多核苷酸;或
(iii)核苷酸序列与SEQ ID NO.:1、3、5、7、9、11、13、15、17、19、21、或25所示序列的同源性≥95%(较佳地≥98%)的多核苷酸;或
(iv)如SEQ ID NO.:1、3、5、7、9、11、13、15、17、19、21、或25所示多核苷酸的5’端和/或端截短或添加1-60个(较佳地1-30,更佳地1-10个)核苷酸的多核苷酸;
(v)与(i)-(iv)的任一序列互补的多核苷酸。
在另一优选例中,导入了外源性二元有机酸合成正调控基因的工程菌株与其出发菌株(野生型)相比,所述的正调控基因在工程菌株中的表达量至少提高了50%,更佳地,至少提高了60%、70%、80%、90%、或100%。
在另一优选例中,下调了二元有机酸合成负调控基因的工程菌株与其出发菌株(野生型)相比,所述的负调控基因在工程菌株中的表达量至少降低了50%,更佳地,至少降低了60%、70%、80%、90%、或100%。
本发明第二方面,提供了一种制备二元有机酸的方法,包括步骤:
(i)提供本发明第一方面所述的工程菌株;
(ii)在底物的存在下,培养(i)中所述的工程菌株,从而获得含二元有机酸的发酵产物,其中所述培养的温度25-60℃;和,任选地
(iii)从(ii)中获得的发酵产物进行分离纯化,从而进一步获得二元有机酸;
其中,所述的底物包括聚糖和/或植物木质素。
在另一优选例中,所述工程菌株的培养温度为40-55℃,较佳地,为45-52℃,更佳地,为48-50℃。
在另一优选例中,所述的底物为纤维素、半纤维素、淀粉、植物生物质。
在另一优选例中,所述的底物还包括多糖、单糖或其组合。
在另一优选例中,所述的多糖包括蔗糖,麦芽糖,纤维二糖,纤维寡糖,木二糖,木寡糖或其组合。
在另一优选例中,所述的单糖包括葡萄糖,木糖,阿拉伯糖或其组合。
本发明第三方面,提供了一种制备本发明第一方面所述工程菌株、和/或赋予或增强毁丝霉属菌株二元有机酸生产能力的方法,包括步骤:
向出发菌株中导入外源性二元有机酸合成正调控基因;和/或下调出发菌株中二元有机酸合成负调控基因,从而制备本发明第一方面所述的工程菌株、和/或使毁丝霉属菌株合成二元有机酸。
在另一优选例中,所述的方法包括步骤:
(a1)提供携带外源性二元有机酸合成正调控基因的表达载体;
(b1)将所述的表达载体转入宿主细胞中;
(c1)培养所述的宿主细胞;和/或
所述的方法包括步骤:
(a2)敲除宿主细胞中二元有机酸合成负调控基因;
(b2)培养所述的宿主细胞。
本发明第四方面,提供了二元有机酸生产调控基因的表达产物的组合,所述表达产物的组合含有至少两种选自下组的多肽:
(Ia)SEQ ID NO.:4、6、10所示的序列或其组合;或
(IIa)将SEQ ID NO.:4、6、10所示的序列经一个或几个氨基酸的缺失、添加或取代而形成的、能赋予和/或提高毁丝霉属菌株二元有机酸生产能力的由(Ia)衍生的多肽或其组合;和任选的
(Ib)SEQ ID NO.:12、14、16、18、20、22、或26所示的序列或其组合;
(IIb)将SEQ ID NO.:12、14、16、18、20、22、或26所示的序列经一个或几个氨基酸的缺失、添加或取代而形成的、能赋予和/或提高毁丝霉属菌株二元有机酸生产能力的由(Ib)衍生的多肽。
在另一优选例中,所述的组合至少包括SEQ ID NO.:4和6所示的序列。
在另一优选例中,所述的组合至少包括SEQ ID NO.:6和10所示的序列。
在另一优选例中,所述的组合至少包括SEQ ID NO.:4和10所示的序列。
本发明第五方面,提供了二元有机酸生产调控基因组合,所述的基因组合含有至少两种分别编码本发明第四方面所述表达产物组合中的表达产物的多核苷酸。
本发明第六方面,提供了一种载体,所述的载体含有本发明第四方面所述基因组合,和/或所述的载体含有抑制二元有机酸生产负调控基因的抑制剂。
在另一优选例中,所述的抑制剂为二元有机酸生产负调控基因(如琥珀酰辅酶A合酶)的干扰RNA、或反义核酸。
在另一优选例中,所述的干扰RNA序列如SEQ ID NO.:74、75所示。
在另一优选例中,所述的载体为一个或多个。
本发明第七方面,提供了一种宿主细胞,所述的宿主细胞具有选自下组的特征:
(a1)含有本发明第一方面0所述的载体;
(b1)所述的宿主细胞的染色体整合有外源的编码SEQ ID NO.:4、6、10所示的多肽的多核苷酸;或所述的宿主细胞的染色体中编码SEQ ID NO.:2、和/或8所示多肽的基因被敲除或减弱;和任选地
所述的宿主细胞的染色体整合有一种或多种选自SEQ ID NO.:4、6、10、12、14、16、18、20、22、或26所示的多肽的多核苷酸。
在另一优选例中,所述的宿主细胞为本发明第一方面所述的工程菌株。
在另一优选例中,所述的宿主细胞为毁丝霉属菌株,较佳地为嗜热毁丝霉。
本发明第八方面,提供了本发明第四方面所述组合的用途,用于在赋予或增强毁丝霉属菌株二元有机酸生产能力。
在另一优选例中,所述“赋予”或“增强”二元有机酸生产能力指的是经过改造后,原先不具备二元有机酸生产和/或积累能力的菌株具有了二元有机酸工业化生产能力,和/或院系二元有机酸生产和/或积累能力较差的菌株具有了增强的二元有机酸工业化生产能力。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1为mae基因表达载体pAN52-mae的物理图谱。
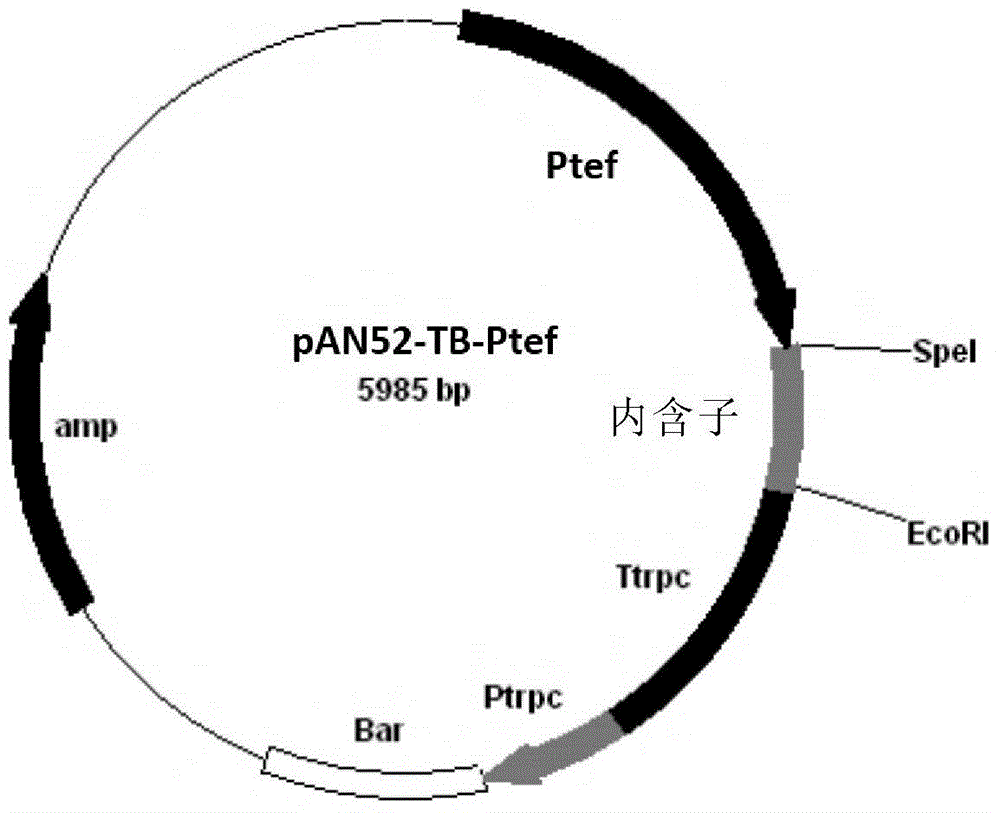
图2为表达载体pAN52-TB-Ptef的物理图谱。
图3为mae基因与pyc基因共表达载体pAN52-mae-pyc的物理图谱。
图4为mdh基因表达载体pAN52-mdh的物理图谱。
图5为双元载体pAN52-SCLsilent-A的物理图谱。
图6为双元载体pAN52-SCLsilent-B的物理图谱。
图7为敲除载体pPK2sur-barGFP::odc的物理图谱。
图8为质粒pMF272的物理图谱。
图9为不同菌株以结晶纤维素为碳源时第八天时苹果酸产量图。
图10为M.thermophila过表达不同C2-二羧酸转运单边时苹果酸产量图。
具体实施方式
本发明经过广泛而深入的研究,首次意外地发现了一组能够对丝状真菌尤其是毁丝霉属菌株(例如嗜热毁丝霉)生产或合成二元有机酸的调控基因。其中,具有正调控作用的基因包括天冬氨酸氨基转移酶、谷氨酸-天冬氨酸转运蛋白、苹果酸脱氢酶、C4-二羧酸转运蛋白,丙酮酸羧化酶,或其组合,具有负调控作用的基因包括琥珀酰辅酶A合酶、苹果酸-α酮戊二酸转运蛋白或其组合。发明人还通过实验证实,经过上调一种或多种所述正调控基因和/或下调一种或多种所述负调控基因的遗传改造工程菌株,能够赋予原先不具备二元酸生产能力的菌株具备能够有效地利用聚糖或植物生物质这些普通菌株无法利用的发酵底物,并在普通菌株无法耐受的高温下高产率地合成出二元有机酸。此外,发明人还通过实验证实,这种调控作用具有相对的菌株种属特异性。在此基础上,完成了本发明。
二元有机酸
如本文所用,术语“二元有机酸”指的是每个分子在水中能且只能电离出两个氢离子的有机酸。可用于本发明的二元有机酸包括C4-C6的二元有机酸,优选为C4-C5的二元有机酸,例如苹果酸、琥珀酸、富马酸、草酰乙酸,戊二酸,或己二酸。优选地,本发明所述的二元有机酸包括苹果酸、琥珀酸。
以苹果酸为例,L-苹果酸是一种重要的天然有机酸,广泛用于食品、饮料、香料、医药保健、化工、塑料等行业。在食品工业中,L-苹果酸可作为酸味调节剂、 食品保鲜剂、食品除腥脱臭剂、面食强化剂等,在医药行业中,可添加在药物注射液、制剂、片剂、糖浆中添加L-苹果酸,有助于提高药物的利用率。在日用化工领域,可用做除臭剂和洗涤剂成分等。苹果酸在有机酸工业中具有重要的地位和作用,近年来国际市场对苹果酸的需求量快速增加,市场前景广阔。
传统的苹果酸生产基于石油基材料化工催化合成,生产的产品为DL-苹果酸,限制了其在医药和食品行业的应用,需通过光学拆分来得到L-苹果酸,以微生物发酵生产单一旋光性的L-苹果酸受到人们广泛关注和高度重视。
本发明“有机酸生产能力”指的是工业化的有机酸生产能力,即等同于术语二元有机酸的“工业生产级”、“工业化潜力”、“工业生产能力”、“有机酸生产能力”可互换使用,指的是发酵液的总体积计,发酵产量至少为10克/升,较佳地至少15-40克/升;更佳地,至少50-300克/升,以及在此范围中的任意整数和非整数值,在此不再一一例举。
对于苹果酸等有机酸发酵,传统优势菌株为曲霉属菌株。此外,还有些传统有机酸的优势菌株包括但不限于:柠檬酸-黑曲霉,苹果酸-黄曲霉、米曲霉,乳酸-米根霉。但毁丝霉属并不属于常见积累有机酸菌株,本发明试验表明,对天然条件下没有明显有机酸积累(通常不大于克级/升)的菌株(比如粗糙脉孢霉,里氏木霉)而言,通过改造其有机酸(比如苹果酸)合成途径,并不能有效提高其产量至潜在工业化能力(10克/升或以上),然而在不积累有机酸的菌株中,毁丝霉菌株(嗜热毁丝霉,异梭毁丝霉),经过基因改造显著提高了有机酸(苹果酸)合成能力(10克/升或以上),是非常令人意外的。
底物
如本文所用,术语“底物”和“碳源”可互相替代使用,为可在丝状真菌存在下产生二元有机酸的糖类物质,包括单糖、多糖、聚糖、以及植物生物质或其组合,其中术语“单糖”包括但不限于葡萄糖、木糖、阿拉伯糖或其组合;“多糖”包括但不限于蔗糖、纤维二糖、纤维寡糖、木二糖、木寡糖或其组合,其中“聚糖”包括但不限于纤维素,半纤维素、或其组合等;植物生物质包括但不限于农作物秸秆、林业废弃物、能源植物或其组合等。优选的底物的例子如下所述:
葡萄糖,木糖和阿拉伯糖是三种重要的单糖。葡萄糖(Glucose)(化学式C6H12O6)又称为玉米葡糖、玉蜀黍糖,简称为葡糖。是自然界分布最广且最为重要的一种单糖,葡萄糖在生物学领域具有重要地位,是活细胞的能量来源和新陈代谢中间产物,即生物的主要供能物质。在糖果制造业和医药领域有着广泛应用。工业上可以通过玉米,木薯等为原料大量制备。
木糖是一种五碳戊糖,是半纤维素组成的主要单糖,因此,木糖也广泛的存在于玉米的穗轴、秸秆、棉桃的外皮等农产品废弃部分中。可以由植物生物质中半纤维素水解而来。
阿拉伯糖又称果胶糖,常与其他单糖结合,以杂多糖的形式存。阿拉伯糖在玉米皮、玉米棒芯、稻子、麦子等谷类以及甜菜、苹果等植物细胞壁的半纤维素和果胶质中。木糖和阿拉伯糖是生物质降解或预处理后获得的最主要的五碳糖,微生物通常情况下难以利用,也是生物质全糖利用的困难所在。
蔗糖,纤维二糖和木二糖是三种重要的二糖。蔗糖是光合作用的主要产物,广泛分布于植物体内,特别是甜菜、甘蔗和水果中含量极高。蔗糖由一分子葡萄糖 和一分子果糖脱水缩合形成.被广泛应用于生物发酵行业的二糖,是多种制品的原料,如酒精、柠檬酸、乳酸、甘油、醇类、药品等。而纤维二糖是纤维素组成的单元,可由纤维素降解而来,可进一步水解为两分子葡萄糖。木二糖是2个木糖由β-1,4-糖苷键连接而成的木寡糖,是一种直链二糖。可由半纤维素水解而来,可进一步分解为两个木糖。
纤维寡糖和木寡糖是两种重要的寡糖。纤维寡糖通常是指由葡萄糖通过β-1,4糖苷键相连而成的低聚糖。木寡糖亦为低聚木糖,是由2-7个D-木糖通过β-1,4-糖苷键结合而成的低聚糖,部分还可能含有阿拉伯糖、葡萄糖醛酸等侧链。木二塘、木寡糖、纤维寡糖、纤维二糖主要由植物纤维素(玉米芯、小麦麸皮、甘蔗渣等)中的纤维素、半纤维素水解后生成的产物。
植物生物质是自然界通过光合作用合成的有机分子组合,主要包括纤维素,半纤维素和木质素。各类农作物和能源植物秸秆(玉米秸秆,小麦秸秆,水稻秸秆,高粱秸秆,甘蔗渣,芒草等),林业废弃物(锯末,树枝树叶)等都属于重要的生物质资源。在一定条件下,可以降解为聚糖(如木聚糖,葡聚糖),寡糖,单糖被部分微生物发酵利用。开发可利用生物质水解产物甚至直接利用简单预处理的生物质为碳源,发酵生产化工产品(乙醇,有机酸等)是国内外重要研发内容。
二元有机酸合成调控基因及其表达产物
如本文所用,术语“二元有机酸合成调控基因”、“本发明多肽编码多核苷酸”可互换使用,包括了“二元有机酸合成正调控基因和负调控基因。其中,术语“二元有机酸合成正调控基因”、“正调控基因”、“过表达基因”可互换使用,指的是在毁丝霉菌中,能够对二元有机酸合成具有促进或提高作用的正向基因,而术语“二元有机酸合成负调控基因”、“负调控基因”指的是在丝状真菌中能够对二元有机酸合成具有抑制或降低作用的负向基因,对其中,经遗传改造高表达或过表达正调控基因、或低表达或敲除负调控基因,能够使改造后的菌株与其野生型相比,二元有机酸的生产能力具有显著的提高。
优选地,所述正调控基因的表达产物包括一种或多种选自下组的本发明多肽或其衍生多肽:天冬氨酸氨基转移酶、谷氨酸-天冬氨酸转运蛋白、C4-二羧酸转运蛋白、苹果酸脱氢酶、或丙酮酸羧化酶。所述的负调控基因的表达产物包括一种或多种选自下组的本发明多肽或其衍生多肽:琥珀酰辅酶A合酶、苹果酸-α酮戊二酸转运蛋白。
更优选地,本发明多肽或其衍生多肽选自下组:
(I)SEQ ID NO.:2、4、6、8、10、12、14、16、18、20、22、或26所示的序列;
(II)将SEQ ID NO.:2、4、6、8、10、12、14、16、18、20、22、或26所示的序列经一个或几个氨基酸的缺失、添加或取代而形成的、能使工程菌株具有二元有机酸生产能力的由(I)衍生的多肽;和
(III)氨基酸序列与SEQ ID NO.:2、4、6、8、10、12、14、16、18、20、22、或26所示序列的同源性≥90%(较佳地≥95%、更佳地≥98%)、能使工程菌株具有二元有机酸生产能力的多肽。
所述的衍生多肽包括能使出发菌株具有二元有机酸合成能力的、SEQ ID NO.:2、4、6、8、10、12、14、16、18、20、22、或26所示序列的变异形式。这些 变异形式包括(但并不限于):1-3个(通常为1-2个,更佳地1个)氨基酸的缺失、插入和/或取代,以及在C末端和/或N末端添加或缺失一个或数个(通常为3个以内,较佳地为2个以内,更佳地为1个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在C末端和/或N末端添加或缺失一个或数个氨基酸通常也不会改变蛋白质的结构和功能。术语“片段”、“衍生物”和“类似物”是指基本上保持能使出发菌株具有二元有机酸合成能力的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或几个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)本发明多肽与另一个化合物(比如延长多肽半衰期的化合物)融合所形成的多肽,或(iv)附加的氨基酸序列融合于此多肽序列而形成的多肽(与前导序列、分泌序列或6His等标签序列融合而形成的然后蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。一类优选的活性衍生物指与式I的氨基酸序列相比,有至多3个,较佳地至多2个,更佳地至多1个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表1进行氨基酸替换而产生。
表1
在另一优选例中,编码本发明多肽或其衍生多肽的多核苷酸(本发明多核苷酸) 序列包括:
(i)编码SEQ ID NO.:2、4、6、8、10、12、14、16、18、20、22、或26所示序列的多核苷酸;
(ii)SEQ ID NO.:1、3、5、7、9、11、13、15、17、19、21、或25所示序列的多核苷酸;或
(iii)核苷酸序列与SEQ ID NO.:1、3、5、7、9、11、13、15、17、19、21、或25所示序列的同源性≥95%(较佳地≥98%)的多核苷酸;或
(iv)如SEQ ID NO.:1、3、5、7、9、11、13、15、17、19、21、或25所示多核苷酸的5’端和/或端截短或添加1-60个(较佳地1-30,更佳地1-10个)核苷酸的多核苷酸;
(v)与(i)-(iv)的任一序列互补的多核苷酸。
本发明多核苷酸的全长序列或其片段通常可以用PCR扩增法、重组法或人工合成的方法获得。一种优选的获得本发明多核苷酸的方法一般来说有以下步骤:
(1).用编码本发明多肽的多核苷酸(或变异体),或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;
(2).在合适的培养基中培养的宿主细胞;
(3).从培养基或细胞中分离、纯化蛋白质。
本发明多肽及其编码多核苷酸序列对应如表2所示:
表2
工程菌株及其制备方法
本发明“工程菌”、“工程菌株”“遗传改造菌株”可互换使用,均指的导入了外源性二元有机酸合成正调控基因,和/或下调了二元有机酸合成负调控基因的工程菌株。其中,本发明工程菌与其野生型相比,二元有机酸生产能力显著提高,其中,所述的二元有机酸包括苹果酸、琥珀酸、富马酸、草酰乙酸,戊二酸或己二 酸。
可用于改造为本发明工程菌株的出发菌株通常为丝状真菌,尤其是毁丝霉属的丝状真菌,例如嗜热毁丝霉、异梭毁丝霉,优选为嗜热毁丝霉。野生的出发菌株通常不具备二元有机酸的合成能力,或不具备工业所需量的二元有机酸生产能力。通常,自然状态下可生成、但极快为下游消耗二元有机酸(即无法形成二元有机酸积聚)的出发菌也在本发明出发菌的范围内。而经过遗传改造后,本发明工程菌株生产二元有机酸的能力显著提高,包括原先不具备二元有机酸合成能力的菌株具备了此能力,或与出发菌株相比,该能力大幅上升。优选地,所述“显著提高”指的是与其野生型相比,工程菌的二元有机酸生产能力增强或提高了至少10%;较佳地至少10-50%;更佳地,至少50%-500%。
本发明的工程菌可采用以下方法制备获得:
(a1)提供携带外源性二元有机酸合成正调控基因的表达载体;
(b1)将所述的表达载体转入宿主细胞中;
(c1)培养所述的宿主细胞;和/或
所述的方法包括步骤:
(a2)敲除宿主细胞中二元有机酸合成负调控基因;
(b2)培养所述的宿主细胞;
其中,所述的宿主细胞为所述的出发菌株。
可采用抑制负调控基因的表达和/或活性的基因工程手段或物质对本发明负调控基因进行敲除或下调,从而获得新的转基因工程菌。这一类物质被称为“本发明抑制剂”或“负调控基因抑制剂”。例如,所述的抑制剂包括负调控基因的抗体、抑制性mRNA、反义RNA、microRNA(miRNA)、siRNA、shRNA以及锌指转录因子的活性抑制剂。一种优选的抑制剂为负调控基因的siRNA,例如针对SEQ ID NO.:1所示的序列。根据本发明提供的SEQ ID NO.:1所示的序列,可通过本领域常规技术设计抑制其表达的siRNA,优选的siRNA基因如SEQ ID NO.:74和75所示。
二元有机酸生产调控基因或其表达产物的组合
本发明还提供了一种本发明多肽或其编码多核苷酸的组合。实验证明,利用本发明组合同时对出发菌株进行改造,能够更有效地改善菌株的二元有机酸的生产能力。其中,所述本发明调控基因的表达产物的组合分别可以包括至少两种选自下组的多肽:
(Ia)SEQ ID NO.:4、6、或10所示的序列或其组合;或
(IIa)将SEQ ID NO.:4、6或10所示的序列经一个或几个氨基酸的缺失、添加或取代而形成的、能赋予和/或提高毁丝霉属菌株二元有机酸生产能力的由(Ia)衍生的多肽;和任选的
(Ib)SEQ ID NO.:12、14、16、18、20、22、或26所示的序列或其组合;
(IIb)将SEQ ID NO.:12、14、16、18、20、22、或26所示的序列经一个或几个氨基酸的缺失、添加或取代而形成的、能赋予和/或提高毁丝霉属菌株二元有机酸生产能力的由(Ib)衍生的多肽。
而本发明二元有机酸生产调控基因组合中所含有至少两个多核苷酸,且所述的多核苷酸则分别对应编码本发明表达产物的组合中的多肽。
此外,本发明还提供了含有本发明基因组合的载体,以及含有载体、或染色体整合有二元有机酸生产正调控基因和/或下调了二元有机酸生产负调控基因的宿主细胞。
优选地,本发明宿主细胞的染色体整合有外源的编码SEQ ID NO.:4、6和/或10所示的多肽的多核苷酸;或所述的宿主细胞的染色体中编码SEQ ID NO.:2、和/或8所示多肽的基因被敲除或减弱;和任选地
所述的宿主细胞的染色体整合有一种或多种选自SEQ ID NO.:4、6、10、12、14、16、18、20、22、26所示的多肽的多核苷酸。
本发明有益效果
(a)利用原生质体或农杆菌介导的转化/转染方法向出发菌株稳定引入异源或同源的核酸序列,所述的核酸序列与表达调控区可操作链接,也包括敲除或突变或减弱表达,以及利用绿色荧光蛋白辅助筛选基因敲除转化子。嗜热毁丝霉目前没有成熟的遗传操作技术体系.本发明是首次利用遗传工程技术,改造嗜热毁丝霉发酵生产二元酸。
(b)发现了一组丝状真菌中影响二元酸发酵水平的新的关键基因,并通过在毁丝霉中进行遗传改造,提高了二元酸(尤其是苹果酸)的发酵水平,包括琥珀酰辅酶A合酶、天冬氨酸氨基转移酶,苹果酸-α酮戊二酸转运蛋白,谷氨酸-天冬氨酸转运蛋白和C4-二羧酸转运蛋白、苹果酸脱氢酶。
(c)在一定条件下使所述重组菌株以多种碳源(尤其是生物质、聚糖等普通菌株无法利用的)为底物发酵生产二元酸,大大降低了生物质来源化学品发酵成本,微生物直接发酵生产L-苹果酸(及其他二元有机酸甚至更多的化学品成为可能)。
(d)发酵温度高,可以在40-50度(优先45度)条件下发酵,显著节省发酵时的冷凝费用,降低发酵成本。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
实施例1、在嗜热毁丝霉中过表达C4-二羧酸转运蛋白编码基因mae1,使其获得生产苹果酸的能力
1、mae过表达载体(pAN52-mae)的构建
以pAN52-TB-Intron(Liu Q,Li J,Ying S,Wang J,Sun W,Tian C,Feng M.2014.Unveiling equal importance of two 14-3-3proteins for morphogenesis,conidiation,stress tolerance and virulence of an insect pathogen.Environ Microbiol.doi:10.1111/1462-2920.12634)为骨架构建表达载体,以质粒pCSN44(购自fungal genetics stock center)为模板,在引物的引导下PCR扩增出在TrpC启动子调控下潮霉素磷酸转移酶编码基因(hph),引物序列如下所示:
hph-F:(SEQ ID NO.:23)
GCTCTAGACAGAAGATGATATTGAAGGAGC
hph-R:(SEQ ID NO.:24)
CCCAAGCTTCTATTCCTTTGCCCTCGGACGAG
hph.PCR反应体系为:
5×phusion HF buffer 10μl,10mM dNTPs 1μL,GLT-F 2.5μl,GLT-R 2.5μl,cDNA 1μL,Phusion DNA polymerase 0.5μl,水32.5μl。PCR反应条件为:先98℃30s;然后98℃10s,65℃30s,72℃1.5min,34个循环;最后72℃10min,4℃10min。
PCR反应结束后,经XbaI和HindIII酶切,连接入经同样酶双酶切的线性化载体pAN52-TB-Intron,将连接产物用限制性内切酶进行酶切鉴定,再进行测序,测序结果表明hph的核苷酸序列如SEQ ID NO.:27所示,表明获得了序列及插入位置正确的携带hph基因的重组表达质粒,命名为pAN52-hph。
在引物的引导下以米曲霉DSM1863(DSMZ,购自德国微生物和细胞培养有限公司)的cDNA为模板,PCR扩增出C4-二羧酸转运蛋白编码基因mae(XM_001820829.2,SEQ ID NO.:11),经BglII酶切后,连接入经BglII及EcoRV酶切后线性化载体pAN52-hph,将连接产物用限制性内切酶进行酶切鉴定,得到携带mae基因的载体,命名为pAN52-hph-mae。引物如下所示:
mae-F:5’(SEQ ID NO.:43):
GGAAGATCTTAATTAACTCGAGCGGCCGCGTTTAAACACTAGTATGCTGACACCTCCCAAGTTTG
mae-R:5’(SEQ ID NO.:44)
ATCCTAATCAGATACAT CCTCATCTTTA
以出发菌株嗜热毁丝霉ATCC42464(购自美国模式培养物集存库,American type culture collection)基因为模板,PCR扩增出翻译延长因子编码阅读框(MYCTH_2298136)上游1.4kb的启动子(命名为Ptef启动子),采用引物扩增出SEQ ID NO.:28所示的序列。引物如下所示:
tef-F:(SEQ ID NO.:29)
CCTTAATTAACATGTACCTTGACGTCCTCCGAG
tef-R:(SEQ ID NO.:30)
GGACTAGTTCTGAAGAACGAAACTGGC GACT
PCR反应结束后,经PacI和SpeI酶切,连接入经同样酶双酶切的线性化载体pAN52-hph-mae,将连接产物用限制性内切酶进行酶切鉴定,得到在启动子tef调控下mae基因表达载体,命名为pAN52-mae,表达载体的物理图谱如图1所示。
2、将表达载体(pAN52-mae)导入嗜热毁丝霉
2.1将嗜热毁丝霉ATCC42464在MM斜面培养基[50×Vogel’s盐20mL,蔗糖20g,琼脂15g,组氨酸(50mg/mL)20mL,定容体积到1L,高压灭菌。50×Vogel’s盐(1L):柠檬酸三钠(1/2H2O)150g,无水KH2PO4250g,无水NH4NO3100g,MgSO4·7H2O10g,CaCl2·2H2O 5g,微量元素盐溶液5mL,生物素(0.1mg/mL)2.5mL,定容体积到1L。]上45℃培养10天后待用
2.2嗜热毁丝霉原生质体转化
1)菌丝体准备
将成熟的嗜热毁丝霉孢子,用0.05%吐温80灭菌水收集,经擦镜纸过滤出去菌丝后,涂布于铺有玻璃纸的MM平板,45℃培养14h。
2)原生质体制备
将带有菌丝的玻璃纸放置于30mL裂解液(配方:0.15g裂解酶,无菌操作加入30mL溶液A,过滤除菌;溶液A:1.0361g磷酸二氢钾,21.864g山梨醇,溶于90mL去离子水,氢氧化钾调PH到5.6,定量至100mL,高温灭菌)中,28℃裂解2h,每隔20min轻轻摇动。
而后经过玻璃纸过滤后,2000rpm 4℃离心10min,弃上清,加入4mL溶液B(0,735g氯化钙,18,22g山梨醇,1mL Tris HCl 1M pH 7.5,溶于90mL去离子水,盐酸调PH到7.6,定量至100mL,高温灭菌),2000rpm 4℃离心10min;弃上清,按200uL/质粒加入一定体积溶液B。
3)原生质体转化
预冷的15ml离心管,依次加入50ul预冷PEG(12.5gPEG6000,0,368g氯化钙,500ul Tris HCl 1M pH 7.5。),10ul用HindIII线性化的质粒pAN52-mae,200uL原生质体。放置冰上20min后加入2mL预冷PEG,室温5min,加入4mL溶液B,轻轻混匀。取3mL上述溶液加入12mL融化的含相应抗生素MM培养基中,置于平板中,45℃培养,2d-4d后于体式显微镜下挑取单个菌丝体于相应抗性平板生长
2.3嗜热毁丝霉转化子验证
1)基因组提取
采用酚氯仿法从上述转化过程中挑选的转化子提取基因组DNA,具体包括以下操作:
1)2.0mL的无菌的DNA提取管中加入200mg的锆珠及1mL的裂解液(lysis buffer,配方:0.2M Tris·HCl(pH 7.5),0.5M NaCl,10mM EDTA,1%SDS(w/v)),挑取平板中生长的嗜热毁丝霉菌丝于DNA提取管中。
2)将所有DNA提取管置于助磨器上,最大转速振荡30s,重复两次。
3)65℃水浴30分,在水浴过程中每个几分钟取出漩涡振荡。
4)水浴结束后取出,每管加入80μl pH 7.5的1M的Tris·HCl中和。
5)加入400μl的酚:氯仿(1:1),13000rpm离心5分钟。
6)取300μl上清液于新的1.5mLEP管中,加入600μl 95%的乙醇(DNA级)。
7)冰上孵育一小时,随后4℃、13000rpm离心,可看到白色的DNA沉淀到EP管底
部。
8)用75%的酒精(DNA级)400μl清洗,4度13000rpm离心,轻轻取出上清液。
9)将EP管置于真空浓缩仪中,真空干燥酒精。
10)加入50μl ddH2O溶解DNA,用NanoDrop测DNA浓度,测完浓度后将提取的DNA
置于-20冰箱保存,以备下一步进行PCR验证
2)PCR验证嗜热毁丝霉转化子
以提取的基因组DNA为模版,用引物tef-F及mea-R对转化子进行基因PCR验证。PCR反应体系为:5×phusion GC buffer 4μl,10mM dNTPs 0.2μl,引物各1μL,基因组1μL,DMSO 0.6μL,Phusion DNA polymerase 0.1μL,水12.1μL。PCR反应条件为:先98℃30s;然后98℃10s,62℃30s,72℃1.5min,30个循环;最后72℃10min,4℃10min.
3)对PCR扩增产物进行1%琼脂糖凝胶电泳(110V电压,30分钟),在凝胶成像系统下看基因扩增条带,显示在上游引物tef-F和下游引物mae-R引导下经PCR扩增获得了2360bp目的条带,该条带表明经hindIII线性化的pAN52-mae整合到了嗜热毁丝霉基因组中。
3、嗜热毁丝霉转化子生产苹果酸能力测定
将上述验证的转化子全部接种至250mL三角瓶中的50mL以结晶纤维素(Avicel)为碳源培养基中(配方:碳源75g/L,蛋白胨6.0g/L,0.15g/L KH2PO4,0.15g/L K2HPO4,0.10g/L CaCl2·2H2O,0.10g/L MgSO4·7H2O,碳酸钙80.0g/L,1mL/L 0.5g/L生物素,1ml/L微量元素液;微量元素配方(100mL):5g C6H8O·7H2O,5g ZnSO4·7H2O, 1g Fe(NH4)2(SO4)·6H2O,0.25g CuSO4·5H2O,0.05g MnSO4·H2O,0.05g H3BO3,0.05g NaMoO4·2H2O,溶于水中,定容至100mL),接种量为2.5*105个/mL,45℃,150rpm培养,第八天取样测定苹果酸含量。
1)样品处理:
取1mL发酵液于15mL离心管中,并添加1mL 1M H2SO4,而后80℃下放置30min,每个隔0min进行充分震荡。之后将2mL双蒸水添加至离心管中,充分震荡后,取1mL液体于1.5mL离心管中,12000rpm离心10min,取上清液测定苹果酸含量。
2)苹果酸含量测定
处理后的样品用高效液相色谱测定苹果酸含量,其中检测器为紫外检测器,5mM H2SO4为流动相,流速为0.5mL/min。结果显示mae在嗜热毁丝霉中过表达时,能显著促进苹果酸的生产,其中产量最高的菌株命名为JG141,第八天在相应碳源时苹果酸产量为42g/L(如图9)。实验说明嗜热毁丝霉经过遗传改造后可以利用包括结晶纤维素在内的碳源进行苹果酸发酵。
实施例2将不同来源的C4-二羧酸转运蛋白编码基因在嗜热毁丝霉中过表达,获得重组微生物能够显著提高苹果酸生产能力。
1.C4-二羧酸转运蛋白同源性比对分析
本实施例选取来自米曲霉NRRL3488的C4-二羧酸转运蛋白(AO090023000318,mae,SEQ ID NO.:12)与粗糙脉孢菌C4-二羧酸转运蛋白(XP_958365,NCmae,SEQ ID NO.:14)、里氏木霉C4-二羧酸转运蛋白(XP_006963989,Trmae,SEQ ID NO.:16)、嗜热毁丝霉C4-二羧酸转运蛋白(XP_003663832,Mtmae,SEQ ID NO.:18)、黑曲霉NRRL599C4-二羧酸转运蛋白(XM_001398094,Anmae,SEQ ID NO.:20)、酱油曲霉NBRC4239C4-二羧酸转运蛋白(Asmae,SEQ ID NO.:22)。
2.C4-二羧酸转运蛋白基因表达载体启动子构建
以出发菌株嗜热毁丝霉ATCC 42464基因为模板,PCR扩增出翻译延长因子编码阅读框tef(MYCTH_2298136)上游1.0kb的启动子,其反应体系和条件见实施例1步骤1。根据构建的质粒不同,PCR扩增所用引物为:
tef-2F:GAAGATCTCATGTACCTTGACGTCCTCCGAG(SEQ ID NO.:55)
tef-2R:GGACTAGTTCTGAAGAACGAAACTGGCGACT(SEQ ID NO.:56)
PCR反应结束后,经BglⅡ与SpeI酶切,连接入经同样酶双酶切的线性化载体pAN52-TB-Intron,将连接产物用限制性内切酶进行酶切鉴定,得到的重组载体,命名为pAN52-TB-Ptef,其物理图谱见图2.
3.C4-二羧酸转运蛋白基因表达载体构建
3.1以粗糙脉孢菌(购自FGSC)基因组为模板,进行PCR扩增,获得编码C4-二羧酸转运蛋白编码基因Ncmae(SEQ ID NO.:13),PCR扩增所用引物为:
NCmae-F:GGACTAGTATGGGCAGCCAGCCTCCCATGC(SEQ ID NO.:45)
NCmae-R:CGGAATTCCTAATGATCCTCCACATCCTCA(SEQ ID NO.:46)
3.2以里氏木霉(购自ATCC)基因组为模板,进行PCR扩增,获得编码C4-二羧酸转运蛋白编码基因Trma(SEQ ID NO.:15),PCR扩增所用引物为:
Trmae-F:GGACTAGTATGAAAGCGGCATTCCCTCATGC(SEQ ID NO.:47)
Trmae-R:CGGAATTCTCAGTGATCCTCCACATTCTCATC(SEQ ID NO.:48)
3.3以嗜热毁丝霉ATCC42464(购自ATCC)基因组为模板,进行PCR扩增,获得编码C4-二羧酸转运蛋白编码基因Mtmae(SEQ ID NO.:17),PCR扩增所用引物为:
Mtmae-F:CGGACTAGTATGTCAACACCGCGGCGAAG(SEQ ID NO.:49)
Mtmae-R:CCGGAATTCTTAATGATCCTCCACGTCCTC(SEQ ID NO.:50)
3.4以黑曲霉NRRL599基因组为模板,进行PCR扩增,获得编码C4-二羧酸转运蛋白编码基因Anmae(XM_001398094)(SEQ ID NO.:19),PCR扩增所用引物为:
Anmae-F:GGACTAGTATGAACGTTGAAACGAGC(SEQ ID NO.:51)
Anmae-R:CGGAATTCTCATTCAGACACATCCTCAT(SEQ ID NO.:52)
3.5以酱油曲霉NBRC4239基因组为模板,进行PCR扩增,获得编码C4-二羧酸转运蛋白编码基因Asmae(SEQ ID NO.:21),PCR扩增所用引物为:
Asmae-F:GCTCTAGAATGCTGACACCTCCCAAGTTTGAGGATG(SEQ ID NO.:53)
Asmae-R CCTTAATTAACTAATCAGATACATCCTCATCTTTACCC(SEQ ID NO.:54)
上述经PCR扩增并分析获得的C4-二羧酸转运蛋白基因片段,使用限制性核酸内切酶SpeI与EcoRI酶切PCR产物以及质粒pAN52EF-Intron。然后采用T4DNA连接酶连接,获得了表达质粒,分别命名为pAN52-Ptef-Ncmae、pAN52-Ptef-Trmae、pAN52-Ptef-Mtmae、pAN52-Ptef-Anmae、pAN52-Ptef-Asmae。
4.嗜热毁丝霉重组转化子发酵产苹果酸分析
(1)获得嗜热毁丝霉重组转化子
将构建的基因表达载体(pAN52-Ptef-Ncmae、pAN52-Ptef-Trmae、pAN52-Ptef-Mtmae、pAN52-Ptef-Anmae、pAN52-Ptef-Asmae),整合至出发菌株嗜热毁丝霉菌株基因组,以终浓度为100ug/mL草铵膦为筛选抗生素,其方法见实施例1步骤2。利用引物tef-2F和对应基因克隆的下游引物,验证得到转化子,PCR体系及方法见实施例1步骤1.3。
将验证的转化子全部接种至250mL三角瓶中的50mL以结晶纤维素(Avicel)为碳源培养基中(配方见实施例1步骤3),接种量为2.5*105个/mL,45℃,150rpm培养,第八天取样。样品经实施例1步骤3.2所述方法进行处理后,测定发酵液中苹果酸含量。
结果显示在嗜热毁丝霉中过表达来自不同物种C4-二羧酸转运蛋白,能显著促进苹果酸的生产,其苹果酸的产量分别可达到(如图10):37.9g/L(Ncmae),26.1g/L(Mtmae),16.6g/L(Trmae),0.24g/L(Anmae)和59.4g/L(Asmae)。说明粗糙脉孢菌C4-二羧酸转运蛋白、嗜热毁丝霉C4-二羧酸转运蛋白、里氏木霉C4-二羧酸转运蛋白、酱油曲霉C4-二羧酸转运蛋白、可以用于构建嗜热毁丝霉苹果酸工业化发酵菌株。但值得注意的是,虽然黑曲霉和米曲霉的C4-二羧酸转运蛋白同源性较高(约90%左右),但在本实验中来自黑曲霉的C4-二羧酸转运蛋白在嗜热毁丝霉中表达时,转化子没有表现出适用于工业应用的苹果酸生产能力。由此可见,即使在本身就具有苹果酸累积能力的曲霉属菌株中,其所含有的高同源性的蛋白也无法均使其他菌株具备更优异的苹果酸生产能力。
而对于来自不同属菌株的基因,本发明人则进行了更多的实验以探索,包括来自有机酸积累非优势菌株(粗糙脉孢霉、里氏木霉等)的基因,是否能够通过代谢工程方法,利用这些基因,提高自身或其他菌株二元酸生产能力。
实施例3在嗜热毁丝霉中同时过表达C4-二羧酸转运蛋白编码基因mae及丙酮酸羧化酶pyc,加强其生产苹果酸的能力
1、mae及pyc共表达载体的构建
以质粒pAN52-TB-Intron为模板,在引物的介导下,PCR扩增出构巢曲霉gpdA的启动子,PCR条件及体系见实施例1步骤1,命名为AngpdA(SEQ ID NO.:84)。引物如下
ANgpadA-F:(SEQ ID NO.:61)
CCTTAATTAAGTCCAGATCATGGTTGACCGGTG
ANgpdA-R:(SEQ ID NO.:62)
GAACCTCCTTCAGAGAGGTTCGTGTTTAAACTGATGTCTGCTCAAGCGGGGTA
而后利用引物以出发菌株嗜热毁丝霉基因组为模板,PCR扩增出纤维二糖水解酶编码基因cbh(MYCTH_109566)终止子(SEQ ID NO.:85)。引物如下:
CBH-F:(SEQ ID NO.:63)
ACCCCGCTTGAGCAGACATCAGTTTAAACACGAACCTCTCTGAAGGAGGTTC
CBH-R:(SEQ ID NO.:64)
CCCAAGCTTCTAATAGGGATAATAAGCTAGGGTC
采用融合PCR的方法将序列gpdA启动子及cbh终止子连接在一起,具体方法为采用基因重叠延伸(SOE)方法,由Horton et al.1989发明(Horton RM,Hunt HD,Ho SN,Pul len JK,Pease LR.1989.Engineering hybrid genes without the useof restriction enzymes:gene spl icing-by-overlap extension.Gene 77:61-68)。
将An_gpdA启动子及cbh终止子通过HindIII酶切得到粘性末端,连入经同样酶双酶切的pAN52-mae体中得到重组载体:pAN52-mae-PgpdA-Tcbh。
以米曲霉DSM1863的cDNA为模板,在引物PYC-F(SEQ ID NO.:57)和PYC-R(SEQ ID NO.:58)的介导下,PCR扩增丙酮酸羧化酶编码基因pyc(XM_001820829.2,SEQ ID NO.:25),经PmeI酶切后,连入经同样酶酶切的pAN52-mae-PgpdA-Tcbh中,将重组质粒用引物PYC-F和PYC-R进行PCR验证后,再进行测序,测序结果确认为pyc基因的核苷酸序列,表明获得了序列及插入位置正确的携带pyc基因的重组表达质粒,命名为pAN52-mae-pyc,表达载体的物理图谱如图3示。
2、嗜热毁丝霉转化子利用结晶纤维素生产苹果酸能力的测定
将mae及pyc共表达载体pAN52-mae-pyc经BglII线性化后整合至出发菌株嗜热毁丝霉基因组,其方法见实施例1步骤2。利用引物mae-F(SEQ ID NO.:43)和mae-R(SEQ ID NO.:44)(验证mea整合在基因组中),PYC-F和PYC-R(验证pyc整合到基因组中),验证得到转化子,PCR体系及方法见实施例1步骤1.3。
将验证的转化子全部接种至250mL三角瓶中的50mL以葡萄糖,D-木糖,纤维二糖,木聚糖,结晶纤维素,蔗糖,可溶性淀粉,玉米芯木糖渣,玉米芯脱木素为碳源培养基中(配方见实施例1步骤3),接种量为2.5*105个/mL,45℃,150rpm培养,第八天取样。样品经实施例1步骤3.2所述方法进行处理后,测定发酵液中苹果酸含量。
结果显示在嗜热毁丝霉中同时过表达mae与pyc在时,能显著促进苹果酸的生产,其中一株菌株命名为JG207,第八天时测定转化子利用各种碳源发酵时的苹果酸的产量:62g/L(葡萄糖),28g/L(D-木糖),78.7g/L(纤维二糖),61.3g/L(木聚糖),63g/L(结晶纤维素),36.3g/L(蔗糖),46.3g/L(可溶性淀粉),36.8g/L(玉米芯木糖渣),55.15g/L(玉米芯脱木素)。
实施例4在嗜热毁丝霉转化子中过表达苹果酸脱氢酶编码基因mdh,进一步加强其生产苹果酸的能力
1、mdh过表达载体的构建
以pAN52-TB-Intron为模板,在引物的引导下PCR扩增出在来自构巢曲霉的色氨酸合成酶编码基因的启动子PtrpC(SEQ ID NO.:86)。引物如下:
Trpc-F:CTTTCTAGACGACGTTAACTGATATTGAAGGAGC(SEQ ID NO.:65)
Trpc-R:CGTGCAATCCATCTTGTTCAATCATTTGGATGCTTGGGTAGAATAGGTAA(SEQ ID NO.:66)
利用引物以质粒pEGFP-N2为模板,PCR扩增出新霉素磷酸转移酶编码基因neo(GI:339515868),反应体系及条件见实施例1步骤1。引物如下:
NEO-F:(SEQ ID NO.:67)
TTACCTATTCTACCCAAGCATCCAAATGATTGAACAAGATGGATTGCACG
NEO-R:(SEQ ID NO.:68)
AAAAAAAGCTTGGTACCATCGATGCGGCCGCC CGCGGTCAGAAGAACTCGTCAA。
采用融合PCR的方法将序列PtrpC及neo连接在一起,具体方法为采用基因重 叠延伸(SOE)方法。
将PtrpC及neo通过XbaI和Hind III酶切得到粘性末端,连入经同样酶双酶切的pAN52-TN-Intron中,得到能以neo为筛选标记的重组载体,命名为:pAN52-TN。
将出发菌株嗜热毁丝霉中3-磷酸甘油醛脱氢酶编码基因上游1.5K的启动子MtPgpdA进行序列优化,以除去酶切位点,人工合成后如序列SEQ ID NO.:69)。以此为模板,在引物的介导下,PCR扩增出MtPgpdA,经BglII和BamHI酶解后,连入用相同酶双酶切线性化的载体pAN52-TN,从而得到含有gpdA启动子的重组质粒:pAN52-TN-MtPgpdA。引物如下:
MtPgpdA-F:(SEQ ID NO.:70)
TGCAGATCTTTAATTAACTCGAGTGACGGTGCTTTTCACCTCTC
MtPgpdA-R:(SEQ ID NO.:71)
AGTGGATCCGAATTCGATATCGTTTAAACACTAGTTTTGATTTCTGTGATGTGG
以出发菌株嗜热毁丝霉cDNA为模板,利用引物PCR扩增出嗜热毁丝霉中苹果酸脱氢酶编码基因mdh(MYCTH_2315052)。引物如下:
MtMDH-F:CGGACTAGTATGGTCAAAGCTGTCGTTGCTG(SEQ ID NO.:59)
MtMDH-R:CGCGGATCCTCACTTCTGGGGGGGGTTGTG(SEQ ID NO.:60)。
用SpeI和BamHI后,连如用同样酶双酶切的线性化质粒pAN52-TN-MtPgpdA,从而得到mdh表达重组载体,命名为:pAN52-mdh,表达载体的物理图谱如图4所示。
2、嗜热毁丝霉转化子生产苹果酸能力的测定
将mdh过表达载体pAN52-mdh经BglII线性化后整合至嗜热毁丝霉JG207菌株基因组,以终浓度为100ug/mL G418为筛选抗生素,其方法见实施例1步骤2。利用引物MtPgpdA-F和MtMDH-R,验证得到转化子,PCR体系及方法见实施例1步骤1.3。
将验证的转化子全部接种至250mL三角瓶中的50mL以结晶纤维素(Avicel)为碳源培养基中(配方见实施例1步骤3),接种量为2.5*105个/mL,45℃,150rpm培养,第八天取样。样品经实施例1步骤3.2所述方法进行处理后,测定发酵液中苹果酸含量。
结果显示在嗜热毁丝霉中同时过表达mae与pyc在时,能显著促进苹果酸的生产,其中一株菌株命名为JG319,第八天时苹果酸产量为75g/L(如图9),转化率达1.0g/g Avicel。
实施例5利用RNA干扰技术抑制琥珀酰辅酶A合酶的表达,提高苹果酸发酵水平
1、干扰载体的构建上游的启动子,分别命名为P1和P2启动子SEQ ID NO.:72和73),用BglII和PmeI酶解后,分别连入用相同酶双酶切线性化的载体pAN52-TB-Intron,得到含的重组质粒分别命名为pAN52-TB-Psilent-A和pAN52-TB-Psilent-B.
利用引物PCR扩增出嗜热毁丝霉琥珀酰辅酶A合酶编码基因scl的第一段干扰序列SCL-S1(SEQ ID NO.:74),引物如下:
SCL1-F:CCATCGATCATCAAGAACCTGTACCGCATC(SEQ ID NO.:31)
SCL1-R:GGGTTTAAACCAATGATGGGGA TCTTCAGGTC(SEQ ID NO.:32)。
利用引物PCR扩增出嗜热毁丝霉琥珀酰辅酶A合酶编码基因scl的第二条干扰序列SCL-S2(SEQ ID NO.:75)。
SCL2-F:CGCGGATCCCAATGATGGGGATCTTCAGGTC(SEQ ID NO.:33)
SCL2-R:CGCGGATCCGTTTAAACCATCAAGAACCTGTACCGCATC(SEQ ID NO.:34)。
将scl的两段干扰序列分别用ClaI/PmeI和BamHI酶解后,依次连接至用同样酶酶切的线性化质粒pAN52-TB-Psilent-A和pAN52-TB-Psilent-B,从而得到了含有SCL基因干扰序列发夹结构的转录元件和筛选标记bar基因的双元载体: pAN52-SCLsilent-A和pAN52-SCLsilent-B,其物理图谱如图5和图6
2、干扰琥珀酰辅酶A合酶的表达显著提高微生物生产苹果酸的能力
将含有SCL基因干扰序列发夹结构的转录元件和筛选标记bar基因的双元载体pAN52-SCLsilent-A和pAN52-SCLsilent-B,分别整合至嗜热毁丝霉JG207菌株基因组,以终浓度为100ug/mL草铵膦为筛选抗生素,其方法见实施例1步骤2。利用引物Intron-F(AGCTGTTTACTCATTATTAC,SEQ ID NO.:76)和SCL2-R(SEQ ID NO.:34),验证得到转化子,PCR体系及方法见实施例1步骤1.3。
将验证的转化子全部接种至250mL三角瓶中的50mL以结晶纤维素(Avicel)为碳源培养基中(配方见实施例1步骤3),接种量为2.5*105个/mL,45℃,150rpm培养,第八天取样。样品经实施例1步骤3.2所述方法进行处理后,测定发酵液中苹果酸含量。
结果显示在嗜热毁丝霉JG207中整合pAN52-SCLsilent-A后,其苹果酸产量与其起始菌株JG207相似,第八天时苹果酸产量为68g/L。而嗜热毁丝霉JG207中整合pAN52-SCLsilent-B后,其苹果酸产量与其起始菌株JG207相比有了显著的提高,其中产量最高的菌株命名为JG207S,苹果酸最终产量(发酵第八天)为74.8g/L(如图9),相比JG207菌株提高了15.3%。
本实施例说明通过时间调控启动子控制的RNA干扰序列发夹结构的转录,干扰TCA循环关键酶编码基因的翻译,从而减弱三羧酸循环,显著提高微生物生产苹果酸的能力。
此后,发明人以粗糙脉孢霉为宿主,利用其单基因突变体筛选除了新的微生物苹果酸生产的关键基因,即天冬氨酸氨基转移酶、谷氨酸-天冬氨酸转运蛋白和苹果酸-α酮戊二酸转运蛋白。在以下实验中,发明人对这些新发现的与二元酸合成相关的基因进行了进一步实验验证。
实施例6调控嗜热毁丝霉苹果酸-天冬氨酸穿梭途径中的天冬氨酸氨基转移酶,可以显著提高微生物合成苹果酸的能力
1.天冬氨酸氨基转移酶表达载体的构建
在已公开的嗜热毁丝霉全基因组数据库信息(http://genome.jgi.doe.gov/Spoth2/Spoth2.home.html),查找编码天冬氨酸氨基转移酶,设计引物对以嗜热毁丝霉基因组为模板,进行PCR扩增,获得编码天冬氨酸氨基转移酶核酸序列CI7941(MYCTH_2314321)(SEQ ID NO.:3)。用BSpeI与EcoRI酶解后,连入用相同酶双酶切线性化的载体pAN52-TN-MtPgpdA,得到的重组质粒分别命名为pAN52gpdA-CI7941,引物如下:
CI7941-F:GGACTAGTATGGCGCCGACGTCAACAACG(SEQ ID NO.:35)
CI7941-R:CGGAATTCTCATTGCACCTCCCGAACCAC(SEQ ID NO.:36)
2.嗜热毁丝霉转化子生产苹果酸能力的测定
将天冬氨酸氨基转移酶过表达载体pAN52gpdA-CI7941整合至嗜热毁丝霉AS2菌株(整合来自酱油曲霉的Asmae过表达载体的嗜热毁丝霉转化子,详细见实施例2)基因组,以终浓度为100ug/mL G418为筛选抗生素,其方法见实施例1步骤2。
将验证的转化子全部接种至250mL三角瓶中的50mL以结晶纤维素(Avicel)为碳源培养基中(配方见实施例1步骤3),接种量为2.5*105个/mL,45℃,150rpm培养,第八天取样。样品经实施例1步骤3.2所述方法进行处理后,测定发酵液中苹果酸含量。
结果显示在嗜热毁丝霉AS2基础上整合有该天冬氨酸氨基转移酶,能显著促进苹果酸的生产,其中产量最高的一株菌株命名为CN201,第八天时苹果酸的最产量为 69.2g/L(如图9),以对照菌株AS2相比提高超过了10%。
本实施例说明苹果酸-天冬氨酸穿梭途径相关基因天冬氨酸氨基转移酶的过表达,能够提高微生物生产苹果酸的能力。
实施例7调控嗜热毁丝霉苹果酸-天冬氨酸穿梭途径中的谷氨酸-天冬氨酸转运蛋白,可以显著提高微生物合成苹果酸的能力
1.谷氨酸-天冬氨酸转运蛋白表达载体的构建
在已公开的嗜热毁丝霉全基因组数据库信息(http://genome.jgi.doe.gov/Spoth2/Spoth2.home.html),查找编码谷氨酸-天冬氨酸转运蛋白,设计引物对:
CI 1241-F:GGACTAGTATGTCCAAGGCCGCAACTGTC(SEQ ID NO.:35)
CI 1241-R:CGGAATTCCTACGCCGTCTTTGCGTTCATC(SEQ ID NO.:36)
以嗜热毁丝霉基因组为模板,进行PCR扩增,获得编码天冬氨酸氨基转移酶核酸序列CI 1241(MYCTH_2300593)(SEQ ID NO.:5)。用BSpeI与EcoRI酶解后,连入用相同酶双酶切线性化的载体pAN52-TN-MtPgpdA,得到的重组质粒分别命名为pAN52gpdA-CI 1241。
2、嗜热毁丝霉转化子生产苹果酸能力的测定
将谷氨酸-天冬氨酸转运蛋白过表达载体pAN52gpdA-CI 1241整合至嗜热毁丝霉AS2菌株(整合来自酱油曲霉的Asmae过表达载体的嗜热毁丝霉转化子,详细见实施例2)基因组,以终浓度为100ug/mL G418为筛选抗生素,其方法见实施例1步骤2。
将验证的转化子全部接种至250mL三角瓶中的50mL以结晶纤维素(Avicel)为碳源培养基中(配方见实施例1步骤3),接种量为2.5*105个/mL,45℃,150rpm培养,第八天取样。
样品经实施例1步骤3.2所述方法进行处理后,测定发酵液中苹果酸含量。结果显示在嗜热毁丝霉中同时过表达酱油曲霉Asmae和嗜热毁丝霉谷氨酸-天冬氨酸转运蛋白(CI 1241),能显著促进苹果酸的生产,其中一株菌株命名为CN202,第八天时苹果酸的最产量为66.9g/L(如图9),以对照菌株AS2相比提高超过了10%。
本实施例说明苹果酸-天冬氨酸穿梭途径相关基因谷氨酸-天冬氨酸转运蛋白的过表达,能够提高微生物生产苹果酸的能力。
实施例8苹果酸-α酮戊二酸转运蛋白基因缺失能够提高嗜热毁丝霉菌株CN2生产苹果酸的能力
(1)苹果酸-α酮戊二酸转运蛋白基因及其上下游同源臂核酸片段扩增
在已公开的嗜热毁丝霉全基因组数据库信息(http://genome.jgi.doe.gov/Spoth2/Spoth2.home.html),查找编码苹果酸-α酮戊二酸转运蛋白基因(MYCTH_2081554,SEQ ID NO.:91)及其上下游同源臂核酸序列,设计引物对:
CI4837-UF:GCTCTAGATGCTTGCAGGAACTCTCTGTGAAACC(SEQ ID NO.:39)
CI4837-UR:GCGTTAACCCCACAGTTTGGAGAGACGACATCG(SEQ ID NO.:40)
CI4837-DF:CCTTAATTAATGTATATACGGGGCGAATACGAAGG(SEQ ID NO.:41)
CI4837-DR:CGGAATTCTTCCTCCTGCAAACTCAGCTTGAG(SEQ ID NO.:42)。
以嗜热毁丝霉基因组为模板,进行PCR扩增,获得编码苹果酸-α酮戊二酸转运蛋白基因上下游同源臂核酸序列UL和DL,经北京六合华大基因科技股份有限公司测序并经NCBI Blast比对分析。
(2)苹果酸-α酮戊二酸转运蛋白基因敲除载体构建
以质粒pPK2surGFP为模板,采用引物对扩增Sur基因片段(GI:2547090)扩增Sur基因片段,引物如下:
Sur-F:GCTCTAGAGTTAACGCGGCCGCGACTAGATCTGTGCCAACGCCACAG(SEQ ID NO.:77)
Sur-R:CGGAATTCGTTTAAACTTAATTAACCGACGGAATTGAGGATATCAGTCAC(SEQ ID NO.: 78)
使用限制性核酸内切酶XbaI与EcoRI酶PCR产物以及质粒pPK2barGFP,然后采用T4DNA连接酶连接,获得了质粒pPK2sur-barGFP。
上述经PCR扩增并测序分析获得的苹果酸-α酮戊二酸转运蛋白基因上下游同源臂片段,使用限制性核酸内切酶XbaI与HpaI酶切上游同源臂PCR产物,PacI与EcoRI酶切下游同源臂PCR产物。采用相同的酶酶切质粒pPK2sur-barGFP,采用T4DNA连接酶连接,依次将上下游同源臂连接于载体pPK2sur-barGFP,获得了敲除载体:pPK2sur-barGFP::odc(如图7)。
(3)基因敲除载体pPK2sur-barGFP::odc转化嗜热毁丝霉AS2,获得转化子
用PCR方法鉴定转化子,用位于嗜热毁丝霉苹果酸-α酮戊二酸转运蛋白基因5`端上游同源臂外端的引物CI4837-F2和位于sur基因内部的Sur-R2对转化子进行PCR验证,引物序列如下:
CI4837-F2:CAGACTGTGTGGTTCTGCAACAGG(SEQ ID NO.:87)
Sur-R2:GGCCAACAGTACGAAGCATTTCG(SEQ ID NO.:88)
PCR结果显示,用CI4837-F2和Sur-R能够扩增出大小为3kb的片段,说明Sur基因已经替换了苹果酸-α酮戊二酸转运蛋白编码基因CI4837。
同时用苹果酸-α酮戊二酸转运蛋白编码基因doc的ORF扩增引物CI4837-F与CI4837-R对转化子基因组进行扩增,引物序列如下:
CI4837-F:ATGGCGTCAGCAAAGGAGAAGG(SEQ ID NO.:89)
CI4837-R:CTACGCCTCGCCATCCCTAATC(SEQ ID NO.:90)
PCR结果显示,用引物CI4837-F与CI4837-R未能扩增出任何片段,说明所得到的转化子为纯核。
(4)转化子发酵生产苹果酸
以250ml三角烧瓶做为发酵容器,每瓶发酵体系为50ml。苹果酸发酵培养基配方如下:微晶纤维素7.5%,蛋白胨6.0g/L,0.15g/L KH2PO4,0.15g/L K2HPO4,0.10g/L CaCl2.2H2O,0.10g/L MgSO4.7H2O,碳酸钙80.0g/L,1ml/L微量元素液(5g NaCl,5g FeSO4·7H2O,1g citric acid/L水)。
采用生理盐水溶液收集获得的32株转化子,经2层擦镜纸过滤后,计算孢子的数量,接种量均为2.5*105个/ml。于45℃,150rpm振荡培养,分别在第4天、第6天和第8天取样,样品处理后,进行HPLC分析苹果酸含量。其中一株菌株命名为CN203第8天苹果酸产量为70.5克/升(如图9),相比对照菌株菌株AS2,苹果酸产量提高超过了10%。
实施例9在粗糙脉孢霉中过表达C4-二羧酸转运蛋白,未能获得工业生产级的苹果酸的能力
1.C4-二羧酸转运蛋白基因表达载体构建
以粗糙脉孢菌基因组为模板,进行PCR扩增,获得编码C4-二羧酸转运蛋白基因核酸序列Ncmae(NCU07517)(SEQ ID NO.:13)。PCR扩增所用引物NCU7517-F:GCTCTAGAATGGGCAGCCAGCCTCCCATGC(SEQ ID NO.:79)和NCU7517-R:CCTTAATTAACTAATGATCCTCCACATCCTCA(SEQ ID NO.:80)。以米曲霉DSM1863基因组为模板,进行PCR扩增,获得编码C4-二羧酸转运蛋白基因核酸序列mae(SEQ ID NO.:11)。PCR扩增所用引物为
Asmae-F:GCTCTAGAATGCTGACACCTCCCAAGTTTGAGGATG(SEQ ID NO.:53)
mae-2R:CCTTAATTAACTAATCAGATACATCCTCATCTTTACCC(SEQ ID NO.:81)
上述经PCR扩增分析获得的C4-二羧酸转运蛋白基因片段,使用限制性核酸内切酶XbaI与PacI酶切PCR产物以及质粒pMF272(其物理图谱如图8)。然后采用T4DNA连接酶连接,获得表达质粒,分别命名为pMF272-Nrmae、pMF272-mae。
2.将C4-二羧酸转运蛋白编码基因整合至粗糙脉孢霉基因组中
C4-二羧酸转运蛋白表达载体pMF272-Nrmae和pMF272-mae转入粗糙脉孢霉FGSC9015后,将验证的转化子全部接种至250mL三角瓶中的50mL以D-葡萄糖为碳源培养基中(配方:葡萄糖100.0g/L,蛋白胨6.0g/L,0.15g/L KH2PO4,0.15g/L K2HPO4,0.10g/L CaCl2.2H2O,0.10g/L MgSO4.7H2O,碳酸钙80.0g/L,1ml/L微量元素液(5g NaCl,5g FeSO4·7H2O,1g citric acid/L水),接种量为1*106个/mL,25℃,200rpm培养,第4天取上清液,测定发酵液中苹果酸含量。结果显示在粗糙脉孢霉FGSC9015表达来自粗糙脉孢霉的Ncmae后,其苹果酸的最高产量为2.7g/L;在粗糙脉孢霉FGSC9015表达来自米曲霉的mae后,其苹果酸的最高产量为2.5g/L。与对照菌株粗糙脉孢霉FGSC9015(产量为1.5g/L)相比,C4-二羧酸转运蛋白的表达虽然有所上升,但无法满足工业应用需要。
本试验表明,对于有机酸积累非优势菌株,比如粗糙脉孢菌,通过改造苹果酸合成途径(比如过表达苹果酸转运蛋白)不能有效提高其苹果酸合成能力至工业化生产能力。尽管有报导表明在有机酸积累优势菌株曲霉属菌株,通过改造苹果酸合成途径可以提高有机酸合成至工业化水平,但这在有机酸积累非优势菌株中并不具备推广性。
实施例10在里氏木霉中过表达C4-二羧酸转运蛋白,未能提高微生物生产苹果酸的能力
1、米曲霉C4-二羧酸转运蛋白(SEQ ID NO.:11)过表达载体构建
从曲霉DSM1863的cDNA中PCR扩增C4-二羧酸转运蛋白基因的编码阅读框mae(SEQ ID NO.:11),引物如下:
Amae-F:TTCCAACTAGTATGCTGACACCTCCCAAG(SEQ ID NO.:82)
Amae-R:AATGGTTAACCTAATCAGATACATCCTC(SEQ ID NO.:83)
PCR反应结束后,使用限制性内切酶Spe I和Hpa I消化PCR产物,并将其插入到质粒pCY01(含有潮霉素抗性基因,在多克隆酶切位点两边分别是嗜热毁丝霉的延长因子的启动子和曲霉trpC终止子)SpeI和HpaI酶切位点之间,得到质粒pNEO-Amae。将质粒pNEO-Amae利用原生质体法转入里氏木霉QM6a中,所得转化子为QM6a-Amae。
2、里氏木霉过表达C4-二羧酸转运蛋白的重组菌株的产酸能力检测
培养基如实施例1所述,将1.25×107个孢子接种至50ml产酸培养基中,150rpm,28度培养8天,取1ml发酵液加入到1ml 2M的硫酸中,80度反应20min,加2ml水,混匀后,14000rpm离心10min,取上清,按照实施例1的方法,利用HPLC进行检测上清中的苹果酸含量。出发菌2.5±0.6g/L,转化子最高苹果酸产量为2.4±0.4g/L。
结果显示C4-二羧酸转运蛋白在里氏木霉中的表达未能显著提高其合成苹果酸发酵工业化能力。
本试验表明,对于有机酸积累非优势菌株,比如里氏木霉,通过改造苹果酸合成途径(比如过表达苹果酸转运蛋白)不能有效提高其苹果酸合成能力至工业化生产能力。尽管有报导表明在有机酸积累优势菌株曲霉属菌株,通过改造苹果酸合成途径可以提高有机酸合成至工业化能力,但这在有机酸积累非优势菌株中并不具备推广性。
实施例11、在嗜热型真菌Myceliophthora heterothallica中过表达mae和pyc,使其获得生产苹果酸的能力
本实施例说明丙酮酸羧化酶和C4-二羧酸转运蛋白在嗜热性真菌(M.heterothallica)中表达,获得的重组微生物能够显著提高苹果酸生产能力。
表达mae基因和pyc基因的载体pAN52-mar-pyc(构建方法见实施例1步骤1), 原生质体转化菌株M.heterothallica CBS202.75,以潮霉素基因hph为选择性标记,筛选获得多株阳性转化子,对阳性转化子以7.5%微晶纤维素Avicel为底物进行苹果酸发酵,其培养基成份见实施例1步骤3,结果如下图。以出发菌株M.heterothallica CBS202.75作为参照,其中,27号转化子发酵第八天转化子的苹果酸产量提高到47.4g/L。
本试验表明,通过代谢工程改造,可以显著提高异梭毁丝霉苹果酸合成能力,与本发明实施例9,10比较可以发现,毁丝霉属菌株改造后可以大副提高有机酸(苹果酸)合成,而这一发现不具备可预见性。
实施例12、重组嗜热毁丝霉苹果酸生产发酵工艺建立
1.孢子培养:将重组嗜热毁丝霉JG207在5L发酵罐(BIOTECH-5JG,上海保兴生物设备工程有限公司)中进行发酵,方法如下:重组嗜热毁丝霉JG207接种到MM平板培养基,将平板放在45℃培养箱生长8d。用0.8%NaCl和0.1%Tween-80洗孢子并计数。
2.种子液培养:将2.5×107个孢子转接到含100ml种子培养基的250ml三角瓶中,45℃,150rpm培养24h后的菌液即为发酵的种子。采用合成培养基对其进行发酵。5L发酵罐装3.3L发酵培养基,400ml种子液。
MM固体培养基(每升)成分为20g蔗糖、20ml 50×Vogel’s salt、15g琼脂。50×Vogel’s salt(g/L)成分为:125g Na3citrate·2H2O、250g KH2PO4、100g NH4NO3、10g MgSO4·7H2O、0.1g CaCl2·2H2O、5ml微量元素溶液、2.5ml Biotin、755ml水。
种子培养基(每升)成分为10g葡萄糖、0.15g K2HPO4、0.15g KH2PO4、0.1g MgSO4·7H2O、0.1g CaCl2、6g Bacto peptone、1ml微量元素溶液。微量元素溶液的成分(g/L)为:5g Citric acid·1H2O、5g ZnSO4·7H2O、1g Fe(NH4)2(SO4)2·6H2O、0.25g CuSO4·5H2O、0.05g MnSO4·1H2O、0.05g H3BO3、0.05g Na2MoO4·2H2O。
发酵培养基(每升)成分为75g碳源、80g CaCO3、0.15g K2HPO4、0.15g KH2PO4、0.1g MgSO4·7H2O、0.1g CaCl2、6g Bacto peptone、0.5ml Biotin、1ml微量元素溶液。
补料培养基(每升)成分为:0.45g K2HPO4、0.45g KH2PO4、0.3g MgSO4·7H2O、0.3g CaCl2、18g Bacto peptone、1.5ml Biotin、3ml微量元素溶液。
3.发酵工艺:发酵温度45℃,空气流量4L/min,溶氧控制在30%。为了使溶氧控制在30%,转速需与溶氧偶联,转速保持在200-800rpm。发酵过程中补加碳酸钙将pH控制在6.0以上。
发酵第48h采用模拟指数流加补料方式开始流加补料培养基,平均补料速度是8ml/h。发酵的第72h、96h、120h、144h、168h、192h、216h、240h分别补加60g碳源。
自发酵48h后,每隔24h取1ml菌液,加入1ml 2M H2SO4混匀后于80℃高温处理25min,再加入1ml无菌水,14000rpm离心10min,取上清使用HPLC(Waters e2695高效液相色谱仪)测苹果酸含量。
发酵周期是240h-264h,苹果酸产量可一直增加。
重组嗜热毁丝霉菌株以多种碳源为底物发酵生产苹果酸的方法跟上述方法一致。以葡萄糖为碳源,苹果酸产量是230g/L。以Avicel为碳源,苹果酸产量是168g/L。以秸秆为碳源,苹果酸产量是95g/L。实施例13、苹果酸的分离制备
苹果酸的分离制备一般分为苹果酸的提取粗制、精制和结晶三个步骤。
1.苹果酸的提取粗制:发酵液经过酸解、过滤、中和、过滤、酸解、过滤等六个步骤处理,得到粗制苹果酸溶液。将发酵液放入酸解槽中,用硫酸酸解至PH1.6,酸解要在搅拌下缓慢进行。酸解完成后,用板框压滤机滤除石膏渣、菌体及其他沉淀物。将滤液放入中和槽中,加入CaCO3固体和石灰乳,将PH调到7.5。中和液放入沉淀滤 槽中,静置7h,让溶液中的苹果酸钙盐充分结晶沉淀下来。上述钙盐体系澄清之后,除去上清液,再放开滤槽的假底,过滤,用少量冷水洗涤滤饼,除去大部分可溶杂质。将苹果酸钙转到酸解槽中,加入2倍重量的温水,搅拌成悬浮液,加入硫酸酸化至PH1.6,继续搅拌约半小时,再静置数小时让石膏渣沉淀充分析出。用压滤机滤去上述体系中的石膏渣,这时的滤液为粗制苹果酸溶液,其中还含有微量丁二酸等有机酸,以及Ca2+、Mg2+等金属离子和色素等,下一步进行精制。
2.苹果酸的精制:采用离子交换和活性炭联合处理法。苹果酸母液依次经过CAL型粒状活性炭脱色柱、阳离子交换树脂732、阴离子交换树脂D315、BPL型柱状活性炭吸附柱和阳离子交换树脂的5柱纯化系统。处理时,粗制苹果酸溶液依次通过上述5柱系统,液流都是有上而下,流速用7~8L/min,流出液用紫外吸收分析仪监测不饱和脂肪酸含量。如果有不饱和脂肪酸流出,则要返回阴离子交换树脂D315柱重新处理。CAL型粒状活性炭脱色柱的作用是脱色,并能除去部分不饱和脂肪酸。阳离子交换树脂732除去金属离子。阴离子交换树脂D315除去丁二酸等阴离子。
将上述纯度较高的苹果酸溶液在70℃下减压浓缩。再冷却到20℃,加入适量晶种,在缓慢搅拌下结晶,3h使苹果酸结晶出来。
苹果酸晶体的干燥在真空条件下进行,温度控制在40~50℃。
小结
对于苹果酸等有机酸发酵,传统优势菌株为曲霉属菌株(优选黑曲霉-柠檬酸,衣糠酸-土曲霉,苹果酸-黄曲霉,米曲霉)以及根霉属菌株(米根霉-乳酸).但上述菌株利用葡萄糖为碳源发酵,不能利用纤维素,生物质等复杂高聚糖发酵,葡萄糖成本较高,如果可以利用纤维素、生物质作为碳源,将大幅降低发酵成本。但目前已知有机酸发酵菌株(如黑曲霉-柠檬酸,米曲霉-苹果酸,乳酸-米根霉等)不能利用木质纤维素发酵。另一方面,可以利用木质纤维素为碳源来生长的菌株(如木霉属和脉孢霉属)却不能大量积累有机酸,本试验表明,对这些天然条件下没有明显有机酸积累的菌株而言,通过改造其有机酸(比如苹果酸)合成途径,通常不能有效提高其产量至潜在工业化能力(10克/升或以上)。因此本试验一方面说明曲霉属有机酸合成途径改造显著提高有机酸合成结论不能推广到整个丝状真菌,尤其是非有机酸积累菌株,包括毁丝霉属等是否具有有机酸合成工业化能力,不具备推测能力,需要具体试验探索;另一方面,对于能够利用木质纤维素生长的菌株,不能利用其有效发酵生产有机酸,出乎预料的是,本发明人首次表明毁丝霉属菌虽然天然条件下培养基中并不大量积累有机酸(通常不能超过克级/升),但通过改造可以在包括木质纤维素等生物质在内的多种碳源发酵积累苹果酸能力(10-100克/升及以上),毁丝霉属菌株改造后,集合了有机酸发酵菌株和木质纤维素利用两类菌株的优势,因此本发明具有很大偶然性和创新性.
同时,发明人发现通过调控多个新基因,不仅可以提高毁丝霉属苹果酸(乃至有机酸)发酵,这些基因改造在具有有机酸积累能力的毁丝霉属以外菌株,包括曲霉属(优选米曲霉,酱油曲霉,土曲霉,黑曲霉),根霉属(优选米根霉)等可以提高有机酸发酵生产能力.
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!