mazG基因缺失的抗结核重组卡介苗的制作方法
本发明属微生物和生物工程领域。具体涉及基因敲除重组疫苗,更具体涉及mazG基因缺失重组卡介苗及其制备方法,以及其在结核分枝杆菌感染的预防性疫苗中的用途。
背景技术:
结核病是全世界关注的一种主要的公众传染性疾病。早在1993年,世界卫生组织(WHO)就因为全球的结核病例日趋增多而宣布结核病疫情进入紧急状态。目前,全世界约有1/3人口(18.6亿)携带有结核杆菌(Mycobacterium tuberculosis),每年约有800万新增病例,200万人死于结核病;我国大约有活动性结核病人600万,每年有25万人死于结核病。根据卫生部公布的2005年传染病疫情,在27种法定甲、乙类传染病中,肺结核的发病数已经超过乙型肝炎,肺结核的死亡数也超过了狂犬病,发病数和死亡数均居第一位。而且,结核病的控制也因为多重抗药性(Multidrug-resistant,MDR)菌株和艾滋病的出现使得原本就越来越严重的结核病疫情变得更加复杂化。
目前,预防结核病唯一有效的疫苗是卡介苗(Bacillus Calmette-Guerin,BCG),一种活的减毒牛型分支杆菌(Mycobacterium bovis)。然而遗憾的是,由于BCG发明的当时还没有冻干技术,用来生产BCG的菌种在早期是通过培养的方法进行传代和保存的,这种方法一直沿用到20世纪60年代,结果造成了世界各国使用的卡介苗菌种之间极大的差异性。据统计,在世界各国进行过大小数十次的卡介苗临床试验,然而试验结果显示,卡介苗对肺结核的免疫保护力是0-80%,差异性极大(Brewer,T.F.and Colditz,G.A.Clin Infect Dis.1995;20:126-35.Colditz,G.A.,Brewer,T.F.,et al.JAMA.1994;271:698-702)。因此,研究一种保护效力超过BCG的结核病新疫苗势在必行。
尽管BCG对成人结核病的保护效力差强人意,但是由于其良好的安全性以及对儿童重症结核病如粟粒性结核和结核性脑膜炎的显著免疫保护效果,WHO 坚持建议在新生儿中接种卡介苗。自1928年以来,BCG至今已在182个国家,对40多亿的儿童进行了接种。卡介苗是目前全球接种最广泛的疫苗之一,根据WHO扩大计划免疫的要求,现在每年仍有1亿多的新生儿接种卡介苗。此外,基于BCG良好的免疫刺激效果以及数十年来业已证实的安全性,使其作为预防结核病以及其他传染病的优良细菌表达载体成为可能。已有实验报道,不同来源的保护性候选抗原基因可在BCG菌中克隆并得以表达,从而构建相对高效的重组BCG疫苗(Stover,C.K.,de la Cruz,V.F.,et al.Nature.1991;351:456-60.Stover,C.K.,Bansal,G.P.,et al.J Exp Med.1993;178:197-209.Grode,L.,Seiler,P.,et al.J Clin Invest.2005;115:2472-9)。
研发出一种能够取代卡介苗的新疫苗并非易事。卡介苗是世界上使用人数最多的疫苗,虽存在缺陷,却价廉和安全,估计在今后也很难完全被取代。众所周知,卡介苗对儿童重症结核病,尤其是粟粒性结核和脑膜炎的免疫保护作用是毋庸置疑的。另外,在小动物模型中,尤其是豚鼠,卡介苗对动物的免疫保护效果是其它新型的亚单位疫苗(如蛋白质疫苗和核酸疫苗)所无法超越的(Smith DW,et al.Adv Tuberc Res,1985;22:1-97)。因此只有新型的减毒活疫苗才有可能取代卡介苗。法国巴斯德研究所构建了一株毒力基因phoP灭活的Mtb减毒菌株SO2,该菌株的ESAT-6分泌系统被破坏,因而即使在SCID小鼠中也高度减毒,同时在小鼠、豚鼠和非人灵长类动物模型中都证实了提高的免疫保护效果(Martin C,et al.Vaccine 2006;24:3408-19.Verreck FA,et al.PLoS One 2009;4:e5264),而这种增强的免疫保护功能也被进一步证实与其持续诱导产生的多功能性CD4免疫记忆反应密切相关(Nambiar JK,et al.Eur J Immunol.2012;42:385-92),目前该减毒活疫苗菌株已经进入了I期临床试验。瑞士苏黎世大学则构建了一株zmp-1基因缺失的BCG菌株,锌金属蛋白酶Zmp-1通过干扰炎性小体激活和吞噬体成熟而介导Mtb致病,zmp-1缺失可使得BCG菌株解除对吞噬体成熟的抑制,因此,吞噬体成熟和溶酶体递送方便了BCG抗原的呈递并显著增强了其免疫原性(Johansen P,et al.Clin Vaccine Immunol.2011;18:907-13)。德国柏林Max-Planck感染生物学研究所Kaufmann小组构建的一株分泌李斯特菌溶菌素(listeriolysin,Hly)的基因重组BCG菌株(rBCGΔUreC::Hly)则由于过表达活性Hly而促进BCG MHCⅠ类抗原的呈递并提高了其抗Mtb感染的保护效力(Gorde L,et al.J.Clin.Invest.2005;115:2472-9),而这种增强的疫苗 效力与高频率的中央记忆T细胞(TCM)反应呈正相关,且过继转移抗原特异性中央记忆表型T细胞进一步证实了TCM在抗Mtb感染中的关键作用(Vogelzang A,et al.J Infect Dis.2014;210:1928-37),目前该重组疫苗已进入到了IIa期临床试验阶段。
本发明人在前期研究工作中,解析了Mtb标准毒株H37Rv MazG(MtMazG)的酶学功能,发现MtMazG是一类新的dNTP焦磷酸水解酶,其体内真正底物是5-OH-dCTP(Lv LD,et al.J.Biol.Chem.2010;285:28076-85)。而且,MtMazG是一个新的氧化压力应答基因,具有house-cleaning功能,并能维持基因组的稳定(Lv LD,et al.PLoS Pathogens.2013;9:e1003814)。进一步的转录组测序结果则发现,mazG缺失改变了H37Rv众多基因的体内表达,多个细胞壁合成相关基因和分泌蛋白表达上调,其中包括五个PE/PPE抗原、两个ESAT-6-like分泌性抗原,而这些蛋白均具备良好的抗原性和免疫原性。基于上述工作基础,我们推测mazG缺失的BCG(BCGΔmazG)重组菌株可能也会具备该免疫表型,PE/PPE、ESAT-6-like等免疫显性抗原亦将表达上调,从而提高其免疫原性并进而增强其抗结核保护效力。为此,我们构建了BCGΔmazG重组菌株,皮下接种小鼠后发现该菌株具备了较之野生型BCG明显提高的免疫原性,Mtb毒株攻击试验则证实了该菌株诱导产生了显著增强的抗结核保护效果,且增强的免疫保护与小鼠感染后明显增强的二次T细胞免疫应答相关。野生型BCG Danish株免疫小鼠产生的分泌IL-2/IFN-γ/TNF-α的PPD抗原特异性多功能T细胞比例由感染1周时的29%急剧下降至感染5周后的16%,而BCGΔmazG免疫小鼠的多功能T细胞频率则一直维持着一个较高的水平,由感染1周时的49%缓慢下降至感染5周后的39%,这在一定程度上解释了BCGΔmazG提高的免疫保护效果。与此同时,细菌体内存活试验则发现BCGΔmazG重组菌株在高剂量静脉接种后在小鼠脾、肺、肝、肾等脏器持续存活长达20w以上,较之野生型菌株,BCGΔmazG重组菌株的细菌数量明显提高。这些详实的试验数据证实了BCGΔmazG重组菌株具备了显著提高的抗结核免疫原性及其保护效力与体内持留活性,有望取代卡介苗成为预防结核感染的新型候选疫苗之一。
因此,本发明的第一个目的是提供一种基因缺失的重组卡介苗。
本发明的第二个目的是提供这种基因缺失的重组卡介苗的制备方法。
本发明的第三个目的是提供含这种基因缺失的重组卡介苗菌株的预防结 核病重组疫苗。
技术实现要素:
本发明的第一个方面是提供一种基因缺失的重组卡介苗菌株,所述重组卡介苗菌株中缺失的基因是mazG基因。
该重组菌株基因组的mazG基因通过分枝杆菌噬菌体转导介导的同源重组方式被潮霉素抗性基因所替换。
本发明的基因缺失的重组卡介苗菌株中,所述缺失的基因为序列1所示的编码分枝杆菌dNTP焦磷酸水解酶MazG的mazG基因,其中所述的mazG基因通过构建包含序列2所示的与BCG基因组序列完全匹配的mazG基因侧翼序列的同源臂-潮霉素抗性基因的分枝杆菌转导噬菌体,然后通过该噬菌体感染BCG Danish菌株而介导的同源重组方式敲除其mazG基因。
本发明的mazG基因缺失的重组卡介苗菌株保藏于中国典型培养物保藏中心((CCTCC),地址:武汉市武昌珞珈山,邮编:430072),分类:分枝杆菌科/属,保藏日期:2015年4月19日,保藏号为CCTCC M2015239,命名为牛分支杆菌BCG-DanishΔmazG(Mycobacterium bovis BCG-DanishΔmazG)。
本发明的一个优选实施方案中,所敲除的基因为编码分枝杆菌dNTP焦磷酸水解酶MazG的mazG基因。更优选的是,mazG基因通过分枝杆菌噬菌体转导介导的同源重组方式从BCG Danish菌株的基因组中被敲除。
本发明的一个优选实施方案中,所述用来介导同源重组基因敲除的分枝杆菌转导噬菌体为phageAE87。
本发明的一个更优选的实施方案中,所述构建重组分枝杆菌转导噬菌体的分枝杆菌Cosmid质粒为pYUB854。
本发明的第二个方面是提供mazG基因缺失的重组卡介苗菌株的制备方法,包括如下步骤:
1)mazG基因上下游同源臂的PCR扩增;
2)重组Cosmid质粒的构建;
3)重组转导噬菌体的构建与扩增;
4)mazG基因缺失重组卡介苗菌株的制备与鉴定。
具体来说,包括扩增mazG基因侧翼序列的上下游同源臂,并将其分别连接到Cosmid质粒pYUB854的AflII/XbaI和HindIII/XhoI位点之间,两个同源臂之间包含潮霉素抗性基因。再测序确认同源臂与BCG基因组序列完全匹配之后,将连接有同源臂的pYUB854质粒用PacI酶切,插入分支杆菌转导噬菌体phageAE87的PacI位点,构建用于敲除mazG的转导噬菌体。用该噬菌体转导BCG Danish株,筛选潮霉素抗性菌株,通过PCR和southern blot验证确定mazG基因被敲除。
更具体地说,该实施方案优选地包括以下步骤:
1)mazG基因上下游同源臂的PCR扩增:根据序列2提供的mazG基因侧翼序列,分别设计一对扩增上下游同源臂的引物,以BCG Danish株基因组DNA为模板,通过PCR扩增分别获得mazG基因上下游同源臂。
2)重组Cosmid质粒的构建:PCR扩增获得的上下游同源臂,酶切后分别连接至Cosmid质粒pYUB854的AflII/XbaI与HindIII/XhoI位点之间,两个同源臂之间包含潮霉素抗性基因。用基因测序对连接入质粒pYUB854的同源臂片段测序,确认同源臂与BCG基因组序列完全匹配。
3)重组转导噬菌体的构建与扩增:将连接有同源臂的重组pYUB854质粒用PacI酶切,插入分支杆菌转导噬菌体phageAE87的PacI位点,构建用于敲除mazG的重组转导噬菌体。然后将该重组转导噬菌体感染耻垢分枝杆菌mc2155,以体外扩增该重组转导噬菌体。
4)mazG基因缺失重组卡介苗菌株的制备与鉴定:用含mazG基因上下游同源臂的重组转导噬菌体感染BCG Danish株,涂布于含潮霉素及OADC的Middlebrook 7H11平板上,37℃培养3~4周筛选潮霉素抗性菌株,通过PCR和southern blot验证确定mazG基因被敲除。将鉴定正确的mazG基因缺失重组菌株(BCGΔmazG)在完全Middlebrook 7H9培养基中生长至对数期,离心收集菌体,并重悬于含15%甘油的PBS-T80缓冲液,-80℃冰箱中保存备用。
在所附的序列表中,序列2提供的mazG基因侧翼序列中,加粗字体“ATG……TAA”为mazG序列;下划线部分依次为上下游同源臂的上游F、上游R、下游F和下游R引物的配对区域,带□的碱基依次为mazG上游基因终止密码子TGA,及mazG下游基因的起始密码GTG和终止密码TAG。
本发明的第三个方面是提供mazG基因缺失重组卡介苗在制备预防结核病重组疫苗中的应用。
本发明以mazG基因缺失重组卡介苗(BCGΔmazG)皮下免疫BALB/c小鼠一针,接种剂量为106CFU/小鼠,在免疫后的第8周处死小鼠,无菌分离脾脏,制备脾淋巴细胞,通过ELISPOT分析小鼠的T细胞应答;同时对余下的小鼠进行结核杆菌毒株H37Rv攻击试验,并在感染后的第1周和第5周分别分离感染小鼠的肺、脾进行CFU测定和肺病理分析以评估其免疫保效果,同时分离肺组织单细胞进行二次T细胞反应测定。结果显示,较之野生型的BCG Danish菌株,本发明的mazG基因缺失重组卡介苗(BCGΔmazG)可产生抗原特异性增强T细胞免疫应答,具体表现为高水平IFN-γ的分泌。用结核杆菌毒株H37Rv攻击小鼠后,较之野生型BCG接种小鼠,BCGΔmazG免疫小鼠在感染1周肺组织的CFU数量即有降低,感染5周后肺、脾的CFU结核杆菌荷菌量均显著下降,肺免疫病理程度也明显降低,说明其诱导产生了提高的抗结核保护效果。进一步分析感染后的二次T细胞免疫应答反应发现,BCG免疫小鼠产生的分泌IL-2/IFN-γ/TNF-α的PPD抗原特异性多功能T细胞比例由感染1周时的29%急剧下降至感染5周后的16%,而BCGΔmazG免疫小鼠的多功能T细胞频率则一直维持着一个较高的水平,由感染1周时的49%缓慢下降至感染5周后的39%,这在一定程度上解释了BCGΔmazG提高的免疫保护效果。同时,细菌体内存活试验则发现BCGΔmazG重组菌株在高剂量静脉接种后在小鼠脾、肺、肝、肾等脏器持续存活长达20w以上,较之野生型菌株,BCGΔmazG重组菌株的细菌数量明显提高。这些详实的试验数据证实了BCGΔmazG重组菌株具备了显著提高的抗结核免疫原性及其保护效力与体内持留活性,因而mazG基因缺失重组卡介苗(BCGΔmazG)有望取代卡介苗成为预防结核感染的新型候选疫苗之一。
本发明所用的术语“疫苗”是指用于预防或治疗感染疾病的组合物。疫苗含有抗原或者可以表达抗原,所以,它可以诱导对抗原的免疫应答。本发明的mazG基因缺失重组卡介苗(BCGΔmazG)是在现在免疫接种用于预防结核病的卡介苗丹麦株基础之上敲除了其基因组的mazG基因,保留了所有BCG Danish株的抗原组分,同时还能诱导更强的T细胞免疫应答及对结核杆菌的免疫保护,因而可用于对结核分枝杆菌的感染、传播和流行的预防或治疗。
“接种”是指通过接种疫苗在生物体或培养系统中能动地产生免疫性(体液 免疫性,细胞免疫性,或两者)。由此可以预防阻止病原体的感染、繁殖、传播和/或流行,而且也可以抑制感染了病原体后病症的表现和/或发展。
“抗原”指含有一个或多个表位并且可以通过刺激宿主的免疫系统诱导特异于抗原的免疫应答的蛋白。免疫应答可以是体液免疫应答和/或细胞免疫应答。虽然3个到几个氨基酸可以构成表位,在蛋白质中,一个表位通常含有约7到15个氨基酸,例如8、9、10、12或14个氨基酸。抗原又称为免疫原。在本发明中,所用的抗原为mazG基因缺失BCG Danish减毒疫苗的全组分抗原,其通过接种至哺乳动物中能够存活并持续表达相应的抗原蛋白,因而可用作疫苗的成分。
“免疫应答”或“免疫学应答”指针对抗原或疫苗的体液免疫应答和/或细胞免疫应答。体液免疫应答指抗体分子介导的免疫应答,细胞免疫应答指T淋巴细胞和/或其它白细胞介导的免疫应答。细胞免疫应当包括诸如CTL的产生、辅助T细胞的产生或活化。细胞免疫应答可以通过检测诸如CD4+或CD8+T细胞等活化T细胞或其它白细胞产生的细胞因子或趋化因子来测定,如本发明中的ELISPOT或流式细胞术等方法均可测定抗原刺激后的特异性T细胞反应。另外,还可以通过诸如已知的淋巴细胞增殖测试、CTL测试、特异于抗原的T细胞测试来确定。
“重组”体指通过重组的聚核苷酸产生的化合物/组合物或细菌/病毒等染色体DNA的基因同源交换而成的新细菌/病毒。重组聚核苷酸指与天然一样非结合的聚核苷酸。表达重组聚核苷酸可以得到重组蛋白质。另外,“重组”病毒载体的定义是通过基因工程由重组聚核苷酸或它的扩增产物构建的病毒载体。“重组”细菌的定义为通过基因工程的手段过表达某些免疫优势抗原或敲除某些基因而构建的减毒细菌,如本发明中缺失mazG基因BCG Danish的重组减毒菌株BCGΔmazG。
附图说明
图1为实施例1mazG基因缺失重组卡介苗(BCGΔmazG)的构建(A)及其Southern-blot(B)与PCR(C)鉴定。
其中,WT为野生型BCG Danish株,KO为mazG基因缺失重组卡介苗菌株(BCGΔmazG),p1,p2,p3为用来PCR鉴定所用的引物。
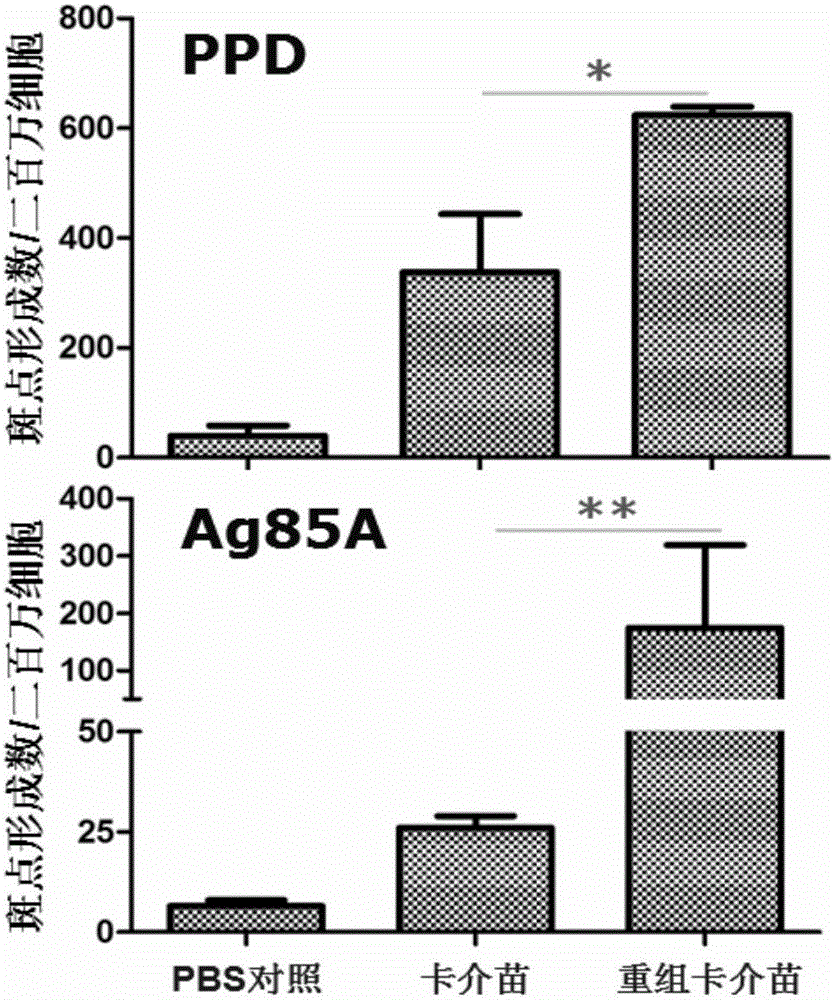
图2为实施例3mazG基因缺失重组卡介苗(BCGΔmazG)接种小鼠诱导产生提高的PPD(A)和Ag85A(B)抗原特异性T细胞免疫应答。免疫8周后分离小鼠脾淋巴细胞,抗原刺激20h后,用IFN-γELISPOT方法测定T细胞免疫反应。
图3为实施例4mazG基因缺失重组卡介苗(BCGΔmazG)诱导产生明显增强抗结核分枝杆菌感染保护效果。Mtb毒株H37Rv攻击5周后,无菌分离感染小鼠的肺和脾,组织匀浆后进行CFU涂板,培养3周后进行菌落计数。
图4为实施例5mazG基因缺失重组卡介苗(BCGΔmazG)感染结核分枝杆菌后肺炎症反应明显降低。感染5周后,分离小鼠右后腔静脉肺叶,多聚甲醛固定后进行常规的包埋、切片并进行H&E染色,显微镜下拍照后用Image Pro Plus分析组织的炎性反应。
图5为实施例6mazG基因缺失重组卡介苗(BCGΔmazG)感染结核分枝杆菌后诱导产生显著增强且持续的抗原特异性T细胞二次应答。感染5周后,分离小鼠右肺上叶制备单细胞悬液,然后进行流式细胞测定,分泌IL-2/IFN-γ/TNF-α的CD4T细胞频率进行统计分析。
图6为实施例7mazG基因缺失重组卡介苗(BCGΔmazG)尾静脉接种小鼠后的体内存活能力明显提高。小鼠静脉感染大剂量的BCGΔmazG及其对照菌之后,在感染后不同时间节点分别分离其肺、脾、肝、肾,组织匀浆后进行CFU涂板,培养3周后进行菌落计数。
具体实施方式
实施例1.mazG基因缺失重组卡介苗(BCGΔmazG)的构建与鉴定
根据序列2中的mazG基因及其侧翼序列,分别设计扩增上下游同源臂的引物对,序列如下,其中粗体显示为与基因组配对序列,下换线为加入的酶切位点,其他为保护碱基:
上游同源臂F1:CTCTCCTTAA
上游同源臂R1:CTCTCTCTAGA
下游同源臂F2:CTCTCAAGCTT
下游同源臂R2:CTCTCCTCGAG
其中上游同源臂上下游引物5'端分别引入Afl II/Xba I酶切位点,下游同源臂上下游引物5'端分别引入和Hind III/Xho I酶切位点。然后以BCG Danish基因组DNA为模板,PCR扩增mazG基因侧翼序列的上下游同源臂,并将其分别连接到Cosmid质粒pYUB854的AflII/XbaI和HindIII/XhoI位点之间,两个同源臂之间包含潮霉素抗性基因。再测序确认同源臂与BCG基因组序列完全匹配之后,将连接有同源臂的pYUB854质粒用Pac I酶切,插入分支杆菌转导噬菌体phageAE87的Pac I位点,构建用于敲除mazG的转导噬菌体。用该噬菌体转导BCG Danish株,筛选潮霉素抗性菌株,通过PCR和Southern blot验证确定mazG基因被敲除与否。
实施例2.mazG基因缺失重组卡介苗(BCGΔmazG)的制备与小鼠免疫及感染
将mazG基因缺失重组卡介苗(BCGΔmazG)及其野生型BCG Danish株在Middlebrook 7H9+10%OADC培养基中生长至对数期,4,000×g离心收集菌体,并重悬于含15%甘油的PBS-T80缓冲液(1×PBS,pH7.4,0.05%Tween80),-80℃冰箱中保存备用。
SPF级6~8周龄的雌性BALB/c小鼠购买于上海市斯莱克实验动物有限公司,10只/组,共3组,分别皮下接种(s.c.)106CFU/0.1mL BCG或BCGΔmazG,空白对照组接种0.1mL PBS-T80。免疫8周杀死4只小鼠,无菌条件下摘取脾脏,分离淋巴细胞进行T细胞免疫测定;余下小鼠则用结核杆菌毒株H37Rv进行气雾攻击100-200CFU/肺,感染后1周后,无菌分离小鼠肺并制备单细胞悬液,进行二次T细胞应答测定;感染5周后,分离小鼠后腔静脉肺叶,多聚甲醛固定后进行H&E染色进行病理测定,分离右肺上叶进行二次T细胞应答测定,其余肺叶组织匀浆后进行CFU测定。
实施例3.小鼠脾淋巴细胞制备及IFN-γELISPOT测定免疫小鼠的T细胞反应
免疫8周后,拉断颈动脉处死小鼠,无菌分离脾脏,并将每组小鼠脾脏集中于200目尼龙网袋一起碾磨,制备各组的脾淋巴细胞,以小鼠ELISPOT试剂盒(eBioscience Inc.)定量测定抗原特异的分泌IFN-γ的T淋巴细胞数量。首先用终浓度为4μg/mL的捕获抗体(clone AN-18,eBioscience Inc.)进行抗体包被过 夜,第二天加入含10%胎牛血清的1640完全培养液封闭非特异性结合的抗原位点。然后加入分离的淋巴细胞2.5×105/孔,并加入抗原刺激物至其终浓度分别为rAg85A 2μg/mL与PPD 10μg/mL继续培养细胞20h;再加入终浓度为2μg/mL的生物素标记检测抗体(clone R4-6A2,eBioscience Inc.)室温孵育2h,洗涤后加入终浓度为0.4μg/mL的HRP标记链霉亲和素,室温孵育45min后,加入100μL/孔新鲜配置的AEC底物溶液(BD Biosciences),室温孵育10~30min,实时观察斑点形成情况。
实施例4.mazG基因缺失重组卡介苗(BCGΔmazG)免疫显著提高小鼠抗结核杆菌感染的保护效果
以BCGΔmazG免疫6~8周龄SPF级雌性Balb/c小鼠,每组6只,皮下接种(s.c.)一次,并以野生型BCG和PBS作为对照,免疫8周后采用结核杆菌毒株H37Rv气雾攻击的方式感染小鼠,方法如下:起始气雾攻击菌量为107CFU/5mL,采用Glas-Col公司的099CA-4212型气雾发生装置,设定的气雾攻击参数分别为:900s、2400s、2400s、900s,然后启动气雾攻击程序,攻击结束后紫外照射30min以清除装置内残留的结核杆菌。攻击后将小鼠饲养于生物安全三级实验室,感染5周后无菌分离小鼠脾、肺,分别用碾磨珠组织均浆器(MiniBeadbeater-16,Biospec公司)制成匀浆,用PBS-T80液作10倍倍比稀释液,分别涂布于含0.5%甘油和10%OADC(BD Difco)的Middlebrook 7H11琼脂平板(BD Difco),37℃静置培养3周后进行结核杆菌菌落(CFU)计数。结果见图3,显示BCGΔmazG免疫组小鼠的脾、肺残留结核杆菌数目显著低于BCG免疫小鼠,表明本发明的mazG基因缺失重组卡介苗可显著提高抗结核杆菌感染的免疫保护效果。
实施例5.H&E染色分析感染小鼠的炎症反应和病变程度
结核杆菌气雾攻击小鼠5周后,分离感染小鼠的后腔静脉肺叶固定于20倍体积的多聚甲醛溶液中,常规包埋、切片(5μm)、并进行HE染色分析。方法如下:将组织切片置于二甲苯中脱蜡,脱蜡后的组织切片置于梯度酒精中进行水化处理,然后浸入苏木精中染色5~15min(细胞核特异性颜色),用自来水流水冲洗10~30min除去苏木精液,将切片浸入1%盐酸乙醇中分色30s,见切片 变红,颜色较浅即可。用自来水流水冲洗5~10min,然后用促蓝液返蓝10~30s,再经水洗、脱水后将切片置于0.5%伊红乙醇溶液中复染2~5min,洗涤后置于苯酚二甲苯中进行透明化处理,最后滴加中性树胶,盖上盖波片封存。制作完成的切片于光镜下进行形态学观察,并拍照,对比,分析。结果见图4,显示BCGΔmazG免疫组小鼠的肺炎症浸润程度降低,肉芽肿减少,表明本发明的mazG基因缺失重组卡介苗免疫可降低结核杆菌感染小鼠的病变程度,进一步说明获得了提高的抗结核保护效果。
实施例6.mazG基因缺失重组卡介苗(BCGΔmazG)免疫显著提高感染小鼠的Mtb抗原特异性T细胞二次应答
皮下接种(s.c.)106CFU/0.1mL BCG或BCGΔmazG至6-8周龄SPF级Balb/c小鼠,空白对照组接种0.1mL PBS。免疫8周进行结核杆菌毒株H37Rv攻击试验,感染1周与5周后,无菌分离小鼠右肺上叶进行二次T细胞应答测定。肺组织用剪刀剪碎后加入终浓度1mg/mL的胶原酶V和10U DNase I在37℃作用30min,然后用70μm细胞筛滤过处理过的肺组织以获得肺单细胞悬液。在红细胞裂解后,106细胞中加入PPD至终浓度10μg/mL,37℃ 5%CO2刺激12h,随后加入1μg/mL monensin/GolgiStop孵育5h,洗涤后至加入如下抗体进行表面染色:CD3-PB(Biolegend),CD4-Alexa Fluor 647,CD8-FITC(BD Biosciences),CD44-FITC,CD62L-Percp-Cy5.5(eBioscience),冰上孵育30min后用fix/perm进行固定和穿孔,洗涤后加入胞内细胞因子抗体IFN-γ-APC-Cy7,IL-2-PE(BD Biosciences),TNF-α-PE Cy7(eBioscience),继续冰上孵育30min后上机记性流式细胞分析(LSRFortessa,BD Biosciences)。
实施例7.mazG基因缺失重组卡介苗(BCGΔmazG)在小鼠体内存活明显提高
尾静脉注射(i.v.)107CFU/0.1mL BCGΔmazG至6-8周龄SPF级Balb/c小鼠,对照组注射同剂量的野生型BCG或互补株,在感染后的第1天、2周、4周、8周、12周和20周分别无菌分离小鼠的肺、脾、肝、肾,组织匀浆后10倍倍比稀释,取0.1mL分别涂布于含0.5%甘油和10%OADC的Middlebrook7H11琼脂平板,37℃静置培养3周后进行菌落(CFU)计数。结果见图6所示,BCGΔmazG重组菌株在高剂量静脉接种后在小鼠脾、肺、肝、肾等脏器持续存 活长达20w以上,较之野生型菌株,BCGΔmazG重组菌株的细菌数量明显提高。
序列表
- 还没有人留言评论。精彩留言会获得点赞!