一种以细菌纤维素为载体的固定化酶及其制备方法与流程
本发明涉及固定化酶技术领域,具体涉及一种以细菌纤维素为载体的固定化酶及其制备方法。
背景技术:
固定化酶(immobilized enzyme)是通过物理的或化学的方法,将酶束缚于水不溶性载体上或一定的空间内,从而达到限制酶分子的自由流动,但能使酶充分发挥催化作用的技术,反应结束后并能使酶与底物、产物分开,酶能够重复使用。固定化酶的制备方法可分为以下几种:吸附、共价结合、包埋和交联。共价结合方式是将酶与载体通过共价键连接起来。为了达到有效的共价连接,必须先活化载体或酶上的有关官能团。与其它非共价、吸附作用的固定化方法相比,共价结合能给酶与载体之间提供最强的结合力,酶与载体的连接很牢,使用过程中酶漏出量最少,稳定性良好。
然而综合现有共价结合固定化酶的技术,发现这些方法存在以下弊端:(1)、载体的活化及固定化操作复杂,过程繁琐;(2)、载体的活化及固定化反应条件较剧烈,极易影响载体和酶的活性;(3)、载体的形状和尺寸过于单一,不利于制备形状和尺寸多样性的固定化酶。
技术实现要素:
为解决上述问题,本发明提供了一种以细菌纤维素为载体的固定化酶及其制备方法。本发明固定化酶的制备方法工艺简单,反应条件温和,制得的固定化酶采用形状和尺寸可控的细菌纤维素作为载体,有利于获得形状与尺寸多样化的固定化酶。
本发明第一方面提供了一种以细菌纤维素为载体的固定化酶,包括细菌纤维素和酶,所述细菌纤维素和所述酶通过C-N键进行共价结合。
优选地,所述细菌纤维素为细菌纤维素膜、细菌纤维素球或细菌纤维素棒。
优选地,所述细菌纤维素球的直径为1μm-0.5cm。
优选地,所述细菌纤维素膜的边长为1μm-3cm,厚度为1μm-3cm。
优选地,所述细菌纤维素棒的长度为1μm-3cm,所述细菌纤维素棒的截面为圆形,直径为1μm-0.5cm。
所述酶为含有氨基基团的酶。优选地,所述酶为淀粉酶、脂肪酶、纤维素酶、果胶酶、乳糖酶或蛋白酶。
本发明第一方面提供的一种以细菌纤维素为载体的固定化酶,细菌纤维素的尺寸和形状可控,有利于获得形状与尺寸多样化的固定化酶。
本发明第二方面提供了一种以细菌纤维素为载体的固定化酶的制备方法,包括以下步骤:
(1)提供细菌纤维素,将所述细菌纤维素置于氧化剂溶液中,室温下避光搅拌8-12小时,所述细菌纤维素结构中的邻二羟基被氧化成醛基,洗涤后,得到活化后的细菌纤维素;所述氧化剂选自高碘酸钠、偏高碘酸钾、偏高碘酸钠和四醋酸铅中的至少一种;所述氧化剂和所述细菌纤维素的质量比为10:1-135:1;
(2)将所述活化后的细菌纤维素置于酶溶液中,室温下避光搅拌2-6小时,所述活化后的细菌纤维素和所述酶的质量比为0.72:1-4.28:1;然后加入还原剂氰基硼氢化钠,室温下继续避光搅拌8-40小时,洗涤后,真空干燥,得到以细菌纤维素为载体的固定化酶,所述还原剂与所述酶的质量比为1:1-6.5:1,所述以细菌纤维素为载体的固定化酶包括细菌纤维素和酶,所述细菌纤维素和所述酶通过C-N键进行共价结合。
优选地,所述细菌纤维素为细菌纤维素膜、细菌纤维素球或细菌纤维素棒。
优选地,所述细菌纤维素球的直径为1μm-0.5cm。
优选地,所述细菌纤维素膜的边长为1μm-3cm,厚度为1μm-3cm。
优选地,所述细菌纤维素棒的长度为1μm-3cm,所述细菌纤维素棒的截面为 圆形,直径为1μm-0.5cm。
所述酶为含有氨基基团的酶。优选地,所述酶为淀粉酶、脂肪酶、纤维素酶、果胶酶、乳糖酶或蛋白酶。
优选地,所述酶溶液中的溶剂为蒸馏水或磷酸盐缓冲液。
优选地,所述氧化剂溶液中的溶剂为去离子水。
本发明第二方面提供的一种以细菌纤维素为载体的固定化酶的制备方法,活化和固定化条件温和,工艺简单,所制得的以细菌纤维素为载体的固定化酶形状和尺寸可控,固定化酶的形状和尺寸可灵活设计。
综上,本发明有益效果包括以下几个方面:
1、本发明提供的以细菌纤维素为载体的固定化酶在制备过程中,活化和固定化反应条件温和、操作简单,降低了活化和固定化过程中对载体和酶活力的损失,十分适用于固定化酶的工业化生产;
2、本发明以细菌纤维素作为载体,其形状和尺寸具有可被灵活设计的特点,有利于获得形状与尺寸可控性良好的固定化酶。
附图说明
图1为本发明实施例中不同尺寸的细菌纤维素球的照片;
图2为本发明实施例以细菌纤维素为载体的固定化酶的制备流程图;
图3为本发明实施例细菌纤维素的活化反应以及活化后的细菌纤维素和酶固定反应的示意图;
图4为本发明实施例1的以细菌纤维素为载体的固定化脂肪酶的显色反应图。
具体实施方式
以下所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
本发明第一方面提供了一种以细菌纤维素为载体的固定化酶,包括细菌纤维素和酶,细菌纤维素和酶通过C-N键进行共价结合。
通过合适工艺获得不同形态、尺寸及微观结构的细菌纤维素作为载体,细菌纤维素的来源不限。
优选地,细菌纤维素为细菌纤维素膜、细菌纤维素球或细菌纤维素棒。
优选地,细菌纤维素球的直径为1μm-0.5cm。
优选地,细菌纤维素膜的边长为1μm-3cm,厚度为1μm-3cm。
优选地,细菌纤维素棒的长度为1μm-3cm,所述细菌纤维素棒的截面为圆形,直径为1μm-0.5cm。
要获得理想的固定化酶,载体的作用十分关键。细菌纤维素是指在不同条件下,由醋酸均属(Acetobacter)、土壤杆菌属(Agrobacterium)、根瘤菌属(Rhizobium)和八叠球菌属(Sarcina)等中的某种微生物合成的纤维素的统称。细菌纤维素与植物或海藻生产的天然纤维素具有相同的分子结构单元,但有许多不同于天然纤维素的结构特质:(1)、超精细的网状结构,细菌纤维素是由直径3~4纳米的微纤组合成40~60纳米粗的纤维束,并相互交织形成发达的超精细网络结构;(2)、细菌纤维素有很强的持水能力(water retention values,WRV),未经干燥的细菌纤维素的WRV值高达1000%以上,冷冻干燥后的持水能力仍超过600%。(3)、细菌纤维素生物的合成具有可调控性,改变不同的生物碳源,可控制微纤维的纳米尺寸。运用不同的模型,可形成各种形状的功能材料。本发明以细菌纤维素作为固定化酶的载体,原料方便易得,形状和尺寸可控,可以得到形状和尺寸可控性良好的固定化酶,对于固定化酶的工业化生产和灵活应用十分有利。
酶为含有氨基基团的酶。优选地,酶为淀粉酶、脂肪酶、纤维素酶、果胶酶、乳糖酶或蛋白酶。
细菌纤维素与酶通过稳定的C-N键进行共价结合,这一结合方式对得到稳定性好的固定化酶十分有利,便于酶的回收和再利用。
本发明第一方面提供的以细菌纤维素为载体的固定化酶,细菌纤维素的形状与尺寸可控,采用形状与尺寸可控的细菌纤维素为固定化酶的载体,有利于获得 形状与尺寸多样化的固定化酶,对于固定化酶的工业化生产和灵活应用十分有利。
本发明第二方面提供了一种以细菌纤维素为载体的固定化酶的制备方法,包括以下步骤:
(1)提供细菌纤维素,将细菌纤维素置于氧化剂溶液中,室温下避光搅拌8-12小时,细菌纤维素结构中的邻二羟基被氧化成醛基,洗涤后,得到活化后的细菌纤维素;氧化剂选自高碘酸钠、偏高碘酸钾、偏高碘酸钠和四醋酸铅中的至少一种;氧化剂和细菌纤维素的质量比为10:1-135:1;
(2)将活化后的细菌纤维素置于酶溶液中,室温下避光搅拌2-6小时,活化后的细菌纤维素和酶的质量比为0.72:1-4.28:1;然后加入还原剂氰基硼氢化钠,室温下继续避光搅拌8-40小时,洗涤后,真空干燥,得到以细菌纤维素为载体的固定化酶,还原剂和酶的质量比为1:1-6.5:1,以细菌纤维素为载体的固定化酶包括细菌纤维素和酶,细菌纤维素和酶通过C-N键进行共价结合。
细菌纤维素的来源不限,可按照现有的制备方法制得。
通过合适工艺获得不同形态、尺寸及微观结构的细菌纤维素作为载体,细菌纤维素的来源不限。
优选地,细菌纤维素为细菌纤维素膜、细菌纤维素球或细菌纤维素棒。
优选地,细菌纤维素球的直径为1μm-0.5cm。
优选地,细菌纤维素膜的边长为1μm-3cm,厚度为1μm-3cm。
优选地,细菌纤维素棒的长度为1μm-3cm,所述细菌纤维素棒的截面为圆形,直径为1μm-0.5cm。
优选地,氧化剂溶液中的溶剂为去离子水。
优选地,氧化剂溶液的浓度为0.1-1.1mol/L。
酶为含有氨基基团的酶。优选地,酶为淀粉酶、脂肪酶、纤维素酶、果胶酶、乳糖酶或蛋白酶。
优选地,酶溶液中的溶剂为蒸馏水或磷酸盐缓冲液。
优选地,酶溶液的浓度为1-30mg/ml。
步骤(1)中所述细菌纤维素结构中的邻二羟基为细菌纤维素结构中D-吡喃葡萄糖单元中相邻的两个羟基,经过氧化剂的氧化反应,细菌纤维素结构中D-吡喃葡萄糖单元中相邻的两个羟基被氧化成两个醛基。
优选地,步骤(2)中活化后的细菌纤维素和酶发生反应生成席夫碱,然后加入还原剂,席夫碱被还原,得到以细菌纤维素为载体的固定化酶。
优选地,步骤(2)中加入所述还原剂氰基硼氢化钠后,室温下继续避光搅拌8-15小时。
优选地,步骤(1)洗涤方法为:将细菌纤维素先采用乙二醇溶液洗涤,然后采用双蒸水洗涤,得到活化后的细菌纤维素。
优选地,步骤(2)洗涤方法为:使用蒸馏水洗涤2到3次。
优选地,将以细菌纤维素为载体的固定化酶进行冷冻干燥。
采用氧化剂在室温下将富含羟基的细菌纤维素进行活化,使细菌纤维素结构中的邻二羟基被氧化成醛基,得到活化后的细菌纤维素,然后将活化后的细菌纤维素和酶反应,以酶活性蛋白中赖氨酸残基上的氨基作为活性位点,与活化后富含醛基的细菌纤维素载体在室温下先形成席夫碱(Schiff base),进一步在极其温和的条件下进行还原,席夫碱亚胺基团中的C=N键被还原成C-N键,使细菌纤维素和酶通过C-N键进行共价结合,结合方式稳定,有利于得到稳定性高的固定化酶。
本发明第二方面提供的一种以细菌纤维素为载体的固定化酶的制备方法,活化和固定化条件温和,工艺简单,所制得的以细菌纤维素为载体的固定化酶形状和尺寸可控,可灵活设计。
本发明旨在提供一种采用形状与尺寸可控的细菌纤维素作为载体的新型固定化酶及其制备方法,首先,通过合适工艺获得不同形态、尺寸及微观结构的细菌纤维素作为载体,然后,室温下采用十分温和的氧化剂一步得到活化的载体,进一步在室温下采用活化的载体与活性酶蛋白进行处理,使其互相进行共价结合,制得一种以形状与尺寸可控的细菌纤维素为载体的固定化酶。所制得的以形状与尺寸可控的细菌纤维素为载体的固定化酶具有载体形状多样化,酶活收率 高、稳定性好的优点,所采用的制备方法具有载体活化及固定化操作简单,反应条件温和的优点。所制得的固定化酶因载体形状与尺寸可控性良好,对于固定化酶的工业化生产和使用十分有利。
图1为本发明实施例中不同尺寸的细菌纤维素球的照片;从图1中可以看出,可以根据不同的需要,制备出不同尺寸的细菌纤维素球。从左到右,瓶中细菌纤维素球的尺寸依次为0.5mm、1mm、2mm和3mm。
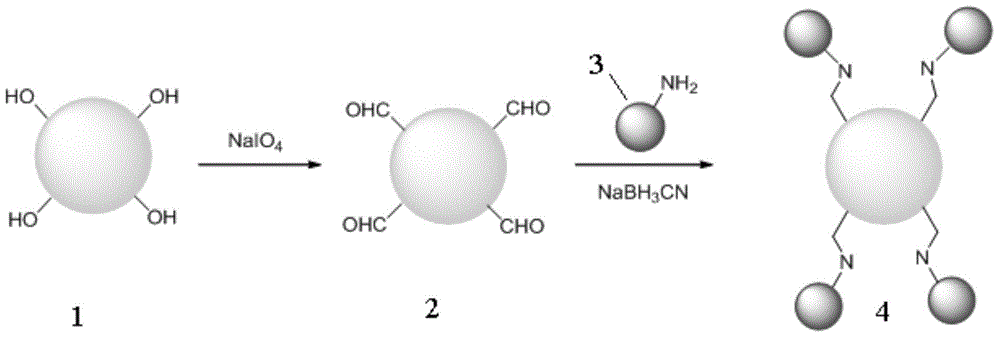
图2为本发明实施例以细菌纤维素为载体的固定化酶的制备流程图;细菌纤维素1被氧化剂(如高碘酸钠,NaIO4)氧化后,细菌纤维素中的邻二羟基被氧化成醛基,得到活化后的细菌纤维素2,将活化后的细菌纤维素2和酶3混合,并在还原剂的作用下,得到以细菌纤维素为载体的固定化酶4,细菌纤维素和酶通过C-N键进行共价结合。
图3为细菌纤维素的活化反应以及活化后的细菌纤维素和酶反应的示意图。从图3中可以看出,通过调整氧化剂(如高碘酸钠,NaIO4)与细菌纤维素载体的质量比,可得到不同活化程度的细菌纤维素载体,例如图3中的(a)、(b)为不同活化程度的细菌纤维素;不同活化程度的纤维素载体用于制备固定化酶时,调整酶(用R-NH2表示)和活化后的细菌纤维素载体的质量比,可以进一步控制载体上酶的负载量,从而控制固定化酶催化活性大小,如图3中的(c)、(d)、(e)、(f)、(g)、(h)和(i))为具有不同酶负载量的细菌纤维素载体。本发明以细菌纤维素为载体的固定化酶活性在一定程度上具有可控性。
实施例1:
一种以细菌纤维素为载体的固定化酶的制备方法,包括以下步骤:
(1)取10.6950g(湿重,含水量为99.2%)直径为1.0cm的细菌纤维素球,加入到50ml 0.1mol/L的高碘酸钠溶液中,室温下避光搅拌8小时,细菌纤维素结 构中的邻二羟基被氧化成醛基,反应后分别用0.2mol/L的乙二醇溶液和双蒸水先后洗涤,获得活化后的细菌纤维素;
(2)取10ml 2mg/ml的脂肪酶溶液,加入上述活化后的细菌纤维素,室温下避光充分搅拌2小时,然后加入0.1258g氰基硼氢化钠,室温下继续避光搅拌8小时,蒸馏水充分洗涤,冻干,得以细菌纤维素为载体的固定化脂肪酶0.9056g。细菌纤维素和酶通过C-N键进行共价结合。
取0.02g上述以细菌纤维素为载体的固定化脂肪酶与0.02g细菌纤维素分别加入到0.2%的茚三酮溶液中,沸水浴中加热片刻,图4为本发明实施例1的以细菌纤维素为载体的固定化脂肪酶的显色反应图。从图4a左图中可以看出,经去离子水充分透析、洗涤后的以细菌纤维素为载体的固定化脂肪酶使茚三酮溶液变蓝;图4a右图中细菌纤维素没有使茚三酮溶液变蓝;同时,取0.02g经去离子水充分透析、洗涤后的以细菌纤维素为载体的固定化脂肪酶与0.02g细菌纤维素加入到浓硝酸溶液中,沸水浴中加热片刻,从图4b左图中可以看出,硝酸溶液使以细菌纤维素为载体的固定化脂肪酶变黄。图4b右图中细菌纤维素没有变色。说明本实施例通过上述制备方法获得具有一定酶负载量的以细菌纤维素为载体的固定化酶。
测试上述制得的以细菌纤维素为载体的固定化脂肪酶的活力:以4ml橄榄油乳化液为底物,加5ml,0.25M,pH=7.5的PBS缓冲液,在40℃下保温5分钟,加入0.02g上述以细菌纤维素为载体的固定化脂肪酶,精确计时保温30min,最后加15ml,95%乙醇,终止酶反应。加3滴酚酞用0.05mol/LNaOH滴定产生的酸,消耗氢氧化钠溶液4.9ml,我们定义在40℃,pH=7.5,每分钟水解释放出1μmol游离有机酸所需的脂肪酶的量为一个活力单位,活力计算方法如下:固定化酶的活力:U(u/mg)=V(氢氧化钠溶液体积)×N(氢氧化钠溶液浓度)×103/t(反应时间)=9.8×10-6。由此可知,本发明实施例1制得的固定化酶具有较高的酶活力。
实施例2:
一种以细菌纤维素为载体的固定化酶的制备方法,包括以下步骤:
(1)取10.3711g(湿重,含水量为99.2%)边长为2.5cm×2.5cm、厚度为0.2mm的细菌纤维素膜,加入到50ml 0.3mol/L的高碘酸钠溶液中,室温下避光搅拌12小时,细菌纤维素结构中的邻二羟基被氧化成醛基,反应后分别用0.2mol/L的乙二醇溶液和双蒸水先后洗涤,获得活化后的细菌纤维素。
(2)取10ml 4mg/ml的脂肪酶溶液,加入上述活化后的细菌纤维素,室温下避光充分搅拌6小时,加入0.1258g氰基硼氢化钠,室温下继续避光搅拌10小时,蒸馏水充分洗涤,冻干,得到以细菌纤维素为载体的固定化脂肪酶0.8936g。细菌纤维素和酶通过C-N键进行共价结合。
取0.02g上述以细菌纤维素为载体的固定化脂肪酶与0.02g细菌纤维素分别加入到0.2%的茚三酮溶液中,沸水浴中加热片刻,以细菌纤维素为载体的固定化脂肪酶使茚三酮溶液变蓝;细菌纤维素没有使茚三酮溶液变蓝;同时,取0.02g以细菌纤维素为载体的固定化脂肪酶与0.02g细菌纤维素加入到浓硝酸溶液中,沸水浴中加热片刻,硝酸溶液使以细菌纤维素为载体的固定化脂肪酶变黄。细菌纤维素没有变色。说明本实施例通过上述制备方法获得具有一定酶负载量的以细菌纤维素为载体的固定化酶。
测试上述制得的以细菌纤维素为载体的固定化脂肪酶的活力:以4ml橄榄油乳化液为底物,加5ml,0.25M,pH=7.5的PBS缓冲液,在40℃下保温5分钟,然后加入0.02g上述以细菌纤维素为载体的固定化脂肪酶,精确计时保温30min,最后加15ml,95%乙醇,终止酶反应。加3滴酚酞用0.05mol/L NaOH滴定产生的酸,消耗氢氧化钠1.4ml,我们定义在40℃,pH=7.5,每分钟水解释放出1μmol游离有机酸所需的脂肪酶的量为一个活力单位,活力计算方法如下:固定化酶的活力:U(u/mg)=V(氢氧化钠溶液体积)×N(氢氧化钠溶液浓度)×103/t(反应时间)=2.3×10-6。由此可知,本发明实施例2制得的固定化酶具有较高的酶活力。
实施例3:
一种以细菌纤维素为载体的固定化酶的制备方法,包括以下步骤:
(1)取10.2349g(湿重,含水量为99.2%)边长为3.0cm×3.0cm、厚度为0.2mm的细菌纤维素膜,加入到50ml 0.5mol/L的高碘酸钠溶液中,室温下避光搅拌10小时,细菌纤维素结构中的邻二羟基被氧化成醛基,反应后分别用0.2mol/L的乙二醇溶液和双蒸水先后洗涤,获得活化后的细菌纤维素。
(2)取10ml 6mg/ml的脂肪酶溶液,加入上述活化后的细菌纤维素,室温下避光充分搅拌4小时,加入0.1258g氰基硼氢化钠,室温下继续避光搅拌12小时,蒸馏水充分洗涤,冻干,得到以细菌纤维素为载体的固定化脂肪酶0.8973g。细菌纤维素和酶通过C-N键进行共价结合。
取0.02g上述以细菌纤维素为载体的固定化脂肪酶与0.02g细菌纤维素分别加入到0.2%的茚三酮溶液中,沸水浴中加热片刻,以细菌纤维素为载体的固定化脂肪酶使茚三酮溶液变蓝;细菌纤维素没有使茚三酮溶液变蓝;同时,取0.02g以细菌纤维素为载体的固定化脂肪酶与0.02g细菌纤维素加入到浓硝酸溶液中,沸水浴中加热片刻,硝酸溶液使以细菌纤维素为载体的固定化脂肪酶变黄。细菌纤维素没有变色。说明本实施例通过上述制备方法获得具有一定酶负载量的以细菌纤维素为载体的固定化酶。
测试上述制得的以细菌纤维素为载体的固定化脂肪酶的活力:以4ml橄榄油乳化液为底物,加5ml,0.25M,pH=7.5的PBS缓冲液,在40℃下保温5分钟,然加入0.02g上述纤维素固定化的脂肪酶,精确计时保温30min,最后加15ml,95%乙醇,终止酶反应。加3滴酚酞用0.05mol/L NaOH滴定产生的酸,消耗氢氧化钠0.7ml,我们定义在40℃,pH=7.5,每分钟水解释放出1μmol游离有机酸所需的脂肪酶的量为一个活力单位,活力计算方法如下:固定化酶的活力:U(u/mg)=V(氢氧化钠溶液体积)×N(氢氧化钠溶液浓度)×103/t(反应时间)=1.2×10-6。由此可知,本发明实施例3制得的固定化酶具有较高的酶活力。
实施例4:
一种以细菌纤维素为载体的固定化酶的制备方法,包括以下步骤:
(1)取10.3902g(湿重,含水量为99.2%)直径为0.2cm的细菌纤维素球, 加入到50ml 0.7mol/L的高碘酸钠溶液中,室温下避光搅拌8小时,细菌纤维素结构中的邻二羟基被氧化成醛基,反应后分别用0.2mol/L的乙二醇溶液和双蒸水先后洗涤,获得活化后的细菌纤维素。
(2)取10ml 8mg/ml的1,4-α-D-葡聚糖水解酶溶液,加入上述活化后的细菌纤维素,室温下避光充分搅拌2小时,加入0.1258g氰基硼氢化钠,室温下继续避光搅拌40小时,蒸馏水充分洗涤,冻干,得到以细菌纤维素为载体的固定化的1,4-α-D-葡聚糖水解酶0.9012g。细菌纤维素和酶通过C-N键进行共价结合。
取0.02g上述以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶与0.02g细菌纤维素分别加入到0.2%的茚三酮溶液中,沸水浴中加热片刻,以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶使茚三酮溶液变蓝;细菌纤维素没有使茚三酮溶液变蓝;同时,取0.02g以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶与0.02g细菌纤维素加入到浓硝酸溶液中,沸水浴中加热片刻,硝酸溶液使以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶变黄。细菌纤维素没有变色。说明本实施例通过上述制备方法获得具有一定酶负载量的以细菌纤维素为载体的固定化酶。
测试上述制得的以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶的活力:将上述细菌纤维素固定化的1,4-α-D-葡聚糖水解酶加到蒸馏水中配制成浓度为2mg/ml的细菌纤维素固定化的1,4-α-D-葡聚糖水解酶溶液,取1ml 2mg/ml的细菌纤维素固定化的1,4-α-D-葡聚糖水解酶溶液,加入到50ml锥形瓶中,加入2ml10mg/ml的3,5-二硝基水杨酸,同时,另取1ml 10mg/ml的淀粉溶液于10ml锥形瓶中,将上述两个锥形瓶分别置40℃恒温水浴中保温10min,然后将上述两个锥形瓶中的淀粉溶液和1,4-α-D葡聚糖水解酶溶液混合后置40℃下准确保温5min后,取少量溶液,测定淀粉在1,4-α-D-葡聚糖水解酶催化下降解产生的麦芽糖含量C为2.83mg。我们定义在40℃,pH=5.6下,每分钟释放出的麦芽糖含量占淀粉总质量的百分数为一个活力单位,活力计算方法如下:U=(/min)=C(麦芽糖质量)/w(淀粉质量)t(反应时间)=5.6%/min。由此可知,本发明实施例4制得的固定化酶具有较高的酶活力。
实施例5:
一种以细菌纤维素为载体的固定化酶的制备方法,包括以下步骤:
(1)取10.9382g(湿重,含水量为99.2%)直径为0.3cm的细菌纤维素球,加入到50ml 0.9mol/L的高碘酸钠溶液中,室温下避光搅拌8小时,细菌纤维素结构中的邻二羟基被氧化成醛基,反应后分别用0.2mol/L的乙二醇溶液和双蒸水先后洗涤,获得活化后的细菌纤维素。
(2)取10ml 10mg/ml的1,4-α-D葡聚糖水解酶溶液,加入上述活化后的细菌纤维素,室温下避光充分搅拌2小时,加入0.1258g氰基硼氢化钠,室温下继续避光搅拌8小时,蒸馏水洗涤3次,冻干,得到以细菌纤维素为载体的固定化的1,4-α-D-葡聚糖水解酶0.9321g。细菌纤维素和酶通过C-N键进行共价结合。
取0.02g上述以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶与0.02g细菌纤维素分别加入到0.2%的茚三酮溶液中,沸水浴中加热片刻,以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶使茚三酮溶液变蓝;细菌纤维素没有使茚三酮溶液变蓝;同时,取0.02g以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶与0.02g细菌纤维素加入到浓硝酸溶液中,沸水浴中加热片刻,硝酸溶液使以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶变黄。细菌纤维素没有变色。说明本实施例通过上述制备方法获得具有一定酶负载量的以细菌纤维素为载体的固定化酶。
测试上述制得的以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶的活力:将上述细菌纤维素固定化的1,4-α-D-葡聚糖水解酶加到蒸馏水中配制成浓度为2mg/ml的细菌纤维素固定化的1,4-α-D-葡聚糖水解酶溶液,取1ml 2mg/ml细菌纤维素固定化的1,4-α-D-葡聚糖水解酶溶液,加入到50ml锥形瓶中,加入2ml10mg/ml的3,5-二硝基水杨酸,同时,另取1ml 10mg/ml的淀粉溶液于10ml锥形瓶中,将上述两个锥形瓶分别置40℃恒温水浴中保温10min,然后将上述两个锥形瓶中的淀粉溶液和1,4-α-D葡聚糖水解酶溶液混合后置40℃下准确保温5min后,取少量溶液,测定淀粉在1,4-α-D-葡聚糖水解酶催化下降解产生的麦芽糖含量C为 2.95mg。我们定义在40℃,pH=5.6下,每分钟释放出的麦芽糖含量占淀粉总质量的百分数为一个活力单位,活力计算方法如下:U=(/min)=C/wt=5.6%/min。由此可知,本发明实施例5制得的固定化酶具有较高的酶活力。
实施例6:
一种以细菌纤维素为载体的固定化酶的制备方法,包括以下步骤:
(1)取10.8361g(湿重,含水量为99.2%)细菌纤维素棒,细菌纤维素棒的长度为3cm,横截面为圆形,直径为0.5cm,加入到50ml 1.1mol/L的高碘酸钠溶液中,室温下避光搅拌8小时,细菌纤维素结构中的邻二羟基被氧化成醛基,反应后分别用0.2mol/L的乙二醇溶液和双蒸水先后洗涤,获得活化后的细菌纤维素。
(2)取10ml 12mg/ml的脂肪酶溶液,加入上述活化后的细菌纤维素,室温下避光充分搅拌2小时,加入0.1258g氰基硼氢化钠,室温下继续避光搅拌15小时,蒸馏水洗涤2到3次,冻干,得到以细菌纤维素为载体的固定化的1,4-α-D-葡聚糖水解酶0.9348g。细菌纤维素和酶通过C-N键进行共价结合。
取0.02g上述以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶与0.02g细菌纤维素分别加入到0.2%的茚三酮溶液中,沸水浴中加热片刻,以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶使茚三酮溶液变蓝;细菌纤维素没有使茚三酮溶液变蓝;同时,取0.02g以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶与0.02g细菌纤维素加入到浓硝酸溶液中,沸水浴中加热片刻,硝酸溶液使以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶变黄。细菌纤维素没有变色。说明本实施例通过上述制备方法获得具有一定酶负载量的以细菌纤维素为载体的固定化酶。
测试上述制得的以细菌纤维素为载体的固定化1,4-α-D-葡聚糖水解酶的活力:将上述细菌纤维素固定化的1,4-α-D-葡聚糖水解酶加到蒸馏水中配制成浓度为2mg/ml的细菌纤维素固定化的1,4-α-D-葡聚糖水解酶溶液,取1ml 2mg/ml细菌纤维素固定化的1,4-α-D-葡聚糖水解酶溶液,加入到50ml锥形瓶中,加入2ml10mg/ml的3,5-二硝基水杨酸,同时,另取1ml 10mg/ml的淀粉溶液于10ml锥形瓶 中,将上述两个锥形瓶分别置40℃恒温水浴中保温10min,然后将上述两个锥形瓶中的淀粉溶液和1,4-α-D葡聚糖水解酶溶液混合后置40℃下准确保温5min后,取少量溶液,测定淀粉在1,4-α-D-葡聚糖水解酶催化下降解产生的麦芽糖含量C2.99mg。我们定义在40℃,pH=5.6下,每分钟释放出的麦芽糖含量占淀粉总质量的百分数为一个活力单位,活力计算方法如下:U=(/min)=C/wt=5.6%/min。由此可知,本发明实施例6制得的固定化酶具有较高的酶活力。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!