荧光纳米铜簇的发卡式DNA模板及其应用的制作方法
本发明涉及功能化材料领域和荧光纳米探针及分子识别和生物传感技术领域,具体公开了一种新的荧光纳米铜簇合成用DNA模板及其在生物分子检测中的应用。
背景技术:
现有技术公开了荧光分析技术具有简单直观的特性,以及时间和空间分辨能力,该技术广泛应用于体内、外目标分子的检测[Wu J.,Liu W.,Ge J.,Zhang H.,Wang P.Chem.Soc.Rev.,2011,40,3483–3495]。典型的包括有机荧光染料分子[Dsouza R.N.,Pischel U.,Nau W.M.,Chem.Rev.,2011,111(12),7941-7980]、聚集诱导增强和淬灭的荧光染料[Wang B.,Yu C.,Angew.Chem.Int.Ed.,2010,49(8):1485-1488;Hu Q.,Gao M.,Feng G.,Chen X.,Liu B.ACS Appl.Mater.Interfaces,2015,7(8),4875–4882],以及近几十年来发展迅速的纳米荧光探针,如量子点[Bruchez M.,Moronne M.,Gin P.,Weiss S.,Science,1998,281(5385),2013-2016;Resch-Genger U.,Grabolle M.,Cavaliere-Jaricot S.,Nitschke R.,Nat.Methods,2008,5(9),763-775]、上转换纳米晶[Haase M.,Schafer H.Upconverting nanoparticles.Angew.Chem.Int.Edit,2011,50(26),5808-5829]、碳点[Baker S.N.,Baker G.A.Angew.Chem.Int.Edit,2010,49,6726-2744],以及金属纳米簇,如金、银和铂等纳米簇已发展成为继有机染料、量子点之后的新型荧光纳米材料,并被应用于体内外化学和生物分子的检测以及影像学研究[Zhang L.,Wang E.,Metal nanoclusters:New fluorescent probes for sensors and bioimaging.Nano Today,2014,9(1),132-157;Lu Y.,Chen W.Sub-nanometre sized metal clusters:from synthetic challenges to the unique property discoveries.Chem.Soc.Rev.,2012,41(9),3594-3623]。金属纳米簇的广泛应用主要依据以下特点:1)发射波长可调且范围宽,涵盖可见-红外区;2)Stoke’s位移 较大,背景低;3)生物相容性好,可用于细胞内影像学研究;4)均相反应无需洗涤分离,免标记,方便易行;5)检测模式的多样化。尤其是DNA模板的发展,使其可方便地结合杂交、适配体识别以及核酸等温扩增技术,拓宽至不同类型的目标物检测,如金属离子、小分子、核酸和蛋白等。
相比于金、银和铂纳米簇,基于DNA模板制备的荧光纳米铜簇不仅具有背景低、环境友好、免标记和均相无需分离等特点,其制备过程还具有以下突出优势:合成快速,一般在几分钟内完成,远低于其它纳米簇形成所需的数小时甚至过夜;其次,反应条件温和;特定DNA模板存在下,硫酸铜由维生素C在中性pH、室温条件下还原即可形成。
目前,荧光纳米铜簇制备所用的DNA模板集中在双链模板和线性多聚脱氧胸苷(poly T)模板,可应用于核酸酶、核酸、三磷酸腺苷以及碱性磷酸酯酶等物质的检测。
但是,就目前而言,荧光纳米铜簇的研究仍处于初级阶段,发展新型的荧光纳米铜簇的模板,尤其是新型的DNA模板,并改善荧光铜簇荧光性能,进一步拓宽荧光纳米铜簇的应用范围是该领域发展的重要方向。
技术实现要素:
本发明目的在于提供一种新的荧光纳米铜簇合成用DNA模板及其在生物分子检测中的应用。所述的DNA模板环部为多聚脱氧胸苷(poly T)的发卡式DNA模板(MB-Tn)。
本发明提供一种荧光纳米铜簇的新型DNA模板,并获得该模板的碱基组成和长度不同与形成荧光纳米铜簇直接的相互关系,进一步提供其在生物分子检测中的应用。
本发明中,DNA模板所用DNA序列如图1所示。
本发明公开的荧光纳米铜簇合成模板为具有poly T环部的发卡式DNA模板(MB-Tn)。
本发明的发卡式结构DNA模板MB-Tn,其环部为不同长度的poly T,其茎部为不同长度和碱基排列的双链序列(或带粘性末端),以此模板形成的荧光纳米铜簇,具有DNA序列依赖性;该发卡式DNA模板在一定的缓冲液中,以及硫酸 铜和维生素C作用下,室温反应几分钟即可产生荧光信号。
本发明中,环部poly T长度范围为5-40个寡核苷酸,即T数目可低至5,且随着poly T数目增多,形成的荧光铜簇的荧光强度逐渐增加;如,环部T碱基数目大于40后,仍可以作为模板形成强荧光信号的铜簇,相对而言,线性poly T长度小于15时,则不能作为模板形成荧光铜簇;此外,环部换成其他类型的碱基如:poly A、poly C和poly(CT)时,均无法形成荧光铜簇,荧光信号低;
本发明公开了基于MB-Tn合成荧光纳米铜簇的制备方法,进一步获得了MB-Tn序列的茎部、环部碱基以及序列长度对于荧光纳米铜簇形成的影响及规律。
本发明中,发卡式DNA模板MB-Tn的茎部双链的长度对于荧光纳米铜簇形成具有影响:其小于12bp,随着茎部延长,荧光强度逐渐增强;大于12bp时,荧光纳米铜簇信号趋于稳定;
本发明中所述的发卡式DNA模板,其具有3种不同类型的茎部双链序列,包括a)无形成荧光铜簇的能力(GC MB-Tn,CGC GCC GGC GCG CGC CGC tn CGC GCC GGC GCG CGC CGC);b)形成荧光铜簇的能力较弱(RS1 MB-Tn,ACC TTC CTC CGC AAT ACT tn AGT ATT GCG GAG GAA GGT);c)形成荧光铜簇的能力较强(RS2 MB-Tn,CTG AAG TTC TGA TGA CCA tn TGG TCA TCA GAA CTT CAG);本发明的实验显示,所述的3种茎部序列可影响荧光纳米铜簇的形成,3种不同类型茎部的发卡式DNA模板均可以形成荧光纳米铜簇,但,茎、环部序列在形成荧光纳米铜簇时,相互间的增强效应不同,其中:RS1双链与环部Tn的相互促进作用最强,GC次之,RS2最弱,仅呈相互叠加趋势;RS2自身可以作为模板形成荧光纳米铜簇,其最大发射波长约为590nm,发卡式模板RS2MB-Tn形成的荧光铜簇,呈现出茎部和环部信号的叠加,最大发射波长约为610nm。
本发明提供了基于发卡式DNA模板MB-Tn制备荧光纳米铜簇的方法,其包括:配制一定浓度的发卡式DNA模板在MOPs缓冲液中,依次加入硫酸铜溶液和维生素C溶液,放置10分钟即得荧光纳米铜簇;形成的荧光纳米铜簇的直径为5-10nm。
上述制得的荧光纳米铜簇,最大激发波长和最大发射波长分别约为345nm和635nm,相比于双链模板和单链poly T形成的荧光纳米铜簇,其发射波长红 移约10-50nm;
上述制备方法中,发卡式DNA模板的量为12.5-400pmol时,均能作为模板产生荧光铜簇,随着浓度升高,荧光信号增强;
上述制备方法中,MOPs缓冲液含有10mM MOPs,150mM NaCl,pH 7.0;硫酸铜溶液浓度为10mM(水溶液),用量为0.25—4μL;维生素C溶液100mM(水溶液),用量为0.5-8μL。
本发明进一步提供了基于发卡式DNA模板形成的荧光纳米铜簇在生物分子检测中的应用。
本发明中,采用发卡式DNA模板制备的荧光纳米铜簇通过下述方法检测生物小分子烟酰胺腺嘌呤二核苷酸(NAD+):
首先设计一段茎部带缺口的哑铃型探针I,其两个环部均为poly T,该探针I在一定量的NAD+参与下,可由大肠杆菌(E.coli)连接酶作用下,连接呈闭合的哑铃型探针,保留MB-Tn结构,随后在硫酸铜和维生素C作用下生成强荧光信号的纳米铜簇,用于NAD+的定量,无NAD+存在时,无NAD+存在时,哑铃型探针无法闭合,从而被外切酶I和III的剪切,无法形成荧光铜簇;
所述的的哑铃型探针的两环部为长度大于5的poly T序列;
进一步,本发明的基于发卡式DNA模板制备的荧光纳米铜簇可用于检测疾病相关miRNA;通过下述方法:
设计一段带有粘性末端的发卡式DNA探针(II),其环部序列为多聚脱氧腺苷(poly A),探针II的两末端序列分别与目标miRNA互补杂交,可在目标miRNA存在下,探针II两末端靠近,由连接酶连接成环,引发滚环扩增,获得一段长DNA序列(带有多个重复单元的荧光纳米铜簇的发卡DNA模板),所述的多个重复单元为:具有poly T环部的发卡式DNA模板(MB-Tn),在硫酸铜和维生素C作用下生成强荧光信号的铜簇,可用于miRNA快速、灵敏的检测。
本发明中,带有粘性末端的发卡式DNA探针的环部为poly A,其长度优选大于20碱基。
本发明所述的发卡式DNA模板的荧光纳米铜簇的形成模板,不仅具有形成条件温和、反应迅速的特点,且具有更高的荧光强度,易于设计为无需标记、无需分离的生物分子检测技术。
本发明具有的优点有:
本发明的发卡式DNA模板与线性poly T相比,形成荧光纳米铜簇的荧光强度更强,所述模板与荧光纳米铜簇形成间相关性包括:1)环部碱基类型对于荧光铜簇的形成具有重要意义,只有poly T才能作为模板形成荧光铜簇,其他碱基的环部如多聚脱氧腺苷(poly A)、多聚脱氧胞苷(poly C)或poly(CT)的发卡DNA均不能作为模板,形成荧光纳米铜簇;2)发卡式DNA模板形成的荧光纳米铜簇,其荧光强度具有poly T长度和序列浓度依赖性,随着poly T长度延长,荧光信号增强;在一定浓度范围内,荧光纳米铜簇的荧光强度随浓度增加而增强;3)发卡式DNA模板的稳定性将影响荧光纳米铜簇的形成,茎部双链长度在12碱基对(bp)以下时,荧光信号随长度增长而荧光增强;当大于等于12bp时,荧光信号趋于稳定;4)发卡式DNA模板形成的荧光纳米铜簇,具有茎部序列类型依赖性,其中RS1对于荧光纳米铜簇的促进能力最强,GC组次之,而RS2作为茎部的发卡结构呈现出茎部和环部的叠加效应。
为了便于理解,以下将通过具体的附图和实施例对本发明进行详细地描述。需要特别指出的是,具体实例和附图仅是为了说明,显然本领域的普通技术人员可以根据本文说明,在本发明的范围内对本发明做出各种各样的修正和改变,这些修正和改变也纳入本发明的范围内。下面结合附图和具体实施方式对本发明进一步说明。
附图说明
图1本发明所用DNA序列。
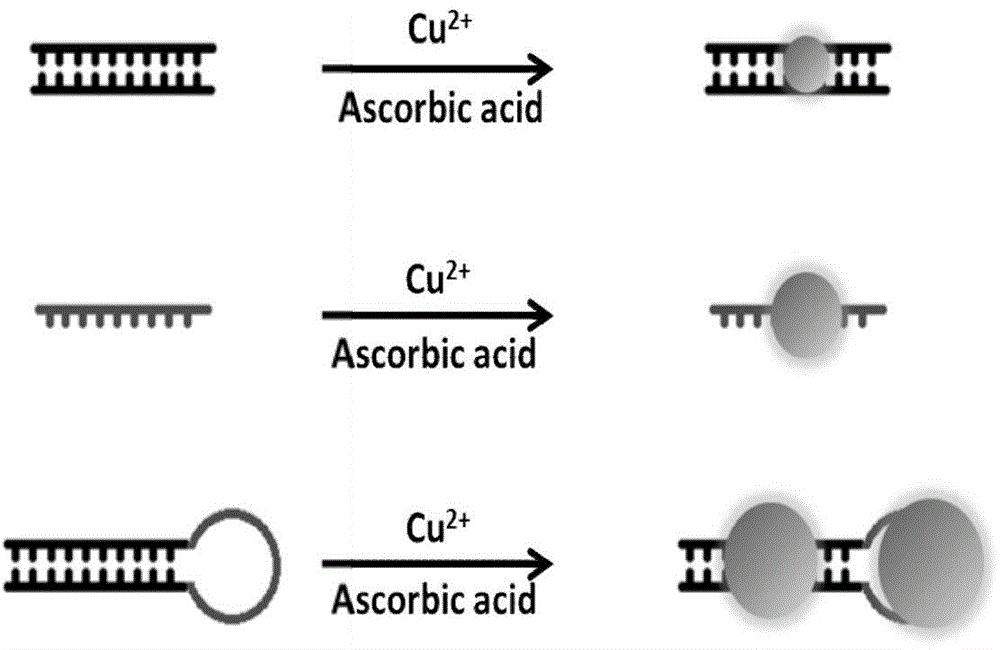
图2基于双链模板、线性poly T模板和MB-Tn模板形成荧光纳米铜簇的示意图。
图3线性poly T模板与含poly T环的发卡式模板形成荧光纳米铜簇的光谱图与强度。
图4T20和MB-T20形成的荧光纳米铜簇透射电镜图。
图5不同环部碱基的MB-Tn形成的荧光纳米铜簇的光谱图。
图6不同茎部长度的MB-Tn形成的荧光纳米铜簇的光谱图。
图7不同茎部碱基排布的MB-Tn形成的荧光纳米铜簇光谱图。
图8基于发卡式DNA模板制备的荧光纳米铜簇构建NAD+检测技术。
图9核酸外切酶I和III的剪切反应电泳验证图。
图10NAD+浓度与荧光信号的对数相关相关曲线图。
图11基于发卡式DNA模板制备的荧光纳米铜簇构建miRNA检测技术。
图12目标miRNA序列引发滚环扩增电泳验证图。
图13目标miRNA浓度与荧光信号对数相关曲线图。
具体实施方式
实施例1:发卡式DNA模板形成荧光纳米铜簇,并与线性DNA模板比较实验
所用DNA序列为:环部T数目分别为6、10、15、20、30和40的发卡DNA模板(如图1—DNA 1-5),茎部均采用形成荧光铜簇能力较弱的RS1双链,此外,还采用单链线性poly T作为对照,包括T6、T10、T20、T30和T40(如图1—DNA 6-10);
基于线性双链模板、poly T模板和MB-Tn模板形成荧光铜簇的示意图如图2所示;
分别取100pmol的DNA 1-10,置1.5mL EP管中,加入MOPs缓冲液(10mM MOPs,150mM NaCl,pH 7.0)至194μL,随后,加入10mM的硫酸铜溶液2μL,100mM的维生素C溶液4μL,于摇床中室温反应10分钟;
荧光测定,激发波长为345nm,发射波长扫描范围为500nm-650nm;
以上模板形成的荧光纳米铜簇的荧光光谱与强度如图3所示,相比于线性模板,发卡式模板形成的荧光铜簇荧光强度更高,尤其在T数目较短时(T6,T10),线性模板无明显信号,发卡式模板可产生明显的荧光信号,表明形成发卡式结构有利于荧光纳米铜簇的合成,此外,两种类型的模板形成荧光纳米铜簇均时具有T长度依赖性,长度延长,荧光信号增强;图4显示了T20和MB-T20形成的荧光纳米铜簇透射电镜图。
实施例2:发卡式DNA模板的环部碱基对于荧光纳米铜簇形成的影响实验
所用DNA序列为:环部分别为T20、A20、C20以及(CT)10的发卡式DNA,茎 部采用RS1双链(如图1—DNA 3,11-13);
分别取100pmol的以上发卡式序列置1.5mL EP管中,用MOPs缓冲液稀释至194μL,加入10mM的硫酸铜溶液2μL,100mM的维生素C溶液4μL,在摇床中室温反应10分钟后;
荧光测定,激发波长为345nm,发射波长扫描范围为500nm-650nm;
结果显示,发卡式模板形成的荧光纳米铜簇其荧光光谱如附图5所示,只有T碱基作为环部时,才能形成强荧光信号。
实施例3:茎部序列长度对于荧光铜簇形成的影响实验
所用DNA序列为:环部均为T20,茎部为不同长度的GC双链序列,长度分别为6、8、10、12、14、16、18bp的发卡式DNA模板(如图1—DNA 14-20),
分别取100pmol的以上发卡式序列置1.5mL EP管中,用MOPs缓冲液稀释至194μL,加入10mM的硫酸铜溶液2μL,100mM的维生素C溶液4μL,在摇床中室温反应10分钟后,
荧光测定,激发波长为345nm,发射波长扫描范围为500nm-650nm,
制得的发卡式模板形成的荧光纳米铜簇的荧光光谱如图6所示,茎部序列碱基对为6-12之间时,随着茎部长度延长,荧光强度增强;而当茎部碱基对大于12,在12-18之间时,荧光强度基本保持不变。
实施例4:发卡式模板的茎部双链序列对于荧光纳米铜簇形成的影响实验
所用DNA序列为:环部均为T20,茎部有GC双链(不能形成荧光铜簇);RS1双链(形成荧光铜簇能力较弱)和RS2双链(形成荧光铜簇能力较强),如图1—DNA21-31所示,其中,RS1-1和RS1-2互补杂交呈双链RS1,RS1-1 T20和RS1-2互补杂交呈带有T20粘性末端的双链RS1-T20;RS2-1和RS2-2互补杂交呈双链RS2,RS2-1 T20和RS2-2互补杂交呈带有T20粘性末端的双链RS2-T20;GC-1和GC-2互补杂交成双链GC,GC-1 T20和GC-2互补杂交呈带有T20粘性末端的双链GC-T20;
3组序列:GC组——GC MB-T20\GC-T20\T20,RS1组——RS1 MB-T20\RS1-T20\T20,RS2组——RS2 MB-T20\RS2-T20\T20,分别取100pmol 置1.5mL EP管中,用MOPs缓冲液稀释至194 μL。加入10mM的硫酸铜溶液2μL,100mM的维生素C溶液4μL,于摇床中室温反应10分钟;
荧光测定,激发波长为345nm,发射波长扫描范围为500nm-650nm;
制得的发卡式模板形成的荧光纳米铜簇的光谱图如图7所示,RS1 MB-T20产生的荧光纳米铜簇信号明显高于RS1-T20、T20以及两者加合,最大发射波长约在635nm;GC组有相同的效应,但是GC对于环部poly T的增强效应不及RS1。RS2组中,RS2MB-T20产生的荧光纳米铜簇信号相当于RS2-T20和T20的加合,且最大发射波长在两者信号之间,约为610nm;
结果表明:GC组和RS1组的茎部双链对于环部poly T形成荧光纳米铜簇具有较强的促进作用,RS1组最强;若茎部双链序列形成荧光铜簇较强时,如RS2组,表现为茎部和发卡式环部的相互叠加效果。
实施例5:基于发卡式DNA的荧光铜簇构建NAD+检测方法
如图8所示:1)合成一段茎部带缺口的哑铃型探针(5’-P-TGATGACCA t30 TGGTCATCAGAACTTCAG t30 CTGAAGTTC-3’,探针I),两个环部均为T30,该探针可作为模板形成荧光铜簇;2)探针I在NAD+存在条件下,由E.coli连接酶连接呈环状,无NAD+,探针将在切口处被核酸外切酶I和III(Exo I和Exo III)剪切,荧光铜簇模板破坏;3)依次加入硫酸铜和维生素C,10分钟后进行荧光测定;4)酶连接与酶剪切过程采用电泳验证。具体步骤如下:
1)连接反应:在10μL的E.coli连接酶反应液(Buffer I:Tris-HCl 30 mM,Mg(Cl)24mM,NH4Cl 20mM,pH=8.0)中,含有25pmol的探针I(终浓度:2.5μM),95℃高温变形3min,缓慢降至室温,与不同浓度的NAD+混合。随后在体系中加入1U的E.coli DNA连接酶(终浓度:0.1U/μL),恒温25℃反应1h;
剪切反应:向上述溶液中,加入10μL含有Exo I和Exo III(终浓度:2U/μL)的混合溶液,恒温37℃反应1h;
电泳验证试验:配制8%丙烯酰胺凝胶,量取2.76mL 29%丙烯酰胺加1%N,N-亚甲双丙烯酰胺储备液,5.24mL DEPC处理去离子水,2mL 5×TBE,70μL 10%过硫酸铵溶液,5μL TEMED,混匀,静置30min即得;
取上述的反应溶液10μL加入2μL 6×上样缓冲液,混匀,取10μL上样,在恒压200V,电流不高于150mA的电泳条件下分离,时间约为30min,GelRed染色30min,在Alpha Innotech FluorchemTM SP采集荧光图像(如图9所示);
荧光纳米铜簇的合成:在所述的反应体系中加入175μL MOPS缓冲液稀释,震荡混匀,随后加入2μL10mM的硫酸铜、3μL 100mM的维生素C,立即震荡,15℃反应20min;
荧光信号检测:取200μL的反应液,加入微量检测池中,置于荧光光谱分析仪中,激发波长345nm,发射波长扫描范围500nm-650nm;
考察了硫酸铜浓度范围为25-250μM,最佳浓度为是100μM;
考察了维生素C浓度为0.5-3.0mM,最佳浓度为1.5mM;
考察了E.coli DNA连接酶量的范围为0.25-8U,最佳量为1U;
考察了实验用Exo I和Exo III浓度范围0.25-4U/μL,两者的最佳浓度为2U/μL;
考察了实验用探针量的范围,200μL溶液中含有探针为10-100pmol,最佳量为25pmol;
在最优条件下检测结果如图10所示,在5-500nM的浓度范围内,荧光强度与NAD+浓度呈对数线性相关,最低检测限达5nM。
实施例6:基于发卡式DNA模板制备的荧光纳米铜簇构建miRNA检测方法
实验设计如图11所示:1)合成一段带有粘性末端的发卡式DNA探针(I,5’-P-CTACTA CCTCA a5 ACCTTC CTCCGC AATACT a20 AGTATT GCGGAG GAAGGT a5 AACTATACAAC-3’,探针II),5’磷酸化。环部为20个脱氧腺苷(A20),探针II两端分别与目标序列let 7a互补;2)探针II只有与目标序列let 7a杂交后,两末端才能靠近,随后由连接酶连接呈闭合环状探针;3)再以let 7a为引物,环状探针II为模板,进行滚环扩增,获得一段长DNA序列,该序列带有多个poly T环的发卡结构;4)依次加入硫酸铜和维生素C,10分钟后进行荧光测定;4)扩增结果采用电泳验证;具体步骤如下:
1)杂交和连接反应:1pmol的DNA探针II溶解于10μL的Buffer I(Tris-HCl 30mM,Mg(Cl)24mM,NH4Cl 20mM,pH=8.0)中,95℃高温变形3 min,缓慢降至室温。加入不同浓度let 7a,随后加入4U的E.coli DNA连接酶(终浓度:0.5U/μL)和2μL 1mM的NAD+溶液,加入Buffer I至总体积20μL,恒温25℃反应1h;
2)扩增反应:向上述溶液中,加入5μL的扩增反应液,含有phi 29扩增酶1U,dNTP 3.2mM,恒温37℃反应1h;
电泳验证试验:配制8%丙烯酰胺凝胶,量取2.76mL 29%丙烯酰胺加1%N,N-亚甲双丙烯酰胺储备液,5.24mL DEPC处理去离子水,2mL 5×TBE,70μL 10%过硫酸铵溶液,5μL TEMED,混匀,静置30min即得;
将按上述步骤制备的3个样品:探针II、探针+let 7a+E.coli连接酶、探针+E.coli连接酶溶液,各取10μL加入2μL 6×上样缓冲液,混匀,再取10μL上样,在恒压200V,电流不高于150mA的电泳条件下分离,时间约为30min,GelRed染色30min,在Alpha Innotech FluorchemTM SP采集荧光光谱(如图12所示);
荧光纳米铜簇的合成:在上述反应体系中加入168μL MOPs缓冲液稀释,震荡混匀,随后加入3μL10mM的硫酸铜、4μL 100mM的维生素C,立即震荡,15℃反应10min;
荧光信号检测:取200μL的反应液,加入微量检测池中,置于荧光光谱分析仪中,激发波长345nm,发射波长扫描范围为500nm-650nm;
采用的硫酸铜、维生素C的浓度分别是10mM和100mM;探针II、E.coli DNA连接酶和phi 29聚合酶的量分别1pmol、4U和1U;
在以上条件下,可测定的let 7a浓度范围为1fmol-10pmol,测定曲线如图13所示。
- 还没有人留言评论。精彩留言会获得点赞!