桥联的聚乙二醇-脂肪族聚酯嵌段共聚物、其制备方法、中间体和用途与流程
本发明涉及药物载体领域,特别涉及包含桥联的聚乙二醇-脂肪族聚酯嵌段共聚物的药物载体领域。
背景技术:
纳米尺度的药物载体能保护药物分子,改变药物分子的体内分布和药物代谢动力学,提高药物胞内浓度,增强候选药物成药性,从而显著增强药效并降低毒副作用。基础研究和应用领域已出现大量以两亲性嵌段聚合物为基础的药物辅料及其制剂,已批准上市的基于聚合物的纳米药物也取得了巨大经济效益。其中代表性的两亲嵌段聚合物是具有优良的生物可降解性、生物可吸收性和生物相容性的聚乙二醇-脂肪族聚酯嵌段聚合物,其以聚乙二醇-聚乳酸、聚乙二醇-聚乙醇酸和聚乙二醇-聚己内酯为主。
纳米药物研究初期,通常认为延长颗粒体内循环可改善药物体内分布,可达到增强治疗效果的目的;然而,后续研究发现,在肿瘤的治疗中,荷载药物的纳米颗粒在体内应突破多重屏障才能有效提高药物疗效,这些屏障包括:1)药物分子或颗粒在血液中需有合适及延长的循环时间;2)纳米颗粒荷载药物需增强肿瘤组织中药物的富集;3)需提高肿瘤细胞对药物摄取;4)需使得药物分子从肿瘤细胞内快速释放。由传统的两亲性嵌段聚合物,例如前述聚乙二醇-脂肪族聚酯嵌段聚合物,与药物分子形成的纳米药物表面被亲水性组份如聚乙二醇(PEG)覆盖,有助于延长药物体内循环时间,并促进药物在肿瘤组织中富集,但覆盖在纳米药物表面的PEG分子阻止肿瘤细胞对纳米药物的摄取,甚至阻止药物分子从进入细胞的纳米颗粒中释放,限制了这些两亲性聚合物作为纳米药物载体的药物输送性能,制约其转化和应用。
研究人员利用肿瘤细胞内特殊的理化微环境,设计了以敏感化学键 “桥联”的两亲性嵌段聚合物,典型的如以二硫键、双硒键“桥联”的两亲性聚合物。这种“桥联”两亲性聚合物是指利用特殊化学键作为亲水性组份(如PEG)和其它疏水组分(如脂肪族聚酯)“桥联”的一类两亲性聚合物,一般情况下,“桥联”的化学键具有对特殊环境(如pH、还原环境)的敏感性,能在特定环境下发生快速降解,从而使得亲水疏水组分分离,最终改变由其制备的纳米颗粒的组成,导致纳米颗粒性能的变化或破坏纳米颗粒的结构,从而增强颗粒从内涵体逃逸,或促进药物的释放。这些对肿瘤细胞内特殊的理化微环境敏感的“桥联”两亲性嵌段能解决部分问题,如药物从纳米药物载体在胞内释放的问题,但在肿瘤细胞对纳米药物载体的摄取方面没有作用。
随着桥联化聚合物的发展以及“化学键库”的日益扩大,相关工作逐渐转移至如何改变桥联化学键的组分以实现桥联聚合物细胞外降解,从而克服聚乙二醇对纳米颗粒细胞摄取的阻碍。肿瘤细胞外的肿瘤组织基质特异性微环境主要分为Warburg效应造成的弱酸性环境(pH 6.5-7.0)以及相关与肿瘤发生发展相关特异性表达的酶类物质,而后者更易被利用设计相关桥联聚合物。如在对基质金属蛋白酶2(MMP2)敏感的多肽(XPLG*LAGR9X)末端分别键合聚乙二醇及聚已内酯后形成的桥联化聚乙二醇-九聚精氨酸-聚己内酯嵌段聚合物(PEG-XPLG*LAGR9X-PCL)。但以酶敏感的化学键桥联的聚乙二醇-脂肪族聚酯嵌段共聚物聚合物载体的实际应用效果并不理想。载体体系的药效缺乏重复性和普适性。此外,这类桥联聚合物的合成工艺通常反应效率低,重复性差,在扩大合成方面不具备可实施性。
实体瘤内部环境呈现弱酸性(pH 6.5-7.0),而纳米颗粒在内吞进入肿瘤细胞后还要经历内涵体/溶酶体中酸性更强的环境(pH 5.0-5.5),氢离子与化学键的结合速度要远高于酶与多肽化学键的结合,以具备pH响应性的化学键构建桥联聚乙二醇-脂肪族聚酯嵌段聚合物的应用范围将更为实际和广泛。然而,由于肿瘤细胞内外上述pH值与正常生理环境的pH值相差较小,这对“桥联”化学键的设计和响应敏感度提出了更苛刻的要求。因此,本发明重点旨在提供一类肿瘤基质和细胞内pH响应酰胺键桥联的聚乙二醇-脂肪族聚酯嵌段共聚物嵌段聚合物,作为小分子化疗药物和核酸 药物输送载体,其能在肿瘤基质和细胞内pH环境下发生特异降解,改变纳米颗粒结构,增强肿瘤细胞对纳米颗粒的摄取,提高细胞内药物含量,进而最终提高药物治疗效果。
技术实现要素:
为了解决以上技术问题,本发明首先提供:
第一方面,一种桥联的聚乙二醇-脂肪族聚酯嵌段共聚物,其结构通式III如下:
其中,A3选自CgHh,g、h为整数,0≤g≤4,0≤h≤10;B3是甲基或不存在;C3选自CiHj,i、j为整数,1≤i≤20,2≤j≤42;R3不存在或为烷基、烷氧基、芳基、芳氧基、卤素原子或被取代的烷基、烷氧基、芳基、芳氧基;PEG表示聚乙二醇残基,aliphatic polyester表示脂肪族聚酯残基。
其中,优选A3不存在,或为碳原子数1-4的亚烷基;
优选C3为碳原子数1-20的亚烷基,更优选碳原子数1-6的亚烷基;
优选R3为碳原子数1-6的烷基、碳原子数1-6的烷氧基、碳原子数6-20的芳基、碳原子数6-20的芳氧基、卤素原子,所述的烷基、烷氧基、芳基、芳氧基可以进一步被取代,更优选R3为碳原子数1-6的烷氧基。
2.根据上述第一方面所述的桥联的聚乙二醇-脂肪族聚酯嵌段共聚物,其中聚乙二醇残基以如下通式表示:
其中,x3为整数,1≤x3≤500。
所述脂肪族聚酯残基是聚ε-己内酯、聚乳酸或聚乳酸乙醇酸残基。
其中优选所述脂肪族聚酯的数均分子量为2000-20000;更优选5000-15000;
其中优选聚乳酸乙醇酸中乳酸和乙醇酸重复单元数量的比例为10-90/90-10,更优选20-80/80-20,进一步优选75/25。
3.根据上述第一或第二方面所述的桥联的聚乙二醇-脂肪族聚酯嵌段共聚物的制备方法,包括:将马来酰胺酸衍生物修饰的聚乙二醇作为引发剂,使脂肪族聚酯单体发生开环聚合反应,既得桥联的聚乙二醇-脂肪族聚酯嵌段共聚物;或将马来酰胺酸衍生物修饰的聚乙二醇与具有氨基端基的脂肪族聚酯发生大分子偶联反应,既得桥联的聚乙二醇-脂肪族聚酯嵌段共聚物。
其中优选在无水条件下进行开环聚合反应;
优选在催化剂存在下进行反应;
优选催化剂是有机杂环分子1,5,7-三叠氮双环(4.4.0)癸-5-烯;
优选溶剂是二氯甲烷;
优选反应在0℃下进行;
优选反应时间是10-120min;
优选所得粗产物经过纯化处理,例如沉淀处理。
4.本发明的第四个方面,提供一种马来酰胺酸衍生物修饰的聚乙二醇,其结构通式II如下:
其中,A2选自CcHd,c、d为整数,0≤c≤4,0≤d≤10;B2为甲基或不存在;C2选自CeHf,e、f为整数,1≤e≤20,2≤f≤42;R2不存在或为烷基、烷氧基、芳基、芳氧基、卤素原子或被取代的烷基、烷氧基、芳基、芳氧基;PEG表示聚乙二醇残基。
其中的A2、B2、C2、R2以及PEG可以与根据第一方面的桥联的聚乙二醇-脂肪族聚酯嵌段共聚物中的A3、B3、C3、R3以及PEG相同,并且 优选范围也可以相同。
5.本发明的第五个方面,提供第四个方面所述的马来酰胺酸衍生物修饰的聚乙二醇的制备方法,包括将氨基醇与端基含马来酸酐基团的聚乙二醇混合,利用氨基醇中的伯胺基团与马来酸酐基团进行开环反应形成酰胺键,既得马来酰胺酸衍生物修饰的聚乙二醇。
其中优选反应在无水溶液体系中或无水条件下进行;
优选在室温下进行反应;
优选对粗产物进行纯化处理;
优选纯化处理包括萃取分液和沉淀。
6.本发明的第六个方面,提供一种端基含马来酸酐基团的聚乙二醇,结构通式I如下:
其中,A1选自CaHb,a、b为整数,0≤a≤4,0≤b≤10;B1为甲基或不存在;R1不存在或为烷基、烷氧基、芳基、芳氧基、卤素原子或被取代的烷基、烷氧基、芳基、芳氧基;PEG表示聚乙二醇残基。
其中的A1、B1、R1以及PEG可以与根据第一方面的桥联的聚乙二醇-脂肪族聚酯嵌段共聚物中的A3、B3、R3以及PEG相同,并且优选范围也可以相同。
7.本发明的第七个方面,提供第六个方面所述的端基含马来酸酐基团的聚乙二醇的制备方法,包括将马来酸酐取代基中的羧基进行酰氯化,再与聚乙二醇末端羟基进行反应。
优选酰氯化试剂为草酰氯、二氯亚砜;
优选溶剂为无水二氯甲烷;
优选反应温度为0-40℃;
优选经过纯化处理粗产物;
优选纯化处理包括萃取、沉淀。
8.本发明的第八个方面,提供第一或第二个方面所述的桥联的聚乙二醇-脂肪族聚酯嵌段共聚物制备的药物载体或核酸载体。
其中优选所述载体的制备方法是将聚ε-己内酯、聚乳酸或聚乳酸乙醇酸与聚乙二醇形成的桥联嵌段共聚物在与水不互溶的有机相中溶解,与水在超声条件下进行乳化(例如,0℃,50-200W,30-120s),从而制备纳米颗粒;同时,如在有机相中加入疏水性药物,可以完成对药物的包载;
优选所述有机相为二氯甲烷、氯仿、乙酸乙酯;
优选所述疏水性药物为紫杉醇、多西紫杉醇、去盐酸化阿霉素、全反式维甲酸、羟基喜树碱中的一种或多种。
9.本发明的第九个方面,提供一种由第八个方面所述的药物载体制备的载药纳米颗粒或载核酸纳米颗粒。
其中优选纳米颗粒包括将聚ε-己内酯、聚乳酸或聚乳酸乙醇酸与聚乙二醇形成的桥联嵌段共聚物和阳离子脂质在与水不互溶的有机相中溶解,与siRNA水溶液初乳化(例如,0℃,50-200W,30-120s),再与水进行第二次乳化(例如,0℃,50-200W,30-120s),除去有机相后,即可得到高效包载siRNA的纳米颗粒。
优选所述有机相为二氯甲烷、氯仿、乙酸乙酯;
优选所述阳离子脂质可以为N,N-二羟乙基-N-甲基-N-2-(胆固醇氧羰基氨基)乙基溴化铵和溴化三甲基-2,3-二油酰氧基丙基铵。
10.本发明的第十个方面,提供由第四个方面所述的马来酰胺酸衍生物修饰的聚乙二醇制备而得的药物载体或核酸载体,由第六个方面所述的端基含马来酸酐基团的聚乙二醇制备而得的药物载体或核酸载体,第八个方面所述的药物载体或核酸载体,第九个方面所述的载药纳米颗粒或载核酸纳米颗粒在制备抗肿瘤药物中的用途。
附图说明
图1.本发明的实施例一中,端基为甲基马来酸酐的PEG衍生物的化学结构及合成路线。
图2.本发明的实施例一中,核磁共振氢谱对端基为甲基马来酸酐的PEG衍生物进行表征,溶剂为氘代氯仿。图3.本发明的实施例一中,核 磁共振碳谱对端基为甲基马来酸酐的PEG衍生物进行表征,溶剂为氘代氯仿。图4.本发明的实施例一中,核磁共振氢谱对端基为甲基马来酸酐的不同分子量的PEG衍生物进行表征,溶剂为氘代氯仿。
图5.本发明的实施例二中,端基为马来酸酐的PEG衍生物的化学结构及合成路线。图6.本发明的实施例二中,核磁共振氢谱对端基为马来酸酐的PEG衍生物进行表征,溶剂为氘代氯仿。图7.本发明的实施例二中,核磁共振碳谱对端基为马来酸酐的PEG衍生物进行表征,溶剂为氘代氯仿。图8.本发明的实施例二中,核磁共振氢谱对端基为马来酸酐的不同分子量的PEG衍生物进行表征,溶剂为氘代氯仿。
图9.本发明的实施例三中,α-PEG-β-甲基-6-羟己基马来酰胺酸的化学结构及合成路线。图10.本发明的实施例三中,核磁共振氢谱对α-PEG-β-甲基-6-羟己基马来酰胺酸进行表征,溶剂为氘代氯仿。图11.本发明的实施例三中,核磁共振碳谱对α-PEG-β-甲基-6-羟己基马来酰胺酸进行表征,溶剂为氘代氯仿。图12.本发明的实施例三中,核磁共振氢谱对不同分子量的α-PEG-β-甲基-6-羟己基马来酰胺酸进行表征,溶剂为氘代氯仿。
图13.本发明的实施例四中,α-PEG-6-羟己基马来酰胺酸的化学结构及合成路线。图14.本发明的实施例四中,核磁共振氢谱对α-PEG-6-羟己基马来酰胺酸进行表征,溶剂为氘代氯仿。图15.本发明的实施例四中,核磁共振碳谱对α-PEG-6-羟己基马来酰胺酸进行表征,溶剂为氘代氯仿。图16.本发明的实施例四中,核磁共振氢谱对不同分子量的α-PEG-β-甲基-6-羟己基马来酰胺酸进行表征,试剂为氘代氯仿。
图17.本发明的实施例五中,可酸催化水解酰胺键Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸共聚物的化学结构及合成路线。图18.本发明的实施例五中,凝胶渗透色谱表征Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸共聚物。图19.本发明的实施例五中,核磁共振氢谱对Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸共聚物的化学结构进行表征,溶剂为氘代氯仿。图20.本发明的实施例五中,核磁共振碳谱对Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸共聚物的化学结构进行表征,溶剂为氘代氯仿。
图21.本发明的实施例六中,可酸催化水解酰胺键Dlink桥联的聚乙 二醇-Dlink-聚乳酸共聚物的化学结构及合成路线。图22.本发明的实施例六中,凝胶渗透色谱表征Dlink桥联的聚乙二醇-Dlink-聚乳酸共聚物。
图23.本发明的实施例六中,核磁共振氢谱可酸催化水解酰胺键Dlink桥联的聚乙二醇-Dlink-聚乳酸共聚物的化学结构进行表征,试剂为氘代氯仿。图24.本发明的实施例六中,核磁共振碳谱对Dlink桥联的聚乙二醇-Dlink-聚乳酸共聚物的化学结构进行表征,溶剂为氘代氯仿
图25.本发明的实施例七中,可酸催化水解酰胺键Dlink(或Dlinkm)桥联的聚乙二醇-Dlink-聚己内酯(或聚乙二醇-Dlinkm-聚己内酯)共聚物的化学结构及合成路线。图26.本发明的实施例七中,凝胶渗透色谱表征Dlinkm桥联的聚乙二醇-Dlinkm-聚己内酯共聚物。图27.本发明的实施例七中,凝胶渗透色谱表征Dlink桥联的聚乙二醇-Dlink-聚己内酯共聚物。图28.本发明的实施例七中,核磁共振氢谱对可酸催化水解酰胺键Dlinkm桥联的聚乙二醇-Dlinkm-聚己内酯共聚物的化学结构进行表征,溶剂为氘代氯仿。图29.本发明的实施例七中,核磁共振氢谱对可酸催化水解酰胺键Dlink桥联的聚乙二醇-Dlink-聚己内酯共聚物的化学结构进行表征,试剂为氘代氯仿。图30.本发明的实施例七中,核磁共振碳谱对Dlinkm桥联的聚乙二醇-Dlinkm-聚己内酯共聚物的化学结构进行表征,试剂为氘代氯仿。图31.本发明的实施例七中,核磁共振碳谱对Dlink桥联的聚乙二醇-Dlink-聚己内酯共聚物的化学结构进行表征,试剂为氘代氯仿
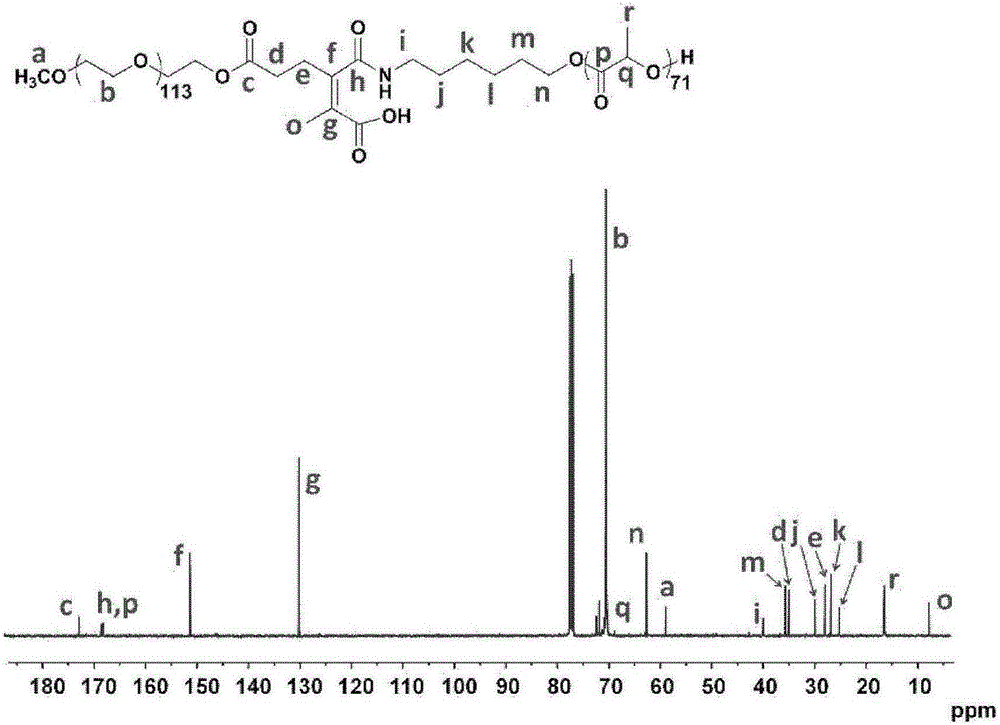
图32.本发明的实施例八中,可酸催化水解酰胺键Dlinkm和Dlink桥联的聚乙二醇-聚乳酸乙醇酸共聚物的化学结构及合成路线。图33.本发明的实施例八中,凝胶渗透色谱表征Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸乙醇酸共聚物。PLGA处下标分别代表D,L-LA和GA的聚合度。图34.本发明的实施例八中,凝胶渗透色谱表征Dlink桥联的聚乙二醇-Dlink-聚乳酸乙醇酸共聚物。PLGA处下标分别代表D,L-LA和GA的聚合度。图35.本发明的实施例八中,核磁共振氢谱对可酸催化水解酰胺键Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸乙醇酸共聚物的化学结构进行表征,试剂为氘代氯仿。图36.本发明的实施例八中,核磁共振氢谱对可酸催化水解酰胺键Dlink桥联的聚乙二醇-Dlink-聚乳酸乙醇酸共聚物的化学结构进行表征,试剂为氘代氯仿。图37.本发明的实施例八中,核磁共振碳谱 对Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸乙醇酸共聚物的化学结构进行表征,试剂为氘代氯仿。图38.本发明的实施例八中,核磁共振碳谱对Dlink桥联的聚乙二醇-Dlink-聚乳酸乙醇酸共聚物的化学结构进行表征,试剂为氘代氯仿。
图39.本发明的实施例十中,(A)桥联聚合物降解示意图;高效液相色谱检测对(B)mPEG113-Dlinkm-PDLLA42、(C)mPEG113-Dlinkm-PDLLA71、(D)mPEG113-Dlinkm-PDLLA142、(E)mPEG113-Dlink-PDLLA140组装形成的纳米颗粒在不同pH环境下的降解行为进行检测。
图40.本发明的实施例十一中,流式细胞术对NPPDLLA以及Dm-NPPDLLA在不同pH条件下处理后MDA-MB-231细胞的细胞摄取进行检测。荧光标记Dm-NPPDLLA和NPPDLLA制备方法如实施例九所述,组分为mPEG113-Dlinkm-PDLLA142和mPEG113-b-PDLLA140。
图41.本发明的实施例十二中,ICR小鼠体内不同组分纳米颗粒的体内循环。RhoB标记的纳米颗粒Dm-NPPDLLA和NPPDLLA制备方法如实施例九所述,组分为mPEG113-Dlinkm-PDLLA142和mPEG113-b-PDLLA140。
图42.本发明的实施例十三中,不同处理组对MDA-MB-231原位肿瘤模型的抑制,多西紫杉醇的给药剂量为3.5mg/kg。包载多西紫杉醇的NPPDLLA/DTXL,Dm-NPPDLLA/DTXL以及D-NPPDLLA/DTXL制备方法如实施例九所述,组分分别为mPEG113-b-PDLLA72、mPEG113-Dlinkm-PDLLA70以及mPEG113-Dlink-PDLLA75。通过函数t-test计算显著性差异,*p<0.05。
图43.本发明的实施例十四中,双乳化纳米颗粒携载siRNA在不同pH条件下对siRNA的释放。携载siRNA的纳米颗粒Dm-NPPLGA/FAM-siNC和NPPLGA/FAM-siNC制备方法如实施例九所述,组分为mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56。
图44.本发明的实施例十五中,流式细胞术检测MDA-MB-231细胞对不同pH条件下处理携载siRNA的双乳化纳米颗粒的摄取行为。携载siRNA的纳米颗粒Dm-NPPLGA/Cy5-siNC和NPPLGA/Cy5-siNC制备方法如实施例九所述,组分为mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56。MFI为细胞内平均荧光强度。通过函数t-test计算显著性差异,**p<0.01。图 45.本发明的实施例十五中,高效液相色谱定量检测MDA-MB-231细胞对不同pH条件下处理携载siRNA的双乳化纳米颗粒的摄取行为。携载siRNA的纳米颗粒Dm-NPPLGA/Cy5-siNC和NPPLGA/Cy5-siNC制备方法如实施例九所述,组分为mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56。通过函数t-test计算显著性差异,*p<0.05。图46.本发明的实施例十五中,激光共聚焦扫描显微镜观察MDA-MB-231细胞对不同pH条件下处理携载siRNA的双乳化纳米颗粒的摄取行为。携载siRNA的纳米颗粒Dm-NPPLGA/Cy5-siNC和NPPLGA/Cy5-siNC制备方法如实施例九所述,组分为mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56。
图47.本发明的实施例十六中,双乳化纳米颗粒携载siRNA在pH 7.4(A)和pH 6.5(B)条件下对MDA-MB-231细胞的PLK1基因进行下调。携载siRNA的纳米颗粒Dm-NPPLGA/Cy5-siNC、NPPLGA/Cy5-siNC、Dm-NPPLGA/siPLK1和NPPLGA/siPLK1制备方法如实施例九所述,组分为mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56。通过函数t-test计算显著性差异,*p<0.05。
图48.本发明的实施例十七中,蛋白质印迹法检测双乳化纳米颗粒携载siRNA(Dm-NPPLGA/Cy5-siNC、NPPLGA/Cy5-siNC、Dm-NPPLGA/siPLK1和NPPLGA/siPLK1)在pH 6.5条件下对MDA-MB-231细胞的PLK1蛋白的影响。
图49.本发明的实施例十八中,双乳化纳米颗粒携载siRNA在pH 6.5条件下对MDA-MB-231细胞的细胞活力影响。携载siRNA的纳米颗粒(Dm-NPPLGA/Cy5-siNC、NPPLGA/Cy5-siNC、Dm-NPPLGA/siPLK1和NPPLGA/siPLK1)制备方法如实施例九所述,组分为mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56。通过函数t-test计算显著性差异,*p<0.05。
图50.本发明的实施例十九中,MDA-MB-231荷瘤小鼠体内携载siRNA的双乳化纳米颗粒体内分布。携载siRNA的纳米颗粒(Dm-NPPLGA/Cy5-siNC和NPPLGA/Cy5-siNC)制备方法如实施例九所述,组分为mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56。通过函数t-test计算显著性差异,**p<0.01。
图51.本发明的实施例二十中,不同处理组对MDA-MB-231原位肿瘤模型的抑制。携载siRNA的纳米颗粒(Dm-NPPLGA/siPLK1和NPPLGA/siPLK1) 制备方法如实施例九所述,组分为mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56。通过函数t-test计算显著性差异,*p<0.05。
具体实施方式
本发明首先提供一种端基含马来酸酐基团的聚乙二醇(PEG)的衍生物,本发明涉及的聚乙二醇衍生物结构通式I如下:
其中,A1可以选自CaHb,a、b为整数,0≤a≤4,0≤b≤10;B1可以为甲基或不存在;R1不存在或为烷基、烷氧基、芳基、芳氧基、卤素原子或被取代的烷基、烷氧基、芳基、芳氧基;PEG表示聚乙二醇残基。
其中,优选A1不存在,或为碳原子数1-4的亚烷基;
优选R1为碳原子数1-6的烷基、碳原子数1-6的烷氧基、碳原子数6-20的芳基、碳原子数6-20的芳氧基、卤素原子,所述的烷基、烷氧基、芳基、芳氧基可以进一步被取代,更优选R1为碳原子数1-6的烷氧基。
聚乙二醇PEG是以如下通式表示:
其中,x1为整数,20≤x1≤500。
本发明进一步提供了一种端基含马来酸酐基团的聚乙二醇衍生物的合成方法。
所述合成端基含马来酸酐基团的聚乙二醇衍生物的方法是将马来酸酐取代基中的羧基先进行酰氯化,制备酰氯化的马来酸酐取代物,再在温和条件下与聚乙二醇末端羟基进行反应,经过萃取、沉淀的方式纯化,从而最终合成端基含马来酸酐基团的聚乙二醇衍生物。所述方法中,酰氯化试剂为草酰氯、二氯亚砜等,但不仅限于此范围;选取溶剂为无水二氯甲烷,反应温度为0-40℃。
其次,本发明提供另一类马来酰胺酸衍生物修饰的聚乙二醇(PEG),其结构通式II如下:
其中,A2选自CcHd,c、d为整数,0≤c≤4,0≤d≤10;B2为甲基或不存在;C2选自CeHf,e、f为整数,1≤e≤20,2≤f≤42;R2不存在或为烷基、烷氧基、芳基、芳氧基、卤素原子或被取代的烷基、烷氧基、芳基、芳氧基;PEG表示聚乙二醇残基。
其中,优选A2不存在,或为碳原子数1-4的亚烷基;
优选C2为碳原子数1-20的亚烷基,更优选碳原子数1-6的亚烷基;
优选R2为碳原子数1-6的烷基、碳原子数1-6的烷氧基、碳原子数6-20的芳基、碳原子数6-20的芳氧基、卤素原子,所述的烷基、烷氧基、芳基、芳氧基可以进一步被取代,更优选R2为碳原子数1-6的烷氧基。
聚乙二醇是以如下通式表示:
其中,x2为整数,20≤x2≤500。
本发明提供了上述聚乙二醇衍生物的相应合成方法,所述聚乙二醇衍生物的合成方法是在温和的无水溶液体系下,将氨基醇与端基含马来酸酐基团的聚乙二醇衍生物按照一定比例混合,利用氨基醇中的伯胺基团与马来酸酐基团进行开环反应,在室温下形成特定的酰胺键,在反应后经萃取分液和沉淀的方式对产物进行处理纯化,以得到最终的预期产物。
本发明提供了一类桥联的聚乙二醇-脂肪族聚酯嵌段共聚物(Aliphatic Polyester),其结构通式III如下:
其中,A3选自CgHh,g、h为整数,0≤g≤4,0≤h≤10;B3是甲基或不存在;C3选自CiHj,i、j为整数,1≤i≤20,2≤j≤42;R3不存在或为烷基、烷氧基、芳基、芳氧基、卤素原子或被取代的烷基、烷氧基、芳基、芳氧基;PEG表示聚乙二醇残基,aliphatic polyester表示脂肪族聚酯残基。
其中,优选A3不存在,或为碳原子数1-4的亚烷基;
优选C3为碳原子数1-20的亚烷基,更优选碳原子数1-6的亚烷基;
优选R3为碳原子数1-6的烷基、碳原子数1-6的烷氧基、碳原子数6-20的芳基、碳原子数6-20的芳氧基、卤素原子,所述的烷基、烷氧基、芳基、芳氧基可以进一步被取代,更优选R3为碳原子数1-6的烷氧基。
其中聚乙二醇残基以如下通式表示:
其中,x3为整数,1≤x3≤500。
本发明提供了一种桥联化聚乙二醇-脂肪族聚酯的优选合成方法。
所述合成桥联化聚乙二醇-脂肪族聚酯的优选合成方法为利用通式II所示的聚乙二醇衍生物作为大分子引发剂,在无水条件下利用有机杂环分子1,5,7-三叠氮双环(4.4.0)癸-5-烯作为催化剂,使用二氯甲烷作为溶剂,在0℃进行溶液聚合引发ε-己内酯、丙交酯或乙交酯等单体的开环聚合反应,反应时间为10-120min,经过沉淀等方式最终达到纯化效果,从而最终合成对应的桥联化聚乙二醇-脂肪族聚酯。与常规合成桥联化聚合物所使用的大分子偶联方法不同,该合成路线简便可控、利于重复;产物不包含未反应的高分子均聚物,便于纯化,更具备可行性。
以下式为例,与非桥联化嵌段聚合物相比,桥联化聚乙二醇-脂肪族聚酯包含特定结构的酰胺基团。
这使得本发明涉及的桥联聚合物具有其他特征,即与处在中性条件下相比,酰胺键结构会在弱酸性条件下发生特异性降解,产生两个不同组分:
当B3或B2为不存在时,桥联酰胺键可在pH 5.0-6.0范围发生降解,其中pH 5.0-5.5范围内降解速度更快:
当B3或B2为甲基时,桥联酰胺键可在pH 6.0-7.0范围发生降解,其中pH 6.0-6.5范围内降解速度更快:
本发明还提供了一种通过将嵌段共聚物在水中制备成纳米颗粒,负载疏水性药物从而形成纳米药物输送体系的方法。
本发明所述制备方法是将聚ε-己内酯、聚乳酸或聚乳酸乙醇酸与聚乙二醇形成的桥联嵌段共聚物在与水不互溶的有机相中溶解,与水在超声条件下进行乳化(0℃,50-200W,30-120s),从而制备纳米颗粒;同时,如在有机相中加入疏水性药物,可以完成对药物的包载,且包载效率稳定、重复性好。所述有机相为二氯甲烷、氯仿、乙酸乙酯,但不局限于此范围;所述疏水性药物为紫杉醇、多西紫杉醇、去盐酸化阿霉素、全反式维甲酸、羟基喜树碱等中的一种或多种,但不局限于此范围。
本发明提供了通过将嵌段共聚物在水中制备成纳米颗粒,负载亲水性小干扰RNA(siRNA)从而形成纳米药物输送体系的方法。
所述合成方法是将聚ε-己内酯、聚乳酸或聚乳酸乙醇酸与聚乙二醇形成的桥联嵌段共聚物和阳离子脂质在与水不互溶的有机相中溶解,与siRNA水溶液初乳化(0℃,50-200W,30-120s),再与水进行第二次乳化(0℃,50-200W,30-120s),除去有机相后,即可得到高效包载siRNA的纳米颗粒。所述有机相为二氯甲烷、氯仿、乙酸乙酯,但不局限于此范围;所述阳离子脂质可以为N,N-二羟乙基-N-甲基-N-2-(胆固醇氧羰基氨基)乙基溴化铵和溴化三甲基-2,3-二油酰氧基丙基铵,但不局限于此范围。
本发明由聚ε-己内酯、聚乳酸或聚乳酸乙醇酸与聚乙二醇形成的桥联嵌段共聚物,其聚乙二醇嵌段的稳定性与环境的pH条件有关,利用此性质,本发明所制备得到的纳米载体可用于针对肿瘤组织的体内药物输送。在血液循环过程中(pH 7.4,PEG稳定存在)借助聚乙二醇对纳米颗粒的保护作用,可以较好地延长携载药物的循环时间,提高药物生物利用度,降低药物的体内毒性;而当纳米颗粒进入肿瘤组织(pH 6.0-6.5)或肿瘤细胞(pH 5.0-5.5)后,桥联酰胺键响应性降解,PEG会从纳米颗粒表面脱落,纳米载体的结构被破坏,细胞摄取或药物释放能力显著提高,从而克服传统非桥联聚合物在药物输送过程中面临的数重障碍,增加在肿瘤细胞内的活性分子含量,达到更强的肿瘤细胞增殖抑制。因此,与目前临床 或基础研究领域广泛采用的游离药物相比,本发明的桥联化聚合物可有望提高其疗效并降低毒副作用。
此外,本发明涉及的桥联化聚合物的性质能够通过调节聚合物组分、亲疏水嵌段的分子量来进行调节,反应原料易得,反应条件温和,工艺简便,有利于放大化和批量生产。
本发明得到了针对肿瘤组织或肿瘤细胞内特定pH响应化学键桥联的聚乙二醇-脂肪族聚酯嵌段共聚物,可用于小分子药物或大分子核酸药物的包载及其体内输送。与传统的聚乙二醇-脂肪族聚酯嵌段聚合物相比,本发明设计的桥联聚合物在颗粒稳定性、体外药物释放、血液循环等方面有相同性能,但能够借助肿瘤组织或细胞内特异性pH调控纳米颗粒表面的PEG程度,增强细胞摄取和胞内药物释放,进一步提高药物疗效。本发明为了合成得到桥联聚乙二醇-脂肪族聚酯嵌段共聚物,使用的聚合反应条件温和,来源易得,反应后纯化过程简便;该类聚合物组装形成纳米颗粒后,对肿瘤微环境的响应速度快,能显著提高抗肿瘤药效。
以下以实施例的方式描述本发明的某些具体实施方式,但是这些实施例仅用于说明目的,而不是用于限制本发明的范围。
实施例
实施例中的缩写:
(1)mPEG,聚乙二醇单甲醚
(2)PEG,聚乙二醇
(3)CDM,2-羧乙基-3-甲基马来酸酐
(4)CSM,2-羧乙基-马来酸酐
(5)TBD,1,5,7-三叠氮双环(4.4.0)癸-5-烯
(6)ε-CL,ε-己内酯
(7)PCL,聚ε-己内酯
(8)D,L-LA,外消旋丙交酯
(9)PDLLA,聚乳酸
(10)GA,乙交酯
(11)PLGA,聚乳酸乙醇酸无规共聚物
(12)BHEM-Chol,N,N-二羟乙基-N-甲基-N-2-(胆固醇氧羰基氨基)乙基溴化铵
(13)RhoB,罗丹明B
(14)DIC,N,N-二异丙基碳二亚胺
(15)DMAP,4-二甲氨基吡啶
(16)PCL-RhoB,罗丹明B标记聚己内酯
(17)DTXL,多西紫杉醇
(18)siRNA,小干扰RNA
实施例中原料来源及处理方法:
(1)mPEG,分子量2000,5000,10000,20000,Sigma-Aldrich公司,使用前经甲苯共沸蒸馏除水
(2)mPEG,分子量3400,上海景宇生物技术有限公司,使用前经甲苯共沸蒸馏除水
(3)PEG,分子量6000,Sigma-Aldrich公司,使用前经甲苯共沸蒸馏除水
(4)D,L-LA,济南岱罡生物工程有限公司
(5)DTXL,武汉大华伟业医药化工有限公司
(6)GA,济南岱罡生物工程有限公司
(7)ε-CL,日本大赛璐化学工业株式会社
(8)TBD,Sigma-Aldrich公司
(9)α-酮戊二甲酯,Sigma-Aldrich公司
(10)噻唑蓝,Sigma-Aldrich公司
(11)安万特医药
(12)红色荧光和绿色荧光标记的siRNA(Cy5-siNC和FAM-siNC),苏州瑞博生物技术有限公司,反义链序列:5’-ACGUGACACGUUCGGAGAAdTdT-3’
(13)PLK1 siRNA,苏州瑞博生物技术有限公司,反义链序列:
5’-UAAGGAGGGUGAUCUUCUUCAdTdT-3’
(14)二氯甲烷和氯仿,液相色谱级,韩国森山公司,经布劳恩公司SPS800溶剂纯化装置处理
(15)MDA-MB-231细胞,ATCC公司
(16)Dulbecco′s Modified Eagle Medium(DMEM)完全培养基,Invitrogen公司
(17)ICR小鼠,北京华阜康生物科技股份有限公司
(18)BALB/c nude小鼠,北京华阜康生物科技股份有限公司
(19)未经特别说明的其它试剂,均为可从常规化学试剂公司商购获得的分析纯级别的试剂,直接使用
(20)阳离子脂质BHEM-Chol的具体合成过程如下:
在500毫升烧瓶内将2-溴乙胺氢溴酸盐(17.4g,85.0mmol)和氯甲酸胆固醇酯(34.7g,77.3mmol)溶解于-30℃的氯仿溶液中,然后将三乙胺(24mL,172mmol)滴加到上述溶液中。在室温下反应过夜后,用1M盐酸的饱和氯化钠溶液(150mL)洗涤三次,并用饱和氯化钠溶液洗涤一次(150mL)。有机相用无水硫酸镁干燥后在减压下除去有机溶剂得到粗产物。粗产物用乙醇和丙酮各重结晶一次后得到N-(2-溴乙基)氨基甲酸胆固醇酯。将得到的N-(2-溴乙基)氨基甲酸胆固醇酯(4.8g,7.8mmol)和N-甲基二乙醇胺(1.2g,9.7mmol)加入到50毫升干燥的甲苯中,回流过夜。反应溶液沉淀到大量的乙醚中,过滤后收集沉淀并真空干燥,在乙醇中重结晶产物两次后得到白色固体,即得BHEM-Chol。
(21)聚乙二醇-聚乳酸(mPEG-b-PDLLA)具体合成过程如下:
将聚乙二醇单甲醚(mPEG113,1.0g,0.2mmol)和外消旋丙交酯(2.5g,17.4mmol)在手套箱内加入到干燥的圆底烧瓶中,130℃加热至二者熔融,搅拌条件下加入异辛酸亚锡(12.2mg,0.03mmol),继续反应2h。粗产物在二氯甲烷中溶解,并沉淀至冷的无水乙醚/甲醇(4/1,v/v)两次。收集沉淀,真空干燥至恒重,即得到聚乙二醇-聚乳酸嵌段聚合物。
对该聚合物进行核磁共振氢谱和凝胶渗透色谱分析,乳酸聚合度为140,聚合物分子量分布为1.14,记为mPEG113-b-PDLLA140。
(22)聚乙二醇-聚乳酸乙醇酸(mPEG-b-PLGA)具体合成过程如下:
将聚乙二醇单甲醚(mPEG113,1.0g,0.2mmol)、外消旋丙交酯(2.5g,17.4mmol)和乙交酯(0.76g,6.6mmol)在手套箱内加入到干燥的圆底烧瓶中,130℃加热至二者熔融,搅拌条件下加入异辛酸亚锡(24.1 mg,0.06mmol),继续反应2h。粗产物在二氯甲烷中溶解,并沉淀至冷的无水乙醚/甲醇(4/1,v/v)两次。收集沉淀,真空干燥至恒重,即得到聚乙二醇-聚乳酸嵌段聚合物。
对该聚合物进行核磁共振氢谱和凝胶渗透色谱分析,乳酸聚合度为165,乙醇酸聚合度为56,聚合物分子量分布为1.12,记为mPEG113-b-PLGA165/56。
(23)聚ε-己内酯(PCL),参考文献(Polymer,2009,50,5048-5054)合成和表征,具体过程如下:
称取ε-CL(0.92g,8mmol),加入约15mL甲苯,搅拌约10分钟后,加入85μL含0.188mmol Al(OiPr)3的甲苯溶液,于25℃下反应1小时,加入乙酸终止反应。将反应液中的甲苯用旋转蒸发仪浓缩后,沉淀到冷的甲醇中,过滤,得到的聚合物在25℃下真空干燥到恒重,即得到聚己内酯均聚物。
对该聚合物进行核磁共振氢谱和凝胶渗透色谱分析,己内酯聚合度为30,分子量分布为1.06,记为PCL30。
(24)罗丹明B标记聚己内酯(PCL-RhoB),合成过程如下:
称取PCL30(0.50g,0.14mmol)、RhoB(0.211g,0.42mmol)、DIC(0.055g,0.70mmol)和DMAP(0.055g,0.70mmol)并溶解于10mL N,N-二甲基甲酰胺中,在25℃、避光条件下反应48小时。反应结束后,在N,N-二甲基甲酰胺中透析以除去未参与反应的RhoB,真空干燥至恒重即得PCL-RhoB。
(25)2-羧乙基-3-甲基马来酸酐(CDM),参考文献(Angewandte Chemie International Edition,2013,52,6218-6221)合成和表征,具体过程如下:
将低温下经50mL无水四氢呋喃淋洗两次的NaH(0.720g,0.030mol)悬浮于60mL无水四氢呋喃,在冰浴中搅拌。向悬浮液中缓慢滴加2-膦酰丙酸三乙脂(8.568g,0.036mol),待体系不再产生氢气后,加入α-酮戊二甲酯(6.960g,0.040mmol),冰浴中反应0.5小时,然后加入30mL饱和NH4Cl溶液终止反应。产物用100mL无水乙醚萃取两次,收集有机相,经无水MgSO4干燥,浓缩,用200目硅胶柱层析分离纯化,展开剂 为无水乙醚/正己烷(v/v,2/1),收集Rf=0.6的物质,干燥,进一步溶解于80mL无水乙醇,加入KOH溶液(2.0M,80mL),加热回流1h。体系冷却至室温,加入盐酸(6.0M)调节pH至2.0,用200mL乙酸乙酯萃取,收集有机相,干燥,减压蒸馏除去乙酸乙酯溶剂,粗产物在无水乙醚中重结晶,得CDM(3.892g,产率54.6%)。
对CDM进行电喷雾电离质谱分析,该物质理论分子量为184.15,而检测到的m/z=185.12即为[M+H]+的信号峰,证明产物结构与预期吻合。
(26)2-羧乙基马来酸酐(CSM),合成和表征具体过程如下:
将低温下经50mL无水四氢呋喃淋洗两次的NaH(0.720g,0.030mol)悬浮于60mL无水四氢呋喃,在冰浴中搅拌。向悬浮液中缓慢滴加三乙基膦酰乙酸酯(8.064g,0.036mol),待体系不再产生氢气后,加入α-酮戊二甲酯(6.960g,0.040mmol),冰浴中反应0.5小时,然后加入30mL饱和NH4Cl溶液终止反应。产物用100mL无水乙醚萃取两次,收集有机相,经无水MgSO4干燥,浓缩,用200目硅胶柱层析分离纯化,展开剂为无水乙醚/正己烷(v/v,2/1),收集Rf=0.65的物质,干燥,进一步溶解于80mL无水乙醇,加入KOH溶液(2.0M,80mL),加热回流1h。体系冷却至室温,加入盐酸(6.0M)调节pH至2.0,用200mL乙酸乙酯萃取,收集有机相,干燥,减压蒸馏除去乙酸乙酯溶剂,粗产物在无水乙醚中重结晶,得CSM(3.496g,产率52.80%)。
对CSM进行电喷雾电离质谱分析,该物质理论分子量为170.12,而检测到的m/z=171.24即为[M+H]+的信号峰,证明产物结构与预期吻合。
实施例一:端基为甲基马来酸酐的PEG衍生物的合成
端基为甲基马来酸酐的PEG衍生物的化学结构及合成路线如附图1所示。
在0℃下,将CDM(1.840g,0.010mol)在无水二氯甲烷(20mL)中完全溶解,依次加入N,N-二甲基甲酰胺(50μL)和草酰氯(3.810g,0.030mol),反应10min后,25℃下继续反应1h。使用旋转蒸发仪除去二氯甲烷,在15.0Pa下蒸馏除去N,N-二甲基甲酰胺,获得中间产物酰氯化CDM(1.96g,产率97%)。
将mPEG(或PEG)、吡啶、酰氯化CDM在0℃下按1.0∶6.0∶3.0 的摩尔比例依次加入到干燥二氯甲烷(聚合物浓度为0.1M)中搅拌溶解,在0℃下反应30min后转入25℃继续反应2h。反应结束后,加入与CH2Cl2等体积的饱和NH4Cl溶液,充分萃取后收集有机相,将无水MgSO4干燥后的有机相使用旋转蒸发仪浓缩,并在0℃下用无水乙醚沉淀,真空干燥固体至恒重。
对上述合成得到的端基为甲基马来酸酐的PEG衍生物进行核磁共振氢谱(1H NMR)分析,测定其分子结构,1H NMR谱见图2。对上述端基为甲基马来酸酐的PEG衍生物进行核磁共振碳谱(13C NMR)分析,以对其分子结构进行进一步确认,13C NMR见图3。核磁共振氢谱对不同分子量的端基为甲基马来酸酐的PEG衍生物进行表征,结果见图4。
图2(A)中,字母a所示信号归属于聚乙二醇单甲醚末端甲基的质子氢,位于3.67ppm处的信号峰b则归属于聚乙二醇骨架-CH2CH2O-的质子氢。由于CDM的键合,c、d均为新出现的信号峰,其中c归属于CDM中的两个亚甲基的质子氢;而d则归属于CDM中甲基的的质子氢。CDM的键合效率通过3.67ppm的信号峰与2.13ppm处的信号峰的积分面积计算得到,反应效率高于98%。
在图2(B)中,由于使用双羟基为末端的聚乙二醇,因此不存在聚乙二醇单甲醚末端甲基的质子氢信号,而其它质子信号则与图2(A)相似,积分面积计算显示CDM的反应效率高于98%。
图3中,端基为甲基马来酸酐的PEG衍生物的所有碳原子均能在13CNMR中找到相应的信号归属。其中,70.4ppm附近信号峰归属于聚乙二醇主链的碳原子,而174.4ppm处的信号峰则是酰氯化反应生成的酯键中碳原子的信号峰,9.8ppm处的信号归属于酸酐取代基中的甲基碳原子, 13C NMR的结果进一步证实制备得到的端基为甲基马来酸酐的PEG衍生物结构的正确性。
由图4可见不同分子量的聚乙二醇单甲醚与CDM键合后产物的1H NMR图谱,其各个质子信号峰均与图2(A)相似,证明了该方法可以合成不同分子量的端基为甲基马来酸酐的PEG衍生物。
实施例二:端基为马来酸酐的PEG衍生物的合成
端基为马来酸酐的PEG衍生物的化学结构及合成路线如附图5所示。
端基为马来酸酐的PEG衍生物具体合成方法和端基为甲基马来酸酐的PEG衍生物相似,以2-羧乙基马来酸酐(CSM)代替2-羧乙基-3-甲基马来酸酐(CDM)进行。
在0℃下,CSM(3.080g,0.020mol)在无水二氯甲烷(35mL)中完全溶解,依次加入N,N-二甲基甲酰胺(45μL)和草酰氯(7.620g,0.060mol),反应10min后,25℃继续反应1h。使用旋转蒸发仪除去二氯甲烷,在15.0Pa下蒸馏除去N,N-二甲基甲酰胺,获得酰氯化CSM(3.420g,产率91%)。
将mPEG(或PEG)、吡啶、酰氯化CSM在0℃下按1.0∶6.0∶3.0的摩尔比例依次加入到干燥二氯甲烷(mPEG或PEG浓度为0.1M)中搅拌溶解,在0℃下反应30min后转入25℃继续反应2h。反应结束后,加入与CH2Cl2等体积的饱和NH4Cl溶液,充分萃取后收集有机相,将无水MgSO4干燥后的有机相使用旋转蒸发仪浓缩,并在0℃下用无水乙醚沉淀,真空干燥固体至恒重。
对上述合成得到的端基为马来酸酐的PEG衍生物进行1H NMR分析,测定其分子结构,1H NMR谱见图6。对上述端基为马来酸酐的PEG衍生物进行13C NMR分析,以对其分子结构进行进一步确认,13C NMR见图7。核磁共振氢谱对端基为马来酸酐的不同分子量的PEG衍生物进行表征,结果见图8。
图6(A)中,字母a所示信号峰归属于聚乙二醇单甲醚末端甲基的质子氢,位于3.65ppm处的单峰b则归属于聚乙二醇骨架-CH2CH2O-的质子氢。由于CSM的键合,c,d,e均为新出现的信号峰,其中d归属于CSM中的两个亚甲基质子氢;而e则归属于马来酸酐中的质子。CSM的键合效率通过3.65ppm的信号峰与2.74ppm处的多重峰的积分面积计算得到,反应效率高于97%。
在图6(B)中,由于使用双羟基聚乙二醇,因此不存在聚乙二醇单甲醚末端甲基的质子氢,而其它质子信号则与图6(A)一致,积分面积计算显示CSM的键合效率高于98%。
图7中,端基为马来酸酐的PEG衍生物的所有碳原子均能在13C NMR中找到相应的归属。其中,70.3ppm附近信号峰归属于聚乙二醇主链的 碳原子,而174.1ppm处的信号峰则是酰氯化反应生成的酯键中碳原子的信号峰,与核磁共振氢谱对应的是在9.8ppm处归属于CDM分子酸酐取代基中的甲基碳原子的信号并未出现,13C NMR的结果进一步证实制备得到的端基为马来酸酐的PEG衍生物结构的正确性。
由图8可见不同分子量的聚乙二醇单甲醚与CSM键合后产物1H NMR谱,其各个质子信号峰均与图6(A)相似,证明了该方法可以合成不同分子量的端基为马来酸酐的PEG衍生物。
实施例三:α-PEG-β-甲基-6-羟己基马来酰胺酸的合成
α-PEG-β-甲基-6-羟己基马来酰胺酸的化学结构及合成路线如附图9所示,所得产物表示为mPEG-Dlinkm-OH或HO-Dlinkm-PEG-Dlinkm-OH。
在25℃下,将端基为甲基马来酸酐的PEG衍生物与6-氨基-1-己醇共同在无水CH2Cl2中完全溶解搅拌反应(聚合物浓度为0.1M,6-氨基-1-己醇与聚乙二醇羟基摩尔量为3∶1)。反应12h后,连续加入饱和NaCl溶液进行两次萃取,收集有机相,在0℃下用过量的无水乙醚进行沉淀,减压抽滤后,真空干燥固体至恒重。
对上述合成得到的α-PEG-β-甲基-6-羟己基马来酰胺酸进行1H NMR分析,测定其分子结构,1H NMR谱见图10。对上述α-PEG-β-甲基-6-羟己基马来酰胺酸进行13C NMR分析,以对其分子结构进行进一步确认, 13C NMR见图11。核磁共振氢谱对不同分子量的α-PEG-β-甲基-6-羟己基马来酰胺酸进行表征,结果见图12。
图10(A)中,字母a-k标记了所有核磁氢谱中的信号峰,并依次归属对应产物的各个质子信号。由于6-氨基-1-己醇的引入,3.23ppm以及1.30-1.60ppm处发现新的质子信号并能正确归属于反应后的6-氨基-1-己醇的质子;而原有端基为甲基马来酸酐的PEG衍生物在2.13ppm处酸酐基团中甲基的单信号峰,则由于酸酐环状结构打开而在1.85ppm及1.94ppm处出现两个信号峰,证明了开环反应的成功进行。6-氨基-1-己醇与酸酐基团的反应效率则通过3.38ppm的聚乙二醇单甲醚的甲基信号峰与1.30-1.60ppm处的多重峰的积分面积计算得到,证实开环反应的效率大于96%。
在图10(B)中,由于使用双羟基聚乙二醇,因此不存在单甲醚聚乙二醇单甲醚末端甲基的质子氢信号,而其它质子信号则与图10(A)一致,积分面积计算显示马来酸酐的开环效率高于96%。
图11中,α-PEG-β-甲基-6-羟己基马来酰胺酸的所有碳原子均能在13C NMR中找到相应的归属。其中,71.2ppm附近信号峰归属于聚乙二醇主链的碳原子,而173.9ppm处的峰则是酰氯化反应生成的酯键中碳原子的信号峰,7.9ppm处归属于酸酐取代基中的甲基碳原子的信号,20.0-40.0ppm处的新出现的信号归属于6-氨基-1-己醇中部分亚甲基碳原子,13C NMR的结果进一步证实制备得到的α-PEG-β-甲基-6-羟己基马来酰胺酸结构的正确性。
由图12可见不同分子量的α-PEG-β-甲基-6-羟己基马来酰胺酸的1H NMR谱,其各个质子信号峰均与图10(A)相似,证明了该方法对合成不同分子量的α-PEG-β-甲基-6-羟己基马来酰胺酸均适用。
实施例四:α-PEG-6-羟己基马来酰胺酸的合成
α-PEG-6-羟己基马来酰胺酸的化学结构及合成路线如附图13所示,所得产物表示为mPEG-Dlink-OH或HO-Dlink-PEG-Dlink-OH。
在25℃下,将端基为马来酸酐的PEG衍生物与6-氨基-1-己醇共同在无水CH2Cl2中完全溶解搅拌反应(聚合物浓度为0.1M,6-氨基-1-己醇与聚乙二醇羟基摩尔量为3∶1)。反应12h后,连续加入饱和NaCl溶液进行两次萃取,收集有机相,在0℃下用过量的无水乙醚进行沉淀,减压抽滤后,真空干燥固体至恒重。
对上述合成得到的α-PEG-6-羟己基马来酰胺酸进行1H NMR分析,测定其分子结构,1H NMR谱见图14。对上述α-PEG-6-羟己基马来酰胺酸进行13C NMR分析,以对其分子结构进行进一步确认,13C NMR见图15。核磁共振氢谱对不同分子量的α-PEG-β-甲基-6-羟己基马来酰胺酸进行表征,结果见图16。
图14(A)中,字母a-k标记了所有核磁氢谱中的信号峰,并依次归属对应产物的各个质子。由于6-氨基-1-己醇的引入,3.24ppm以及1.20-1.80ppm处发现新的质子信号并能正确归属于反应后的6-氨基-1-己醇的质子。6-氨基-1-己醇与酸酐基团的反应效率则通过3.37ppm的聚乙 二醇单甲醚的甲基信号峰与1.20-1.80ppm处的多重峰的积分面积计算得到,证实开环反应的效率大于96%。
在图14(B)中,由于使用双羟基聚乙二醇,因此不存在聚乙二醇单甲醚末端甲基的质子氢,而其它质子信号则与图14(A)一致,积分面积计算显示马来酸酐的开环效率高于96%。
图15中,α-PEG-6-羟己基马来酰胺酸的所有碳原子均能在13C NMR中找到相应的归属。其中,71.1ppm附近信号峰归属于聚乙二醇主链的碳原子,而173.9ppm处的峰则是酰氯化反应生成的酯键中碳原子的信号峰,20.0-40.0ppm处的信号可归属于6-氨基-1-己醇中部分亚甲基碳原子。与图11相比,7.9ppm处归属于酸酐取代基中的甲基碳原子的信号消失, 13C NMR的结果进一步证实制备得到的端基为马来酸酐的PEG衍生物结构正确。
由图16可见不同分子量的α-PEG-6-羟己基马来酰胺酸1H NMR图谱,各个质子信号峰均与图14(A)相似,证明了该方法对合成不同分子量的α-PEG-6-羟己基马来酰胺酸均适用。
实施例五:可酸催化水解酰胺键Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸共聚物的合成
可酸催化水解酰胺键Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸共聚物的化学结构及合成路线如附图17所示。
具有不同分子量的Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸嵌段聚合物是以α-PEG-β-甲基-6-羟己基马来酰胺酸为引发剂,在溶液条件下引发D,L-LA单体聚合而成。D,L-LA以及大分子引发剂在使用前经过真空干燥过夜。通过调节反应过程中单体与大分子引发剂的投料比,可以得到不同分子量聚乙二醇-Dlinkm-聚乳酸嵌段聚合物。1,5,7-三叠氮双环(4.4.0)癸-5-烯(TBD)属于有机杂环非金属催化剂,其催化效率较高,已经被证明较适用于内酯及交酯等环状单体的开环聚合。合成的具体实验步骤如下:
聚合反应在惰性气体手套箱(购自:布劳恩惰性气体系统(上海)有限公司)中进行(O2与H2O的浓度均小于0.1ppm),以mPEG-Dlinkm-OH或HO-Dlinkm-PEG-Dlinkm-OH作为引发剂为例,合成的具体实验步骤如 下:
1)将进行反应的圆底烧瓶经多次的抽真空火焰干燥和充氮气的处理后,放入手套箱。
2)按表1的配比进行投料:向烧瓶中加入mPEG-Dlinkm-OH(或HO-Dlinkm-PEG-Dlinkm-OH)、D,L-LA单体、CH2Cl2和TBD,在0℃搅拌下反应。
3)反应结束后,使用旋转蒸发仪将体系浓缩,用0℃的乙醚甲醇混合溶剂(乙醚∶甲醇=20∶1,v/v,100mL)沉淀两次,收集沉淀物,用油泵抽干至恒重为止,即得产物。
表1 不同投料比(质量比)合成Dlinkm桥联的聚乙二醇-Dlinkm--聚乳酸共聚物
用凝胶渗透色谱(GPC)法以聚苯乙烯为标准分析聚乙二醇-聚乳酸嵌段聚合物的数均分子量和分子量分布宽度指数(PDI),GPC谱见图18,数均分子量和分子量分布PDI见表2。
由图18可见,嵌段聚合物的GPC谱均为单峰,而且不存在拖尾现象即无大分子引发剂的信号峰,表明大分子引发剂已完全消耗且得到了预期的嵌段共聚物。
表2 Dlinkm桥联的聚乙二醇-聚乳酸共聚物的分子量与组成
a由1H NMR得到;b由GPC得到;c由GPC得到。
对上述Dlinkm桥联的聚乙二醇-聚乳酸共聚物进行1H NMR分析,测定其聚合度和数均分子量,1H NMR谱见图19。对上述Dlinkm桥联的聚乙二醇-聚乳酸共聚物进行13C NMR分析,以进一步对其结构进行确认, 13C NMR谱见图20。
图19中,mPEG-Dlink-PDLLA的1H NMR图谱字母a到g标记了归属于两嵌段聚合物的质子氢。聚乳酸的聚合度通过1.58ppm的多重峰(归属于聚乳酸的-CH3)与3.67ppm的单峰(归属于聚乙二醇的-OCH2CH2-)的积分面积比计算得到。
图20为mPEG113-Dlinkm-PDLLA71的13C NMR图谱,字母a到r标记了归属于嵌段聚合物的碳原子。其中,71.2ppm处信号峰归属于聚乙二醇主链中的碳原子,168.9ppm处的信号峰归属于大分子引发剂以及聚乳酸主链中的羰基信号峰,16.7ppm处为聚乳酸嵌段甲基碳原子信号,核磁共振碳谱的结果进一步验证了嵌段聚合物的结构。
实施例六:可酸催化水解酰胺键Dlink桥联的聚乙二醇-Dlink-聚乳酸共聚物的合成
可酸催化水解酰胺键Dlink桥联的聚乙二醇-Dlink-聚乳酸共聚物的化学结构及合成路线如附图21所示。
各种分子量Dlink桥联的聚乙二醇聚-Dlink-乳酸嵌段聚合物是以α-PEG-6-羟己基马来酰胺酸为引发剂,在溶液条件下引发D,L-LA单体聚合而成。D,L-LA以及大分子引发剂在使用前经过真空干燥过夜。通过调节反应过程中单体与大分子引发剂的投料比,可以得到不同分子量聚乙二醇-Dlink-聚乳酸嵌段聚合物,合成的具体实验步骤如下:
聚合反应在惰性气体手套箱中进行(O2与H2O的浓度均小于0.1ppm),以mPEG113-Dlink-OH或HO-Dlink-PEG136-Dlink-OH作为引发剂为例,合成的具体实验步骤如下:
1)将进行反应的圆底烧瓶经多次的抽真空火焰干燥和充氮气的处理后,放入手套箱。
2)按表3的配比进行投料:向烧瓶中加入mPEG113-Dlink-OH(或HO-Dlink-PEG136-Dlink-OH)、D,L-LA单体、CH2Cl2和TBD,在0℃搅拌下反应。
3)反应结束后,使用旋转蒸发仪将体系浓缩,用0℃的乙醚甲醇混合溶剂(乙醚∶甲醇=20∶1,v/v,100mL)沉淀两次,收集沉淀物,用油泵抽干至恒重为止,即得产物。
表3 不同投料比(质量比)合成Dlink桥联的聚乙二醇-Dlink-聚乳酸共聚物
用凝胶渗透色谱法以聚苯乙烯为标准分析聚乙二醇-Dlink-聚乳酸嵌段聚合物的数均分子量和分子量分布宽度指数,GPC谱见图22,数均分子量和分子量分布PDI见表4。
由图22可见,嵌段聚合物的GPC谱均为单峰,而且不存在拖尾现象即无大分子引发剂的信号峰,表明大分子引发剂已完全消耗且得到了预期的嵌段共聚物。
表4 Dlink桥联的聚乙二醇-Dlink-聚乳酸共聚物的分子量与组成
a由1H NMR得到;b由GPC得到;c由GPC得到。
对上述Dlink桥联的聚乙二醇-Dlink-聚乳酸共聚物进行核磁共振氢谱分析,测定其聚合度和数均分子量,1H NMR谱见图23。对上述Dlink桥联的聚乙二醇-Dlink-聚乳酸共聚物进行核磁共振碳谱分析,以进一步对其结构进行确认,13C NMR谱见图24。
图23中,mPEG-Dlink-PDLLA的1H NMR图谱字母a到f标记了归属于两嵌段聚合物的质子氢。聚乳酸的聚合度通过1.58ppm的多重峰(归属于聚乳酸的-CH3)与3.65ppm的单峰(归属于聚乙二醇的-OCH2CH2-)的积分面积比计算得到。
图24为mPEG113-Dlink-PDLLA42的13C NMR图谱,字母a到q标记了归属于两嵌段聚合物的碳原子。与图20相比,7.8ppm处酸酐取代基中的甲基碳信号峰消失而其它信号峰均较为相似,进一步验证了嵌段聚合物的结构。
实施例七:Dlink(或Dlinkm)桥联的聚乙二醇-Dlink-聚己内酯(或聚乙二醇-Dlinkm-聚己内酯)共聚物的合成
Dlink(或Dlinkm)桥联的聚乙二醇-Dlink-聚己内酯(或聚乙二醇-Dlinkm-聚己内酯)共聚物化学结构及合成路线如附图25所示。
各种分子量酸敏感化学键桥联聚乙二醇和聚己内酯的嵌段聚合物是以α-PEG-β-甲基-6-羟己基马来酰胺酸或α-PEG-6-羟己基马来酰胺酸为引发剂,在溶液条件下引发ε-CL单体聚合而成。大分子引发剂在使用前经过真空干燥过夜。通过调节ε-CL与引发剂的投料比,可以得到不同分子量的酸敏感化学键桥联聚乙二醇和聚己内酯的嵌段聚合物。
聚合反应在惰性气体手套箱中进行(O2与H2O的浓度均小于0.1ppm),合成的具体实验步骤如下:
1)将进行反应的圆底烧瓶经多次的抽真空火焰干燥和充氮气的处理后,放入手套箱。
2)按表5的配比进行投料:向烧瓶中加入大分子引发剂、ε-CL单体、CH2Cl2和TBD,在0℃搅拌下反应。
3)反应结束后,使用旋转蒸发仪将体系浓缩,用0℃的乙醚甲醇混合溶剂(乙醚∶甲醇=20∶1,v/v,100mL)沉淀两次,收集沉淀物,用油泵抽干至恒重为止,即得产物。
表5 不同投料比(质量比)合成Dlink(或Dlinkm)桥联的聚乙二醇-Dlink-聚己内酯(或聚乙二醇-Dlinkm-聚己内酯)共聚物
用凝胶渗透色谱法以聚苯乙烯为标准分析共聚物的数均分子量和分子量分布,GPC谱见图26和27,数均分子量和分子量分布PDI见表6。
由图26和27可见,没有大分子引发剂存在产生的拖尾现象,表明大分子引发剂已完全消耗且得到了预期的两嵌段共聚物。
表6 Dlink(或Dlinkm)桥联的聚乙二醇-Dlink-聚己内酯(或聚乙二醇-Dlinkm-聚己内酯)共聚物的分子量与组成
a由1H NMR得到;b由GPC得到;c由GPC得到。
对上述Dlinkm和Dlink桥联的共聚物进行核磁共振氢谱分析,测定其聚合度和数均分子量,1H NMR谱见图28和29。对上述Dlinkm和Dlink桥联的共聚物进行核磁共振碳谱分析,13C NMR谱见图30和31。
图28和29中,字母a到m标记了归属于嵌段聚合物的质子氢。聚己内酯的聚合度通过4.08ppm的多重峰(归属于聚己内酯的-OC(O)CH2)与3.65ppm的单峰(归属于聚乙二醇的-OCH2CH2-)的积分面积比计算得到。
图30为mPEG77-Dlinkm-PCL95的13C NMR图谱,字母a到u标记了归属于嵌段聚合物的碳原子。其中,72.1ppm处信号峰归属于聚乙二醇主链中的碳原子,174.2ppm和169.1ppm处的信号峰归属于大分子引发 剂以及聚己内酯主链中羰基的信号峰,20.0-40.0ppm处信号峰归属于聚己内酯嵌段亚甲基及6-氨基-己醇的亚甲基碳原子信号,9.9ppm处则为Dlinkm中甲基碳原子信号峰,核磁共振碳谱的结果进一步验证了嵌段聚合物的结构。
图31为mPEG77-Dlink-PCL70的13C NMR图谱,字母a到t标记了归属于嵌段聚合物的碳原子。与图30相比,7.84ppm附近归属于Dlinkm中的甲基的信号峰消失而其它信号峰相似。
实施例八:Dlinkm(或Dlink)桥联的聚乙二醇-Dlinkm-聚乳酸乙醇酸(或聚乙二醇-Dlink-聚乳酸乙醇酸)共聚物的合成
Dlinkm(或Dlink)桥联的聚乙二醇-Dlinkm-聚乳酸乙醇酸(或聚乙二醇-Dlink-聚乳酸乙醇酸)共聚物的化学结构及合成路线如附图32所示。
各种分子量酸敏感化学键桥联聚乙二醇和聚乳酸乙醇酸的嵌段聚合物是以α-PEG-β-甲基-6-羟己基马来酰胺酸或α-PEG-6-羟己基马来酰胺酸为引发剂,在溶液条件下引发D,L-LA和GA混合单体聚合而成,其中目标产物中聚乳酸和聚乙醇酸的重复单元比例为3比1。D,L-LA和GA单体以及大分子引发剂在使用前经过真空干燥过夜。通过调节单体与引发剂的投料比,可以得到不同分子量的酸敏感化学键桥联聚乙二醇和聚乳酸乙醇酸的嵌段聚合物。
聚合反应在惰性气体手套箱中进行(O2与H2O的浓度均小于0.1ppm),合成的具体实验步骤如下:
1)将进行反应的圆底烧瓶经多次的抽真空火焰干燥和充氮气的处理后,放入手套箱。
2)按表7的配比进行投料:向烧瓶中加入大分子引发剂、D,L-LA和GA单体、CH2Cl2和TBD,在0℃搅拌下反应。
3)反应结束后,使用旋转蒸发仪将体系浓缩,用0℃的乙醚甲醇混合溶剂(乙醚∶甲醇=20∶1,v/v,100mL)沉淀两次,收集沉淀物,用油泵抽干至恒重为止,即得产物。
表7 不同投料比(质量比)合成Dlinkm(或Dlink)桥联的聚乙二醇-Dlinkm-聚乳酸乙醇酸(或聚乙二醇-Dlink-聚乳酸乙醇酸)共聚物
用凝胶渗透色谱法以聚苯乙烯为标准分析共聚物的数均分子量和分子量分布宽度指数,GPC谱见图33和34,数均分子量和分子量分布PDI见表8。
由图33和34可见,共聚物的GPC谱为单峰,而没有大分子引发剂存在产生的拖尾现象,表明大分子引发剂已完全消耗且得到了预期的两嵌段共聚物。
表8 Dlinkm和Dlink桥联聚乙二醇和聚乳酸乙醇酸的嵌段共聚物的分子量与组成
a由1H NMR得到;b由GPC得到;c由GPC得到。
对上述Dlinkm和Dlink桥联的聚乙二醇和聚乳酸乙醇酸的嵌段共聚物进行核磁共振氢谱分析,测定其聚合度和数均分子量,1H NMR谱见图35和36。对上述Dlinkm和Dlink桥联的聚乙二醇和聚乳酸乙醇酸的嵌段共聚物进行核磁共振碳谱分析,13C NMR谱见图37和38。
图35和36中,字母a到g标记了归属于嵌段聚合物的质子氢。1.59ppm、4.83ppm以及5.22ppm处的多重复归属于聚乳酸乙醇酸嵌段的质子,聚乳酸乙醇酸的聚合度通过1.59ppm的多重峰(归属于聚乳酸中-CH3)、4.83ppm处多重峰(归属于聚乙醇酸中-CH2-)与3.65ppm的单峰(归属于聚乙二醇的-OCH2CH2-)的积分面积比计算得到。
图37为mPEG45-Dlinkm-PLGA112/39的13C NMR图谱,字母a到t标记了归属于嵌段聚合物的碳原子信号。其中,72.4ppm处信号峰归属于聚乙二醇主链中的碳原子,20.0-40.0ppm处信号峰归属于聚己内酯嵌段亚甲基及6-氨基-己醇的碳原子信号,16.7ppm处信号峰归属于聚乳酸乙醇酸中甲基的碳原子,7.9ppm处则为Dlinkm中甲基信号峰,核磁共振碳谱的结果进一步验证了嵌段聚合物的结构。
图38为mPEG77-Dlink-PLGA20/7的13C NMR图谱,字母a到s标记了归属于嵌段聚合物的碳原子。与图37相比,7.9ppm附近归属于Dlinkm中的甲基的信号峰消失而其它信号峰相似。
实施例九:纳米颗粒制备
两亲性聚乙二醇-脂肪族聚酯可以在一定条件下通过各种方法在水中形成胶束或囊泡状纳米颗粒,同时其疏水内核能够对疏水性药物分子或荧光染料进行包载,亲水结构在阳离子脂质辅助下可结合siRNA。本实施例采用不同乳化方法制备以下纳米颗粒。
制备空载的纳米颗粒,以mPEG-Dlinkm-PDLLA为例,具体方法为:将质量为10mg的mPEG113-Dlinkm-PDLLA142溶解在200μL的乙酸乙酯中,向上述溶液中加入1mL的水,然后在冰浴下超声1min(130W,工作4s停2s,共60s),再加入2mL水,转移至圆底烧瓶,立即减压蒸发除去乙酸乙酯。
制备载药的纳米颗粒,以mPEG-Dlink-PDLLA为例,具体方法为:将质量为10mg的mPEG113-Dlink-PDLLA142以及1mg的多西紫杉醇(DTXL)溶解在200μL的乙酸乙酯中,向上述油相中加入1mL的水,然后在冰浴下超声1min(130W,工作4s停2s,共60s),再加入2mL水,转移至圆底烧瓶,立即减压蒸发除去乙酸乙酯,使用切向流超滤系统(颇尔过滤器(北京)有限公司)除去游离的DTXL。
制备荧光标记纳米颗粒,以mPEG-Dlinkm-PDLLA为例,制备方法如下:将mPEG113-Dlinkm-PDLLA142与PCL-RhoB同时溶解于乙酸乙酯,其质量比例为100∶3。取上述聚合物储液200μL(10mg),向其中加入1mL的超纯水,然后超声1min(0℃,130W,工作4s停2s,共60s),再向体系加入2mL超纯水,转移至圆底烧瓶立即减压蒸发除去乙酸乙酯,使用切向流装置除去游离的PCL-RhoB。
制备包载siRNA的纳米颗粒,以mPEG-Dlinkm-PLGA为例,制备方法如下:取400μL的mPEG113-Dlinkm-PLGA161/54三氯甲烷储液(62.5mg/mL),加入100μL的BHEM-Chol储液(10mg/mL,三氯甲烷),再加入25μL的PLK1 siRNA储液(8mg/mL),超声1min(0℃,130W,工作5s停2s,共60s),再向体系加入5mL无RNase水,再次超声1min(0℃,130W,工作10s停2s,共60s),转移至圆底烧瓶立即减压蒸发除去三氯甲烷。
实施例十:纳米颗粒降解测定
在弱酸性环境下,如图39A所示,可酸水解化学键Dlinkm或Dlink中的酰胺键会发生降解,生成两组均聚物,分别为聚乙二醇和相应的脂肪族聚酯。本实施例在不同pH条件下通过定量分析降解后得到的聚乙二醇,对Dlinkm或Dlink化学键的酸敏感性进行检测。本实施例中的单乳化纳米 颗粒制备方法如实施例九所示,选取组分为mPEG113-Dlinkm-PDLLA42、mPEG113-Dlinkm-PDLLA71、mPEG113-Dlinkm-PDLLA142和mPEG113-Dlink-PDLLA140。
采用单乳化方法制备纳米颗粒后,利用磷酸盐缓冲液调节颗粒溶液pH至5.50、6.50和7.40(磷酸盐缓冲液浓度为20mM),将溶液在37℃、60rpm转速下处理,在不同的时间间隔,将含有100mg纳米颗粒的磷酸盐缓冲溶液取出,100000g离心30min后,将上层液体冻干,通过高效液相色谱检测其PEG释放量,结果见图39。
由图39可见,在pH 6.5条件下,Dlinkm桥联的嵌段聚合物在24h内约有超过50%的PEG分子被释放,而在对照条件下(pH 7.4)仅有不足20%的释放量;与此同时,Dlink桥联两嵌段聚合物在模拟胞内环境的pH 5.5条件下同样响应性地释放了大于60%的PEG分子,证明了两种酸水解化学键桥联的聚乙二醇脂肪族聚酯组装形成的纳米颗粒能够在不同的肿瘤微环境刺激下,相对快速地释放PEG分子。
实施例十一:纳米颗粒在微酸性环境下降解PEG以增强细胞摄取
在本实施例中,通过流式细胞术检测细胞对于RhoB标记的纳米颗粒的摄取情况来研究酸性环境下降解PEG前后纳米颗粒的行为。本实施例以mPEG113-Dlinkm-PDLLA142和mPEG113-b-PDLLA140制备荧光标记纳米颗粒,制备方法如实施例九所述,颗粒命名为Dm-NPPDLLA和NPPDLLA。
在24孔板中种入5×104个MDA-MB-231细胞,加入0.5mL的Dulbecco′s Modified Eagle Medium(DMEM)完全培养基,置于CO2培养箱中培养过夜,吸去旧的培养基,向每个孔中加入含有Dm-NPPDLLA以及NPPDLLA的新鲜培养基溶液(pH 6.5和7.4分别处理不同时间),于37℃的CO2培养箱中培养2h。实验结束后,将细胞消化用PBS洗涤两遍并用1%多聚甲醛溶液重悬(200μL),用流式细胞分析仪(Becton Dickinson)进行检测,其结果如图40。
由图40可见,对于NPPDLLA而言,由于在两种不同pH条件下,其纳米颗粒组分不存在变化,因此其摄取行为没有明显区别;而对于Dm-NPPDLLA,其在pH 7.4条件下的细胞内吞量与NPPDLLA相比有少量增加, 但在pH 6.5条件下细胞摄取行为明显增强,参考实施例十中纳米颗粒的降解行为,认为在模拟肿瘤环境的pH条件下的颗粒降解下调了纳米颗粒表面PEG密度,解决了PEG对颗粒摄取的障碍。
实施例十二:单乳化纳米颗粒在体内的循环情况
在本实施例中,通过高效液相色谱检测纳米颗粒在小鼠血液中的循环情况,研究酸水解化学键桥联的嵌段共聚物组装形成的纳米颗粒与非酸水解化学键桥联的嵌段共聚物组装形成的纳米颗粒的血液循环性能。荧光标记的颗粒制备方法如实施例九所述。在本实施例中,聚合物组分选取为mPEG113-Dlinkm-PDLLA142和mPEG113-b-PDLLA140,制备得到的纳米颗粒记为Dm-NPPDLLA和NPPDLLA。
本实施例在ICR小鼠体内进行,首先通过尾静脉注射Dm-NPPDLLA以及NPPDLLA,RhoB的每次给药剂量为60μg。在注射后不同时间点经眼底静脉丛摘取血,得到的血液样本在加入肝素钠后10000rpm离心5min获取血浆,将血浆通过有机溶剂萃取并经高效液相色谱检测分析其中RhoB的含量,结果见图41。由图可见,Dm-NPPDLLA以及NPPDLLA两种纳米颗粒在血液中的循环情况基本一致,没有显著性差异,说明在体内循环过程中PEG层能够保护纳米颗粒,延长血液循环时间。
实施例十三:纳米颗粒携载化疗药物对乳腺癌生长的抑制
在本实施例中,使用MDA-MB-231原位乳腺癌小鼠肿瘤模型,模型建立具体过程如下:在DMEM完全培养基中培养MDA-MB-231细胞,在建立模型前6小时用无血清DMEM培养细胞,胰酶消化,经过1000rpm离心收集细胞,用PBS重悬细胞使细胞密度达到2×107cells/mL。将100μL细胞悬液注射在裸鼠右侧第二个乳腺中。本实施例以mPEG113-b-PDLLA72、mPEG113-Dlinkm-PDLLA70和mPEG113-Dlink-PDLLA75以及制备载药纳米颗粒,制备方法如实施例九所述,颗粒命名为NPPDLLA/DTXL、Dm-NPPDLLA/DTXL以及D-NPPDLLA/DTXL。
原位注射乳腺癌细胞的裸鼠在SPF级动物房中饲养7天左右可以形 成可见肿瘤。肿瘤的体积按照公式:V=0.5*a*b*b计算,其中a是指肿瘤较长的直径,b是指肿瘤较短的直径。在裸鼠的肿瘤体积达到60mm3左右开始进行治疗,将接种了MDA-MB-231肿瘤的20g裸鼠按照下述处理方式分为5组,每组5只裸鼠。分别使用200uL PBS、200μL溶解70μg 的PBS溶液、200μL NPPDLLA/DTXL的PBS溶液、200μL Dm-NPPDLLA/DTXL和200μL D-NPPDLLA/DTXL的PBS溶液,其中纳米颗粒所包载的DTXL量为70μg。每7天为一个治疗周期共进行三次给药,每3天测量一次肿瘤体积。图42显示了肿瘤生长情况,图中的纵坐标为测量得到的肿瘤体积相对治疗第一天肿瘤体积的比例。从图中可以看出,PBS以及低剂量的DTXL对肿瘤的生长没有抑制作用。相比于无法降解的聚乙二醇-聚乳酸组装形成的NPPDLLA/DTXL,Dm-NPPDLLA/DTXL以及D-NPPDLLA/DTXL载药纳米胶束抑制MDA-MB-231乳腺癌的效果更强。
实施例十四:Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸共聚物制备的纳米颗粒在不同pH条件下的siRNA释放测定
本实施例选取mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56,在双乳化方法下(实施例9)辅以BHEM-Chol制备携载FAM-siNC的纳米颗粒,分别命名为Dm-NPPLGA/FAM-siNC和NPPLGA/FAM-siNC。将纳米颗粒溶液分别用pH为5.50、6.50和7.40的缓冲溶液稀释至5mL(10mg/mL),37℃、60rpm下培养。在不同时间间隔,取100μL纳米颗粒溶液,离心2h(20000g),高效液相色谱检测上层清液中FAM-siNC含量,结果见图43。
由图43可见,在pH 7.4三种条件下,Dm-NPPLGA/FAM-siNC和NPPLGA/FAM-siNC两种纳米颗粒的siRNA释放行为基本一致。在偏酸环境下(pH 6.5和pH 5.5),两种纳米颗粒的siRNA释放量在40%-60%,Dm-NPPLGA/FAM-siNC的siRNA释放略快于NPPLGA/FAM-siNC,说明Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸乙醇酸共聚物制备的纳米颗粒与非酸水解化学键桥联的聚乙二醇脂肪族聚酯组装形成的纳米颗粒在细胞内外多种pH条件下对siRNA具有相似的释放行为。此外,在24h时有一半的siRNA释放出来,有利于快速沉默胞内基因表达。
实施例十五:聚乙二醇-脂肪族聚酯纳米颗粒在微酸性环境下增强细胞摄取
在本实施例中,分别通过半定量流式细胞术、定量高效液相色谱和定性激光共聚焦显微镜分别检测观察细胞对于包载Cy5-siNC的纳米颗粒的摄取情况。本实施例选取mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56,在双乳化方法下辅以BHEM-Chol制备携载Cy5-siNC的纳米颗粒,分别命名为Dm-NPPLGA/Cy5-siNC和NPPLGA/Cy5-siNC。
首先通过流式细胞术半定量检测酸性环境下细胞对纳米颗粒的摄取情况。在24孔板中种入5×104个MDA-MB-231细胞,加入0.5mL的DMEM完全培养基,置于CO2培养箱中培养过夜。吸去旧的培养基,向每个孔中加入含有Dm-NPPLGA/Cy5-siNC和NPPLGA/Cy5-siNC的新鲜培养基溶液(pH 6.5和7.4分别处理不同时间),于37℃的CO2培养箱中培养4h。实验结束后,将细胞消化用PBS洗涤两遍并用4%多聚甲醛溶液重悬(200μL),用流式细胞分析仪(Becton Dickinson)进行检测,其结果如图44。由图44可见,对于NPPLGA/Cy5-siNC,由于在两种不同pH条件下,其纳米颗粒组分不存在变化,因此其摄取行为没有明显区别;而对于Dm-NPPLGA/Cy5-siNC,其在pH 7.4条件下的细胞内吞量与NPPLGA/Cy5-siNC相比有少量增加,但在pH 6.5条件下细胞摄取行为明显增强,可以认为在模拟肿瘤环境的pH条件下的颗粒降解下调了纳米颗粒表面PEG密度,增强了细胞对于携载siRNA纳米颗粒的摄取。
通过高效液相色谱定量检测酸性环境下降解PEG前后细胞对纳米颗粒的摄取情况。在6孔板中种入2×105个MDA-MB-231细胞,加入2mLDMEM完全培养基,置于CO2培养箱中培养过夜,吸去旧的培养基,向每个孔中加入含有Dm-NPPLGA/Cy5-siNC和NPPLGA/Cy5-siNC的新鲜培养基溶液(pH 6.5和7.4分别处理),于37℃的CO2培养箱中培养4h。实验结束后,将细胞消化用PBS洗涤两遍后裂解细胞,通过高效液相色谱检测胞内摄取的Cy5-siNC含量,其结果如图45。由图45可见,对于NPPLGA/Cy5-siNC而言,在pH 7.4和pH 6.5条件下,每百万细胞的Cy5-siNC内吞量都在15pmol左右;而对于Dm-NPPLGA/Cy5-siNC,经过pH 6.5条件处理,其每百 万细胞的Cy5-siNC内吞量由pH 7.4条件下的16pmol上升到25pmol,这一结果也表明在模拟肿瘤酸性环境下的Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸共聚物制备的纳米颗粒能够增强细胞的摄取。
通过激光共聚焦定性检测酸性环境下降解PEG前后细胞对纳米颗粒的摄取情况。在24孔板中放入细胞爬片,种入5×104个MDA-MB-231细胞,加入0.5mL的DMEM完全培养基,置于CO2培养箱中培养过夜,吸去旧的培养基,向每个孔中加入含有Dm-NPPLGA/Cy5-siNC以及NPPLGA/Cy5-siNC的新鲜培养基溶液(pH 6.5和7.4分别处理不同时间),于37℃的CO2培养箱中培养4h。实验结束后,用4%多聚甲醛溶液固定细胞,0.1%Triton X-100穿膜后通过Alexa Fluor 488标记细胞骨架,DAPI标记细胞核,通过激光共聚焦(蔡司LSM 710)进行观察,其结果如图46。由图46可见,Dm-NPPLGA/Cy5-siNC组细胞内的Cy5荧光信号明显强于NPPLGA/Cy5-siNC,这也间接证明了在模拟肿瘤酸性环境下的颗粒降解了PEG后能够增强细胞对颗粒的摄取。此外,细胞内两种颗粒的都是均匀分布在细胞质,胞内定位没有明显差异。
实施例十六:Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸乙醇酸共聚物制备的包载小干扰RNA的纳米颗粒在微酸性环境下对乳腺癌细胞PLK1基因mRNA表达的抑制
在本实施例中,通过定量聚合酶链式反应(RT-PCR)检测细胞摄取包载PLK1 siRNA的纳米颗粒后PLK1 mRNA表达水平变化来研究酸性环境下降解PEG前后纳米颗粒摄取对PLK1表达水平的影响。包载PLK1 siRNA的纳米颗粒的制备方法如实施例九所述。选取组分为mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56,制备得到颗粒记为Dm-NPPLGA/siPLK1和NPPLGA/siPLK1。
在6孔板中种入2×105个MDA-MB-231细胞,加入2mL的DMEM完全培养基,置于CO2培养箱中培养过夜,吸去旧的培养基,向每个孔中分别加入含有Dm-NPPLGA/siPLK1、NPPLGA/siPLK1,以及包载对照siRNA的纳米颗粒Dm-NPPLGA/siNC、NPPLGA/siNC新鲜培养基溶液(培养基的pH值分 别设置为6.5和7.4),于37℃的CO2培养箱中培养6h,吸去包含纳米颗粒的培养基,更换为新鲜培养基,继续于37℃的CO2培养箱中培养24h。实验结束后,将细胞消化用PBS洗涤两遍,然后使用Takara公司RNAiso plus提取细胞总RNA,通过定量PCR的方法检测PLK1 mRNA表达水平的变化,其结果如图47。
由图47可见,pH 7.4条件下,由于Dm-NPPLGA/siPLK1纳米颗粒未发生大量的PEG降解,与NPPLGA/siPLK1的表面PEG密度没有明显差异,因此Dm-NPPLGA/siPLK1和NPPLGA/siPLK1对细胞PLK1 mRNA表达的抑制水平没有显著差异;而pH 6.5条件下,由于Dm-NPPLGA/siPLK1纳米颗粒在微酸性环境下降解PEG以增强细胞摄取,因此Dm-NPPLGA/siPLK1对细胞PLK1 mRNA表达的抑制强于NPPLGA/siPLK1,与对照组相比,PLK1 mRNA的表达量仅在20%。
实施例十七:Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸乙醇酸共聚物制备的包载小干扰RNA的纳米颗粒在微酸性环境下对乳腺癌肿瘤细胞PLK1基因蛋白表达的抑制
在本实施例中,通过蛋白质印迹法(Western blot)的方法检测细胞摄取包载PLK1 siRNA的纳米颗粒后PLK1蛋白表达水平变化来研究酸性环境下降解PEG前后纳米颗粒摄取对PLK1表达水平的影响。包载PLK1 siRNA的纳米颗粒的制备方法如实施例九所述,选取组分为mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56,制备得到颗粒记为Dm-NPPLGA/siPLK1和NPPLGA/siPLK1。
在6孔板中种入2×105个MDA-MB-231细胞,加入2mL的DMEM完全培养基,置于CO2培养箱中培养过夜。吸去旧的培养基,向每个孔中分别加入含有Dm-NPPLGA/siPLK1、NPPLGA/siPLK1以及包载对照siRNA的纳米颗粒Dm-NPPLGA/siNC、NPPLGA/siNC新鲜培养基溶液(培养基的pH值设置为6.5),于37℃的CO2培养箱中培养6h,吸去含有纳米颗粒的培养基,更换为新鲜培养基,继续于37℃的CO2培养箱中培养48h。实验结束后,将细胞消化用PBS洗涤两遍,然后使用碧云天公司NP40蛋白裂解液提取细胞总蛋白,通过Western blot的方法检测PLK1蛋白表达水平的变化, 其结果如图48。
由图48可见,在pH 6.5条件下,与实施例十六中RT-PCR实验结果一致,由于Dm-NPPLGA/siPLK1发生降解,增强了细胞摄取和胞内PLK1基因沉默,因此Dm-NPPLGA/siPLK1对细胞PLK1蛋白表达的下调强于NPPLGA/siPLK1。
实施例十八:Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸乙醇酸共聚物制备的包载小干扰RNA的纳米颗粒在微酸性环境下对乳腺癌细胞增殖的抑制
在本实施例中,使用MTT法检测检测细胞摄取包载PLK1 siRNA的纳米颗粒后细胞活力的变化来研究酸性环境下降解PEG前后纳米颗粒摄取对细胞增殖的影响。包载PLK1 siRNA的纳米颗粒的制备方法如实施例九所述,选取组分为mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56,制备得到颗粒记为Dm-NPPLGA/siPLK1和NPPLGA/siPLK1。
在96孔板中种入5×103个MDA-MB-231细胞,加入0.1mL的DMEM完全培养基,置于CO2培养箱中培养过夜。吸去旧的培养基,向每个孔中分别加入含有Dm-NPPLGA/siPLK1、NPPLGA/siPLK1以及包载对照siRNA的纳米颗粒Dm-NPPLGA/siNC、NPPLGA/siNC新鲜培养基溶液(培养基的pH值设置为6.5)于37℃的CO2培养箱中培养6h,吸去含有纳米颗粒的培养基,更换为新鲜培养基,继续于37℃的CO2培养箱中培养72h。实验结束后,向每个孔中加入25μL 5mg/mL噻唑蓝,于37℃的CO2培养箱中培养2h,向每个孔中加入100μL细胞裂解液,在37℃避光孵育4h,用酶标仪(Bio-rad)进行检测,其分析结果如图49。
由图49可见,在pH 6.5条件下,由于Dm-NPPLGA/siPLK1能够更好地诱导PLK1基因沉默,从而造成了细胞增殖能力下降,因此Dm-NPPLGA/siPLK1对细胞增殖的抑制能力强于NPPLGA/siPLK1。
实施例十九:Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸乙醇酸共聚物制备的包载小干扰RNA的纳米颗粒在体内的分布
在本实施例中,通过高效液相色谱定量检测纳米颗粒携载siRNA后在荷瘤小鼠体内各脏器的分布情况。包载Cy5-siNC的颗粒制备方法如实 施例九所述。在本实施例中,聚合物组分选取为mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56,制备得到的纳米颗粒记为Dm-NPPLGA/Cy5-siNC和NPPLGA/Cy5-siNC。本实施例使用MDA-MB-231原位乳腺癌小鼠肿瘤模型,模型建立具体过程如实施例十三所述。
通过尾静脉注射Dm-NPPLGA/Cy5-siNC以及NPPLGA/Cy5-siNC,Cy5-siNC的给药剂量为0.5OD/injection。注射24h后,处死小鼠,取小鼠各个脏器,萃取组织内的Cy5-siRNA用高效液相色谱检测脏器内的siRNA含量,结果见图50。由图50可见,Dm-NPPLGA/Cy5-siNC和NPPLGA/Cy5-siNC两种纳米颗粒在各个脏器都有不同程度的富集,其中在脑、心、肺等器官富集较少,而在肝、肾和脾等与体内代谢清除机制相关的器官富集较多。除肿瘤外的其他脏器中,两种纳米颗粒的富集没有明显差异。而在肿瘤部位,Dm-NPPLGA/Cy5-siNC的富集明显高于NPPLGA/Cy5-siNC,说明肿瘤酸性微环境中Dm-NPPLGA/Cy5-siNC降解PEG后增强肿瘤细胞摄取能够增加siRNA在肿瘤部位的富集。
实施例二十:Dlinkm桥联的聚乙二醇-Dlinkm-聚乳酸乙醇酸共聚物制备的包载小干扰RNA的纳米颗粒对乳腺癌肿瘤生长的抑制
在本实施例中,使用MDA-MB-231原位乳腺癌小鼠肿瘤模型,模型建立具体过程如实施例十三所述。本实施例以mPEG113-Dlinkm-PLGA161/54和mPEG113-b-PLGA165/56制备携载PLK1 siRNA的纳米颗粒,制备方法如实施例九所述,颗粒命名为Dm-NPPLGA/siPLK1和NPPLGA/siPLK1。
原位注射乳腺癌细胞的裸鼠在SPF级动物房中饲养7天左右可以形成可见肿瘤。肿瘤的体积按照公式:V=0.5*a*b*b计算,其中a是指肿瘤较长的直径,b是指肿瘤较短的直径。在裸鼠的肿瘤体积达到60mm3左右开始进行治疗,将接种了MDA-MB-231肿瘤的20g裸鼠按照下述处理方式分为7组,每组5只裸鼠。按照PLK1 siRNA的给药剂量作为计算标准,实验组设置为:PBS组、Free siPLK1 1mg/kg、NPPLGA/siPLK1 1mg/kg、Dm-NPPLGA/siPLK1 1mg/kg、NPPLGA/siPLK1 0.5mg/kg、Dm-NPPLGA/siPLK1 0.5mg/kg、Dm-NPPLGA/siPLK1 0.25mg/kg,通过400uL PBS配置以上药物进行给药。每2天为一个治疗周期共进行10次给药,每2天测量一次肿瘤体 积。图51显示了肿瘤体积的变化,图中的纵坐标为测量得到的肿瘤体积。从图中可以看出,在1mg/kg和0.5mg/kg的给药剂量下,Dm-NPPLGA/siPLK1对肿瘤生长的抑制效果明显优于同等剂量下的NPPLGA/siPLK1。
尽管出于说明和描述的目的在此给出本发明,但并非意在穷举或限制。许多修改和变化对本领域技术人员来说将是显而易见的。为了解释原则和实际应用而选择和描述所述技术方案,并且使本领域技术人员理解具有各种修改的本发明不同的实施方案适合于预期的具体用途。
- 还没有人留言评论。精彩留言会获得点赞!