一种重组高保真DNA聚合酶及其编码基因和表达方法与流程
本发明属于生物工程基因领域,涉及一种重组高保真DNA聚合酶及其编码基因,以及其表达、纯化和活性测定方法。
背景技术:
2001年,人类基因组工作草图的发表标志着人类基因组计划的基本成功。2003年4月,经过全世界科学家13年的努力,人类基因序列全部测序完成。然而,基因序列测序成功仅仅是科学研究的一个开始,科学家的研究对象也将逐步从研究基因功能转向对蛋白质功能的研究,科学家们必须对基因所编码的各种蛋白质进行大规模系统的研究,才有可能实现基因诊断及治疗的目的。2003年12月,我国科学家贺福初等人发起成立了人类肝蛋白质组计划,人类蛋白质组计划正式实施。伴随人类基因组计划的成功以及蛋白质组计划的开始,必将为世界带来不可估量的科学价值和经济价值。
聚合酶链式反应(PCR),因为其方便,快捷,准确地大规模复制目的基因片段的能力,已经成为了分子生物学不可或缺的技术手段,其在人类基因组计划以及后续的人类蛋白质组计划中都起着不可替代的作用。至其诞生以来,在全世界各国科学家的共同努力下,该技术已经获得的长足的进步。如热循环仪的发明,大大节约了反应时间,节省了研究者的精力;逆转录聚合酶链式反应则可用于检测细胞/组织中基因表达水平,细胞中RNA病毒的含量和直接克隆特定基因的cDNA序列等;实时定量聚合酶链式反应的发明,则使得精确定量测定特定DNA片段的拷贝数成为可能。如今,该技术凭借其诸多优势,在诸多领域如医学检测、感染性疾病检测、法医学检测分子进化等,成为无法取代的技术手段。
作为聚合酶链式反应中的核心工具,DNA聚合酶在聚合反应中极为重要,其性能会直接影响产物的特异性、产量、保真性等各种特性。因此,高性能的DNA聚合酶的获得对分子生物学实验来说就显得非常关键。
技术实现要素:
有鉴于此,本发明的目的在于针对现有技术的不足,提供一种高保真DNA聚合酶的编码基因,其编码出的DNA聚合酶具有超强的热稳定性和冻融稳定性,该高保真DNA聚合酶编码基因在大肠杆菌中能高效可溶表达,通过简单的纯化工艺即可获得较高纯度的高保真DNA聚合酶,同时提供一种反应缓冲液,能够使得该高保真DNA聚合酶反应灵敏度、扩增效率和保 真性都提高,适用于扩增各种目的DNA聚合酶链式反应。
本发明提供了一种重组高保真DNA聚合酶(High Fidelity DNA聚合酶,以下简称为“ZHB HiFi DNA聚合酶”),其氨基酸序列如SEQ ID NO:1所示。
本发明提供了编码上述所述ZHB HiFi DNA聚合酶的基因,其碱基序列如SEQ ID NO:2所示。该序列是专为大肠杆菌表达系统进行密码子优化得到的序列,能显著提高异源基因在宿主菌中的表达效率。
本发明还提供了包含了上述所述编码ZHB HiFi DNA聚合酶的基因的可溶表达载体,所述的载体优选为原核表达质粒pDEST14。
本发明还提供了包含有上述所述载体高效可溶表达的大肠杆菌菌株,优选地,所述菌株选自大肠杆菌BL21(AI)菌株。
本发明还提供了ZHB HiFi DNA聚合酶在大肠杆菌高效可溶表达方法,包括如下步骤:
该方法的步骤为:
1.挑取一个上述所述的大肠杆菌菌落,接入LB培养液,于37℃培养过夜;
2.取过夜培养物接入于TB培养液中,于37℃震荡培养至对数中期(A600=1.0);
3.在培养物中加入阿拉伯糖至(v/v)0.2%,于37℃,过夜诱导表达,离心收集含有ZHB HiFi DNA聚合酶的大肠杆菌菌体沉淀。
所述TB培养液中均含有氨苄青霉素50-100μg/mL。
本发明还提供了ZHB HiFi DNA聚合酶的可溶表达的纯化方法,包括如下步骤:
1.将收集得到的含有诱导ZHB HiFi DNA聚合酶大肠杆菌菌体沉淀,用预冷的PBS重悬,并于4℃高速离心处理;重复一次。
2.吸去上清,称菌体沉淀重量,每克菌体加入结合缓冲液BufferA 3-10ml,悬起菌体。
3.每克菌体加入3-10μL浓度为100mmol/L的PMSF,3-100μL浓度为100mg/mL的溶菌酶,于冰上搅动。
4.破碎菌体,于冰浴中超声,并于4℃以12000rpm高速离心5min收集上清。
5.离心上清液在75℃水浴保温1h,12000rpm离心20min去除沉淀。将上清细菌裂解液于0.22μm滤膜过滤。
6.IMAC亲和层析,合并洗脱峰收集样品并用微型超滤系统更换BufferC缓冲液。
7.Heparin亲和层析,得到所需的ZHB HiFi DNA聚合酶。
优选的,上述纯化方法中,IMAC亲和层析,选用的结合缓冲液BufferA:20mM NaH2PO4,20mM咪唑,300mM NaCl,pH=7.5,洗脱缓冲液BufferB:20mM NaH2PO4,300mM NaCl,500mM咪唑,pH=7.5。Heparin亲和层析,选用的结合缓冲液BufferC:10mM NaH2PO4, pH=7.5,洗脱缓冲液BufferD:10mM NaH2PO4,1M NaCl,pH=7.5。
本发明还提供了能够应用于PCR扩增目的基因的反应缓冲液配方BufferE:100mM KCl;160mM(NH4)2SO4;20mM MgSO4;1mg/ml BSA;200mM Tris-HCl(pH 8.8,25℃);1.0%(v/v)Triton X-100。
附图说明
图1表示高保真DNA聚合酶密码子优化前后核苷酸序列比较
其中,奇数行(即“优化前序列”对应的行)为高保真DNA聚合酶天然基因核苷酸序列,即密码子优化前的序列;偶数行(即“优化后序列”对应的行)为本发明的ZHB HiFi DNA聚合酶的基因核苷酸序列,即密码子优化后的序列。
图2-a、图2-b为高保真DNA聚合酶密码子优化前后在大肠杆菌表达宿主中CAI指数。
其中,图2-a表示高保真DNA聚合酶天然基因核苷酸序列在大肠杆菌表达宿主中CAI指数经过程序计算为0.53;图2-b表示优化后的本发明的ZHB HiFi DNA聚合酶密码子在大肠杆菌表达宿主中CAI指数经过程序计算为0.91。
图3-a、图3-b为高保真DNA聚合酶密码子优化前后在大肠杆菌表达宿主中最优密码子频率分布区域图。
其中,图3-a表示高保真DNA聚合酶天然基因核苷酸序列在大肠杆菌表达宿主中最优密码子频率分布区域图,从图中可以看出:高保真聚合酶天然基因核苷酸序列的低利用率密码子出现百分比为17%;图3-b表示优化后的本发明的ZHB HiFi DNA聚合酶密码子在大肠杆菌表达宿主中最优密码子频率分布区域图,优化后的本发明的ZHB HiFi DNA聚合酶密码子序列的低利用率密码子出现百分比为0。
图4-a、图4-b为高保真DNA聚合酶密码子优化前后在大肠杆菌表达宿主中平均GC碱基含量分布区域图。
其中,图4-a表示高保真DNA聚合酶天然基因核苷酸序列在大肠杆菌表达宿主中平均GC碱基含量为:39.48%;图4-b表示优化后的本发明的ZHB HiFi DNA聚合酶密码子在大肠杆菌表达宿主中平均GC碱基含量为:46.25%。
图5为ZHB HiFi DNA聚合酶基因PCR产物的琼脂糖凝胶电泳图。
其中,泳道1为500bp DNA Ladder;泳道2为两端含有NdeI和XhoI酶切位点的优化后的重组高保真DNA聚合酶基因PCR产物。
图6-a,图6-b为ZHB HiFi DNA聚合酶表达质粒构建过程图。
其中,图6-a为ZHB HiFi DNA聚合酶构建到表达质粒pET21b过程图;图6-b为ZHB HiFi DNA聚合酶构建到表达质粒pDEST14过程图。
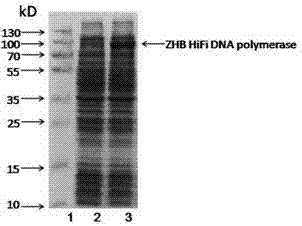
图7-a,图7-b为ZHB HiFi DNA聚合酶诱导前后SDS-PAGE凝胶电泳鉴定图。
其中,图7-a泳道1为(10-230kDa)宽范围的预染的蛋白上样Marker;泳道2为未加入IPTG诱导表达的ZHB HiFi DNA聚合酶重组大肠杆菌BL21(DE3)裂解液;泳道3为加入IPTG诱导表达的ZHB HiFi DNA聚合酶重组大肠杆菌BL21(DE3)裂解液。
其中,图7-b泳道1为(10-230kDa)宽范围的预染的蛋白上样Marker;泳道2为未加入阿拉伯糖诱导表达的ZHB HiFi DNA聚合酶大肠杆菌BL21(AI)裂解液;泳道3为加入阿拉伯糖诱导表达的ZHB HiFi DNA聚合酶大肠杆菌BL21(AI)裂解液。
图8为IMAC亲和纯化重组菌株BL21(DE3)和BL21(AI)表达ZHB HiFi DNA聚合酶的SDS-PAGE凝胶电泳图。
其中,图8-a为IMAC亲和纯化重组菌株BL21(DE3)表达ZHB HiFi DNA聚合酶的SDS-PAGE凝胶电泳图。泳道1为(10-230kDa)宽范围的预染的蛋白上样Marker;泳道2-10为IMAC亲和层析纯化洗脱缓冲液洗脱时收集的不同收集管样品。
图8-b为IMAC亲和纯化重组菌株BL21(AI)表达ZHB HiFi DNA聚合酶的SDS-PAGE凝胶电泳图。泳道1为(10-230kDa)宽范围的预染的蛋白上样Marker;泳道2-10为IMAC亲和层析纯化洗脱缓冲液洗脱时收集的不同收集管样品。
图9为Heparin层析柱纯化重组菌株BL21(AI)表达ZHB HiFi DNA聚合酶的SDS-PAGE凝胶电泳图。
其中,泳道1为(10-230kDa)宽范围的预染的蛋白上样Marker;泳道2-10为Heparin层析柱洗脱缓冲液洗脱时收集的不同收集管样品。
图10为ZHB HiFi DNA聚合酶扩增不同片段的人基因组中DNA序列琼脂糖凝胶电泳图。
其中,泳道1为500bp DNA Ladder;泳道2-7为ZHB HiFi DNA聚合酶扩增0.5-1.5kb人基因组中DNA片段。
图11-a和图11-b为90℃高温孵育不同时间的ZHB HiFi DNA聚合酶扩增人基因组中DNA序列琼脂糖凝胶电泳图。
其中,图11-a泳道1为500bp DNA Ladder;泳道2为没有经过高温孵育的ZHB HiFi DNA聚合酶扩增人基因组1.5kb DNA片段;泳道3为90℃高温孵育1小时ZHB HiFi DNA聚合酶扩增人基因组1.5kb DNA片段;泳道4为90℃高温孵育2小时ZHB HiFi DNA聚合酶扩增人基因组1.5kb DNA片段;泳道5为90℃高温孵育3小时ZHB HiFi DNA聚合酶扩增人基因组1.5kb DNA片段。图11-b泳道1为500bp DNA Ladder;泳道2为没有经过高温孵育的ZHB HiFi DNA聚合酶扩增人基因组1.0kb DNA片段;泳道3为90℃高温孵育1小时ZHB HiFi DNA聚合酶扩增人基因组1.0kb DNA片段;泳道4为90℃高温孵育2小时ZHB HiFi DNA聚合酶扩增人基因组1.0kb DNA片段;泳道5为90℃高温孵育3小时ZHB HiFi DNA聚合酶扩增人基因组1.0kb DNA片段。
图12为冻融交替处理不同次数的ZHB HiFi DNA聚合酶扩增人基因组中1.5kb DNA序列琼脂糖凝胶电泳图。
泳道1为500bp DNA Ladder;泳道2为没有经过冻融交替处理的ZHB HiFi DNA聚合酶扩增人基因组1.5kb DNA片段;泳道3-22为经过冻融交替处理1-20次的ZHB HiFi DNA聚合酶扩增人基因组1.5kb DNA片段。
具体实施方式
下面结合具体实施例,进一步阐述本发明,应理解,引用实施例仅用于说明本发明而不用于限制本发明的范围。
实施例1 ZHB HiFi DNA聚合酶基因优化设计
发明人根据GenBank已公开的高保真DNA聚合酶的cDNA序列(GenBank登录号:NP_577941.1),对该基因进行密码子优化后得到本发明的ZHB HiFi DNA聚合酶基因,如SEQ ID No:2所示。
下面是对高保真DNA聚合酶进行密码子优化,优化前后各参数对比如下:
1.密码子适应指数(Codon Adaptation Index,CAI)
由图2-a可知,密码子没有优化前,高保真DNA聚合酶天然基因在大肠杆菌中密码子适应指数(CAI)为0.53。由图2-b可知,通过密码子优化后,使得本发明的ZHB HiFi DNA聚合酶基因在大肠杆菌中CAI指数为0.91。通常CAI=1时被认为该基因在该表达系统中是最理想的高效表达状态,CAI指数越低表明该基因在该宿主中表达水平越差,因此可以看出经过了密码子优化后得到的基因序列可以提高ZHB HiFi DNA聚合酶基因在大肠杆菌中的表达水平。
2.最优密码子使用频率(Frequency of Optimal Codons,FOP)
由图3-a可知,基于大肠杆菌表达载体,密码子没有优化前,高保真DNA聚合酶天然基因序列的低利用率密码子出现百分比为17%。这条未进行优化的基因含有串联稀有密码子,这些密码子可能降低翻译效率,甚至能够解散翻译装配物。由图3-b可知,通过密码子优化后,本发明的ZHB HiFi DNA聚合酶基因在大肠杆菌系统中出现低利用率密码子的频率为0。
3.GC碱基含量(GC curve)
GC含量理想分布区域为30%-70%,在这个区域外的出现任何峰都会不同程度地影响转录和翻译效率。由图4-a、图4-b的高保真DNA聚合酶基因的GC碱基平均含量分布区域图对比可知,由图4-a中显示高保真DNA聚合酶天然基因中在优化前GC碱基平均含量为39.48%,由图 4-b中显示出优化后的序列消除了GC含量在30%-70%区域外所有碱基,最终得到优化后重组ZHB HiFi DNA聚合酶的GC碱基平均含量为46.25%。
实施例2:ZHB HiFi DNA聚合酶基因的表达载体构建
将优化后的ZHB HiFi DNA聚合酶全基因在5’端引入NdeI酶切位点序列,3’端引入组氨酸标签和XhoI酶切位点序列(如SEQ ID No:2所示),进行全基因合成,并将合成的基因片段,构建到pUC57质粒(由南京金斯瑞科技有限公司提供)中,得到一种长期保存质粒,记为pUC57-ZHB HiFi DNA质粒。以pUC57-ZHB HiFi DNA质粒为模板,进行PCR扩增,所用引物序列如下:
上游引物:
M13F:CGC CAG GGT TTT CCC AGT CAC GAC
下游引物:
M13R:AGC GGA TAA CAA TTT CAC ACA GGA
反应总体积50μL,其中浓度为10μmol/L引物各加2.5μL,浓度为10mmol/L的dNTP加1μL,所用DNA聚合酶为Q5(购自New England Biolabs公司),2U/μL,加0.5μL。反应条件为98℃5秒、55℃45秒、72℃30秒,25个循环后,产物经1.0%琼脂糖凝胶电泳分析,结果显示产物大小与预期大小(2349bp)一致(如图5所示)。
方案1.ZHB HiFi DNA聚合酶基因在pET21b中的表达载体构建
将得到的基因产物用DNA凝胶回收试剂盒(购自北京天根生化科技有限公司)纯化。纯化后,用NdeI和XhoI(购自New England Biolabs公司)双酶切,用T4连接酶(购自New England Biolabs公司)连接到pET21b质粒(购自Merck公司)载体中,转化到DH5α感受态细胞(购自北京天根生化科技有限公司)中,在含有100μg/mL的氨苄青霉素(购自Amresco公司)的LB平板中37℃培养过夜。第二天筛选阳性克隆菌测序,比对,与预期序列完全一致,即得到ZHB HiFi DNA聚合酶一种形式的表达载体,记为pET21b-ZHB HiFi DNA(表达载体构建流程如如6-a所示)。
方案2.ZHB HiFi DNA聚合酶基因在pDEST14中的表达载体构建
将得到的基因产物用DNA凝胶回收试剂盒(购自北京天根生化科技有限公司)纯化。纯化后,用NdeI和XhoI(购自New England Biolabs公司)双酶切,用T4连接酶(购自New England Biolabs公司)连接到分别在attR1位点处引入NdeI酶切位点,attR2位点处引入XhoI酶切位点的pDEST14质粒(购自Invitrogen公司)中,转化到DH5α感受态细胞(购自北京天根生化科 技有限公司)中,在含有100μg/mL的氨苄青霉素(购自Amresco公司)的LB平板中37℃培养过夜。第二天筛选阳性克隆菌测序,比对,与预期序列完全一致,即得到ZHB HiFi DNA聚合酶一种形式的表达载体,记为pDEST14-ZHB HiFi DNA(表达载体构建流程如如6-b所示)。
实施例3 ZHB HiFi DNA聚合酶在重组大肠杆菌中的表达和鉴定
方案1.ZHB HiFi DNA聚合酶在BL21(DE3)中的IPTG诱导表达鉴定
具体步骤如下:
1).将实施例2方案1中测序比对正确的pET21b-ZHB HiFi DNA质粒转化到大肠杆菌BL21(DE3)感受态细胞(购自北京天根生化科技有限公司)中,37℃氨苄青霉素平板中过夜培养。
2).第二天挑1-4个含有pET21b-ZHB HiFi DNA质粒的重组菌落,接入含有100μg/mL氨苄青霉素的LB培养液,37℃培养过夜。
3).取25mL过夜培养物接入500mL含100μg/mL氨苄青霉素的TB培养液(1.2%(W/V)Tryptone,2.4%(W/V)Yeast Extract,0.4%(V/V)Glycerol,磷酸盐缓冲液17mM KH2PO4,72mM K2HPO4)中,37℃振荡培养。
4).接种后每隔1小时测菌液OD600值,待OD600=1.0时,用1mmol/L的IPTG(购自Amresco公司)进行诱导表达。同时以未加入IPTG的大肠杆菌培养液做阴性对照。
5).4小时后收集菌液,12000rpm高速离心3min,用预冷的PBS清洗沉淀,加入5×SDS凝胶上样缓冲液,100℃加热5min,12000rpm高速离心1min,取上清。未加入IPTG的大肠杆菌培养液也按此步骤处理。
6).各取5μL未加入IPTG和加入IPTG诱导的培养物充分悬液,10%SDS-PAGE凝胶电泳分析。
7).8-15V/cm电泳,至溴酚蓝迁移到分离胶底部。
8).考马斯亮蓝染色和免疫印迹,观察表达产物条带(结果如图7-a所示)。
方案2.ZHB HiFi DNA聚合酶在BL21(AI)中的阿拉伯糖诱导表达鉴定
具体步骤如下:
1).将实施例2方案2中测序比对正确的pDEST14-ZHB HiFi DNA质粒转化到大肠杆菌BL21(AI)感受态菌株(购自Invitrogen)中,37℃氨苄青霉素平板中过夜培养。
2).第二天挑1-4个含有pDEST14-ZHB HiFi DNA质粒的重组菌落,接入含有100μg/mL氨苄青霉素的LB培养液,37℃培养过夜。
3).取25mL过夜培养物接入500mL含100μg/mL氨苄青霉素的LB培养液中,37℃振荡培 养。
4).接种后每隔1小时测菌液OD600值,待OD600=1.0时,用0.2%(V/V)的阿拉伯糖(购自Amresco公司)进行诱导表达。同时以未加入阿拉伯糖的大肠杆菌培养液做阴性对照。
5).4小时后收集菌液,12000rpm高速离心3min,用预冷的PBS清洗沉淀,加入5×SDS凝胶上样缓冲液,100℃加热5min,12000rpm高速离心1min,取上清。未加入阿拉伯糖的大肠杆菌培养液也按此步骤处理。
6).各取5μL未加入阿拉伯糖和加入阿拉伯糖诱导的培养物充分悬液,10%SDS-PAGE凝胶电泳分析。
7).8-15V/cm电泳,至溴酚蓝迁移到分离胶底部。
8).考马斯亮蓝染色和免疫印迹,观察表达产物条带(结果如图7-b所示)。
实施例4 ZHB HiFi DNA聚合酶纯化
1.重组菌体超声破碎
1).将实施例3方案1和方案2中经预冷的PBS清洗得到的含有诱导ZHB HiFi DNA聚合酶的重组大肠杆菌BL21(DE3)和BL21(AI)沉淀,分别用预冷的PBS重悬,于4℃以12000rpm离心15min;重复一次。
2).吸去上清,称菌体沉淀重量,每克菌体加入5mL结合缓冲液BufferA,用磨光玻璃棒搅动,使菌体悬起。
3).每克菌体加入5μL 100mmol/L PMSF,5μL 100mg/mL溶菌酶,冰上搅动20min。
4).用探针型超声波仪破碎菌体,样品置于冰上,超声120次,每次5秒间隔5秒,循环三次,每次循环间隔等待5min。12000rpm,4℃高速离心30min,过0.22μM滤膜过滤备用。
5).分别将离心获得的BL21(DE3)和BL21(AI)细菌裂解上清液于75℃水浴中孵育1h,12 000rpm离心20min去除沉淀。过0.22μm滤膜过滤备用。
2.IMAC亲和纯化
1)IMAC亲和层析选用的层析柱是HisTrap crude FF 5mL(购自GE healthcare),结合缓冲液BufferA:20mM NaH2PO4,20mM咪唑,300mM NaCl,pH=7.5,洗脱缓冲液BufferB:20mM NaH2PO4,300mM NaCl,500mM咪唑,pH=7.5,0.22μm滤膜过滤备用。
2)将HisTrap FF crude 5mL接入AKTA avant150纯化仪柱位阀中,分别用双蒸水清洗机器和柱子后,结合缓冲液BufferA平衡柱子。再用样品泵将BL21(DE3)和BL21(AI)细菌裂解上清液分别进行上样。上完样品后,先用结合缓冲液BufferA清洗柱子,再用洗脱缓冲液BufferB进行洗脱并收集洗脱峰。
3)对IMAC亲和层析收集的各收集管进行SDS-PAGE蛋白电泳检测,由图8-a和8-b所知,重组菌株BL21(AI)诱导可溶表达的ZHB HiFi DNA聚合酶的远高于重组BL21(DE3)菌株。
3.Heparin亲和纯化
1)Heparin亲和纯化选用的层析柱是HiTrap Heparin HP(购自GE healthcare,17-0407-01),结合缓冲液BufferC:10mM NaH2PO4,pH=7.5,洗脱缓冲液BufferD:10mM NaH2PO4,1M NaCl,pH=7.5,0.22μm滤膜过滤备用,同时对步骤2中IMAC亲和层析收集的重组菌株BL21(AI)诱导可溶表达的ZHB HiFi DNA聚合酶样品用微型超滤系统更换BufferC缓冲液。
2)将HiTrap Heparin HP亲和层析柱接入AKTA avant150纯化仪柱位阀中,分别用双蒸水清洗机器和层析柱后,用样品泵将上述步骤中处理过的样品进行上样。上完样品后,先用结合缓冲液BufferC清洗层析柱,再用洗脱缓冲液BufferD进行洗脱并收集洗脱峰。
3)对HiTrap Heparin HP层析柱洗脱的各收集管中的样品进行SDS-PAGE蛋白电泳检测(结果如图9所示)。
实施例5 ZHB HiFi DNA聚合酶在核酸扩增中的应用
将实施例4制备得的ZHB HiFi DNA聚合酶应用于核酸扩增。首先,测试该ZHB HiFi DNA聚合酶在核酸扩增中的反应条件,以pUC57质粒为模板,M13F和M13R引物扩增约2.7kb片段并确定其反应的最适pH值及K+、NH4+、Mg2+离子浓度。配制10×PCR buffer:200mmol/L Tris-HCl,pH值为7.4~8.8,20mmol/L MgSO4,分别添加不同浓度KCl、(NH4)2SO4、BSA、Triton X-100,反应体系为20μL,其中含不同条件的10×PCR buffer 2μL,2.5mmol/L的dNTPs1.6μL,10μmol/L的引物M13F 0.5μL,10μmol/L的引物M13R0.5μL,ZHB HiFi DNA聚合酶0.2μL,15ng/μL的pUC57-ZHB HiFi DNA 0.5μL,按98℃1min,(98℃10s,55℃45s,72℃30s)25cycles,最后72℃延伸5min,电泳检测,确定最适buffer。根据结果,确定ZHB HiFi DNA的最适反应缓冲液为BufferE(10×ZHB HiFi DNA PCR Buffer):100mM KCl;160mM(NH4)2SO4;20mM MgSO4;1mg/ml BSA;200mM Tris-HCl(pH 8.8,25℃);1.0%(v/v)Triton X-100。
以所述的BufferE和实施例4制备得的ZHB HiFi DNA聚合酶分别扩增0.5-1.5kb人基因组不同的DNA片段,琼脂糖凝胶电泳结果显示均能很好地扩增得到目的片段,检测结果如图10所示为0.5-1.5kb人基因组中不同的DNA片段。将上述PCR产物送至南京金斯瑞科技有限公司进行DNA序列测序,测序结果显示,与模板完全匹配,保真性达到了100%,说明ZHB HiFi DNA聚合酶具有较高的扩增效率和保真性。
实施例6 ZHB HiFi DNA聚合酶热稳定性
将实施例4制备得到的ZHB HiFi DNA聚合酶于90℃高温孵育0、1、2、3、4、5、6h;并将孵育后获得的不同时间的ZHB HiFi DNA聚合酶以实施例5中的BufferE测其扩增1.0-1.5kb人基因组DNA片段中活性,1%琼脂糖凝胶电泳检测其扩增效果。结果如图11-a和图11-b所示,ZHB HiFi DNA聚合酶在90℃高温中孵育2h,仍扩增出目的基因,说明ZHB HiFi DNA聚合酶具有极高的热稳定性,其90℃半衰期约为2h。
实施例7 ZHB HiFi DNA聚合酶冻融稳定性
将实施例4制备得到的ZHB HiFi DNA聚合酶用干冰冻结、37℃水浴溶解进行交替处理20次,并将交替处理得到的不同次数的ZHB HiFi DNA聚合酶以实施例5中的BufferE测其在扩增重组人基因组DNA片段中活性,1%琼脂糖凝胶电泳检测其扩增效果。结果如图12显示ZHB HiFi DNA聚合酶经过干冰冻结、37℃水浴溶解交替处理20次后均能很好地扩增得到目的片段,说明ZHB HiFi DNA聚合酶经过反复冻融20次以上,仍具有较高的稳定性。
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!