细胞培养载体模块、生物反应器及细胞回收方法与流程
本发明涉及一种细胞培养载体模块、生物反应器及细胞回收方法,且特别是涉及一种具有可在二维结构与三维结构之间转换的细胞培养载体模块、包括上述细胞培养载体模块的生物反应器以及使用上述细胞培养载体模块的细胞回收方法。
背景技术:
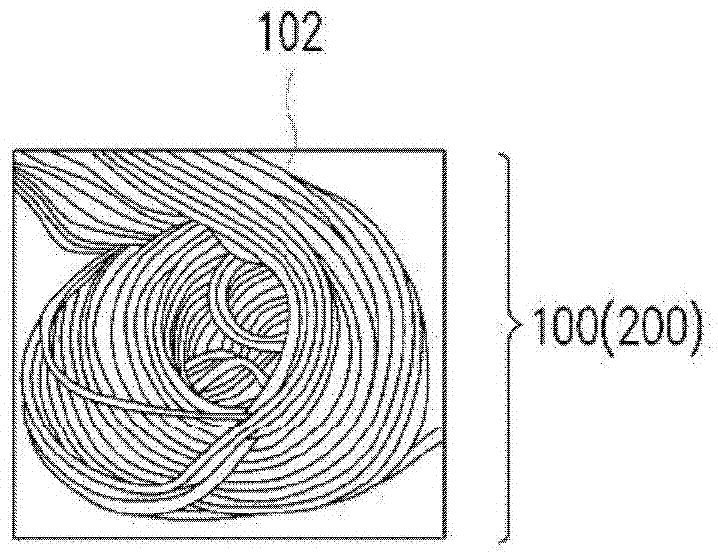
:目前细胞量产所使用的载体支架可分为两类,分别为天然材料(例如胶原蛋白(collagen)、几丁聚醣(chitosan)或明胶(gelatin)等),或是合成材料(聚已内酯(PCL)、聚苯乙烯(PS)、聚丙烯(PP)或聚乳酸-聚甘醇酸共聚物(PLGA)等)。天然材料多为动物来源材料,虽然动物来源材料具有低细胞毒性且生物相容性高,但动物来源材料可能会带有无法检测出的动物性污染原,因此目前趋势倾向减少使用甚至不使用动物来源材料以降低污染风险。另外,目前市面上的细胞载体除了以海藻酸盐(Alginate)为基材的相关产品外,其他的合成材料都相当难以降解(degradation),所以难以顺利回收细胞。由于海藻酸盐为基材的相关产品在进行细胞培养时需使用高浓度钙离子,可能会伤害细胞或使某些细胞趋向分化(例如间质干细胞),而且海藻酸盐降解时也需要使用钙离子螯合剂(chelator),使用不当很容易伤害细胞。此外,收集细胞的载体支架关键技术仍待突破,故目前细胞量产技术一直停留在传统二维平盘培养方法,无法顺利放大制作工艺。因此,如何找出适合细胞快速大量生长又不带有动物性污染源的载体材料,以及如何提高细胞回收率及细胞品质,是目前研究人员急欲解决的问题。技术实现要素:本发明的目的在于提出一种细胞培养载体模块,其可有效地提高细胞回 收率。为达上述目的,本发明提供一种细胞培养载体模块,其包括至少一细胞培养载体,细胞培养载体可在二维结构与三维结构之间转变。细胞培养载体在松开的状态为二维结构,且在压缩的状态为三维结构。依照本发明实施例所述的细胞培养载体模块,其中二维结构例如是平行线阵列或交错线阵列。依照本发明实施例所述的细胞培养载体模块,其中三维结构例如是螺旋状或线团状。依照本发明实施例所述的细胞培养载体模块,其中细胞培养载体的材料包括细胞可贴附材料或经处理后具有细胞可贴附性的材料。依照本发明实施例所述的细胞培养载体模块,其中处理方式例如是表面改质、表面涂覆或表面微结构化。依照本发明实施例所述的细胞培养载体模块,还包括外套管以及至少一固定构件,固定构件配置于细胞培养载体的至少一端,例如是将两个固定构件分别配置于细胞培养载体的两端,其中细胞培养载体位于外套管内且固定于固定构件上。依照本发明实施例所述的细胞培养载体模块,其中通过将固定构件推进所述外套管内而挤压细胞培养载体,使细胞培养载体从二维结构转变成三维结构,并通过将固定构件从外套管内退出,使细胞培养载体从三维结构转变成二维结构。依照本发明实施例所述的细胞培养载体模块,其中外套管的内侧管壁可具有螺纹,通过使固定构件沿着螺纹旋入外套管内,而将细胞培养载体从二维结构转变成三维结构,并通过使固定构件沿着螺纹从外套管内旋出,而将细胞培养载体从三维结构转变成二维结构。依照本发明实施例所述的细胞培养载体模块,还包括驱动件以及螺杆。驱动件配置于所述外套管的一端,螺杆连接于所述驱动件,且穿过固定构件,通过驱动件驱动螺杆,使固定构件推进外套管内,而将细胞培养载体从二维结构转变成三维结构,并通过驱动件驱动螺杆,使固定构件从外套管内退出,而将细胞培养载体从三维结构转变成二维结构。本发明提供一种生物反应器。生物反应器包括上述细胞培养载体模块。本发明提供一种细胞回收方法,其包括以下步骤:提供细胞培养载体模 块,细胞培养载体模块包括至少一细胞培养载体,细胞培养载体可在二维结构与三维结构之间转变,细胞培养载体在松开的状态为二维结构,在压缩的状态为三维结构,且在细胞培养载体为三维结构状态下进行细胞培养,在细胞培养载体为二维结构状态下进行细胞回收。依照本发明实施例所述的细胞回收方法,其中将二维结构的细胞培养载体转变为三维结构的细胞培养载体的方法例如是扭转或挤压二维结构的细胞培养载体。依照本发明实施例所述的细胞回收方法,其中在细胞培养载体为二维结构的状态下进行细胞回收的步骤包括下列步骤。将二维结构状态的细胞培养载体浸渍在含有细胞脱附酵素的试剂中,使细胞从细胞培养载体脱附。取出含有细胞的悬浮液。依照本发明实施例所述的细胞回收方法,其中细胞脱附酵素例如是胰蛋白酶(trypsin)、TrypLE(商品名)、Accutase(商品名)、Accumax(商品名)或胶原蛋白酶(collagenase)。依照本发明实施例所述的细胞回收方法,还包括在三维结构的状态下或从三维结构转变至二维结构的过程中,在细胞培养载体上加入细胞脱附酵素。依照本发明实施例所述的细胞回收方法,还包括在三维结构的状态下或从三维结构转变至二维结构的过程中进行细胞回收。依照本发明实施例所述的细胞回收方法,其中细胞培养载体模块还包括外套管以及至少一固定构件。固定构件配置于外套管的至少一端,例如是将两个固定构件分别配置于细胞培养载体的两端。细胞培养载体位于外套管内且固定于固定构件上。依照本发明实施例所述的细胞回收方法,其中通过将固定构件推进所述外套管内而挤压细胞培养载体,使细胞培养载体从二维结构转变成三维结构,并通过将固定构件从外套管内退出,使细胞培养载体从三维结构转变成二维结构。依照本发明实施例所述的细胞回收方法,其中外套管的内侧管壁具有螺纹。通过使固定构件沿着螺纹旋入外套管内,而将细胞培养载体从二维结构转变成三维结构,通过使固定构件沿着螺纹从外套管内旋出,而将细胞培养载体从三维结构转变成二维结构。依照本发明实施例所述的细胞回收方法,其中细胞培养载体还包括驱动件以及螺杆。驱动件配置于所述外套管的一端,螺杆连接于驱动件,且穿过固定构件,通过驱动件驱动所述螺杆,将固定构件推进外套管内,而使细胞培养载体从二维结构转变成三维结构。并通过驱动件驱动所述螺杆,将固定构件从外套管内退出,而使细胞培养载体从三维结构转变成二维结构。依照本发明实施例所述的细胞回收方法,其中细胞培养载体的材料包括细胞可贴附材料或经处理后具有细胞可贴附性的材料。依照本发明实施例所述的细胞回收方法,其中处理方式例如是表面改质、表面涂覆或表面微结构化。基于上述,本发明的细胞培养载体模块,其具有可在二维结构与三维结构之间转换的细胞培养载体,因此当细胞培养载体在三维结构下进行细胞培养时,三维结构的细胞培养载体可提供更多的表面积与空间以供细胞生长,进而提高所培养的细胞数量。此外,当细胞培养载体在二维结构状态下进行细胞回收时,其松开的结构可使细胞培养载体与细胞脱附酵素充分地反应,有助于进行生长于细胞培养载体内层的细胞脱附,进而提高细胞的回收率。为让本发明的上述特征和优点能更明显易懂,下文特举实施例,并配合所附的附图作详细说明如下。附图说明图1为本发明一实施例的细胞培养载体模块所绘示的示意图;图2为本发明一实施例的螺旋状的细胞培养载体模块所绘示的示意图;图3为本发明一实施例的线团状的细胞培养载体模块所绘示的示意图;图4为本发明另一实施例的细胞培养载体模块所绘示的示意图;图5a为本发明第一实施例的细胞培养载体模块所绘示的示意图;图5b为图5a的细胞培养载体模块中细胞培养载体经压缩后所绘示的示意图;图6a为本发明第二实施例的细胞培养载体模块所绘示的示意图;图6b为图6a的细胞培养载体模块中细胞培养载体经压缩后所绘示的示意图;图7a为依据本发明第三实施例的细胞培养载体模块所绘示的示意图;图7b为图7a的细胞培养载体模块中细胞培养载体经压缩后所绘示的示 意图;图8为本发明的一实施例的一种细胞回收的流程步骤图;图9为本发明一实施例的生物反应器所绘示的示意图;图10为在本发明的细胞培养载体上培养非洲绿猴肾(VERO)细胞21天后的生长曲线图;图11为在本发明的细胞培养载体上培养脂肪干细胞(ADSC)21天后的生长曲线图。符号说明10、20、30、500:细胞培养载体模块50:生物反应器100、200、302、402、502:细胞培养载体102、302a、402a:细胞培养线材304、404、504:外套管305:螺纹306a、306b、406a、406b、506a、506b:固定构件408:驱动件410:螺杆510:培养基槽511:细胞注入孔512:培养基输入管线513:泵514:培养基输出管线516:探测器516a:探针518:加热器520:系统控制主机S100、S110、S120:步骤S112、S114、S116、S118、S122、S124、S126:子步骤具体实施方式图1为依据本发明一实施例的细胞培养模块所绘示的示意图。图2为依 据本发明一实施例的螺旋状的细胞培养载体模块所绘示的示意图。图3为依据本发明一实施例的线团状的细胞培养载体模块所绘示的示意图。请参照图1至图3,细胞培养载体模块包括可在二维结构与三维结构之间转变的细胞培养载体100。细胞培养载体100在松开的状态为所述二维结构(请参照图1),且在压缩的状态为所述三维结构(请参照图2与图3)。在图1的实施例中,二维结构是以平行线阵列为例进行说明,但本发明并不以此为限。三维结构例如是螺旋状(图2)或线团状(图3)。举例来说,细胞培养载体100包括多条细胞培养线材102。如图1所示,多条细胞培养线材102可彼此平行排列成平行线阵列的二维结构。细胞培养载体100的材料例如是聚酯(Polyester;PET)、尼龙(Nylon)、聚乙烯(Polyethylene;PE)、聚丙烯(Polypropylene;PP)、聚氯乙烯(polyvinylchloride;PVC)、聚苯乙烯(polystyrene;PS)、乙烯-乙酸乙烯酯共聚物(EthyleneVinylAcetate;EVA)或聚氨酯(polyurethane;PU)等。但本发明不限于此,凡是具有可抽丝特性的材料(例如,条状薄片或线状片材)都可作为本发明的细胞培养载体的材料。细胞培养载体100可为细胞可贴附材料或经处理后具有细胞可贴附性的材料。上述处理的方法包括表面改质、表面涂覆或表面微结构化等。表面改质例如是对细胞可贴附材料或细胞不可贴附材料的表面进行等离子体处理(plasmamodification),使其表面具有细胞可贴附特性,以利于细胞贴附。表面涂覆(coating)为在细胞可贴附材料或细胞不可贴附材料的表面上涂覆例如是胶原蛋白(collagen)、几丁聚醣(chitosan)、明胶(gelatin)或海藻酸盐(Alginate)等,但不限于此,以利于细胞贴附。表面微结构化(micro-structured)例如是在细胞可贴附材料或细胞不可贴附材料的表面上进行激光切割以形成微孔道,以利于细胞贴附。但本发明的处理方式并不限于此,凡是可提高细胞贴附性的处理方式都可应用在本发明中。在本实施例中,将细胞培养载体100由二维结构转变为三维结构的方法例如是通过挤压或扭转二维结构状态的细胞培养载体100,以使二维结构状态的细胞培养载体100经压缩而转变为三维结构状态,如螺旋状(图2)或线团状(图3)的三维结构。举例来说,可用手直接扭转或压缩二维结构的细胞培养载体100,但本发明不限于此。在另一实施例中,也可使用辅助工具来扭转或压缩二维结构的细胞培养载体100。将细胞培养载体100由三维结构转变为二维结构的方法例如是通过松开或拉直三维结构状态的细胞培养载体100,以使三维结构状态的细胞培养载体100转变为二维结构状态。举例来说,可用手直接松开或拉直三维结构的细胞培养载体100,但本发明不限于此。在另一实施例中,也可使用辅助工具(请参照图5a至图7b)来松开或拉直三维结构的细胞培养载体100。在上述实施例中,由于细胞培养载体模块具有可在二维结构与三维结构之间转换的细胞培养载体100,因此当细胞培养载体100在三维结构下进行细胞培养时,三维结构的细胞培养载体100可提供更多的表面积与空间以供细胞生长,进而提高所培养的细胞数量。此外,当细胞培养载体100在二维结构状态下进行细胞回收时,其松开的结构可使细胞培养载体100与细胞脱附酵素充分地反应,有助于进行生长于细胞培养载体100内层的细胞脱附,进而提高细胞的回收率。图4为依据本发明另一实施例的细胞培养载体模块所绘示的示意图。请参照图4,细胞培养载体200也可在二维结构与三维结构之间转变。细胞培养载体200在松开的状态为所述二维结构(请参照图4),且在压缩的状态为所述三维结构(请参照图2与图3)。请同时参照图1与图4,图4的细胞培养载体200与图1的细胞培养载体100的差别在于:细胞培养载体200的二维结构为交错线阵列,意即,细胞培养线材102可彼此交错排列成交错线阵列的二维结构。此外,在细胞培养载体200与细胞培养载体100中相同的构件以相同的符号表示并省略其说明。图5a为依据本发明第一实施例的细胞培养载体模块所绘示的示意图。图5b为图5a的细胞培养载体模块中细胞培养载体经压缩后所绘示的示意图。请同时参考图5a与图5b,细胞培养载体模块10包括细胞培养载体302、外套管304以及二个固定构件306a、306b。细胞培养载体302例如是上述实施例中的细胞培养载体100、200中至少一者。细胞培养载体302可包括多条细胞培养线材302a。固定构件306a、306b分别配置于细胞培养载体302的两端。细胞培养载体302位于外套管304内且固定于固定构件306a、306b上。外套管304的材料及固定构件306a、306b的材料例如是聚酯(Polyester;PET)、尼龙(Nylon)、聚乙烯(Polyethylene;PE)、聚丙烯(Polypropylene;PP)、聚 氯乙烯(polyvinylchloride;PVC)、聚苯乙烯(polystyrene;PS)、乙烯-乙酸乙烯酯共聚物(EthyleneVinylAcetate;EVA)、聚氨酯(polyurethane;PU)、聚碳酸酯(polycarbonate;PC)或玻璃等,但本发明不限于此。在本实施例中,可通过将固定构件306a推进外套管内304而挤压细胞培养载体302,使细胞培养载体302从所述二维结构转变成所述三维结构(如图5b所示);同理,可通过将固定构件306a从外套管304内退出,使细胞培养载体302从所述三维结构转变成所述二维结构(如图5a所示)。图6a为依据本发明第二实施例的细胞培养载体模块所绘示的示意图。图6b为图6a的细胞培养载体模块中细胞培养载体经压缩后所绘示的示意图。图6a及图6b的细胞培养模块20与图5a及图5b的细胞培养模块10大致相似。在图6a及图6b中,与图5a及图5b相同的元件以相同的标号表示,于此不另行对其进行说明。请同时参照图6a及图6b,图6a及图6b的细胞培养模块20与图5a及图5b的细胞培养模块10的主要差异在于:在本实施例中,外套管304的内侧管壁具有螺纹305。在本实施例中,可通过将固定构件306a沿着螺纹305旋入外套管304内,以使细胞培养载体302经扭转而压缩成螺旋状,进而将细胞培养载体302从二维结构转变为三维结构(如图6b所示);同理,可通过将固定构件306a沿着螺纹305从外套管304内旋出,以使细胞培养载体302松开,进而使细胞培养载体302从三维结构转变为二维结构(如图6a所示)。图7a为依据本发明第三实施例的细胞培养载体模块所绘示的示意图。图7b为图7a的细胞培养载体模块中细胞培养载体经压缩后所绘示的示意图。请同时参考图7a与图7b,本实施例的细胞培养载体模块30包括细胞培养载体402、外套管404、二个固定构件406a、406b、驱动件408与螺杆410。细胞培养载体402例如是上述实施例中的细胞培养载体100、200中至少一者。细胞培养载体402可包括多条细胞培养线材402a。固定构件406a与406b分别配置于细胞培养载体402的两端。细胞培养载体402线性排列于外套管404内且固定于固定构件406a与406b上。外套管404的材料及固定构件406a、406b的材料例如是聚酯(Polyester;PET)、尼龙(Nylon)、聚乙烯(Polyethylene;PE)、聚丙烯(Polypropylene;PP)、 聚氯乙烯(polyvinylchloride;PVC)、聚苯乙烯(polystyrene;PS)、乙烯-乙酸乙烯酯共聚物(EthyleneVinylAcetate;EVA)、聚氨酯(polyurethane;PU)、聚碳酸酯(polycarbonate;PC)或玻璃等,但本发明不限于此。驱动件408配置于外套管404靠近固定构件406a的一端。螺杆410连接于驱动件408,且穿过固定构件406a。因此,可通过驱动件408驱动螺杆410,而将固定构件406a推进外套管404内,使细胞培养载体402从二维结构转变成三维结构(如图7b所示);同理,可通过驱动件408驱动螺杆410,而将固定构件406a从外套管404内退出,使细胞培养载体402从三维结构转变成二维结构(如图7a所示)。图8为依照本发明的一实施例的一种细胞回收的流程步骤图。请参考图8,并提供执行细胞回收步骤的详细叙述如下:首先,执行步骤S100:提供细胞培养载体模块。细胞培养载体模块可使用图1至图7b中的细胞培养载体模块中的至少一者。上述细胞培养载体模块包括可在二维结构与三维结构之间转变的细胞培养载体。细胞培养载体在松开的状态为所述二维结构,而在压缩的状态为所述三维结构。其次,执行步骤S110:在细胞培养载体为三维结构状态下进行细胞培养。步骤S110可进一步包括子步骤S112、S114、S116、S118;其中,子步骤S112为将二维结构状态的细胞培养载体转变为三维结构状态,而关于将二维结构状态的细胞培养载体转变为三维结构状态的方式已于上述实施例中进行详尽地描述,故于此不再赘述。接着,执行子步骤S114:将细胞接种至三维结构的细胞培养载体上。培养的细胞例如是干细胞或分化的细胞,但本发明不限于此;具体来说,培养的细胞例如是非洲绿猴肾(VERO,anAfricangreenmonkeykidneycellline)细胞、脂肪干细胞(ADSC,HumanAdipose-DerivedStemCell)、间质干细胞(MSC,MesenchymalStemCell)、马丁达比犬肾细胞(MDCK,Madin-DarbyCanineKidney)或人类胚胎肾脏细胞(HEK293,HumanEmbryonicKidney293)等,但不限于此。在本实施例中,先将培养基加入细胞培养载体中,以使整个三维结构的细胞培养载体充满了培养基,再将细胞接种至细胞培养载体中。在另一实施例中,也可直接将含有细胞的细胞培养基均匀加入三维结构的细胞培养载体中,以使整个三维结构的细胞培养载体充满了细胞培养基。培养基为一般常用于细胞培养的标准生长培养基;例如是具有胎牛血清 (FBS)的培养基或无血清培养基,但本发明不限于此。此外,应理解的是,因应不同的细胞特性,其细胞培养基操作浓度的需求也不相同,因此可视细胞特性来调整操作浓度,且视情况需要,可于培养基中添加生长因子或抗生素等等,此为本领域通常知识者所熟知。再接着,执行子步骤S116:使细胞贴附于细胞培养载体上。在本实施例中,将细胞培养模块在特定生长条件(例如特定的温度、湿度或二氧化碳浓度)下置于培养箱中,以使细胞贴附于细胞培养载体上。再接着,执行子步骤S118:进行细胞培养。细胞培养的方式例如是将细胞培养载体置于培养箱中进行静态培养或动态培养。动态培养可通过扰动细胞培养载体周围的培养基来进行,扰动培养基的方式例如是将具有细胞培养载体模块的培养瓶置放于磁力转盘上,通过磁力转盘带动磁石的旋转来扰动培养基。在一实施例中,细胞培养后的细胞生长数量可增加至100倍以上。在另一实施例中,细胞培养后的细胞生长数量更可增加至高达2000倍以上。在此要说明的是,由于不同的细胞具有不同的特性,因此可依据不同细胞种类来调整细胞培养条件。举例来说,在培养哺乳动物细胞时,可在37℃与5%CO2条件下进行细胞培养,并将培养基的pH值维持在其生理范围内,例如对大多数动物细胞而言,培养液合适pH值为7.2~7.4。相较于二维结构的细胞培养载体而言,在本实施例中,由于是在三维结构的细胞培养载体上接种细胞并进行细胞培养,三维结构的细胞培养载体除了可提供更多的表面积与空间以供细胞生长,进而提高所培养的细胞数量。除此之外,在本实施例中,细胞培养载体是在压缩的状态下进行细胞接种及后续的细胞培养,因此也可减少培养基的使用量,进而减少成本。再者,执行步骤S120:在细胞培养载体为二维结构状态下进行细胞回收。步骤S120可进一步包括以下子步骤S122、S124、S126。首先,执行子步骤S122:将三维结构状态的细胞培养载体转变为二维结构状态。将三维结构状态的细胞培养载体转变为二维结构状态的方式已于上述实施例中进行详尽地描述,故于此不再赘述。接着,执行子步骤S124:将二维结构的细胞培养载体浸渍在含有细胞脱附酵素的试剂中,使细胞从细胞培养载体上脱附。在一实施例中,含有细胞脱附酵素的试剂可在二维结构状态下进行滴加,而使得二维结构的细胞培养载体浸渍在含有细胞脱附酵素的试剂中。在另一实施例中,也可在三维结 构的状态下或从三维结构转变至二维结构的过程中,在细胞培养载体上滴加含有细胞脱附酵素的试剂,此时细胞培养载体可在三维结构的状态下就已浸渍在含有细胞脱附酵素的试剂中。细胞脱附酵素例如是胰蛋白酶、TrypLE、Accutase、Accumax或胶原蛋白,但本发明不限于此,也可以使用其他可使细胞脱附的酵素或试剂。再接着,进行子步骤S126:取出含有细胞的悬浮液,而完成细胞回收。在上述实施例中,是以在细胞培养载体为二维结构状态下进行细胞回收为例来进行说明。在另一实施例中,在三维结构的状态下或从三维结构转变至二维结构的过程中,在细胞培养载体上滴加含有细胞脱附酵素的试剂的情况下,除了可在细胞培养载体为二维结构状态下进行细胞回收之外,还可在所述三维结构的状态下或从所述三维结构转变至所述二维结构的过程中进行细胞回收。在本实施中,由于是在细胞培养载体为二维结构的状态下进行细胞回收,其松开的结构可充分的使细胞培养载体与含有细胞脱附酵素的试剂反应,且其松开的结构也有利于生长于细胞培养载体内层的细胞脱附,进而有效提高细胞回收率。在一实施例中,可将图1至图7b中的细胞培养载体模块中的至少一者应用在生物反应器中,以提高生物反应器的细胞数量与细胞回收率。图9为依据本发明一实施例的生物反应器所绘示的示意图。请参考图9,本实施例的生物反应器50包括细胞培养载体模块500以及培养基槽510。细胞培养载体模块500包括细胞培养载体502、外套管504以及二个固定构件506a、506b。固定构件506a、506b分别配置于细胞培养载体502的两端。细胞培养载体502位于外套管504内且固定于固定构件506a、506b上。培养基槽510包括培养基输入管线512以及培养基输出管线514。培养基槽510经由培养基输入管线512以及培养基输出管线514分别连接至外套管504的两端。培养基输入管线512可通过泵513将培养基槽510中的培养基注入外套管504中,而培养基输出管线514可将外套管504中的培养基输出至培养基槽510中。培养基输入管线512具有细胞注入孔511。可将含有细胞的细胞培养基由细胞注入孔511注入培养基输入管线512中,并经由培养基输入管线512进入外套管504中。在本实施例中,培养基槽510可更包括至少一探测器516以及加热器518。探测器516配置在培养基槽510上。探测器516具有探针516a,探针516a的一端延伸入培养基槽510内的培养基中。探测器516通过探针516a来检测培养基。探测器516例如是pH酸碱度计、温度计或溶氧度计。加热器518配置在培养基槽510外。可通过加热器518来加热培养基槽510内培养基的温度,以使培养基维持在适当的温度。此外,生物反应器50可还包括系统控制主机520,连接于泵513、探测器516以及加热器518,用以控制培养基的输入与输出、探测器516以及加热器518。以下将描述使用上述生物反应器进行细胞回收的流程步骤。首先,将含有细胞的细胞培养基由细胞注入孔511注入培养基输入管线512中。所注入的细胞培养基经由培养基输入管线512进入外套管504内且接种至三维结构状态的细胞培养载体502上。在本实施例中,所注入至外套管内的细胞培养基的体积约为刚好覆盖整个细胞培养载体502的体积。使细胞贴附于细胞培养载体上(约4-6小时,可依细胞种类不同而调整)。接着,将培养基槽510内的培养基经由培养基输入管线512注入外套管504中,且同时将外套管504中的培养基经由培养基输出管线514输出至培养基槽510中,以进行培养基灌流及循环。为了使培养基槽510中的培养基混合均匀,可通过扰动培养基槽510中的培养基,或者是通过震荡培养基槽510而使培养基槽510内的培养基混合。扰动培养基的方式例如是将培养基槽510置放于磁力转盘上,通过磁力转盘带动磁石的旋转来扰动培养基。震荡培养基槽510的方式例如是将培养基槽510置放于震荡器上,通过震荡器来摇晃震荡培养基槽510,以使培养基槽510中的培养基混合。然后,在培养基持续循环下进行细胞培养。在此期间中,系统控制主机520控制培养基的输入与输出、探测器516以及加热器518。举例来说,可通过控制探测器516来监控培养基和细胞生长代谢状况。细胞培养之后,将外套管504内所有的培养基经由培养基输出管线514输出至培养基槽510中。使用磷酸缓冲盐溶液(phosphatebuffersaline,PBS)反复冲洗细胞培养载体502上残留的培养基,然后移除磷酸缓冲盐溶液。接着,在三维结构状态的细胞培养载体502上滴加含有细胞脱附酵素的 试剂(例如是胰蛋白酶、TrypLE、Accutase、Accumax或胶原蛋白酶),使细胞从细胞培养载体502上脱附。将三维结构状态的细胞培养载体502转变为二维结构状态,用以将生长于细胞培养载体502内层的细胞脱附。将三维结构状态的细胞培养载体转变为二维结构状态的方式已于上述实施例中进行详尽地描述,故于此不再赘述。在其他实施例中,也可在细胞培养载体502为二维结构状态时滴加含有细胞脱附酵素的试剂,或者在细胞培养载体502从三维结构状态转变成二维结构状态的过程中滴加含有细胞脱附酵素的试剂。之后,取出含有细胞的悬浮液,并进行离心等后续处理步骤而完成细胞回收。以下,列举本发明的实例以更具体对本发明进行说明。然而,在不脱离本发明的精神,可适当地对以下的实例中所示的材料、使用方法等进行变更。因此,本发明的范围不应以以下所示的实例来限定解释。[动态培养实验]实例1在实例1中,使用图1的细胞培养载体模块且依照图8所示的细胞培养步骤来进行细胞动态培养实验。采用非洲绿猴肾细胞(VERO)作为待培养的细胞。细胞培养的步骤如下:将具有VERO细胞的M199培养基(含有5%FBS)接种于三维结构的细胞培养载体,其中在M199培养基中的VERO细胞密度为2×104/cm2;将上述接种细胞后的细胞培养载体在37℃与5%CO2条件下进行动态培养21天;在此期间,每2-3天更换新的培养基,并于不同时间点测量细胞生长情况。实例2在实例2中,使用图1的细胞培养载体模块且依照图8所示的细胞培养步骤来进行细胞动态培养实验。采用脂肪干细胞(ADSC)作为待培养的细胞。细胞培养的步骤如下:将含有ADSC的无血清培养基分别接种于三维结构的细胞培养载体,其中在无血清培养基中的ADSC的细胞密度为1.5×103/cm2;将上述接种细胞后的细胞培养载体在37℃与5%CO2条件下进行动态培养21天;在此期间,每2-3天更换新的培养基,并于不同时间点测量细胞生长情况。图10为在本发明的细胞培养载体上培养非洲绿猴肾(VERO)细胞21 天后的生长曲线图。图11为在本发明的细胞培养载体上培养脂肪干细胞(ADSC)21天后的生长曲线图。如图10与图11所示,实例1的VERO细胞与实例2的ADSC的细胞数都随着培养的天数增加而上升,其中,实例1的VERO细胞于培养21天之后,其细胞生长数量增加800倍以上;实例2的ADSC于培养21天之后,其细胞生长数量增加2000倍以上。由上述结果可知,本发明的细胞培养载体不具有毒性,可使细胞顺利贴附并生长,具有良好的生物相容性。[细胞回收率检测]实例3在实例3中,依照图8所示的细胞回收步骤来对实例2的ADSC进行细胞回收,并对所回收的细胞进行细胞回收率测试。使用ADSC作为待培养的细胞。进行细胞回收的步骤如下:将ADSC分别培养于3个三维结构的细胞培养载体中(细胞培养载体A、细胞培养载体B及细胞培养载体C)并进行细胞培养10天后,将各个细胞培养载体分别浸泡在胶原蛋白酶中,接着再松开各个细胞培养载体以使结构由三维结构转变为二维结构,持续使各个二维结构状态的细胞培养载体浸泡于胶原蛋白酶中以促进细胞脱附,接着计算细胞悬浮液中细胞数目与载体上残留的细胞数(各个细胞培养载体回收的结果详列于下表1中)。如表1所示,细胞培养载体上取下的细胞仍保有大于80%的高存活率。并且,利用本发明的细胞培养载体进行细胞培养的回收率大于80%。由上述结果可知,由于上述实施例是在细胞培养载体为二维结构的状态下进行细胞回收,其松开的结构可充分的使细胞培养载体与胶原蛋白酶反应,且松开的二维结构也有利于生长于细胞培养载体内层的细胞脱附,因此在细胞培养载体为三维结构状态下无法进行脱附的细胞可在二维结构状态下进行脱附,进而提升细胞回收率。[表1]条件存活率(%)回收率(%)细胞培养载体A8188细胞培养载体B8693细胞培养载体C8795[细胞特性测试]为了测试利用本发明细胞培养载体所培养的细胞的特性,使用如同下述流式细胞仪的操作步骤对上述实例3所回收的ADSC进行细胞表面标记分析。流式细胞仪分析的操作步骤如下:1.将细胞离心后移去上清液并加入适量体积MACS分离缓冲液(MACSSeparationBuffer)(或2%FBS)去回溶(resuspend)细胞,使细胞浓度约为1×106/ml至2×106/ml。2.取100μl平分到每一试管中,细胞数目为1×105/管至1×106/管。3.依抗体的种类加入适量的抗体在2℃至8℃避光反应30分钟。4.加入1ml的杜氏磷酸盐缓冲液(Dulbecco'sPhosphateBufferedSaline,DPBS)后,以1500rpm离心5分钟后,移去上清液。5.加入300μl的DPBS回溶细胞后,使用流式细胞仪(型号:BDFACScan)进行分析。一般来说,脂肪干细胞的特性为:需高度表现标记蛋白CD73、CD90及CD105,且需低度表现或不表现血球细胞的标记蛋白CD34及CD45。结果如表2所示,由细胞培养载体A、B及C所回收的ADSC细胞,都会高度表现CD73、CD90及CD105,且低度表现或不表现CD34及CD45。此结果证实了利用本发明的细胞培养载体所培养及回收的ADSC仍能维持其干细胞的特性。[表2]综上所述,由于上述实施例的细胞培养载体模块具有可在二维结构与三维结构之间转换的细胞培养载体,因此不仅提高了所培养的细胞数量与细胞回收率,且能维持细胞培养的品质,使细胞于增长的同时仍维持其既有的特性,例如上述回收的ADSC仍维持其干细胞的特性。虽然结合以上实施例公开了本发明,然而其并非用以限定本发明,任何 所属
技术领域:
中具有通常知识者,在不脱离本发明的精神和范围内,可作些许的更动与润饰,故本发明的保护范围应当以附上的权利要求所界定的为准。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1