检测多特异性抗体轻链错配的方法与流程
发明背景
1995年,Yamaguchi等人(J.Immunol.Meth.181(1995)259-267)报告了小鼠免疫球蛋白G的高特异性蛋白水解片段化的方法,该方法使用赖氨酰内肽酶、梭菌蛋白酶、金属内肽酶和V8蛋白酶,由此在反应条件下检测的梭菌蛋白酶、赖氨酰内肽酶、金属内肽酶和V8蛋白酶选择性地不切割铰链区的lgG1和lgG1-CM。
Matsuda等人(FEBS Lett.473(2000)349-357)报告了使用Lys-C制备Fc片段的方法,通过MS获得Fc相关糖型的信息,用于确定免疫球蛋白G的Fc区中寡糖的配对。
Villanueva等人(J.Mass Spectrom.37(2002)974-984)报告了限制性蛋白质水解方法,该方法基于使用结合基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF MS)的非特异性外蛋白酶,以快速从两端(N-和C-端)绘制蛋白质的二级结构要素。
在WO 2005/073732中报告了高分子量蛋白质的分析方法,具体而言,报告了高分子量蛋白质(包括抗体)的反相LC/MS分析方法。
WO 2006/047340涉及用柱使用还原/氧化试剂和离液剂分离多肽的制剂,并分离从所述接触产生的再折叠活性蛋白质。活性蛋白可以是高分子量蛋白质,包括含有Fc结构域的多肽或片段。
Kleemann等人(Anal.Chem.80(2008)2001-2009)报告了通过限制性蛋白质水解并结合LC-MS,表征IgG1免疫球蛋白和肽-Fc融合蛋白。使用内蛋白酶Lys-C的限制性蛋白质水解导致主要切割该赖氨酸残基的C-端。
发明概述
业已发现,对于(多特异性)抗体的多特异性抗体限制性蛋白质水解中轻链错配的确定,必须在MS分析之前进行,因为完整多特异性抗体中轻链错配的确定被等压质量的干扰阻碍。
因此,如本文中报告的一个方面是使用蛋白质水解酶的多特异性抗体的限制性消化对分析多特异性抗体轻链配对的用途。
如本文所报告的一个方面是使用蛋白质水解酶的多特异性抗体的限制性消化对确定多特异性抗体中轻链错配的用途。
如本文所报告的一个方面是使用蛋白质水解酶的重组哺乳动物细胞生产的多特异性抗体的限制性消化对选择生产多特异性抗体的哺乳动物细胞的用途。
在所有上述方面的一个实施方案中,分析/确定/选择通过使用被消化抗体的质谱结果。
如本文所报告的一个方面是用于确定多特异性抗体中轻链配对的方法,所述方法包括以下步骤:
a)将包含多特异性抗体的样本与蛋白质水解酶孵育限定的时间,
b)通过质谱法鉴定由步骤a)的限制性蛋白水解消化获得的片段的质量,和
c)从步骤b)的结果确定多特异性抗体的轻链配对。
如本文所报告的一个方面是用于确定多特异性抗体的轻链错配的方法,所述方法包括以下步骤:
a)将包含多特异性抗体的样本与蛋白质水解酶孵育限定的时间,
b)通过质谱法鉴定由步骤a)的限制性蛋白水解消化获得的片段的质量,和
c)从步骤b)的结果确定多特异性抗体的轻链配对,从而确定轻链错配。
如本文所报告的一个方面是用于选择生产多特异性抗体的重组哺乳动物细胞的方法,所述方法包括以下步骤:
a)将包含一组重组哺乳动物细胞的一个重组哺乳动物细胞克隆群生产的多特异性抗体的样本单独地与蛋白质水解酶孵育限定的时间,所述一组重组哺乳动物细胞的所有细胞生成相同的多特异性抗体,
b)通过质谱法鉴定由步骤a)的限制性蛋白质水解消化获得的片段的质量,和
c)从步骤b)的结果确定每个克隆细胞群的多特异性抗体的轻链错配的存在,和
d)基于步骤c)的结果选择生产多特异性抗体的重组细胞。
在所有方面的一个实施方案,蛋白质水解酶选自Lys-C、纤溶酶、Asp-N、Arg-C、Glu-C、Ides、胃蛋白酶和胰凝乳蛋白酶。
在一个实施方案中多特异性抗体是二价抗体。
在所有方面的一个优选的实施方案中,蛋白质水解酶是Lys-C或纤溶酶。
在一个实施方案中,多特异性抗体是三或四价抗体。在一个实施方案中,多特异性抗体是包含两条轻链和两条重链的全长抗体,由此对重链C端直接或经由肽接头缀合一部分(moiety),所述一部分彼此独立地选自无部分、Fv片段、Fab片段、scFv片段和的scFab片段。
在抗体是四价抗体、其中结合位点还附着于重链C-端的情况下,可能需要两种蛋白质水解酶的双酶切消化。
在一个实施方案中,多特异性抗体是三价或四价多特异性抗体,方法包括通过与两种蛋白质水解酶混合物孵育的双消化。
在一个实施方案中,蛋白质水解酶混合物是纤溶酶和Ides。在一个实施方案中,蛋白质水解酶混合物是Lys-C和Ides。
在效应子沉默的抗体(L234A,L235A突变)的情况下,Ides不切割,必须选择胃蛋白酶。
在一个实施方案中,蛋白质水解酶混合物是纤溶酶和胃蛋白酶。在一个实施方案中蛋白质水解酶混合物是Lys-C和胃蛋白酶。
在一个优选的实施方案中,多价抗体是双特异性抗体。
在所有方面的一个实施方案中,孵育持续至多60分钟。在所有方面的一个实施方案中,孵育持续20至60分钟。在所有方面的一个实施方案中,孵育持续35至45分钟。
在所有方面的一个优选的实施方案中,孵育持续约40分钟。
在所有方面的一个实施方案,与蛋白质水解酶孵育的多特异性抗体是去糖基化的多特异性抗体。
在所有方面的一个实施方案中,抗体与酶的重量比为1:150至1:500。在所有方面的一个实施方案中,抗体与酶的重量比为1:200至1:400。在所有方面的一个实施方案中,抗体与酶的重量比为约1:200。
在所有方面的一个实施方案中,与蛋白质水解酶孵育的多特异性抗体具有从200至600μg/mL的浓度。
在所有方面的一个实施方案中,步骤b)是
b)脱盐步骤a)的孵育混合物,并通过质谱法鉴定由步骤a)的限制性蛋白质水解消化获得的片段的质量。
在所有方面的一个实施方案中,多特异性抗体是单克隆多特异性抗体。
在所有方面的一个实施方案中,多特异性抗体包含至少两个非肽相连的轻链。
在所有方面的一个实施方案中,多特异性抗体包含至少三个非肽相连的多肽。
在所有方面的一个实施方案中,质谱法是在线测定。
在所有方面的一个实施方案中,质谱是脱线测定。在一个实施方案中,脱线质谱法在脱盐步骤之后。
发明的详细说明
定义
如本文和所附权利要求书中所使用的,单数形式“一个(a)”,“一个(an)”,和“该(the)”包括复数指代,除非上下文另有明确说明。因此,例如,提及“一个(a)细胞”包括多个这样的细胞以及本领域技术人员已知的其等同物,等等。同样,术语“一(a)”(或“一(an)”),“一个或多个”和“至少一个”可以在本文中互换使用。与此相反,提及“一个(one)细胞”不包括多个这样的细胞,而是限于单个(分离的)细胞。
还应当注意的是,术语“包含”,“包括”和“具有”可以互换使用。
进一步还应当注意的是,术语“包含”涵盖了作为限制的术语“由...组成”。
术语“抗体”在本文中用于最广泛的意义,包含各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,至少双特异性抗体),只要这些抗体结构是多特异性的并包括至少两个非肽结合的轻链。
术语“非肽结合”表示两个多肽不是通过肽键(氨基酸的氨基和羧基基团之间形成的)彼此相连。但是这些多肽可以通过其他共价键(如二硫键)或非共价地相连。
术语“嵌合”抗体指这样的抗体,其中重链和/或轻链的一部分来自特定的来源或物种,而重链和/或轻链的其余部分来自不同的来源或物种。
抗体的“种类”指的是其重链具有的恒定结构域或恒定区的类型。有五大类抗体:IgA,IgD,IgE,IgG和IgM,其中有些可进一步分为亚类(同种型),例如IgG1,IgG2,IgG3,IgG4,IgA1和IgA2。对应于免疫球蛋白不同种类的重链恒定结构域分别被称为α,δ,ε,γ和μ。
本文的术语“Fc区”用于定义至少包含恒定区一部分的免疫球蛋白重链的C-端区域。该术语包括天然序列Fc区和变体Fc区。在一个实施方案中,人IgG重链Fc区从Cys226或从Pro230延伸至重链的羧基端。然而,Fc区的C-端赖氨酸(Lys447)可以存在或可以不存在。除非本文另有规定,Fc区或恒定区中氨基酸残基的编号依照EU编号系统,也被称为EU索引,如Kabat,E.A.等人,Sequences of Proteins of Immunological Interest,第5版,Public Health Service,National Institutes of Health,Bethesda,MD(1991),NIH Publication 91-3242中描述的。
术语“全长抗体”,“完整抗体”和“整个抗体”在本文中可互换使用,指具有与天然抗体结构基本上相似的结构的抗体或者具有包含如本文所定义的Fc区的重链的抗体。
术语“宿主细胞”,“宿主细胞系”和“宿主细胞培养物”可互换使用,是指其中已引入外源核酸的细胞,包括这样的细胞的后代。宿主细胞包括“转化体”和“转化的细胞”,其包括初次转化的细胞和来自其的后代,不考虑传代数目。后代可能在核酸含量上与亲代细胞不完全一致,但也可以含有突变。具有与在最初转化的细胞中筛选或选择的功能或生物学活性相同的功能或生物学活性的突变体后代包括在本文中。
“人抗体”是指具有如下氨基酸序列的抗体,所述氨基酸序列对应于人或人细胞、或来自利用人抗体谱或其他人抗体编码序列的非人来源生产的抗体的氨基酸序列。人抗体的这种定义特定地排除包含非人抗原结合残基的人源化抗体。
“人源化”抗体是指包含来自非人HVR氨基酸残基和来自人FR氨基酸残基的嵌合抗体。在某些实施方案中,人源化抗体将基本上包含至少一个,通常两个可变结构域的全部,其中HVR(例如CDR)的全部或基本上全部对应于非人类抗体的那些,和全部或基本上全部对应于人抗体的FR的FR。人源化抗体任选地可以包含来自人抗体的抗体恒定区的至少一部分。抗体(例如,非人抗体)的“人源化形式”,是指已经历人源化的抗体。
“分离的”抗体是已经从其天然环境成分中分离的抗体。在一些实施方案中,抗体被纯化至纯度大于95%或99%的纯度,如,例如,通过电泳(例如,SDS-PAGE,等电聚焦(IEF),毛细管电泳)或色谱(例如,离子交换或反向相HPLC)确定的。对于抗体纯度评估方法的综述,见,例如,Flatman,S.等人,J.Chromatogr.B 848(2007)79-87。
“分离的”核酸是指已从其天然环境成分中分离的核酸分子。分离的核酸包括通常含有核酸分子的细胞中含有的核酸分子,但是所述核酸分子存在于染色体外或在与其天然染色体位置不同的染色体位置。
如本文所用的术语“单克隆抗体”指从一群基本上同质的抗体获得的抗体,即,包含抗体的群的个体是相同的和/或结合相同的表位,除了可能的变体抗体外,所述变体抗体例如,包含天然存在的突变或在生产单克隆抗体制剂过程中产生,此类变体一般少量存在。与典型地包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂的各单克隆抗体针对抗原上的单一决定簇。因此,修饰语“单克隆”表示从基本上同质的抗体群获得的抗体的特征,而不应被解释为需要通过任何特定的方法生产抗体。例如,根据本发明使用的单克隆抗体可通过多种技术制备,包括但不限于杂交瘤方法、重组DNA方法、噬菌体展示方法和利用含有全部或部分人免疫球蛋白基因座的转基因动物的方法,这样的方法和用于制备单克隆抗体的其他示例性方法在本文中描述。
术语“可变区”或“可变结构域”指的是参与抗体结合抗原的抗体重链或轻链的结构域。天然抗体的重链和轻链的可变结构域(分别为VH和VL)通常具有类似的结构,其中每个结构域包含四个保守的框架区(FR)和三个高变区(HVR)。(参见,例如,Kindt,T.J.等人,Kuby Immunology,第6版,W.H.Freeman and Co.,N.Y.(2007),第91页)。单一的VH或VL结构域可足以赋予抗原结合特异性。此外,使用来自抗体的结合抗原的VH或VL结构域分别筛选互补的VL或VH结构域文库,可以分离结合特定抗原的抗体。见,例如,Portolano,S.等人,J.Immunol.150(1993)880-887;Clackson,T.等人,Nature 352(1991)624-628)。
如本文所用的术语“载体”,是指能够传播其连接的另一核酸的核酸分子。该术语包括作为自我复制的核酸结构的载体,以及整合到其已被导入的宿主细胞基因组中的载体。某些载体能够指导其有效连接的核酸的表达。此类载体在本文中称为“表达载体”。
发明详述
本文报告了基于限制性蛋白质水解消化和ESI-MS分析确定多特异性抗体制剂中轻链错配的方法。该方法可以被用于质量控制或细胞系选择。
业已发现,对于(多特异性)抗体的多特异性抗体限制性蛋白质水解中轻链错配的确定,必须在MS分析之前进行,因为完整多特异性抗体中轻链错配的确定被等压质量干扰(isobaric mass interference)阻碍。
因此,如本文中报告的一个方面是使用多特异性抗体的蛋白质水解酶的限制性消化分析多特异性抗体的轻链配对的用途。
在二价多特异性抗体中,即在二价双特异性抗体中,一个轻链错配的产品是可能的(参见图1)。
在本文报告的方法的一个示例性实施方案中,二价双特异性抗体的两个样本已经被纤溶酶(EC 3.4.21.7)消化。消化后在所有样本中没有出现未切割的完整抗体。在样本1中可检测到约20%的轻链错配抗体(见图3),而在第二样本中没有检测到轻链错配抗体(见图4)。
在如本文报告的方法的一个示例性实施方案中,二价双特异性抗体的样本已被Lys-C限制性消化。在样本中可检测到轻链错配抗体(见图5)。
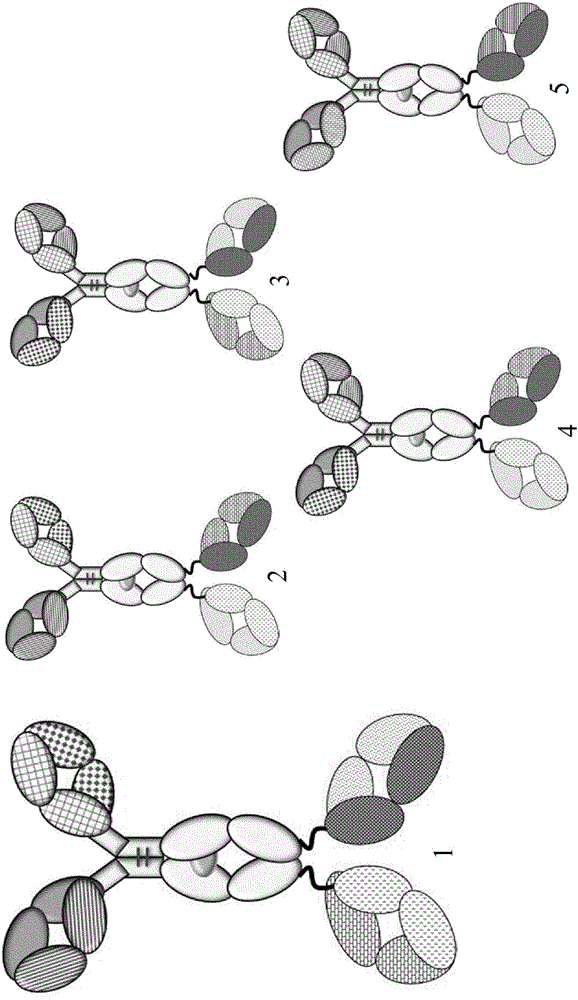
如果多于2条轻链存在时,例如在三价或四价多特异性抗体中,多于一条轻链的错配产品是可能的(参见图2)。在完整抗体的质谱分析中,只可能确定轻链错配产品的存在,但不是化学计量的,并且不能检测到潜在的错配方向(参见图6)。
对于这一任务,可以选择不同的蛋白质水解酶:
-Ides:在铰链区下方切割(不能用于具有L234A,L235A突变的抗体)
-纤溶酶:在铰链区上方切割
-胃蛋白酶:在铰链区下方切割;导致降解的Fc区
-Lys-C:在铰链区上方切割。
如本文报告的方法的一个示例性实施方案中,四价双特异性抗体的样本已被Lys-C限制性消化。
已经发现,对于四价多特异性抗体,来自轻链1和重链1片段形成的Fab区中的错配可以在0的ISCID得到更好地检测,而包含第二轻链的Fc区片段可以在90的ISCID得到更好地检测。
为了去除Fc区,可以使用蛋白A亲和色谱法以在酶消化后从Fc区分离Fab片段。Fab片段在蛋白A亲和色谱法的流动液(flow-through)中。
嵌合和人源化抗体
在某些实施方案中,用本文中报告的方法分析的抗体为嵌合抗体。某些嵌合抗体描述于,例如,US 4,816,567;和Morrison,S.L.等人,Proc.Natl.Acad.Sci.USA 81(1984)6851-6855)。在一个实施例中,嵌合抗体包括非人可变区(例如,来自小鼠,大鼠,仓鼠,兔子,或非人灵长类动物,如猴的可变区)和人恒定区。在进一步的实施例中,嵌合抗体是“种类转换”的抗体,其中种类或亚类已从亲代抗体改变。嵌合抗体包括其抗原结合片段。
在某些实施方案中,嵌合抗体是人源化抗体。通常情况下,非人抗体被人源化以降低对人的免疫原性,而保留亲代非人抗体的特异性和亲合性。通常,人源化抗体包含一个或多个可变结构域,其中HVR,例如,CDR(或其部分)来自非人抗体和FR(或其部分)来自人抗体序列。人源化抗体任选还将包含人恒定区的至少一部分。在一些实施方案中,人源化抗体中的一些FR残基被来自非人抗体(例如,HVR残基来源的抗体)的相应残基取代,例如,以恢复或改善抗体特异性或亲合性。
人源化抗体和制备其的方法的综述,例如,在Almagro,J.C.和Fransson,J.,Front.Biosci.13(2008)1619-1633中,还描述在,例如Riechmann,I.等人,Nature 332(1988)323-329;Queen,C.等人,Proc.Natl.Acad.Sci.USA 86(1989)10029-10033;US 5,821,337,US 7,527,791,US 6,982,321,和US 7,087,409;Kashmiri,S.V.等人,Methods 36(2005)25-34(描述了特异性决定区(SDR)接枝);Padlan,E.A.,Mol.Immunol.28(1991)489-498(描述了“表面重修(resurfacing)”);Dall’Acqua,W.F.等人,Methods 36(2005)43-60(描述了“FR改组(shuffling)”);和Osbourn,J.等人,Methods 36(2005)61-68和Klimka,A.等人,Br.J.Cancer 83(2000)252-260(描述了对FR改组的“指导选择”方法)。
可用于人源化的人框架区包括但不限于:使用“最佳拟合”方法选择的框架区(见,例如,Sims,M.J.等人,J.Immunol.151(1993)2296-2308;来自轻链或重链可变区特定亚组的人抗体的共有序列的框架区(见,例如,Carter,P.等人,Proc.Natl.Acad.Sci.USA 89(1992)4285-4289;和Presta,L.G.等人,J.Immunol.151(1993)2623-2632);人成熟(体细胞突变的)框架区或人种系框架区(见,例如,Almagro,J.C.和Fransson,J.,Front.Biosci.13(2008)1619-1633);和来自筛选的FR文库的框架区(参见,例如Baca,M.等人,J.Biol.Chem.272(1997)10678-10684和Rosok,M.J.等人,J.Biol.Chem.271(19969 22611-22618)。
人抗体
在某些实施方案中,如本文所报告的方法中分析的抗体是人抗体。可以使用本领域中已知的各种技术来生产人抗体。人抗体一般性地描述在van Dijk,M.A.和van de Winkel,J.G.,Curr.Opin.Pharmacol.5(2001)368-374和Lonberg,N.,Curr.Opin.Immunol.20(2008)450-459中。
可以通过向转基因动物施用免疫原来制备人抗体,所述转基因动物已被修饰以响应抗原挑战产生完整的人抗体或具有人可变区的完整的抗体。这些动物通常包含人免疫球蛋白基因座的全部或一部分,其取代内源性免疫球蛋白基因座,或存在于染色体外或随机地整合到动物的染色体。在这样的转基因小鼠中,内源性免疫球蛋白基因座已普遍被失活。用于从转基因动物获得人抗体的方法综述,参见Lonberg,N.,Nat.Biotech.23(2005)1117-1125。还参见,例如US 6,075,181和US 6,150,584,描述了XENOMOUSETM技术;US 5,770,429描述了技术;US 7,041,870描述了K-M技术,和US 2007/0061900描述了技术)。由这样的动物生成的完整抗体的人可变区可以被进一步修饰,例如,通过与不同人恒定区组合。
还可以通过基于杂交瘤的方法制备人抗体。已经描述了人骨髓瘤和小鼠-人杂合骨髓瘤细胞系用于生产人单克隆抗体(参见,例如,Kozbor,D.,J.Immunol.133(1984)3001-3005;Brodeur,B.R.等人,Monoclonal Antibody Production Techniques and Applications,Marcel Dekker,Inc.,New York(1987),第51-63页;和Boerner,P.等人,J.Immunol.147(1991)86-95)还在Li,J.等人,Proc.Natl.Acad.Sci.USA 103(2006)3557-3562中描述了通过人B细胞杂交瘤技术生成人抗体。其他方法包括描述于例如US 7,189,826(描述了由杂交瘤细胞系生产单克隆人IgM抗体)和Ni,J.,Xiandai Mianyixue 26(2006)265-268(描述了人-人杂交瘤)中的那些。人杂交瘤技术(Trioma技术)也描述于Vollmers,H.P.和Brandlein,S.,Histology和Histopathology 20(2005)927-937以及Vollmers,H.P.和Brandlein,S.,Methods and Findings in Experimental and Clinical Pharmacology 27(2005)185-191中。
还可以通过分离选自人源噬菌体展示文库的Fv克隆可变结构域序列来生成人抗体。这种可变结构域序列然后可以与所希望的人恒定结构域组合。用于从抗体文库选择人抗体的技术如下所述。
文库来源的抗体
可以通过筛选组合文库中具有所期望的一种或多种活性的抗体来分离如本文报告的方法中分析的抗体。例如,用于生成噬菌体展示文库和筛选这些文库中具有所期望的结合特征的抗体的各种方法是本领域中已知的。对这样的方法进行了综述,例如,在Hoogenboom,H.R.等人,Methods in Molecular Biology 178(2001)1-37中,进一步描述在例如McCafferty,J.等人,Nature 348(1990)552-554;Clackson,T.等人,Nature 352(1991)624-628;Marks,J.D.等人,J.Mol.Biol.222(1992)581-597;Marks,J.D.和Bradbury,A.,Methods in Molecular Biology 248(2003)161-175;Sidhu,S.S.等人,J.Mol.Biol.338(2004)299-310;Lee,C.V.等人,J.Mol.Biol.340(2004)1073-1093;Fellouse,F.A.,Proc.Natl.Acad.Sci.USA 101(2004)12467-12472;和Lee,C.V.等人,J.Immunol.Methods 284(2004)119-132中。
在某些噬菌体展示方法中,VH和VL基因组库(repertoire)分别通过聚合酶链反应(PCR)克隆,并在噬菌体文库中随机重组,然后可以如Winter,G.等人,Ann.Rev.Immunol.12(1994)433-455中描述的筛选其抗原结合的噬菌体。噬菌体通常展示抗体片段,或是作为单链Fv(scFv)片段或作为Fab片段。来自被免疫来源的文库提供对免疫原高亲合性的抗体,而无需构建杂交瘤。可选择地,可以(例如,从人)克隆天然组库以提供针对广泛的非自身抗原还有自身抗原的抗体单一来源,而没有任何免疫,如Griffiths,A.D.等人,EMBO J.12(1993)725-734所述。最后,还可以通过从干细胞克隆未重排的V基因区段、和使用包含编码高度可变CDR3区并在体外实现重排的随机序列的PCR引物来合成地制备天然文库,如Hoogenboom,H.R.和Winter,G.,J.Mol.Biol.227(1992)381-388所述。描述人抗体噬菌体文库的专利出版物包括,例如:US 5,750,373和US 2005/0079574,US 2005/0119455,US 2005/0266000,US 2007/0117126,US 2007/0160598,US 2007/0237764,US 2007/0292936和US 2009/0002360。
从人抗体文库分离的抗体或抗体片段在本文中被认为是人抗体或人抗体片段。
多特异性抗体
工程化的蛋白质,如能够结合两种或更多种抗原的双特异性或多特异性抗体在本领域中是公知的。这样的多特异性结合蛋白质可以使用细胞融合、化学缀合、或重组DNA技术生成。
在某些实施方案中,如本文报告的方法中分析的抗体是多特异性抗体,例如至少是双特异性抗体。多特异性抗体是对至少两个不同位点具有结合特异性的单克隆抗体。多特异性抗体可以作为全长抗体来制备。
用于制备多特异性抗体的技术包括但不限于具有不同特异性的两个免疫球蛋白重链-轻链对的重组共表达(见Milstein,C.和Cuello,A.C.,Nature 305(1983)537-540,WO 93/08829,和Traunecker,A.等人,EMBO J.10(1991)3655-3659),和“杵臼(knob-in-hole)”工程化(见,例如,US 5,731,168)。多特异性抗体还可以通过如下制备:用于制备抗体Fc-异二聚体分子的工程化静电转向效果(WO 2009/089004);交联两个或更多个抗体或片段(参见,例如,US 4,676,980,和Brennan,M.等人,Science 229(1985)81-83);使用亮氨酸拉链产生双特异性抗体(见,例如,Kostelny,S.A.等人,J.Immunol.148(1992)1547-1553;使用“双抗体(diabody)”技术制备双特异性抗体片段(见,例如,Holliger,P.等人,Proc.Natl.Acad.Sci.USA 90(1993)6444-6448);和使用单链Fv(sFv)二聚体(见,例如Gruber,M等人,J.Immunol.152(1994)5368-5374);和制备三特异性抗体,如,例如,Tutt,A.等人,J.Immunol.147(1991)60-69)中所述。
具有三个或更多个功能性抗原结合位点的工程化抗体,包括“章鱼抗体”也包括在本文中(参见,例如US2006/0025576)。
本文中的抗体或片段还包括“双作用Fab”或“DAF”,其包含结合[[PRO]]以及另一不同抗原的抗原结合位点(参见,例如US2008/0069820)。
本文中的抗体或片段还包括在以下所述的多特异性抗体:WO 2009/080251,WO 2009/080252,WO 2009/080253,WO 2009/080254,WO 2010/112193,WO 2010/115589,WO 2010/136172,WO 2010/145792和WO 2010/145793。
在过去的近段时间已经开发了各种各样的重组多特异性抗体形式,例如通过融合例如IgG抗体形式和单链结构域的四价双特异性抗体(见例如Coloma,M.J.,等人,Nature Biotech.15(1997)159-163;WO 2001/077342;和Morrison,S.L.,Nature Biotech.25(2007)1233-1234。
还有已开发了其他一些新的形式,其中抗体核心结构(IgA,IgD,IgE,IgG或IgM)不再保留如dia-、tria-或tetrabodies、微型抗体、一些单链形式(scFv,Bis-scFv),其都能够结合两种或更多种抗原,(Holliger,P.,等人,Nature Biotech.23(2005)1126-1136;Fischer,N.,和Léger,O.,Pathobiology 74(2007)3-14;Shen,J.,等人,J.Immunol.Methods 318(2007)65-74;Wu,C.,等人,Nature Biotech.25(2007)1290-1297)。
所有这样的形式使用接头融合抗体核心(IgA,IgD,IgE,IgG或IgM)和进一步的结合蛋白(例如scFv),或者使用接头融合例如两个Fab片段或scFv(Fischer,N.和Léger,O.,Pathobiology 74(2007)3-14)。虽然很明显,接头具有用于工程化多特异性抗体的优点,其也可能会导致在治疗设置上的问题。事实上,这些外来肽可能引发针对接头本身或蛋白和接头之间连接处的免疫应答。此外,这些肽的柔性性质使得其更容易被蛋白水解裂解,潜在地导致抗体稳定性差、聚集和增加的免疫原性。此外人们可能希望通过保持与天然存在的抗体的高度相似性保留通过Fc部分介导的效应子功能,如,例如补体依赖性细胞毒性(CDC)或抗体依赖性细胞毒性(ADCC)。
因此,理想情况下,应着眼于开发在总体结构上与天然存在的抗体(如IGA,IgD,IgE,IgG或IgM)非常相似的多特异性抗体,与人序列具有最小的偏差。
在一种方法中,使用quadroma技术已经生产了与天然抗体非常相似的双特异性抗体(参见Milstein,C.和Cuello,A.C.,Nature 305(1983)537-540),其基于表达具有期望的双特异性抗体的特异性的鼠单克隆抗体的两种不同杂交瘤细胞系的体细胞融合。由于在所得杂合杂交瘤(或quadroma)细胞系内两个不同的抗体重链和轻链的随机配对,最多生成十种不同的抗体种类,其中只有一种是期望的,功能性双特异性抗体。由于存在错配的副产物以及显著降低的生产产量,需要复杂的纯化步骤(例如参见Morrison,S.L.,Nature Biotech.25(2007)1233-1234)。一般地如果使用重组表达技术,仍然保留了相同的错配副产物的问题。
规避错配副产物问题的方法,被称为“knobs-into-holes”,目的是通过将突变引入CH3结构域修饰接触界面,迫使两个不同的抗体重链配对。在一条链上,体积庞大的氨基酸被具有短侧链的氨基酸取代,形成“臼”。相反,具有大侧链的氨基酸被引入到其他CH3结构域,形成“杵”。通过共表达这两条重链(和两条相同的轻链,其必须适合于两条重链),观察到高产率的异源二聚体形式(“杵-臼”)对(versus)同源二聚体形式(“臼-臼”或“杵-杵”)(Ridgway,J.B.,等人,Protein Eng.9(1996)617-621;和WO 96/027011)。通过使用噬菌体展示方法以及引入二硫键来稳定异源二聚体、重塑两个CH3结构域的相互作用表面,可进一步增加异源二聚体的百分比(Merchant,A.M.,等人,Nature Biotech.16(1998)677-681;Atwell,S.,等人,J.Mol.Biol.270(1997)26–35)。对于knobs-into-holes技术的新方法描述在例如EP 1 870 459A1中。虽然这种形式似乎非常有吸引力,但是目前没有可获得的描述向临床进展的数据。这种策略的一个重要的限制是两个亲本抗体的轻链必须相同,以防止错配和形成无活性的分子。因此,该技术不适合作为从针对第一和第二抗原的两种抗体起始容易地开发重组的、针对三个或四个抗原的三或四特异性抗体的基础,因为必须首先优化这些抗体的重链和/或相同的轻链,然后必须进一步加入针对第三和第四抗原的抗原结合肽。
WO 2006/093794涉及异源二聚体蛋白结合组合物。WO99/37791描述了多用途抗体衍生物。Morrison,S.L.,等人,J.Immunol.160(1998)2802-2808涉及可变区结构域交换对IgG功能性质的影响。
WO 2013/02362涉及异源二聚体多肽。WO2013/12733涉及包含异源二聚体Fc区的多肽。WO2012/131555涉及工程化的异源二聚体免疫球蛋白。EP 2647707涉及工程化的异源二聚体免疫球蛋白。
WO 2013/026835涉及具有结构域交叉的双特异性、无Fc抗体。WO 2009/080251、WO 2009/080252、WO 2009/080253、WO 2009/080254和Schaefer,W.等人,PNAS,108(2011)11187-1191涉及具有结构域交叉的二价、双特异性IgG抗体。
在WO2009/080252(还见Schaefer,W.等人,PNAS,108(2011)11187-1191)中描述的为了防止轻链错配(CrossMabVH-VL)而在一个结合中具有VH/VL取代/交换的多特异性抗体,明显地减少由针对第一抗原的轻链和针对第二抗原的错的重链错配引起的副产物(与没有这样的结构域交换方法相比)。然而,其制剂不是完全没有副产物。主要副产物基于Bence-Jones型相互作用(又见Schaefer,W.等人,PNAS,108(2011)11187-1191;在增补的图S1I中)。
双特异性抗体
在一个实施方案中多特异性抗体是双特异性抗体。
如本文所报告的一个方面是二价、双特异性抗体,其包含
a)特异性结合第一抗原的抗体的第一轻链和第一重链,和
b)特异性结合第二抗原的抗体的第二轻链和第二重链,其中第二轻链和第二重链的可变结构域VL和VH相互取代,
其中第一和第二抗原是不同的抗原。
a)中的抗体不包含如b)所报告的修饰,a)中的重链和轻链是分离的链。
在b)的抗体中
在轻链内
可变轻链结构域VL被所述抗体的可变重链结构域VH取代,
和
在重链内
可变重链结构域VH被所述抗体的可变轻链结构域VL取代。
在一个实施方案中
i)在a)的第一轻链的恒定结构域CL中,第124位氨基酸(根据Kabat编号)被带正电的氨基酸取代,和其中在a)的第一重链的恒定结构域CH1中,第147位氨基酸或第213位氨基酸(根据Kabat EU索引编号)被带负电的氨基酸取代,
或者
ii)在b)的第二轻链的恒定结构域CL中,第124位氨基酸(根据Kabat编号)被带正电的氨基酸取代,和其中在b)的第二重链的恒定结构域CH1中,第147位氨基酸或第213位氨基酸(根据Kabat EU索引编号)被带负电的氨基酸取代。
在一个优选的实施方案中
i)在a)的第一轻链的恒定结构域CL中,第124位氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)取代(根据Kabat编号)(在一个优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R)取代),和其中在a)的第一重链的恒定结构域CH1中,第147位氨基酸或第213位氨基酸独立地被谷氨酸(E)或天冬氨酸(D)取代(根据Kabat EU索引编号),
或者
ii)在b)的第二轻链的恒定结构域CL中,第124位氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)取代(根据Kabat编号)(在一个优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R)取代),和其中在b)的第二重链的恒定结构域CH1中,第147位氨基酸或第213位氨基酸独立地被谷氨酸(E)或天冬氨酸(D)取代(根据Kabat EU索引编号)。
在一个实施方案中,在第二重链的恒定结构域CL中,第124位和123位氨基酸被K取代(根据Kabat EU索引编号)。
在一个实施方案中,在第二轻链的恒定结构域CH1中,第147位和213位氨基酸被E取代(根据Kabat EU索引编号)。
在一个优选的实施方案中,在第一轻链的恒定结构域CL中,第124位和123位的氨基酸被K取代,和在第一重链的恒定结构域CH1中,第147位和213位的氨基酸被E取代(根据Kabat EU索引编号)。
在一个实施方案中,在第二重链的恒定结构域CL中,第124位和123位的氨基酸被K取代,和其中在第二轻链的恒定结构域CH1中,第147位和213位氨基酸被E取代,和在第一轻链的可变结构域VL中,第38位的氨基酸被K取代,在第一重链的可变结构域VH中,第39位的氨基酸被E取代,在第二重链的可变结构域VL中,第38位的氨基酸被K取代,和在第二轻链的可变结构域VH中,第39位的氨基酸被E取代(根据Kabat EU索引编号)。
如本文所报告的一个方面是二价、双特异性抗体,其包含
a)特异性结合第一抗原的抗体的第一轻链和第一重链,和
b)特异性结合第二抗原的抗体的第二轻链和第二重链,其中第二轻链和第二重链的可变结构域VL和VH相互取代,和其中第二轻链和第二重链的恒定结构域CL和CH1相互取代,
其中第一和第二抗原是不同的抗原。
a)中的抗体不包含如b)所报告的修饰,a)中的重链和轻链是分离的链。
在b)的抗体中
在轻链内
可变轻链结构域VL被所述抗体的可变重链结构域VH取代,恒定轻链结构域CL被所述抗体的恒定重链结构域CH1取代;
和
在重链内
可变重链结构域VH被所述抗体的可变轻链结构域VL取代,恒定重链结构域CH1被所述抗体的恒定轻链结构域CL取代。
如本文所报告的一个方面是二价、双特异性抗体,其包含
a)特异性结合第一抗原的抗体的第一轻链和第一重链,和
b)特异性结合第二抗原的抗体的第二轻链和第二重链,其中第二轻链和第二重链的恒定结构域CL和CH1相互取代,
其中第一和第二抗原是不同的抗原。
a)中的抗体不包含如b)所报告的修饰,a)中的重链和轻链是分离的链。
在b)的抗体中
在轻链内
恒定轻链结构域CL被所述抗体的恒定重链结构域CH1取代;
和
在重链内
恒定重链结构域CH1被所述抗体的恒定轻链结构域CL取代。
如本文所报告的一个方面是一种多特异性抗体,其包含
a)特异性结合第一抗原的全长抗体,其由两条抗体重链和两条抗体轻链组成,和
b)特异性结合一至四个其他抗原(即第二和/或第三和/或第四和/或第五抗原,优选特异性结合一个其他抗原,即第二抗原)的一、二、三或四个单链Fab片段,
其中在b)中所述的单链Fab片段通过在所述全长抗体的重链或轻链的C-或N-端的肽接头融合至a)中的所述全长抗体,
其中第一和第二抗原是不同抗原。
在一个实施方案中,结合第二抗原的一个或两个相同的单链Fab片段通过在所述全长抗体的重链或轻链的C-端的肽接头融合至所述全长抗体。
在一个实施方案中,结合第二抗原的一个或两个相同的单链Fab片段通过在所述全长抗体的重链的C-端的肽接头融合至所述全长抗体。
在一个实施方案中,结合第二抗原的一个或两个相同的单链Fab片段通过在所述全长抗体的轻链的C-端的肽接头融合至所述全长抗体。
在一个实施方案中,结合第二抗原的两个相同的单链Fab片段通过在所述全长抗体的每条重链或轻链的C-端的肽接头融合至所述全长抗体。
在一个实施方案中,结合第二抗原的两个相同的单链Fab片段通过在所述全长抗体的每条重链的C-端的肽接头融合至所述全长抗体。
在一个实施方案中,结合第二抗原的两个相同的单链Fab片段通过在所述全长抗体的每条轻链的C-端的肽接头融合至所述全长抗体。
如本文所报告的一个方面是三价、双特异性抗体,其包含
a)特异性结合第一抗原的全长抗体,其由两条抗体重链和两条抗体轻链组成,
b)第一多肽,其由以下组成
ba)抗体重链可变结构域(VH),
或者
bb)抗体重链可变结构域(VH)和抗体恒定结构域1(CH1),
其中所述第一多肽通过所述全长抗体的两条重链之一的C-端的肽接头与其VH结构域的N-端融合,
c)第二多肽由以下组成
ca)抗体轻链可变结构域(VL),
或者
cb)抗体轻链可变结构域(VL)和抗体轻链恒定结构域(CL),
其中所述第二多肽通过所述全长抗体的两条重链的另一条的C-端的肽接头与VL结构域的N-端融合,
和
其中第一多肽的抗体重链可变结构域(VH)和第二多肽的抗体轻链可变结构域(VL)一起形成特异性结合第二抗原的抗原结合位点,
和
其中第一和第二抗原是不同的抗原。
在一个实施方案中,b)中多肽的抗体重链可变结构域(VH)和c)中多肽的抗体轻链可变结构域(VL)通过在以下位置之间引入二硫键的链间二硫键桥相连接和稳定:
i)重链可变结构域第44位至轻链可变结构域第100位,或
ii)重链可变结构域第105位至轻链可变结构域第43位,或
iii)重链可变结构域第101位至轻链可变结构域第100位(通常根据Kabat EU索引编号)。
引入非天然二硫键桥用于稳定的技术描述在例如WO 94/029350,Rajagopal,V.,等人,Prot.Eng.(1997)1453-59;Kobayashi,H.,等人,Nuclear Medicine&Biology,Vol.25,(1998)387-393;或Schmidt,M.,等人,Oncogene(1999)181711-1721。在一个实施方案中b)和c)中多肽的可变结构域之间的任选二硫键在重链可变结构域第44位和轻链可变结构域第100位之间。在一个实施方案中b)和c)中多肽的可变结构域之间的任选二硫键在重链可变结构域第105位和轻链可变结构域第43位之间(通常根据Kabat EU索引编号)。在一个实施方案中,优选三价、双特异性抗体在单链Fab片段的可变结构域VH和VL之间无所述任选的二硫键稳定结构。
如本文所报告的一个方面是一种三特异性或四特异性抗体,其包含
a)特异性结合第一抗原的全长抗体的第一轻链和第一重链,和
b)特异性结合第二抗原的全长抗体的第二(经修饰)轻链和第二(经修饰)重链,其中可变结构域VL和VH相互取代,和/或其中恒定结构域CL和CH1相互取代,和
c)其中特异性结合一个或两个其他抗原(即第三和/或第四抗原)的一至四个抗原结合肽通过肽接头融合至a)和/或b)的轻链或重链的C-或N-端,
其中第一和第二抗原是不同的抗原。
a)中的抗体不包含如b)中所报告的修饰,和a)中的重链和轻链是分离的链。
在一个实施方案中,三特异性或四特异性抗体包含c)中的一个或两个特异性结合一个或两个其他抗原的抗原结合肽。
在一个实施方案中,抗原结合肽选自scFv片段和scFab片段。
在一个实施方案中,抗原结合肽是scFv片段。
在一个实施方案中,抗原结合肽是scFab片段。
在一个实施方案中,抗原结合肽融合至a)和/或b)的重链的C-端。
在一个实施方案中,三特异性或四特异性抗体包含c)中的一个或两个特异性结合一个其他抗原的抗原结合肽。
在一个实施方案中,三特异性或四特异性抗体包含c)中的特异性结合第三抗原的两个相同的抗原结合肽。在一个优选的实施方案中,这样的两个相同的抗原结合肽都通过相同的肽接头融合至a)和b)的重链的C-端。在一个优选的实施方案中,两个相同的抗原结合肽是scFv片段或scFab片段。
在一个实施方案中,三特异性或四特异性抗体包含c)中的特异性结合第三和第四抗原的两个抗原结合肽。在一个实施方案中,所述两个抗原结合肽都通过相同的肽连接子融合至a)和b)的重链的C-端。在一个优选的实施方案中,所述两个抗原结合肽是scFv片段或scFab片段。
如本文所报告的一个方面是双特异性、四价抗体,其包含
a)特异性结合第一抗原的抗体的两条轻链和两个重链(和包含两个Fab片段),
b)特异性结合第二抗原的抗体的两个额外的Fab片段,其中所述额外的Fab片段都通过肽接头融合至a)的重链的C-或N端,
和
其中,在Fab片段中进行了以下的修饰
i)在a)的两个Fab片段中,或在b)的两个Fab片段中,可变结构域VL和VH相互取代,和/或恒定结构域CL和CH1相互取代,
或
ii)在a)的两个Fab片段中可变结构域VL和VH相互取代,和恒定结构域CL和CH1相互取代,
和
在b)的两个Fab片段中可变结构域VL和VH相互取代,或恒定结构域CL和CH1相互取代,
或
iii)在a)的两个Fab片段中可变结构域VL和VH相互取代,或恒定结构域CL和CH1相互取代,
和
在b)的两个Fab片段中可变结构域VL和VH相互取代,和恒定结构域CL和CH1相互取代,
或
ⅳ)在a)的两个Fab片段中可变结构域VL和VH相互取代,和在b)的两个Fab片段中恒定结构域CL和CH1相互取代,
或
v)在a)的两个Fab片段中恒定结构域CL和CH1相互取代,和在b)的两个Fab片段中可变结构域VL和VH相互取代,
其中第一和第二抗原是不同的抗原。
在一个实施方案中,所述额外的Fab片段都通过肽接头融合至a)的重链的C-端,或融合至a)的重链的N-端。
在一个实施方案中,所述额外的Fab片段都通过肽接头融合至a)的重链的C-端。
在一个实施方案中,所述额外的Fab片段都通过肽连接子融合至a)的重链的N-端。
在一个实施方案中,在Fab片段中进行以下的修饰:
i)在a)的两个Fab片段中,或b)的两个Fab片段中,可变结构域VL和VH相互取代,
和/或
恒定结构域CL和CH1相互取代。
在一个实施方案中,在Fab片段中进行以下的修饰:
i)在a)的两个Fab片段中,可变结构域VL和VH相互取代,
和/或
恒定结构域CL和CH1相互取代。
在一个实施方案中,在Fab片段中进行以下的修饰:
i)在a)的两个Fab片段中恒定结构域CL和CH1相互取代。
在一个实施方案中,在Fab片段中进行以下的修饰:
i)在b)的两个Fab片段中可变结构域VL和VH相互取代,
和/或
恒定结构域CL和CH1相互取代。
在一个实施方案中,在Fab片段中进行以下的修饰:
i)在b)的两个Fab片段中恒定结构域CL和CH1相互取代。
如本文所报告的一个方面是一种双特异性、四价抗体,其包含:
a)特异性结合第一抗原的第一抗体的(经修饰)的重链,其包含第一VH-CH1结构域对,其中所述第一抗体的第二VH-CH1结构域对的N-端通过肽接头融合至所述重链的C-端,
b)所述a)的第一抗体的两条轻链,
c)特异性结合第二抗原的第二抗体的(经修饰)的重链,其包含第一VH-CL结构域对,其中所述第二抗体的第二VH-CH1结构域对的N-端通过肽接头融合至所述重链的C-端,和
d)所述c)的第二抗体的两条(经修饰)的轻链,每条包含CL-CH1结构域对,
其中第一和第二抗原是不同的抗原。
如本文所报告的一个方面是双特异性抗体,其包含
a)特异性结合第一抗原的第一全长抗体的重链和轻链,和
b)特异性结合第二抗原的第二全长抗体的重链和轻链,其中重链的N-端通过肽接头连接到轻链的C-端,
其中第一和第二抗原是不同的。
a)中的抗体不包含如b)报告的修改,和重链和轻链是分离的链。
如本文所报告的一个方面是双特异性抗体,其包含
a)特异性结合第一抗原的全长抗体,其由两条抗体重链和两条抗体轻链组成,和
b)特异性结合第二抗原的Fv片段,其包含VH2结构域和VL2结构域,其中两个结构域通过二硫键桥相互连接,
其中只有VH2结构域或VL2结构域通过肽接头融合至特异性结合第一抗原的全长抗体的重链或轻链,
其中第一和第二抗原是不同的抗原。
在双特异性(抗体)中a)中的重链和轻链是分离的链。
在一个实施方案中,VH2结构域或VL2结构域的另一个不通过肽接头融合至特异性结合第一抗原的全长抗体的重链或轻链。
在如本文所报告的所有方面,第一轻链包含VL结构域和CL结构域,第一重链包含VH结构域、CH1结构域、铰链区、CH2结构域和CH3结构域。
在所有方面的一个实施方案中,如本文报告的抗体是多特异性抗体,其需要至少两条重链多肽的异源二聚化。
已经描述了一些为支持异源二聚化的CH 3修饰的方法,例如在WO 96/27011,WO 98/050431,EP 1870459,WO 2007/110205,WO 2007/147901,WO 2009/089004,WO 2010/129304,WO 2011/90754,WO 2011/143545,WO 2012/058768,WO 2013/157954,WO 2013/096291中,其在此作为参考并入本文。通常,在本领域已知的方法中,第一重链的CH3结构域和第二重链的CH3结构域均以互补的方式工程化,使得含有一个工程化的CH3结构域的重链不再与另一相同结构的重链同源二聚化(例如CH3工程化的第一重链不再与另一CH3工程化的第一重链同源二聚化;和CH3工程化的第二重链不再与另一CH3工程化的第二重链同源二聚化)。从而包含一个工程化的CH3结构域的重链被强制与另一包含以互补方式工程化的CH3结构域的重链异源二聚化。对于本发明的这个实施方案,第一重链的CH3结构域和第二重链的CH3结构域通过氨基酸取代以互补方式工程化,使得第一重链和第二重链被强制异源二聚化,而第一重链和第二重链可以不再同源二聚化(例如由于位阻的原因)。
用于支持本领域中已知的重链异源二聚化的不同方法(以上引用和包括的),预期为根据本发明的多特异性抗体中使用的不同替代,其包括源自特异性结合第一抗原的第一抗体的“非交叉Fab区”,和源自特异性结合第二抗原的第二抗体的“交叉Fab区”,组合上述的用于本发明的特定氨基酸取代。
如本文所报告的多特异性抗体的CH3结构域可通过“杵臼”技术改变,该技术和一些实例详细描述于例如WO 96/027011,Ridgway,J.B.,等人,Protein Eng.9(1996)617-621;和Merchant,A.M.,等人,Nat.Biotechnol.16(1998)677-681。在该方法中改变两个CH3结构域的相互作用表面以增加含有这两种CH3结构域的两条重链的异源二聚化。(两条重链的)两个CH3结构域的每个可以是“杵”,而另一个是“臼”。二硫键桥的引入进一步稳定异源二聚体(Merchant,A.M.,等人,Nature Biotech.16(1998)677-681;Atwell,S.,等人,J.Mol.Biol.270(1997)26-35),以及增加了产量。
在一个优选的实施方案中,如本文所报告的多特异性抗体包含在“杵链”的CH3结构域中的T366W突变和在“臼链”的CH3结构域中的T366S,L368A,Y407V突变(根据Kabat EU索引编号)。也可使用CH3结构域之间的额外的链间二硫键桥(Merchant,A.M.,等人,Nature Biotech.16(1998)677-681),例如通过将Y349C突变引入“杵链”的CH3结构域和将E356C突变或S354C突变引入“臼链”的CH3结构域。因此,在另一个优选的实施方案中,如本文所报告的多特异性抗体包含在两个CH3结构域之一中的Y349C和T366W突变和在两个CH3结构域的另一个中的E356C,T366S,L368A和Y407V突变,或如本文所报告的多特异性抗体包含在两个CH3结构域之一中的Y349C和T366W突变和在两个CH3结构域的另一个中的S354C,T366S,L368A和Y407V突变(在一个CH3结构域中的额外Y349C突变和在另一个CH3结构域中的额外E356C或S354C突变形成链间二硫键桥)(根据Kabat EU索引编号)。
但是还可以替代地或额外地使用由EP 1870459A1描述的其他杵-臼技术。在一个实施方案中如本文所报告的多特异性抗体包含在“杵链”的CH3结构域中的R409D和K370E突变和在“臼链”的CH3结构域中的D399K和E357K突变(根据Kabat EU索引编号)。
在一个实施方案中如本文所报告的多特异性抗体包含在“杵链”的CH3结构域中的T366W突变和在“臼链”的CH3结构域中的T366S,L368A和Y407V突变,以及额外地在“杵链”的CH3结构域中的R409D和K370E突变和在“臼链”的CH3结构域中的D399K和E357K突变(根据Kabat EU索引编号)。
在一个实施方案中,如本文所报告的多特异性抗体包含在两个CH3结构域之一中的Y349C和T366W突变和在两个CH3结构域的另一个中的S354C,T366S,L368A和Y407V突变,或如本文所报告的多特异性抗体包含在两个CH3结构域之一中的Y349C和T366W突变和在两个CH3结构域的另一个中的S354C,T366S,L368A和Y407V突变和额外地在“杵链”的CH3结构域中的R409D和K370E突变和在“臼链”的CH3结构域中的D399K和E357K突变(根据Kabat EU索引编号)。
除了“杵-臼技术”,用于修饰多特异性抗体重链的CH3结构域以增强异源二聚化的其他技术在本领域中是公知的。这些技术,尤其是在WO 96/27011,WO 98/050431,EP 1870459,WO 2007/110205,WO 2007/147901,WO 2009/089004,WO 2010/129304,WO 2011/90754,WO 2011/143545,WO 2012/058768,WO 2013/157954和WO 2013/096291中描述的那些,在此预期为“杵-臼技术”的替代与如本文所报告的多特异性抗体组合。
在如本文所报告的多特异性抗体的一个实施方案中,在EP 1870459中描述的方法被用于支持多特异性抗体的第一重链和第二重链的异源二聚化。这种方法基于将具有相反电荷的带电氨基酸引入第一和第二重链二者之间的CH3/CH3-结构域界面中的特定氨基酸位置。
因此,本实施方案涉及如本文所报告的多特异性抗体,其中在抗体的三级结构中第一重链的CH3结构域和第二重链的CH3结构域形成位于各抗体CH3结构域之间的界面,其中第一重链的CH3结构域和第二重链的CH3结构域的各自的氨基酸序列包括在抗体的三级结构中位于所述界面的一组氨基酸,其中从位于一条重链的CH3结构域的界面中的氨基酸组中,将第一氨基酸用带正电的氨基酸取代,和从位于另一条重链的CH3结构域的界面中的氨基酸组中,将第二氨基酸用带负电的氨基酸取代。根据本实施方案的多特异性抗体在本文也称为“CH3(+/-)-工程化的多特异性抗体”(其中缩写“+/-”表示在各CH3结构域中引入的带相反电荷的氨基酸)。
在如本文所报告的所述CH3(+/-)-工程化的多特异性抗体的一个实施方案中,带正电的氨基酸选自K、R和H,带负电的氨基酸选自E或D。
在如本文所报告的所述CH3(+/-)-工程化的多特异性抗体的一个实施方案中,带正电的氨基酸选自K和R,带负电的氨基酸选自E或D。
在如本文所报告的所述CH3(+/-)-工程化的多特异性抗体的一个实施方案中,带正电的氨基酸是K,带负电的氨基酸选自是E。
在如本文所报告的所述CH3(+/-)-工程化的多特异性抗体的一个实施方案中,在一条重链的CH3结构域中第409位的氨基酸R被D取代和第位的氨基酸K被E取代,在另一条重链的CH3结构域中第399位的氨基酸D被K取代和第357位的氨基酸E被K取代(根据Kabat EU索引编号)。
在如本文所报告的多特异性抗体的一个实施方案中,使用WO2013/157953中描述的方法支持多特异性抗体的第一重链和第二重链的异源二聚化。在如本文所报告的所述多特异性抗体的一个实施方案中,在一条重链的CH3结构域中第366位的氨基酸T被K取代,在另一条重链的CH3结构域中第351位的氨基酸L被D取代(根据Kabat EU索引编号)。在如本文报告的所述多特异性抗体的另一实施方案中,在一条重链的CH3结构域中第366位的氨基酸T被K取代,第351位的氨基酸L被K取代,在另一条重链的CH3结构域中第351位的氨基酸L被D取代(根据Kabat EU索引编号)。
在如本文所报告的所述多特异性抗体的另一实施方案中,在一条重链的CH3结构域中第366位的氨基酸T被K取代和第351位的氨基酸L被K取代,在另一条重链的CH3结构域中第351位的氨基酸L被D取代(根据Kabat EU索引编号)。另外以下取代中的至少一个包括在另一条重链的CH3结构域中:第349位氨基酸Y被E取代,第349位氨基酸Y被D取代和第368位氨基酸L被E取代(根据Kabat EU索引编号)。在一个实施方案中,第368位氨基酸L被E取代(根据Kabat EU索引编号)。
在如本文所报告的多特异性抗体的一个实施方案中,使用WO2012/058768中描述的方法支持多特异性抗体的第一重链和第二重链的异源二聚化。在如本文所报告的所述多特异性抗体的一个实施方案中,在一条重链的CH3结构域中第351位的氨基酸L被Y取代和第407位的氨基酸Y被A取代,在另一条重链的CH3结构域中第366位的氨基酸T被A取代和第409位的氨基酸K被F取代(根据Kabat EU索引编号)。在另一个实施方案中,除了以上所述的取代,在一条重链的CH3结构域中至少一个以下位置的氨基酸被取代:第411位(原来为T)、第399位(原来为D)、第400位(原来为S)、第405位(原来为F)、第390位(原来为N)和第392位(原来为K)(根据Kabat EU索引编号)。优选的取代为:
-由选自N,R,Q,K,D,E和W的氨基酸取代第411位的氨基酸T(根据Kabat EU索引编号),
-由选自R,W,Y和K的氨基酸取代第399位的氨基酸D(根据Kabat EU索引编号),
-由选自E,D,R和K的氨基酸取代第400位的氨基酸S(根据Kabat EU索引编号),
-由选自I,M,T,S,V和W的氨基酸取代第405位的氨基酸F(根据Kabat的EU索引编号);
-由选自R,K和D的氨基酸取代第390位的氨基酸N(根据Kabat EU索引编号);和
-由选自V,M,R,L,F和E的氨基酸取代第392位的氨基酸K(根据Kabat EU索引编号)。
在如本文报告的所述多特异性抗体的另一个实施方案中(根据WO2012/058768工程化),在一条重链的CH3结构域中第351位的氨基酸L被Y取代和第407位的氨基酸Y被A取代,在另一条重链的CH3结构域中第366位的氨基酸T被V取代和第409位的氨基酸K被F取代(根据Kabat EU索引编号)。在如本文所报告的所述多特异性抗体的另一实施方案中,在一条重链的CH3结构域中第407位的氨基酸Y被A取代,在另一条重链的CH3结构域中第366位的氨基酸T被A取代和第409位的氨基酸K被F取代(根据Kabat EU索引编号)。在所述的上述实施方案中,在所述另一条重链的CH3结构域中第392位的氨基酸K被E取代,第411位的氨基酸T被E取代,第399位的氨基酸D被R取代和第400位的氨基酸S被R取代(根据Kabat EU索引编号)。
在如本文所报告的多特异性抗体的一个实施方案中,使用WO 2011/143545中描述的方法支持多特异性抗体的第一重链和第二重链的异源二聚化。在如本文所报告的所述多特异性抗体的一个实施方案中,在两条重链的CH3结构域中的氨基酸修饰在第368和/或409位引入(根据Kabat EU索引编号)。
在如本文所报告的多特异性抗体的一个实施方案中,使用WO 2011/090762中描述的方法支持多特异性抗体的第一重链和第二重链的异源二聚化。WO 2011/090762涉及根据“杵臼”技术的氨基酸修饰。在如本文所报告的所述CH3(KiH)-工程化的多特异性抗体的一个实施方案中,在一条重链的CH3结构域中第366位的氨基酸T被W取代,在另一条重链的CH3结构域中第407位的氨基酸Y被A取代(根据Kabat EU索引编号)。在如本文所报告的所述CH3(KiH)-工程化的多特异性抗体的另一个实施方案中,在一条重链的CH3结构域中第366位的氨基酸T被Y取代,在另一条重链的CH3结构域中第407位的氨基酸Y被T取代(根据Kabat EU索引编号)。
在如本文所报告的多特异性抗体(其是IgG2同种型)的一个实施方案中,使用在WO 2011/090762中描述的方法支持多特异性抗体的第一重链和第二重链的异源二聚化。
在如本文所报告的多特异性抗体的一个实施方案中,使用WO 2009/089004中描述的方法支持多特异性抗体的第一重链和第二重链的异源二聚化。在如本文报告的所述多特异性抗体的一个实施方案中,在一条重链的CH3结构域中第392位的氨基酸K或N被带负电的氨基酸取代(在一个优选的实施方案中被E或D取代,在一个优选的实施方案中被D取代),在另一条重链的CH3结构域中第399位的氨基酸D第356位的氨基酸E或D或第357位的氨基酸E被带正电的氨基酸取代(在一个优选的实施方案中被K或R取代,在一个优选实施方案中被K取代,在一个优选的实施方案中第399或356位的氨基酸被K取代)(根据Kabat EU索引编号)。在一个进一步的实施方案中,除了上述取代,在一条重链的CH3结构域中第409位的氨基酸K或R被带负电的氨基酸取代(在一个优选的实施方案中被E或D取代,在一个优选的实施方案中被D取代)(根据Kabat EU索引编号)。在一个更进一步的实施方案中,除了或替代上述取代,在一条重链的CH3结构域中第439位的氨基酸K和/或第370位的氨基酸K彼此独立地被带负电的氨基酸取代(在一个优选的实施方案中被E或D取代,在一个优选的实施方案中被D取代)(根据Kabat EU索引编号)。
在如本文所报告的多特异性抗体的一个实施方案中,使用WO 2007/147901中描述的方法支持多特异性抗体的第一重链和第二重链的异源二聚化。在如本文报告的所述多特异性抗体的一个实施方案中,在一条重链的CH3结构域中第253位的氨基酸K被E取代、第282位的氨基酸D被K取代和第322位的氨基酸K被D取代,在另一条重链的CH3结构域中第239位的氨基酸D被K取代、第240位的氨基酸E被K取代和第292位的氨基酸K被D取代(根据Kabat EU索引编号)。
在如本文所报告的多特异性抗体的一个实施方案中,使用WO 2007/110205中描述的方法支持多特异性抗体的第一重链和第二重链的异源二聚化。
在如本文所报告的所有方面和实施方案的一个实施方案中,多特异性抗体是双特异性抗体或三特异性抗体。在本发明的一个优选实施方案中,多特异性抗体是双特异性抗体。
在如本文所报告的所有方面的一个实施方案中,所述抗体是二价或三价抗体。在一个实施方案中,抗体是二价抗体。
在如本文所报告的所有方面的一个实施方案中,多特异性抗体具有IgG型抗体的恒定结构域结构。在如本文所报告的所有方面的另一实施方案中,多特异性抗体的特征在于,所述多特异性抗体是人亚类IgG1,或者具有突变L234A和L235A的人亚类IgG1。在如本文所报告的所有方面的另一实施方案中,多特异性抗体的特征在于,所述多特异性抗体是人亚类IgG2。在如本文所报告的所有方面的另一实施方案中,多特异性抗体的特征在于,所述多特异性抗体是人亚类IgG3。在如本文所报告的所有方面的另一实施方案中,多特异性抗体的特征在于,所述多特异性抗体是人亚类IgG4,或具有额外的突变S228P的人亚类IgG4。在如本文所报告的所有方面的另一实施方案中,多特异性抗体的特征在于,所述多特异性抗体是人亚类IgG1或人亚类IgG4。在如本文所报告的所有方面的另一实施方案中,多特异性抗体的特征在于,所述多特异性抗体是具有突变L234A和L235A的人亚类IgG1(根据Kabat EU索引编号)。在如本文所报告的所有方面的另一实施方案中,多特异性抗体的特征在于,所述多特异性抗体是具有突变L234A、L235A和P329G的人亚类IgG1(根据Kabat EU索引编号)。在如本文所报告的所有方面的另一实施方案中,多特异性抗体的特征在于,所述多特异性抗体是具有突变S228P和L235E的人亚类IgG4(根据Kabat EU索引编号)。在如本文所报告的所有方面的另一实施方案中,多特异性抗体的特征在于,所述多特异性抗体是具有突变S228P、L235E和P329G的人亚类IgG4(根据Kabat EU索引编号)。
在如本文所报告的的所有方面的一个实施方案中,如本文所特定的包含重链(包括CH3结构域)的抗体,包含额外的C-端甘氨酸-赖氨酸二肽(G446和K447,根据Kabat EU索引编号)。在如本文所报告的所有方面的一个实施方案中,如本文所特定的包含重链(包括CH3结构域)的抗体,包含额外的C-端甘氨酸残基(G446,根据Kabat EU索引编号)。
在一个实施方案中,抗体包含第一Fc区多肽和第二Fc区多肽,和
其中,
i)第一Fc区多肽是人IgG1Fc区多肽和第二Fc区多肽是人IgG1Fc区多肽,或
ii)第一Fc区多肽是具有突变L234A、L235A的人IgG1Fc区多肽和第二Fc区多肽是具有突变L234A、L235A的人IgG1Fc区多肽,或
iii)所述第一Fc区多肽是具有突变L234A、L235A、P329G的人IgG1Fc区多肽和第二Fc区多肽是具有突变L234A、L235A、P329G的人IgG1Fc区多肽,或
iv)所述第一Fc区多肽是具有突变L234A、L235A、S354C、T366W的人IgG1Fc区多肽和所述第二Fc区多肽是具有突变L234A、L235A、Y349C、T366S、L368A、Y407V的人IgG1Fc区多肽,或
v)所述第一Fc区多肽是具有突变L234A、L235A、P329G、S354C、T366W的人IgG1Fc区多肽和所述第二Fc区多肽是具有突变L234A、L235A、P329G、Y349C、T366S、L368A、Y407V的人IgG1Fc区多肽,或
vi)所述第一Fc区多肽是人IgG4Fc区多肽和所述第二Fc区多肽是人IgG4Fc区多肽,或
vii)所述第一Fc区多肽是具有突变S228P、L235E的人IgG4Fc区多肽和所述第二Fc区多肽是具有突变S228P、L235E的人IgG4Fc区多肽,或
viii)所述第一Fc区多肽是具有突变S228P、L235E、P329G的人IgG4Fc区多肽和所述第二Fc区多肽是具有突变S228P、L235E、P329G的人IgG4Fc区多肽,或
ix)所述第一Fc区多肽是具有突变S228P、L235E、S354C、T366W的人IgG4Fc区多肽和所述第二Fc区多肽是具有突变S228P、L235E、Y349C、T366S、L368A、Y407V的人IgG4Fc区多肽,或
x)所述第一Fc区多肽是具有突变S228P、L235E、P329G、S354C、T366W的人IgG4Fc区多肽和所述第二Fc区多肽是具有突变S228P、L235E、P329G、Y349C、T366S、L368A、Y407V的人IgG4Fc区多肽。
在一个实施方案中,抗体包含第一Fc区多肽和第二Fc区多肽,和
其中所述抗体在第一Fc区多肽和在第二Fc区多肽中包含突变组合
i)I253A、H310A和H435A,或
ii)H310A、H433A和Y436A,或
iii)L251D、L314D和L432D,或
iv)i)至iii)的组合。
在如本文所报告的所有方面的一个实施方案中,如本文报告的抗体是效应子沉默抗体。在如本文所报告的所有方面的一个实施方案中,抗体是效应子沉默抗体并且其不结合人FcRn。在如本文所报告的所有方面的一个优选的实施方案中,是人亚类IgG1抗体,其在两条重链上具有突变L234A、L235A、P329G、I253A、H310A和H434A(根据Kabat索引编号)。
重组方法和组合物
可以使用例如,如在US 4,816,567中描述的重组方法和组合物来生产抗体。所需的核酸可编码包含抗体VL的氨基酸序列和/或编码包含抗体VH的氨基酸序列(例如,抗体的轻链和/或重链)。在进一步的实施方案中,提供包含此类核酸的一种或多种载体(例如,表达载体)。在进一步的实施方案中,提供包含此类核酸的宿主细胞。在一个这样的实施方案中,宿主细胞包含(例如,已经被转化有):(1)包含核酸的载体,所述核酸编码包含抗体VL的氨基酸序列和包含抗体VH的氨基酸序列,或(2)第一载体和第二载体,所述第一载体包含编码包含抗体VL的氨基酸序列的核酸,和所述第二载体包含编码包含抗体VH的氨基酸序列的核酸。在一个实施方案中,宿主细胞是真核的,例如中国仓鼠卵巢(CHO)细胞或淋巴样细胞(例如,Y0、NS0、SP20细胞)。在一个实施方案中,提供制备抗[[PRO]]抗体的方法,其中所述方法包括在适于抗体表达的条件下,培养如上提供的包含编码抗体的核酸的宿主细胞,和任选地从宿主细胞(或宿主细胞培养基)回收抗体。
为了重组生产抗体,分离编码抗体的核酸(例如,如上文所述的),并插入一种或多种载体,用于在宿主细胞中进一步克隆和/或表达。可以使用常规方法容易地分离和测序这样的核酸(例如通过使用能够特异性结合编码抗体重链和轻链的基因的寡核苷酸探针)。
用于克隆或表达编码抗体的载体的合适的宿主细胞包括本文所述的原核或真核细胞。例如,可以在细菌中生产抗体,尤其是不需要糖基化和Fc效应子功能时。对于在细菌中表达抗体片段和多肽,参见例如,US 5,648,237、US 5,789,199和US 5,840,523。(还参见Charlton,K.A.,In:Methods in Molecular Biology,Vol.248,Lo,B.K.C.(编辑),Humana Press,Totowa,NJ(2003),pp.245-254,其描述了在大肠杆菌中表达抗体片段)。表达后,可以在可溶性级分中从细菌细胞糊中分离抗体,并可以进一步纯化。
除了原核生物,真核微生物如丝状真菌或酵母也是编码抗体的载体的合适的克隆或表达宿主,包括真菌和酵母菌株,其糖基化途径已经被“人源化”,导致生产具有部分或全部人糖基化模式的抗体。见Gerngross,T.U.,Nat.Biotech.22(2004)1409-1414;和Li,H.等人,Nat.Biotech.24(2006)210-215。
对于糖基化抗体的表达,合适的宿主细胞也可来源于多细胞生物体(无脊椎动物和脊椎动物)。无脊椎动物细胞的例子包括植物和昆虫细胞。已经鉴定了许多杆状病毒株,其可以与昆虫细胞共同使用,特别是用于草地夜蛾(Spodoptera frugiperda)细胞的转染。
植物细胞培养物也可以用作宿主。参见,例如,US 5,959,177、US 6,040,498、US 6,420,548、US 7,125,978和US 6,417,429(描述了用于在转基因植物中生产抗体的PLANTIBODIESTM技术中)。
脊椎动物细胞也可以用作宿主。例如,适于悬浮生长的哺乳动物宿主细胞系可以是有用的。其他有用的哺乳动物细胞系的例子是用SV40转化的猴肾CV1系(COS-7);人胚胎肾细胞系(例如,如Graham,F.L.等人,J.Gen Virol.36(1977)59-74中描述的293或293细胞);幼仓鼠肾细胞(BHK);小鼠支持细胞(例如,如Mather,J.P.,Biol.Reprod.23(1980)243-252中描述的TM4细胞);猴肾细胞(CV1);非洲绿猴肾细胞(VERO-76);人宫颈癌细胞(HeLa细胞);犬肾细胞(MDCK;水牛大鼠肝细胞(BRL 3A);人肺细胞(W138);人肝细胞(Hep G2);小鼠乳腺肿瘤(MMT 060562);TRI细胞,例如,如Mather,J.P.等人,Annals N.Y.Acad.Sci.383(1982)44-68中所描述的;MRC 5细胞;和FS4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(CHO)细胞,包括DHFR-CHO细胞(Urlaub,G.等人,Proc.Natl.Acad.Sci.USA 77(1980)4216-4220);和骨髓瘤细胞系,如Y0、NS0和Sp2/0。对于适于抗体生产的某些哺乳动物宿主细胞系的综述,参见,例如,Yazaki,P.和Wu,A.M.,Methods in Molecular Biology,Vol.248,Lo,B.K.C.(编辑),Humana Press,Totowa,NJ(2004),pp.255-268。
具体实施方案
1.多特异性抗体的蛋白质水解酶的限制性消化对分析多特异性抗体轻链配对的用途。
2.多特异性抗体的蛋白质水解酶的限制性消化对确定多特异性抗体中轻链错配的用途。
3.重组哺乳动物细胞生产的多特异性抗体的蛋白质水解酶的限制性消化对选择生产多特异性抗体的哺乳动物细胞的用途。
4.根据实施方方案1至3中任一项所述的用途,其中所述蛋白质水解酶选自Lys-C、Asp-N、Arg-C、Glu-C和胰凝乳蛋白酶。
5.根据实施方案4所述的用途,其中蛋白质水解酶是Lys-C。
6.根据实施方案1至5中任一项所述的用途,其中所述孵育持续35至45分钟。
7.根据实施方案6所述的用途,其中所述孵育持续约40分钟。
8.根据实施方案1至7中任一项所述的用途,其特征在于,与蛋白质水解酶孵育的多特异性抗体是去糖基化的多特异性抗体。
9.根据实施方案1至8中任一项所述的用途,其中抗体与酶的重量比为约1:200。
10.根据实施方案1至9中任一项所述的用途,其中与蛋白质水解酶孵育的多特异性抗体具有从200至600μg/mL的浓度。
11.根据实施方案1至10中任一项所述的用途,其中所述多特异性抗体是单克隆多特异性抗体。
12.根据实施方案1至11中任一项所述的用途,其中所述多特异性抗体包含至少两个非肽结合的轻链。
13.根据实施方案1至11中任一项所述的用途,其中所述多特异性抗体包含至少三个非肽结合的多肽。
14.一种用于确定多特异性抗体中轻链配对的方法,所述方法包括以下步骤:
a)将包含多特异性抗体的样本与蛋白质水解酶孵育限定的时间,
b)通过质谱法鉴定由步骤a)的限制性蛋白水解消化获得的片段的质量,和
c)从步骤b)的结果确定多特异性抗体的轻链配对。
15.一种用于确定多特异性抗体的轻链错配的方法,所述方法包括以下步骤:
a)将包含多特异性抗体的样本与蛋白质水解酶孵育限定的时间,
b)通过质谱法鉴定由步骤a)的限制性蛋白水解消化获得的片段的质量,和
c)从步骤b)的结果确定多特异性抗体的轻链配对,从而确定轻链错配。
16.一种用于选择生产多特异性抗体的重组哺乳动物细胞的方法,所述方法包括以下步骤:
a)将包含一组重组哺乳动物细胞的一个重组哺乳动物细胞克隆群生产的多特异性抗体的样本单独地与蛋白质水解酶孵育限定的时间,所述一组重组哺乳动物细胞的所有细胞生成相同的多特异性抗体,
b)通过质谱法鉴定由步骤a)的限制性蛋白水解消化获得的片段的质量,和
c)从步骤b)的结果确定每个克隆细胞群的多特异性抗体的轻链错配的存在,和
d)基于步骤c)的结果选择生产多特异性抗体的重组细胞。
17.根据实施方案14至16中任一项所述的方法,其中蛋白质水解酶选自Lys-C、Asp-N、Arg-C、Glu-C和胰凝乳蛋白酶。
18.根据实施方案17所述的方法,其中蛋白质水解酶是Lys-C。
19.根据实施方案14至18中任一项所述的方法,其中所述孵育持续35至45分钟。
20.根据实施方案19所述的方法,其中所述孵育持续约40分钟。
21.根据实施方案14至20中任一项所述的方法,其中与蛋白质水解酶孵育的多特异性抗体是去糖基化的多特异性抗体。
22.根据实施方案14至21中任一项所述的方法,其中抗体与酶的重量比为约1:200。
23.根据实施方案14至22中任一项所述的方法,其中与蛋白质水解酶孵育的多特异性抗体具有从200至600μg/mL的浓度。
24.根据实施方案14至23中任一项所述的方法,其中步骤b)是
b)脱盐步骤a)的孵育混合物,并通过质谱法鉴定由步骤a)的限制性蛋白水解消化获得的片段的质量。
25.根据实施方案14至24中任一项所述的方法,其中所述多特异性抗体是单克隆多特异性抗体。
26.根据实施方案14至25中任一项所述的方法,其中所述多特异性抗体包含至少两个非肽结合的轻链。
27.根据实施方案14至25中任一项所述的方法,其中所述多特异性抗体包含至少三个非肽结合的多肽。
附图说明
图1二价双特异性抗体的正确装配(1)和轻链错配(2)形式。
图2四价双特异性抗体的正确装配(1)和一些轻链错配(2,3,4,5)形式。
图3纤溶酶消化的二价双特异性抗体的IE;轻链1和重链1形成第一结合位点,轻链2和重链2形成第二结合位点;预期各对在以下位置:A:轻链2+重链片段1,B:轻链1+重链1,C:轻链2+重链2,D:轻链1+重链2。
图4纤溶酶消化的二价双特异性抗体的IE;轻链1和重链1形成第一结合位点,轻链2和重链2形成第二结合位点;预期各对在以下位置:A:轻链2+重链片段1,B:轻链1+重链1,C:轻链2+重链2,D:轻链1+重链2。
图5限制性Lys-C消化的二价双特异性抗体的IE;轻链1和重链1形成第一结合位点,轻链2和重链2形成第二结合位点;预期各对在以下位置:A:轻链2+重链片段1,B:轻链1+重链1,C:轻链2+重链2,D:轻链1+重链2。
图6四价双特异性抗体的IE;A:3次(time)轻链1;B:正确装配的抗体;C:3次轻链2。
图7蛋白质水解酶消化的四价双特异性抗体的蛋白A亲和色谱法流动液的MS分析,ISCID 0;A:正确配对的Fab,B:错配的Fab。
图8蛋白质水解酶消化的四价双特异性抗体的蛋白A亲和色谱法流动液的MS分析,ISCID 90;A:正确配对的Fab,B:错配的Fab。
图9蛋白质水解酶消化的四价双特异性抗体的蛋白A亲和色谱法洗脱液的MS分析,ISCID 0;A:正确配对的Fc-Fab,B:错配的Fc-Fab。
图10蛋白质水解酶消化的四价双特异性抗体的蛋白A亲和色谱法洗脱液的MS分析,ISCID 90;A:正确配对的Fc-Fab,B:错配的Fc-Fab。
图11胃蛋白酶消化的四价双特异性抗体的EI。
提供以下实施例以帮助真正理解本发明,其范围列于所附权利要求中。应当理解,可以修改所列的方法而不脱离本发明的精神。
实施例
材料和一般方法
关于人免疫球蛋白轻链和重链的核苷酸序列的一般信息在以下给出:Kabat,E.A.,等人,Sequences of Proteins of Immunological Interest,第5版,Public Health Service,National Institutes of Health,Bethesda,MD(1991)。对抗体链的氨基酸的编号和提及根据Kabat编号系统(Kabat,E.A.,等人,Sequences of Proteins of Immunological Interest,第5版,Public Health Service,National Institutes of Health,Bethesda,MD(1991))如上定义。
重组DNA技术
使用标准方法操作DNA,如Sambrook,J.等人,Molecular Cloning:A laboratory manual;Cold Spring Harbor Laboratory Press,Cold Spring Harbor,New York,1989所述。分子生物学试剂根据制造商的说明使用。
基因合成
从化学合成生成的寡核苷酸制备期望的基因区段。通过退火和连接寡核苷酸(包括PCR扩增)装配600-1800bp长的基因区段,其侧翼有单数的(singular)限制性内切酶切割位点,和随后经由指定的限制性位点,例如KpnI/SacI或AscI/PacI克隆至基于pPCRScript(Stratagene)的pGA4克隆载体。亚克隆基因片段的DNA序列通过DNA测序证实。基因合成片段根据给定的说明在Geneart(Regensburg,Germany)定制。
DNA序列的确定
通过MediGenomix GmbH(Martinsried,Germany)或SequiServe GmbH(Vaterstetten,Germany)进行双链测序来确定DNA序列。
DNA和蛋白质序列分析和序列数据管理
GCG(Genetics Computer Group,Madison,Wisconsin)软件包版本10.2和Infomax's Vector NT1高级套件8.0版用于序列创建、汇谱、分析、注释和说明。
表达载体
对于所描述抗体的表达,应用用于瞬时表达细胞(例如在HEK293EBNA或HEK293-F中)的表达质粒变体,其或者基于具有或不具有CMV-内含子A启动子的cDNA组构(organization)、或者基于具有CMV启动子的基因组组构。
除了抗体表达盒,载体包含:
-复制起点,其允许该质粒在大肠杆菌中复制,和
-β-内酰胺酶基因,其在大肠杆菌中赋予氨苄青霉素抗性。
抗体基因的转录单位由以下元件组成:
-在5'端的独特限制性位点(一个或多个)
-来自人巨细胞病毒的即时早期增强子和启动子,
-在cDNA组构的情况下后续内含子A序列,
-人抗体基因的5'-非翻译区,
-免疫球蛋白重链信号序列,
-人抗体链(野生型或具有结构域交换),其作为cDNA组构或作为具有免疫球蛋白外显子-内含子结构的基因组组构
-3'非翻译区,其具有聚腺苷酸化信号序列,和
-在3'端的独特限制性位点(一个或多个)。
通过PCR和/或基因合成生成如下所述包含抗体链的融合基因,通过已知的重组方法和技术通过连接相应的核酸区段(例如使用各自载体中的独特的限制性位点)来装配。通过DNA测序验证亚克隆的核酸序列。对于瞬时转染,通过质粒制备从转化的大肠杆菌培养物(Nucleobond AX,Macherey-Nagel)制备大量质粒。
细胞培养技术
使用标准细胞培养技术,如Current Protocols in Cell Biology(2000),Bonifacino,J.S.,Dasso,M.,Harford,J.B.,Lippincott-Schwartz,J.and Yamada,K.M.(编辑),John Wiley&Sons,Inc.中描述的。
如下所述,通过在贴壁生长的HEK293-EBNA或悬浮生长的HEK29-F细胞中瞬时共转染各表达质粒表达多特异性抗体。
在HEK293-EBNA系统中瞬时转染
通过在贴壁生长的HEK293-EBNA细胞(表达Epstein-Barr病毒核抗原的人胚肾细胞系293;美国类型培养物保藏保藏号ATCC#CRL-10852,Lot.959 218)中瞬时共转染各表达质粒(例如,编码重链和修饰的重链以及相应的轻链和修饰的轻链)表达多特异性抗体,所述HEK293-EBNA细胞培养在DMEM(Dulbecco改进的Eagle培养基,)中,补充有10%Ultra Low IgG FCS(胎牛血清)、2mM L-谷氨酰胺和250μg/ml遗传霉素(Geneticin)。对于转染,使用FuGENETM6转染试剂(Roche Molecular Biochemicals),其中FuGENETM试剂(μl)与DNA(μg)的比例为4:1(从3:1到6:1的范围)。使用(修饰的和野生型)轻链和重链编码质粒1:1(等摩尔)的摩尔比(范围从1:2至2:1),分别从各质粒表达蛋白质。在第3天将细胞饲养在L-谷氨酰胺ad 4mM、葡萄糖[Sigma]和NAA中。从转染后第5至11天通过离心收获含有多特异性抗体的细胞培养物上清液,储存在-20℃。关于在例如HEK293细胞中重组表达人免疫球蛋白的一般信息提供在Meissner,P.等人,Biotechnol.Bioeng.75(2001)197-203中。
HEK293-F系统中的瞬时转染
根据制造商的说明书使用HEK293-F系统(Invitrogen)通过用相应的质粒(例如,编码重链和修饰的重链,以及相应的轻链和修饰的轻链)瞬时转染生成多特异性抗体。简单地说,用四种表达质粒和293fectinTM或fectin(Invitrogen)的混合物转染在摇瓶中或者在搅拌发酵罐中的无血清FreeStyleTM293表达培养基(Invitrogen)中悬浮生长的HEK293-F细胞(Invitrogen)。对于2升摇瓶(Corning),HEK293-F细胞以600mL中1.0E*6细胞/mL的密度接种,并在120rpm、8%CO2中孵育。第二天,将细胞以约1.5E*6细胞/mL的细胞密度与约42mL A)和B)的混合物转染,其中A)20mL Opti-MEM(Invitrogen)和600μg总质粒DNA(1μg/mL)(分别编码重链或修饰的重链,以及相应的轻链,等摩尔比)和B)20mL Opti-MEM+1.2mL 293fectin或fectin(2μl/mL)。根据葡萄糖消耗在发酵过程中加入葡萄糖溶液。5-10天后收获含有分泌抗体的上清液,从上清中直接纯化抗体或将上清液冷冻保存。
蛋白质测定
通过测定280nm处的光密度(OD)、利用摩尔消光系数确定纯化抗体和衍生物的蛋白质浓度,所述摩尔消光系数根据Pace,等人,Protein Science,1995,4,2411-1423,基于氨基酸序列计算。
上清中抗体浓度测定
在细胞培养物上清液中的抗体和衍生物的浓度通过使用蛋白A琼脂糖珠(Roche)的免疫沉淀估计。60μL蛋白A琼脂糖珠在TBS-NP40(50mM Tris,pH 7.5,150mM NaCl,1%Nonidet-P40)中洗涤三次。随后,将1-15mL细胞培养上清液施加到在TBS-NP40中预平衡的蛋白A琼脂糖珠上。在室温下孵育1小时后,将珠在Ultrafree-MC-过滤柱(Amicon)上用0.5mL TBS-NP40洗涤一次,用0.5ml 2×磷酸盐缓冲盐水(2xPBS,Roche)洗涤两次,用0.5ml 100mM柠檬酸钠pH5.0短暂地洗涤四次。通过添加35μlLDS样品缓冲液(Invitrogen)洗脱结合的抗体。分别将样品的一半与样品还原剂组合或保持未还原,在70℃下加热10分钟。因此,5-30μl施加到4-12%Bis-TrisSDS-PAGE(Invitrogen)(对于非还原SDS-PAGE,使用MOPS缓冲液,对于还原SDS-PAGE,使用MES缓冲液和抗氧化运行缓冲液添加剂(Invitrogen)),并用考马斯亮蓝染色。
通过亲和HPLC色谱法定量测定细胞培养物上清液中的抗体和衍生物的浓度。简言之,在Agilent HPLC 1100系统上,将含有结合于蛋白A的抗体和衍生物的细胞培养物上清液施加到200mM KH2PO4、100mM柠檬酸钠,pH 7.4中的Applied Biosystems Poros A/20柱上,用200mM NaCl、100mM柠檬酸,pH 2.5从基质中洗脱。洗脱的蛋白质通过UV吸光度和峰面积积分进行定量。纯化的标准IgG1抗体作为标准。
可替代地,通过Sandwich-IgG-ELISA测定细胞培养物上清液中抗体和衍生物的浓度。简言之,用100μL/孔的生物素化抗人IgG捕获分子F(ab')2<h-Fcγ>BI(Dianova)0.1μg/mL,在室温下放置1小时或备选地在4℃过夜包被StreptaWell高结合链霉亲和素A-96孔微量滴定板(Roche),随后用200μL/孔PBS、0.05%Tween(PBST,Sigma)洗涤三次。在PBS(Sigma)中系列稀释的各含有抗体的细胞培养物上清液100μL/孔加入到孔中,并在室温下在微量滴定板摇床上孵育1-2小时。用200μL/孔PBST洗涤孔三次,用100μl F(ab‘)2<hFcγ>POD(Dianova),0.1μg/mL作为检测抗体在室温在微量滴定板摇床上放置1-2小时,检测结合的抗体。用200μL/孔PBST三次洗掉未结合的检测抗体,并通过加入100μL ABTS/孔检测结合的检测抗体。在Tecan氟分光光度计上在405nm测量波长下进行吸光度的测定(参考波长492nm)。
蛋白质纯化
参照标准流程从过滤的细胞培养物上清液中纯化蛋白。简言之,将抗体施加到蛋白A Sepharose柱(GE Healthcare)上,并用PBS洗涤。抗体洗脱液在pH 2.8获得,随后立即中和样品。通过尺寸排阻色谱法(Superdex 200,GE Healthcare)在PBS或在20mM组氨酸、150mMNaCl pH 6.0中从单体抗体分离聚集的蛋白质。合并单体抗体级分,(如需要)用例如MILLIPORE Amicon Ultra(30MWCO)离心浓缩机浓缩,冷冻储存在-20℃或-80℃。提供部分样品用于随后的蛋白分析和分析表征,例如通过SDS-PAGE、尺寸排阻层析(SEC)或质谱。
SDS-PAGE
根据制造商的指示使用Pre-Cast凝胶系统(Invitrogen)。特别是,使用10%或4-12%Bis-Tris Pre-Cast凝胶(pH 6.4)和MES(还原凝胶,具有抗氧运行缓冲液添加剂)或MOPS(非还原凝胶)运行缓冲液。
分析型尺寸排阻色谱法
通过HPLC色谱法进行用于确定抗体聚集和寡聚状态的尺寸排阻色谱法(SEC)。简言之,将蛋白A纯化的抗体施加到Agilent HPLC 1100系统的300mM NaCl、50mM KH2PO4/K2HPO4,pH 7.5中的Tosoh TSKgel G3000SW柱上,或Dionex HPLC系统的2×PBS中的Superdex 200柱(GE Healthcare)上。通过UV吸光度和峰面积积分定量洗脱的蛋白质。BioRad凝胶过滤标准151-1901作为标准。
实施例1
确定限制性蛋白水解消化后多特异性抗体的轻链错配的方法
通过限制性LysC消化的交叉单抗(CrossMab)的电喷雾离子化质谱法(ESI-MS)分析预期的一级结构。有利地,该抗体已预先去糖基化。
用N-糖苷酶F、在磷酸盐或Tris或组氨酸缓冲液中,在37℃下使VH/VL交叉单抗去糖基化达17小时,蛋白质浓度1mg/mL,并且抗体:酶的比率为100:1。用100μg去糖基化的VH/VL交叉单抗在Tris缓冲液pH 8在37℃下进行40分钟限制性Lys-C(Roche Diagnostics GmbH,Mannheim,Germany)消化。
在质谱法之前,在Sephadex G25柱(GE Healthcare)上通过HPLC使样品脱盐。
在装配有TriVersa NanoMate源(Advion)的maXis 4G UHR-QTOF MS系统(Bruker Daltonik)上通过ESI-MS来确定总质量。
实施例2
确定四价双特异性抗体的轻链错配的方法
用N-糖苷酶F、在磷酸盐或Tris或组氨酸缓冲液中,在37℃下使四价双特异性抗体去糖基化达17小时,蛋白质浓度1mg/mL,并且抗体:酶的比率为100:1。用100μg去糖基化的四价双特异性抗体在100mM柠檬酸盐缓冲液pH3.7在37℃下进行16小时限制性Lys-C(Roche Diagnostics GmbH,Mannheim,Germany)消化,蛋白质浓度约0.9mg/mL,并且抗体:酶的比率为50:1。
- 还没有人留言评论。精彩留言会获得点赞!