化合物及其在扩增造血干细胞和/或造血祖细胞中的应用的制作方法
本发明涉及本文所述的特定化合物。另外,本发明涉及这些化合物在扩增造血干细胞(HSC)和/或造血祖细胞(HPC)中的应用。此外,本发明涉及包括HSC和HPC的疾病的药物治疗。
背景技术:
造血干细胞(HSC)的主要来源是骨髓和脐带血(UCB)。HSC用于抑制设施(自体或异体),其在患有血液恶性肿瘤、骨髓衰竭病症、各种全球关注的先天性疾病(例如镰状细胞贫血和地中海贫血)和自身免疫疾病(如狼疮)的患者中构成治疗的最有效治疗策略之一。但是,由于这些细胞不能充分地离体扩增以使该程序安全和成功,全球数以千计的人不能获得用于救命治疗或生命改善治疗的该机会。更具体而言,对于每3个患者,有一个会放弃移植的机会,这是因为找不到人白细胞抗原(HLA)相同的供体。另一比例的患者简单地因为对于成功移植而言在移植物(即脐带血或自体物)中能够获得的HSC太少而不会进行移植。骨髓移植的安全性和有效性直接依赖于移植可获得的HSC和HPC的数量。其能够输注得越多,血液功能恢复得越快,因缺乏粒细胞导致的感染风险或者因缺乏血小板导致的出血的窗口越短。当例如在用于主要的遗传性血液病(全球发病率和死亡率的主要遗传原因)的基因疗法的背景下优选非清髓性调理时,提供足够HSC的挑战进一步升级。
在成人中,HSC主要驻留在骨髓中,并且必须被动员进入循环,然后通过单采血液成分术收集以用于自体或异体造血干细胞移植(HSCT)。收集足够数量的CD34+细胞((HSC)的替代标记物)是最重要的,因为CD34+细胞的剂量影响造血恢复的成功和速率。多个报道表明,更高的输注CD34+细胞的剂量可独立地预测改善的存活。
两个最常使用的动员方案是粒细胞集落刺激因子(G-CSF)和G-CSF加化疗。美国食品药品监督局(FDA)于2008年和加拿大卫生部于2011年批准的普乐沙福(一种CXCR4拮抗剂)在与G-CSF一起施用时增强了HSC的动员。但是,由于白血病细胞的动员,普乐沙福在患有白血病的患者中是禁忌。据估计利用目前使用的动员方案不能获得足够数量的CD34+细胞/kg影响了多达15%的患者(在疾病间存在变化)。在血液恶性肿瘤中使用自体HSCT经常受到以下事实的限制:正常干细胞和癌症干细胞都存在于骨髓中,因此容易被动员。
具有BM或mPBSC的异体HSCT是另一种移植替代物。但是,适合这种移植的患者的约三分之一至四分之一找不到合适的供体。对于得到移植的那些患者,由于移植物抗宿主病、再发或移植排斥以及长期免疫缺陷的风险,导致存在高频率的移植相关死亡率。作为另选,脐带血已经显示为异体HSCT中的有效选项。但是,对于快速有效的造血恢复而言,单个CB单位通常为成人患者提供的HSC不足。
因此需要新策略来增加造血干细胞和/或造血祖细胞的扩增。
技术实现要素:
本发明人发现了本文所述的特定化合物。这些化合物可用于扩增造血干细胞和/或造血祖细胞群。具体而言,造血细胞是人细胞。所述化合物还可用于涉及HSC和/或HPC的疾病的药物治疗。
根据一个方面,本发明提供以下通式或者式I、II、III、IV、V、VI、I’、II’、III’、IV’、V’和VI’的化合物:
根据一个方面,本发明提供包含本文定义的化合物的药物组合物。
根据一个方面,本发明提供本文定义的化合物扩增HSC和/或HPC的应用。在本发明的实施方式中,造血细胞是人细胞。
根据一个方面,本发明提供增加HSC和/或HPC的方法,所述方法包括在本文定义的化合物的存在下接触起始细胞群。在本发明的实施方式中,起始细胞群是体内、体外或离体的。另外,在本发明的实施方式中,所述起始细胞群包含从动员的外周血(mPB)、骨髓(BM)或脐带血(UCB)收集的CD34+细胞。此外,在根据本发明的方法的实施方式中,可选地,所述在本文定义的化合物的存在下接触起始细胞群与作为生物或其他小分子的至少一种细胞扩增因子一起进行。
根据一个方面,本发明提供根据本发明的方法扩增的细胞群,更具体而言,使用根据本发明的化合物扩增的细胞群。在实施方式中,本发明提供根据本发明的方法扩增的HSC和/或HPC,更具体而言,使用本文定义的化合物扩增的HSC和/或HPC。
根据一个方面,本发明提供治疗对象中造血功能障碍/恶性肿瘤、自身免疫疾病和/或遗传性免疫缺陷疾病的方法,所述方法包括对需要此类治疗的对象施用使用本文定义的化合物扩增的HSC。
在本发明的实施方式中,所述造血功能障碍/恶性肿瘤、自身免疫疾病和/或遗传性免疫缺陷疾病包括骨髓衰竭病症、各种全球关注的先天性疾病(例如镰状细胞贫血和地中海贫血)、狼疮、急性骨髓性白血病、急性淋巴细胞性白血病、慢性骨髓性白血病、慢性淋巴细胞白血病、骨髓增生性疾病、骨髓增生异常综合征、多发性骨髓瘤、非霍奇金淋巴瘤、霍奇金病、再生障碍性贫血、纯红细胞再生障碍、血红蛋白尿、范可尼贫血、地中海贫血、镰状细胞贫血、威斯科特-奥尔德里奇综合征、先天性代谢缺陷(特别例如戈谢病)。
根据一个方面,本发明提供用于增加或扩增HSC和/或HPC的试剂盒,所述试剂盒包括本文定义的化合物和使用说明书。在本发明的实施方式中,所述试剂盒包含作为生物或其他小分子的至少一种细胞扩增因子。
通过阅读以下的参照附图以仅仅实例的方式给出的本发明的具体实施方式的非限制性的描述,会更清楚地了解本发明的其它目的、优点和特征。
附图说明
在附图中:
图1~6是在本文公开的化合物的存在下CD34+/CD45RA-细胞数量相对于在DMSO(阴性对照)的存在下CD34+/CD45RA-细胞数量之比的原始数据和图形表示的表格。
具体实施方式
本发明人已经发现本文所述的特定化合物。这些化合物用于扩增造血干细胞和/或造血祖细胞群体。特别地,所述造血细胞是人细胞。所述化合物还用于涉及造血干细胞和/或造血祖细胞的疾病的药物治疗。
具体而言,本发明人发现了这些化合物可用作工具化合物。在一个实施方式中,所述工具化合物由具有末端炔烃部分的第一反应物和具有光亲和性官能部分(例如双吖丙啶、叠氮基和二苯甲酮)的第二反应物组成,两个部分形成所述工具化合物的一部分。工具化合物可用于“点击化学(click chemistry)”(Luba Dubinsky,Bastiaan P.Krom,Michael M.Meijler,“Diazirine based photoaffinity labeling”Bioorganic Med.Chem.2012(20),554;David J.Lapinsky,Tandem photoaffinity labeling–bioorthogonal conjugation in medicinal Chemistry Bioorganic Med.Chem.2012(20),6237;Kolb et al.,“Click Chemistry:Diverse Chemical Function from a Few Good Reactions”Angew.Chem.Int.Ed.Engl.40:2004-2021(2001);Lewis et al.,“Click Chemistry in Situ:Acetylcholinesterase as a Reaction Vessel for the Selective Assembly of a...,”Angew.Chem.Int.Ed.Engl.41:1053-1057(2002))。在另一实施方式中,工具化合物由生物素化部分和光亲和性官能部分组成。
本文定义的化合物的盐或前药也在本发明的化合物的范围内。
本文定义的化合物的取代基如下定义。
Z是:1)-P(O)(OR1)(OR1),2)-C(O)OR1,3)-C(O)NHR1,4)-C(O)N(R1)R1,5)-C(O)R1,6)-CN,7)-SR1,8)-S(O)2NH2,9)-S(O)2NHR1,10)-S(O)2N(R1)R1,11)-S(O)R1,12)-S(O)2R1,13)-L,14)-苯甲基,其可选地取代有1、2或3个RA或R1取代基,15)-L-杂芳基,其可选地取代有连接在L和/或杂芳基基团上的一个或多个RA或R1取代基,16)-L-杂环基,其可选地取代有连接在L和/或杂环基基团上的一个或多个RA或R1取代基,17)-L-芳基,其可选地取代有连接在L和/或杂芳基基团上的一个或多个RA或R1取代基,18)-杂芳基,其可选地取代有一个或多个RA或R1取代基,或19)-芳基,其可选地取代有一个或多个RA或R1取代基。在该列表中,各取代基如果尚未存在,其可选地连接至所述L基团;并且,当(R1)和R1连接至氮原子时,它们可选地与所述氮原子结合在一起形成3~7元环,所述3~7元环可选地包括一个或多个选自N、O和S的其它杂原子,所述环可选地取代有一个或多个R1或RA。
W是H、卤素或者通过为N、O、S或C的原子连接至该分子的嘧啶并吲哚核的基团。可选地,W包含作为具有1~20个碳原子的、饱和、不饱和、线性、支链和/或环烷基和/或杂烷基的至少一个部分。另外,可选地,所述部分包含至少一个为N、O或S的其它杂原子。如本领域技术人员会理解的,本发明的化合物的化学结构中的W可以属于本领域中常用的化学基团的各种类别。
更具体而言,W是:1)-H,2)-卤素,3)-OR1,4)-L-OH,5)-L-OR1,6)-SR1,7)-CN,8)-P(O)(OR1)(OR1),9)-NHR1,10)–N(R1)R1,11)-L-NH2,12)-L-NHR1,13)-L-N(R1)R1,14)-L-SR1,15-L-S(O)R1,16)-L-S(O)2R1,17)-L-P(O)(OR1)(OR1),18)-C(O)OR1,19)-C(O)NH2,20)-C(O)NHR1,21)-C(O)N(R1)R1,22)-NHC(O)R1,23)-NR1C(O)R1,24)-NHC(O)OR1,25)-NR1C(O)OR1,26)-OC(O)NH2,27)-OC(O)NHR1,28)-OC(O)N(R1)R1,29)-OC(O)R1,30)-C(O)R1,31)-NHC(O)NH2,32)-NHC(O)NHR1,33)-NHC(O)N(R1)R1,34)-NR1C(O)NH2,35)-NR1C(O)NHR1,36)-NR1C(O)N(R1)R1,37)-NHS(O)2R1,38)-NR1S(O)2R1,39)-S(O)2NH2,40)-S(O)2NHR1,41)-S(O)2N(R1)R1,42)-S(O)R1,43)-S(O)2R1,44)-OS(O)2R1,45)-S(O)2OR1,46)-苯甲基,其可选地取代有1、2或3个RA或R1取代基,47)-L-杂芳基,其可选地取代有一个或多个连接在L和/或杂芳基基团上的RA或R1取代基,48)-L-杂环基,其可选地取代有一个或多个连接在L和/或杂环基基团上的RA或R1取代基,49)-L-芳基,其可选地取代有一个或多个连接在L和/或芳基基团上的RA或R1取代基,50)-L-NR1(R1),51)-L-)2NR1,52)-L-(N(R1)-L)n–N(R1)R1,53)-L-(N(R1)-L)n–(N(R1)R1)n,54)-L-(N(R1)-L)n-杂芳基,其可选地取代有一个或多个连接在L和/或杂芳基基团上的RA或R1取代基,55)-L-(N(R1)-L)n-杂环基,其可选地取代有一个或多个连接在L和/或杂环基基团上的RA或R1取代基,56)-L-(N(R1)-L)n-芳基,其可选地取代有一个或多个连接在L和/或芳基基团上的RA或R1取代基,57)-O-L-N(R1)R1,58)-O-L-杂芳基,其可选地取代有一个或多个连接在L和/或杂芳基基团上的RA或R1取代基,59)-O-L-杂环基,其可选地取代有一个或多个连接在L和/或杂环基基团上的RA或R1取代基,60)-O-L-芳基,其可选地取代有一个或多个连接在L和/或芳基基团上的RA或R1取代基,61)-O-L)2-NR1,62)-O-L-(N(R1)-L)n-N(R1)R1,63)-O-L-(N(R1)-L)n-(N(R1)R1)n,64)-O-L-(N(R1)-L)n-杂芳基,其可选地取代有一个或多个连接在L和/或杂芳基基团上的RA或R1取代基,65)-O-L-(N(R1)-L)n-杂环基,其可选地取代有一个或多个连接在L和/或杂环基基团上的RA或R1取代基,66)-O-L-(N(R1)-L)n-芳基,其可选地取代有一个或多个RA或R1取代基,67)-S-L-杂芳基,其可选地取代有一个或多个RA或R1取代基,68)-S-L-杂环基,其可选地取代有一个或多个RA或R1取代基,69)-S-L-芳基,其可选地取代有一个或多个连接在L和/或芳基基团上的RA或R1取代基,70)-S-L)2NR1,71)-S-L-(N(R1)-L)n–N(R1)R1,72)-S-L-(N(R1)-L)n–(N(R1)R1)n,73)-S-L-(N(R1)-L)n-杂芳基,其可选地取代有一个或多个RA取代基,74)-S-L-(N(R1)-L)n-杂环基,其可选地取代有一个或多个RA取代基,75)-S-L-(N(R1)-L)n-芳基,其可选地取代有一个或多个RA取代基,76)-NR1(R1),77)-(N(R1)-L)n–N(R1)R1,78)-(N(R1)-L)n–(N(R1)R1)n,79)-N(R1)L)2–NR1,80)-(N(R1)-L)n–N(R1)RA,81)-(N(R1)-L)n-杂芳基,其可选地取代有一个或多个RA或R1取代基,82)-(N(R1)-L)n-杂环基,其可选地取代有一个或多个RA或R1取代基,83)-(N(R1)-L)n-芳基,其可选地取代有一个或多个RA或R1取代基,84)-杂芳基,其可选地取代有一个或多个RA取代基,或85)-芳基,其可选地取代有一个或多个RA取代基,86)-X(CR1CR1)m-C(O)-(CR1CR1)n-X(R1R1)-[L-N(R1R1)]p,87)-X(CR1CR1)m-CR1(OR1)-(CR1CR1)n-X(R1R1)-[L-N(R1R1)]p,88)-X(R1)-L-N(R1)-(LX)n-RA,89)-X(R1)-L-N(R1)-(LX)n-H。在该列表中,各取代基如果尚未存在,其可选地连接至所述L基团;并且当两个R1取代基存在于同一氮原子上时,则各R1取代基独立地选自后述的R1值的列表;n是等于0、1、2、3、4或5的整数;并且,当(R1)和R1连接至氮原子时,它们可选地与所述氮原子结合在一起形成3~7元环,所述3~7元环可选地包括一个或多个选自N、O和S的其它杂原子,所述环可选地取代有一个或多个R1或RA。
L是:1)-C1-6烷基,2)-C2-6烯基,3)-C2-6炔基,4)-C3-7环烷基,5)-C3-7环烯基,6)杂环基,7)-C1-6烷基-C3-7环烷基,8)-C1-6烷基-杂环基,9)芳基,或10)杂芳基。在该列表中,所述烷基、所述烯基、所述炔基、所述环烷基、所述环烯基、所述杂环基、所述芳基和所述杂芳基基团各自独立地可选地取代有一个或两个RA或R1取代基。
R1是:1)–H,2)-C1-6烷基,3)-C2-6烯基,4)-C2-6炔基,5)-C3-7环烷基,6)-C3-7环烯基,7)-氟化C1-5,其包含一个或多个氟原子,8)-杂环基,9)-芳基,10)-杂芳基,11)-苯甲基,或12)5-[(3aS,4S,6aR)-2-氧代六氢-1H-噻吩并[3,4-d]咪唑-4-基]戊酰基。在该列表中,所述烷基、所述烯基、所述炔基、所述环烯基、所述全氟化烷基、所述杂环基、所述芳基、所述杂芳基和所述苯甲基基团各自独立地可选地取代有1、2或3个RA或R1取代基,当(R1)和R1连接至氮原子时,它们可选地与所述氮原子结合在一起而形成3~7元环,所述3~7元环可选地包括选自N、O和S的一个或多个其它杂原子,所述环可选地取代有一个或多个R1或RA,
R2是:1)-H,2)-C1-6烷基,3)-SR1,4)-C(O)R1,5)-S(O)R1,6)-S(O)2R1,7)-苯甲基,其可选地取代有1、2或3个RA或R1取代基,8)-L-杂芳基,其可选地取代有一个或多个连接在L和/或杂芳基基团上的RA或R1取代基,9)-L-杂环基,其可选地取代有一个或多个连接在L和/或杂环基基团上的RA或R1取代基,10)-L-芳基,其可选地取代有一个或多个连接在L和/或芳基基团上的RA或R1取代基,11)-杂芳基,其可选地取代有一个或多个RA或R1取代基,或12)-芳基,其可选地取代有一个或多个RA或R1取代基。在该列表中,各取代基如果尚未存在,其可选地连接至所述L基团。
RA是:1)-卤素,2)-CF3,3)-OH,4)-OR1,5)-L-OH,6)-L-OR1,7)-OCF3,8)-SH,9)-SR1,10)-CN,11)-NO2,12)-NH2,13)-NHR1,14)-NR1R1,15)-L-NH2,16)-L-NHR1,17)-L-NR1R1,18)-L-SR1,19)-L-S(O)R1,20)-L-S(O)2R1,21)-C(O)OH,22)-C(O)OR1,23)-C(O)NH2,24)-C(O)NHR1,25)-C(O)N(R1)R1,26)-NHC(O)R1,27)-NR1C(O)R1,28)-NHC(O)OR1,29)-NR1C(O)OR1,30)-OC(O)NH2,31)-OC(O)NHR1,32)-OC(O)N(R1)R1,33)-OC(O)R1,34)-C(O)R1,35)-NHC(O)NH2,36)-NHC(O)NHR1,37)-NHC(O)N(R1)R1,38)-NR1C(O)NH2,39)-NR1C(O)NHR1,40)-NR1C(O)N(R1)R1,41)-NHS(O)2R1,42)-NR1S(O)2R1,43)-S(O)2NH2,44)-S(O)2NHR1,45)-S(O)2N(R1)R1,46)-S(O)R1,47)-S(O)2R1,48)-OS(O)2R1,49)-S(O)2OR1,50)-苯甲基,51)-N3,或52)-C(-N=N-)(CF3)。在该列表中,所述苯甲基基团可选地取代有1、2或3个RA或R1取代基,可选地,所述化合物中的至少一个氢原子被氘取代,可选地,所述化合物连接至固体支持物,所述固体支持物是树脂、聚合物或纤维素,包括聚苯乙烯交联的聚酰胺树脂、琼脂糖珠。
在一个实施方式中,在本文所述的化合物中:
D是CH或N;
Z是–CN;-C(O)OR1;-C(O)N(R1)R3;-C(O)R1,或-杂芳基,所述杂芳基可选地取代有一个或多个RA或R4取代基,
其中,当(R1)和R3连接至氮原子时,它们可选地与所述氮原子结合在一起形成3~7元环,所述3~7元环可选地包括一个或多个选自N、O和S的其它杂原子,所述环可选地取代有一个或多个RA或R4;
W是–CN;–N(R1)R3;-C(O)OR1;-C(O)N(R1)R3;-NR1C(O)R1;-NR1C(O)OR1;-OC(O)N(R1)R3;-OC(O)R1;-C(O)R1;-NR1C(O)N(R1)R3;-NR1S(O)2R1;-苯甲基,其可选地取代有1、2或3个RA或R1取代基;-X-L-(X-L)n–N(R1)R3;-X-L-(X-L)n–杂芳基,其可选地取代有一个或多个连接在L和/或杂芳基基团上的RA或R4取代基;-X-L-(X-L)n-杂环基,其可选地取代有一个或多个连接至L和/或杂环基基团上的RA或R4取代基;-X-L-(X-L)n-芳基,其可选地取代有一个或多个RA或R4取代基;–X-L-(X-L)n-NR1RA或者-(N(R1)-L)n–N+R1R3R5R6-,其中n是等于0、1、2、3、4或5的整数,
并且其中,当R1和R3连接至氮原子时,它们可选地与所述氮原子结合在一起形成3~7元环,所述3~7元环可选地包括一个或多个选自N、O和S的其它杂原子,所述环可选地取代有一个或多个RA或R4;
各个X独立地选自O、S和NR1;
各个L独立地是-C1-6亚烷基;-C2-6亚烯基;-C2-6亚炔基;-C3-7亚环烷基,其可选地包括一个或多个选自N、O和S的其它杂原子;或-C3-7亚环烯基,其可选地包括一个或多个选自N、O和S的其它杂原子;
其中,所述亚烷基、所述亚烯基、所述亚炔基、所述亚环烷基和所述亚环烯基基团各自独立地可选地取代有一个或两个R4或RA取代基;
R1各自独立地是–H、-C1-6烷基、-C2-6烯基、-C2-6炔基、-C3-7环烷基、-C3-7环烯基、-全氟化C1-5、-杂环基、-芳基、-杂芳基或-苯甲基,
其中,所述烷基、所述烯基、所述炔基、所述环烯基、所述全氟化烷基、所述杂环基、所述芳基、所述杂芳基和所述苯甲基基团各自独立地可选地取代有1、2或3个RA或Rd取代基;
R2是-H;-C1-6烷基,其可选地取代有一个或多个RA取代基;-C(O)R4;-L-杂芳基,其可选地取代有一个或多个RA或R4取代基;-L-杂环基,其可选地取代有一个或多个RA或R4;或-L-芳基,其可选地取代有一个或多个RA或R4取代基;
R3各自独立地是–H、-C1-6烷基、-C2-6烯基、-C2-6炔基、-C3-7环烷基、-C3-7环烯基、-全氟化C1-5、-杂环基、-芳基、-杂芳基或-苯甲基,
其中,所述烷基、所述烯基、所述炔基、所述环烷基、所述环烯基、所述全氟化烷基、所述杂环基、所述芳基、所述杂芳基和所述苯甲基基团各自独立地可选地取代有1、2或3个RA或Rd取代基;
R4各自独立地是–H、-C1-6烷基、-C2-6烯基、-C2-6炔基、-C3-7环烷基、-C3-7环烯基、-全氟化C1-5、-杂环基、-芳基、-杂芳基或-苯甲基,
其中,所述烷基、所述烯基、所述炔基、所述环烷基、所述环烯基、所述全氟化烷基、所述杂环基、所述芳基、所述杂芳基和所述苯甲基基团各自独立地可选地取代有1、2或3个RA或Rd取代基;
R5各自独立地是:-C1-6烷基;-C1-6亚烷基-C2-6烯基,其可选地包括一个或多个选自N、O和S的其它杂原子;-C1-6亚烷基-C2-6炔基,其可选地包括一个或多个选自N、O和S的其它杂原子;-L-芳基,其可选地包括一个或多个RA或R4取代基;–L-杂芳基,其可选地包括一个或多个RA或R4取代基;-C1-6亚烷基-C(O)O-;-C1-6亚烷基-C(O)OR1;-C1-6亚烷基-CN;-C1-6亚烷基-C(O)NR1R3,其中R1和R3可选地与所述氮原子结合在一起形成3~7元环,所述3~7元环可选地包括一个或多个选自N、O和S的其它杂原子;或-C1-6亚烷基-OH;
R6是卤素、OC(O)CF3或OC(O)R1;
RA各自独立地是:-卤素、-CF3、-OR1、-L-OR1、-OCF3、-SR1、-CN、-NO2、-NR1R3、-L-NR1R1、-C(O)OR1、S(O)2R4、-C(O)N(R1)R3、-NR1C(O)R1、-NR1C(O)OR1、OC(O)N(R1)R3、-OC(O)R1、-C(O)R4、–NHC(O)N(R1)R3、-NR1C(O)N(R1)R3或-N3;并且
Rd各自独立地是:–H、-C1-6烷基、-C2-6烯基、-C2-6炔基、-C3-7环烷基、-C3-7环烯基、-全氟化C1-5、–苯甲基或-杂环基。
在一个实施方式中,在本文所述的化合物中:
Z是–CN;-C(O)OR1;-C(O)N(R1)R3;或-杂芳基,其可选地取代有一个或多个RA或R4取代基,
W是-CN;–N(R1)R3;-苯甲基,其可选地取代有1、2或3个RA或R1取代基;-X-L-(X-L)n–N(R1)R3;–X-L-(X-L)n-NR1RA;或-(N(R1)-L)n–N+R1R3R5R6-
其中,n是等于0、1、2或3的整数,
并且其中,当R1和R3连接至氮原子时,它们可选地与所述氮原子结合在一起形成3~7元环,所述3~7元环可选地包括一个或多个选自N、O和S的其它杂原子,所述环可选地取代有一个或多个RA或R4;
各个X独立地是O、S或NR1,
L各自独立地是-C1-6亚烷基;-C2-6亚烯基;-C2-6亚炔基;-C3-7亚环烷基,其可选地包括一个或多个选自N、O和S的其它杂原子;或-C3-7亚环烯基,其可选地包括一个或多个选自N、O和S的其它杂原子
其中,所述亚烷基、所述亚烯基、所述亚炔基、所述亚环烷基和所述亚环烯基基团各自独立地可选地取代有一个或两个R4或RA取代基;
R1各自独立地是–H、-C1-6烷基、-C2-6烯基、-C2-6炔基、-C3-7环烷基、-C3-7环烯基、-全氟化C1-5、-杂环基、-杂芳基或-苯甲基,
其中,所述烷基、所述烯基、所述炔基、所述环烷基、所述环烯基、所述全氟化烷基、所述杂环基、所述芳基、所述杂芳基和所述苯甲基基团各自独立地可选地取代有1、2或3个RA或Rd取代基;
R2是-H;-C1-6烷基,其可选地取代有一个或多个RA取代基;-C(O)R4;-L-杂芳基,其可选地取代有一个或多个RA或R4取代基;-L-杂环基,其可选地取代有一个或多个RA或R4;或-L-芳基,其可选地取代有一个或多个RA或R4取代基;
R3各自独立地是–H、-C1-6烷基、-C2-6烯基、-C2-6炔基或-全氟化C1-5,
其中,所述烷基、所述烯基、所述炔基、所述全氟化烷基基团各自独立地可选地取代有1、2或3个RA或Rd取代基;
R4各自独立地是–H、-C1-6烷基、-C2-6烯基、-C2-6炔基、-C3-7环烷基、-C3-7环烯基、-全氟化C1-5、-杂环基、-芳基、-杂芳基或-苯甲基,
其中,所述烷基、所述烯基、所述炔基、所述环烷基、所述环烯基、所述全氟化烷基、所述杂环基、所述芳基、所述杂芳基和所述苯甲基基团各自独立地可选地取代有1、2或3个RA或Rd取代基;
R5各自独立地是:-C1-6烷基;-L-芳基,其可选地包括一个或多个RA或R4取代基;–L-杂芳基,其可选地包括一个或多个RA或R4取代基;-C1-6亚烷基-C(O)O-;-C1-6亚烷基-C(O)OR1;-C1-6亚烷基-CN;-C1-6亚烷基-C(O)NR1R3;或-C1-6亚烷基-OH;
R6是卤素、OC(O)CF3或OC(O)R1;
RA各自独立地是:-卤素、-CF3、-OR1、-L-OR1、-OCF3、-SR1、-CN、-NO2、-NR1R3、-L-NR1R1、-C(O)OR1、S(O)2R4、-C(O)N(R1)R3、-NR1C(O)R1、-NR1C(O)OR1、-OC(O)N(R1)R3、-OC(O)R1、-C(O)R4、–NHC(O)N(R1)R3、-NR1C(O)N(R1)R3或-N3;
Rd各自独立地是:–H、-C1-6烷基、-C2-6烯基、-C2-6炔基、-C3-7环烷基、-C3-7环烯基、-全氟化C1-5、–苯甲基或-杂环基。
在本发明的实施方式中,所述化合物具有以下所示的通式IIA、IIB、IIA’或IIB’。此类化合物的盐或前药也在本发明的化合物的范围内。
在根据以上通式IIA或IIA’的化合物的本发明的实施方式中,W和R2各自如上文定义。
在根据以上通式IIB或IIB’的化合物的本发明的实施方式中,W和R2各自如上文定义,并且Het是杂芳基,该杂芳基可选地取代有一个或多个如上文定义的R1或RA。
在根据以上通式IVA或IVA’的化合物的本发明的实施方式中,W、L、R1和R2各自如上文定义。另外,m、Li、R3和R4各自如上文定义。
在根据以上通式VIA或VIA’的化合物的本发明的实施方式中,Z是CO2Me或2-甲基-2H-四唑-5-基;R2是可选地取代有OMe的苯甲基,3-噻吩基甲基或3-吡啶基甲基;并且W是NH-L-N(R1)R1,其中L是C2-4烷基,R1是C1-4烷基,或者(R1)和R1与它们所连接的氮原子结合在一起形成3~7元环,所述3~7元环可选地包括一个或多个选自N、O和S的其它杂原子,所述环可选地取代有一个或多个R1或RA。
在一个实施方式中,提供一种化合物,其中
D是CH或N
Z是-杂芳基,其可选地取代有一个或多个RA或R1取代基;或
-C(O)OR1,其中R1是-C1-6烷基;
W是–(N(R1)-L)n—N(R1)R1,其中n=1,并且L是-C3-7环烷基或-C1-6烷基;或
–L-NR1(R1),其中L是可选地取代有一个或两个RA或R1取代基的杂环基,条件是-NR1(R1)不与所述杂环基的杂原子结合,并且其中各个R1独立地是H或-C1-6烷基,或者N(R1)R1与所述氮原子结合在一起形成3~7元杂环,所述3~7元杂环可选地取代有一个或多个R1或RA
R2是-H;-L-杂芳基,其可选地在L和/或杂芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基;或-L-芳基,其可选地在L和/或芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基。
在一个实施方式中,Z是-杂芳基,可选地取代有一个或多个RA或R1取代基,优选的是,所述杂环基是5元环,例如四唑基,包括2-甲基-2H-四唑-5-基。
在另一个实施方式中,Z是-C(O)OR1,其中R1是-C1-6烷基,优选的是R1是-C1-3烷基,例如甲基、乙基、丙基和异丙基。
在一个实施方式中,R2是–H。
在一个实施方式中,R2是-L-杂芳基,其可选地在L和/或杂芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基。优选的是,杂芳基是5-6元杂芳基。优选的是,-L-杂芳基是–CH2-杂芳基,例如–CH2-吡啶基或–CH2-噻吩基。
在一个实施方式中,R2是-L-芳基,其可选地在L和/或芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基。优选的是,-L-芳基是取代有一个或多个RA或R1取代基的–CH2-芳基,例如–CH2-苯基。
在一个实施方式中,W是–(N(R1)-L)n—N(R1)R1,其中n=1,并且L是-C3-7环烷基或-C1-6烷基;其中各个R1独立地是H,或-C1-6烷基,或者N(R1)R1与所述氮原子结合在一起形成3~7元杂环,所述3~7元杂环可选地取代有一个或多个R1或RA。
在一个实施方式中,W是–N(R1)-L-N(R1)R1,其中-N(R1)-是-N(H)-或-N(C1-2烷基)-;L是-C5-6环烷基或–C2-4烷基;并且-N(R1)R1是-N(H)C1-2烷基,-N(C1-2烷基)C1-2烷基,或者N(R1)R1与所述氮原子结合在一起形成5或6元杂环,例如哌啶-1基或吡咯烷-1基。
在一个实施方式中,W是–L-NR1(R1),其中L是可选地取代有一个或两个RA或R1取代基的杂环基,条件是-NR1(R1)不与所述杂环基的杂原子结合,并且其中各个R1独立地是H或-C1-6烷基,或者-NR1(R1)与所述氮原子结合在一起形成3~7元杂环,所述3~7元杂环可选地取代有一个或多个R1或RA。
在一个实施方式中,W是–L-NR1(R1),其中L是6元杂环基,例如哌啶-1基,其中各个R1独立地是H或-C1-6烷基,或者-NR1(R1)与所述氮原子结合在一起形成5或6元杂环,例如哌啶-1基或吡咯烷-1基。
在一个实施方式中,W是
在一个实施方式中,提供一种化合物,其中
D是CH或N
Z是-杂芳基,其可选地取代有一个或多个RA或R1取代基;或
-C(O)OR1,其中R1是-C1-6烷基;
W是
–(N(R1)-L)n—N(R1)R1,其中n=1,并且L是-C3-7环烷基或-C1-6烷基;
–L-NR1(R1),其中L是可选地取代有一个或两个RA或R1取代基的杂环基,条件是-NR1(R1)不与所述杂环基的杂原子结合,并且其中各个R1独立地是H或-C1-6烷基,或者(R1)和R1与所述氮原子结合在一起形成3~7元杂环,所述3~7元杂环可选地取代有一个或多个R1或RA;
-(N(R1)-L)n–N+R1R3R5R6-,其中n=1,并且L是-C1-6烷基;其中R1和R3与所述氮原子结合在一起形成5~6元环,R5是-C1-6烷基,并且R6是卤素、OC(O)CF3或OC(O)R1;
-L-芳基,其可选地包括一个或多个RA或R4取代基;
–L-杂芳基,其可选地包括一个或多个RA或R4取代基,
-C1-6亚烷基-C(O)O-,
-C1-6亚烷基-C(O)OR1,
-C1-6亚烷基-CN,
-C1-6亚烷基-C(O)NR1R3,或
-C1-6亚烷基-OH;
R2是-H;-L-杂芳基,其可选地在L和/或杂芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基;或-L-芳基,其可选地在L和/或芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基;
并且当R1和Ra是取代基时,所述R1和Ra优选如下选择:
R1各自独立地是:–H、-C1-6烷基、-C2-6烯基、-C2-6炔基、-C3-7环烷基、-C3-7环烯基、-全氟化C1-5、-杂环基、-杂芳基或-苯甲基
RA各自独立地是:-卤素、-CF3、-OR1、-L-OR1、-OCF3、-SR1、-CN、-NO2、-NR1R3、-L-NR1R1,-C(O)OR1、S(O)2R4、-C(O)N(R1)R3、-NR1C(O)R1、-NR1C(O)OR1、-OC(O)N(R1)R3、-OC(O)R1、-C(O)R4、–NHC(O)N(R1)R3、-NR1C(O)N(R1)R3或-N3,其中R3和R4各自独立地是–H、-C1-6烷基、-C2-6烯基、-C2-6炔基、-C3-7环烷基、-C3-7环烯基、-全氟化C1-5、-杂环基、-杂芳基或-苯甲基。
在一个实施方式中,提供一种化合物,其中,
D是CH或N
Z是-杂芳基,其可选地取代有一个或多个RA或R1取代基;或
-C(O)OR1,其中R1是-C1-6烷基;
W是
–(N(R1)-L)n—N(R1)R1,其中n=1,并且L是-C3-7环烷基或-C1-6烷基;
–L-NR1(R1),其中L是可选地取代有一个或两个RA或R1取代基的杂环基,条件是-NR1(R1)不与所述杂环基的杂原子结合,并且其中各个R1独立地是H或-C1-6烷基,或者(R1)和R1与所述氮原子结合在一起形成3~7元杂环,所述3~7元杂环可选地取代有一个或多个R1或RA
-(N(R1)-L)n–N+R1R3R5R6-,其中n=1,并且L是-C1-6烷基;其中R1和R3与所述氮原子结合在一起形成5~6元环,R5是-C1-6烷基、-C1-6亚烷基-C(O)OR1,并且R6是卤素、OC(O)CF3或OC(O)R1;
R2是-H;-L-杂芳基,其可选地在L和/或杂芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基;或-L-芳基,其可选地在L和/或芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基;
并且当R1和Ra是取代基时,所述R1和Ra优选如下选择:
R1各自独立地是–H、-C1-6烷基或-C3-7环烷基,
RA各自独立地是-卤素、-CF3、-C1-6烷氧基、-CN、-NO2。
在一个实施方式中,提供一种化合物,其中
D是CH或N
Z是-杂芳基,其可选地取代有一个或多个RA或R1取代基;或
-C(O)OR1,其中R1是-C1-6烷基;
W是
–(N(R1)-L)n—N(R1)R1,其中n=1,并且L是-C3-7环烷基或-C1-6烷基;或
–L-NR1(R1),其中L是可选地取代有一个或两个RA或R1取代基的杂环基,条件是-NR1(R1)不与所述杂环基的杂原子结合,并且其中各个R1独立地是H或-C1-6烷基,或者(R1)和R1与所述氮原子结合在一起形成3~7元杂环,所述3~7元杂环可选地取代有一个或多个R1或RA;
R2是-H;-L-杂芳基,其可选地在L和/或杂芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基;或-L-芳基,其可选地在L和/或芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基;
并且当R1和Ra是取代基时,所述R1和Ra优选如下选择:
R1各自独立地是–H、-C1-6烷基、-C2-6烯基、-C2-6炔基、-C3-7环烷基、-C3-7环烯基、-全氟化C1-5、-杂环基、-杂芳基或-苯甲基
RA各自独立地是:-卤素、-CF3、-OR1、-L-OR1、-OCF3、-SR1、-CN、-NO2、-NR1R3、-L-NR1R1,-C(O)OR1、S(O)2R4、-C(O)N(R1)R3、-NR1C(O)R1、-NR1C(O)OR1、-OC(O)N(R1)R3、-OC(O)R1、-C(O)R4、–NHC(O)N(R1)R3、-NR1C(O)N(R1)R3或-N3,其中R3和R4各自独立地是–H、-C1-6烷基、-C2-6烯基、-C2-6炔基、-C3-7环烷基、-C3-7环烯基、-全氟化C1-5、-杂环基、-杂芳基或-苯甲基。
在一个实施方式中,提供一种化合物,其中
D是CH;
Z是-杂芳基,其可选地取代有一个或多个RA或R1取代基;或
-C(O)OR1,其中R1是-C1-6烷基;
W是–(N(R1)-L)n—N(R1)R1,其中n=1,并且L是-C3-7环烷基或-C1-6烷基;或
–L-NR1(R1),其中L是可选地取代有一个或两个RA或R1取代基的杂环基,条件是-NR1(R1)不与所述杂环基的杂原子结合,并且其中各个R1独立地是H或-C1-6烷基,或者N(R1)R1与所述氮原子结合在一起形成3~7元杂环,所述3~7元杂环可选地取代有一个或多个R1或RA
R2是-H;-L-杂芳基,其可选地在L和/或杂芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基;或-L-芳基,其可选地在L和/或芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基。
在一个实施方式中,提供一种化合物,其中
D是N
Z是-杂芳基,其可选地取代有一个或多个RA或R1取代基;或
-C(O)OR1,其中R1是-C1-6烷基;
W是–(N(R1)-L)n-N(R1)R1,其中n=1,并且L是-C3-7环烷基或-C1-6烷基;或
–L-NR1(R1),其中L是可选地取代有一个或两个RA或R1取代基的杂环基,条件是-NR1(R1)不与所述杂环基的杂原子结合,并且其中各个R1独立地是H或-C1-6烷基,或者N(R1)R1与所述氮原子结合在一起形成3~7元杂环,所述3~7元杂环可选地取代有一个或多个R1或RA
R2是-H;-L-杂芳基,其可选地在L和/或杂芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基;或-L-芳基,其可选地在L和/或芳基基团上取代有一个或多个RA或R1取代基,其中L是C1-6烷基。
在一个实施方式中,提供一种化合物,其中
D是CH或N
Z是-杂芳基,优选为可选地取代有一个或多个RA或R1取代基的5元环的杂芳基,例如四唑基;或-C(O)OR1,其中R1是-C1-6烷基,优选的是R1为-C1-3烷基,例如甲基、乙基、丙基和异丙基,优选甲基;
W是–N(R1)-L-N(R1)R1,其中-N(R1)-是-N(H)-或-N(C1-2烷基)-;L是-C5-6环烷基或–C2-4烷基;并且-N(R1)R1是-N(H)C1-2烷基,-N(C1-2烷基)C1-2烷基,或者N(R1)R1与所述氮原子结合在一起形成5或6元杂环,例如哌啶-1基或吡咯烷-1基;或
–L-NR1(R1),其中L是6元杂环基,例如哌啶-1基,其中各个R1独立地是H或-C1-6烷基,或者-NR1(R1)与所述氮原子结合在一起形成5或6元杂环,例如哌啶-1基或吡咯烷-1基;
R2是-H;-L-杂芳基,其可选地在L和/或杂芳基基团上取代有一个或多个RA或R1取代基,其中所述杂芳基是5-6元杂芳基,例如吡啶基或噻吩基,并且L是C1-3烷基;或-L-芳基,其可选地在L和/或芳基基团上取代有一个或多个RA或R1取代基,其中所述芳基是苯基并且L是C1-3烷基。
在一个实施方式中,提供一种化合物,其中
D是CH或N
Z是5元环的杂芳基(例如四唑基),其可选地取代有-C1-6烷基,例如甲基;或
-C(O)OR1,优选的是R1是-C1-3烷基,并且优选甲基;
W选自W1-W21,并且优选W1和W16;
R2是–CH2-杂芳基,例如–CH2-吡啶基或–CH2-噻吩基;或者–CH2-芳基,例如–CH2-苯基;所述杂芳基和芳基各自可选地被一个RA取代。
在一个实施方式中,提供一种化合物,其中
D是CH或N
Z是5元四唑基环的杂芳基,其可选地取代有甲基;或
-C(O)OR1,其中R1是甲基;
W选自W1和W16
R2是–CH2-杂芳基,例如–CH2-吡啶基或–CH2-噻吩基;或者–CH2-芳基,例如–CH2-苯基;所述杂芳基和芳基各自可选地被一个RA取代,所述RA优选地选自–卤素、C1-6烷氧基-(例如甲氧基)、羟基或C1-6烷基(例如甲基)。
在一个实施方式中,提供一种化合物,其中
D是CH或N
Z是5元四唑基环的杂芳基,其可选地取代有甲基;或
-C(O)OR1,其中R1是甲基;
W选自W1和W16
R2是–CH2-杂芳基,例如–CH2-吡啶基或–CH2-噻吩基;或者–CH2-芳基,例如–CH2-苯基;所述杂芳基和芳基各自可选地被一个RA取代,所述RA优选地选自–卤素、C1-6烷氧基-(例如甲氧基)、羟基或C1-6烷基(例如甲基)。
在一个实施方式中,提供一种化合物,其中
D是CH;
Z是5元环的杂芳基(例如四唑基),其可选地取代有-C1-6烷基,例如甲基;或
-C(O)OR1,优选的是R1为-C1-3烷基,并且优选甲基;
W选自W1-W21,并且优选W1和W16
R2是–CH2-杂芳基,例如–CH2-吡啶基或–CH2-噻吩基;或者–CH2-芳基,例如–CH2-苯基;所述杂芳基和芳基各自可选地取代有一个或多个RA或R1取代基,并且优选的是未取代或者取代有一个RA,所述RA选自–卤素、C1-6烷氧基-(例如甲氧基)、羟基或C1-6烷基(例如甲基)。
在一个实施方式中,提供一种化合物,其中
D是N
Z是5元环的杂芳基(例如四唑基),其可选地取代有-C1-6烷基,例如甲基;或
-C(O)OR1,优选的是R1是-C1-3烷基,并且优选甲基;
W选自W1-W21,并且优选W1和W16
R2是–CH2-杂芳基,例如–CH2-吡啶基或–CH2-噻吩基;或者–CH2-芳基,例如–CH2-苯基;所述杂芳基和芳基各自可选地取代有一个或多个RA或R1取代基,并且优选的是未取代或者取代有一个RA,所述RA选自–卤素、C1-6烷氧基-(例如甲氧基)、羟基或C1-6烷基(例如甲基)。
在一个实施方式中,提供一种化合物,其中
D是CH
Z是-C(O)OR1,其中R1是-C1-3烷基,并且优选甲基;
W选自W1-W21,并且优选W1和W16;
R2是–CH2-杂芳基,例如–CH2-吡啶基或–CH2-噻吩基;或者–CH2-芳基,例如–CH2-苯基;所述杂芳基和芳基各自未取代或者取代有一个RA,所述RA选自–卤素、C1-6烷氧基-(例如甲氧基)、羟基或C1-6烷基(例如甲基)。
在一个实施方式中,提供一种化合物,其中
D是N
Z是-C(O)OR1,其中R1是-C1-3烷基,并且优选甲基;
W选自W1-W21,并且优选W1和W16;
R2是–CH2-杂芳基,例如–CH2-吡啶基或–CH2-噻吩基;或者–CH2-芳基,例如–CH2-苯基;所述杂芳基和芳基各自未取代或者取代有一个RA,所述RA选自–卤素、C1-6烷氧基-(例如甲氧基)、羟基或C1-6烷基(例如甲基)。
在本发明的实施方式中,本发明的化合物是描述于下文表1中的化合物和描述于下文表1’中的化合物。此类化合物的盐或前药也在本发明的化合物的范围内。
定义:
除非另外规定,适用以下定义:
单数形式“a”、“an”和“the”包括对应的复数指代,除非上下文另外明确指出。
如本文所用,术语“包含”旨在表示跟随词语“包含”的列举要素是必要或强制性的,但是其它要素是可选的,可以存在或可以不存在。
如本文所用,术语“由……组成”旨在表示包括并且限制为跟随短语“由……组成”的任何要素。因此短语“由……组成”表示所列出要素是必要或强制性的,并且不可以存在其它要素。
如本文所用,术语“烷基”旨在包括具有特定数量碳原子的支链和直链的饱和脂肪族烃基,例如C1-C6烷基中的C1-C6定义为包括以直链或支链饱和排列的具有1、2、3、4、5或6个碳的基团。以上定义的C1-C6烷基的实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、戊基和己基。
如本文所用,术语“环烷基”旨在表示其中具有特定数量的碳原子的单环饱和脂肪族烃基,例如C3-C7环烷基中的C3-C7定义为包括以单环饱和排列的具有3、4、5、6或7个碳的基团。以上定义的C3-C7环烷基的实例包括但不限于环丙基、环丁基、环戊基、环己基和环庚基。
如本文所用,术语“烯基”旨在表示不饱和直链或支链烃基,其中具有特定数量的碳原子并且其中至少两个碳原子以双键彼此键合,并且具有E或Z区域化学及其组合。例如,C2-C6烯基中的C2-C6定义为包括以直链或支链排列的具有2、3、4、5或6个碳、至少两个碳原子以双键键合在一起的基团。C2-C6烯基的实例包括但不限于乙烯基(vinyl)、1-丙烯基、2-丙烯基和1-丁烯基等。
如本文所用,术语“炔基”旨在表示其中具有特定数量的碳原子并且其中至少两个碳原子以三键彼此键合的不饱和直链或支链烃基。例如C2-C4炔基定义为包括链中具有2、3或4个碳原子、至少两个碳原子以三键键合在一起的基团。此类炔基的实例包括但不限于乙炔基、1-丙炔基和2-丙炔基等。
如本文所用,术语“环烯基”旨在表示其中具有特定数量的碳原子的单环饱和脂肪族烃基,例如C3-C7环烯基中的C3-C7定义为包括以单环排列的具有3、4、5、6或7个碳的基团。以上定义的C3-C7环烯基的实例包括但不限于环戊烯基和环己烯基等。
如本文所用,术语“卤”或“卤素”旨在表示氟、氯、溴或碘。
如本文所用,术语“卤代烷基”旨在表示其中每个氢原子可以依次被卤素原子取代的如上定义的烷基。卤代烷基的实例包括但不限于CH2F、CHF2和CF3。
如本文所用,术语“芳基”,单独或者与另一基团组合,表示含有6个碳原子的碳环芳香族单环基团,其可以进一步稠合至可以为芳香族、饱和或不饱和的第二个5或6元碳环基团。芳基的实例包括但不限于苯基、茚满基、1-萘基、2-萘基和四氢萘基等。芳基可以连接至在环烷基环或芳香族环上的合适位置的另一基团。
如本文所用,术语“杂芳基”旨在表示至多10个原子的单环或双环系统,其中至少一个环是芳香环,并且含有1~4个选自由O、N和S组成的组的杂原子。杂芳基可以经由杂原子之一或环碳原子连接。杂芳基的实例包括但不限于噻吩基、苯并咪唑基、苯并[b]噻吩基、呋喃基、苯并呋喃基、吡喃基、异苯并呋喃、色烯基、呫吨基、2H-吡咯基、吡咯基、咪唑基、吡唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、吲嗪基、异吲哚基、3H-吲哚基、吲哚基、吲唑基、嘌呤基、4H-喹嗪基、异喹啉基、喹啉基、酞嗪基、萘啶基、喹喔啉基、喹唑啉基、噌啉基、蝶啶基、异噻唑基、异色满基、色满基、异噁唑基、呋咱基、二氢吲哚基、异二氢吲哚基、噻唑并[4,5-b]-吡啶、四唑基、噁二唑基、噻二唑基、噻吩基和荧光素衍生物。
如本文所用,术语“杂环”、“杂环的”或“杂环基”旨在表示含有1~4个选自由O、N和S组成的组中的杂原子的3、4、5、6或7元非芳香族环体系。杂环的实例包括但不限于吡咯烷基、四氢呋喃基、哌啶基、3,5-二甲基哌啶基、吡咯啉基、哌嗪基、咪唑烷基、吗啉基、咪唑啉基、吡唑烷基和吡唑啉基等,其中,与环的连接可以在环的氮原子或碳原子上,例如下文所述:
如本文所用,术语“可选地取代有一个或多个取代基”或其等效术语“可选地取代有至少一个取代基”旨在表示后述的情况事件可以发生或可以不发生,并且该描述包括其中所述情况事件发生的情况和其不发生的情况。该定义旨在表示0~5个取代基。
如本文所用,术语“对象”或“患者”旨在表示人和非人哺乳动物,例如灵长类、猫、狗、猪、牛、绵羊、山羊、马、兔、大鼠和小鼠等。
如果取代基自身与本文所述的合成方法不相容,取代基可以用对于这些方法中使用的反应条件而言稳定的合适的保护基(PG)进行保护。保护基可以在所述方法的反应过程中的适当时间点除去,从而提供期望的中间体或目标化合物。合适的保护基以及使用此类合适的保护基将不同的取代基保护和去保护的方法是本领域技术人员公知的;其实例可以见于T.Greene和P.Wuts,“Protecting Groups in Chemical Synthesis”(4th ed.),John Wiley&Sons,NY(2007),此处通过援引并入其全部内容。通篇使用的保护基的实例包括但不限于Fmoc、Bn、Boc和CBz。在一些情况下,取代基可以特别选择为在本文所述方法中使用的反应条件下是反应性的。在这些情况下,反应条件将所选择的取代基转化成可用于在本文所述方法中的中间体化合物的另一取代基或者作为在目标化合物中的期望取代基的另一取代基。
本文所指化合物的“盐”优选是药学上可接受的盐。如本文所用,术语“药学上可接受的盐”旨在表示酸加成盐和碱加成盐。
如本文所用,术语“药学上可接受的酸加成盐”旨在表示保持游离碱的生物功效和性质的那些盐,其不是生物学上或者其他方面不期望的,并且其用无机酸和有机酸形成,所述无机酸例如盐酸、氢溴酸、硫酸、硝酸和磷酸等,所述有机酸例如乙酸、三氟乙酸、丙酸、乙醇酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸和水杨酸等。
如本文所用,术语“药学上可接受的碱加成盐”旨在表示保持游离酸的生物功效和性质的那些盐,其不是生物学上或其他方面不期望的。这些盐由无机碱或有机碱对游离酸的加成而制备。衍生自无机碱的盐包括但不限于钠、钾、锂、铵、钙、镁、铁、锌、铜、锰和铝盐等。衍生自有机碱的盐包括但不限于下述的盐:伯胺、仲胺和叔胺,取代胺,包括天然存在的取代胺、环状胺和碱性离子交换树脂,例如异丙胺、三甲基胺、二乙基胺、三乙基胺、三丙基胺、乙醇胺、2-二甲基氨基乙醇、2-二乙基氨基乙醇、二环己基胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、海巴明、胆碱、甜菜碱、乙二胺、葡糖胺、甲基葡糖胺、可可碱、嘌呤、哌嗪、哌啶、N-乙基哌啶和多胺等。
本发明的化合物或其药学上可接受的盐可以含有一个或多个不对称中心、手性轴和手性面,因此可以产生对应异构体、非对应异构体和其它立体异构形式,并且可以根据绝对立体化学来定义,例如(R)-或(S)-,或者(D)-或(L)(对于氨基酸)。其旨在包括所有此类可能的异构体,以及其外消旋形式和光学纯形式。光学活性(+)和(-)、(R)-和(S)-或者(D)-和(L)-异构体可以使用手性合成子或者手性试剂制备,并且使用诸如反相HPLC等常规技术解析。可以制备外消旋混合物,其后分离成单独的光学异构体,或者这些光学异构体可以通过手性合成来制备。对映异构体可以通过本领域技术人员公知的方法解析,例如通过形成非对映异构体盐,其然后可以通过结晶、气相-液相或者液相色谱、一种对映异构体与对映异构体特异性试剂的选择性反应来分离。本领域技术人员还会认识到,当所期望的对映异构体通过分离技术转化成另一化学实体时,则需要另外的步骤来形成所需的对映异构形式。另选的特定对映异构体可以通过使用光学活性试剂、物质、催化剂或溶剂的不对称合成或者通过利用不对称转化将一种对映异构体转化成另一种来合成。
本发明的特定化合物可以作为差向异构体的混合物而存在。差向异构体是指在各化合物中存在的两个以上立体中心中的仅一个处具有相反构象的非对映异构体。
本发明的化合物可以以两性离子形式存在,并且其包括这些化合物的两性离子形式及其混合物。
另外,本发明的化合物还可以以水合和无水形式存在。包括本文所述的任何化学式的化合物的水合物。在另一个实施方式中,根据本文所述的任何化学式的化合物是一水合物。在本发明的实施方式中,本文所述化合物包含约10重量%以下、约9重量%以下、约8重量%以下、约7重量%以下、约6重量%以下、约5重量%以下、约4重量%以下、约3重量%以下、约2重量%以下、约1重量%以下、约0.5重量%以下、约0.1重量%以下的水。在其它实施方式中,本文所述化合物包含约0.1重量%以上、约0.5重量%以上、约1重量%以上、约2重量%以上、约3重量%以上、约4重量%以上、约5重量%以上或者约6重量%以上的水。
可以方便或者理想地制备、纯化和/或处理前药形式的化合物。因此,如本文所用的术语“前药”涉及当代谢(例如在体内)时产生所期望的活性化合物的化合物。通常而言,前药是无活性的,或者与所期望的活性化合物相比活性较低,但是可以提供有利的处理、施用或代谢性质。除非另外规定,提及特定化合物也包括其前药。
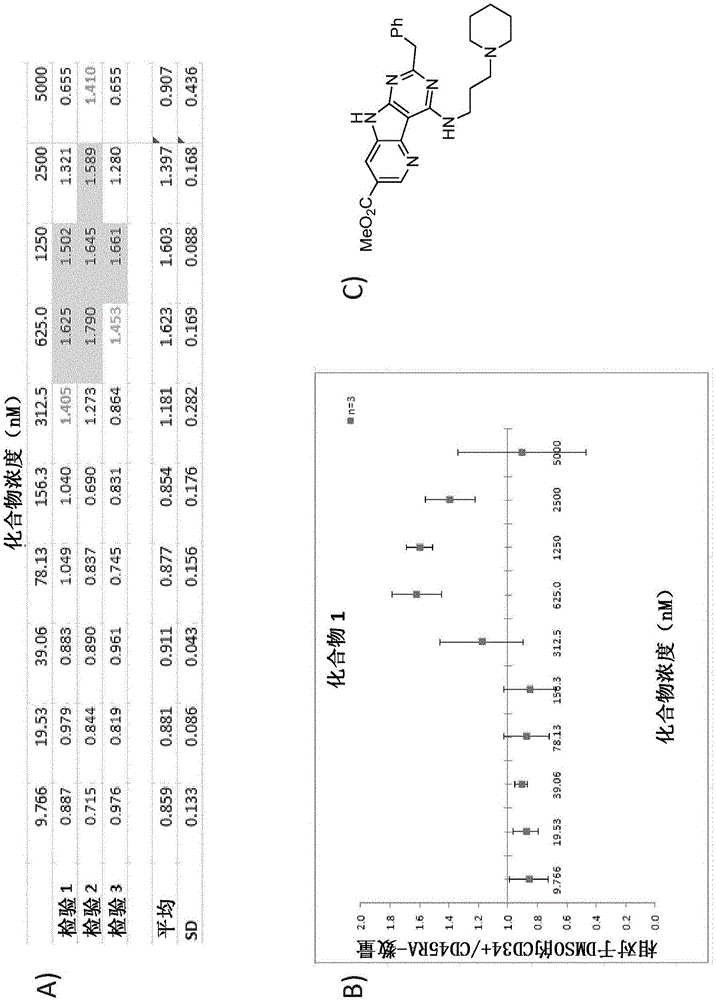
如本文所用,术语“EC50”旨在表示产生与载体培养物(DMSO)相比的CD34+CD45RA-细胞计数增加50%的浓度。
如本文所用,术语“造血干细胞”或“HSC”旨在表示具有允许其分化成功能成熟细胞的多能性和在保持其多能性的同时再生(自我更新)能力的细胞,所述功能成熟细胞例如粒细胞(例如早幼粒细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、红细胞(例如网织红细胞、红细胞)、凝血细胞(例如原巨核细胞、血小板产生原巨核细胞、血小板)和单核细胞(例如单核细胞、巨噬细胞)。
如本文所用,术语“造血祖细胞”或“HPC”旨在表示具有分化成功能成熟细胞的潜能的细胞,所述功能成熟细胞例如粒细胞(例如早幼粒细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、红细胞(例如网织红细胞、红细胞)、凝血细胞(例如巨核细胞、血小板产生巨核细胞、血小板)和单核细胞(例如单核细胞、巨噬细胞)。
HSC和/或HPC是起始细胞群的一部分。这些细胞可选地从身体或者含有造血源的细胞的身体的器官而获得。此类来源包括未分级分离的骨髓、脐带、外周血、肝、胸腺、淋巴和脾。所有上述粗品或未分级分离的血液产品可以以本领域技术人员已知的方式富集具有造血干细胞特征的细胞。
如本文所用,术语“起始细胞群”如本领域已知,是指鉴定包含从上述各种来源之一收集的HSC和/或HPC的细胞群。起始细胞群可以富集CD34+细胞,所述CD34+细胞是指基于细胞表面标记物CD34+的存在而选择的细胞群。CD34+细胞可以使用例如流式细胞术和荧光标记的抗-CD34抗体来检测和计数。此外,起始细胞群可以直接使用以用于扩增或冷冻和储存以在其后的时间点使用。
造血期间,HSC首先分化成祖细胞阶段成为髓细胞样谱系和淋巴样谱系,然后分别分化成髓细胞样干细胞(混合的集落形成细胞,CFU-GEMM)和分化成淋巴样干细胞。此外,髓细胞样干细胞经由红细胞样爆发形成细胞(BFU-E)和红细胞样集落形成细胞(CFU-E)而分化成红细胞,经由巨核细胞集落形成细胞(CFU-MEG)而分化成凝血细胞,经由粒细胞-巨噬细胞集落形成细胞(CFU-GM)而分化成单核细胞、嗜中性粒细胞和嗜碱性粒细胞,并且经由嗜酸性粒细胞集落形成细胞(CFU-Eo)而分化成嗜酸性粒细胞,同时淋巴样干细胞经由T淋巴样祖细胞分化成T细胞,并且经由B淋巴样祖细胞分化成B细胞。这些骨髓样干细胞和由其衍生的各种造血祖细胞通过在各种细胞因子的存在下它们在软琼脂或半固体甲基纤维素培养基等上形成的集落的性质来鉴定。
本发明还包括根据本发明的如本文定义的化合物或其盐在制备用于治疗患有以下非限制性列表的疾病的对象(或患者)的药物中的应用:患有上述疾病或者患有自体免疫疾病的对象(或患者)的自体或异体移植或治疗。造血功能恶性肿瘤/障碍和先天性疾病的实例可以包括但不限于:急性骨髓性白血病、急性淋巴细胞性白血病、慢性骨髓性白血病、慢性淋巴细胞白血病、骨髓增生性疾病、骨髓增生异常综合征、多发性骨髓瘤、非霍奇金淋巴瘤、霍奇金病、再生障碍性贫血、纯红细胞再生障碍、血红蛋白尿、范可尼贫血、地中海贫血、镰状细胞贫血、威斯科特-奥尔德里奇综合征、先天性代谢缺陷(特别例如戈谢病)。可以获益于移植的免疫疾病的实例有许多,包括多发性硬化、狼疮、特定形式的关节炎和严重联合免疫缺陷症等。
因此,本发明涵盖了对患有任一种上述疾病/恶性肿瘤的患者施用使用本发明化合物扩增的HSC和/或HPC。
此外,所述的化合物和组合物可用于以下非限制性设施:患有上述疾病或者患有自体免疫疾病的对象(或患者)的自体或异体移植或治疗。造血功能恶性肿瘤/障碍和先天性疾病的实例可以包括但不限于:急性骨髓性白血病、急性淋巴细胞性白血病、慢性骨髓性白血病、慢性淋巴细胞白血病、骨髓增生性疾病、骨髓增生异常综合征、多发性骨髓瘤、非霍奇金淋巴瘤、霍奇金病、再生障碍性贫血、纯红细胞再生障碍、血红蛋白尿、范可尼贫血、地中海贫血、镰状细胞贫血、威斯科特-奥尔德里奇综合征、先天性代谢缺陷(特别例如戈谢病)。可以获益于移植的免疫疾病的实例有许多,包括多发性硬化、狼疮、特定形式的关节炎和严重联合免疫缺陷症等。
因此,本发明涵盖了对患有任一种上述疾病/恶性肿瘤的患者施用使用本发明化合物扩增的HSC和/或HPC。
还涵盖在本发明内的是使用根据本发明的本文所述方法扩增后获得的细胞群。造血干细胞和造血祖细胞可以收获自成体、脐带血、胎儿或胚胎来源。使用根据本发明的方法的细胞扩增可以导致祖细胞数量的增加,其可用于加快例如嗜中性粒细胞或血小板植入的时间。此类方法包括:使包含HSC和/或HPC的起始群体与能够增加HSC和/或HPC的数量的试剂接触。所述起始群体可以富含所关注的细胞表面标记物或其组合(例如CD34+、CD34+CD45RA+/-)。
扩增HSC和/或HPC的方法
因此本发明涉及扩增HSC和/或HPC的方法,所述方法包括:(a)提供包含HSC和/或HPC的起始细胞群,和(b)在对于扩增HSC和/或HPC而言合适的条件下离体接触所述起始细胞群。
在一个实施方式中,扩增HSC和/或HPC的方法包括:(a)提供包含HSC和/或HPC的起始细胞群,和(b)在本发明的化合物或组合物的存在下离体接触所述起始细胞群。
细胞群可以首先进行富集或纯化步骤,包括基于特定的细胞标记物阴性和/或阳性选择细胞以提供起始细胞群。基于特定的细胞标记物分离所述起始细胞群的方法可以使用荧光激活的细胞分选(FACS)技术(也称为流式细胞术)或者结合有与特定的细胞标记物相互作用的抗体或配体的固体或不溶性基底。例如,细胞可以与含有所述抗体的固体基底(例如珠的柱、烧瓶、磁性颗粒)接触,并且除去任何未结合的细胞。当使用包含磁性或顺磁性珠的固体基底时,可以通过磁性分离器容易地分离与所述珠结合的细胞。
在一个实施方式中,所述起始细胞群富含CD34+细胞。用于使血液细胞群富含CD34+细胞的方法包括可由Miltenyi Biotec(CD34+直接分离试剂盒,Miltenyi Biotec,Bergisch,Gladbach,德国)或由Baxter(Isolex 3000)市售的试剂盒。
来自一个新生儿的脐带血的量经常是不足以治疗成人或者稍大的儿童。使用本发明的化合物或组合物的扩增方法的一个优点在于其能够从一个脐带血单位产生足够量的HSC和/或HPC。
因此,在一个实施方式中,起始细胞群衍生自已富含CD34+细胞的新生儿脐带血细胞。在一个相关实施方式中,所述起始细胞群衍生自一个或两个脐带血单位。
在另一实施方式中,起始细胞群衍生自已富含CD34+细胞的人类动员外周血细胞。在一个相关实施方式中,所述起始细胞群衍生自从仅仅一个患者分离的人类动员外周血细胞。
所述起始细胞群可以优选含有至少50%CD34+细胞,在一些实施方式中,大于90%CD34+细胞。
起始细胞群扩增的培养条件会根据起始细胞群、所需最终数量的细胞和所需最终比例的HSC和/或HPC而不同。
在一个实施方式中,具体而言,使用来自富含CD34+细胞的脐带血细胞的起始细胞群,所述培养条件包括使用对于HSC/HPC扩增而言通常本领域已知的其它细胞扩增因子,例如细胞因子和生长因子。此类细胞因子和生长因子可以是生物制品或小分子,并且它们包括但不限于IL-1、IL-3、IL-6、IL-11、G-CSF、GM-CSF、SCF、FlT3-L、促血小板生成素(TPO)、促红细胞生成素和它们的类似物。如本文所用,“类似物”包括细胞因子和生长因子的具有与天然存在的形式一样的生物活性的变体,包括但不限于,当与天然存在的形式比较时具有增强或降低的生物活性的变体,或者细胞因子受体激动剂,例如针对TPO受体的激动剂抗体(例如,如专利公报WO 2007/145227中详述的VB22B sc(Fv)2等等)。选择细胞因子和生长因子的组合来扩增HSC和祖细胞,同时限制终末分化的细胞的产生。在一个具体实施方式中,一种或多种细胞因子和生长因子选自由SCF、Flt3-L和TPO组成的组。
人IL6或白细胞介素-6,也称为B细胞刺激因子2,已经由(Kishimoto,Ann.review of 1mm.23:1 2005)描述,并且商业上可获得。人SCF或干细胞因子,也称为c-kit配体、肥大细胞生长因子或青灰因子(Steel factor)已经描述于(Smith,M A et al.,ACTA Haematologica,105,3:143,2001),并且商业上可获得。Flt3-L或FLT-3配体,也称为FL,是与flt3-受体结合的因子。其已经描述于(Hannum C,Nature 368(6472):643-8),并且商业上可获得。TPO或促血小板生成素,也称为巨核细胞生长因子(MGDF)或c-Mpl配体已经描述于(Kaushansky K(2006).N.Engl.J.Med.354(19):2034-45),并且商业上可获得。
在另一具体实施方式中,一种或多种细胞因子和生长因子选自由SCF、Flt3-L、TPO和IL6组成的组。在另一具体实施方式中,一种或多种细胞因子和生长因子选自由SCF、Flt3-L、TPO、IL6和IL3组成的组。
上述化学成分和生物成分不仅可以通过将其加入培养基而使用,还可以通过将其固定在用于培养的基底或支持体的表面上而使用,更具体而言,通过将待用成分溶解在合适的溶剂中,用所得溶液涂布所述基底或支持体,然后洗涤掉过量的成分。可以将此类待用成分添加至预先用与所述成分结合的物质涂布的基底或支持体。
HSC的扩增可以根据成分在天然培养基、半合成培养基或合成培养基中进行,并且根据形状可以是固体培养基、半固体培养基或液体培养基,以及用于造血干细胞和/或造血祖细胞培养的任何营养培养基,其可以补充有上述细胞扩增因子的混合物。此类培养基通常包括钠、钾、钙、镁、磷、氯、氨基酸、维生素、细胞因子、激素、抗生素、血清、脂肪酸或糖等。在培养中,可以根据情况需要单独或组合引入其它化学成分或生物成分。此类引入培养基中的成分可以是胎牛血清、人血清、马血清、胰岛素、转铁蛋白、乳铁蛋白、胆固醇、乙醇胺、亚硒酸钠、一硫代甘油、2-巯基乙醇、胎牛血清白蛋白、丙酮酸钠、聚乙二醇、各种维生素、各种氨基酸、琼脂、琼脂糖、胶原、甲基纤维素、各种细胞因子或各种生长因子等。适合于扩增HSC的方法的此类基础培养基的实例包括但不限于:StemSpanTMSerum-Free Expansion Medium(SFEM)(StemCell Technologies,Vancouver,Canada)、StemSpanTMH3000-Defined Medium(StemCell Technologies,Vancouver,Canada)、CellGroTM、SCGM(CellGenix,Freiburg Germany)、StemProTM-34SFM(Invitrogen)、达尔伯克氏改良伊格尔培养基(Dulbecco's Modified Eagles's Medium)(DMEM)、Ham's Nutrient Mixture H12Mixture F12、McCoy's 5A培养基、伊格尔最小必需培养基(Eagles's Minimum Essential Medium)(EMEM)、αMEM培养基(α改良伊格尔最小必需培养基)、RPMI1640培养基、Isocove's Modified Dulbecco's Medium(IMDM)、StemPro34(Invitrogen)、X-VIVO 10(Cambrex)、X-VIVO 15(Cambrex)和Stemline II(Sigma-Aldrich)。
在一个实施方式中,本发明的化合物或组合物在起始细胞群的扩增方法期间在适合于HSC和/或HPC扩增的浓度下施用。在一个具体实施方式中,所述化合物或组合物以1~3000nmol或者例如1~100nmol的浓度施用。
在其中起始细胞群基本上由来自一个或两个脐带血单位或者来自动员PB细胞或者来自收集的骨髓的富含CD34+的细胞组成的一个具体实施方式中,使细胞在用于HSC和/或HPC扩增的条件下生长例如2~21天和/或直到指定的倍数扩增,并且获得特征细胞群。在一个具体实施方式中,使细胞在用于HSC和/或HPC扩增的条件下离体生长不超过21天、12天、10天或7天。
然后洗涤细胞群以除去本发明的化合物或组合物,和/或细胞培养物中的其它成分,并重悬于合适的细胞悬浮培养基中以供短期使用或重悬于长期储存培养基中,例如适合冷冻保存的培养基。
HSC和/或HPC可以在通常用于动物细胞培养的培养容器中培养,例如陪替氏培养皿、烧瓶、塑料袋、TeflonTM袋,可选地在预先用细胞外基质或细胞粘附分子涂布之后。用于此类涂布的材料可以是胶原Ito XIX、纤连蛋白、玻连蛋白、层粘连蛋白1至12、氮、腱生蛋白、血小板反应蛋白、血管性血友病因子、骨桥蛋白、纤维蛋白原、各种弹性蛋白、各种蛋白聚糖、各种钙粘蛋白、桥粒芯胶粘蛋白、桥粒芯蛋白、各种整联蛋白、E-选择蛋白、P-选择蛋白、L-选择蛋白、免疫球蛋白超家族、基质胶、聚-D-赖氨酸、聚-L-赖氨酸、几丁质、壳聚糖、琼脂糖、海藻酸凝胶、水凝胶或其片段。此类涂布材料可以是具有人工修饰氨基酸序列的重组材料。造血干细胞和/或造血祖细胞可以通过使用生物反应器来培养,所述生物反应器可以机械地控制培养基组成和pH等,并且获得高浓度的培养物(Schwartz R M,Proc.Natl.Acad.Sci.U.S.A.,88:6760,1991;Koller M R,Bone Marrow Transplant,21:653,1998;Koller,M R,Blood,82:378,1993;Astori G,Bone Marrow Transplant,35:1101,2005)。
本发明还提供具有扩增的HSC和/或HPC的细胞群,其能够通过上述扩增方法获得,或者通过上述扩增方法获得。在一个具体实施方式中,将此类细胞群重悬于适合对哺乳动物宿主施用的药学上可接受的介质中,由此提供治疗组合物。
本发明还提供用于在哺乳动物对象中自体或异体干细胞移植的具有扩增的HSC和/或HPC的细胞群或其组合物。
本文所指的对象例如是骨髓供体或者具有或处于血液细胞水平耗尽或血液细胞水平有限的风险的个体。可选地,对象是骨髓收集之前的骨髓供体或者骨髓收集之后的骨髓供体。对象可选地是骨髓移植的接收者。本文所述方法特别可用于具有有限的骨髓储备的对象,例如老年对象或者之前暴露于免疫耗尽治疗或清髓性治疗(例如化疗)的对象,例如用于治疗白血病或淋巴瘤。与对照血液细胞水平相比,对象可选地具有降低的血液细胞水平,或者处于发展降低的血液细胞水平的风险。如本文所用,术语“对照血液细胞水平”是指在改变对象的血液细胞水平的事件之前或者实质上不存在该事件的对象中的血液细胞平均水平。改变对象的血液细胞水平的事件包括例如贫血、创伤、化疗、骨髓移植和放射疗法。例如,对象具有因为创伤而导致的贫血或失血。
移植物可以是除了通过本发明的方法扩增的HCS和/或HPC之外还含有缓冲液、抗生素、药品的组合物。
例如,在化疗、放射疗法或骨髓移植之前、同时或者之后,对对象施用扩增的HCS和/或HPC群或包含具有扩增的HCS和/或HPC的细胞群的组合物。所述对象可选地具有耗尽的骨髓,该耗尽的骨髓与例如特征在于骨髓损失或耗尽的骨髓的先天性、遗传性或获得性综合征相关。因此,对象可选地是需要造血的对象。可选地,对象是骨髓供体或者是具有或处于耗尽的骨髓的风险的对象。
造血干细胞操作可用作化疗或放射疗法的补充治疗。例如,使HSC位于外周血,然后从会进行化疗的对象分离,并在该疗法后将细胞返回。因此,对象是进行或预期进行免疫细胞耗尽治疗(例如化疗、放射疗法)或者充当骨髓移植用供体的对象。骨髓是身体增殖性最强的组织之一,因此其经常是被化疗药物和放射首先破坏的器官。结果是在化疗或放射治疗期间血液细胞产生被迅速破坏,并且必须终止化疗和放射以允许造血系统在患者用化疗再治疗之前再补充血液细胞供给。因此,如本文所述,由本文所述方法制造的HSC、HPC或血液细胞可选地对需要补充的血液细胞的此类对象施用。
提供了与能够增强HSC和/或HPC体内、体外或离体增殖的治疗剂(例如小分子或抗体等)以及可选的至少一种药学上可接受的赋形剂或载体组合的、通过上述本发明的化合物或组合物扩增的HSC和/或HPC。能够增强HSC和/或HPC增殖的治疗剂是指但不限于针对TPO受体的激动剂抗体(例如,专利公报WO 2007/145227中详述的VB22B sc(Fv)2,等等);诸如SCF、IL-6、Flt-3配体、TPO或TPO模拟物等细胞因子(例如,如WO/2007/022269;WO/2007/009120;WO/2004/054515;WO/2003/103686;WO/2002/085343;WO/2002/049413;WO/2001/089457;WO/2001/039773;WO/2001/034585;WO/2001/021180;WO/2001/021180;WO/2001/017349;WO/2000/066112;WO/2000/035446;WO/2000/028987;WO/2008/028645等中所述);粒细胞集落刺激因子(G-CSF);粒细胞巨噬细胞集落刺激因子(GM-CSF);前列腺素受体激动剂(例如,前列腺素E2受体-1(EP-I)激动剂、前列腺素E2受体-2(EP-2)激动剂、前列腺素E2受体-3(EP-3)激动剂和前列腺素E2受体-4(EP-4)激动剂,如专利公报WO/2008/073748中详述);四亚乙基五胺(TEPA);Notch配体(Delta-1);和/或WNT激动剂。另外,与间充质干细胞(MSC)一起培养干细胞防止移植物抗宿主病(GvHD),并且可以帮助干细胞扩增。
“药学上可接受的”是指不是生物学上或其他方面不期望的材料,即,所述材料可以对对象或细胞施用,而不会引起不期望的生物效应或者以有害的方式与包含其的药物组合物的其它成分相互作用。将载体或赋形剂选择为使活性成分的降解最小化或者使对象或细胞中的不利副作用最小化。
将组合物以任何常规方式配制以用于本文所述的方法。在实施方式中,本发明的组合物包含本文定义的化合物。在其它实施方式中,本发明的组合物包含使用本文定义的化合物扩增的HSC和/或HPC群。本发明的组合物还可以包含药学上可接受的载体。组合物的施用由本领域技术人员通过已知有效的任何途径。例如,将所述组合物口服、胃肠外(例如静脉内)、通过肌肉内注射、通过腹膜内注射、经皮、体外、鼻内或局部施用。
优选的施用方法是静脉内输注。输入的细胞数量会考虑各种因素,例如性别、年龄、体重、疾病或病症类型、病症阶段、期望细胞在细胞群中的百分比和需要产生治疗益处的细胞数量。在一个具体实施方式中,组合物通过静脉内输注施用,并且对于脐带血而言包含至少≥0.3x 105CD34+/kg或>2x 106CD34+,对于骨髓而言包含至少2.5x 105CD34+/kg以上或者动员的外周血细胞。在一个具体实施方式中,输注的细胞都源自来自单个新生儿的经扩增的脐带血细胞。
扩增的HCS和/或HPC可以通过点滴(例如在治疗白血病的情况下)输注到用抗癌药、全身照射或免疫抑制药预处理以根除癌细胞或者促进供体细胞植入的患者中。要治疗的疾病、预处理和细胞移植方法由负责人恰当地选择。这样移植的HCS和/或HPC在接收者中的植入、造血的恢复、移植副作用的存在和移植的治疗效果可由在移植疗法中使用的常规检验判断。
如上所述,本发明使得可以扩增HCS和/或HPC,并且通过使用扩增的HCS和/或HPC在短时间内安全容易地进行移植疗法。
本文还提供了试剂盒,所述试剂盒包含填充有一种或多种本文所述成分的一个或多个容器。此类试剂盒可选地按需要或期望包含溶液和缓冲液。所述试剂盒可选地包括通过上述方法制造的干细胞的扩增群体,并且可以包含用于制造HSC和/或HPC的扩增群体的容器或组合物。特别地,本发明提供用于离体扩增造血干细胞的试剂盒,其包含本文定义的本发明的化合物和在HSC和/或HPC扩增方法中使用此类化合物的说明书,以及可选的一种或多种细胞扩增因子,或者用于细胞生长的培养基,特别是如上所述用于HSC和/或HPC生长的培养基。所述试剂盒还可以包含用于监视所述细胞产生的抗体,例如抗-CD34、抗-CD38和/或抗-CD45RA抗体。在一个具体实施方式中,此类试剂盒还包括选自由IL6、FLT3-L、SCF和TPO组成的组中的一种或多种细胞扩增因子。与此类包或试剂盒可选地关联的是使用说明书。
还提供了用于提供有效量的本发明的化合物以增加对象中的HSC和/或HPC的试剂盒,所述试剂盒包括一次或多次剂量的所述化合物以供长时间使用,其中,试剂盒中本发明化合物的总剂量数等于足以增加对象中的HSC和/或HPC的有效量。所述时间为约1天至数天、1周至数周或者1月至数月。因此,时间为至少约5、6、7、8、10、12、14、20、21、30、60天或更多或1~180天中的任何天数。
生物检验
筛选检验:如本发明人之前的专利申请WO 2013/110198所述进行筛选检验。
使用以下生物检验来评估本发明的化合物对造血干细胞扩增的效果。结果显示在图1~6中。培养基:所用培养基由补充有以下重组细胞因子的无血清培养基组成:白细胞介素-6、促血小板生成素、Flt-3配体和干细胞因子,各自的最终浓度为100ng/ml,在载体(DMSO)、阳性对照(SR1)或者本发明的化合物或者化合物的组合的存在下。细胞培养物:通过流式细胞术测定的起始收集物的CD34+细胞纯度高于90%。CD34+CD45RA-亚群达到高于70%的纯度水平。将细胞以40,000细胞/ml铺板,并且在37℃于5%CO2中温育7~12天。为了进行长期培养,将来自动员PB的200,000CD34+细胞/ml用无血清培养基铺板,所述无血清培养基补充有白细胞介素-6、促血小板生成素、Flt-3配体和干细胞因子,各自的最终浓度为100ng/ml,在500nM的载体(DMSO)、阳性对照或者本发明的化合物的存在下。
吡啶并吡咯并嘧啶化合物的合成方法
以下列出的合成方法涉及本发明的实施方式。如本领域技术人员会理解的,可以进行类似的合成方法,其改变对于本领域技术人员而言是显而易见的。
方案1
方案2
方案3
方案1:从6-羟基-5-硝基烟酸开始,将OH用诸如SOCl2等活化剂和如酰卤等羧酸转化成卤化物,其然后可以与醇反应以形成酯(II)。酯还能够在第一步中经由许多方式制备以制备酯,诸如Fisher酯化。卤离子(或甲磺酸根,例如如果选择OH)被2-氰基乙酰胺的阴离子(通过诸如NaH、MeONa或叔丁醇钾等碱产生)置换,产生中间体III。用诸如烷基氰基乙酸酯等氰基乙酸酯也可以适用相同的程序。硝基基团的还原然后环化可以用各种金属(例如铁/氯化铵)在极性溶剂(例如二甲基甲酰胺)中加热、用锌/乙酸加热、钯或二氯化锡实现,这里只列举一些。该还原-环化形成中间体IV,中间体IV能够通过在高温(80-140℃)下与诸如甲醇钠等碱一起,在诸如甲醇和N-甲基吡咯烷等极性溶剂中用酯加热而转化成中间体V(当Y=NH2时)。当Y=OR时,中间体可以用氰化物衍生物和HCl处理,然后在碱性条件(例如碳酸钾和甲醇钠)下处理。作为另选,IV(Y=OR)可以用原甲酸酯衍生物或用甲酰胺通过加热(80-200℃)而转化成中间体V。苯酚(或同分异构酰胺)转化成离去基团(例如三氟甲磺酸根、氯离子或溴离子)(VI)可以用三氟甲磺酸酐与碱(例如三乙基胺)在惰性溶剂(例如二氯甲烷)中或者通过用诸如氧氯化磷(或氧溴化磷)等试剂卤化来完成。中间体VI可以用胺(使用或不使用诸如三乙基胺等碱)加热(60-160℃)以提供化合物VII。中间体VIII能够通过用过量(5-25当量)的所需醇加热(80-160℃)中间体VI然后用诸如甲醇等烷氧化物(23-140℃)处理以在7-位返回酯而获得。类似地,中间体VI与合适的硫醇盐(由诸如NaH等氢化物或诸如甲醇钠等碱或碳酸酯产生,或者由甲硅烷基用氟源在DMF(N-甲基吡咯烷)中去保护而产生)的混合物,产生所期望的中间体VIII。在诸如钯(例如PdCl2(PPh3)2-CuI-Et3N)等金属催化剂的存在下在诸如二甲基甲酰胺等溶剂中在加热(30-140℃)下合适的硼酸乙烯酯(通常由炔烃和二烷氧基硼酸酯制备)提供相应的烯烃。该烯烃能够通过许多方式(例如用钯碳氢化)还原,从而产生化合物IX。
方案2:7位的酯可以通过在高温下对胺的醇溶液加热从而直接转化成酰胺,或者以两步的方式通过首先将酯水解然后根据标准程序形成酰胺从而转化成酰胺。相应的腈可以通过将之前的酰胺用例如亚硫酰氯或三氟乙酸酐脱水而获得。中间体四唑可以通过将之前的腈与三甲基甲硅烷基或三丁基锡叠氮化物在热甲苯中加热而获得。烷基化可以在诸如乙腈等惰性溶剂中用卤代烷与诸如碳酸钾等碱进行,并且可以用公知的进行此种转化的许多方式进行。
方案3:按照方案2,可以将中间体I或II转化成腈X,然后用叠氮化物转化成中间体XI,并且最后在烷基化后转化成中间体XII。最终化合物XIII-XV可以按照方案1获得。
在可获得一些起始材料的功能上,方案的顺序可以相互交换,或者根据中间体上的官能的类型相互交换。
实施例
概述
报告的HPLC保留时间针对反相HPLC(Agilent,1200系列),使用以下条件:溶剂A:MeOH:H2O:TFA(5:95:0.05);溶剂B:MeOH:H2O:TFA(95:5:0.05);流速:3.0mL/min;梯度0~100%B,在2.0分钟内;柱:ZorbaxC18,3.5微米,4.6x 30mm:波长220nm。
在来自Agilent Technologies的6210G1969A LC/MSD TOF谱仪上或者在来自Agilent Technologies的Quadrupole LC/MS Model G6120B上记录质谱,使用以下LC条件:溶剂A:AcCN:H2O:HCOOH(5:95:0.05);溶剂B:AcCN:H2O:HCOOH(95:5:0.05);梯度0~100%B,在2.0分钟内;流速:0.3mL/min;柱:ZorbaxC18,3.5微米,2.1x 30mm;波长220nm。
实验程序
实施例1
2-苯甲基-4-((3-(哌啶-1-基)丙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体1A
6-氟-5-硝基烟酸甲酯
6-羟基-5-硝基烟酸(5.00g,27.2mmol)、SOCl2(29.7ml,407mmol)和DMF(0.315ml,4.07mmol)的混合物回流过夜。除去挥发物,将残留物置于DCM中。减压除去溶剂去除最后的痕量试剂。将残留物稀释在DCM(50mL)中,使其在N2下到达-40℃,并缓慢添加MeOH(54.4mmol)。使溶液达到室温,1小时后除去溶剂从而得到5.2g(88%)的粗酯。1H NMR(400MHz,CDCl3)δppm 4.03(s,3H)8.77(d,J=1.9Hz,1H)9.18(d,J=2.3Hz,1H)。
中间体1B
2-氨基-3-氨基甲酰基-1H-吡咯并[2,2-b]吡啶-6-甲酸甲酯
将NaH(0.776g,19.39mmol,60重量%)添加至在DMF(12ml)中的2-氰基乙酰胺(0.815g,9.70mmol)的5℃溶液。使混合物升至室温15分钟然后返回5℃。向之前的溶液中缓慢添加在THF(6ml)中的6-氯-5-硝基烟酸甲酯(2.00g,9.23mmol),然后使其升至室温。搅拌3小时后,将溶液冷却至5℃,用24ml水淬灭,10分钟后用浓HCl(0.81ml,9.7mmol)。将获得的固体过滤,真空干燥过夜从而得到0.80g的6-(2-氨基-1-氰基-2-氧代乙基)-5-硝基烟酸甲酯。LCMS m/z 263.2(M-H);1H NMR(400MHz,DMSO-d6)δppm 3.95(s,3H)5.99(s,1H)7.81(s,1H),8.15(s,1H)8.86(d,J=2.0Hz,1H)9.38(d,J=2.0Hz,1H),具有一些区域异构体(Z)-6-(2-氨基-1-氰基-2-氧代亚乙基)-5-硝基-1,6-二氢吡啶-3-甲酸甲酯。
使DMF(9ml)中的铁(1.522g,27.3mmol)和饱和氯化铵(0.348g,7.57mmol)的混合物升至85℃,然后滴加DMF(6ml)中的6-(2-氨基-1-氰基-2-氧代乙基)-5-硝基烟酸甲酯(0.800g,3.03mmol)。搅拌4小时后,将混合物用更多DMF(6ml)稀释,热过滤,并在真空下除去溶剂。用DCM-MeOH(0-20%)使用RediSep柱在ISCO上进行纯化,得到290mg所需产物。1H NMR(400MHz,DMSO-d6)δppm 3.84(s,3H)7.04(br.s,1H)7.40(br.s,2H)7.80(br.s,1H)7.83(d,J=1.5Hz,1H)8.67(d,J=1.6Hz,1H)10.90(br.s,1H)。
中间体1C
2-苯甲基-4-羟基-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
将MeOH(1.3ml)中的2-氨基-3-氨基甲酰基-1H-吡咯并[3,2-b]吡啶-6-甲酸甲酯(0.100g,0.42mmol)、甲醇钠(0.248ml,1.71mmol)和2-苯基乙酸甲酯(0.280g,1.70mmol)的混合物在微波设备中加热80分钟。将溶液冷却至室温,并用乙酸淬灭(0.100ml,1.75mmol)。将获得的固体过滤,并用最小量的甲醇冲洗,真空干燥从而产生0.095g的标题化合物;1H NMR(400MHz,DMSO-d6)δppm 3.89(s,3H)4.04(s,2H)7.23-7.29(m,1H)7.34(t,J=7.4Hz,2H)7.39(d,J=7.8Hz,2H)8.17(d,J=1.9Hz,1H)8.98(d,J=1.9Hz,1H)12.59(br.s,2H);LCMS m/z 333.2(M-H)-。
中间体1D
2-苯甲基-4-氯-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
将在POCl3(2.0ml)和二噁烷(2.0ml)中的中间体1C(0.092g;0.27mmol)的混合物在90℃加热2.5小时。然后真空下除去溶剂,残留物在EA和NaHCO3(溶液(sol))之间分配。分离出有机相,将其在MgSO4上干燥,过滤,真空下除去溶剂,从而得到0.096g的中间体2-苯甲基-4-氯-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯,将其直接用于下一步骤。
中间体1E
2-苯甲基-4-((3-(哌啶-1-基)丙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
将中间体1D与3-(哌啶-1-基)丙烷-1-胺(0.047ml,0.28mmol)和Et3N(0.020ml,0.14mmol)一起在微波设备中于140℃加热40分钟。真空下除去溶剂,将残留物在制备型HPLC上使用Zorbax SB-C18柱21.2x 150mm利用水(0.05%TFA)-MeOH(0.05%TFA)从30%纯化至100%。合并所需级分,并且真空下除去溶剂。将获得的残留物冻干从而产生16mg的作为TFA盐的标题化合物。特征峰是:1H NMR(400MHz,DMSO-d6)δppm 1.19-1.42(m,1H)1.51-1.72(m,3H)1.79(d,J=14.9Hz,2H)1.98-2.08(m,2H)2.80(q,J=11.7Hz,2H)3.03-3.11(m,2H)3.72(q,J=6.3Hz,2H)3.92(s,3H)4.09(s,2H)7.21(t,J=7.4Hz,1H)7.30(t,J=7.6Hz,2H)7.38(d,J=7.2Hz,2H)7.62(t,J=6.2Hz,1H)8.21(d,J=1.5Hz,1H)8.91(br.s.,1H)9.01(d,J=1.6Hz,1H)12.30(s,1H);HRMS m/z 459.2531(M+H)+。
实施例2
4-((3-(哌啶-1-基)丙基)氨基)-2-(噻吩-3-基甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体2A
4-羟基-2-(噻吩-3-基甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
从2-(噻吩-3-基)乙酸乙酯(0.257ml,1.71mmol)出发,按照实施例1C所述的程序获得中间体2A(0.108g)。1H NMR(400MHz,DMSO-d6)δppm 3.90(s,3H)4.04(s,2H)7.13(dd,J=4.9,1.4Hz,1H)7.40(d,J=1.9Hz,1H)7.50(dd,J=4.9,2.9Hz,1H)8.18(d,J=1.9Hz,1H)8.99(d,J=1.9Hz,1H)12.53(br.s,2H)12.53-12.53(m,1H);LCMS m/z 341.2(M+H)+。
中间体2B
4-氯-2-(噻吩-3-基甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
从中间体2A出发,按照1D所述的程序获得标题化合物。LCMS m/z 359.0(M+H)+。
中间体2C
4-((3-(哌啶-1-基)丙基)氨基)-2-(噻吩-3-基甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
从中间体2B出发,按照实施例1所述的程序以TFA盐获得标题化合物。1H NMR(400MHz,DMSO-d6)δppm 1.29-1.42(m,1H)1.51-1.72(m,3H)1.74-1.84(m,2H)1.97-2.10(m,2H)2.83(q,J=12.1Hz,2H)3.04-3.13(m,2H)3.73(q,J=6.3Hz,2H)3.92(s,3H)4.10(s,2H)7.14(dd,J=4.7,1.2Hz,1H)7.31(d,J=1.9Hz,1H)7.46(dd,J=4.9,2.9Hz,1H)7.62(t,J=5.8Hz,1H)8.22(d,J=1.5Hz,1H)8.91(br.s,1H)9.01(d,J=1.5Hz,1H)12.29(s,1H);HRMS m/z 465.2064(M+H)+。
实施例3
4-((3-(哌啶-1-基)丙基)硫代)-2-(噻吩-3-基甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体3A
1-(3-((三异丙基甲硅烷基)硫代)丙基)哌啶
在N2下向THF(14.8ml,18mmol)中的1-(3-氯丙基)哌啶.HCl(0.500g,2.52mmol)的混合物添加三异丙基硅烷硫醇(1.09ml,5.0mmol)和四丁基碘化铵(0.093g,0.25mmol)。然后分批添加NaH(0.252g,6.3mmol;60重量%),并将混合物在50℃加热19h。将反应冷却至室温,用水(15ml)稀释并用EtOAc(4x 15mL)萃取。合并有机相,将其用水(2x 15ml)洗涤,然后用盐水(15ml)洗涤。将有机相在MgSO4上干燥、过滤,并在真空下除去溶剂。使用RediSep柱(CH2Cl2-MeOH)在ISCO上从20%纯化至100%,提供0.71g标题化合物。1H NMR(400MHz,DMSO-d6)δppm 1.06(d,J=7.0Hz,18H)1.14-1.29(m,3H)1.36(m,J=5.1Hz,2H)1.46(quin,J=5.4Hz,4H)1.65(quin,J=7.0Hz,2H)2.29(m,J=6.7Hz,6H)2.53(t,J=7.3Hz,2H)。
中间体3B
4-((3-(哌啶-1-基)丙基)硫代)-2-(噻吩-3-基甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
向N-甲基吡咯烷(0.5ml)中的中间体2B(0.040g,0.11mmol)和中间体3A(0.074g,0.23mmol)的溶液添加四丁基氟化铵(0.223ml,0.22mmol),并在35℃加热过夜。在制备型HPLC上将反应混合物直接纯化。合并所需级分,并在真空下除去溶剂。将获得的残留物冻干从而产生作为TFA的10mg标题化合物。特征峰为:1H NMR(400MHz,DMSO-d6)δppm 1.29-1.42(m,1H)1.51-1.72(m,3H)1.74-1.84(m,2H)1.97-2.10(m,2H)2.83(q,J=12.1Hz,2H)3.04-3.13(m,2H)3.73(q,J=6.3Hz,2H)3.92(s,3H)4.10(s,2H)7.14(dd,J=4.7,1.2Hz,1H)7.31(d,J=1.9Hz,1H)7.46(dd,J=4.9,2.9Hz,1H)7.62(t,J=5.8Hz,1H)8.22(d,J=1.6Hz,1H)8.91(br.s,1H)9.01(d,J=1.6Hz,1H)12.29(s,1H)。HRMS m/z 482.1683(M+H)+。
实施例4
2-(3-甲氧基苯甲基)-4-((3-(2-甲基哌啶-1-基)丙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体4A
4-羟基-2-(3-甲氧基苯甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
按照制备中间体1C的程序,2-(3-甲氧基苯基)乙酸甲酯(0.246g,1.36mmol)得到0.062g的标题化合物。1H NMR(400MHz,DMSO-d6)δppm 3.74(s,3H)3.90(s,3H)3.99(s,2H)6.83(d,J=7.04Hz,1H)6.91-7.03(m,3H)7.25(t,J=7.8Hz,1H)8.17(s,1H)8.97(s,1H)12.37(br.s,2H);
中间体4B
4-氯-2-(3-甲氧基苯甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
在100℃将POCl3(2.0ml)中的中间体4A(0.062g,0.17mmol)加热1小时。将混合物冷却至室温并在真空下除去溶剂。将残留物在EA和NaHCO3(溶液)之间分配,并分离有机相,将其在MgSO4上干燥,过滤并在真空下除去溶剂,从而得到0.027g的粗4B;LCMS m/z 383.2(M+H)+。
中间体4C
2-(3-甲氧基苯甲基)-4-((3-(2-甲基哌啶-1-基)丙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
在微波设备中在140℃将甲醇(0.7ml)中的中间体4B(0.060g,0.15mmol)、3-(2-甲基哌啶-1-基)丙-1-胺(0.073g,0.47mmol)和Et3N(0.044ml,0.31mmol)的混合物加热45分钟。真空下除去溶剂,使用DCM-MeOH-NH4OH(80-20-2.5%)用RediSep柱在ISCO上纯化残留物提供0.024g的标题化合物。1H NMR(400MHz,DMSO-d6)δppm 0.97(d,J=6.3Hz,3H)1.23-1.36(m,2H)1.49-1.64(m,4H)1.70-1.85(m,2H)1.95-2.08(m,1H)2.16-2.31(m,2H)2.70-2.91(m,2H)3.65-3.71(m,2H)3.72(s,3H)3.91(s,3H)4.03(s,2H)6.77(dd,J=8.2,1.9Hz,1H)6.92-6.99(m,2H)7.19(t,J=7.8Hz,1H)7.6(t,J=5.6Hz,1H)8.18(d,J=1.6Hz,1H)8.96(d,J=1.6Hz,1H)12.21(br.s.,1H)。HRMS m/z 503.2771(M+H)+。
实施例5
4-((2-(二乙基氨基)乙基)氨基)-2-(3-甲氧基苯甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体5A
按照实施例4的程序,中间体4B(0.060g,0.15mmol)、N-N-二乙基乙烷-1,2-二胺(0.055g,0.47mmol)和Et3N(0.022ml,0.157mmol)的混合物在制备型HPLC上纯化之后得到作为TFA盐的0.025g的标题化合物。1H NMR(400MHz,DMSO-d6)δppm 1.17(t,J=7.04Hz,6H)3.13-3.22(m,4H)3.35(q,J=5.1Hz,2H)3.73(s,3H)3.93(s,3H)3.94-3.98(m,2H)4.08(s,2H)6.80(dd,J=8.2,1.9Hz,1H)6.89-6.94(m,2H)7.22(t,J=8.Hz,1H)7.75(t,J=5.8Hz,1H)8.24(d,J=1.5Hz,1H)9.03(d,J=1.5Hz,1H)12.39(s,1H)。
实施例6
2-苯甲基-4-(甲基(3-(哌啶-1-基)丙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
在90℃加热在POCl3(2.0ml,21.4mmol)和二噁烷(2.0ml)中的中间体1C(0.092g,0.27mmol)的混合物2.5小时。使混合物为室温,并在真空下除去溶剂。将获得的残留物在EA和NaHCO3溶液之间分配,并分离有机相,将其在MgSO4上干燥、过滤并在真空下除去溶剂,从而提供0.096g的粗氯类似物。
在微波设备中将之前的粗品(0.096g,0.27mmol)与甲醇(1.08ml)中的N-甲基-3-(哌啶-1-基)丙烷-1-胺(0.128g,0.81mmol)和Et3N(0.038ml,0.27mmol)一起在140℃加热50分钟。然后除去溶剂,并将粗油在制备型HPLC上纯化。合并期望的级分并在真空下除去溶剂。将获得的残留物冻干从而产生作为TFA盐的16mg标题化合物。特征峰为:1H NMR(400MHz,DMSO-d6)δppm 1.26-1.43(m,1H)1.50-1.71(m,3H)1.79(br.s.,2H)2.00-2.13(m,2H)2.85(q,J=13.7Hz,2H)3.05-3.16(m,2H)3.92(s,3H)4.06(s,2H)4.33(br.s,2H)7.21(t,J=7.4Hz,1H)7.30(t,J=7.4Hz,2H)7.38(d,J=7.0Hz,2H)8.17(d,J=1.9Hz,1H)8.95(br.s,1H)9.03(d,J=1.9Hz,1H)12.43(s,1H)。HRMS m/z 473.2658(M+H)+。
实施例7
2-(2-甲基苯甲基)-4-((3-(哌啶-1-基)丙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体7A
4-羟基-2-(2-甲基苯甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
按照关于1C的制备程序,2-(邻甲苯基)乙酸甲酯(0.240g,1.34mmol)得到0.105g的标题化合物。1H NMR(400MHz,DMSO-d6)δppm 2.35(s,3H)3.84(s,3H)3.89(s,2H)7.07-7.20(m,4H)7.21-7.27(m,1H)8.00(br.s.,1H)8.71(br.s,1H)11.06(br.s,1H);
中间体7B
4-氯-2-(2-甲基苯甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
向二氯乙烷(2ml)中的中间体7A(0.090g,0.25mmol)添加TFA(0.4ml)以得到溶液。然后除去溶剂,在微波设备中将POCl3(2.0ml)中的残留物于160℃加热10分钟。按照中间体1D的程序,获得0.095g中间体7B。LCMS m/z 367.1(M+H)+。
中间体7C
2-(2-甲基苯甲基)-4-((3-(哌啶-1-基)丙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
按照中间体4C所述的程序,在微波中对甲醇(0.5ml)中的中间体7B(0.020g,0.055mmol)、3-(哌啶-1-基)丙-1-胺(0.039g,0.27mmol)的混合物加热从而提供0.005mg标题化合物。1H NMR(400MHz,DMSO-d6)δppm 1.31-1.44(m,2H)1.50-1.61(m,4H)1.77(quin,J=6.70Hz,2H)2.23-2.44(m,9H)3.67(q,J=6.13Hz,2H)3.91(s,3H)4.09(s,2H)7.06-7.18(m,3H)7.21-7.30(m,1H)7.64(t,J=5.48Hz,1H)8.08-8.20(m,1H)8.86-9.00(m,1H)12.24(br.s.,1H)。
实施例8
2-(2-甲基苯甲基)-4-((3-(哌啶-1-基)丙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体8A
按照实施例7的程序,中间体7B(0.045g,0.12mmol)和3-(吡咯烷-1-基)丙-1-胺(3当量)得到0.010mg标题化合物。特征峰为:1H NMR(400MHz,DMSO-d6)δppm 1.70-1.87(m,6H)2.64(br.s.,6H)3.69(q,J=5.90Hz,2H)3.91(s,3H)4.10(s,2H)7.06-7.18(m,3H)7.21-7.30(m,1H)7.70(t,J=6.30Hz,1H)8.16(d,J=1.56Hz,1H)8.97(d,J=1.56Hz,1H)12.26(br.s.,1H)。
实施例9
4-((3-(甲基氨基)丙基)氨基)-2-(2-甲基苯甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体9A
按照实施例7的程序,按照中间体4C所述的程序在微波设备中对中间体7B(0.045g,0.12mmol)、叔丁基(3-氨基丙基)(甲基)氨基甲酸酯盐酸盐(0.046g,0.24mmol)和三乙基胺(0.037g,0.37mmol)加热,以提供作为BOC保护的胺的标题化合物。该粗材料然后用DCM-三氟乙酸的混合物处理45分钟,从而提供作为三氟乙酸盐的0.009g标题化合物。特征峰为:1H NMR(400MHz,DMSO-d6)δppm 1.93(quint,J=7.00,7.00,7.00,7.00,7.00,7.00Hz,1H)2.36(s,3H)2.54-2.56(m,3H)2.84-2.93(m,2H)3.66-3.71(m,2H)3.92(s,3H)4.12(s,2H)7.09-7.19(m,3H)7.22-7.29(m,1H)7.61(t,J=6.06Hz,1H)8.19(d,J=1.56Hz,1H)8.27(br.s.,2H)9.01(d,J=1.56Hz,1H)12.33(s,1H)。
实施例10
(1R,4R)-N1-(2-苯甲基-7-(2-甲基-2H-四唑-5-基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-4-基)环己烷-1,4-二胺
中间体10A
2-氰基-2-(5-氰基-3-硝基吡啶-2-基)乙酰胺
向DMF(22ml)中的氢化钠60%(1.77g,44.4mmol)的0℃悬浮液分批添加2-氰基乙酰胺(1.86g,22.2mmol)。在室温下搅拌15分钟后,使温度为0℃,用10分钟缓慢地添加THF中的6-氯-5-硝基烟腈(3.88g,21.1mmol)的溶液。1小时后,使温度为室温5小时。将混合物冷却回0℃,用水(55ml)和浓HCl(1.8ml)淬灭,并在冰箱中静置过夜。将浆料过滤,用水、己烷洗涤滤饼并干燥,从而提供4.32g标题化合物。特征峰为:1H NMR(400MHz,DMSO-d6)δppm 3.06(s,1H)7.31(br.s.,2H)7.76(s,1H)8.23(s,1H)。
中间体10B
2-氨基-6-氰基-1H-吡咯并[3,2-b]吡啶-3-甲酰胺
向铁(8.6g,154mmol)和氯化铵的饱和溶液(11ml)的85℃悬浮液添加中间体10A(4.32g,17.1mmol)在DMF(34ml)中的溶液。3小时后,在硅藻土上过滤反应混合物,并用DMF洗涤滤饼(3次)。除去溶剂,在硅胶上吸收深色油。使用DCM-MeOH(0-25%)用RediSep柱在ISCO上进行纯化,提供0.229g标题化合物。LCMS m/z 200.1(M-H)-。
中间体10C
2-苯甲基-4-羟基-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲腈
对二噁烷中的中间体10B(0.229g,1.14mmol)、叔丁醇钾(0.513g,4.57mmol)和2-苯基乙酸甲酯(0.644ml,4.57mmol)的混合物加热回流2小时。将反应混合物冷却至45℃,并添加水(2.94ml,163mmol)。在60℃继续搅拌,30分钟后,添加水(5.88ml)。将混合物冷却,并再搅拌2小时。在Buchner上收集固体,并用1,4-二噁烷/水(1:3,2x 1ml)洗涤然后用MeOH(2x 0.5ml)洗涤滤饼,从而提供0.121g标题化合物;LCMS m/z 302.2(M+H)+。
中间体10D
2-苯甲基-4-氯-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲腈
将氯氧化磷(1.0ml)中的中间体10C(0.050g,0.17mmol)的混合物在微波设备中于175℃加热15分钟。将反应混合物浓缩至干燥,并将残留物悬浮在水(4ml)中。添加NaHCO3(5mL)的饱和溶液,并将所得悬浮液搅拌1小时。在Buchner上收集固体,将滤饼用水洗涤2次并干燥,从而提供0.039g标题化合物;LCMS m/z 320.1(M+H)+。
中间体10E
4-(((1R,4R)-4-氨基环己基)氨基)-2-苯甲基-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲腈
将MeOH(3.00ml)中的中间体10D(0.091g,0.29mmol)和(1R,4R)-环己烷-1,4-二胺(0.227g,1.99mmol)的混合物在微波设备中于140℃加热30分钟。将反应混合物浓缩干燥,并使用DCM-MeOH/NH4OH利用RediSep柱在ISCO上将残留物纯化,提供0.113g标题化合物;特征峰为:1H NMR(400MHz,DMSO-d6)δppm 1.14-1.30(m,2H)1.38-1.55(m,2H)1.83(m,J=11.30Hz,2H)2.00(m,J=9.80Hz,2H)2.58-2.72(m,1H)4.08(s,2H)4.00-4.22(m,1H)6.71(d,J=8.22Hz,1H)7.15-7.23(m,1H)7.29(t,J=7.43Hz,2H)7.38(d,J=7.43Hz,2H)8.24(d,J=1.80Hz,1H)8.80(d,J=1.80Hz,1H)。
中间体10F
(1R,4R)-N1-(2-苯甲基-7-(2-甲基-2H-四唑-5-基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-4-基)环己烷-1,4-二胺
将(三氟甲基)苯(2.1ml)中的中间体10E(0.059g,0.15mmol)和叠氮基三丁基锡(0.43ml,1.57mmol)的混合物在微波中加热至180℃30分钟。30分钟后,将混合物浓缩干燥,并添加MeOH(3.6ml)、HCl 4M二噁烷溶液(1.1ml)和Et2O(3.6ml)。约2分钟后,开始结晶并搅拌过夜。收集固体,将其用Et2O(3x 0.5mL)洗涤然后用己烷(3x 0.5mL)洗涤,从而提供0.074g的(1R,4R)-N1-(2-苯甲基-7-(2H-四唑-5-基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-4-基)环己烷-1,4-二胺;LCMS m/z 441.2(M+H)+。
向之前的中间体在THF(4.8ml)和MeOH(1.2ml)中的悬浮液添加三甲基甲硅烷基重氮甲烷2M己烷溶液(0.52ml,1.04mmol)。5分钟后,添加相同量的三甲基甲硅烷基重氮甲烷,然后5分钟后,再次添加相同量。将反应用10滴乙酸淬灭,并浓缩干燥。将残留物使用RediSep柱(DCM/MeOH/NH4OH)在ISCO上纯化,从而提供0.004g标题化合物;特征峰为:1H NMR(400MHz,DMSO-d6)δppm 1.14-1.31(m,2H)1.40-1.57(m,2H)1.84(d,J=10.96Hz,2H)2.02(d,J=10.56Hz,2H)2.65(m,J=10.80,10.80Hz,1H)4.09(s,2H)4.11-4.20(m,1H)4.46(s,3H)6.66(d,J=7.83Hz,1H)7.16-7.24(m,1H)7.29(t,J=7.43Hz,2H)7.35-7.43(m,2H)8.29(d,J=1.57Hz,1H)9.11(d,J=1.57Hz,1H);HRMS m/z 455.2406(M+H)+。
实施例11
2-(3-氟苯甲基)-4-((3-(哌啶-1-基)丙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体11A
2-(3-氟苯甲基)-4-羟基-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
从中间体1B(0.090g,0.38mmol)和4.0当量的2-(3-氟苯基)乙酸甲酯出发,按照实施例1所述的程序获得0.110g标题化合物。1H NMR(400MHz,DMSO-d6)δppm3.91(s,3H)4.08(s,2H)7.11(t,J=9.40Hz,1H)7.20-7.28(m,2H)7.39(s,1H)8.17(s,1H)8.99(s,1H)12.56(br.s,2H)。
中间体11C
2-(3-氟苯甲基)-4-((3-(哌啶-1-基)丙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
将在二氯乙烷-二噁烷(0.5ml-1.5ml)中的中间体11A(0.108g,0.31mmol)和氧氯化磷(0.2ml)的混合物在微波设备于155℃加热10分钟。除去溶剂,将残留物置于乙酸乙酯和NaHCO3中。分离有机相,将其在Na2SO4上干燥,过滤并除去溶剂以提供0.095g of 4-氯-2-(3-氟苯甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯(中间体11B)。
将该中间体11B(0.030g,0.081mmol)按照实施例4用3-(哌啶-1-基)丙-1-胺处理,从而提供0.017g标题化合物。特征峰为:1H NMR(400MHz,DMSO-d6)δppm 1.34-1.43(m,2H)1.49-1.60(m,4H)1.78(quin,J=6.70Hz,2H)2.25-2.40(m,6H)3.70(q,J=6.26Hz,2H)3.91(s,3H)4.10(s,2H)7.03(t,J=9.70Hz,1H)7.20(d,J=7.43Hz,2H)7.27-7.38(m,1H)7.69(t,J=5.67Hz,1H)8.18(d,J=1.96Hz,1H)8.97(d,J=1.96Hz,1H)12.23(br.s.,1H);HRMS m/z 477.2411(M+H)+。
实施例12
4-((3-(3-氨基丙基)(甲基)氨基)丙基)氨基)-2-(3-氟苯甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体12A
将中间体11B(0.030g;0.65mmol)按照实施例4用N1-(3-氨基丙基)-N1-甲基丙烷-1,3-二胺(0.094g;0.081mmol)和三乙基胺(0.066g;0.65mmol)处理,从而在利用DCM/MeOH-NH4OH(80-20-2.5%)使用RediSep柱于ISCO上纯化之后,提供0.007g标题化合物。特征峰为:1H NMR(400MHz,DMSO-d6)δppm 1.34-1.43(m,2H)1.49-1.60(m,4H)1.78(quin,J=6.70Hz,2H)2.25-2.40(m,6H)3.70(q,J=6.26Hz,2H)3.91(s,3H)4.10(s,2H)7.03(t,J=9.70Hz,1H)7.20(d,J=7.43Hz,2H)7.27-7.38(m,1H)7.69(t,J=5.67Hz,1H)8.18(d,J=1.96Hz,1H)8.97(d,J=1.96Hz,1H)12.23(br.s.,1H);HRMS m/z 480.2570(M+H)+。
实施例13
2-(3-氟苯甲基)-4-((3-(甲基氨基)丙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体13A
4-((3-((叔丁氧羰基)(甲基)氨基)丙基)氨基)-2-(3-氟苯甲基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
将中间体11B(0.030g;0.08mmol)按照实施例4用在甲醇(0.6ml)中的叔丁基(3-氨基丙基)(甲基)氨基甲酸酯盐酸盐(0.091g;0.41mmol)和三乙基胺(0.090ml;0.65mmol)处理,从而提供0.013g标题化合物。特征峰为:1H NMR(400MHz,DMSO-d6)δppm1.23-1.41(m,9H)1.83(br.s.,2H)2.77(br.s.,3H)3.23(t,J=6.85Hz,2H)3.62(q,J=6.70Hz,2H)3.91(s,3H)4.10(s,2H)6.99-7.06(m,1H)7.20(s,2H)7.27-7.36(m,1H)7.44(br.s,1H)8.19(d,J=1.56Hz,1H)8.99(d,J=1.56Hz,1H)12.25(s,1H)。
中间体13B
向中间体13A(0.010g,0.019mmol)在DCM(1.0ml)中的溶液添加TFA(0.5ml)。搅拌30分钟后除去溶剂,并将残留物利用DCM/MeOH-NH4OH(80-20-2.5%)使用RediSep柱于ISCO上纯化,从而提供0.008g标题化合物。特征峰为:1H NMR(400MHz,DMSO-d6)δppm 1.77(quin,J=6.70Hz,2H)2.29(s,3H)2.57(t,J=6.65Hz,2H)3.69(quin,J=5.90Hz,2H)3.91(s,3H)4.10(s,2H)7.03(td,J=9.40,2.30Hz,1H)7.18-7.24(m,2H)7.29-7.37(m,1H)7.67(t,J=5.10Hz,0H)8.18(d,J=1.56Hz,1H)8.99(d,J=1.57Hz,1H););HRMS m/z 423.1968(M+H)+。
实施例14
2-苯甲基-4-((3-(二甲基氨基)-2-甲基丙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体14A
按照实施例4中所述的程序,中间体1D(0.029g,0.08mmol)和N1,N1,2-三甲基丙烷-1,3-二胺(0.048g,0.41mmol)得到0.013g标题化合物。特征峰为:1H NMR(400MHz,DMSO-d6)δppm 0.89(d,J=6.65Hz,3H)2.05-2.18(m,2H)2.22(s,6H)2.28-2.37(m,1H)3.46-3.53(m,1H)3.68-3.75(m,1H)3.91(s,3H)4.06(s,2H)7.19(m,J=7.04Hz,1H)7.28(t,J=7.63Hz,2H)7.33-7.40(m,2H)8.17(d,J=1.56Hz,1H)8.31(br.s.,1H)9.00(d,J=1.57Hz,1H)12.19(s,1H);HRMS m/z 433.2387(M+H)+。
实施例15
2-苯甲基-4-(4-(二甲基氨基)哌啶-1-基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体15A
按照实施例4中所述的程序,中间体1D(0.029g,0.08mmol)和N,N-二甲基哌啶-2-胺(0.053g,0.42mmol)得到0.014g标题化合物。特征峰为:1H NMR(400MHz,DMSO-d6)δppm 1.40(qd,J=11.93,3.72Hz,2H)1.83-1.93(m,2H)2.17(s,6H)3.15(t,J=12.13Hz,2H)3.83-3.94(m,4H)4.04(s,2H)7.14-7.21(m,1H)7.27(t,J=7.43Hz,2H)7.36(d,J=7.43Hz,2H)8.13(d,J=1.96Hz,1H)8.95(d,J=1.56Hz,1H)12.35(br.s,1H);HRMS m/z 445.2363(M+H)+。
实施例16
2-苯甲基-4-((2-(二乙基氨基)乙基)(乙基)氨基)-9H-吡啶并[2',3':4,5]吡咯并[2,3-d]嘧啶-7-甲酸甲酯
中间体16A
按照实施例4中所述的程序,中间体1D(0.029g,0.08mmol)和N1,N1,N2-三乙基乙烷-1,2-二胺(0.059g,0.41mmol)得到0.008g标题化合物。特征峰为:1H NMR(400MHz,DMSO-d6)δppm 0.93(br.s.,6H)1.17(t,J=6.85Hz,3H)2.67(br.s.,2H)3.32(br.s,10H)3.91(s,3H)4.02(s,2H)7.15-7.22(m,1H)7.28(t,J=7.63Hz,2H)7.32-7.38(m,2H)8.13(d,J=1.96Hz,1H)8.93(d,J=1.96Hz,1H)12.35(br.s.,1H);HRMS m/z 461.2685(M+H)+。
报道的HPLC保留时间针对反相HPLC(Agilent,1200系列),使用以下条件:溶剂A:MeOH:H2O:TFA(5:95:0.05);溶剂B:MeOH:H2O:TFA(95:5:0.05);流速:2.0mL/min.;梯度0~100%B,在1.5分钟内;运行时间:3.5分钟;柱:Kinetex C18,2.6μm,4.6x 30mm;波长254nm。
表1
将EC50定义为与载体培养物(DMSO)相比产生CD34+CD45RA-细胞计数增加50%的浓度。*EC50:A>1000nM;B:>500-1000nM;C:>250-500nM;D=100-250;E=<100nM。
吡啶并[4,3,b]吲哚基化合物的合成方法
方案1
为了制备5H-吡啶并[4,3-b]吲哚,可以使用市售起始材料(v)或者根据已知方法(McElroy,William T.and DeShong,Philip.Tetrahedron 2006,62(29),6945-6954;Pryde,David C.et al.MedChemComm.2011,2(3),185-189;Ohashi,Tomohiro et al.Bioorganic&Medicinal Chemistry 2012,20(18),5507-5517;Hansen,Karl B.et al.Organic Letters 2005,7(22),4935-4938)制备。这些化合物(v)通过方案1所示的方法制备。将醛(i)用例如二氯甲烷中的氯化锡二水合物和重氮基乙酸乙酯处理,从而提供化合物(iii)。作为另选,该化合物(iii)可以通过用1,1’-羰基二咪唑在溶剂(例如二氯甲烷)中处理酸(ii)然后用麦德鲁姆酸(2,2-二甲基-1,3-二噁烷-4,6-二酮)而获得。将分离出的中间体在醇中回流得到化合物(iii)。然后使该产物与乙酸铵在例如乙醇中反应,从而得到化合物(iv)。然后通过在例如乙醇和甲苯的混合物中与乙醇钠和丙二酸二乙酯反应然后在二噁烷中的酸(例如HCl)中于100℃加热而将该产物环化并脱羧,从而得到化合物(v),或者在碱(例如KOH)的水溶液中于100℃加热然后用HCl水溶液酸化,从而得到化合物(v)。
方案2
制备5H-吡啶并[4,3-b]吲哚母核(ix、x和xi)的通常途径示于方案2。将4-羟基吡啶-2(1H)-酮(v)用肼(vi)在有机非极性溶剂(例如二苯基醚)中加热至175~220℃。为了制备化合物(viii),苯酚(或同分异构酰胺)转化成离去基团(例如三氟甲磺酸根、氯离子或溴离子),可以用三氟甲磺酸酐与碱(例如三乙基胺)在惰性溶剂(例如二氯甲烷)中或者通过用诸如氧氯化磷(或氧溴化磷)等试剂(纯试剂,或者在诸如1,4-二噁烷等极性有机溶剂中)卤化来完成。中间体(viii)可以用胺(使用或不使用诸如三乙基胺等碱)加热(60-160℃)以提供化合物(ix)。中间体(x)能够通过用过量(5-25当量)的所需醇加热(80-160℃)中间体(viii)而获得。类似地,中间体(viii)与合适的硫醇盐(由诸如NaH等氢化物或诸如甲醇钠等碱或碳酸盐产生,或者由甲硅烷基用DMF(N-甲基吡咯烷)中的氟源去保护而产生)的混合物,产生所期望的中间体(x)。在诸如钯(例如PdCl2(PPh3)2-CuI-Et3N)等金属催化剂的存在下在诸如二甲基甲酰胺等溶剂中在加热(30-140℃)下合适的硼酸乙烯酯(通常由炔烃和二烷氧基硼烷制备)和中间体(viii)能够得到相应的烯烃。该烯烃能够通过许多方式(例如用钯碳氢化)还原,从而产生化合物(xi)。
方案3
化合物(xii)可以根据方案3中所述的途径获得。中间体(xi)可以在诸如钯(例如Pd(OAc)2-Xantphos或Pd(OAc)2-dppf)等金属催化剂的存在下用诸如三乙基胺等有机碱并且在诸如甲醇等醇的存在下被羰基化。反应在一氧化碳气氛下在70–85℃进行。还可以使用诸如二甲基亚砜等极性非质子溶剂。
方案4
化合物(xvi)可以根据方案4中所述的途径获得。中间体(xii)可以在诸如钯(例如Pd(PPh3)4)等金属催化剂的存在下在诸如氰化锌等氰化物源的存在下在诸如N,N-二甲基甲酰胺等极性非质子溶剂中于高温(例如160℃)下氰化。产物(xiv)的腈基然后被转化成四唑(xv)。该转化可以使用叠氮基三丁基锡在诸如(三氟甲基)苯等非极性溶剂中于180℃然后使用甲醇中的HCl进行酸性水解而完成。该转化还可以使用其它已知的方法例如叠氮化钠或三甲基甲硅烷基叠氮化物和二丁基氧化锡在诸如苯或甲苯等非极性非质子溶剂中于高温(80–100℃)下进行。然后四唑(xv)可以使用重氮甲烷或三甲基甲硅烷基重氮甲烷在极性非质子溶剂(例如四氢呋喃)中在甲醇的存在下烷基化成产物(xvi)。烷基化还可以使用碱(例如氢化钠或者碳酸盐(钠/钾或铯))和卤代烷在极性非质子溶剂(例如四氢呋喃、1,4-二噁烷、乙腈、N,N-二甲基甲酰胺或N,N-二甲基乙酰胺)中进行。
在一些起始材料的可获性的功能上,方案的顺序可以相互交换,或者根据在中间体上的官能的类型而可以相互交换。
实验程序
实施例1
1-((3-(哌啶-1-基)丙基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
中间体1A
7-溴-5H-吡啶并[4,3-b]吲哚-1-醇
在配备有Dean-Stark的50mL圆底烧瓶中,在N2(3次循环真空然后再填充N2)下添加在二苯基醚(15.75ml)中的(3-溴苯基)肼游离碱(3.20g,17.11mmol)和吡啶-2,4-二醇(1g,9.00mmol)。将混合物加热至175℃约20分钟,然后逐渐升至230℃并搅拌3小时。将两相混合物冷却至100℃并添加甲苯(25ml)。将所得浆料在20℃搅拌1小时,并在Buchner上收集固体。将滤饼用甲苯(3x 5mL)洗涤,并将产物在20℃在高真空下干燥,从而得到2.05g作为含有两种异构体的黄褐色固体。将该固体研磨成微细固体,并在MeOH(5mL)中超声化15分钟,并再次在Buchner上收集。这提供含有约10%的9-溴异构体的761mg的产物。重复该顺序从而得到作为黄褐色固体的7-溴-5H-吡啶并[4,3-b]吲哚-1-醇(642mg,2.4mmol,27.1%产率)。1H NMR(400MHz,DMSO-d6)δppm 6.52(d,J=7.0Hz,1H)7.29-7.37(m,2H)7.67(d,J=1.6Hz,1H)8.00(d,J=8.6Hz,1H)11.13-11.23(m,1H)11.82(s,1H)。
中间体1B
7-溴-1-氯-5H-吡啶并[4,3-b]吲哚
将在POCl3(2.18ml,23.38mmol)中的7-溴-5H-吡啶并[4,3-b]吲哚-1-醇(0.205g,0.78mmol)的混合物在微波设备中加热至175℃15分钟。将反应混合物冷却至20℃并倒在冰(50g)上。将混合物用50重量%的NaOH水溶液(6.14ml,117mmol)碱化,并用EtOAc(2x 50mL)提取水性层。将有机层在无水MgSO4上干燥、过滤和浓缩干燥,从而得到作为黄褐色固体的粗7-溴-1-氯-5H-吡啶并[4,3-b]吲哚(93mg,0.33mmol,42.4%产率),将其按原样用于下一步骤。LCMS m/z 280.9,282.9(M+H)+。
中间体1C
7-溴-N-(3-(哌啶-1-基)丙基)-5H-吡啶并[4,3-b]吲哚-1-胺
将在3-(哌啶-1-基)丙-1-胺(2.00ml,12.59mmol)中的7-溴-1-氯-5H-吡啶并[4,3-b]吲哚(0.093g,0.33mmol)的混合物加热至150℃19小时。将反应混合物冷却至20℃,倒在水(10mL)中并用EtOAc(3x 10mL)萃取。将合并的有机相用水(8x 10mL)洗涤,然后用盐水(10ml)洗涤。将有机相在无水MgSO4上干燥、过滤并浓缩。将残留物使用RediSep 24g柱(CH2Cl2/MeOH/NH4OH)在ISCO上纯化,从而得到94mg红色泡沫,将其悬浮在Et2O(2mL)中并搅拌30分钟。在Buchner上收集固体,用Et2O(2x 0.5mL)洗涤并在高真空中于40℃干燥,从而得到作为粉红色固体的7-溴-N-(3-(哌啶-1-基)丙基)-5H-吡啶并[4,3-b]吲哚-1-胺(56mg,0.14mmol,43.8%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.33-1.45(m,2H)1.46-1.58(m,4H)1.76-1.91(m,2H)2.19-2.48(m,6H)3.53-3.64(m,2H)6.45(br.s.,1H)6.74(d,J=5.8Hz,1H)7.33(dd,J=8.2,1.8Hz,1H)7.64(d,J=1.8Hz,1H)7.93(d,J=5.8Hz,1H)8.22(d,J=8.2Hz,1H)11.60(s,1H)。LCMS m/z(M+H)+=387.1,389.1。
中间体1D
1-((3-(哌啶-1-基)丙基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
将7-溴-N-(3-(哌啶-1-基)丙基)-5H-吡啶并[4,3-b]吲哚-1-胺(0.05g,0.13mmol)、Pd(OAc)2(1.44mg,6.45μmol)和4,5-双(二苯基膦基)-9,9-二甲基呫吨(7.47mg,0.013mmol)的混合物放入在N2下的小瓶中。添加甲醇(0.104ml,2.58mmol)和三乙基胺(0.45ml,3.23mmol),并使一氧化碳鼓泡通过粉红色悬浮液1分钟,将混合物加热至70℃18小时。反应混合物用EtOAc(3mL)和MeOH(2mL)稀释,然后在0.45μm过滤器上过滤。将烧瓶和过滤器用EtOAc(2mL)和MeOH(2mL)冲洗。浓缩至干燥得到67mg橙色油。将粗物质使用水(0.05%TFA)-MeOH(0.05%TFA)在制备型HPLC上从20%纯化至100%。合并所需级分并在真空下除去溶剂。将获得的固体悬浮在EtOAc(5mL)中并添加饱和NaHCO3(3mL)。将混合物剧烈搅拌10分钟,然后用EtOAc(5mL)萃取水性层。将合并的有机层在无水MgSO4上干燥、过滤并浓缩,从而得到33mg油,将其从CH3CN冻干从而得到作为白色固体的1-((3-(哌啶-1-基)丙基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(29mg,0.079mmol,61.3%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.38-1.47(m,2H)1.47-1.61(m,4H)1.79-1.94(m,2H)2.24-2.48(m,6H)3.61(q,J=6.7Hz,2H)3.89(s,3H)6.63(br.s.,1H)6.78(d,J=5.9Hz,1H)7.81(dd,J=8.2,1.5Hz,1H)7.97(d,J=5.9Hz,1H)8.07(d,J=1.5Hz,1H)8.37(d,J=8.2Hz,1H)11.76(s,1H)。LCMS m/z(M+H)+=367.2。
实施例2
3-苯甲基-1-((3-(哌啶-1-基)丙基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
中间体2A
3-氧-4-苯基丁酸乙酯
向SnCl2.2H2O(1.409g,6.2mmol)和2-重氮基乙酸乙酯(8.55g,74.9mmol)在DCM(80ml)中的悬浮液逐滴添加2-苯基乙醛(7.5g,62.4mmol)。搅拌2小时后,将悬浮液过滤并用盐水溶液稀释。分离有机相,将其在无水MgSO4上干燥、过滤并在真空下除去溶剂。将残留物利用Hex-EA(0-40%)使用RediSep柱在ISCO上纯化,从而产生6.00g标题化合物。1H NMR(400MHz,CDCl3)δppm 1.26(t,J=7.04Hz,3H)3.44(s,2H)3.83(s,2H)4.17(q,J=7.30Hz,2H)7.10-7.38(m,5H)。
中间体2B
3-氨基-4-苯基丁-2-烯酸乙酯
将在乙醇中的3-氧-4-苯基丁酸乙酯(0.200g,0.97mmol)和乙酸铵(0.374g,4.8mmol)的混合物加热至75℃。搅拌3小时后将温度冷却至20℃并在真空下除去溶剂。将残留物放在Et2O中并用饱和NaHCO3溶液洗涤。分离有机相,将其在无水MgSO4上干燥并在真空下除去溶剂,从而产生180mg标题化合物。1H NMR(400MHz,DMSO-d6)δppm 1.12(t,J=7.04Hz,3H)3.38(s,2H)3.94(q,J=7.30Hz,2H)4.29(s,1H)7.04(br.s.,1H)7.19-7.34(m,5H)7.72(br.s.,1H)。
中间体2C
6-苯甲基-4-羟基吡啶-2(1H)-酮
将在乙醇(20mL)和甲苯(20ml)的混合物中的3-氨基-4-苯基丁-2-烯酸乙酯(5.45g,26.6mmol)、乙醇钠(10.88ml,29.2mmol)和丙二酸二乙酯(4.46ml,29.2mmol)的混合物加热至80℃30分钟,然后在110℃过夜。真空下除去大多数溶剂并将固体过滤、用甲苯:乙醇(4:1)的混合物冲洗,从而提供3.2g中间体酯。将该酯在4M HCl-二噁烷(60ml)中于100℃加热。真空下除去溶剂,将残留物放入甲醇中并过滤。将获得的固体吸收在SiO2上,并利用DCM-MeOH(0-15%)使用RediSep柱在ISCO上纯化,从而产生1.00g标题化合物。1H NMR(400MHz,DMSO-d6)δppm 3.71(s,2H)5.37(d,J=1.96Hz,1H)5.56(d,J=1.96Hz,1H)7.11-7.37(m,5H)10.41(br.s.,1H)11.14(br.s.,1H)。
中间体2D
3-苯甲基-7-溴-5H-吡啶并[4,3-b]吲哚-1-醇
在配备有Dean-Stark的50mL圆底烧瓶中,添加在脱气二苯基醚(9.25ml)中的(3-溴苯基)肼游离碱(1.76g,9.44mmol)和6-苯甲基-4-羟基吡啶-2(1H)-酮(1g,4.97mmol)。将烧瓶和Dean-Stark用N2(3次循环、真空然后再填充N2)冲洗并加热至175℃1小时,并逐渐升高至230℃。3小时后将混合物冷却至100℃并添加甲苯(14ml)。所得悬浮液在20℃搅拌1小时,在Buchner上收集固体,用甲苯(3x 3mL)洗涤,并在20℃在高真空下干燥,从而得到含有两种异构体的1.17g黄褐色固体。将获得的固体吸收在SiO2上,并使用RediSep 40g柱DCM-MeOH(0-20%)在ISCO上纯化,从而产生作为黄褐色固体的3-苯甲基-7-溴-5H-吡啶并[4,3-b]吲哚-1-醇(534mg,1.512mmol,30.4%产率)。LCMS m/z 353.0,355.0(M+H)+。
中间体2E
3-苯甲基-7-溴-1-氯-5H-吡啶并[4,3-b]吲哚
将在氧氯化磷(3.00ml,32.2mmol)中的3-苯甲基-7-溴-5H-吡啶并[4,3-b]吲哚-1-醇(0.205g,0.58mmol)的混合物在微波设备中加热至175℃15分钟,并将反应混合物在旋转蒸发器上浓缩至干燥。添加水(12.00ml),通过添加45重量%氢氧化钾水溶液(13.4ml,157mmol)使pH为8-10。所得悬浮液搅拌30分钟,在Buchner上收集固体,然后用水(2x 1.5mL)洗涤,从而得到196mg褐色固体(粗品)。将残留物用Hex-EtOAc(0-100%)使用RediSep 12g柱在ISCO上纯化,从而得到作为粉红色固体的3-苯甲基-7-溴-1-氯-5H-吡啶并[4,3-b]吲哚(61mg,0.16mmol,28.3%产率)。1H NMR(400MHz,DMSO-d6)δppm 4.19(s,2H)7.18-7.26(m,1H)7.26-7.35(m,4H)7.38(s,1H)7.48(dd,J=8.20,1.60Hz,1H)7.79(d,J=1.60Hz,1H)8.22(d,J=8.22Hz,1H)12.11(br.s.,1H);LCMS m/z 371.0,373.0(M+H)+。
中间体2F
3-苯甲基-7-溴-N-(3-(哌啶-1-基)丙基-5H-吡啶并[4,3-b]吲哚-1-胺
将在3-(哌啶-1-基)丙-1-胺(1.00ml,6.29mmol)中的粗3-苯甲基-7-溴-1-氯-5H-吡啶并[4,3-b]吲哚(0.170g,0.45mmol)的混合物加热至150℃16小时。将反应混合物冷却至20℃并倒入水(20mL)中。用EtOAc(3x 20mL)萃取水层,并用水(3x 20mL)然后盐水(10mL)洗涤合并的有机层。将有机层在无水MgSO4上干燥、过滤并浓缩,从而得到253mg红色油。将残留物用DCM–2%NH4OH/MeOH(0-20%)使用RediSep 40g柱在ISCO上纯化,从而得到169mg红色油。将该红色油溶解在MeOH(3.4ml)中,并添加HCl 4M 1,4-二噁烷溶液(0.266ml,1.06mmol)。向所得红色溶液添加EtOAc(6.80ml)并搅拌悬浮液2小时。在Buchner上收集固体并用MeOH:EtOAc(1:4,3x 0.5mL)洗涤。将该固体(75mg)重悬在EtOAc(15mL)-NaHCO3(饱和)(7.5mL)中并剧烈搅拌10分钟。分层,用EtOAc(5mL)反萃取水层。将合并的有机层在无水MgSO4上干燥、过滤并浓缩,从而得到作为红色泡沫的3-苯甲基-7-溴-N-(3-(哌啶-1-基)丙基)-5H-吡啶并[4,3-b]吲哚-1-胺(70mg,0.147mmol,32.1%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.31-1.43(m,2H)1.50(quin,J=5.5Hz,4H)1.80(quin,J=6.9Hz,2H)2.21-2.44(m,6H)3.51-3.65(m,2H)3.96(s,2H)6.42(t,J=5.5Hz,1H)6.55(s,1H)7.12-7.21(m,1H)7.23-7.31(m,3H)7.32-7.39(m,2H)7.57(d,J=1.6Hz,1H)8.15(d,J=8.6Hz,1H)11.44(s,1H);LCMS m/z 477.2,479.2(M+H)+。
中间体2G
3-苯甲基-1-((3-(哌啶-1-基)丙基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
向在MeOH(0.73ml)、三乙基胺(0.051ml,0.37mmol)和DMSO(1.45ml)中的3-苯甲基-7-溴-N-(3-(哌啶-1-基)丙基)-5H-吡啶并[4,3-b]吲哚-1-胺(0.035g,0.07mmol)的混合物添加DPPF(4.06mg,7.3μmol)和Pd(OAc)2(1.646mg,7.3μmol)。将烧瓶用一氧化碳排空(3次真空+一氧化碳再填充循环),并使一氧化碳鼓泡通过红色悬浮液1分钟,在一氧化碳气氛(气囊)下,将混合物加热至85℃21.5小时。将反应混合物用EtOAc(10mL)–水(10mL)稀释并分层。用EtOAc(2x 10mL)反萃取水层,并将合并的有机层用水(4x 10mL)然后用盐水(10mL)洗涤。将有机层在无水MgSO4上干燥、过滤并浓缩,从而得到40mg红色油。将残留物用DCM–2%NH4OH/MeOH(0-20%)使用RediSep 12g柱在ISCO上纯化,从而产生32mg红色油。将残留物用水(0.05%TFA)-MeOH(0.05%TFA)在制备型HPLC上从20%纯化至100%。合并所需的级分并在真空下除去溶剂。将获得的残留物从乙腈冻干,从而得到作为白色固体的3-苯甲基-1-((3-(哌啶-1-基)丙基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯2,2,2-三氟乙酸盐(18.4mg,0.032mmol,44.0%产率)。游离碱上的1H NMR(用固体Na2CO3处理然后过滤的DMSO中的TFA盐)(400MHz,DMSO-d6)δppm 1.39(m,J=5.1Hz,2H)1.51(quin,J=5.5Hz,4H)1.82(quin,J=6.9Hz,2H)2.18-2.46(m,6H)3.61(q,J=6.7Hz,2H)3.88(s,3H)3.98(s,2H)6.57(s,1H)6.59(t,J=5.5Hz,1H)7.13-7.22(m,1H)7.27(t,J=7.4Hz,2H)7.36(m,J=7.0Hz,2H)7.77(dd,J=8.2,1.4Hz,1H)8.00(d,J=1.4Hz,1H)8.30(d,J=8.2Hz,1H)11.59(s,1H);HRMS m/z 457.2596(M+H)+。
实施例3
3-苯甲基-1-((2-(吡咯烷-1-基)乙基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
中间体3A
3-苯甲基-7-溴-N-(2-(吡咯烷-1-基)乙基)-5H-吡啶并[4,3-b]吲哚-1-胺
使用经纯化的中间体2E(30mg,0.081mmol)和2-(吡咯烷-1-基)乙胺(0.512ml,4.04mmol),按照中间体2F的制备程序,得到作为红色油的3-苯甲基-7-溴-N-(2-(吡咯烷-1-基)乙基)-5H-吡啶并[4,3-b]吲哚-1-胺(21mg,0.047mmol,57.9%产率)。LCMS m/z 449.2,451.2(M+H)+。
实施例3
3-苯甲基-1-((2-(吡咯烷-1-基)乙基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
按照实施例1的制备程序,使用3-苯甲基-7-溴-N-(2-(吡咯烷-1-基)乙基)-5H-吡啶并[4,3-b]吲哚-1-胺(21mg,0.047mmol)、Pd(OAc)2(1.049mg,4.6μmol)、4,5-双(二苯基膦基)-9,9-二甲基呫吨(5.41mg,9.3μmol)、MeOH(76μl,1.86mmol)和三乙基胺(326μl,2.3mmol),得到作为白色固体的3-苯甲基-1-((2-(吡咯烷-1-基)乙基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(10.2mg,0.024mmol,50.9%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.60-1.87(m,4H)2.57-3.03(m,6H)3.66-3.82(m,2H)3.88(s,3H)4.00(s,2H)6.64(s,1H)6.61(br.s.,1H)7.14-7.23(m,1H)7.29(t,J=7.63Hz,2H)7.32-7.39(m,2H)7.80(d,J=8.22Hz,1H)8.02(s,1H)8.28(d,J=8.22Hz,1H)11.65(br.s.,1H);HRMS m/z 429.2293(M+H)+。
实施例4
3-苯甲基-1-((3-(二甲基氨基)丙基)(甲基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
中间体4A
N1-(3-苯甲基-7-溴-5H-吡啶并[4,3-b]吲哚-1-基)-N1,N3,N3-三甲基丙烷-1,3-二胺
按照中间体2F的制备程序,使用经纯化的中间体2E(30mg,0.08mmol)和N1,N1,N3-三甲基丙烷-1,3-二胺(0.591ml,4.04mmol),得到作为黄色油的N1-(3-苯甲基-7-溴-5H-吡啶并[4,3-b]吲哚-1-基)-N1,N3,N3-三甲基丙烷-1,3-二胺(22mg,0.049mmol,60.4%产率)。LCMS m/z 451.2,453.2(M+H)+。
实施例4
3-苯甲基-1-((3-(二甲基氨基)丙基)(甲基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
按照实施例1的制备程序,使用N1-(3-苯甲基-7-溴-5H-吡啶并[4,3-b]吲哚-1-基)-N1,N3,N3-三甲基丙烷-1,3-二胺(22mg,0.05mmol)、Pd(OAc)2(1.6mg,7.3μmol)、4,5-双(二苯基膦基)-9,9-二甲基呫吨(8.5mg,0.015mmol)、MeOH(79μl,1.95mmol)和三乙基胺(340μl,2.43mmol),得到作为白色固体的3-苯甲基-1-((3-(di甲基氨基)丙基)(甲基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(12.7mg,0.029mmol,60.5%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.75(quin,J=7.24Hz,2H)2.06(s,6H)2.20(t,J=6.06Hz,2H)3.03(s,3H)3.42-3.52(m,2H)3.89(s,3H)4.07(s,2H)6.86(s,1H)7.15-7.22(m,1H)7.28(t,J=7.43Hz,2H)7.32-7.39(m,2H)7.84(dd,J=8.41,1.20Hz,1H)7.94(d,J=8.40Hz,1H)8.05(d,J=1.20Hz,1H)11.76(s,1H);HRMS m/z 431.2453(M+H)+。
实施例5
3-苯甲基-7-(2-甲基-2H-四唑-5基)-N-(3-(哌啶-1-基)丙基)-5H-吡啶并[4,3-b]吲哚-1-胺
中间体5A
3-苯甲基-1-((3-(哌啶-1-基)丙基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲腈
将在DMF(0.70ml,9.04mmol)中的3-苯甲基-7-溴-N-(3-(哌啶-1-基)丙基)-5H-吡啶并[4,3-b]吲哚-1-胺(0.022g,0.046mmol)、氰化锌(10.8mg,0.09mmol)和四(三苯基膦)钯(0)(10.6mg,9.2μmol)用氮气(3次真空+氮气再填充循环)冲洗。将混合物在微波设备中加热至160℃1.5小时。将反应混合物倒入EtOAc(30mL)中并用水(2x 10mL)然后用盐水(10mL)洗涤。将有机层在无水MgSO4上干燥、过滤并浓缩,从而得到35mg红色油。将残留物用DCM–2%NH4OH/MeOH(0-20%)使用RediSep 4g柱在ISCO上纯化,并将获得的固体从乙腈冻干,从而得到作为粉红色固体的3-苯甲基-1-((3-(哌啶-1-基)丙基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲腈(14.3mg,0.03mmol,73.3%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.31-1.45(m,2H)1.50(s,4H)1.81(s,2H)2.20-2.46(m,6H)3.54-3.65(m,2H)3.98(s,2H)6.59(s,1H)6.65(t,J=5.48Hz,1H)7.13-7.22(m,1H)7.27(t,J=7.43Hz,2H)7.36(d,J=7.43Hz,2H)7.56(d,J=8.22Hz,1H)7.85(s,1H)8.39(d,J=8.22Hz,1H)11.76(s,1H);HRMS m/z 424.2485(M+H)+。
中间体5B
3-苯甲基-N-(3-(哌啶-1-基)丙基)-7-(2H-四唑-5-基)-5H-吡啶并[4,3-b]吲哚-1-胺
将在(三氟甲基)苯(750μl)中的3-苯甲基-1-((3-(哌啶-1-基)丙基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲腈(13.1mg,0.03mmol)和叠氮基三丁基锡(89μl,0.32mmol)的混合物在微波设备中加热至180℃30分钟。将混合物浓缩至干燥,从而得到红色油,对其添加MeOH(750μl)和HCl 4M 1,4-二噁烷溶液(232μl,0.928mmol)。添加Et2O(1.4mL)并将所得悬浮液搅拌1小时。在Buchner上收集固体,并用Et2O(3x 0.5mL)然后用己烷(3x 0.5mL)洗涤。将固体在高真空下于20℃干燥,从而得到作为黄褐色固体的3-苯甲基-N-(3-(哌啶-1-基)丙基)-7-(2H-四唑-5-基)-5H-吡啶并[4,3-b]吲哚-1-胺盐酸盐(16mg,0.032mmol,103%产率)。LCMS m/z 451.2,467.4(M+H)+。
实施例5
3-苯甲基-7-(2-甲基-2H-四唑-5基)-N-(3-(哌啶-1-基)丙基)-5H-吡啶并[4,3-b]吲哚-1-胺
向在THF(1mL)和MeOH(0.25ml)中的3-苯甲基-N-(3-(哌啶-1-基)丙基)-7-(2H-四唑-5-基)-5H-吡啶并[4,3-b]吲哚-1-胺盐酸盐(16mg,0.032mmol)和DIPEA(23.76μl,0.136mmol)的混合物添加重氮甲烷0.5M Et2O溶液(372μl,0.18mmol)。完成时,用乙酸(3滴)淬灭反应并在旋转蒸发器上浓缩至干燥。将残留物使用水(0.05%TFA)-MeOH(0.05%TFA)在制备型HPLC上从20%纯化至100%。合并所需级分并在真空下除去溶剂。将获得的残留物从乙腈冻干,从而得到作为白色固体的3-苯甲基-7-(2-甲基-2H-四唑-5-基)-N-(3-(哌啶-1-基)丙基)-5H-吡啶并[4,3-b]吲哚-1-胺2,2,2-三氟乙酸盐(10.4mg,0.017mmol,56.5%产率)。游离碱的1H NMR(将在DMSO中的TFA盐用固体Na2CO3处理然后过滤)(400MHz,DMSO-d6)δppm 1.40(m,J=5.09Hz,2H)1.52(dt,J=10.86,5.33Hz,4H)1.83(dt,J=13.89,6.75Hz,2H)2.25-2.42(m,6H)3.56-3.66(m,2H)3.98(s,2H)4.43(s,3H)6.53(t,J=5.28Hz,1H)6.58(s,1H)7.14-7.22(m,1H)7.28(t,J=7.63Hz,2H)7.37(d,J=7.04Hz,2H)7.86(dd,J=8.20,1.20Hz,1H)8.08(s,1H)8.35(d,J=8.22Hz,1H)11.57(br.s.,1H);HRMS m/z 481.2823(M+H)+。
实施例6
3-(3-甲氧基苯甲基)-1-((4-(吡咯烷-1-基)丁基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
中间体6A
4-(3-甲氧基苯基)-3-氧代丁酸乙酯
用5分钟向2-(3-甲氧基苯基)乙酸(5g,30.1mmol)在CH2Cl2(50mL)中的溶液分批添加CDI(5.28g,32.6mmol)。在20℃搅拌混合物30分钟。添加麦德鲁姆酸(4.70g,32.6mmol)并在20℃搅拌16小时。完成时,将反应混合物倒入HCl 5%(175mL,245mmol)中。剧烈搅拌并分层。用CH2Cl2(3x 50mL)萃取水层。将合并的有机层用HCl 5%(125mL)然后用水(125mL)洗涤。将有机层在无水MgSO4上干燥、过滤并浓缩,从而得到9.56g浅橙色油。将所述油放入100mL圆底烧瓶中并溶解在无水EtOH(25mL,429mmol)中。将反应混合物加热回流1小时,然后在旋转蒸发器上浓缩至干燥。将所得油倒入NaHCO3 5重量%水溶液(175mL)。用EtOAc(3x 50mL)萃取所述混合物。用水(125mL)然后用盐水(50mL)洗涤合并的有机层。将有机层在无水MgSO4上干燥、过滤并浓缩,从而得到6.55g浅橙色油。将残留物使用RediSep Gold 120g柱(Hex/EtOAc)在ISCO上纯化,从而产生作为无色油的4-(3-甲氧基苯基)-3-氧代丁酸乙酯(6.1g,25.8mmol,86%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.17(t,J=7.20Hz,3H)3.64(s,2H)3.73(s,3H)3.83(s,2H)4.07(q,J=7.20Hz,2H)6.73-6.78(m,2H)6.80-6.86(m,1H)7.19-7.27(m,1H);LCMS m/z 237.2(M+H)+。
中间体6B
3-氨基-4-(3-甲氧基苯基)丁-2-烯酸乙酯
将在无水EtOH(103mL)中的4-(3-甲氧基苯基)-3-氧代丁酸乙酯(6.1g,25.8mmol)和乙酸铵(9.95g,129mmol)的混合物加热回流5小时。将混合物在旋转蒸发器上浓缩至干燥,并用EtOAc(129mL)稀释。将有机层用水(2x 129mL)然后用盐水(30mL)洗涤。将有机层在无水MgSO4上干燥、过滤和浓缩至干燥,从而产生作为黄色油的3-氨基-4-(3-甲氧基苯基)丁-2-烯酸乙酯(6.07g,25.8mmol,100%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.12(t,J=7.04Hz,3H)3.34(s,2H)3.73(s,3H)3.94(q,J=7.04Hz,2H)4.31(s,1H)6.77-6.83(m,1H)6.83-6.89(m,2H)7.02(br.s.,1H)7.21(t,J=8.02Hz,1H)7.71(br.s.,1H);LCMS m/z 236.2(M+H)+。
中间体6C
4-羟基-6-(3-甲氧基苯甲基)-2-氧-1,2-二氢吡啶-3-甲酸乙酯
将3-氨基-4-(3-甲氧基苯基)丁-2-烯酸乙酯(6.07g,25.8mmol)、丙二酸二乙酯(4.13mL,27.1mmol)和乙醇钠21重量%乙醇溶液(11.56mL,31.0mmol)的混合物加热至150℃,并搅拌43小时。将悬浮液冷却至20℃并倒入水:冰(1:1)(65g)的混合物中。将混合物用HCl 2N水溶液(21.93mL,43.9mmol)酸化。加热至45℃并缓慢冷却至20℃。将所得白色悬浮液搅拌2小时。在Buchner上收集固体,并用水(2x 15mL)洗涤固体。将产物在20℃在高真空下干燥直到恒重,从而得到作为白色固体的4-羟基-6-(3-甲氧基苯甲基)-2-氧-1,2-二氢吡啶-3-甲酸乙酯(6.92g,22.81mmol,88%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.24(t,J=7.04Hz,3H)3.72(s,2H)3.74(s,3H)4.23(q,J=7.04Hz,2H)5.73(s,1H)6.80-6.86(m,1H)6.88(d,J=7.83Hz,1H)6.91-6.95(m,1H)7.20-7.28(m,1H)11.53(br.s.,1H)12.39(s,1H);LCMS m/z 304.1(M+H)+。
中间体6D
4-羟基-6-(3-甲氧基苯甲基)吡啶-2(1H)-酮
将在氢氧化钾(7.26g,110mmol)的水(53.5mL)溶液中的4-羟基-6-(3-甲氧基苯甲基)-2-氧-1,2-二氢吡啶-3-甲酸乙酯(6.67g,21.99mmol)的混合物加热回流2.5小时。将混合物冷却至20℃,并用HCl 4M水溶液(29.4mL)酸化至pH 2。将所得白色悬浮液搅拌30分钟。在Buchner上收集固体,并用水(3x 25mL)洗涤固体。将产物在高真空下在20℃干燥直到恒重,从而得到作为灰白色固体的4-羟基-6-(3-甲氧基苯甲基)吡啶-2(1H)-酮(4.36g,18.85mmol,86%产率)。1H NMR(400MHz,DMSO-d6)δppm 3.66(s,2H)3.73(s,3H)5.33(d,J=2.35Hz,1H)5.56(d,J=2.35Hz,1H)6.79-6.84(m,1H)6.86(d,J=7.43Hz,1H)6.88-6.92(m,1H)7.23(t,J=8.02Hz,1H)10.32(s,1H)11.03(br.s.,1H);LCMS m/z 232.1(M+H)+.。
中间体6E
7-溴-3-(3-甲氧基苯甲基)-5H-吡咯并[4,3-b]吲哚-1-醇
按照中间体2D的制备程序,使用(3-溴苯基)肼游离碱(6.51g,34.81mmol)和中间体6D(4.00g,17.3mmol),得到作为含有7-溴和9-溴异构体(比例2.6:1)的混合物的灰色固体的7-溴-3-(3-甲氧基苯甲基)-5H-吡啶并[4,3-b]吲哚-1-醇(4.70g,12.26mmol,70.9%产率)。该中间体未通过快速色谱进行纯化。LCMS m/z 383.1,385.1(M+H)+。
中间体6F
7-溴-1-氯-3-(3-甲氧基苯甲基)-5H-吡咯并[4,3-b]吲哚
按照中间体2E的制备程序,使用7-溴-3-(3-甲氧基苯甲基)-5H-吡啶并[4,3-b]吲哚-1-醇(4.2g,10.95mmol)和氧氯化磷(45.0mL,483mmol),得到作为含有7-溴和9-溴异构体(比例2.3:1)的混合物的灰色固体的7-溴-1-氯-3-(3-甲氧基苯甲基)-5H-吡啶并[4,3-b]吲哚(4.90g,12.20mmol,111%产率)。该中间体不进行纯化。LCMS m/z 401.1,403.1(M+H)+。
中间体6G
7-溴-3-(3-甲氧基苯甲基)-N-(4-(吡咯烷-1-基)丁基)-5H-吡啶并[4,3-b]吲哚-1-胺
按照中间体2F的制备程序,使用中间体6F(500mg,1.245mmol)和4-(吡咯烷-1-基)丁烷-1-胺(0.959ml,6.22mmol),得到作为粉红色固体的7-溴-3-(3-甲氧基苯甲基)-N-(4-(吡咯烷-1-基)丁基)-5H-吡啶并[4,3-b]吲哚-1-胺(214mg,0.422mmol,33.9%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.48-1.62(m,2H)1.62-1.81(m,6H)2.52-2.86(m,6H)3.58(q,J=6.65Hz,2H)3.72(s,3H)3.93(s,2H)6.39(t,J=5.67Hz,1H)6.56(s,1H)6.75(dd,J=8.22,1.57Hz,1H)6.89-6.96(m,2H)7.19(t,J=7.83Hz,1H)7.30(dd,J=8.20,2.00Hz,1H)7.57(d,J=1.96Hz,1H)8.18(d,J=8.22Hz,1H)11.44(s,1H);LCMS m/z 507.2,509.2(M+H)+。
中间体6H
3-(3-甲氧基苯甲基)-1-((4-(吡咯烷-1-基)丁基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
按照实施例1的制备程序,使用7-溴-3-(3-甲氧基苯甲基)-N-(4-(吡咯烷-1-基)丁基)-5H-吡啶并[4,3-b]吲哚-1-胺(120mg,0.236mmol)、Pd(OAc)2(7.96mg,0.035mmol)、4,5-双(二苯基膦基)-9,9-二甲基呫吨(41mg,0.071mmol)、MeOH(383μl,9.46mmol)和三乙基胺(1.65mL,11.8mmol),得到作为白色固体的3-(3-甲氧基苯甲基)-1-((4-(吡咯烷-1-基)丁基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(53mg,0.109mmol,46.1%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.63-1.78(m,4H)1.91(br.s.,4H)2.99(br.s.,2H)3.09-3.21(m,2H)3.46(br.s.,2H)3.58-3.68(m,2H)3.73(s,3H)3.88(s,3H)3.96(s,2H)6.55-6.64(m,2H)6.78(m,J=8.20,1.60Hz,1H)6.89-6.98(m,2H)7.21(t,J=7.83Hz,1H)7.79(dd,J=8.20,1.37Hz,1H)8.01(d,J=1.40Hz,1H)8.34(d,J=8.22Hz,1H)11.62(s,1H);HRMS m/z 487.2701(M+H)+。
实施例7
3-(3-羟基苯甲基)-1-((4-(吡咯烷-1-基)丁基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
将在CH2Cl2(7mL)中的3-(3-甲氧基苯甲基)-1-((4-(吡咯烷-1-基)丁基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(0.045g,0.092mmol)的混合物冷却至-78℃。添加三溴化硼1M CH2Cl2溶液(0.555mL,0.555mmol)。将所得悬浮液搅拌30分钟,然后缓慢升温至20℃并再搅拌21小时。添加MeOH(4.00ml,99mmol),并将混合物在20℃搅拌1小时,然后加热回流7小时。将混合物在旋转蒸发器上浓缩至干燥。将残留物使用RediSep 4g柱(CH2Cl2/MeOH)在ISCO上纯化2次,从而得到15mg灰白色粘性固体。将固体悬浮在Et2O(2mL)中并搅拌30分钟。在Buchner上收集固体并将固体用Et2O(2x 0.5mL)洗涤。将产物在高真空下于40℃干燥直到恒重,从而得到作为黄褐色固体的3-(3-羟基苯甲基)-1-((4-(吡咯烷-1-基)丁基)氨基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(13mg,0.028mmol,29.7%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.60-1.79(m,4H)1.80-2.08(m,4H)2.80-3.06(m,2H)3.08-3.21(m,2H)3.41-3.55(m,2H)3.57-3.69(m,2H)3.82-3.96(m,5H)6.49-6.66(m,3H)6.71-6.82(m,2H)7.08(t,J=7.63Hz,1H)7.79(d,J=7.43Hz,1H)8.01(br.s.,1H)8.34(d,J=8.22Hz,1H)9.23(br.s.,1H)11.62(br.s.,1H);HRMS m/z 473.2568(M+H)+。
实施例8
1-((2-((叔丁氧羰基)氨基)乙基)(甲基)氨基)乙基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
中间体8A
3-氧-4-(噻吩-3-基)丁酸乙酯
按照中间体6A的制备程序,对于第一反应使用2-(噻吩-3-基)乙酸(6g,42.2mmol)、CH2Cl2(70mL)、CDI(7.41g,45.7mmol)和麦德鲁姆酸(6.59g,45.7mmol)并且对于第二反应使用无水EtOH(50mL),得到作为浅橙色油的3-氧-4-(噻吩-3-基)丁酸乙酯(8.23g,38.8mmol,92%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.18(t,J=7.24Hz,3H)3.63(s,2H)3.88(s,2H)4.08(q,J=7.20Hz,2H)6.96(dd,J=4.89,1.37Hz,1H)7.29(m,J=1.76,0.98Hz,1H)7.49(dd,J=4.89,2.93Hz,1H);LCMS m/z 213.0(M+H)+。
中间体8B
3-氨基-4-(噻吩-3-基)丁-2-烯酸乙酯
按照中间体6B的制备程序,使用3-氧-4-(噻吩-3-基)丁酸乙酯(8.23g,38.8mmol)、乙酸铵(14.94g,194mmol)和无水EtOH(155mL),得到作为橙色油的3-氨基-4-(噻吩-3-基)丁-2-烯酸乙酯(8.10g,38.3mmol,99%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.12(t,J=7.04Hz,3H)3.40(s,2H)3.94(q,J=7.04Hz,2H)4.30(s,1H)7.04(br.s,1H)7.02(dd,J=4.70,1.17Hz,1H)7.30(m,J=1.96,1.17Hz,1H)7.46(dd,J=4.89,2.93Hz,1H)7.70(br.s.,1H);LCMS m/z 212.1(M+H)+。
中间体8C
4-羟基-2-氧-6-(噻吩-3-基甲基)-1,2-二氢吡啶-3-甲酸乙酯
按照中间体6C的制备程序,使用3-氨基-4-(噻吩-3-基)丁-2-烯酸乙酯(8.10g,38.3mmol)、丙二酸二乙酯(7.31mL,47.9mmol)和乙醇钠21重量%乙醇溶液(20.04ml,53.7mmol),得到作为黄褐色固体的4-羟基-2-氧-6-(噻吩-3-基甲基)-1,2-二氢吡啶-3-甲酸乙酯(6.59g,23.59mmol,61.5%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.25(t,J=7.20Hz,3H)3.77(s,2H)4.23(q,J=7.20Hz,2H)5.71(s,1H)7.06(dd,J=5.09,1.17Hz,1H)7.36(dd,J=2.74,1.17Hz,1H)7.51(dd,J=5.10,2.70Hz,1H)11.53(br.s.,1H)12.42(s,1H);LCMS m/z 280.1(M+H)+。
中间体8D
4-羟基-6-(噻吩-3-基甲基)-吡啶-2(1H)-酮
按照中间体6D的制备程序,使用4-羟基-2-氧-6-(噻吩-3-基甲基)-1,2-二氢吡啶-3-甲酸乙酯(6.59g,23.59mmol)、氢氧化钾(7.79g,118mmol)和水(57.4mL),得到作为灰白色固体的4-羟基-6-(噻吩-3-基甲基)吡啶-2(1H)-酮(4.62g,22.29mmol,94%产率)。1H NMR(400MHz,DMSO-d6)δppm 3.71(s,2H)5.34(d,J=2.20Hz,1H)5.55(d,J=2.20Hz,1H)7.04(dd,J=4.89,1.37Hz,1H)7.32(m,J=1.76,0.98Hz,1H)7.49(dd,J=4.89,2.93Hz,1H)10.34(s,1H)11.04(br.s.,1H);LCMS m/z 208.2(M+H)+。
中间体8E
7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-醇
按照中间体2D的制备程序,使用(3-溴苯基)肼游离碱(8.12g,43.4mmol)和中间体8D(4.50g,21.7mmol),得到作为含有7-溴和9-溴异构体(比例2:1)的混合物的灰色固体的7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-醇(6.69g,18.62mmol,86%产率)。该中间体不通过快速色谱进行纯化。LCMS m/z 359.0,361.0(M+H)+。
中间体8F
7-溴-1-氯-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚
按照中间体2E的制备程序,使用7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-醇(6.69g,18.63mmol)和氧氯化磷(52.1mL,558mmol),得到7.85g粗品暗灰色固体。将残留物(2.15g)使用RediSep 80g柱在ISCO上纯化,并将残留物(5.70g)使用RediSep Gold 220g柱(Hexane/CH2Cl2/MeOH)在ISCO上纯化,从而得到7.15g褐色固体。将该固体悬浮在1,4-二噁烷(220mL)中并加热回流1小时。冷却至20℃并搅拌16小时。将固体在Buchner上过滤并用1,4-二噁烷(2x 12.5mL)洗涤固体。将滤液浓缩至干燥,从而得到3.38g褐色泡沫。将该泡沫分成两部分,并将每部分使用RediSep 120g柱(Hex/EtOAc)在ISCO上纯化,从而得到作为浅橙色固体的7-溴-1-氯-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚(1.54g,4.08mmol,21.90%产率)。LCMS m/z 377.0,379.0(M+H)+。
中间体8G
N1-(2-氨基乙基)-N2-(7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)-N1-甲基乙烷-1,2-二胺
按照中间体2F的制备程序,使用中间体8F(100mg,0.265mmol)和N1-(2-氨基乙基)-N1-甲基乙烷-1,2-二胺(1.023ml,7.94mmol),得到作为黄色泡沫的N1-(2-氨基乙基)-N2-(7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)-N1-甲基乙烷-1,2-二胺(107mg,0.233mmol,88%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.54(br.s.,2H)2.26(s,3H)2.40(t,J=6.46Hz,2H)2.62(t,J=6.46Hz,4H)3.66(q,J=6.26Hz,2H)3.98(s,2H)6.29(t,J=5.67Hz,1H)6.56(s,1H)7.11(dd,J=4.89,0.98Hz,1H)7.27(d,J=1.96Hz,1H)7.31(dd,J=8.41,1.76Hz,1H)7.44(dd,J=5.09,3.13Hz,1H)7.58(d,J=1.96Hz,1H)8.08(d,J=8.22Hz,1H)11.46(br.s.,1H);LCMS m/z 458.1,460.1(M+H)+。
中间体8H
(2-((2-((7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)氨基)乙基)(甲基)氨基)乙基)氨基甲酸叔丁酯
向在CH2Cl2(4.6mL)中的N1-(2-氨基乙基)-N2-(7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)-N1-甲基乙烷-1,2-二胺(0.099g,0.216mmol)和三乙基胺(0.060ml,0.432mmol)的混合物添加二碳酸二叔丁酯(0.070mL,0.302mmol)在CH2Cl2(0.46mL)中的溶液。在20℃搅拌15分钟。将混合物在旋转蒸发器上浓缩至干燥。将残留物使用RediSep 12g柱(CH2Cl2/MeOH/NH4OH)在ISCO上纯化,从而得到作为白色泡沫的(2-((2-((7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)氨基)乙基)(甲基)氨基)乙基)氨基甲酸叔丁酯(107mg,0.192mmol,89%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.33(s,9H)2.27(br.s.,3H)2.46(br.s.,2H)2.64(br.s.,2H)3.06(br.s.,2H)3.65(br.s.,2H)3.99(s,2H)6.27(br.s.,1H)6.56(br.s.,1H)6.62(br.s.,1H)7.10(d,J=4.70Hz,1H)7.26(d,J=2.35Hz,1H)7.32(d,J=8.22Hz,1H)7.43(dd,J=4.70,3.13Hz,1H)7.58(s,1H)8.08(d,J=7.83Hz,1H)11.47(br.s.,1H);LCMS m/z 558.2,560.2(M+H)+。
实施例8
1-((2-((2-((叔丁氧羰基)氨基)乙基)(甲基)氨基)乙基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
按照实施例1的制备程序,使用(2-((2-((7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)氨基)乙基)(甲基)氨基)乙基)氨基甲酸叔丁酯(88mg,0.158mmol)、Pd(OAc)2(5.31mg,0.024mmol)、4,5-双(二苯基膦基)-9,9-二甲基呫吨(27.3mg,0.047mmol)、MeOH(255μl,6.30mmol)和三乙基胺(1.1mL,7.88mmol),得到作为白色泡沫的1-((2-((2-((叔丁氧羰基)氨基)乙基)(甲基)氨基)乙基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(46mg,0.086mmol,54.3%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.33(s,9H)2.20-2.34(m,3H)2.43(br.s,2H)2.65(br.s.,2H)3.07(br.s.,2H)3.67(br.s.,2H)3.88(s,3H)4.01(s,2H)6.43(br.s.,1H)6.58(s,1H)6.63(br.s.,1H)7.11(d,J=4.70Hz,1H)7.27(d,J=1.57Hz,1H)7.44(dd,J=4.70,3.13Hz,1H)7.81(d,J=8.22Hz,1H)8.01(s,1H)8.22(d,J=8.22Hz,1H)11.62(br.s.,1H);HRMS m/z 538.2485(M+H)+。
实施例9
1-((3-吗啉基丙基)氨基)-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
中间体9A
3-氧-4-(吡啶-3-基)丁酸乙酯
向在CH2Cl2(144mL)中的2-(吡啶-3-基)乙酸盐酸盐(15g,86mmol)和三乙基胺(12.04mL,86mmol)的混合物一次性添加CDI(15.17g,94mmol)。在20℃搅拌45分钟,然后添加麦德鲁姆酸(13.49g,94mmol)。将反应混合物在20℃下搅拌19小时。将混合物在旋转蒸发器上浓缩至干燥。将所得油溶解在EtOAc(225mL)中。用饱和NaHCO3(2x 110mL)然后用水-饱和NaHCO3(1:1,110mL)萃取有机层。向合并的水层添加水(110mL)。将水层用EtOAc(3x 110mL)洗涤。用浓HCl(44mL)将水层酸化至pH 4。搅拌所得悬浮液30分钟。在Buchner上收集固体,并将固体用水(2x 15mL)洗涤。将产物在高真空于20℃干燥直到恒重。向滤液添加NaCl(50g)并搅拌直到溶解。将滤液用CH2Cl2(5x 175mL)萃取。将有机层在无水MgSO4上干燥、过滤并浓缩至干燥。将合并的中间体(21.42g)溶解在无水EtOH(202mL)中并加热回流5小时。将混合物在旋转蒸发器上浓缩至干燥。将所得油添加至5重量%碳酸氢钠水溶液(300mL)。用EtOAc(3x 150mL)萃取混合物。将合并的有机层用水(200mL)然后用盐水(200mL)洗涤。将水和盐水洗涤物合并,并用EtOAc(150mL)反萃取。将合并的有机层在无水MgSO4上干燥、过滤并浓缩至干燥,从而得到作为橙色油的3-氧-4-(吡啶-3-基)丁酸乙酯(15.21g,73.4mmol,85%产率)。1H NMR(400MHz,DMSO-d6)δppm1.18(t,J=7.24Hz,3H)3.72(s,2H)3.95(s,2H)4.09(q,J=7.17Hz,2H)7.35(dd,J=7.63,4.80Hz,1H)7.59(d,J=7.60Hz,1H)8.38(s,1H)8.46(d,J=4.80Hz,1H);LCMS m/z 208.1(M+H)+。
中间体9B
3-氨基-4-(吡啶-3-基)丁-2-烯酸乙酯
按照中间体6B的制备程序,使用3-氧-4-(吡啶-3-基)丁酸乙酯(15.21g,73.4mmol)、乙酸铵(28.3g,367mmol)和EtOH(294mL),得到作为浅黄色固体的3-氨基-4-(吡啶-3-基)丁-2-烯酸乙酯(12.52g,60.7mmol,83%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.12(t,J=7.04Hz,3H)3.41(s,2H)3.95(q,J=7.04Hz,2H)4.32(s,1H)7.13(br.s.,1H)7.30-7.37(m,1H)7.71(dt,J=7.83,1.96Hz,2H)8.44(dd,J=4.70,1.57Hz,1H)8.52(d,J=1.96Hz,1H);LCMS m/z 207.2(M+H)+。
中间体9C
4-羟基-2-氧-6-(吡啶-3-基甲基)-1,2-二氢吡啶-3-甲酸乙酯
按照中间体6C的制备程序,使用3-氨基-4-(吡啶-3-基)丁-2-烯酸乙酯(12.52g,60.7mmol)、丙二酸二乙酯(13.89mL,91mmol)和乙醇钠21重量%乙醇溶液(37.4ml,100mmol),得到作为黄褐色固体的4-羟基-2-氧-6-(吡啶-3-基甲基)-1,2-二氢吡啶-3-甲酸乙酯(10.72g,39.1mmol,64.4%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.24(t,J=7.04Hz,3H)3.80(s,2H)4.23(q,J=7.04Hz,2H)5.75(s,1H)7.32-7.41(m,1H)7.73(dt,J=7.83,1.96Hz,1H)8.48(dd,J=4.70,1.56Hz,1H)8.55(d,J=1.56Hz,1H)11.60(br.s.,1H)12.38(s,1H);LCMS m/z 275.2(M+H)+。
中间体9D
4-羟基-6-(吡啶-3-基甲基)吡啶-2(1H)-酮
将HCl 6M水溶液(78mL,469mmol)中的4-羟基-2-氧-6-(吡啶-3-基甲基)-1,2-二氢吡啶-3-甲酸乙酯(10.72g,39.1mmol)的混合物加热回流22.5小时。将混合物冷却至20℃并用氢氧化铵28%NH3(38.0ml,563mmol)缓慢碱化至pH 8-9。向所得溶液非常缓慢地添加乙酸(7.68mL,134mmol)。将所得悬浮液搅拌1小时,并在Buchner上收集固体。将固体用水(3x 20mL)洗涤。将产物在高真空于20℃下干燥直到恒重,从而得到作为黄褐色固体的4-羟基-6-(吡啶-3-基甲基)吡啶-2(1H)-酮(7.56g,37.4mmol,96%产率)。1H NMR(400MHz,DMSO-d6)δppm 3.73(s,2H)5.35(d,J=2.20Hz,1H)5.56(d,J=2.20Hz,1H)7.32-7.38(m,1H)7.70(dt,J=7.83,1.96Hz,1H)8.46(dd,J=4.70,1.57Hz,1H)8.53(d,J=1.57Hz,1H)10.36(br.s.,1H)11.11(br.s.,1H);LCMS m/z 203.2(M+H)+。
中间体9E
7-溴-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-醇
按照中间体2D的制备程序,使用(3-溴苯基)肼游离碱(8.32g,44.5mmol)和中间体9D(4.50g,22.25mmol),得到作为含有7-溴和9-溴异构体(比例2.2:1)的混合物的灰色固体7-溴-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-醇(7.20g,20.33mmol,91%产率)。此中间体未通过快速色谱进行纯化。LCMS m/z 354.1,356.1(M+H)+。
中间体9F
7-溴-1-氯-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚
将在氧氯化磷(18.95mL,203mmol)中的7-溴-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-醇(2.40g,6.78mmol)的混合物在微波设备中于175℃加热15分钟。添加甲苯(100mL)并将混合物在旋转蒸发器上浓缩至干燥。添加水(60.0mL)并将混合物搅拌10分钟。过滤以从混合物除去黑色固体。将烧瓶和固体用水(20mL)洗涤。将合并的滤液通过添加氢氧化钾45重量%水溶液(7mL)而碱化至pH 8-10。添加EtOAc(100mL)和MeOH(10mL),并剧烈搅拌10分钟。将固体过滤并用EtOAc(20mL)冲洗烧瓶和固体。在获得的滤液中分层。用EtOAc(2x 100mL)萃取水层。将合并的有机层用盐水(100mL)洗涤。将有机层在无水MgSO4上干燥、过滤并浓缩,从而得到1.63g黄褐色固体。将该固体悬浮在1,4-二噁烷(50mL)中并加热回流30分钟。缓慢冷却至20℃并搅拌16小时。在Buchner上收集固体。将该固体用1,4-二噁烷(2x 5mL)洗涤。将合并的滤液浓缩至干燥,从而得到943mg褐色固体。将残留物使用RediSep 80g柱(EtOAc/MeOH)在ISCO上纯化,从而得到作为黄褐色固体的7-溴-1-氯-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚(450mg,1.208mmol,17.82%产率)。LCMS m/z 372.1,374.0(M+H)+。
中间体9G
7-溴-N-(3-吗啉基丙基)-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-胺
按照中间体2F的制备程序,使用中间体9F(100mg,0.268mmol)和3-吗啉基丙-1-胺(0.588ml,4.03mmol),得到作为黄褐色固体的-溴-N-(3-吗啉基丙基)-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-胺(109mg,0.227mmol,85%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.77(quin,J=7.04Hz,2H)2.22-2.42(m,6H)3.47-3.63(m,6H)3.98(s,2H)6.44(t,J=5.67Hz,1H)6.63(s,1H)7.25-7.34(m,2H)7.58(d,J=1.57Hz,1H)7.74(dt,J=8.02,1.66Hz,1H)8.17(d,J=8.61Hz,1H)8.39(dd,J=5.09,1.56Hz,1H)8.58(d,J=1.96Hz,1H)11.49(s,1H);LCMS m/z 480.1,482.2(M+H)+。
实施例9
1-((3-吗啉基丙基)氨基)-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
按照实施例1的制备程序,使用7-溴-N-(3-吗啉基丙基)-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-胺(100mg,0.208mmol)、Pd(OAc)2(4.67mg,0.021mmol)、4,5-双(二苯基膦基)-9,9-二甲基呫吨(24.1mg,0.042mmol)、MeOH(337μl,8.33mmol)和三乙基胺(1.45mL,10.41mmol),得到作为黄褐色固体的1-((3-吗啉基丙基)氨基)-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(83mg,0.181mmol,87%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.78(quin,J=7.04Hz,2H)2.23-2.43(m,6H)3.50-3.64(m,6H)3.88(s,3H)4.00(s,2H)6.61(t,J=5.67Hz,1H)6.66(s,1H)7.30(dd,J=7.83,4.70Hz,1H)7.75(d,J=7.43Hz,1H)7.78(d,J=8.22Hz,1H)8.01(s,1H)8.32(d,J=8.22Hz,1H)8.40(d,J=4.70Hz,1H)8.59(d,J=1.57Hz,1H)11.64(s,1H);HRMS m/z 460.2354(M+H)+。
实施例10
1-((3-(哌啶-1-基)丙基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
中间体10A
7-溴-N-(3-(哌啶-1-基)丙基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-胺
按照中间体2F的制备程序,使用中间体8F(300mg,0.794mmol)和3-(哌啶-1-基)丙-1-胺(1.894ml,11.91mmol),得到作为黄色泡沫的7-溴-N-(3-(哌啶-1-基)丙基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-胺(350mg,0.724mmol,91%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.33-1.44(m,2H)1.51(quin,J=5.28Hz,4H)1.83(quin,J=7.04Hz,2H)2.20-2.46(m,6H)3.60(q,J=6.52Hz,2H)3.98(s,2H)6.43(t,J=5.48Hz,1H)6.54(s,1H)7.11(dd,J=4.89,0.98Hz,1H)7.26(m,J=2.00Hz,1H)7.27-7.32(m,1H)7.43(dd,J=4.70,3.13Hz,1H)7.57(d,J=1.96Hz,1H)8.16(d,J=8.22Hz,1H)11.45(s,1H);LCMS m/z 483.1,485.1(M+H)+。
实施例10
1-((3-(哌啶-1-基)丙基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
按照实施例1的制备程序,使用7-溴-N-(3-(哌啶-1-基)丙基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-胺(200mg,0.414mmol)、Pd(OAc)2(9.29mg,0.041mmol)、4,5-双(二苯基膦基)-9,9-二甲基呫吨(47.9mg,0.083mmol)、MeOH(669μl,16.55mmol)和三乙基胺(2.88mL,20.68mmol),得到作为橙色泡沫的1-((3-(哌啶-1-基)丙基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(164mg,0.355mmol,86%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.09(br.s.,2H)1.43(br.s.,2H)1.57(br.s.,4H)1.91(br.s.,2H)2.33(br.s.,2H)2.82(br.s.,2H)3.63(q,J=6.26Hz,2H)3.88(s,3H)4.00(s,2H)6.58(s,1H)6.63(br.s.,1H)7.11(d,J=5.09Hz,1H)7.27(d,J=2.35Hz,1H)7.44(dd,J=4.89,2.93Hz,1H)7.78(d,J=8.22Hz,1H)8.01(s,1H)8.32(d,J=8.61Hz,1H)11.62(s,1H);HRMS m/z 463.2171(M+H)+。
实施例11
3-(吡啶-3-基甲基)-1-(4-(吡咯烷-1-基)哌啶-1-基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
中间体11A
7-溴-3-(吡啶-3-基甲基)-1-(4-(吡咯烷-1-基)哌啶-1-基)-5H-吡啶并[4,3-b]吲哚三盐酸盐(117mg,0.195mmol,72.7%产率)
按照中间体2F的制备程序,使用中间体9F(100mg,0.268mmol)和4-(吡咯烷-1-基)哌啶(0.621g,4.03mmol),得到粗产物。将获得的油溶解在MeOH(3mL)中。添加HCl4M 1,4-二噁烷溶液(0.235ml,0.939mmol),然后缓慢添加EtOAc(7.5mL)。将所得悬浮液搅拌2小时。在Buchner上收集固体,并用MeOH/EtOAc(1:5,3x 0.5mL)洗涤。将产物在高真空下于20℃干燥直到恒重,从而得到作为黄褐色固体的7-溴-3-(吡啶-3-基甲基)-1-(4-(吡咯烷-1-基)哌啶-1-基)-5H-吡啶并[4,3-b]吲哚三盐酸盐(117mg,0.195mmol,72.7%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.80-2.10(m,6H)2.13-2.30(m,2H)2.89-3.18(m,4H)3.39(br.s.,1H)3.49-3.59(m,2H)3.94(d,J=11.35Hz,2H)4.37-4.52(m,2H)7.22(br.s.,1H)7.47(d,J=8.22Hz,1H)7.69(d,J=8.22Hz,1H)7.79(br.s.,1H)7.95(m,J=5.90,5.90Hz,1H)8.52(d,J=7.43Hz,1H)8.78(d,J=5.09Hz,1H)8.97(s,1H)10.97(br.s.,2H)12.00(br.s,2H);LCMS m/z 490.2,492.1(M+H)+。
实施例11
3-(吡啶-3-基甲基)-1-(4-(吡咯烷-1-基)哌啶-1-基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
按照实施例1的制备程序,使用7-溴-3-(吡啶-3-基甲基)-1-(4-(吡咯烷-1-基)哌啶-1-基)-5H-吡啶并[4,3-b]吲哚三盐酸盐(100mg,0.167mmol)、Pd(OAc)2(3.74mg,0.017mmol)、4,5-双(二苯基膦基)-9,9-二甲基呫吨(19.3mg,0.033mmol)、MeOH(270μl,6.67mmol)和三乙基胺(1.16mL,8.34mmol),得到作为白色固体的3-(吡啶-3-基甲基)-1-(4-(吡咯烷-1-基)哌啶-1-基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(64.5mg,0.137mmol,82%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.62-1.79(m,6H)2.04(d,J=10.17Hz,2H)2.22(br.s.,1H)2.56(br.s.,4H)2.93(t,J=11.93Hz,2H)3.78(d,J=12.91Hz,2H)3.89(s,3H)4.11(s,2H)6.99(s,1H)7.31(dd,J=7.83,4.70Hz,1H)7.76(d,J=7.83Hz,1H)7.82-7.91(m,2H)8.07(s,1H)8.41(dd,J=4.70,1.17Hz,1H)8.57-8.64(m,1H)11.83(s,1H);HRMS m/z 470.2550(M+H)+。
实施例12
1-(甲基(3-(甲基氨基)丙基)氨基)-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
中间体12A
N1-(7-溴-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)-N1,N3-二甲基丙烷-1,3-二胺
按照中间体2F的制备程序,使用中间体9F(100mg,0.268mmol)和N1,N3-二甲基丙烷-1,3-二胺(1.007ml,8.05mmol),得到作为黄褐色泡沫的N1-(7-溴-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)-N1,N3-二甲基丙烷-1,3-二胺(109mg,0.249mmol,93%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.69(quin,J=7.04Hz,2H)2.16(s,3H)2.39(t,J=7.04Hz,2H)2.97(s,3H)3.40-3.49(m,2H)4.08(s,2H)6.92(s,1H)7.30(dd,J=7.83,4.70Hz,1H)7.37(dd,J=8.41,1.76Hz,1H)7.65(d,J=1.96Hz,1H)7.71-7.79(m,2H)8.40(dd,J=4.70,1.57Hz,1H)8.60(d,J=1.96Hz,1H)11.67(br.s.,2H);LCMS m/z 438.2,440.1(M+H)+。
中间体12B
(3-((7-溴-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)(甲基)氨基)丙基)(甲基)氨基甲酸叔丁酯
按照中间体8H的制备程序,使用N1-(7-溴-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)-N1,N3-di甲基丙烷-1,3-二胺(0.103g,0.235mmol)、三乙基胺(0.065ml,0.470mmol)、CH2Cl2(5mL)和二碳酸二叔丁酯(0.076ml,0.329mmol)在CH2Cl2(0.500ml,7.78mmol)中的溶液,得到作为白色泡沫的(3-((7-溴-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)(甲基)氨基)丙基)(甲基)氨基甲酸叔丁酯(109mg,0.202mmol,86%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.12-1.39(m,9H)1.78(dt,J=13.99,6.90Hz,2H)2.67(s,3H)2.98(s,3H)3.12(t,J=6.85Hz,2H)3.37(br.s.,2H)4.08(s,2H)6.94(s,1H)7.29(dd,J=7.63,4.89Hz,1H)7.35(d,J=8.61Hz,1H)7.62-7.67(m,1H)7.70-7.79(m,2H)8.40(dd,J=4.70,1.57Hz,1H)8.56-8.62(m,1H)11.68(br.s.,1H);LCMS m/z 538.2,540.2(M+H)+。
中间体12C
1-((3-((叔丁氧羰基)(甲基)氨基)丙基)(甲基)氨基)-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
按照实施例1的制备程序,使用(3-((7-溴-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)(甲基)氨基)丙基)(甲基)氨基甲酸叔丁酯(94mg,0.175mmol)、Pd(OAc)2(5.88mg,0.026mmol)、4,5-双(二苯基膦基)-9,9-二甲基呫吨(30.3mg,0.052mmol)、MeOH(282μl,6.98mmol)和三乙基胺(1.22mL,8.73mmol),得到作为白色泡沫的1-((3-((叔丁氧羰基)(甲基)氨基)丙基)(甲基)氨基)-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(50mg,0.097mmol,55.3%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.15-1.37(m,9H)1.80(dt,J=14.09,7.04Hz,2H)2.68(br.s.,3H)3.02(s,3H)3.13(t,J=6.85Hz,2H)3.42(br.s.,2H)3.89(s,3H)4.10(s,2H)6.96(s,1H)7.30(dd,J=7.63,4.89Hz,1H)7.75(d,J=7.43Hz,1H)7.84(d,J=8.22Hz,1H)7.93(d,J=8.61Hz,1H)8.06(s,1H)8.40(d,J=4.70Hz,1H)8.60(s,1H)11.82(s,1H);LCMS m/z 518.2(M+H)+。
实施例12
1-(甲基(3-(甲基氨基)丙基)氨基)-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
向在CH2Cl2(2mL)中的1-((3-((叔丁氧羰基)-(甲基)氨基)丙基)(甲基)氨基)-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(0.045g,0.087mmol)的混合物添加三氟乙酸(1.0mL,12.98mmol)。搅拌30分钟并添加甲苯(2.5mL)。将混合物在旋转蒸发器上浓缩至干燥。将残留物使用RediSep 4g柱(CH2Cl2/MeOH/NH4OH)在ISCO上纯化,从而得到作为白色泡沫的1-(甲基(3-(甲基氨基)丙基)氨基)-3-(吡啶-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(35mg,0.084mmol,96%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.72(dt,J=14.09,7.04Hz,2H)2.18(s,3H)2.42(t,J=6.85Hz,2H)3.02(s,3H)3.48(t,J=7.24Hz,2H)3.89(s,3H)4.09(s,2H)6.94(s,1H)7.31(dd,J=7.63,4.89Hz,1H)7.76(d,J=7.83Hz,1H)7.85(d,J=8.61Hz,1H)7.93(d,J=8.22Hz,1H)8.06(s,1H)8.40(d,J=4.30Hz,1H)8.60(s,1H)11.81(br.s.,1H);HRMS m/z 418.2246(M+H)+。
实施例13
1-(((1r,4r)-4-氨基环己基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
中间体13A
(1r,4r)-N1-(7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)环己烷-1,4-二胺
按照中间体2F的制备程序,使用中间体8F(100mg,0.265mmol)和(1r,4r)-环己烷-1,4-二胺(0.907g,7.94mmol),得到作为白色固体的(1r,4r)-N1-(7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)环己烷-1,4-二胺(105mg,0.231mmol,87%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.11-1.27(m,2H)1.41-1.66(m,4H)1.82(m,J=11.70Hz,2H)1.98(m,J=10.20Hz,2H)2.58(tt,J=10.96,3.72Hz,1H)3.98(s,2H)4.17(m,J=15.40,7.80,7.80,3.90Hz,1H)5.75(d,J=7.83Hz,1H)6.51-6.57(m,1H)7.09-7.16(m,1H)7.24-7.32(m,2H)7.43(dd,J=4.70,3.13Hz,1H)7.54-7.59(m,1H)8.13(d,J=8.61Hz,1H)11.45(br.s.,1H);LCMS m/z 455.1,457.1(M+H)+。
中间体13B
((1r,4r)-4-((7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)氨基)环己基)氨基甲酸叔丁酯
按照中间体8H的制备程序,使用中间体13A(0.097g,0.213mmol)、三乙基胺(0.059ml,0.426mmol)、CH2Cl2(4.5mL)、MeOH(1mL)以及二碳酸二叔丁酯(0.081ml,0.351mmol)在CH2Cl2(0.45mL)中的溶液,得到作为白色泡沫的((1r,4r)-4-((7-溴-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)氨基)环己基)氨基甲酸叔丁酯(117mg,0.211mmol,99%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.26-1.45(m,11H)1.46-1.60(m,2H)1.84(d,J=10.96Hz,2H)1.91-2.07(m,2H)2.20-2.44(m,1H)3.98(s,2H)4.08-4.24(m,1H)5.82(d,J=7.83Hz,1H)6.54(s,1H)6.75(d,J=8.22Hz,1H)7.12(d,J=5.09Hz,1H)7.26(d,J=2.35Hz,1H)7.29(dd,J=8.22,1.56Hz,1H)7.44(dd,J=4.89,2.93Hz,1H)7.56(d,J=1.56Hz,1H)8.14(d,J=8.61Hz,1H)11.45(s,1H);LCMS m/z 555.1,557.2(M+H)+。
中间体13C
1-(((1r,4r)-4-((叔丁氧羰基)氨基)环己基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
按照实施例1的制备程序,使用中间体13B(100mg,0.180mmol)、Pd(OAc)2(6.06mg,0.027mmol)、4,5-双(二苯基膦基)-9,9-二甲基呫吨(31.2mg,0.054mmol)、MeOH(291μl,7.20mmol)和三乙基胺(1.25mL,9.00mmol),得到作为黄色固体的1-(((1r,4r)-4-((叔丁氧羰基)氨基)环己基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(90mg,0.168mmol,94%产率)。1H NMR(400MHz,DMSO-d6)δppm1.26-1.37(m,2H)1.40(s,9H)1.48-1.63(m,2H)1.85(d,J=9.78Hz,2H)2.02(d,J=10.96Hz,2H)3.25(m,J=3.52Hz,1H)3.88(s,3H)4.00(s,2H)4.18(m,J=7.80Hz,1H)5.98(d,J=7.83Hz,1H)6.57(s,1H)6.76(d,J=7.83Hz,1H)7.13(d,J=5.09Hz,1H)7.27(d,J=2.74Hz,1H)7.45(dd,J=4.70,3.13Hz,1H)7.78(d,J=8.22Hz,1H)7.99(s,1H)8.29(d,J=8.22Hz,1H)11.60(s,1H);LCMS m/z 535.3(M+H)+。
中间体13D
1-(((1r,4r)-4-氨基环己基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
按照实施例12的制备程序,使用中间体13C(85mg,0.159mmol)、CH2Cl2(3mL)和三氟乙酸(1.5mL),得到作为黄色固体的1-(((1r,4r)-4-氨基环己基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(69mg,0.159mmol,100%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.39-1.66(m,4H)2.00(d,J=11.35Hz,2H)2.08(d,J=11.74Hz,2H)3.00(t,J=11.15Hz,1H)3.88(s,3H)4.01(s,2H)4.20(m,J=7.40,3.90Hz,1H)6.03(d,J=7.83Hz,1H)6.61(s,1H)7.12(d,J=4.70Hz,1H)7.28(d,J=2.74Hz,1H)7.38(br.s.,2H)7.44(dd,J=4.70,3.13Hz,1H)7.78(d,J=8.61Hz,1H)8.00(s,1H)8.28(d,J=8.61Hz,1H)11.65(s,1H);HRMS m/z 435.1852(M+H)+。
实施例14
1-((2-((2-氨基乙基)(甲基)氨基)乙基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯
按照实施例12的制备程序,使用来自实施例8的产物(40mg,0.074mmol)、CH2Cl2(2mL)和三氟乙酸(1mL),得到作为黄褐色固体的1-((2-((2-氨基乙基)-(甲基)氨基)乙基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(27mg,0.062mmol,83%产率)。1H NMR(400MHz,DMSO-d6)δppm 2.27(s,3H)2.43(t,J=6.46Hz,2H)2.65(q,J=6.26Hz,4H)3.68(m,J=5.87Hz,2H)3.88(s,3H)4.01(s,2H)6.45(t,J=4.30Hz,1H)6.58(s,1H)7.12(d,J=5.09Hz,1H)7.25-7.30(m,1H)7.44(dd,J=4.70,3.13Hz,1H)7.79(d,J=7.83Hz,1H)8.01(s,1H)8.23(d,J=8.22Hz,1H)11.62(br.s.,1H);HRMS m/z 439.1957(M+H)+。
实施例15
1-(2-氨基-2-氧代乙基)-1-(3-((7-(甲氧基羰基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)氨基)丙基)哌啶-1-鎓碘化物
向在THF(2.45mL)中的1-((3-(哌啶-1-基)丙基)氨基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-7-甲酸甲酯(50mg,0.108mmol)的混合物添加2-碘乙酰胺(23.99mg,0.130mmol)。搅拌20分钟然后添加另一部分的2-碘乙酰胺(23.99mg,0.130mmol)。另外4天后,添加另一部分的2-碘乙酰胺(50.0mg,0.270mmol)。继续搅拌另外8天。将混合物在旋转蒸发器上浓缩至干燥。将残留物使用RediSep 4g柱(CH2Cl2/MeOH)在ISCO上纯化,从而得到作为黄褐色固体的1-(2-氨基-2-氧代乙基)-1-(3-((7-(甲氧基羰基)-3-(噻吩-3-基甲基)-5H-吡啶并[4,3-b]吲哚-1-基)氨基)丙基)哌啶-1-鎓碘化物(31.5mg,0.049mmol,45.0%产率)。1H NMR(400MHz,DMSO-d6)δppm 1.41-1.64(m,2H)1.76(br.s.,4H)2.12(s,2H)3.35-3.46(m,2H)3.54-3.62(m,2H)3.62-3.76(m,4H)3.88(s,3H)3.98-4.10(m,4H)6.63(s,1H)6.72(t,J=5.48Hz,1H)7.11(d,J=4.70Hz,1H)7.27(br.s.,1H)7.46(dd,J=4.70,3.13Hz,1H)7.74(br.s.,1H)7.81(d,J=8.22Hz,1H)7.93(br.s.,1H)8.02(s,1H)8.34(d,J=8.22Hz,1H)11.65(s,1H);HRMS m/z520.2390(M)+。
报道的HPLC保留时间针对反相HPLC(Agilent,1200序列),使用以下条件:溶剂A:MeOH:H2O:TFA(5:95:0.05);溶剂B:MeOH:H2O:TFA(95:5:0.05);流速:2.0mL/min.;梯度0~100%B,在1.5min内;运行时间:3.5min;柱:Kinetex C18,2.6μm,4.6x 30mm;波长254nm。
表1’
EC50定义为与载体培养物(DMSO)相比产生CD34+CD45RA-细胞计数增加50%的浓度。*EC50:A>1000nM;B:>500-1000nM;C:>250-500nM;D=100-250;E=<100nM。
应理解,本文所述的实施例与实施方式仅仅是为了说明的目的,其各种修改和变化将揭示给本领域技术人员,并包含在本发现和所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!