与右旋糖酐接枝的交联的透明质酸的制作方法
本发明涉及包含交联多糖的水凝胶的领域以及此类水凝胶在医学应用和/或美容应用中的用途。更具体地,本发明涉及与右旋糖酐接枝的交联的透明质酸。
发明背景
针对医学用途最广泛地使用的生物相容性聚合物之一是透明质酸(HA)。其是自然存在的多糖,属于糖胺聚糖(GAG)的组。透明质酸和其他GAG是带负电荷的杂多糖链,该带负电荷的杂多糖链具有吸收大量水的能力。透明质酸以及衍生自透明质酸的产品被广泛地应用于生物医学和美容领域中,例如,在粘性手术(viscosurgery)期间并且作为真皮填充物。
吸水凝胶或水凝胶被广泛地应用于生物医学领域。它们一般通过将聚合物化学交联至无限网络来制备。虽然天然的透明质酸和某些交联的透明质酸产品吸收水直到它们被完全溶解时,但交联的透明质酸凝胶通常吸收一定量的水直到它们饱和,即,它们具有有限的液体保持容量或溶胀度。
由于透明质酸以相同的化学结构存在(除了其在大部分生命有机体中的分子质量之外),它给出了反应的最小程度并且允许用于先进的医学用途。透明质酸分子的交联和/或其他改性对于改善其在体内的持续时间是必要的。此外,此类改性影响透明质酸分子的液体保持容量。作为其结果,透明质酸一直是许多改性尝试的主题。
发明概述
本发明的目的是提供交联的透明质酸产品,其适合于用作真皮填充物。
本发明的另外的目的是提供交联的透明质酸产品,其适合在作为真皮填充物的使用中具有改善的耐久性。
本发明的另外的目的是提供交联的透明质酸产品,其适合具有降低的溶胀。
对于将从本公开内容明显的这些和其他目的,根据第一方面,本发明提供透明质酸产品,所述透明质酸产品包含交联的透明质酸和一种或更多种右旋糖酐分子,其中透明质酸通过醚键交联,并且其中一种或更多种右旋糖酐分子被共价地接枝至交联的透明质酸。
如本文中使用的术语交联是指涉及现有的大分子上的位点或基团的反应或导致在大分子中形成小区域的在大分子之间的相互作用,至少四条链发源于所述小区域。线型大分子的反应性链端与另一个线型大分子的内部反应性位点的反应导致支化点或接枝的形成,但不视作交联反应。
如本文中使用的术语接枝是指这样的反应,在所述反应中,一种或更多种嵌段物质被连接至大分子的主链,作为具有不同于主链中的那些的构成特征或构型特征的侧链。
本发明人惊异地发现,可能以高转化率将右旋糖酐接枝至玻尿酸水凝胶。这一发现是意料之外的,因为交联的透明质酸网络将被预期以防止右旋糖酐的扩散,导致降低的接枝效率。
根据本发明的包含交联的透明质酸与接枝的一种或更多种右旋糖酐分子的透明质酸产品展现出若干有利以及令人惊异的性质,例如,包括对热降解、水解降解、自由基降解和酶降解的改善的稳定性,导致在作为真皮填充物的使用中的改善的耐久性以及降低的溶胀度。降低的溶胀度意指可以产生较硬的凝胶,而不增大在透明质酸中的交联剂的量。
根据本发明的交联的透明质酸产品可以例如用作用于美容手术或医学手术(类似真皮填充和体形塑造)的可注射的组合物,根据本发明的使透明质酸与右旋糖酐组合的交联的透明质酸产品与无右旋糖酐的透明质酸产品相比呈现出降低的溶胀。这是有用的,因为它意指可以产生较硬的凝胶,而不增大在透明质酸中的交联剂的量。根据本发明的交联的透明质酸产品还已被发现与无右旋糖酐的透明质酸产品相比具有较好的热稳定性以及对自由基降解和酶降解的较好的稳定性。可能的解释是透明质酸骨架通过右旋糖酐来保护。这导致与无右旋糖酐的透明质酸产品相比的根据本发明的交联的透明质酸产品的在体内的改善的耐久性。
在优选的实施方案中,右旋糖酐通过酰胺键被附接至透明质酸。与例如酯键相比,酰胺键在右旋糖酐-透明质酸接枝物中的使用已被发现是有利的,因为酰胺键对于在体内的降解是更稳定的。
有利的是,将右旋糖酐分子接枝在已经交联的透明质酸上,该交联的透明质酸可以已经以具有定义的物理-化学性质的合意的形式来制备。这允许用右旋糖酐明显改性交联的HA,而不诱导交联的HA的解聚。
根据本文阐释的第二方面,提供了制备透明质酸产品的工艺,所述透明质酸产品包含交联的透明质酸和一种或更多种官能化的右旋糖酐分子,所述工艺包括以下步骤:
(a)提供交联的透明质酸和一种或更多种官能化的右旋糖酐分子;
(b)将一种或更多种官能化的右旋糖酐分子共价地接枝至所述交联的透明质酸。
将右旋糖酐分子共价地接枝至交联的透明质酸。在优选的实施方案中,通过单一的端-点附接将右旋糖酐分子接枝至交联的透明质酸。为了能够实现共价接枝,将右旋糖酐分子用合适的反应性官能团来官能化。右旋糖酐分子可以例如被提供有具有氨基的连接基,以便能够通过酰胺键接枝至交联的透明质酸。
由于通过根据本发明的工艺可获得的产品的性质是复杂的,产品也可以被定义为是这些工艺的结果。根据本文中阐释的另一个方面,提供了通过本文描述的工艺可获得的包含透明质酸和右旋糖酐的交联的透明质酸产品。
本公开内容的交联的透明质酸产品可以例如在用于治疗软组织紊乱的可注射制剂中使用,包括但不限于,矫正治疗和美学治疗。
本公开内容的交联的透明质酸产品可以例如在用于美容手术、医学手术中以及用于使皮肤保湿和/或赋予皮肤活力的可注射制剂中使用,所述美容手术为例如,真皮填充、体形塑造和面部塑造,所述医学手术为例如,真皮填充、体形塑造、防止组织粘连、形成通道、失禁治疗和整形外科应用。
根据本文中阐释的方面,提供了一种从美容方面治疗皮肤的方法,所述方法包括向皮肤施用如本文描述的交联的透明质酸产品。
交联的透明质酸产品也可以被提供在可注射的真皮的美学制剂或药物制剂中。
本发明的其他方面和优选的实施方案依据本发明的以下详细公开内容和所附权利要求将是明显的。
附图简述
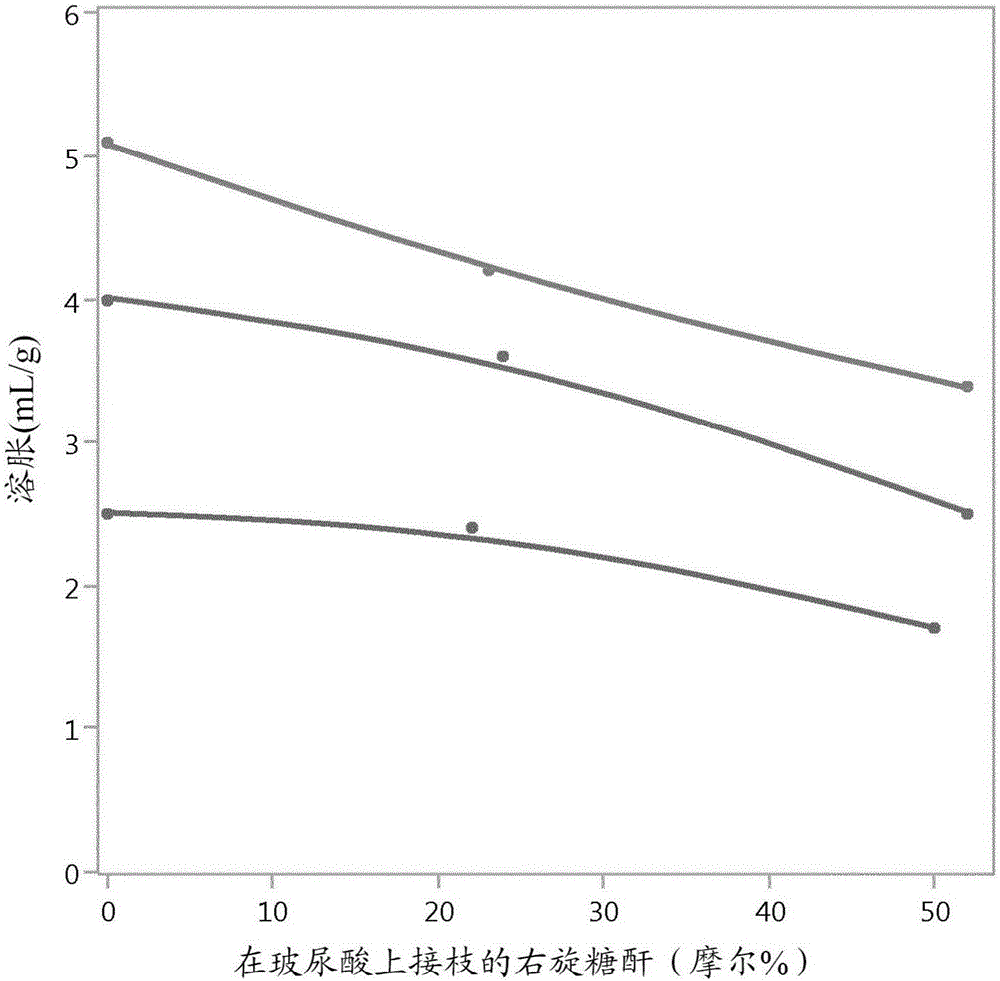
图1是示出透明质酸凝胶的溶胀如何随着增加用右旋糖酐的接枝而降低的图。
图2是HA-右旋糖酐混合的水凝胶的热重分析。
图3是作为右旋糖酐-连接基/HA的比率的函数的在HA上接枝的右旋糖酐。
发明详述
本发明的透明质酸(透明质酸在本文中也被称作“HA”或“玻尿酸”)产品包含交联的透明质酸和一种或更多种右旋糖酐分子,其中透明质酸通过醚键交联,并且其中一种或更多种右旋糖酐分子被共价地接枝至交联的透明质酸。
透明质酸产品可以存在于水溶液中,但它也可以以干燥形式或沉淀形式存在,例如,在乙醇中。透明质酸产品优选地是可注射的。
透明质酸产品可以以凝胶的形式存在(在本文中也被称作“水凝胶”)。在凝胶中的多糖的总量优选地在5mg/mL-150mg/mL的范围内、更优选地在10mg/mL-100mg/mL的范围内。
接枝至交联的透明质酸的右旋糖酐的摩尔量为在0.1%-99%的范围内、优选地在1%-60%的范围内。
透明质酸产品通过它们的溶胀即它们吸收水的能力来评估。溶胀表示为一克干燥产品可以吸收的按mL计的水(或盐水)的量。溶胀也可以关于凝胶来测量并且以mL每克凝胶来表示。透明质酸产品的溶胀优选地在0.5mL/g-10mL/g的范围内、更优选地在1mL/g-5mL/g的范围内。
本发明的透明质酸产品可以呈凝胶颗粒、线、圆盘等等的形式。在优选的实施方案中,交联的透明质酸呈凝胶颗粒的形式。凝胶颗粒优选地具有在0.01mm-5mm、优选地0.1mm-1mm的范围内、例如0.2-0.5mm或0.5-0.8mm的平均溶胀大小(除非另有陈述,否则本文给出的所有粒度是指重量平均粒度)。根据某些实施方案,交联的透明质酸呈具有在0.01mm-5mm、优选地0.1mm-1mm的范围内的平均大小的凝胶颗粒的形式。
根据某些实施方案,一种或更多种右旋糖酐分子和交联的透明质酸的二糖具有0.1%-99%例如0.1%-60%例如1%-60%或例如1%-20%的摩尔比。50%的摩尔比意指HA二糖的一半具有接枝的右旋糖酐链。
根据某些实施方案,右旋糖酐分子具有小于10kDa、优选地小于5kDa的平均分子量。
根据某些实施方案,右旋糖酐分子通过单一的端-点附接被共价地连接至透明质酸。单一的端-点附接意指右旋糖酐仅经由右旋糖酐分子的末端残基、优选地经由右旋糖酐分子的还原端被附接至透明质酸。根据某些实施方案,右旋糖酐分子经由在右旋糖酐的还原端与透明质酸的羧基之间的双官能连接基或多官能连接基通过单一的端-点附接被共价地连接至透明质酸。
根据某些实施方案,右旋糖酐分子包含连接基,所述连接基具有氨基、酰肼、肼基甲酸酯、氨基脲、硫代氨基脲、硫代肼基甲酸酯或氨基氧基官能团,并且其中所述连接基的官能团与交联的透明质酸的羧基形成共价键。
根据某些实施方案,双官能连接基或多官能连接基包括独立地选自以下的至少两种官能团:氨基、酰肼、肼基甲酸酯、氨基脲、硫代氨基脲、硫代肼基甲酸酯或氨基氧基。根据某些实施方案,双官能连接基或多官能连接基是二胺或二酰肼。根据某些实施方案,双官能连接基或多官能连接基是六亚甲基二胺、2,2’-(亚乙基二氧基)双(乙胺)、O,O’-1,3-丙二基双羟胺、己二酸二酰肼或亚精胺。
除非另有提供,否则术语“透明质酸”涵盖各种链长度和电荷状态以及具有各种化学改性的透明质酸、透明质酸盐或玻尿酸的所有变体以及变体的组合。换言之,该术语还涵盖具有各种抗衡离子的透明质酸的各种透明质酸盐,例如透明质酸钠。透明质酸的各种改性也被以下术语涵盖:例如氧化,例如-CH2OH基团至-CHO和/或-COOH的氧化;相邻羟基的高碘酸盐氧化,任选地然后是还原,例如,-CHO至-CH2OH的还原,或与胺偶联以形成亚胺,然后还原成仲胺;硫酸化、脱酰胺、任选地然后是脱氨基或利用新的酸的酰胺形成;酯化;以及脱乙酰。改性的其他实例是异脲偶联、酰肼偶联、溴化氰(bromocyan)偶联、单环氧化物偶联和单砜偶联。
透明质酸可以从动物起源和非动物起源的各种来源获得。非动物起源的来源包括酵母以及优选地细菌。单一透明质酸分子的分子量通常在0.1MDa-10MDa的范围内,但其他分子量是可能的。
在某些实施方案中,交联的透明质酸的浓度为在1mg/ml至100mg/ml的范围内。在某些实施方案中,交联的透明质酸的浓度为在2mg/ml至50mg/ml的范围内。在具体的实施方案中,交联的透明质酸的浓度为在5mg/ml至30mg/ml的范围内或在10mg/ml至30mg/ml的范围内。
交联的透明质酸包含在透明质酸链之间的交联键,其产生了透明质酸分子的通过共价交联键、透明质酸链的物理纠缠以及各种相互作用例如静电相互作用、氢键和范德华力保持在一起的连续网络。
交联的透明质酸产品优选地是生物相容的。这意味着在被治疗的个体中不发生或仅发生非常温和的、免疫应答。即,在被治疗的个体中不发生或仅发生非常温和的不合意的局部或全身效果。
根据本发明的交联的透明质酸产品可以是凝胶,或水凝胶。即,它可以被视作水不溶性的,但当经受液体、通常地含水液体时大体上稀释透明质酸分子的交联体系。
凝胶按重量计主要包含液体并且可以例如包含90%-99.9%的水,但它表现得类似固体,这归因于在液体内的三维交联的透明质酸网络。由于凝胶的显著的液体含量,凝胶在结构上是柔性的并且类似于天然组织,这使得它作为组织工程中的支架以及用于组织增大的支架是非常有用的。
透明质酸的交联可以通过用交联剂改性来实现。透明质酸浓度和交联的程度影响了凝胶的机械性质例如弹性模量G'以及稳定性性质。交联的透明质酸凝胶常常依据“改性度”来表征。透明质酸凝胶的改性度一般地在0.1摩尔%与15摩尔%之间的范围内。改性度(摩尔%)描述了结合至HA的交联剂的量,即,相对于重复的HA二糖单元的总摩尔量的结合的交联剂的摩尔量。改性度反映出HA已通过交联剂被化学地改性的程度。用于交联的反应条件和用于确定改性度的合适的分析技术对本领域技术人员全部都是熟知的,这些技术人员可以容易地调节这些和其他相关因素并且从而提供合适的条件以获得在0.1%-2%的范围内的改性度并且证实了相对于改性度的得到的产品特性。BDDE(1,4-丁二醇二缩水甘油醚)交联的透明质酸凝胶可以例如根据在公布的国际专利申请WO 9704012的实施例1和2中描述的方法来制备。
在优选的实施方案中,交联的透明质酸以通过交联剂交联的凝胶的形式存在,其中所述透明质酸的浓度为在10mg/ml至30mg/ml的范围内,并且利用所述交联剂的改性度为在0.1摩尔%至2摩尔%的范围内。
透明质酸凝胶也可以包含透明质酸的未交联的即未结合至三维交联的透明质酸网络的部分。然而,优选的是,在凝胶组合物中的按重量计至少50%、优选地按重量计至少60%、更优选地按重量计至少70%、并且最优选地按重量计至少80%的透明质酸形成交联的透明质酸网络的一部分。
透明质酸可以以颗粒、线、圆盘等等的形式存在。在优选的实施方案中,交联的透明质酸呈凝胶颗粒的形式。凝胶颗粒优选地具有在0.01mm-5mm、优选地0.1mm-1mm例如0.2mm-0.5mm或0.5mm-0.8mm的范围内的平均大小。
透明质酸链经由连接基彼此交联,所述连接基衍生自双官能交联剂或多官能交联剂。透明质酸组合物的双官能交联剂或多官能交联剂使透明质酸链彼此连接。双官能交联剂或多官能交联剂还充当透明质酸链之间的间隔基。
双官能交联剂或多官能交联剂包含能够与透明质酸的官能团反应、导致共价键的形成的两种或更多种官能团。双官能交联剂或多官能交联剂可以例如选自由以下组成的组:二乙烯基砜、二环氧化物和多环氧化物。
优选类型的双官能交联剂或多官能交联剂是双环氧化物或多环氧化物,例如二缩水甘油醚。根据实施方案,双官能交联剂或多官能交联剂包含两个或更多个缩水甘油醚官能团。缩水甘油醚官能团与透明质酸的伯羟基反应,导致醚键的形成。由此断定,当二缩水甘油醚交联剂与玻尿酸的伯羟基反应时,形成了两个醚键且余留来自交联剂的中间间隔基。
用于使透明质酸链交联的优选的双官能交联剂或多官能交联剂包括1,4-丁二醇二缩水甘油醚(BDDE)、1,2-双(2,3-环氧丙氧基)乙烯(EGDGE)和乙二醇二缩水甘油醚(EGDE)、1,2-乙二醇二缩水甘油醚(EDDE)以及二环氧辛烷。特别优选的双官能交联剂或多官能交联剂是BDDE。
右旋糖酐可以具有通常在0.2kDa至3000kDa的范围内的任何平均分子量(除非另有指定,否则本文给出的右旋糖酐的全部平均分子量是指数均分子量,Mn)。在某些实施方案中,优选的是,右旋糖酐具有较低的分子量,例如小于100kDa、小于50kDa、小于25kDa、小于10kDa或小于5kDa。右旋糖酐具有大于0.2kDa、优选地大于0.5kDa的分子量。在某些实施方案中,右旋糖酐具有在10kDa-100kDa的范围内或在10kDa-50kDa的范围内的分子量。在某些优选的实施方案中,右旋糖酐具有在0.5kDa-10kDa的范围内或在0.5kDa-5kDa的范围内的分子量。在一个优选的实施方案中,右旋糖酐具有在0.5kDa-3kDa的范围内的平均分子量。
右旋糖酐常常被化学改性以便改善它们在水中的溶解度和/或以优化它们在特定应用中的性能。如本文中使用的术语右旋糖酐还意图涵盖功能上等效的变体或其衍生物。
根据本发明的交联的透明质酸产品是优选地生物相容的。这意味着当该产品被引入至个体的组织中时不发生或仅发生非常温和的免疫应答。即,在被治疗的个体中不发生或仅发生非常温和的不合意的局部或全身效果。
本公开内容的交联的透明质酸产品可以例如在用于治疗软组织紊乱的可注射制剂中使用,包括但不限于,矫正治疗和美学治疗。
本公开内容的交联的透明质酸产品可以例如在用于美容手术、医学手术中以及用于使皮肤保湿和/或赋予皮肤活力的可注射制剂中使用,所述美容手术为例如,真皮填充、体形塑造和面部塑造,所述医学手术为例如,真皮填充、体形塑造、防止组织粘连、形成通道、失禁治疗和整形外科应用。
交联的透明质酸产品也可以被提供在可注射的真皮的美学制剂或药物制剂中。
本公开内容的交联的透明质酸产品还可以在用于运输或施用以及缓慢释放或控制释放各种药物物质或美容物质的可注射制剂中使用。
可注射制剂可以任选地包括一种或更多种其他药学上可接受的组分,包括但不限于,缓冲剂、防腐剂、紧张性调节剂、盐、抗氧化剂、同渗重摩调节剂、乳化剂、润湿剂、增甜剂或调味剂、以及类似物。
可注射制剂可以任选地包括药学上有效量的麻醉剂。麻醉剂可以是局部麻醉剂,例如,氨基酰胺局部麻醉剂或氨基酯局部麻醉剂。麻醉剂的实例包括,但不限于,利多卡因、氨布卡因、阿莫拉酮、阿米卡因、丁氧普鲁卡因、苯佐卡因、贝托卡因、珍尼柳酯、布比卡因、布他卡因、氨苯丁酯、布坦卡因、丁胺卡因、丁托西卡因、卡铁卡因、氯普鲁卡因、可卡乙碱、环美卡因、狄步卡因、二甲异喹、二甲卡因、地哌冬、双环胺、芽子定、芽子碱、氯乙烷、依替卡因、β-优卡因、尤普罗辛、非那可明、仿可卡因(formocaine)、海克卡因、羟丁卡因、对氨基苯甲酸异丁酯、亮氨卡因甲磺酸盐、左沙屈尔、利多卡因、甲哌卡因、美普卡因、美布卡因、甲基氯、麦替卡因、纳衣卡因、奥他卡因、奥索卡因、羟乙卡因、对乙氧卡因、非那卡因、酚、哌罗卡因、匹多卡因、聚多卡醇、丙吗卡因、丙胺卡因、普鲁卡因、丙泮卡因、丙美卡因、丙哌卡因、丙氧卡因、假可卡因、吡咯卡因、罗哌卡因、水杨醇、丁卡因、托利卡因、三甲卡因、佐拉敏、其组合、及其盐。氨基酯局部麻醉剂的实例包括但不限于普鲁卡因、氯普鲁卡因、可卡因、环美卡因、二甲卡因(拉罗卡因)、丙氧卡因、普鲁卡因(奴佛卡因)、丙美卡因、丁卡因(阿美索卡因)。氨基酰胺局部麻醉剂的非限制性实例包括阿替卡因、布比卡因、辛可卡因(狄步卡因)、依替卡因、左布比卡因、利多卡因(利诺卡因)、甲哌卡因、哌罗卡因、丙胺卡因、罗哌卡因、三甲卡因、或其组合。
如本文中描述的交联的透明质酸产品或包含交联的透明质酸产品的可注射的药物制剂可以用于改善皮肤的外观、填充皱纹或塑造受试者的面部或身体。
如本文中描述的交联的透明质酸产品或包含交联的透明质酸产品的可注射的药物制剂可以有利地用作真皮填充物。
如本文中描述的交联的透明质酸产品或包含交联的透明质酸产品的可注射的药物制剂可以用于从美容方面治疗皮肤的方法,所述方法包括向皮肤施用如本文描述的交联的透明质酸产品。
如本文中描述的交联的透明质酸产品或包含交联的透明质酸产品的可注射的药物制剂还可以用于通过关节内注射治疗关节紊乱。
交联的透明质酸产品或包含交联的透明质酸产品的可注射的药物制剂的上述用途可以是医学程序或纯粹地美容的非医学程序。
在优选的实施方案中,右旋糖酐分子通过酰胺键被接枝至交联的透明质酸。右旋糖酐分子被官能化,例如胺化,以便能够通过酰胺键接枝至交联的透明质酸。因此,本发明允许进行温和的偶联反应,在右旋糖酐与具有定义的物理-化学性质例如以颗粒形式的交联的透明质酸之间产生酰胺键。与例如酯键相比,右旋糖酐-透明质酸连接(接枝)中的酰胺键的使用已被发现是有利的,因为酰胺键对于在体内的降解是更稳定的。得到的交联的透明质酸产品具有有用的稳定性性质并且因此适合作为真皮填充物以及适合于缓释应用。另一个优点在于右旋糖酐分子经由酰胺键至醚交联的透明质酸的接枝允许用右旋糖酐显著改性交联的透明质酸而不诱导其解聚。
透明质酸产品可以通过包括以下步骤的工艺制备:
(a)提供交联的透明质酸和一种或更多种官能化的右旋糖酐分子;
(b)将一种或更多种官能化的右旋糖酐分子共价地接枝至所述交联的透明质酸。
根据某些实施方案,在步骤(a)中的交联的透明质酸呈凝胶颗粒的形式,所述凝胶颗粒具有在0.01mm-5mm、优选地0.1mm-1mm的范围内的平均大小。
根据某些实施方案,得到的透明质酸产品的一种或更多种右旋糖酐分子和交联的透明质酸的二糖具有0.1%-99%、优选地1%-60%的摩尔比。
根据某些实施方案,在步骤(a)中提供的右旋糖酐分子具有小于10kDa、优选地小于5kDa的平均分子量。
根据某些实施方案,右旋糖酐分子通过单一的端-点附接被共价地连接至所述透明质酸。根据某些实施方案,右旋糖酐分子经由在右旋糖酐的还原端与透明质酸的羧基之间的双官能连接基或多官能连接基通过单一的端-点附接被共价地连接至透明质酸。
根据某些实施方案,在步骤(a)中提供的官能化的右旋糖酐分子在还原端处被双官能连接基或多官能连接基官能化,所述双官能连接基或多官能连接基具有可用于将右旋糖酐分子连接至所述交联的透明质酸的羧基的至少一种官能团。
根据某些实施方案,双官能连接基或多官能连接基包括独立地选自以下的至少两种官能团:氨基、酰肼、肼基甲酸酯、氨基脲、硫代氨基脲、硫代肼基甲酸酯或氨基氧基。根据某些实施方案,双官能连接基或多官能连接基是二胺或二酰肼。根据某些实施方案,双官能连接基或多官能连接基是六亚甲基二胺、2,2’-(亚乙基二氧基)双(乙胺)、O,O’-1,3-丙二基双羟胺、己二酸二酰肼或亚精胺。
根据某些实施方案,步骤(a)的一种或更多种官能化的右旋糖酐分子包含连接基,所述连接基具有氨基、酰肼、肼基甲酸酯、氨基脲、硫代氨基脲、硫代肼基甲酸酯或氨基氧基官能团,并且其中连接基的官能团与交联的透明质酸的羧基形成共价键。
根据某些实施方案,该工艺的步骤(a)还包括在还原端用双官能连接基或多官能连接基使右旋糖酐分子官能化,所述双官能连接基或多官能连接基具有可用于将右旋糖酐分子连接至交联的透明质酸的羧基的至少一种官能团。该工艺在反应方案1中一般地描述。
反应方案1.
双官能连接基或多官能连接基可以具有通式X-R-Y,其中X是能够与右旋糖酐的还原端形成键的官能团,并且其中X和Y可以是相同的官能团或两种不同的官能团。R是合适的间隔基团,并且可以例如包括但不限于,烷基、烷氧基、醚、硫醚或类似物。官能团X能够与开环形式的右旋糖酐的醛基反应以便形成亚胺,该亚胺然后可以被还原剂还原以形成稳定的键。连接基可以仅在右旋糖酐上的一个位点上,因为它在还原端基团处仅具有一个醛基,因此使得反应是高度特异性的。官能团X可以例如是胺、酰肼、肼基甲酸酯、氨基脲、硫代氨基脲、硫代肼基甲酸酯或氨基氧基官能团。还原剂可以例如是NaCNBH3、NaBH4、STAB(三乙酰氧基硼氢化钠)、或2-皮考啉硼烷络合物。官能团Y可以任选地在与右旋糖酐的还原端反应期间被合适的保护基(例如,叔丁氧基羰基(boc))保护,并且在偶联至交联的透明质酸的羧基之间脱保护。用于使右旋糖酐分子官能化的合适的反应条件包括在3-11的范围内的pH、在1h-48h的范围内的反应时间、在20℃-60℃的范围内的反应温度、在1:1至50:1的范围内的连接基与右旋糖酐的摩尔比、以及在1:1至50:1的范围内的还原剂与右旋糖酐的摩尔比。
官能化的右旋糖酐(右旋糖酐-连接基)可以经由连接基的游离官能团Y被接枝至交联的透明质酸,例如使用三嗪-或碳二亚胺-介导的酰胺化。该工艺在反应方案2中一般地描述。
反应方案2
交联的透明质酸的羧基与活化剂反应以形成活性酯。官能团Y是能够与活性酯反应的官能团。官能团Y可以例如是胺、酰肼、肼基甲酸酯、氨基脲、硫代氨基脲、硫代肼基甲酸酯或氨基氧基官能团。活化剂是合适的偶联剂(例如,碳二亚胺偶联剂以及活化剂例如羟胺衍生物、或三嗪)。官能团Y与活性酯反应以将右旋糖酐接枝至交联的透明质酸。用于将官能化的右旋糖酐(右旋糖酐-连接基)接枝至交联的透明质酸的合适的反应条件包括在3-12的范围内的pH、在1h-48h的范围内的反应时间、在15℃-70℃的范围内的反应温度、在0.1:1至10:1的范围内的偶联剂与透明质酸羧基的摩尔比、在0.05:1至5:1的范围内的右旋糖酐-连接基与透明质酸羧基的摩尔比以及在1mg/mL-50mg/mL的范围内的交联的透明质酸的浓度。
根据该工艺的某些实施方案,步骤(b)的接枝包括:
(i)用偶联剂使交联的透明质酸上的羧基活化以形成活化的交联的透明质酸;和
(ii)将一种或更多种官能化的右旋糖酐分子的连接基偶联至活化的交联的透明质酸的羧基。
根据某些实施方案,在步骤(b)中,同时发生交联的透明质酸的活化以及右旋糖酐分子至活化的交联的透明质酸的偶联。
根据某些实施方案,在步骤(b)中,交联的透明质酸的活化在右旋糖酐分子至活化的交联的透明质酸的偶联之前且与右旋糖酐分子至活化的交联的透明质酸的偶联分开地发生。
根据某些实施方案,偶联剂选自由以下组成的组:基于三嗪的偶联剂、碳二亚胺偶联剂、咪唑鎓衍生的偶联剂、Oxyma和COMU。根据某些实施方案,偶联剂是基于三嗪的偶联剂。根据某些实施方案,基于三嗪的偶联剂选自由以下组成的组:4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉鎓氯化物(DMTMM)和2-氯-4,6-二甲氧基-1,3,5-三嗪(CDMT)。在优选的实施方案中,基于三嗪的偶联剂是DMTMM。
步骤(a)和(b)的另外的优选的实施方案依据与得到的透明质酸产品相关的上述描述是明显的。特别地,步骤(b)还可以包括将交联的透明质酸尺寸缩减成颗粒、线、圆盘等等。
由于通过根据本发明的工艺可获得的产品的性质是复杂的,因此产品也可以被定义为是这些工艺的结果。
本发明人已惊异地发现,可能以高转化率将右旋糖酐直接地接枝至交联的透明质酸。接枝优选地经由合适的连接基通过右旋糖酐至透明质酸的共价的单一的端-点附接来进行。根据本发明的包含交联的透明质酸和一种或更多种右旋糖酐分子的透明质酸产品展现出若干优点以及令人惊异的性质。
溶胀度以及因此的吸水能力通过将右旋糖酐接枝至透明质酸凝胶的羧基被惊异地降低。在图1中示出了溶胀度的这种降低。降低的溶胀是有用的,因为这意指可以产生较硬的凝胶,而不增大在透明质酸中的交联剂的量。
右旋糖酐接枝物被期望以保护水凝胶骨架免于热降解,因为右旋糖酐相比透明质酸对降解是更稳定的。基于来自透明质酸和右旋糖酐的混合水凝胶的热重分析的结果,右旋糖酐的热稳定性已被示出为远高于透明质酸的热稳定性(图2)。
右旋糖酐接枝以保护交联的透明质酸免于被例如软骨素酶和玻璃酸酶酶降解,这归因于可用的羧基的空间位阻和/或还原数目(对于酶功能是必需的)。
右旋糖酐接枝物被期望以保护水凝胶骨架免于水解,因为右旋糖酐中的1-6糖苷键比透明质酸中的1-3和1-4糖苷键更具抗性。
用于通过酰胺键将右旋糖酐接枝至透明质酸的合成方案涉及温和且中性的条件,并且因此避免了玻尿酸骨架的不需要的降解。
根据本发明的工艺还通过改变所添加的官能化的右旋糖酐的量能够实现HA网络的高度可控制的接枝比、取代或改性的程度(图3).
右旋糖酐接枝物被相信以保护水凝胶骨架免于自由基降解,因为右旋糖酐相比HA水凝胶网络可以更优选地与自由基反应。通过单一的端-点附接被附接至HA水凝胶的右旋糖酐对于自由基也将是更可用的。
最终,接枝是高度化学选择性的且区域特异性的,因为双官能连接基仅通过单一的端-点附接与右旋糖酐的还原端以及在HA水凝胶网络中的玻尿酸的羧酸反应,产生了高度定义的结构。
不希望受限于此,本发明将在下文中通过实施例的方式来阐释。
实施例
表征
在右旋糖酐上的还原胺化
用连接基对右旋糖酐的改性利用1H NMR和LC-QToF-MS来分析。
右旋糖酐至玻尿酸凝胶的接枝
水凝胶在分析之前用软骨素酶ABC或HCl降解。在玻尿酸上的接枝的右旋糖酐的量利用1H NMR光谱学来分析。
进行LC-QToF-MS分析以确认右旋糖酐-连接基-玻尿酸之间的连接,但前提是材料可以用酶降解。
溶胀在盐水中进行。
实施例1-右旋糖酐的还原胺化
将具有750Da的数均分子量(Mn)的50.0g右旋糖酐、118.4g六亚甲基二胺二盐酸盐和39.4g NaCNBH3称重于500mL玻璃瓶中。将反应物溶解在250g 50mM四硼酸钠缓冲液中。用1M NaOH将pH调节至pH 9.8。将瓶子置于60℃的水浴中持续3h。
将反应粗产物用稀HCl中和至pH 7并且转移至3L塑料烧杯中。在用顶置式搅拌器搅拌并且使用蠕动泵缓慢添加乙醇直到最终的乙醇浓度为90%时,反应粗产物沉淀。将沉淀物用90%乙醇洗涤多次以完全地除去未键合的反应化学品并且在真空干燥器中干燥。
将干燥的粉末溶解在D2O中并且通过1H NMR来分析。通过比较来自右旋糖酐的异头质子的信号(4.94ppm)与六亚甲基二胺信号(1.33ppm)发现的是,样品中的总右旋糖酐的87%被偶联至六亚甲基二胺。
实施例2-麦芽三糖的还原胺化
将1.0g麦芽三糖、1.9g六亚甲基二胺二盐酸盐和0.7g NaCNBH3称重于20mL的具有铝盖的玻璃小瓶中。将反应物溶解在5g 50mM四硼酸钠缓冲液中。用1M NaOH将pH调节至10。然后将小瓶置于60℃的水浴中持续3h。
反应粗产物用稀HCl中和至pH 7。粗产物在稀释之后在LC-QToF-MS上使用负电喷雾来分析。发现的是,溶液包含80面积%的麦芽三糖-HMDA(m/z 603.30)、10面积%的麦芽三糖-HMDA-麦芽三糖(m/z 1091.47)和10面积%的还原的麦芽三糖(m/z 505.18)构成。
实施例3-右旋糖酐的还原胺化
将具有Mn 1100Da的5.0g右旋糖酐、5.4g亚精胺三盐酸盐和1.6g NaCNBH3称重于50mL玻璃瓶中。将反应物溶解在14.3g 50mM四硼酸钠缓冲液中。用1M NaOH将pH调节至pH 9.3。将瓶子置于60℃的水浴中持续2h。
反应粗产物用稀HCl中和至pH 7并且转移至3L塑料烧杯中。在用顶置式搅拌器搅拌并且使用蠕动泵缓慢添加乙醇直到最终的乙醇浓度为90%时,反应粗产物沉淀。沉淀物用90%乙醇洗涤多次以完全地除去未键合的反应化学品并且在真空干燥器中干燥。
将干燥的粉末溶解在D2O中并且通过1H NMR来分析。确认的是,当来自右旋糖酐的异头质子的信号(4.94ppm)与亚精胺信号(1.76ppm)相比时,右旋糖酐被亚精胺改性。
实施例4-右旋糖酐的还原胺化
将具有Mn 1100Da的5.0g右旋糖酐、3.4g 2,2’-(亚乙基二氧基)双(乙胺)和1.5g NaCNBH3称重于50mL玻璃瓶中。将反应物溶解在15.0g 50mM四硼酸钠缓冲液中。用1M NaOH将pH调节至10.3。将瓶子置于60℃的水浴中持续2h。
反应粗产物用稀HCl中和至pH 7并且转移至3L塑料烧杯中。在用顶置式搅拌器搅拌并且使用蠕动泵缓慢添加乙醇直到最终的乙醇浓度为90%时,反应粗产物沉淀。沉淀物用90%乙醇洗涤多次以完全地除去未键合的反应化学品并且在真空干燥器中干燥。
将干燥的粉末溶解在D2O中并且通过1H NMR来分析。确认的是,当来自右旋糖酐的异头质子的信号(4.94ppm)与2,2’-(亚乙基二氧基)双(乙胺)信号(3.20ppm)相比时,右旋糖酐被2,2’-(亚乙基二氧基)双(乙胺)改性。
实施例5-右旋糖酐的还原胺化
将具有Mn 1100Da的5.1g右旋糖酐、4.1g O,O’-1,3-丙二基双羟胺二盐酸盐和1.5g NaCNBH3称重于50mL玻璃瓶中。将反应物溶解在13.4g 50mM四硼酸钠缓冲液中。用1M NaOH将pH调节至9.7。将瓶子置于60℃的水浴中持续2h。
反应粗产物用稀HCl中和至pH 7并且转移至3L塑料烧杯中。在用顶置式搅拌器搅拌并且使用蠕动泵缓慢添加乙醇直到最终的乙醇浓度为90%时,反应粗产物沉淀。沉淀物用90%乙醇洗涤多次以完全地除去未键合的反应化学品并且在真空干燥器中干燥。
将干燥的粉末溶解在D2O中并且通过1H NMR来分析。确认的是,当来自右旋糖酐的异头质子的信号(4.94ppm)与O,O’-1,3-丙二基双羟胺信号(4.18ppm)相比时,右旋糖酐被O,O’-1,3-丙二基双羟胺改性。
实施例6-右旋糖酐的还原胺化
将具有Mn 1100Da的5.0g右旋糖酐、4.1g己二酸二酰肼和1.7gNaCNBH3称重于50mL玻璃瓶中。将反应物溶解在13.5g 50mM四硼酸钠缓冲液中。用1M NaOH将pH调节至9.5。将瓶子置于60℃的水浴中持续2h。
反应粗产物用稀HCl中和至pH 7并且转移至3L塑料烧杯中。在用顶置式搅拌器搅拌并且使用蠕动泵缓慢添加乙醇直到最终的乙醇浓度为90%时,反应粗产物沉淀。沉淀物用90%乙醇洗涤多次以完全地除去未键合的反应化学品并且在真空干燥器中干燥。
将干燥的粉末溶解在D2O中并且通过1H NMR来分析。确认的是,当来自右旋糖酐的异头质子的信号(4.94ppm)与己二酸二酰肼信号(1.60ppm)相比时,右旋糖酐被己二酸二酰肼改性。
实施例7至13-官能化的右旋糖酐至玻尿酸凝胶的接枝
在实施例7-13中,官能化的右旋糖酐分子被接枝至透明质酸水凝胶。透明质酸凝胶根据在国际专利申请WO 97/04012(Agerup等人)的实施例1和2中描述的一般程序来制备。
实施例7-13中使用的术语转化率定义为接枝的改性的右旋糖酐的摩尔数除以在反应中使用的改性的右旋糖酐的总摩尔数。
实施例7-将具有六亚甲基二胺的右旋糖酐(1kDa)接枝至水凝胶
将在还原端处用六亚甲基二胺改性的1.1g右旋糖酐1kDa和5.6gDMTMM称重于100mL玻璃瓶中。添加80g 1mM磷酸盐缓冲液pH 7.4以溶解反应物。在搅拌的同时将1.6g沉淀的玻尿酸水凝胶添加至反应溶液,使得获得了浓度为20mg/mL的玻尿酸。将样品置于50℃水浴中并且允许反应持续一天。
水凝胶被减小粒度并且在0.2μm过滤器上用0.9%NaCl洗涤一次。用0.25M NaOH使pH增加至13。在90分钟之后,用稀HCl将水凝胶中和至中性pH。凝胶用0.9%NaCl连续地洗涤,并且然后通过用顶置式搅拌器搅拌该凝胶并且用蠕动泵缓慢添加乙醇直到70%乙醇来沉淀。沉淀物用70%乙醇洗涤数次。然后,沉淀的水凝胶在真空干燥器中干燥。
1H NMR示出了通过比较右旋糖酐(4.94ppm)的异头质子与HA(2.02ppm)的N-乙酰基质子得到的27%的改性度(右旋糖酐链的摩尔数/HA二糖重复单元的摩尔数)。右旋糖酐在反应中的转化率为85%。偶联的右旋糖酐-连接基-HA用LC-QToF-MS来确认。凝胶的初始溶胀因子为1.6mL/g并且在反应后其已降低至0.9mL/g。
实施例8-将具有六亚甲基二胺的右旋糖酐(1kDa)接枝至水凝胶
将在还原端处用六亚甲基二胺改性的3.5g右旋糖酐1kDa和5.6g DMTMM称重于100mL玻璃瓶中。添加80g 1mM磷酸盐缓冲液pH 7.4以溶解反应物。在搅拌的同时将1.6g沉淀的玻尿酸水凝胶添加至反应溶液,使得获得了浓度为20mg/mL的玻尿酸。将样品置于50℃水浴中并且允许反应持续一天。
水凝胶被减小粒度并且在0.2μm过滤器上用0.9%NaCl洗涤一次。用0.25M NaOH使pH增加至13。在90分钟之后,用稀HCl将水凝胶中和至中性pH。凝胶用0.9%NaCl连续地洗涤,并且然后通过用顶置式搅拌器搅拌该凝胶并且用蠕动泵缓慢添加乙醇直到70%乙醇来沉淀。沉淀物用70%乙醇洗涤若干次。然后,沉淀的水凝胶在真空干燥器中干燥。
1H NMR示出了通过比较右旋糖酐(4.94ppm)的异头质子与HA(2.02ppm)的N-乙酰基质子得到的47%的改性度(右旋糖酐链的摩尔数/HA二糖重复单元的摩尔数)。右旋糖酐在反应中的转化率为46%。偶联的右旋糖酐-连接基-HA用LC-QToF-MS来确认。凝胶的初始溶胀因子为5.1mL/g并且在反应后其已降低至2.7mL/g。
实施例9-将具有亚精胺的右旋糖酐(1kDa)接枝至水凝胶
将在还原端处用亚精胺改性的0.5g右旋糖酐1kDa和0.6g DMTMM称重于50mL塑料瓶中。添加20g 1mM磷酸盐缓冲液pH 7.4以溶解反应物。用稀HCl将溶液的pH调节为7.0。在搅拌的同时将0.4g沉淀的玻尿酸水凝胶添加至反应溶液,使得获得了浓度为20mg/mL的玻尿酸。将样品置于50℃水浴中并且允许反应持续一天。
水凝胶被减小粒度并且在0.2μm过滤器上用0.9%NaCl洗涤一次。用0.25M NaOH使pH增加至13。在70分钟之后,用稀HCl将水凝胶中和至中性pH。将凝胶转移至联接至蠕动泵的柱中。水凝胶通过从底部泵送2.5L 0.9%NaCl到顶部来连续地洗涤。然后,凝胶从柱被除去并且分析。
1H NMR示出了通过比较右旋糖酐(4.94ppm)的异头质子与HA(2.02ppm)的N-乙酰基质子得到的18%的改性度(右旋糖酐链的摩尔数/HA二糖重复单元的摩尔数)。右旋糖酐在反应中的转化率为78%。偶联的右旋糖酐-连接基-HA不能用LC-QToF-MS确认,因为材料未被软骨素酶ABC完全地降解。
实施例10-将具有2,2’-(亚乙基二氧基)双(乙胺)的右旋糖酐(1kDa)接枝至水凝胶
将在还原端处用2,2’-(亚乙基二氧基)双(乙胺)改性的0.5g右旋糖酐1kDa和0.6g DMTMM称重于50mL塑料瓶中。添加20g 1mM磷酸盐缓冲液pH 7.4以溶解反应物。用稀HCl将溶液的pH调节为7.1。在搅拌的同时将0.4g沉淀的玻尿酸水凝胶添加至反应溶液,使得获得了浓度为20mg/mL的玻尿酸。将样品置于50℃水浴中并且允许反应持续一天。
水凝胶被减小粒度并且在0.2μm过滤器上用0.9%NaCl洗涤一次。用0.25M NaOH使pH增加至13。在70分钟之后,用稀HCl将水凝胶中和至中性pH。将水凝胶转移至联接至蠕动泵的柱中。凝胶通过从底部泵送2.5L 0.9%NaCl到顶部来连续地洗涤。然后,凝胶从柱被除去并且分析。
1H NMR示出了通过比较右旋糖酐(4.94ppm)的异头质子与HA(2.02ppm)的N-乙酰基质子得到的21%的改性度(右旋糖酐链的摩尔数/HA二糖重复单元的摩尔数)。右旋糖酐在反应中的转化率为90%。偶联的右旋糖酐-连接基-HA用LC-QToF-MS确认。
实施例11-将具有O,O’-1,3-丙二基双羟胺的右旋糖酐(1kDa)接枝至水凝胶
将在还原端处用O,O’-1,3-丙二基双羟胺改性的0.5g右旋糖酐1kDa和0.6g DMTMM称重于50mL塑料瓶中。添加20g 1mM磷酸盐缓冲液pH 7.4以溶解反应物。用稀HCl将溶液的pH调节为6.9。在搅拌的同时将0.4g沉淀的玻尿酸水凝胶添加至反应溶液,使得获得了浓度为20mg/mL的玻尿酸。将样品置于50℃水浴中并且允许反应持续一天。
水凝胶被减小粒度并且在0.2μm过滤器上用0.9%NaCl洗涤一次。用0.25M NaOH使pH增加至13。在75分钟之后,用稀HCl将水凝胶中和至中性pH。将水凝胶转移至联接至蠕动泵的柱中。凝胶通过从底部泵送2.5L 0.9%NaCl到顶部来连续地洗涤。然后,凝胶从柱被除去并且分析。
1H NMR示出了通过比较右旋糖酐(4.94ppm)的异头质子与HA(2.02ppm)的N-乙酰基质子得到的11%的改性度(右旋糖酐链的摩尔数/HA二糖重复单元的摩尔数)。右旋糖酐在反应中的转化率为49%。偶联的右旋糖酐-连接基-HA用LC-QToF-MS确认。
实施例12-将具有己二酸二酰肼的右旋糖酐(1kDa)接枝至水凝胶
将在还原端处用己二酸二酰肼改性的0.5g右旋糖酐1kDa和0.6g DMTMM称重于50mL塑料瓶中。添加20g 1mM磷酸盐缓冲液pH 7.4以溶解反应物。用稀HCl将溶液的pH调节为7.1。在搅拌的同时将0.4g沉淀的玻尿酸水凝胶添加至反应溶液,使得获得了浓度为20mg/mL的玻尿酸。将样品置于50℃水浴中并且允许反应持续一天。
水凝胶被减小粒度并且在0.2μm过滤器上用0.9%NaCl洗涤一次。用0.25M NaOH使pH增加至13。在75分钟之后,用稀HCl将水凝胶中和至中性pH。将水凝胶转移至联接至蠕动泵的柱中。凝胶通过从底部泵送2.5L 0.9%NaCl到顶部来连续地洗涤。然后,凝胶从柱被除去并且分析。
1H NMR示出了通过比较右旋糖酐(4.94ppm)的异头质子与HA(2.02ppm)的N-乙酰基质子得到的5%的改性度(右旋糖酐链的摩尔数/HA二糖重复单元的摩尔数)。右旋糖酐在反应中的转化率为20%。偶联的右旋糖酐-连接基-HA不能用LC-QToF-MS确认,因为材料未被软骨素酶ABC完全地降解。
实施例13-将具有六亚甲基二胺的麦芽三糖接枝至水凝胶
将在还原端处用六亚甲基二胺改性的0.3g麦芽三糖和0.6g DMTMM称重于50mL塑料瓶中。添加20g 1mM磷酸盐缓冲液pH 7.4以溶解反应物。用稀HCl将溶液的pH调节为7.0。在搅拌的同时将0.4g沉淀的玻尿酸水凝胶添加至反应溶液,使得获得了浓度为20mg/mL的玻尿酸。将样品置于50℃水浴中并且允许反应持续一天。
水凝胶被减小粒度并且在0.2μm过滤器上用0.9%NaCl洗涤一次。用0.25M NaOH使pH增加至13。在80分钟之后,用稀HCl将水凝胶中和至中性pH。将水凝胶转移至联接至蠕动泵的柱中。凝胶通过从底部泵送2.5L 0.9%NaCl到顶部来连续地洗涤。然后,凝胶从柱被除去并且分析。
1H NMR示出了通过比较麦芽三糖(4.94ppm)的异头质子与HA(2.02ppm)的N-乙酰基质子得到的10%的改性度(麦芽三糖链的摩尔数/HA二糖重复单元的摩尔数)。麦芽三糖在反应中的转化率为43%。偶联的麦芽三糖-连接基-HA用LC-QToF-MS确认。
权利要求书(按照条约第19条的修改)
1.一种透明质酸产品,包含交联的透明质酸和一种或更多种右旋糖酐分子,其中所述透明质酸通过醚键交联,并且所述一种或更多种右旋糖酐分子被共价地接枝至所述交联的透明质酸,其中所述右旋糖酐分子经由在右旋糖酐的还原端与透明质酸的羧基之间的双官能连接基或多官能连接基通过单一的端-点附接被共价地连接至所述透明质酸。
2.根据权利要求1所述的透明质酸产品,其中所述交联的透明质酸呈凝胶的形式。
3.根据前述权利要求中任一项所述的透明质酸产品,其中所述交联的透明质酸呈凝胶颗粒的形式,所述凝胶颗粒具有在0.01mm-5mm、优选地0.1mm-1mm的范围内的平均大小。
4.根据前述权利要求中任一项所述的透明质酸产品,其中透明质酸链经由连接基彼此交联,所述连接基衍生自双官能交联剂或多官能交联剂。
5.根据权利要求4所述的透明质酸产品,其中所述双官能交联剂或多官能交联剂是双环氧化物或多环氧化物。
6.根据权利要求5所述的透明质酸产品,其中所述双官能交联剂或多官能交联剂是二缩水甘油醚。
7.根据权利要求6所述的透明质酸产品,其中所述双官能交联剂或多官能交联剂选自由以下组成的组:1,4-丁二醇二缩水甘油醚(BDDE)、1,2-双(2,3-环氧丙氧基)乙烯(EGDGE)和乙二醇二缩水甘油醚(EGDE)、1,2-乙二醇二缩水甘油醚(EDDE)以及二环氧辛烷。
8.根据权利要求7所述的透明质酸产品,其中所述双官能交联剂或多官能交联剂是1,4-丁二醇二缩水甘油醚(BDDE)。
9.根据前述权利要求中任一项所述的透明质酸产品,其中所述一种或更多种右旋糖酐分子和所述交联的透明质酸的二糖具有0.1%-99%的摩尔比。
10.根据前述权利要求中任一项所述的透明质酸产品,其中所述一种或更多种右旋糖酐分子和所述交联的透明质酸的二糖具有1%-60%的摩尔比。
11.根据前述权利要求中任一项所述的透明质酸产品,其中所述右旋糖酐分子具有小于10kDa的平均分子量。
12.根据前述权利要求中任一项所述的透明质酸产品,其中所述右旋糖酐分子具有小于5kDa的平均分子量。
13.根据前述权利要求中任一项所述的透明质酸产品,其中所述右旋糖酐分子包含连接基,所述连接基具有氨基、酰肼、肼基甲酸酯、氨基脲、硫代氨基脲、硫代肼基甲酸酯或氨基氧基官能团,并且其中所述连接基的官能团与所述交联的透明质酸的羧基形成共价键。
14.根据权利要求13所述的透明质酸产品,其中所述双官能连接基或多官能连接基包括二胺或二酰肼。
15.根据前述权利要求中任一项所述的透明质酸产品,其中所述一种或更多种右旋糖酐分子通过酰胺键被共价地接枝至所述交联的透明质酸。
16.一种制备透明质酸产品的工艺,所述透明质酸产品包含交联的透明质酸和一种或更多种右旋糖酐分子,所述工艺包括以下步骤:
(a)提供交联的透明质酸和一种或更多种官能化的右旋糖酐分子;
(b)将一种或更多种官能化的右旋糖酐分子共价地接枝至所述交联的透明质酸;
其中在步骤(a)中提供的所述官能化的右旋糖酐分子在还原端处被双官能连接基或多官能连接基官能化,所述双官能连接基或多官能连接基具有可用于将所述右旋糖酐分子连接至所述交联的透明质酸的羧基的至少一种官能团。
17.根据权利要求16所述的工艺,其中在步骤(a)中的所述交联的透明质酸呈凝胶的形式。
18.根据权利要求16-17中任一项所述的工艺,其中在步骤(a)中的所述交联的透明质酸呈凝胶颗粒的形式,所述凝胶颗粒具有在0.01mm-5mm、优选地0.1mm-1mm的范围内的平均大小。
19.根据权利要求16-18中任一项所述的工艺,其中得到的透明质酸产品中的所述一种或更多种右旋糖酐分子和所述交联的透明质酸的二糖具有0.1%-99%的摩尔比。
20.根据权利要求16-19中任一项所述的工艺,其中得到的透明质酸产品中的所述一种或更多种右旋糖酐分子和所述交联的透明质酸的二糖具有1%-60%的摩尔比。
21.根据权利要求16-20中任一项所述的工艺,其中在步骤(a)中提供的所述右旋糖酐分子具有小于10kDa的平均分子量。
22.根据权利要求16-21中任一项所述的工艺,其中在步骤(a)中提供的所述右旋糖酐分子具有小于5kDa的平均分子量。
23.根据权利要求16-22中任一项所述的工艺,其中步骤(a)的所述一种或更多种官能化的右旋糖酐分子包含连接基,所述连接基具有氨基、酰肼、肼基甲酸酯、氨基脲、硫代氨基脲、硫代肼基甲酸酯或氨基氧基官能团,并且其中所述连接基的官能团与所述交联的透明质酸的羧基形成共价键。
24.根据权利要求23所述的工艺,其中所述双官能连接基或多官能连接基包括二胺或二酰肼。
25.根据权利要求16-24中任一项所述的工艺,其中步骤(b)的共价接枝包括:
(i)用偶联剂使所述交联的透明质酸上的所述羧基活化,以形成活化的交联的透明质酸;以及
(ii)将所述一种或更多种官能化的右旋糖酐分子的所述连接基偶联至所述活化的交联的透明质酸的所述羧基。
26.根据权利要求25所述的工艺,其中,在步骤(b)中,所述交联的透明质酸的所述活化和所述右旋糖酐分子至所述活化的交联的透明质酸的所述偶联同时发生。
27.根据权利要求25所述的工艺,其中,在步骤(b)中,所述交联的透明质酸的所述活化在所述一种或更多种右旋糖酐分子至所述活化的交联的透明质酸的所述偶联之前且与所述一种或更多种右旋糖酐分子至所述活化的交联的透明质酸的所述偶联分开地发生。
28.根据权利要求25-27中任一项所述的工艺,其中所述偶联剂选自由以下组成的组:基于三嗪的偶联剂、碳二亚胺偶联剂、咪唑鎓衍生的偶联剂、Oxyma和COMU。
29.根据权利要求28所述的工艺,其中所述偶联剂是基于三嗪的偶联剂。
30.根据权利要求29所述的工艺,其中所述基于三嗪的偶联剂选自由以下组成的组:4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉鎓氯化物(DMTMM)和2-氯-4,6-二甲氧基-1,3,5-三嗪(CDMT)。
31.根据权利要求30所述的工艺,其中所述基于三嗪的偶联剂是DMTMM。
32.一种透明质酸产品,通过根据权利要求16-31中任一项所述的工艺是可获得的。
33.根据权利要求1-15或32中任一项所述的透明质酸产品用作真皮填充物的用途。
- 还没有人留言评论。精彩留言会获得点赞!