用于处理基于高丝氨酸的化合物的方法与流程
本公开涉及用于处理基于高丝氨酸的化合物的方法,所述方法能够由基于高丝氨酸的化合物大规模生产有用化合物。
背景技术:
煤和石油——工业中的主要天然资源——被用作合成多种化合物的原料,同时也被用作矿物燃料。具体而言,石油的蒸馏能够生成多种物质,如烷烃类、烯烃类等,并且这些物质可以用作合成多种物质的合成原料。例如,由石油合成多种物质,如聚合物、药物和食品添加剂。但是,存在以下问题:在石油消耗过程中会产生二氧化碳和有害物质,并且世界上的石油储量有限。
因此,研究集中在作为合成原料的石油的替换,具体地,在研究中生物质已受到高度关注。生物质是指通过化学方法或生物方法可以由植物(例如,诸如玉米、豆类和甘蔗的可再生植物资源)制备而成的物质。
具体地,可以从植物如甘蔗中得到糖(如葡萄糖、果糖等)。由此得到的糖可以用作食物,并且可以通过使用微生物使糖发酵而得到多种化合物,如基于高丝氨酸的化合物。高丝氨酸是具有2-氨基-4-羟基丁酸结构的氨基酸,并且可以用作制备蛋氨酸、苏氨酸、异亮氨酸等的中间体。高丝氨酸可以转化为内酯形式,或者可以将高丝氨酸的4-羟基部分取代,例如,高丝氨酸、高丝氨酸内酯、O-乙酰基高丝氨酸、O-琥珀酰基高丝氨酸、高丝氨酸内酯盐酸(HCl)盐、高丝氨酸内酯氢溴酸盐等的结构是可能的。
为了提高基于高丝氨酸的化合物的增加值,可以通过内酯化作用或水解制备γ-丁内酯或其衍生物、呋喃酮、琥珀酸二烷基酯等。为此,将氨基从基于高丝氨酸的化合物中除去的过程(即脱氨过程)是必要的。
作为通过工业化学法进行脱氨过程的方法,已经提出使用催化剂的方法、使用酶的方法等。但是,使用催化剂的方法的效果还未得到证实,而使用酶的方法不适合于大规模工业生产。
具体而言,γ-丁内酯是用于制备N-吡咯烷酮衍生物的重要中间体,其被用作合成聚合物、药物等的中间体,并且对γ-丁内酯的需求日益增加。γ-丁内酯可以在石油化工过程中通过1,4-丁二醇的脱氢或马来酸酐或琥珀酸酐的氢化制备而成。然而,上述方法的问题在于,由于原料价格的明显波动,生产成本可能增加,因而有必要开发一种用于制备γ-丁内酯的新物质。
另一方面,1,4-丁二醇在工业中被广泛使用,具体而言,它是用作合成聚对苯二甲酸丁二醇酯树脂、聚氨酯、γ-丁内酯、四氢呋喃等的合成原料的非常重要的物质。1,4-丁二醇主要通过石油化学方法制备而成,例如,其可以由乙炔、丁二烯、氧化丙烯、马来酸酐等生成。然而,其存在的缺点在于,由于原料的价格波动,生产成本可能增加,和其生产过程复杂且需要巨大的设备。因此,有必要开发从石油依赖性原料以外的原料制备1,4-丁二醇的方法。
在这些情况下,本发明人已经作出许多努力以找到由基于高丝氨酸的化合物制备有用化合物的方法,所述有用化合物可以在工业中用作制备重要化合物的中间体。结果,他们发现用于处理基于高丝氨酸的化合物的方法,所述方法由于过程简单和高产率而有利于大规模工业生产,从而完成本公开。
公开内容
技术问题
本公开涉及由基于高丝氨酸的化合物制备有用化合物,其可以在工业中用作制备重要化合物的中间体,具体地,涉及用于处理基于高丝氨酸的化合物的方法以及由此生成的化合物,通过该方法可以大规模地由基于高丝氨酸的化合物生成有用化合物。
技术方案
为了实现上述目的,本公开提供制备γ-丁内酯、γ-丁内酯衍生物、呋喃酮、琥珀酸二烷基酯、副产物或其混合物的方法,其包括:
使基于高丝氨酸的化合物的溶液与NOx反应(步骤1);和
从步骤1的产物中回收γ-丁内酯、γ-丁内酯衍生物、呋喃酮、琥珀酸二烷基酯、副产物或其混合物(步骤2)。
步骤1是基于高丝氨酸的化合物的脱氨过程,其中通过与NOx反应除去基于高丝氨酸的化合物中的氨基。
基于高丝氨酸的化合物的实例可包括高丝氨酸、高丝氨酸内酯、O-乙酰基高丝氨酸、O-琥珀酰基高丝氨酸、高丝氨酸内酯盐酸(HCl)盐、高丝氨酸内酯氢溴酸盐、及其混合物,并且每个化合物的结构如下所示。
上述基于高丝氨酸的化合物具有氨基,并且在本公开中,它们与NOx反应以除去化合物中的氨基(一个或多个)。如本文所使用的,术语“NOx”是指氮氧化物并且在本公开中用作氧化剂。NOx中,x是指1、1.5、2或3。在本公开中,NOx的实例可包括NO、N2O3、NO2和NO3。
NOx可以以气体形式直接与基于高丝氨酸的化合物反应或者以硝酸盐(nitrate)的形式与基于高丝氨酸的化合物反应。当以硝酸盐的形式使用NOx时,其可以通过与HNO3、NH4NO3或金属离子结合而充当催化剂。例如,NOx可以以NaNO2、Fe(NO3)3、Al(NO3)3、Cu(NO3)3、Bi(NO3)3、Zn(NO3)2或Pb(NO3)2的形式起作用。
当以气体形式使用NOx时,将单独使用NO气体从而能够脱氨。此外,NOx可以以NO气体与O2气体、惰性气体或其混合物组合地使用,或者可以与催化剂一起使用。所使用的惰性气体可包括N2气体、He气体、Ar气体或其混合物。
此外,当NO气体与O2气体一起使用时,NO与O2反应生成NO2、N2O3等,并且这些可以与NO一起用于脱氨。NO气体和O2气体可以以1至3∶1(具体是2∶1)的摩尔比(NO∶O2)使用。O2气体也可用作空气。
在封闭的反应系统中,为了增加反应压力,可以同时使用惰性气体。此外,在开放的反应系统中,可以使用不包括惰性气体的NO或O2。此外,在开放的反应系统中,可以同时使用惰性气体,然而,所供给的气体量的增加可能缩短反应物与气体之间的接触时间,从而导致NO气体的损失。因此,可以使用不包括惰性气体的纯NO气体。
为了与NO或NOx和基于高丝氨酸的化合物反应,基于高丝氨酸的化合物可以以溶液的形式或者以分散在溶剂中的状态使用。具体地,基于高丝氨酸的化合物的溶剂的实例可包括可以使基于高丝氨酸的化合物溶解或溶胀的溶剂,或者具有高吸收浓度的NO或NOx气体的溶剂。另一方面,可以使用能够促使产物容易分离的溶剂。根据产物的选择性,溶剂可以是水、氯仿、二氯甲烷、甲醇、卤代-γ-丁内酯或其混合物。
在通过脱氨生成的产物之中,γ-丁内酯衍生物的选择性根据对基于高丝氨酸的化合物的溶剂的选择而变化。例如,当使用水作为溶剂时,促进羟基-γ-丁内酯的生成,而当使用有机溶剂如氯仿、二氯甲烷、卤代-γ-丁内酯或其混合物时,羟基-γ-丁内酯的生成会降至最小。此外,当使用甲醇作为溶剂时,生成甲氧基-γ-丁内酯。
根据所使用的基于高丝氨酸的化合物,生成多种产物。具体地,当使用高丝氨酸内酯时,压倒性地生成羟基-γ-丁内酯,而当使用高丝氨酸内酯盐时,压倒性地生成卤代-γ-丁内酯。呋喃酮与其它化合物一起生成,而不管高丝氨酸衍生物的种类。当使用O-琥珀酰基高丝氨酸或O-乙酰基高丝氨酸时,生成2,4-二羟基丁酸,并且生成琥珀酸、琥珀酸酐、乙酸和乙酸酐。在这方面,可以使用醇进行进一步酯化而制备琥珀酸二烷基酯。可以通过使羟基-γ-丁内酯与乙酸、乙酸酐或乙酰氯进行进一步乙酰化来制备乙酰氧基-γ-丁内酯。具体而言,在步骤1中,当高丝氨酸内酯盐为反应物并且使用水或卤代-γ-丁内酯衍生物作为溶剂时,由于在脱氨过程中比重和溶解度的差异而产生产物(一个或多个)的层分离。因此,未反应的材料和产物(一个或多个)可以容易地分离出并回收。
此外,可以添加卤化物以提高产物中卤代-γ-丁内酯的选择性。更具体地,当使用高丝氨酸内酯盐脱氨时,可以添加形成高丝氨酸内酯盐的相同卤化物,以使选择性最大化。卤化物具体为氢溴酸、氢氯酸、氢氟酸或氢碘酸,并且卤化物的添加可提高经卤素取代的γ-丁内酯的生产速率。在不希望受理论限制的情况下,在使基于高丝氨酸的化合物与NOx反应的过程中,卤化物中的卤素可以部分参与反应,从而提高经卤素取代的γ-丁内酯的生产速率。此外,可以使用不含水的氯仿、二氯甲烷和卤代-丁内酯,以使当使用溶剂时产生的羟基-γ-丁内酯的量最小化。
此外,在步骤1中,可以在没有催化剂的情况下进行反应,或者可以使用金属催化剂。金属催化剂能够加速NOx(特别是,不使用O2的NO气体)和基于高丝氨酸的化合物之间的反应。可以将金属催化剂添加至步骤1的反应系统或基于高丝氨酸的化合物的溶液。金属催化剂可以是选自M1/X、M1M2/X和Fe2O3中的至少一种,其中M1和M2彼此不相同并且是贵金属或过渡金属,并且X是活性炭或SiO2。更具体地,贵金属可以是Pd、Pt、Rh、Ir、Re、Ru、Re、或Au,并且过渡金属可以是Fe、Pb、Sb、Ag、Al、Cu、Ni、Cr或Zn。
此外,步骤1中的反应温度可以在0℃至200℃。此外,步骤1中的反应压力可以是1atm至100atm。反应压力可以通过所供应的气体(如NO、惰性气体等)控制。
在示例性实施方式中,在步骤1中,当使用NO气体而不使用O2进行脱氨时,优选在50℃至150℃进行反应。此外,反应压力优选在5atm至50atm的范围内。反应压力可以通过所供应的气体(如NO、惰性气体等)控制。
在另一个示例性实施方式中,在步骤1中,当单独使用NO气体或同时使用NO气体和O2气体两者时,可以在0℃至50℃进行反应。此外,反应压力可以为1atm,但并不具体限于此。
步骤2涉及对由步骤1中的基于高丝氨酸的化合物制备的γ-丁内酯、γ-丁内酯衍生物、呋喃酮、琥珀酸二烷基酯、副产物或其混合物的分离和回收。
在上述产物中,γ-丁内酯衍生物可以是卤代-γ-丁内酯、羟基-γ-丁内酯、甲氧基-γ-丁内酯、乙酰氧基-γ-丁内酯或其混合物。副产物可以是琥珀酸、琥珀酸酐、乙酸、乙酸酐、2,4-二羟基丁酸、4-羟基-2-丁烯酸甲酯、4-羟基-2-甲氧基丁酸、4-羟基-2-氯代丁酸丁或其混合物。此外,可以将副产物再循环以用于在分离和回收后提高本公开方法中产物的选择性的目的。
由上述产物生成的每种化合物可以通过常规分离方法(如蒸馏等)进行分离。
此外,根据步骤1中使用的基于高丝氨酸的化合物,为了工艺效率,可以通过下述方法分离和回收每个产物。
在示例性实施方式中,当步骤1中的反应物是高丝氨酸内酯盐酸盐或高丝氨酸内酯氢溴酸盐时,每个产物可以按照如下所述进行分离和回收。
当步骤1中的反应物是高丝氨酸内酯盐酸盐或高丝氨酸内酯氢溴酸盐时,可以得到卤代-γ-丁内酯和羟基-γ-丁内酯作为主要产物。由于比重和溶解度的差异,卤代-γ-丁内酯和羟基-γ-丁内酯可以以高产率回收并与下层分离。
此外,可以使用诸如氯仿、二氯甲烷、三氯乙烷或四氯乙烷的有机溶剂萃取步骤1中的含有产物的溶液,从而回收卤代-γ-丁内酯或羟基-γ-丁内酯。可以将下层分离并回收,然后使用上述有机溶剂萃取上层。这是因为通过层分离首先分离出下层以先将卤代-γ-丁内酯回收,可以容易地进行上述萃取。
具体地,作为替代选择,从产物中将下层分离并回收,然后将上层中的一部分返回到步骤1以用作反应溶剂,并按照以上描述萃取上层中的剩余部分。即,通过再循环存在于上层中的脱氨产物的溶液中所含的酸(HCl、HBr等)和NOx并重复使用由于卤代-丁内酯的去除(从而能够制备卤代γ-丁内酯作为主要产物)而具有相对增加的羟基-γ-丁内酯部分的溶液,可以提高工艺效率。此外,处理废水的成本以及因使用NO气体和卤化物(HCl、HBr等)造成的成本可以通过使在整个过程中使用的溶剂的量降到最小而降低。
此外,可以将卤代-γ-丁内酯或羟基-γ-丁内酯回收后的残余溶液再循环到步骤1中。再循环具有的优点在于,残余溶液中存在的未反应物质可再次在步骤1再循环,从而提高了工艺效率,并且由于残余溶液在步骤1中含有大量的基于高丝氨酸的化合物的溶剂,因此也可以使在整个过程中使用的溶剂的量最小化。可选地,可以从残余溶液中回收羟基-γ-丁内酯、呋喃酮或其混合物。由于剩余溶液处于卤代-γ-丁内酯被最大程度除去的状态,可以通过除去剩余溶液中所含的溶剂来回收羟基-γ-丁内酯、呋喃酮或其混合物。可以通过常规方法例如蒸馏、加热等除去溶剂。
在另一个示例性实施方式中,当步骤1中的反应物是O-琥珀酰基高丝氨酸时,可以按如下将每个产物分离并回收。
当步骤1中的反应物是O-琥珀酰基高丝氨酸时,O-琥珀酰基高丝氨酸的水解反应与O-琥珀酰基高丝氨酸的脱氨同时发生,从而生成琥珀酸或琥珀酸酐和2,4-二羟基丁酸作为初级产物,同时生成琥珀酸或琥珀酸酐作为沉淀物。通过过滤将部分琥珀酸和琥珀酸酐回收,其中通过在减压下蒸馏从包含琥珀酸、琥珀酸酐和2,4-二羟基丁酸的溶液中除去溶剂,并使用甲醇进行酯化,从而将琥珀酸或琥珀酸酐转化为琥珀酸二烷基酯。溶剂除去和在酯化反应过程中添加的酸引起2,4-二羟基丁酸的环化脱水,从而形成羟基-γ-丁内酯。可以在减压下对琥珀酸(b.p.:235℃)、琥珀酸酐(b.p.:261℃)、羟基-γ-丁内酯(b.p.:249.3℃)和琥珀酸二甲酯(b.p.:195.3℃)进行蒸馏以被回收作为主要产物。
在又一个示例性实施方式中,当步骤1中的反应物是高丝氨酸时,可以按如下将每个产物分离并回收。
当步骤1中的反应物是高丝氨酸时,首先生成2,4-二羟基丁酸和琥珀酸作为主要产物。然后,使2,4-二羟基丁酸进行环化脱水并转化为羟基-γ-丁内酯,随后通过琥珀酸的酯化反应将琥珀酸二甲酯回收作为主要产物。然后,可以经蒸馏通过除去具有相对低沸点的溶剂和副产物而回收羟基-γ-丁内酯。
在又一个示例性实施方式中,当步骤1中的反应物是乙酰基-高丝氨酸时,可以按如下将每个产物分离并回收。
当步骤1中的反应物是乙酰基-高丝氨酸时,首先生成2,4-二羟基丁酸和乙酸或乙酸酐作为主要产物,并且可以得到羟基-γ-丁内酯、乙酰氧基-γ-丁内酯或其混合物作为最终产物。根据目标产物是羟基-γ-丁内酯还是乙酰氧基-γ-丁内酯,可以仅单独进行纯化步骤,或者也可以进行乙酰化。当目标产物是羟基-γ-丁内酯时,其可以通过除去乙酸、乙酸酐、溶剂和低沸点杂质来回收。相反,当目标产物是乙酰氧基-γ-丁内酯时,使生成的2,4-二羟基丁酸进行环化脱水,并进一步用溶液中所含的乙酸和乙酸酐进行乙酰化,并除去低沸点杂质,从而将乙酰氧基-γ-丁内酯回收。
此外,本公开可进一步包括在氢化催化剂的存在下使在步骤2中回收的γ-丁内酯衍生物中的卤代-γ-丁内酯或羟基-γ-丁内酯与氢反应,从而将它们转化为γ-丁内酯、呋喃酮或其混合物(步骤3)。
步骤3是氢化反应,其中通过氢化催化剂分别从卤代-γ-丁内酯和羟基-γ-丁内酯中除去卤素和羟基部分,并由此可以制得γ-丁内酯或呋喃酮。也可以制得选自4-卤代-丁酸、3-卤代丙醇、丁酸、THF、2-HO-THF、1-PrOH、2-PrOH、1-BuOH和2-BuOH中的至少一种的其它副产物。
氢化催化剂可以用作脱氯催化剂或脱氢-脱水催化剂,其中氢化催化剂可以是选自M1/X1、M1M2/X1、M1/X1X2和M1M2/X1X2中的至少一种。具体而言,M1和M2彼此不相同并且是贵金属或过渡金属,并且X1和X2各自是活性炭或金属氧化物。具体地,贵金属可以是Pd、Pt、Rh、Ir、Re、Ru、Re、或Au,并且过渡金属可以是Fe、Pb、Sb、Ag、Al、Cu、Ni、Cr、In、W、P、Te或Zn。此外,X1和X2彼此不相同并且是活性炭或金属氧化物。金属氧化物可以是含有选自Al、Zr、Si和Ti的材料的混合金属氧化物,并且金属氧化物可以被化学改性,在此方面可以使用无机酸(PO4、SO4)。在其中氢化催化剂中的X1和X2被化学改性的金属氧化物的情况下,主要生成呋喃酮作为氢化产物。
步骤3可以在选自二烷、γ-丁内酯、卤代-γ-丁内酯、羟基-γ-丁内酯、二甘醇(diethylglycol)、二甲醚、二甲基亚砜和碳酸丙烯酯中的至少一种溶剂的存在下进行。步骤3是氢化反应,其可以在本领域的常规反应条件下进行,具体地,在100℃至400℃和1atm至30atm的范围内。
此外,本公开可以进一步包括使在步骤2中回收的γ-丁内酯衍生物中的羟基-γ-丁内酯与乙酸、乙酸酐或乙酰氯反应,从而将其转化为乙酰氧基-γ-丁内酯(步骤4);和
加热乙酰氧基-γ-丁内酯,从而将其转化为γ-丁内酯、副产物或其混合物(步骤5)。
步骤4是将羟基-γ-丁内酯的羟基替换为乙酰氧基的反应,并通过与乙酸、乙酸酐或乙酰氯反应可以将羟基-γ-丁内酯转化为乙酰氧基-γ-丁内酯。该反应可以在加热回流下进行,并且该反应可以在80℃至150℃的温度下、5托或更少的压力下进行。此外,可以使用额外的催化剂来降低反应温度(如树脂;Amberyst-35dry)。
步骤5为去乙酰氧基化反应,其中通过热处理可以将在步骤4中制备的乙酰氧基-γ-丁内酯转化为γ-丁内酯、呋喃酮、副产物或其混合物。通过热处理可以除去乙酰氧基-γ-丁内酯中的乙酰氧基,并且反应温度可以在400℃至600℃的范围内。此外,热处理可以进一步生成呋喃酮,并且可以进一步进行以产生副产物。副产物为丙烯醛、乙酸丁酯、卤代-γ-丁内酯或其混合物。此外,乙酰氧基的除去会引起乙酸的产生,并且可以将乙酸回收再循环至步骤4中。此外,卤代-γ-丁内酯相当于γ-丁内酯衍生物,因而可以将其分离并回收以用于再循环。
此外,本公开可以进一步包括在金属催化剂的存在下使在步骤2、步骤3或步骤5中制备的γ-丁内酯或呋喃酮与氢反应,从而将其转化为1,4-丁二醇(步骤6)。
步骤6是开环反应,其中γ-丁内酯或呋喃酮可以通过其环的打开转化为1,4-丁二醇。该反应可以在金属催化剂的存在下通过与氢反应而进行,并且金属催化剂是选自M1/X和M1M2/X中的至少一种,其中M1和M2彼此不相同并且是贵金属或过渡金属,并且X是活性炭或金属氧化物。具体地,贵金属是Pd、Pt、Rh、Ir、Re、Ru、Re、或Au,此外,过渡金属具体是Fe、Pb、Sb、Ag、Al、Cu、Ni、Cr或Zn。此外,金属氧化物具体是Al2O3、ZrO2、SiO2或TiO2。
反应可以在150℃至200℃的温度下进行。此外,反应可以在20atm至60atm的压力下进行。
此外,本公开可以进一步包括在金属催化剂的存在下使在步骤2中制备的琥珀酸二烷基酯与氢反应,从而将其转化为1,4-丁二醇(步骤7)。
反应可以在金属催化剂的存在下通过与氢反应而进行。金属催化剂是选自M1/X和M1M2/X中的至少一种,其中M1和M2彼此不相同并且为贵金属或过渡金属,并且X是活性炭或金属氧化物。具体地,贵金属为Pd、Pt、Rh、Ir、Re、Ru、Re、或Au,此外,过渡金属具体为Fe、Pb、Sb、Ag、Al、Cu、Ni、Cr或Zn。此外,金属氧化物具体为Al2O3、ZrO2、SiO2或TiO2。
反应可以在150℃至200℃的温度下进行。此外,反应可以在20atm至60atm的压力下进行。
在图1中图解性地示出了根据本公开所述的整个制备方法。如图1所示,通过步骤1和步骤2可以从基于高丝氨酸的化合物中回收γ-丁内酯、γ-丁内酯衍生物、呋喃酮和琥珀酸二烷基酯。从每个产物中,通过步骤3至7可以制得γ-丁内酯,并且最终可以制得1,4-丁二醇。
此外,根据所要制备的产物,可以从整个制备过程中省略一些步骤,并且当产物的量很少时,也可以省略步骤。
公开的有利效果
根据本公开所述的用于处理基于高丝氨酸的化合物的方法可以以良好有效的简单方式由基于高丝氨酸的化合物制备有用化合物,所述有用化合物可以在工业中用作制备重要化合物的中间体,并因此可以提高基于高丝氨酸的化合物的利用价值。
附图简述
图1显示了图解本公开的整个过程的流程图。
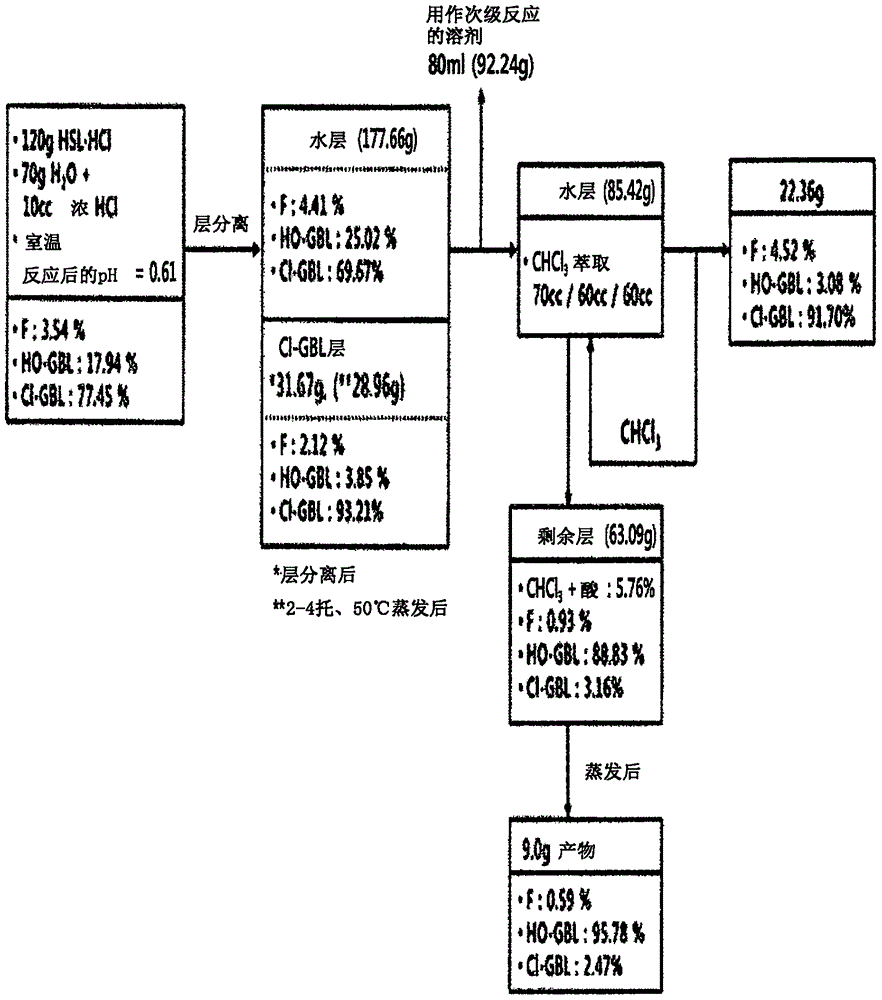
图2至4显示了图解根据本公开的示例性实施方式高丝氨酸内酯盐酸(HCl)盐的脱氨反应的过程和结果的流程图,其中图2涉及初级反应,图3涉及次级反应,图4涉及三级反应。
图5显示了图解根据本公开的示例性实施方式高丝氨酸内酯盐酸(HCl)盐的脱氨反应的结果的图表。
图6显示了图解根据本公开的示例性实施方式高丝氨酸内酯盐酸(HCl)盐的脱氨反应的结果的图表。
图7显示了图解根据本公开的示例性实施方式高丝氨酸内酯盐酸(HCl)盐的脱氨反应的结果的图表,其中根据每种催化剂的反应结果显示在图表中。
图8显示了图解根据本公开的示例性实施方式高丝氨酸内酯盐酸(HCl)盐的脱氨反应的结果的图表。
图9显示了图解根据本公开的示例性实施方式高丝氨酸内酯盐酸(HCl)盐的脱氨反应的结果的图表。
图10显示了图解根据本公开的示例性实施方式高丝氨酸内酯盐酸(HCl)盐的脱氨反应的结果的图表。
图11显示了图解根据本公开的示例性实施方式在由琥珀酸二甲酯制备1,4-BDO的结果中根据H2/DMS的摩尔比的反应性差异的图表。
图12显示了图解根据本公开的示例性实施方式在由琥珀酸二甲酯制备1,4-BDO的结果中根据反应温度的反应性差异的图表。
图13显示了图解根据本公开的示例性实施方式由γ-丁内酯和呋喃酮制备1,4-BDO的结果的图表。
图14显示了图解根据本公开的示例性实施方式由O-琥珀酰基高丝氨酸制备羟基-γ-丁内酯和琥珀酸二甲酯的过程和结果的图表。
图15显示了图解根据本公开的示例性实施方式由高丝氨酸制备甲氧基-γ-丁内酯的结果的图表。
图16显示了图解根据本公开的示例性实施方式由高丝氨酸制备羟基-γ-丁内酯的结果的图表。
最佳方式
在下文中,将参照以下实施例和实验性实施例对本公开进行更加详细地描述。然而,以下实施例和实验性实施例仅仅是为说明性目的而提供,并且本公开的范围不应以任何方式限制于此。
实验方法
在下面所示的实施例中,通过气相色谱法(GC)确认每个产物。气相色谱分析的条件如下。
-使用的柱:DB-200(Agilent,P.N 123-2033,30m×0.32mm,0.5μm)
DB-WAX(Agilent,PN 123-7032,30m,0.32mm,0.25μm)
-GC分析条件(DB-200):100(5’)/7℃·min-1/250(10’)
-GC分析条件(DB-WAX):80(5)/7℃·min-1/220(10’)
此外,在下表中,按产物相对于反应物的产率计算转化率,选择性是指根据GC分析按照每个产物相对于总产物的峰面积的百分比。此外,每种催化剂以M1(n1)/X或M1(n1)M2(n2)/X表示,其中M1和M2各自表示催化剂成分,n1和n2表示每种催化剂成分的重量%,X表示催化剂载体。
实施例1:使用水作为溶剂的高丝氨酸内酯盐酸盐的脱氨
1)实施例1-1(初级反应)
如图2所示,使用水作为溶剂进行高丝氨酸内酯盐酸盐的脱氨(初级反应)。
具体地,将120g高丝氨酸内酯盐酸盐(HSL·HCl)、70g水和10mL浓HCl添加至反应器中,并在25℃、大气压(1atm)下注入NO/空气(O2)气体的同时进行反应。通过GC分析确认未反应的HSL·HCl存在后,将产物添加至分液漏斗中并放置直至观察到层分离。
从分层溶液中回收31.67g下层,并在50℃、减压(2托至4托)下使被回收的下层中的溶剂蒸发,回收28.96g产物。对产物的分析显示,该产物含有93.21%的氯代-γ-丁内酯(Cl-GBL)、3.85%的羟基-γ-丁内酯(HO-GBL)和2.12%的呋喃酮。
下层分离后,使用来自上层(177.66g)的80mL(92.24g)作为次级反应的溶剂。将剩余物(85.42g)用氯仿(70mL/60mL/60mL)萃取三次,并使合并的萃取液在减压下蒸发,回收22.36g产物。对产物成分的分析显示,该产物含有91.70%的Cl-GBL、3.08%的HO-GBL和4.52%的呋喃酮。
氯仿萃取后,在减压下蒸发剩余物(63.09g),回收9.0g产物。对产物的分析显示,该产物含有2.47%的Cl-GBL、95.78%的HO-GBL和0.59%的呋喃酮。
2)实施例1-2(次级反应)
如图3所示,使用水作为溶剂进行HSL·HCl的脱氨(次级反应)。
将初级反应中回收的上层的一部分(80mL;92.24g)和120g HSL·HCl添加至反应器中,在25℃、大气压(1atm)下注入NO/空气(O2)气体的同时进行反应。在通过GC分析确认未反应的HSL·HCl存在后,将产物添加至分液漏斗中并放置直至观察到层分离。
从分层溶液中回收64.04g下层,并在50℃、减压(2托至4托)下使回收的下层中的溶剂蒸发,回收58.28g产物。对产物的分析显示,该产物含有91.34%的Cl-GBL、5.04%的HO-GBL和2.62%的呋喃酮。
下层分离后,使用来自上层(154.05g)的80mL(94.25g)作为三级反应的溶剂。将剩余物(59.8g)用氯仿(60mL/60mL/60mL)萃取三次,并将合并的萃取液在减压下蒸发,回收18.57g产物。对产物成分的分析显示,该产物含有87.36%的Cl-GBL、4.11%的HO-GBL和7.37%的呋喃酮。
氯仿萃取后,将剩余物在减压下蒸发,回收7.8g产物。对产物的分析显示,该产物含有2.28%的Cl-GBL、91.44%的HO-GBL和0.92%的呋喃酮。
3)实施例1-3(三级反应)
如图4所示,使用水作为溶剂进行HSL·HCl的脱氨(三级反应)。
将从次级反应中回收的上层的一部分(80mL;94.25g)和120g HSL·HCl添加至反应器中,并在25℃、大气压(1atm)下注入NO/空气(O2)气体的同时进行反应。通过GC分析确认未反应的HSL·HCl存在后,将产物添加至分液漏斗中并放置直至观察到层分离。
从分层溶液中回收63.46g下层,并在50℃、减压(2托至4托)下使回收的下层中的溶剂蒸发,回收58.66g产物。对产物的分析显示,该产物含有91.80%的Cl-GBL、4.84%的HO-GBL和2.36%的呋喃酮。
分离下层后,独立地分离出来自上层(154.05g)的80mL(96.28g)。将剩余物(59.8g)用氯仿(60mL/60mL/60mL)萃取三次,并将合并的萃取液在减压下蒸发,回收21.17g产物。对产物成分的分析显示,该产物含有83.97%的Cl-GBL、5.12%的HO-GBL和9.63%的呋喃酮。
氯仿萃取后,将剩余物在减压下蒸发,回收8.42g产物。对产物的分析显示,该产物含有2.38%的Cl-GBL、92.45%的HO-GBL和1.05%的呋喃酮。
实施例2:使用氯仿作为溶剂使HSL·HCl脱氨
利用高压反应系统进行HSL·HCl的脱氨。具体地,将2g HSL·HCl、45g氯仿和1g浓HCl添加至容器中,并在25℃、高压(约14atm)下注入NO/空气(O2)气体的同时进行反应。反应2小时后,回收产物并对产物成分进行分析。分析表明,该产物含有92.7%的Cl-GBL、3.3%的HO-GBL、3.8%的呋喃酮和0.2%的其它组分。
实施例3:使用氯代-γ-丁内酯作为溶剂的高丝氨酸内酯HSL·HCl的脱氨反应
将Cl-GBL(30mL)作为溶剂添加至反应器中,然后向其中依次添加HSL·HCl(10g、20g、30g、40g、50g、50g、50g、50g和50g),并在25℃、大气压(1atm)下注入NO/空气(O2)气体的同时进行反应。通过GC分析确认未反应的HSL·HCl存在后,将产物添加至分液漏斗中并放置直至观察到层分离。
将分层产物以约1∶4的体积比分成上层和下层。从分层溶液中回收下层并对其成分进行分析。分析表明,下层含有88.10%的Cl-GBL、6.17%的HO-GBL和3.93%的呋喃酮。回收上层并分析组分。分析显示,上层含有71.11%的Cl-GBL、20.07%的HO-GBL和6.02%的呋喃酮。
实施例4:使用催化剂的高丝氨酸内酯HSL·HCl的脱氨反应
1)实施例4-1
使用2g的Pt(5)/Ac和Pt(5)Au(5)/Ac中的每一个作为催化剂,通过在下述供应条件下向反应器添加NO/N2和10wt%HSL·HCl的水溶液进行HSL·HCl的脱氨。
-进料:20mL/min(NO/N2=1/1,vol%)、0.03mL/min(10wt%HSL·HCl的水溶液)
反应条件为60℃和20atm,根据反应时间回收部分产物并对其成分进行分析。结果显示在下表1中。
[表1]
此外,上述结果显示在图5的图表中。
2)实施例4-2
使用2.3g Fe2O3作为催化剂,通过在下述供应条件下向反应器添加NO/N2和10wt%HSL·HCl的水溶液进行HSL·HCl的脱氨。
-进料:20mL/min(NO/N2=1/1vol%+空气(O2)),0.03mL/min(10wt%HSL·HCl的水溶液)
在20atm下在下表2所示的反应温度下进行反应,并且根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表2中。
[表2]
3)实施例4-3
使用2g Pt(5)/Ac作为催化剂,通过在下述供应条件下向反应器添加NO/N2和10wt%HSL·HBr的水溶液进行HSL·HCl的脱氨。
-进料:20mL/min(NO/N2=1/1,vol%)、0.03mL/min(10wt%HSL·HBr的水溶液)
反应条件为60℃和20atm,根据反应时间回收部分产物并对其成分进行分析。结果显示在下表3中。
[表3]
4)实施例4-4
向分批反应器中添加各为2g的HSL·HCl、高丝氨酸(HS)和高丝氨酸内酯游离盐(HSL)作为反应物。将40g水和0.1g Pt(5)/Ac添加至反应器中,并在下表4所述的条件下进行基于高丝氨酸的化合物的脱氨。根据反应时间回收部分产物并对其成分进行分析。结果显示在下表4中。
[表4]
5)实施例4-5
在1atm下在将以下i)至iii)的物质添加至反应器后进行HSL·HCl的脱氨:
i)2g HSL·HCl、0.1g Pt(5)/Ac、40g水和15atm NO/N2(1/1;v/v);
ii)2g HSL·HCl、0.1g Pt(5)/Ac、40g水、13.5atm N2O/N2(1/1;v/v)和1atm O2;或
iii)0.5g HSL·HCl、6.5g水、HSL·HCl/HNO3=1/1.5m/m。
根据反应时间回收部分产物并对其成分进行分析。结果显示在下表6中。
6)实施例4-6
向分批反应器中添加0.5g HSL·HCl和6.5g水作为反应物。根据下表5中所述的比例将Fe(NO3)3添加至反应器作为催化剂,并进行HSL·HCl的脱氨。反应条件为25℃和1atm。回收部分产物并对其成分进行分析。结果显示在下表5中。
[表5]
7)实施例4-7
向反应器中添加0.5g HSL·HCl和6.5g水作为反应物。以Fe(NO3)3/HSL·HCl为0.5的摩尔比向反应器中添加Fe(NO3)3作为催化剂,并进行HSL·HCl的脱氨。所用的反应温度显示在表6中,反应压力为1大气压。回收部分产物并对其成分进行分析。结果显示在下表6中。
[表6]
8)实施例4-8
以与实施例4-6相同的方式进行脱氨,除了使用的催化剂为表7中所示的那些。回收部分产物并对其成分进行分析。结果显示在下表7中。
[表7]
此外,上述结果显示在图7中。
实施例5:使用甲醇作为溶剂的HSL·HCl的脱氨
1)实施例5-1
向反应器中添加1g HSL·HCl、40g甲醇和0.05g Pt(5)/Ac,然后添加NO/N2(15atm、1∶1(v/v))。如表8所示,进一步向反应器中添加H2(6.5atm),并进行HSL·HCl的脱氨。回收部分产物并对其成分进行分析。结果显示在下表8中。
[表8]
此外,上述结果显示在图8中。
2)实施例5-2
向反应器中添加如表9所述的HSL·HCl、甲醇和/或水。向反应器中添加Pt(5)/Ac,随后添加NO/N2(15atm、1∶1(v/v))。在表9所示的反应时间和反应温度下进行HSL·HCl的脱氨。回收部分产物并对其成分进行分析。结果显示在下表9中。
[表9]
此外,上述结果显示在图9中。
3)实施例5-3
向反应器中添加1g HSL·HCl、20g甲醇、20g氯仿和0.1g Pt(5)/Ac。向反应器中添加NO/N2(15atm、1∶1(v/v)),并在表10所述的反应时间和反应温度下进行HSL·HCl的脱氨。回收部分产物并对其成分进行分析。结果显示在下表10中。
[表10]
此外,上述结果显示在图10中。
实施例6:氯代-γ-丁内酯的脱氯
1)实施例6-1:使用多种催化剂和溶剂的反应
向反应器中添加3g Cl-GBL、表11的溶剂(30g)和催化剂后进行反应,估算Cl-GBL的脱氯度。在大气压(1atm)下进行反应。回收部分产物并对其成分进行分析。结果显示在下表11中。
[表11]
2)实施例6-2:使用Pd/Ac作为催化剂的反应
在下述供应条件下将Cl-GBL和H2供给到反应器中,并使用Pd(5)/Ac作为催化剂。
-进料:H2/Cl-GBL=43/1m/m,WHSV=1.0h-1
反应条件为200℃和大气压(1atm),根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表12中。
[表12]
3)实施例6-3:使用Pd/Ac作为催化剂和1,4-二烷作为溶剂的反应
在下述供应条件下将H2、Cl-GBL和1,4-二烷供给到反应器中,并使用Pd(5)/Ac作为催化剂。
-进料:25/75vol%Cl-GBL/1,4-二烷,WHSV=1.5h-1
反应条件为大气压(1atm),回收部分所产生的产物,并对其成分进行分析。结果显示在下表13中。
[表13]
4)实施例6-4:使用AuPd/Ac作为催化剂和1,4-二烷作为溶剂的反应
在下述供应条件下将Cl-GBL和1,4-二烷供给到反应器中,并使用Au(5)Pd(5)/Ac作为催化剂。
-进料:50/50vol%Cl-GBL/1,4-二烷,WHSV=1.0h-1
反应条件为大气压(1atm),根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表14中。
[表14]
5)实施例6-5:使用AuPd/Ac作为催化剂而没有溶剂的反应
在下述供应条件下将Cl-GBL和H2供给到反应器中,并使用Au(5)Pd(5)/Ac作为催化剂。
-进料:H2/Cl-GBL=38.5/1m/m,WHSV=1.0h-1
反应条件为大气压(1atm),根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表15中。
[表15]
6)实施例6-6:使用改性的Pd/SiO2作为催化剂和二烷作为溶剂的反应
在下述供应条件下将Cl-GBL和二烷供给到反应器中,并使用改性的Pd(5)/SiO2作为催化剂。
-催化剂成分:Pd(5)/PO4(15)/SiO2(Aerosil-380)
-供应条件:50/50vol%Cl-GBL/二烷,WHSV=0.5h-1
反应条件与下表16中所述的相同,根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表16中。
[表16]
7)实施例6-7:使用改性的PdRe/SiO2作为催化剂和二烷作为溶剂的反应
在下述供应条件下将Cl-GBL和二烷供给到反应器中,并使用改性的Pd(5)Re(5)/SiO2作为催化剂。
-催化剂成分:Pd(5)Re(5)/PO4(15)/SiO2(Aerosil-380)
-供应条件:50/50vol%Cl-GBL/二烷,WHSV=1.0h-1
反应条件与下表17中所述相同,根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表17中。
[表17]
8)实施例6-8:使用改性的Rh/SiO2作为催化剂和二烷作为溶剂的反应
在下述供应条件下将Cl-GBL和二烷供给到反应器中,并使用改性的Rh(5)/SiO2作为催化剂。
-催化剂成分:Rh(5)/PO4(15)/SiO2(Aerosil-380)
-供应条件:50/50vol%Cl-GBL/二烷,WHSV=1.0h-1
反应条件与下表18中所述相同,根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表18中。
[表18]
9)实施例6-9:使用改性的Rh(5)/Ac作为催化剂和二烷作为溶剂的反应
在下述供应条件下将Cl-GBL和二烷供给到反应器中,并使用改性的Rh(5)/SiO2作为催化剂。
-供应条件:50/50vol%Cl-GBL/二烷,WHSV=1.0h-1
反应条件与下表19中所述相同,根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表19中。
[表19]
10)实施例6-10:使用Pd(4.5)Pt(0.5)/Ac作为催化剂的反应
在下表20所述的供应条件下将Cl-GBL供给到反应器中,并使用Pd(4.5)Pt(0.5)/Ac作为催化剂。
反应条件与下表20中所述相同,根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表20中。
[表20]
11)实施例6-11:使用PdM/Ac作为催化剂的反应
使用下表21中所述的催化剂和供应条件将Cl-GBL供应到反应器中。反应条件与下表21中所述相同,并且根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表21中。
[表21]
12)实施例6-12:使用PdM/载体作为催化剂的反应
使用下表22中所述的催化剂和供应条件将Cl-GBL供应至反应器。反应条件与下表22中所述相同,并且根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表22中。
[表22]
实施例7:羟基-γ-丁内酯的氢化脱水
1)实施例7-1:使用各种催化剂的反应
按如下进行HO-GBL的氢化脱水。具体地,在下述供应条件下向反应器供应HO-GBL和1,4-二烷,并使用Pd(5)/Ac、Re(5)/Ac、Pd(5)Te(3.3)/Ac、Pd(5)Re(5)/Ac、Pt(5)Re(5)/Ac和Rh(5)Re(5)/Ac作为催化剂。
-进料:25/75v/v HO-GBL/二烷,H2/HO-GBL=110/1m/m,WHSV=0.15h-1
反应条件为250℃和5atm,根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表23中。
[表23]
2)实施例7-2:使用RhRe/Ac作为催化剂的反应
以与实施例7-1相同的方式进行反应,除了使用Rh(2.5)Re(5)/Ac作为催化剂。
结果显示在表24中。
[表24]
3)实施例7-3:使用RhRe/SiO2作为催化剂的反应
以与实施例7-1相同的方式进行反应,除了使用Rh(5)Re(5)/SiO2作为催化剂。结果显示在表25中。
[表25]
4)实施例7-4:随反应压力变化的反应
以与实施例7-1相同的方式进行反应,除了使用Rh(5)Re(5)/Ac作为催化剂且按表26所示改变反应温度和反应压力,和反应进行90小时。结果显示在表26中。
[表26]
5)实施例7-5:使用RhRe/SiO2作为催化剂的反应
在下述供应条件下将HO-GBL和1,4-二烷供给到反应器中,并使用2gRh(5)Re(5)/SiO2(HI-SIL233)作为催化剂。
-进料:50/50vol%HO-GBL/1,4-二烷,H2/HO-GBL=50/1,WHSV:0.3h-1
反应条件为250℃和5atm,根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表27中。
[表27]
实施例8:羟基-γ-丁内酯的乙酰化和去乙酰化
按如下进行HO-GBL的乙酰化和去乙酰化。
1)实施例8-1
在室温大气压下,将10g乙酰氯添加至5g HO-GBL中,同时进行搅拌。具体地,通过乙酰化产生烟气形式的HCl气体并产生热。在室温下搅拌30分钟后,停止反应,并对反应产物进行分析。分析表明,羟基-γ-丁内酯的转化率为99.97%,并且其中生成的乙酰氧基-γ-丁内酯的产率为93.24%。
2)实施例8-2
将含有HO-GBL(92.22重量%)、Cl-GBL(2.67重量%)和呋喃酮(1.83重量%)的含HO-GBL的样品(108g)添加至反应器中,然后添加乙酸酐(117g),并在135℃下加热回流。反应完成后,将生成物在减压(80℃、约3托)下进行蒸馏,得到143g产物,并对产物成分进行分析。分析表明,该产物含有乙酰氧基-γ-丁内酯(乙酰氧基-GBL;87.83wt%)、Cl-GBL(1.68wt%)和呋喃酮(0.95wt%)。
将上述产物再次在减压(135℃至145℃、约5托)下进行蒸馏,得到含有乙酰氧基-GBL(92.35wt%)、Cl-GBL(4.31wt%)和呋喃酮(1.19重量%)的产物。
将上述产物在表28所示的反应条件下进行去乙酰化,结果显示在表28中。
[表28]
实施例9:羟基-γ-丁内酯的脱水反应
使用催化剂(所使用的催化剂的量:2g)和表29中所示的条件(进料速度:0.02mL/min、反应压力:大气压)进行由HO-GBL转化为GBL时的氢化脱水。
[表29]
实施例10:γ-丁内酯的氢化
1)实施例10-1
通过氢化由GBL制备1,4-丁二醇(1,4-BDO)。具体地,在下表30所示的条件下将H2和GBL供给至反应器,并使用按照韩国专利号10-0538979的实施例1中所述制得的CuO(72.2)MnO2(2.5)ZnO(0.3)SiO2(25)(括号内的值表示wt%)作为催化剂。对产物成分进行分析,结果显示在下表30中。
[表30]
2)实施例10-2
通过氢化由GBL制备1,4-BDO。具体地,在以下条件下将H2和GBL供给至反应器,并使用按照韩国专利号10-0538979的实施例1中所述制得的CuO(72.2)MnO2(2.5)ZnO(0.3)SiO2(25)(括号内的值表示wt%)作为催化剂。
-反应条件:170℃、40atm
-供应条件:H2/GBL=32/1m/m、WHSV=0.6h-1
根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表31中。
[表31]
实施例11:由琥珀酸二烷基酯制备1,4-BDO
通过氢化由琥珀酸二甲酯(DMS)制备1,4-BDO。具体地,使用按照韩国专利号10-0538979的实施例1中所述制得的甲醇/DMS(50/50体积%)和CuO(72.2)MnO2(2.5)ZnO(0.3)SiO2(25)(括号内的值表示wt%)作为催化剂,并在下表32所示的条件下进行反应。回收部分产物,并对其成分进行分析。结果显示在下表32中。
[表32]
在表32的结果中,根据H2/DMS的摩尔比的反应性差异显示在图11的图表中,并且根据反应温度所述的反应性差异显示在图12的图表中。
实施例12:由γ-丁内酯和呋喃酮制备1,4-BDO
通过氢化由GBL和呋喃酮制备1,4-BDO。具体地,反应成分与下表33中相同,并且在以下条件下将成分供应到反应器中。所使用的催化剂与实施例11相同。
-进料:H2/反应物=32.6m/m,WHSV=0.6h-1
反应条件为180℃和40atm,根据反应时间回收部分产物,并对其成分进行分析。结果显示在下表33中。
[表33]
此外,上述结果显示在图13的图表中。
实施例13:由O-琥珀酰基高丝氨酸制备羟基-γ-丁内酯和琥珀酸二烷基酯
1)实施例13-1
按图14所示进行O-琥珀酰基高丝氨酸(O-SH)的直接脱氨和水解,具体地,按如下进行。
首先,使用水作为溶剂。但是,由于O-SH的水溶解度为8.7g/L,因此在反应初始阶段过量的O-SH注入会产生作为反应物所供应的NO中包含的惰性气体(N2、Ar等)或由脱氨生成的氮气的气泡。因此,少量的O-SH经多次注入。注入的O-SH的总量为250g,并将其注入成O-SH的最终浓度为50wt%。
反应完成后,对水溶液中的产物进行分析,结果显示在下表34中。
[表34]
如表34所示,证实了通过O-SH的水解生成琥珀酸,并且同时,通过DL-HS的脱氨生成2,4-二羟基丁酸。此外,由于由最终产物生成的沉淀物是水溶解度为58g/L(20℃)的琥珀酸,因此证实了通过反应生成的部分琥珀酸在水溶液中仍是不溶解的。
在初级过滤过程中,以约64%的产率回收纯度为88.5%的琥珀酸,进一步用水冲洗,从而回收纯度为99.5%的琥珀酸。通过初级过滤方法从其中除去琥珀酸的残余溶液含有2,4-二羟基丁酸,其含有16.6%的琥珀酸。
2)实施例13-2
以与实施例13-1相同的方式进行反应,除了在O-SH(30g)的直接脱氨-水解之后不对产物进行分离。
通过减压蒸馏从产物中除去水和酸后,向其中添加甲醇(60g)和浓H2SO4(2g),并在通过回流2小时使2,4-二羟基丁酸环化脱水的同时将琥珀酸酯化,从而制得羟基-γ-丁内酯以及琥珀酸二甲酯和琥珀酸单甲酯的混合物。对最终产物进行GC分析,结果显示在下表35中。
[表35]
实施例14:由高丝氨酸制备羟基-γ-丁内酯
将DL-高丝氨酸(250g)和水(250g)添加至反应器中,并在25℃、常压(1atm)下在向其中注入NO/O2气体的同时进行反应。反应完成后,对产物的成分分析结果显示在下表36中。
[表36]
在上述产物中,以与实施例13-2相同的方式,从通过2,4-二羟基丁酸的环化脱水和琥珀酸的酯化得到的最终分离产物中分别回收HO-GBL(22.6%)和DMS(63%)。
实施例15:由高丝氨酸制备甲氧基-γ-丁内酯
将DL-高丝氨酸(1g)、甲醇(40g)和Pt(5)/Ac(0.05g)添加至反应器中,并在表37所示的条件下进行反应。对产物的成分分析结果显示在下表37中。
[表37]
此外,上述结果显示在图15中。
实施例16:由高丝氨酸制备羟基-γ-丁内酯
将DL-高丝氨酸(1g)、水(40g)和Pt(5)/Ac(0.1g)添加至反应器中,在反应器中注入NO/N2气体以使内部压力为15atm,并在表38所示的条件下进行反应。对产物的成分分析结果显示在下表38中。
[表38]
此外,上述结果显示在图16中。如表38和图16中所示,证实了HO-GBL可以通过同时进行脱氨和环化而制备。
- 还没有人留言评论。精彩留言会获得点赞!
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 斯氏副柔线虫丝氨酸/苏氨酸蛋白激酶Pj_STPK基因克隆、原核表达方法及应用与制造工艺
- 大豆类枯草杆菌蛋白酶基因及应用的制造方法与工艺
- 作为BET蛋白抑制剂的1H‑吡咯并[2,3‑c]吡啶‑7(6H)‑酮和吡唑并[3,4‑c]吡啶‑7(6H)‑酮的制造方法与工艺
- 因子XIa抑制剂的制造方法与工艺
- 蛋白酶体抑制剂在制备降低动物脂含量或脂储积能力产品中的应用的制造方法与工艺
- 菁染料在检测凝血酶中的用途、凝血酶检测试剂盒及方法与制造工艺
- 吡喃衍生物的盐或其盐的水合物及其制备与应用的制造方法与工艺
- 氮杂环类化合物及其应用的制造方法与工艺
- 一种高纯度苯甲酸阿格列汀的制备后处理方法与制造工艺