检测不存在微生物的方法和试剂盒与流程
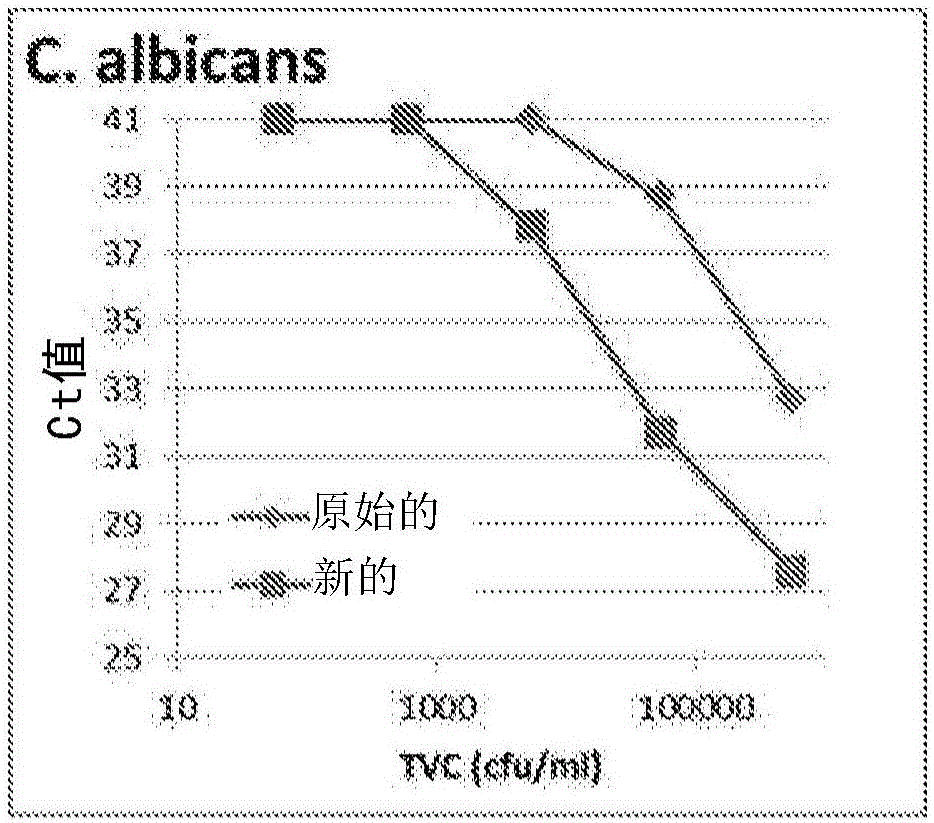
本发明总体上涉及检测在样品中不存在或存在微生物的领域。方法典型地依赖于测量存在于样品中的微生物酶活性(如果有的话),并且可以涉及能够使用核酸扩增技术(如聚合酶链式反应)进行的此类方法。本发明的方法因此使得能够确定在样品(如未经纯化的血液、血液培养物和其他体液)中不存在和存在微生物病原体。本发明还涉及用于在此类方法中使用的试剂,并且涉及包含可用于进行这些方法的此类试剂的测试试剂盒。发明背景测量与细胞活力相关的某些分子的存在和水平在许多背景下是重要的。例如,测量哺乳动物细胞中的ATP水平对于生长分析和毒物学目的而言是有用的。培养方法可以用于检测少量的细菌,但是此类技术需要几天完成,尤其是当试图检测少量的细菌时并且还有当检测生长较慢的微生物时。检测作为活力指示剂的腺苷酸激酶也已经被提出(SquirrellDJ,MurphyMJ,LeslieRL,GreenJCD:AcomparisonofATPandadenylatekinaseasbacterialcellmarkers:correlationwithagarplatecounts。WO96/002665描述了用于确定存在于样品中的微生物和/或其细胞内材料的存在和/或量的方法,其特征在于通过以下来估计样品中的腺苷酸激酶的量:将它与腺苷二磷酸(ADP)混合,确定从该ADP由样品产生的腺苷三磷酸(ATP)的量,并且将如此产生的ATP的量与腺苷酸激酶的存在/或量以及微生物和/或其细胞内材料相关联,其中ADP向ATP的转化在足以允许ADP向ATP最大转化的摩尔浓度的镁离子的存在下进行。在WO2009/007719中,连接酶(特别是NAD依赖性连接酶)被披露为样品中存在(有活力的)微生物的有用指示剂。连接酶是催化核酸分子连接的酶。根据涉及的连接酶,连接反应需要ATP或NAD+作为辅助因子。在本公开内容中,NAD依赖性连接酶活性的使用被用作样品中存在(有活力的)微生物的指示剂。WO2011/130584描述了用于基于DNA或RNA聚合酶的检测来检测有活力的微生物的方法,在该方法中使样品与充当微生物聚合酶底物的核酸底物接触,在适于聚合酶活性的条件下从完整微生物进行孵育,并且使用核酸扩增技术(如定量聚合酶链式反应)来确定任何所得核酸产物。此类测定已被称为“ETGA测定”,其中ETGA代表酶模板生成和扩增(EnzymaticTemplateGenerationandAmplification)。ETGA测定针对粗样品中的有活力的微生物的一个问题是在微生物外存在由宿主(例如人类)细胞和死的微生物导致的污染聚合酶活性。ETGA测定无法将微生物聚合酶活性与宿主或死的微生物的聚合酶活性区别开来。申请人的共同未决申请WO2010/119270描述了用于去除完整微生物外的酶活性(在这种情况下是DNA连接酶)的方法,并且此方法也可以用于去除污染核酸聚合酶活性。发明描述然而,在WO2010/119270中使用的用于去除污染活性的条件包括在高pH(pH11左右)下孵育20min。尽管有用,但是发明人已经发现这些条件对特定细菌菌株(如H.influenzae的某些临床菌株)是有害的。已进一步发现,用高pH处理不会在所有情况下去除样品(如血液培养物)中的所有外微生物核酸酶活性,并且这种核酸酶活性通过降解在测试中使用的核酸底物可以对测定具有有害影响。核酸扩增测定可以包括内部对照探针以监测扩增反应的正确运行(参见例如WO2013/103744,在其中这被应用于类似于WO2011/130584的DNA聚合酶测定)。然而,这种内部对照被添加为核酸扩增试剂混合物的一部分并且不会检测先前的核酸酶活性。在WO2011/130584中描述的方法的另外的问题是在检测酵母(如C.albicans和C.glabrata)方面相对缺乏敏感性。在快速测试中,本领域一直专注于检测微生物的存在而非确定其不存在。所谓“确定其不存在”,申请人并不意指样品一定是无菌的,而是可以具有足够低以至于对实际目的而言阴性的生物负载。例如,血液培养物通常取自疑似患有血流感染的患者,这些血流感染可以与败血症(一种如果不治疗的话可迅速致命的病症)相关。对于临床微生物实验室而言常规的是,将此类标本孵育至少五天后再报告阴性结果,在此期间这些患者通常服用广谱抗生素。典型地,多达90%的此类患者是阴性的,并且因此大量患者接受持续5天的对其病症而言没有必要的抗生素治疗。用于确定阴性结果的更快方法(相对于五天血液培养)在降低不必要的抗生素治疗的成本方面会具有重要价值,并且就降低C.difficile感染风险、抗生素毒性以及降低抗微生物抗性的增加率而言提供健康益处。发明人已经着眼于优化样品中不存在或存在微生物的确定而针对现有ETGA测定设计并测试了一系列改进。本发明的基础因此是检测样品中不存在或存在微生物的方法,其包括:(a)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(b)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(c)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物。本文呈现了这种基本测定形式的多种发展。因此,在第一方面中,本发明提供了检测样品中不存在或存在微生物的方法,该方法包括:(a)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(b)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(c)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其特征在于该核酸分子被修饰以保护它免受核酸酶活性。在本发明的背景下,核酸分子被预修饰以保护它免受核酸酶活性,即核酸分子被修饰以使它在步骤(a)与样品接触之前保护它免受核酸酶活性。发明人已经确定保护底物核酸分子免受核酸酶活性在本发明测定的背景下是有利的。更特别地,如本文所示的,向本发明的方法中掺入受保护的核酸分子改进检测的敏感性。任何适合的手段都可以用于保护核酸分子免受核酸酶活性。非限制性实例包括向核酸分子中掺入甲基化、末端修饰(如保护3’和/或5’端)以及掺入合成核苷酸。在一些具体实施方案中,合成核苷酸包括硫代磷酸酯核苷酸和/或锁核酸核苷酸。优选地,合成核苷酸是硫代磷酸酯核苷酸。在某些实施方案中,合成核苷酸替代核酸分子中的至少一个核苷酸,多至所有核苷酸。发明人已经进一步确定,与先前ETGA测定相比,增加反应中核酸分子的浓度可以导致改进的结果。因此,在一个另外的方面中,本发明提供了检测样品中不存在或存在微生物的方法,该方法包括:(a)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(b)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(c)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其特征在于将该核酸分子以至少2nM但小于50nM的浓度添加至该样品中。先前,在此类测定中,已经以1nM的浓度利用核酸底物。发明人已经确定,将此浓度增加到小于50nM(如2nM、5nM、7.5nM或10nM)导致改进的检测敏感性。在50nM下或高于50nM,改进的敏感性丧失,这是由于由测定造成的假阳性增加。如本文所述的浓度典型地是用于裂解微生物(如果存在于样品中的话)的裂解混合物中的浓度。因此,使样品与底物核酸分子接触的步骤(a)典型地涉及在裂解微生物(如果存在于样品中的话)的裂解混合物中添加底物。本文提供了裂解试剂/混合物的另外的细节。发明人还已经进一步确定,增加反应中游离核苷酸的浓度进一步用于改进测定敏感性。因此,在一些实施方案中,本发明的方法包括向样品中添加浓度多于50μM(如55至300μM、或60至250μM、或75至200μM,特别是至少100μM)的脱氧核糖核苷酸三磷酸(dNTP)。在一些实施方案中,可以在步骤(a)和/或步骤(b)中添加dNTP。如本文所述的浓度典型地是用于裂解微生物(如果存在于样品中的话)的裂解混合物中的浓度。因此,使样品与底物核酸分子接触的步骤(a)典型地涉及在裂解微生物(如果存在于样品中的话)的裂解混合物中添加底物,其中该裂解混合物含有dNTP。本文提供了裂解试剂/混合物的另外的细节。如上文所讨论的,发明人已经发现,虽然在WO2010/119270中采用的用于去除污染活性的高pH条件是有用的,但这些条件对特定细菌菌株(如H.influenzae的某些临床菌株)可以是有害的。因此,在一个另外的方面中,本发明提供了检测样品中不存在或存在微生物的方法,该样品含有核酸修饰活性的非微生物来源,该方法包括:(a)在高pH条件下将该样品处理不多于8分钟,以抑制核酸修饰活性的该非微生物来源(同时不影响该样品中微生物的核酸修饰活性),(b)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(c)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(d)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物。高pH条件的持续时间小于20分钟并且可以不多于10、9、8、7、6或5分钟并且可以在5、6、7、8、9或10分钟左右。在一些又另外的实施方案中,将处理进行介于2至15分钟左右,如5分钟左右。所谓“左右”意指加或减30秒。任何适合的试剂都可以添加至样品中以提供高pH条件。在一些特定实施方案中,高pH条件包括使样品与碱接触。在一些特定实施方案中,使用NaOH或Na2CO3。在一些具体实施方案中,NaOH或Na2CO3的浓度在5mM左右或更大。高pH条件典型地抑制核酸修饰酶(包括来自非微生物来源如哺乳动物细胞的ATP依赖性连接酶和聚合酶)的活性,但并不抑制微生物连接酶或聚合酶的活性。这可能是由于微生物酶对这些条件的耐受性更大和/或由于在方法中应用的裂解条件有差别,以保证只有非微生物酶暴露于高pH条件。高pH通常是至少10左右(如10、11、12、13或14左右)的pH。低pH通常是小于或等于4左右(如4、3、2、或1左右)的pH。所谓“左右”意指所述值任一侧的0.5的pH单位。改变样品的pH可以使用任何适合的手段来实现,如本领域技术人员应容易理解的。微生物酶(如聚合酶和连接酶)可以耐受极端pH,而哺乳动物连接酶在相同pH条件可被失活。这允许选择性地检测含有哺乳动物细胞和微生物细胞两者的样品中的微生物连接酶。在一些具体实施方案中,抑制来自哺乳动物细胞的非微生物核酸修饰活性(如ATP依赖性连接酶)的活性但不抑制核酸修饰活性的微生物来源(如微生物连接酶)的活性的条件包括用氢氧化钠(NaOH)或碳酸钠(Na2CO3)处理样品。如本文所示的,此类试剂可以容易地用于将样品的pH增至高pH,因此使哺乳动物连接酶活性失活同时保留微生物(真菌和细菌)连接酶具有活性。技术人员可以应用适当试剂的适合浓度和体积。然而,在某些实施方案中,NaOH是至少5mM左右的NaOH。在一些实施方案中,碱浓度不多于10mM,如5、6、7、8、9或10mM。在一些另外的实施方案中,pH在12左右以使哺乳动物核酸修饰活性(如聚合酶和/或ATP依赖性连接酶活性)失活,而不使微生物核酸修饰活性(如聚合酶和/或连接酶活性)失活。在一些具体实施方案中,pH条件可以增至至少11左右、或至少11.2。这种处理可以导致样品中的微生物裂解,并且因此使得核酸修饰活性(例如聚合酶和/或连接酶)释放到样品中。这允许检测样品中源自微生物的核酸修饰活性(例如聚合酶和/或连接酶),而无需单独的细胞裂解步骤。在这些条件下,哺乳动物连接酶(如血液ATP依赖性连接酶)被失活。然而,这些方法典型地包括用于裂解样品中的微生物的单独步骤,如在下文更加详细地讨论的。在一些实施方案中,通过添加试剂降低pH来使高pH条件下的处理停止。适合的试剂包括缓冲液和/或酸。在一些具体实施方案中,缓冲液包括Tris-HCl缓冲液(例如pH7.2或8)。另一些适合的用于降低pH的试剂包括酸,如盐酸(HCl)和硫酸(H2SO4)。可以将这些(以及其他)酸掺入缓冲液中,如本领域技术人员应容易理解的。可以将这些步骤并入上文指出的方法的步骤(a)中。在一些具体实施方案中,在介于15至30摄氏度左右(意指加或减0.5度)的温度下进行步骤(a)。在某些实施方案中,在室温下进行步骤(a)。可以在这些温度下进行本文描述的整个方法。在这些方法的更特别的叙述中,本发明进一步提供了检测样品中不存在或存在微生物的方法,该样品含有核酸修饰活性的非微生物来源,该方法包括:(i)用裂解该样品中的非微生物(如果存在的话)但不裂解该样品中的微生物的试剂孵育该样品(ii)任选地将该经裂解的细胞材料与该样品中的完整微生物(如果有的话)分离(iii)使该样品中的(分离的)完整微生物(如果有的话)与高pH试剂接触并孵育不多于5分钟,以抑制核酸修饰活性的非微生物来源(同时不影响该样品中微生物的核酸修饰活性)(iv)添加降pH试剂,以使高pH下的孵育停止(v)将该样品中的微生物(如果存在的话)与pH修饰试剂分离(vi)裂解任何分离的微生物(vi)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(vii)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(viii)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物。步骤(ii)是任选步骤,因为在一些实施方案中,无需将经裂解的细胞材料与完整微生物分离。这是因为在任何情况下步骤(iii)用于抑制在经裂解的细胞材料中存在的核酸修饰活性。所谓“经裂解的细胞材料”意指非微生物的裂解产物。这包括经裂解的细胞的细胞膜和细胞内内容物。更特别地,所述方法可以包括以下步骤:(i)用裂解该样品中的非微生物(如果存在的话)但不裂解该样品中的微生物的试剂孵育该样品(ii)将该样品离心,以形成含有该样品中的微生物(如果存在的话)的沉淀(iii)从该沉淀中去除上清液(iv)将该沉淀重悬于高pH试剂中并孵育不多于8分钟,以抑制核酸修饰活性的该非微生物来源(同时不影响该样品中微生物的核酸修饰活性)(v)添加降pH试剂,以使高pH下的孵育停止(vi)将该样品第二次离心,以形成含有该样品中的微生物(如果存在的话)的沉淀(vi)从该沉淀中去除上清液(vii)裂解该沉淀中的任何微生物(viii)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(ix)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(x)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物。在一些具体实施方案中,在15与30摄氏度之间的温度下分别进行步骤(iii)或(iv)、或进行整个方法。可替代地,可以在室温下分别进行步骤(iii)或(iv)、或进行整个方法。裂解非微生物(特别是哺乳动物细胞,如果存在于样品中的话)而不裂解样品中的微生物的试剂可以是任何适合的试剂。在一些实施方案中,试剂可以包括表面活性剂或去污剂,如非离子型去污剂。适合的实例包括聚乙二醇脱水山梨醇单月桂酸酯(Tween20),例如5%w/v的聚乙二醇脱水山梨醇单月桂酸酯(Tween20)。试剂可以包括皂苷,例如5%w/v的皂苷。试剂可以包括金属卤化物盐,如氯化钠,例如8.5g/l的。试剂可以包括所有三种组分的混合物。可以将样品与试剂在适合的条件下混合,以保证裂解非微生物(特别是哺乳动物细胞,如果存在于样品中的话)而不(或不显著)裂解微生物(如果存在于样品中的话)。可以将样品暴露于试剂持续介于5至30分钟左右(如5、10、15、20、25或30分钟)的时间。可以在任何适合的温度下(例如在15与30摄氏度之间或在室温下)进行此步骤。在使用的情况下,可以通过任何适合的方法将经裂解的细胞材料与样品中的完整微生物(如果有的话)分离。它可以例如依赖于亲和纯化的形式,如基于(多克隆)抗体的方法。在一些实施方案中,它可以依赖于过滤。分离可以依赖于将样品离心,以形成含有微生物(如果存在于样品中的话)的沉淀。可以按任何适合的速度进行样品的离心并且进行任何适合的持续时间。例如,可以按3000与10000g之间(如7000g或7300g左右)的速度离心样品。可以将样品离心适合的时间段,以保证成功裂解非微生物(特别是哺乳动物细胞,如果存在于样品中的话)而不或不显著裂解样品中的微生物。这可以结合离心速度进行确定。时间段可以介于1至30分钟左右,如1、2、3、4、5、10、15、20、25或30分钟。可以在任何适合的温度下(例如在15与30摄氏度之间或在室温下)进行此步骤。分离后,可以弃去经裂解的细胞材料(以上清液的形式)并保留非裂解的细胞(例如作为沉淀)。关于更一般性的方法,上文提供的讨论在这里比照适用。因此,在一些实施方案中,高pH试剂包括NaOH或Na2CO3。在一些实施方案中,高pH试剂的浓度在5mM左右或更大。在某些实施方案中,降pH试剂包括缓冲液或酸,如Tris-HCl缓冲液。在一些具体实施方案中,缓冲液可以是pH7.2或8缓冲液。暴露于pH修饰剂后,将样品中的任何微生物从pH修饰条件中分离。这可以通过第二次离心样品以形成含有微生物(如果存在于样品中的话)的沉淀,随后从沉淀中去除上清液来实现。适合的离心条件是上文讨论的。该方法然后需要裂解任何分离的微生物,以允许检测核酸修饰活性。这可以通过添加裂解混合物实现。裂解混合物在本发明的方法中是普遍性有用的。裂解混合物可以包括用以保证有效裂解微生物而不会不利地影响细胞内的核酸修饰活性的组分的具体混合物。组分可以选自载体/血清蛋白(如BSA)、表面活性剂/去污剂、金属卤化物盐、缓冲液、螯合剂等。在其基本形式中,本发明的裂解混合物可以包括以下组分:1.表面活性剂/去污剂2.血清蛋白,如白蛋白(例如BSA)3.缓冲液4.核苷酸,如dNTP5.核酸分子(在本发明的测定中充当底物)。在下表1中列出了适合的裂解混合物并且形成本发明的一个单独方面:表1.裂解混合物组分列出了每种组分的示例性浓度,但是可以如本领域技术人员应容易理解地那样进行修改。裂解也可以需要破碎细胞。例如,可以与物理和/或酶促手段组合使用裂解混合物破碎细胞。在一些实施方案中,物理破碎应用破碎仪。破碎仪可以掺入珠粒如玻璃珠粒,以裂解细胞。适合的装置是可商购的并且包括由ScientificIndustries,Inc制造的DisruptorGenie。在一些实施方案中,酶促破碎可以需要使用选自溶葡球菌酶、溶菌酶和/或溶细胞酶的试剂。如表1中所指示的,使样品与充当样品中的微生物的核酸修饰活性的底物的核酸分子接触的步骤可以包括向裂解混合物中添加该核酸分子。然后在适于核酸修饰活性的条件下孵育样品。这可以涉及在核酸修饰活性的最适温度下进行孵育。例如,可以在介于15至40摄氏度左右(如37摄氏度左右)的温度下孵育样品。这可以持续任何适合的时间段,例如5与60分钟之间,如5、10、15、20、25或30分钟左右。这之后,可以在修饰的核酸分子检测步骤之前使核酸修饰活性失活。这可以通过将温度升高例如至高于60摄氏度(如95摄氏度)的温度持续适合的时间段来实现。这可以是相对较短的时间段,如1、2、3、4、5、10、15或更多分钟。可以通过如本文讨论的任何适合的方法特异性确定不存在或存在由于核酸修饰活性对底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在微生物。优选方法是基于核酸扩增的并且可以允许对样品中的核酸修饰活性(并且因此对微生物)进行定量。发明人还已经研究了在ETGA方法的背景下使用内部阳性对照(IPC)分子。特别地,本发明可以依赖于包含底物核酸分子与IPC,这样使得该IPC暴露于相同的条件。他们已经发现,样品中的残余核酸酶活性可影响添加至样品(特别地是裂解混合物中的,如本文所定义的)中的底物。因此,保护IPC免受核酸酶活性影响有优势。因此,本发明还提供了检测(液体)样品中不存在或存在微生物的方法,该样品潜在地含有核酸酶活性的非微生物来源,该方法包括:(i)用裂解该样品中的非微生物(如果存在的话)但不裂解该样品中的微生物的试剂孵育该样品(ii)将该经裂解的细胞材料与该样品中的完整微生物(如果有的话)分离和/或使该经裂解的细胞材料失活(iii)分离和/或失活后,裂解任何微生物(iv)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子连同内部阳性对照(IPC)核酸分子接触,(v)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(vi)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其特征在于该IPC核酸分子被修饰以保护它免受核酸酶活性。步骤(ii)中的分离是任选步骤,因为在一些实施方案中,无需将经裂解的细胞材料与完整微生物分离。在一些实施方案中,进行使在经裂解的细胞材料中存在的核酸修饰活性失活的替代性或另外的步骤。可以应用如本文所讨论的任何适合的失活技术。例如,失活可以是经裂解的细胞材料中的核酸修饰活性和/或核酸酶活性的失活。失活可以使用任何适合的手段实现,例如如本文所讨论的高pH处理。微生物保持完整的事实可以保护它们免受失活处理的影响。类似地,本发明还提供了检测(液体)样品中不存在或存在微生物的方法,该样品潜在地含有核酸酶活性的非微生物来源,该方法包括:(a)将该样品离心,以形成含有该样品中的微生物(如果存在的话)的沉淀(b)从该沉淀中去除上清液(c)裂解该沉淀中的任何微生物(d)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子连同内部阳性对照(IPC)核酸分子接触,(e)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(f)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其特征在于该IPC核酸分子被修饰以保护它免受核酸酶活性影响。受保护的IPC在使用受保护的底物分子的背景下是特别有利的。因此,在一些实施方案中,(底物)核酸分子也被修饰以保护它免受核酸酶活性影响。这保证两种核酸分子都受保护并经受相同的条件。任何适合的手段都可以用于保护核酸分子免受核酸酶活性影响。非限制性实例包括向核酸分子中掺入甲基化、末端修饰(如保护3’和/或5’端)以及掺入合成核苷酸。在一些具体实施方案中,合成核苷酸包括硫代磷酸酯核苷酸和/或锁核酸核苷酸。优选地,合成核苷酸是硫代磷酸酯核苷酸。在某些实施方案中,合成核苷酸替代核酸分子中的至少一个核苷酸,多至所有核苷酸。在一些具体实施方案中,以相同方式修饰IPC和底物核酸分子。这是着眼于提供尽可能相等的免受核酸酶活性影响的保护。在本发明的背景下,如果IPC被修饰以保护它免受核酸酶活性影响,则IPC被预修饰以保护它免受核酸酶活性影响,即IPC被修饰以使它与样品接触之前保护它免受核酸酶活性影响。本发明还考虑了使用IPC来监测样品中的潜在污染核酸酶活性。因此,本发明还提供了检测(液体)样品中不存在或存在微生物的方法,该样品潜在地含有核酸酶活性的非微生物来源,该方法包括:(i)用裂解该样品中的非微生物(如果存在的话)但不裂解该样品中的微生物的试剂孵育该样品(ii)将该经裂解的细胞材料与该样品中的完整微生物(如果有的话)分离和/或使该经裂解的细胞材料失活(iii)分离和/或失活后,裂解任何微生物(iv)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子连同内部阳性对照(IPC)核酸分子接触,(v)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(vi)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其特征在于该IPC核酸分子易受核酸酶活性影响并且用于鉴定沉淀中的污染核酸酶活性。步骤(ii)中的分离是任选步骤,因为在一些实施方案中,无需将经裂解的细胞材料与完整微生物分离。在一些实施方案中,进行使在经裂解的细胞材料中存在的核酸修饰活性失活的替代性或另外的步骤。可以应用如本文所讨论的任何适合的失活技术。例如,失活可以是经裂解的细胞材料中的核酸修饰活性和/或核酸酶活性的失活。失活可以使用任何适合的手段实现,例如如本文所讨论的高pH处理。微生物保持完整的事实可以保护它们免受失活处理的影响。类似地,进一步提供了检测(液体)样品中不存在或存在微生物的方法,该样品潜在地含有核酸酶活性的非微生物来源,该方法包括:(a)将该样品离心,以形成含有该样品中的微生物(如果存在的话)的沉淀(b)从该沉淀中去除上清液(c)裂解该沉淀中的任何微生物(d)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子连同内部阳性对照(IPC)核酸分子接触,(e)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(f)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其特征在于该IPC核酸分子易受核酸酶活性影响并且用于鉴定该沉淀中的污染核酸酶活性。典型地,一起进行步骤(iii)和(iv)或(c)和(d)。在一些具体实施方案中,在本发明的方法中使用的(底物)核酸分子至少部分是双链的并且在互补链中包含尿嘧啶残基,并且特异性确定不存在或存在修饰的核酸分子的步骤包括向样品中添加尿嘧啶DNA糖基化酶(UDG),以降解互补链中的尿嘧啶残基。在某些实施方案中,部分双链的(底物)核酸分子的第一链包含合成核苷酸(例如硫代磷酸酯核苷酸)(或由其组成),并且第二(互补)链包含尿嘧啶残基和任选地合成核苷酸(例如硫代磷酸酯核苷酸)(或由其组成)。优选地,双链区域涵盖第一和第二(互补)链的3’端区域。优选地,双链区域是至少5、至少10、至少15、至少20或至少25个核苷酸;任选地,双链区域不多于50个核苷酸。可以使用不受保护的(或标准)dNTP通过样品中的微生物的聚合酶活性在如本文所描述的孵育步骤期间延伸第一链,以形成包含不受保护的(或标准)核苷酸的经延伸的第一链。这个步骤依赖于使用第二链作为模板(第一与第二链之间的互补区的上游)。孵育步骤后,可以通过向样品中添加尿嘧啶DNA糖基化酶(UDG)来降解第二(互补)链,留下作为单链分子的包含合成核苷酸和不受保护的核苷酸的经延伸的第一链。降解第二链后,可以在扩增步骤中对(底物)核酸分子的经延伸的第一链进行检测。发明人已经发现,使用如上文描述的部分双链的(底物)核酸分子改进样品中微生物的检测。在某些实施方案中,IPC核酸分子包含与核酸分子相同的引物结合位点,这样使得存在引物结合竞争(在该方法的步骤(vi)或(f)中)。在一些另外的实施方案中,添加结合至核酸分子内的靶探针序列上的核酸探针(在步骤(vi)或(f)中)。典型地,探针结合至核酸分子的有义链上。在一些其他实施方案中,分别在步骤(vi)或(f)中添加结合至IPC核酸分子内的靶探针序列上的另外的核酸探针。在一些具体实施方案中,核酸探针不结合至IPC核酸分子上并且另外的核酸探针不结合至核酸分子上。可以标记核酸探针和/或另外的核酸探针。优选地,将它们进行不同的标记。在一些具体实施方案中,核酸分子的互补链在3’端包含修饰以防止延伸。这种修饰可以包括掺入不可延伸核苷酸。在一些具体实施方案中,不可延伸核苷酸是双脱氧核苷酸三磷酸(ddNTP),如双脱氧胞苷。在IPC易受核酸酶活性影响的方法中,(底物)核酸分子可以被修饰以保护它免受核酸酶活性影响。适合的修饰在本文进行了讨论并且可以选自掺入甲基化、保护3’和/或5’端、掺入合成核苷酸。合成核苷酸的实例包括硫代磷酸酯核苷酸和/或锁核酸核苷酸。优选地,合成核苷酸是硫代磷酸酯核苷酸。基本测定形式的各种发展可以有利地进行组合,以产生特别具特异性和敏感性的方法。因此,本发明进一步提供了检测样品中不存在或存在微生物的方法,该样品含有核酸修饰活性的非微生物来源,该方法包括:(i)用裂解该样品中的非微生物(如果存在的话)但不裂解该样品中的微生物的试剂孵育该样品(ii)任选地将该经裂解的细胞材料与该样品中的完整微生物(如果有的话)分离(iii)使该样品中的(分离的)完整微生物(如果有的话)与高pH试剂接触并孵育不多于5分钟,以抑制核酸修饰活性的该非微生物来源(同时不影响该样品中微生物的核酸修饰活性)(iv)添加降pH试剂,以使高pH下的孵育停止(v)将该样品中的微生物(如果存在的话)与pH修饰试剂分离(vi)裂解任何分离的微生物(vii)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(viii)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(ix)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其中该核酸分子被修饰以保护它免受核酸酶活性影响。步骤(ii)是任选步骤,因为在一些实施方案中,无需将经裂解的细胞材料与完整微生物分离。这是因为在任何情况下步骤(iii)用于抑制在经裂解的细胞材料中存在的核酸修饰活性。类似地,本发明进一步提供了检测样品中不存在或存在微生物的方法,该样品含有核酸修饰活性的非微生物来源,该方法包括:(a)用裂解该样品中的非微生物(如果存在的话)但不裂解该样品中的微生物的试剂孵育该样品(b)将该样品离心,以形成含有该样品中的微生物(如果存在的话)的沉淀(c)从该沉淀中去除上清液(d)将该沉淀重悬于高pH试剂中并孵育不多于5分钟,以抑制核酸修饰活性的该非微生物来源(同时不影响该样品中微生物的核酸修饰活性)(e)添加降pH试剂,以使高pH下的孵育停止(f)将该样品第二次离心,以形成含有该样品中的微生物(如果存在的话)的沉淀(g)从该沉淀中去除上清液(h)裂解该沉淀中的任何微生物(i)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(j)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(k)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其中该核酸分子被修饰以保护它免受核酸酶活性影响。因此,这些方法代表本文描述的其他方法的组合。因此,所有相关实施方案比照适用这种总体方法。例如,关于核酸被修饰的一些其他实施方案,修饰可以选自掺入甲基化、保护3’和/或5’端、掺入合成核苷酸。合成核苷酸可以包括硫代磷酸酯核苷酸和/或锁核酸核苷酸。优选地,合成核苷酸是硫代磷酸酯核苷酸。在一些特定实施方案中,将核酸分子以至少2nM且小于50nM(例如2nM至25nM、5nM至15nM、或7.5至12.5nM)(如2nM、5nM、7.5nM或10nM)的浓度添加至样品中。核酸分子可以被包括在该方法的步骤(vi)或(h)中使用的裂解混合物中(即指定浓度是裂解混合物中的浓度)。因此,在一些实施方案中,可以分别将步骤(vi)和(vii)或(h)和(i)有效地组合为单个步骤。裂解混合物可以是如在表1中所指定的或如在本公开内容的其他地方所讨论的。该方法可以类似地包括向样品中添加浓度多于50μM、优选至少100μM(如55至300μM、或60至250μM、或75至200μM)的脱氧核糖核苷酸三磷酸。同样地,dNTP可以被包括在该方法的步骤(vi)或(h)中使用的裂解混合物中(即指定浓度是裂解混合物中的浓度)。因此,在一些实施方案中,可以分别将步骤(vi)和(vii)或(h)和(i)有效地组合为单个步骤。如在上文更加详细地讨论的,高pH试剂可以是或包括NaOH或Na2CO3。在一些具体实施方案中,高pH试剂的浓度在5mM左右或更大。降pH试剂可以包括缓冲液或酸,如Tris-HCl缓冲液(例如pH7.2或8)。在一些具体实施方案中,在15与30摄氏度之间的温度下进行步骤(iii)或(d),或在室温下进行。在一些实施方案中,可以在15与30摄氏度之间的温度下或在室温下进行该方法的每个和/或所有步骤。在利用核酸扩增步骤(如PCR)的情况下,那些步骤将需要在如本文详细描述的和技术人员所理解的适当温度下进行。在一些具体实施方案中,可以应用核酸酶敏感性IPC。因此,步骤(vii)或(i)可以分别包括使样品与充当样品中微生物的核酸修饰活性的底物的核酸分子连同内部阳性对照(IPC)核酸分子接触,其中该IPC核酸分子易受核酸酶活性影响并且用于鉴定沉淀中的污染核酸酶活性。可替代地,可以应用核酸酶耐受性IPC。因此,步骤(vii)或(i)可以分别包括使样品与充当样品中微生物的核酸修饰活性的底物的核酸分子连同内部阳性对照(IPC)核酸分子接触,其中该IPC核酸分子被修饰以保护它免受核酸酶活性影响。适合的修饰在本文进行了更加详细地讨论并且可以选自掺入甲基化、保护3’和/或5’端、掺入合成核苷酸。合成核苷酸可以是或包括硫代磷酸酯核苷酸和/或锁核酸核苷酸。优选地,合成核苷酸是硫代磷酸酯核苷酸。如果两种分子都被修饰,则优选的是以相同或类似方式修饰它们,这样使得核酸酶耐受性是可比的。这允许IPC发挥最有用的比较物角色,以确定核酸酶活性对底物分子的影响。如已经提及的,在一些实施方案中,一起进行步骤(vi)和(vii)或(h)和(i)。这里,核酸分子连同裂解试剂被添加至样品中,以形成裂解混合物。如本文进一步详细地讨论的,该讨论比照适用,可以通过多种方法(包括通过测序或核酸扩增)来检测修饰的核酸分子的检测。在一些具体实施方案中,步骤(ix)或(k)分别包括核酸扩增步骤。可以应用任何适合的核酸分子。在一些实施方案中,核酸分子掺入了尿嘧啶残基。在一些具体实施方案中,核酸分子至少部分是双链的并且在互补链中包含尿嘧啶残基。在此类实施方案中,所述方法(并且特别是相应方法的步骤(ix)或(k))可以包括向样品中添加尿嘧啶DNA糖基化酶(UDG),以降解互补链中的尿嘧啶残基。在一些另外的实施方案中,核酸分子的互补链在3’端包含修饰以防止延伸。所谓“延伸”意指添加另外的核苷酸。可以应用任何适合的修饰。在一些具体实施方案中,修饰是或包括掺入不可延伸核苷酸。可以应用任何适合的不可延伸核苷酸。例如,不可延伸核苷酸可以是或包括双脱氧核苷酸三磷酸(ddNTP),如双脱氧胞苷。在某些实施方案中,IPC核酸分子包含与核酸分子相同的引物结合位点,这样使得在检测修饰的核酸分子的步骤期间(在步骤(ix)或(k)中)存在引物结合竞争。如本文所讨论的,存在多种可供使用的扩增技术,其中的许多依赖于探针(如水解或发夹探针)。因此,在一些实施方案中,所述方法包括使用探针,特别是在步骤(ix)或(k)中。在一些具体实施方案中,在该方法的步骤(ix)或(k)中添加核酸探针。这种探针结合至核酸分子(的有义链)内的靶探针序列上。所谓“结合”意指在应用于所述方法的条件下杂交,如本领域技术人员应容易理解的。在一些实施方案中,利用结合至IPC核酸分子内的靶探针序列上的另外的核酸探针,例如在步骤(ix)或(k)中添加。在一些具体实施方案中,核酸探针不结合至IPC核酸分子上并且另外的核酸探针不结合至(底物)核酸分子上。可以使用本领域已知的技术和工具(如在线设计工具)将探针和核酸分子(IPC或底物)设计成避免不想要的交叉杂交。可以标记核酸探针和/或另外的核酸探针。在一些具体实施方案中,不同地标记核酸探针和另外的核酸探针。例如,可以用具有不同的最大发射波长的荧光团标记它们。适合的标记对可以由本领域技术人员容易地进行选择,例如FAM和德克萨斯红可以被用作不同的标记。根据本发明的所有方面,核酸修饰活性可以是可用于指示微生物活力的任何活性。核酸修饰活性是由微生物提供的酶促活性。实例包括聚合酶和/或连接酶活性。优选地,核酸修饰活性是聚合酶活性。聚合酶活性可以包括DNA和/或RNA聚合酶活性。优选地,聚合酶活性是DNA和/或RNA聚合酶活性。连接酶活性可以是ATP或NAD依赖性的。可替代地,可以测量与活力相关的其他核酸修饰活性,如磷酸酶、激酶和/或核酸酶活性。优选地,核酸修饰活性对底物核酸分子的作用产生经延伸的核酸分子。在本文详细地描述了适合的底物分子。也可以参考WO2011/130584、WO2010/119270和WO2009/007719(将其相关公开结合在此),在其中披露了可用于检测核酸修饰活性的适合的底物分子。在磷酸酶活性的情况下,适合的核酸分子披露于WO2006/123154中,将其公开通过引用并入本文。用于在本发明的方法中使用的以及被包括在本发明的试剂盒中的底物核酸分子必须具有使得NAD依赖性连接酶能够作用于该分子以产生可检测的连接的(新颖)核酸分子的序列和结构。在下文的实验部分更加详细地描述了用于在本发明中使用的适合的底物核酸分子。因此,底物可以由以下分子构成:ASUaggcgucggugacaaacggccagcguuguugucucu-DDC(3’末端是双脱氧-C)(SEQIDNO:6)S1Gccgatatcggacaacggccgaactgggaaggcgagactgaccgaccgataagctagaacagagagacaacaac(SEQIDNO:7)这是在反义链中掺入尿嘧啶残基的底物核酸分子的一个实例。核酸分子是部分双链的并且在互补链中包含尿嘧啶残基。这允许延伸后尿嘧啶DNA糖基化酶(UDG)降解互补链中的尿嘧啶残基,并且因此阻止底物分子在不存在延伸的情况下(即在样品中不存在核酸修饰活性的情况下)被非特异性地扩增。在一些另外的实施方案中,核酸分子的互补链在3’端包含修饰以防止延伸。所谓“延伸”意指添加另外的核苷酸。可以应用任何适合的修饰。在一些具体实施方案中,修饰是或包括掺入不可延伸核苷酸。可以应用任何适合的不可延伸核苷酸。例如,不可延伸核苷酸可以是或包括双脱氧核苷酸三磷酸(ddNTP),如SEDIDNO:6中所示的双脱氧胞苷。应当指出,可以在本发明中利用这些序列的变体。例如,可以添加另外的侧翼序列。可以应用替代性ddNTP。变体序列可以与SEQIDNO6和7所列的底物核酸分子的核苷酸序列具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%核苷酸序列同一性。适当时核酸分子可以掺入合成核苷酸类似物,或可以是例如基于RNA或PNA的,或其混合物。在本文描述了例如用以保护免受核酸酶活性影响的适合的修饰。在某些实施方案中,可以例如使用荧光标记、或FRET对标记它们,以有助于检测。在本文描述了适合的检测方法。因此,(底物)核酸分子包括能够通过核酸修饰活性被作用以产生(新的可检测的)核酸分子的任何天然核酸和天然或合成类似物。在一些具体实施方案中,可以将底物延伸和/或连接。在一些实施方案中,可以应用核酸底物分子的组合,以允许检测聚合酶和连接酶活性。优选地,相对于核酸修饰活性(由微生物提供),核酸底物过量地,并且特别是大摩尔过量地存在于样品中。这是相对于现有技术方法的重要技术区别。因为新的经延伸的或连接的核酸分子被检测,所以只有在样品中存在此分子对于检测方法有效地工作而言是重要的。因此,如果其他核酸分子(如来自待检测的微生物或来自哺乳动物或其他例如可以在待测试的样品中发现的来源)存在于样品中,它对本发明的方法不是有害的。在一些实施方案中,底物和/或引物可以掺入可彼此碱基配对的互补的非天然存在的分子,以避免非特异性地检测基因组DNA。作为一个实例,适当时可以将pyDAD和puADA掺入引物和底物分子中(Sismour等人,NucleicAcidsResearch,2004,Vol.32,No.2:728-735)。也如本文所讨论的,本发明的方法可以掺入IPC分子。根据方法要求,可以应用任何适合的IPC。作为一个实例,在本发明中可以使用以下IPC:gccgatatcggacaacggccgaactgggaaggcgagatcagcaggccacacgttaaagacagagagacaacaacgctggccgtttgtcaccgacgccta(SEQIDNO:3)在本发明的所有方法中,特异性确定不存在或存在修饰的核酸分子可以包括核酸扩增步骤、基本上由其组成或由其组成。这用于使得本发明的方法最大限度地敏感。此类扩增技术在本领域是公知的,并且包括方法如PCR、NASBA(Compton,1991)、3SR(Fahy等人,1991)、滚环复制、转录介导的扩增(TMA)、链置换扩增(SDA)(ClinicalChemistry45:777-784,1999)、描述于US6261846(通过引用结合在本文)中的DNA寡聚体自组装过程、连接酶链式反应(LCR)(Barringer等人,1990)、靶多核苷酸序列的选择性扩增(US6410276)、随机引发的PCR(WO90/06995)、共有序列引发的PCR(US4437975)、侵入物(invader)技术、链置换技术以及切口置换扩增(WO2004/067726)。以上列表并不旨在是穷尽性的。可以使用任何核酸扩增技术,只要适当的核酸产物被特异性地扩增即可。类似地,在一些实施方案中,可以应用基于测序的方法学,以包括下一代测序平台范围的任何平台。通过使用对待检测的修饰的核酸分子的序列有特异性的扩增引物来实现扩增。为了提供对核酸分子的特异性,可以对与序列的适合区域对应的引物结合位点进行选择。熟悉技术的读者应理解,除引物结合位点之外,核酸分子还可以包括检测由样品中的修饰活性产生的新核酸分子所需的序列,例如RNA聚合酶结合位点或启动子序列可以为恒温扩增技术(如NASBA、3SR和TMA)所需。例如,一个或多个引物结合位点可以桥联底物核酸分子的连接/延伸边界,这样使得只有已经发生连接/延伸才产生扩增产物。可替代地,引物可以结合在连接/延伸边界的任一侧,并且指导跨边界进行扩增,这样使得只有形成连接/延伸核酸分子才(以指数方式)产生扩增产物。引物和底物核酸分子可以被设计成避免(例如样品中基因组DNA的)非特异性扩增。在下文的实验部分列出了用于在本发明的方法中使用的适合引物。它们包括包含SEQIDNO:4和/或5、基本上由其组成或由其组成的引物。这些引物形成本发明的一个单独方面。应当指出,可以在本发明中利用这些序列的变体。特别地,可以根据需要添加另外的序列特异性侧翼序列,例如以改进结合特异性。变体序列可以与在实验部分中列出的引物的核苷酸序列有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%核苷酸序列同一性。适当时引物可以掺入合成核苷酸类似物,或可以是例如基于RNA或PNA的,或其混合物。取决于所应用的检测模式,可以例如用荧光标记和/或FRET对标记引物。可以利用探针,其也可以根据需要进行标记。因此,在某些方面中,使用核酸扩增技术进行本发明的方法,以检测作为核酸修饰活性对底物核酸分子作用的直接结果产生的修饰的核酸分子,其指示在样品中存在微生物。在某些实施方案中,所使用的技术选自PCR、NASBA、3SR、TMA、SDA以及DNA寡聚体自组装。可以通过常规方法(例如像凝胶电泳)检测扩增产物,但是在一些实施方案中使用实时或末端检测方法来进行。在本领域已知许多用于实时或末端检测扩增反应产物的技术。这些包括使用嵌入式荧光染料(如SYBRGreenI)(Sambrook和Russell,MolecularCloning-ALaboratoryManual,第三版),这允许基于所产生的荧光的量来估计扩增DNA的产量。许多实时检测方法产生可以进行连续监测的荧光读出;一些具体实例包括分子信标和荧光共振能量转移探针。实时和末端技术是有利的,因为它们将反应保持在“单管(singletube)”中。这意味着为了获得结果无需下游分析,使得更快速地获得结果。此外,将反应保持在“单管”环境中降低了交叉污染的风险并且允许从本发明的方法进行定量输出。在本发明的健康和安全问题是最重要的背景下(如在检测例如患者样品中的潜在微生物感染中),这是特别重要的。可以使用系统(AppliedBiosystems)完成对PCR反应的实时和末端定量,参见Holland等人;Detectionofspecificpolymerasechainreactionproductbyutilisingthe5'-3'exonucleaseactivityofThermusaquaticusDNApolymerase;Proc.Natl.Acad.Sci.USA88,7276-7280(1991),Gelmini等人Quantitativepolymerasechainreaction-basedhomogeneousassaywithflurogenicprobestomeasureC-Erb-2oncogeneamplification.Clin.Chem.43,752-758(1997)和Livak等人Towardsfullyautomatedgenomewidepolymorphismscreening.Nat.Genet.9,341-342(19995)(通过引用结合在本文)。这种类型的探针可以统称为水解探针。还提供了用于在实时或末端检测中使用的适合的水解/Taqman探针。可以例如使用下文详细描述的标记对探针进行适当标记。在分子信标系统中,参见Tyagi&Kramer.Molecularbeacons-probesthatfluoresceuponhybridization.Nat.Biotechnol.14,303-308(1996)和Tyagi等人Multicolormolecularbeaconsforallelediscrimination.Nat.Biotechnol.16,49-53(1998)(通过引用结合在本文),信标是具有内部淬灭荧光团的发夹形状的探针,当结合至其靶标时其荧光团的荧光被恢复。这些探针可以称为发夹探针。在本发明中有用的适合的探针被列出为SEQIDNO:1和2。可以掺入本发明方法中的另外的基于实时荧光的系统是Scorpion系统,参见Whitcombe等人的DetectionofPCRproductsusingself-probingampliconsandfluorescenceNatureBiotechnology17,804-807(1999年8月1日)。本领域技术人员公知且可商购的另外的实时或末端检测技术包括技术、引物技术、DzyNA引物(Todd等人,ClinicalChemistry46:5,625-630(2000))或PlexorTMqPCR和qRT-PCR系统。因此,在本发明的一些另外的方面中,使用实时或末端技术检测核酸扩增产物。在本发明的一些具体实施方案中,实时技术由使用以下项中的任一种组成:水解探针(系统)、FRET探针(系统)、发夹引物(系统)、发夹探针(分子信标系统)、掺入引物的发夹探针(探针系统)、掺入DNA酶(DNAzyme)的互补序列和可切割的荧光DNA酶底物的引物(DzYNA)、PlexorqPCR以及寡核苷酸阻断系统。可以对扩增产物进行定量,以给出样品中微生物核酸修饰活性的近似值,并且因此给出样品中微生物的水平。因此,“不存在或存在”旨在涵盖对样品中微生物的水平进行定量。在某些实施方案中,反应混合物将含有以下全部;测试的样品、底物核酸分子、任选地除允许实时或末端检测扩增产物所需的试剂之外,扩增修饰的核酸分子所需的试剂、缓冲液和酶。因此,核酸修饰活性(来自一种或多种感兴趣的细菌细胞或微生物)的整个检测方法可以发生在单一反应中,具有定量输出,并且无需任何中间洗涤步骤。使用“单管”反应是有利的,因为为了获得结果无需下游分析,使得更快速地获得结果。此外,将反应保持在“单管”环境中降低了交叉污染的风险并且允许从本发明的方法进行定量输出。并且,单管反应更易于自动化,例如在高通量背景下。可替代地,本发明的方法可以按逐步方式进行。因此,在第一步中,首先可以需要制备处于适合在本发明方法中使用的形式的样品。例如,如本文所讨论的,可需要选择性细胞裂解或增加细胞通透性。如本文所描述的,俘获特定核酸修饰活性(如聚合酶或连接酶)也可以是希望的。可以抑制其他核酸修饰活性(的来源)(如核酸酶活性)等。在扩增步骤之前,本发明方法的步骤可以不包括在高于40℃、高于50℃、高于60℃、高于70℃、高于80℃、高于90℃或高于95℃的温度下进行的步骤。可替代地,本发明的方法可以不包括在高于40℃、高于50℃、高于60℃、高于70℃、高于80℃、高于90℃或高于95℃的温度下进行的任何步骤。在扩增步骤之前,本发明方法的步骤可以在10与50摄氏度之间、15与45摄氏度之间、20与40摄氏度之间、25与40摄氏度之间、30与40摄氏度之间、25与35摄氏度之间、或15与30摄氏度之间的温度下进行,任选地扩增步骤之前的方法步骤可以在室温下进行。可替代地,本发明方法的步骤可以全部在10与50摄氏度之间、15与45摄氏度之间、20与40摄氏度之间、25与40摄氏度之间、30与40摄氏度之间、25与35摄氏度之间、或15与30摄氏度之间的温度下进行,任选地所有方法步骤可以在室温下进行。本发明的方法可以包括使样品中的核酸酶活性失活的步骤。可替代地,本发明的方法不包括使样品中的核酸酶活性失活的步骤。如果进行的话,使核酸酶活性失活的步骤发生在孵育步骤之后且在特异性确定不存在或存在修饰的核酸分子(例如通过扩增)的步骤之前。在本发明的背景下,“样品”被定义为包括任何这样的样品,在其中希望的是测试表达核酸修饰活性的微生物(如真菌(例如酵母)或细菌)的存在。因此,样品可以包括临床样品(如血液样品)、基本上由其组成或由其组成。本发明的方法特别适用于快速确定阴性血液培养物。因此,样品可以包括来自疑似患有血流感染、或针对血流感染进行筛选的患者的血液培养物样品。样品可以是任何适合体积(如1至10ml,优选1ml)的血液培养物样品。可替代地,样品可以是或包含例如体外测定系统。样品可以包括饮料或食物样品或其制剂、或药物或化妆品(如个人护理产品,包括洗发剂、护发素、保湿剂等)、基本上由其组成或由其组成,全部这些均按照规定针对微生物污染进行测试。例如,样品可以包括组织或细胞、基本上由其组成或由其组成,并且可以包括痰液或血液样品或血小板样品、基本上由其组成或由其组成。另外,本发明的方法和试剂盒可以用于监测表面污染,例如像正在准备食物的地点中。污染通过微生物核酸修饰活性的存在来指示。污染可以来自任何微生物来源,特别是细菌或真菌(例如酵母)污染。此外,本发明还可用于监测环境条件,如水供应、废水、海洋环境等。本发明还可用于监测发酵过程中和大气采样中(可以评估医院、工业设施中或生物防护应用中的细菌或孢子含量)的细菌生长。除针对不存在或存在微生物对样品进行筛选之外,本发明的方法还具有多种应用。因此,在一个另外的方面中,本发明提供了如本文所描述的方法用于筛选对针对微生物的试剂的微生物耐受性的用途。该方法可以涉及使含有感兴趣微生物的样品暴露于该试剂并且然后进行本发明的方法以确定该微生物是否具有耐受性的步骤。如果微生物具有耐受性,则将检测到修饰的核酸分子。典型地,使用良好表征的样品(如感兴趣微生物的培养的临床分离株)进行此类方法。类似地,本发明提供了如本文所描述的方法用于筛选候选试剂的用途,所述候选试剂可以能够杀死一种或多种微生物或阻止其生长。这种方法可以涉及使含有微生物的样品暴露于该试剂并且然后进行本发明的方法。如果该试剂是有效杀死剂,则将检测不到(或检测到减少的)修饰的核酸。典型地,使用良好表征的样品(如感兴趣微生物的培养的临床分离物)进行此类方法。所述方法可以作为时间过程实验来进行,以确定该试剂是否能够阻止该微生物的生长(即使无法杀死)。可以在不存在该试剂的情况下运行平行反应,以确定微生物在不存在该试剂的情况下的生长。这提供了该试剂就生长抑制活性而言的有效性的比较。进一步地,本发明提供了如本文所描述的方法用于诊断受试者的感染、或与微生物的存在相关的疾病的用途。在这种背景下,“样品”将通常是临床样品。将使用的样品将取决于将测试的病症。可以使用但并不旨在限制本发明的典型样品包括取自患者、最优选人类患者的全血、血清、血浆、血小板以及尿液样本等。在一个优选实施方案中,测试将是在从受试者取出的样品上进行的体外测试。在一个另外的实施方案中,上述诊断方法可以另外包括从受试者获得样品的步骤。从受试者获得适合样品的方法在本领域是公知的。可替代地,该方法可以以已经在单独程序中从患者体内分离的样品开始进行。所述诊断方法将最优选地在来自人的样品上进行,但是本发明的方法对许多动物而言可以具有诊断实用性。本发明的诊断方法可以用于补充任何已经可供使用的诊断技术,潜在地作为确认初步诊断的方法。可替代地,所述方法可以凭其本身的实力被用作初步诊断方法,因为所述方法提供快速且方便的诊断手段。此外,由于其固有敏感性,本发明的诊断方法仅需要最少的样品,从而避免不必要的侵入性手术。并且,根据本发明的方法,还可以有效地测试大而非浓缩的样品。因此,除检测样品中的污染生物体之外,本发明的方法还具有多种应用。上文提供的关于本发明的各个方面的描述比照适用于本发明的其他方面,并且出于简明性的原因不再重复。例如,可以对本发明的每种方法并入适合的对照。在一些具体实施方案中,微生物是病原性微生物,如病原性细菌。细菌可以是能够引起受试者、优选人类受试者感染或疾病的任何细菌。在一个实施方案中,细菌包括Staphylococcus物种(特别是Staphylococcusaureus并且优选甲氧西林耐受性菌株)、Enterococcus物种、Streptococcus物种、Mycobacterium物种(特别是Mycobacteriumtuberculosis)、Vibrio物种(特别是Vibriocholerae)、Salmonella和/或Escherichiacoli等中的任何一种或多种,或基本上由其组成或由其组成。在某些实施方案中,细菌可以包括Clostridium物种并且特别是C.difficile、基本上由其组成或由其组成。C.difficile是抗生素相关腹泻和结肠炎(一种主要影响老年患者伴有其他基础疾病的保健相关的肠道感染)的主要病因。可以对Candida物种(如C.albicans,、C.parapsilosis和C.glabrata)进行检测。可以对Cryptococcus物种(如C.neoformans)进行检测。可以使用本发明检测(存在或不存在)真菌血症(如念珠菌血症)。在某些实施方案中,根据本发明的这些另外的方面,在该方法中被测试的分子(针对耐受性或治疗感染的能力或对细胞的毒性)是抗微生物化合物。在化合物筛选方法中,可以对任何分子进行测试。实例包括抗微生物剂、核酸分子(包括siRNA(dsRNA)分子和反义分子)、小分子、抗体及其所有衍生物(包括例如Fab片段、可变区片段和单域抗体,只要它们保留结合亲和力即可)等。该方法可以在高通量背景下进行,以在短时间段内对大量分子进行筛选。在一个实施方案中,抗微生物剂可以取自两种主要类型的抗微生物剂,即抗生素(由微生物产生的天然物质)和化疗剂(化学合成的),或者可以是二者的杂合体,如半合成抗生素(一种后续修饰的天然产生的抗生素)或合成抗生素(天然抗生素的合成版本)。在本发明的方法中得到阳性结果后,就杀死细菌或细菌细胞或待测试的其他适合微生物或阻止其生长的能力而言,可以针对以下至少一种或多种特性对适合的候选抗微生物剂进行测试:(1)该试剂对于受试者而言应该是无毒的并且没有不良副作用,(2)该试剂对于受试者而言应该是非变应性的,(3)该试剂不应消除受试者的天然菌群,(4)该试剂应该是稳定的,(5)该试剂应该优选是便宜且易于获得/易于制备的;以及(6)该试剂应该是足够有效的,使得不会产生病原体耐受性(至任何可评估的程度)。这种特征可以根据上文描述的方法进行测试。在一个实施方案中,可以针对治疗感染的能力和/或针对其的耐受性对多种适合的抗微生物剂的组合进行测试。可以针对耐受性并且或许也可以针对其治疗某些感染的新能力对其进行测试的抗生素或其衍生物可以选自下组(通过举例提供但不限于);β-内酰胺类如青霉素(特别是青霉素G或V)和头孢菌素如头孢噻吩、半合成青霉素(如氨苄西林、甲氧西林和阿莫西林)、优选与半合成青霉素制剂结合使用的克拉维酸(例如像克拉莫西(clavamox)或安灭菌(augmentin)),单酰胺菌素如氨曲南,羧基青霉烯类(carboxypenem)(如亚胺培南),氨基糖苷类如链霉素、卡那霉素、妥布霉素和庆大霉素,糖肽类如万古霉素、林可霉素和克林霉素,大环内酯类如红霉素和竹桃霉素,多肽类如多粘菌素和杆菌肽,多烯类如两性霉素和制霉菌素,利福霉素类如利福平,四环素类如四环素,半合成四环素类如多西环素、氯四环素、氯霉素,喹诺酮类如萘啶酮酸和氟喹诺酮以及竞争性抑制剂如磺胺类(例如甘特里辛和甲氧苄胺嘧啶)。也可以利用头孢曲松和/或呋喃西林。仍进一步地,本发明提供了如本文所描述的方法用于检测含有血小板的样品中存在微生物污染的用途。在此类方面中,这些方法可以并入以下子步骤:(i)在保留微生物细胞完整的条件下裂解血小板。这主要允许在测试核酸修饰活性的存在之前选择性浓缩微生物。因此,可以在测试之前去除由哺乳动物细胞提供的核酸修饰活性(ii)浓缩微生物(例如通过离心以产生含有细菌细胞的沉淀)(iii)裂解微生物或处理以增加微生物的通透性以释放核酸修饰活性。本发明还涉及在进行本发明方法中有用的试剂盒。因此,提供了用于进行如本文所描述的方法的试剂盒,该试剂盒包含:(a)至少一种充当样品中的微生物的核酸修饰活性的底物的核酸分子,其中该至少一种核酸分子至少部分是双链的并且在互补链中包含尿嘧啶残基,其特征在于该核酸分子被修饰以保护它免受核酸酶活性影响(b)至少一种内部阳性对照(IPC)核酸分子,其包含与核酸分子相同的引物结合位点,这样使得在含有该核酸分子和该IPC两者的核酸扩增反应中存在引物结合竞争。试剂盒可以掺入进行本发明方法所需的任何组分。因此,本发明方法的所有讨论比照适用。在本发明的背景下,核酸分子被预修饰以保护它免受核酸酶活性影响。在一些实施方案中,试剂盒进一步包含结合至核酸分子(的有义链)内的靶探针序列上的核酸探针。试剂盒可以进一步包含结合至IPC核酸分子内的靶探针序列上的另外的核酸探针。在某些实施方案中,核酸探针不结合至IPC核酸分子上并且另外的核酸探针不结合至核酸分子上。可以标记核酸探针和/或另外的核酸探针。在一些具体实施方案中,不同地标记核酸探针和另外的核酸探针。例如,可以用具有不同的最大发射波长的荧光团标记它们。适合的标记对可以由本领域技术人员容易地进行选择,例如FAM和德克萨斯红可以被用作不同的标记。在一些另外的实施方案中,核酸分子的互补链在3’端包含修饰以防止延伸。所谓“延伸”意指添加另外的核苷酸。可以应用任何适合的修饰。在一些具体实施方案中,修饰是或包括掺入不可延伸核苷酸。可以应用任何适合的不可延伸核苷酸。例如,不可延伸核苷酸可以是或包括双脱氧核苷酸三磷酸(ddNTP),如双脱氧胞苷。在一些另外的实施方案中,IPC被修饰以保护它免受核酸酶活性影响。在本发明的背景下,IPC被预修饰以保护它免受核酸酶活性影响。适合的修饰在本文进行了更加详细地讨论并且可以选自掺入甲基化、保护3’和/或5’端、掺入合成核苷酸。合成核苷酸可以是或包括硫代磷酸酯核苷酸和/或锁核酸核苷酸。优选地,合成核苷酸是硫代磷酸酯核苷酸。如果两种分子都被修饰,则优选的是以相同或类似方式修饰它们,这样使得核酸酶耐受性是可比的。这允许IPC发挥最有用的比较物角色,以确定核酸酶活性对底物分子的影响。在一些另外的实施方案中,试剂盒进一步包含高pH试剂。高pH试剂可以是或包括NaOH或Na2CO3。在一些具体实施方案中,高pH试剂的浓度在5mM左右或更大。试剂盒可以进一步包含降pH剂。降pH试剂可以包括缓冲液或酸,如Tris-HCl缓冲液(例如pH7.2或8)。试剂盒可以掺入进行反应的适合载体。有利地,这样的载体可以包括多孔板,例如像48或96孔板。这样的载体允许在相对小的体积中进行检测方法-因此有助于扩大规模和最小化所需的样品体积。试剂盒典型地包含适合的说明书。这些说明书允许使用本发明的试剂盒可靠地进行本发明的方法。可以在以下编号项中进一步定义本发明:一种检测样品中不存在或存在微生物的方法,该方法包括:(a)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(b)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(c)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其特征在于该核酸分子被修饰以保护它免受核酸酶活性影响。2.如项1所述的方法,其中该修饰选自掺入甲基化、保护3’和/或5’端和掺入合成核苷酸。3.如项2所述的方法,其中合成核苷酸包括硫代磷酸酯核苷酸和/或锁核酸核苷酸。4.一种检测样品中不存在或存在微生物的方法,该方法包括:(a)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(b)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(c)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其特征在于将该核酸分子以至少2nM但小于50nM的浓度添加至该样品中。5.如项4所述的方法,其中步骤(a)和/或(b)包括向该样品中添加浓度为至少100μM的脱氧核糖核苷酸三磷酸。6.一种检测样品中不存在或存在微生物的方法,该样品含有核酸修饰活性的非微生物来源,该方法包括:(a)在高pH条件下将该样品处理不多于5分钟,以抑制核酸修饰活性的非微生物来源(同时不影响该样品中微生物的核酸修饰活性),(b)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(c)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(d)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物。7.如项6所述的方法,其中高pH条件包括使该样品与NaOH或Na2CO3接触。8.如项7所述的方法,其中NaOH或Na2CO3的浓度为5mM左右或更大。9.如项6至8中任一项所述的方法,其中通过添加试剂降低pH来使高pH条件下的该处理停止。10.如项9所述的方法,其中通过添加缓冲液或酸降低pH。11.如项10所述的方法,其中该缓冲液包括Tris-HCl缓冲液(例如pH7.2或8)。12.如项6至11中任一项所述的方法,其中步骤(a)在15与30摄氏度之间的温度下进行。13.如项6至12中任一项所述的方法,其中步骤(a)在室温下进行。14.如项1至13中任一项所述的方法,其中该方法在15与30摄氏度之间的温度下进行。15.如项1至14中任一项所述的方法,其中该方法在室温下进行。16.一种检测样品中不存在或存在微生物的方法,该样品含有核酸修饰活性的非微生物来源,该方法包括:(a)(i)用裂解该样品中的非微生物(如果存在的话)但不裂解该样品中的微生物的试剂孵育该样品(ii)任选地将经裂解的细胞材料与该样品中的完整微生物(如果有的话)分离(iii)使该样品中的(分离的)完整微生物(如果有的话)与高pH试剂接触并孵育不多于5分钟,以抑制核酸修饰活性的非微生物来源(同时不影响该样品中微生物的核酸修饰活性)(iv)添加降pH试剂,以使高pH下的孵育停止(v)将该样品中的微生物(如果存在的话)与pH修饰试剂分离(vi)裂解任何分离的微生物(vi)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(vii)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(viii)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物。或(b)(i)用裂解该样品中的非微生物(如果存在的话)但不裂解该样品中的微生物的试剂孵育该样品(ii)将该样品离心,以形成含有该样品中的微生物(如果存在的话)的沉淀(iii)从该沉淀中去除上清液(iv)将该沉淀重悬于高pH试剂中并孵育不多于8分钟,以抑制核酸修饰活性的非微生物来源(同时不影响该样品中微生物的核酸修饰活性)(v)添加降pH试剂,以使高pH下的孵育停止(vi)将该样品第二次离心,以形成含有该样品中的微生物(如果存在的话)的沉淀(vi)从该沉淀中去除上清液(vii)裂解该沉淀中的任何微生物(viii)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(ix)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(x)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物。17.如项16所述的方法,其中该高pH试剂包括NaOH或Na2CO3。18.如项16或17所述的方法,其中该高pH试剂的浓度为5mM左右或更大。19.如项16至18中任一项所述的方法,其中该降pH试剂包括缓冲液或酸。20.如项19所述的方法,其中该缓冲液包括Tris-HCl缓冲液(pH7.2或8)21.如项16至20中任一项所述的方法,其中步骤(a)(iii)或(b)(iv)在15与30摄氏度之间的温度下进行。22.如项16至21中任一项所述的方法,其中步骤(a)(iii)或(b)(iv)在室温下进行。23.如项16至22中任一项所述的方法,其中该方法在15与30摄氏度之间的温度下进行。24.如项16至23中任一项所述的方法,其中该方法在室温下进行。25.一种检测(液体)样品中不存在或存在微生物的方法,该样品潜在地含有核酸酶活性的非微生物来源,该方法包括:(i)用裂解该样品中的非微生物(如果存在的话)但不裂解该样品中的微生物的试剂孵育该样品(ii)将该经裂解的细胞材料与该样品中的完整微生物(如果有的话)分离和/或使经裂解的细胞材料失活(iii)分离和/或失活后,裂解任何微生物(iv)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子连同内部阳性对照(IPC)核酸分子接触,(v)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(vi)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其特征在于该IPC核酸分子被修饰以保护它免受核酸酶活性影响或(a)将该样品离心,以形成含有该样品中的微生物(如果存在的话)的沉淀(b)从该沉淀中去除上清液(c)裂解该沉淀中的任何微生物(d)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子连同内部阳性对照(IPC)核酸分子接触,(e)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(f)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其特征在于该IPC核酸分子被修饰以保护它免受核酸酶活性影响。26.如项25所述的方法,其中该核酸分子被修饰以保护它免受核酸酶活性影响。27.如项25或26所述的方法,其中该修饰选自掺入甲基化、保护3’和/或5’端、掺入合成核苷酸。28.如项27所述的方法,其中合成核苷酸包括硫代磷酸酯核苷酸和/或锁核酸核苷酸。29.一种检测(液体)样品中不存在或存在微生物的方法,该样品潜在地含有核酸酶活性的非微生物来源,该方法包括:(i)用裂解该样品中的非微生物(如果存在的话)但不裂解该样品中的微生物的试剂孵育该样品(ii)将该经裂解的细胞材料与该样品中的完整微生物(如果有的话)分离和/或使该经裂解的细胞材料失活(iii)分离和/或失活后,裂解任何微生物(iv)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子连同内部阳性对照(IPC)核酸分子接触,(v)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(vi)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其特征在于该IPC核酸分子易受核酸酶活性影响并且用于鉴定该沉淀中的污染核酸酶活性。或(a)将该样品离心,以形成含有该样品中的微生物(如果存在的话)的沉淀(b)从该沉淀中去除上清液(c)裂解该沉淀中的任何微生物(d)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子连同内部阳性对照(IPC)核酸分子接触,(e)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(f)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其特征在于该IPC核酸分子易受核酸酶活性影响并且用于鉴定该沉淀中的污染核酸酶活性。30.如项25至29中任一项所述的方法,其中分别一起进行步骤(iii)和(iv)或(c)和(d)。31.如项30所述的方法,其中将该核酸分子连同裂解试剂添加至该样品中。32.如项1至31中任一项所述的方法,其中特异性确定不存在或存在该修饰的核酸分子包括核酸扩增步骤。33.如项32所述的方法,其中该核酸分子至少部分是双链的并且在互补链中包含尿嘧啶残基,并且特异性确定不存在或存在该修饰的核酸分子的步骤包括向该样品中添加尿嘧啶DNA糖基化酶(UDG),以降解该互补链中的尿嘧啶残基。34.如项25至33中任一项所述的方法,其中该IPC核酸分子包含与核酸分子相同的引物结合位点,这样使得在步骤(f)中存在引物结合竞争。35.如项25至34中任一项所述的方法,其中在步骤(f)中添加结合至该核酸分子(的有义链)内的靶探针序列上的核酸探针。36.如项25至35中任一项所述的方法,其中在步骤(f)中添加结合至该IPC核酸分子内的靶探针序列上的另外的核酸探针。37.如项36所述的方法,其中该核酸探针不结合至该IPC核酸分子上并且该另外的核酸探针不结合至该核酸分子上。38.如项35至37中任一项所述的方法,其中对该核酸探针进行标记。39.如项35至38中任一项所述的方法,其中对该另外的核酸探针进行标记。40.如项38或39所述的方法,其中对该核酸探针和另外的核酸探针进行不同的标记41.如项33所述的方法,其中该核酸分子的互补链在3’端包含修饰以防止延伸。42.如项41所述的方法,其中该修饰包括掺入不可延伸核苷酸。43.如项42所述的方法,其中该不可延伸核苷酸是双脱氧核苷酸三磷酸(ddNTP)。44.如项43所述的方法,其中该ddNTP是双脱氧胞苷。45.如项29至44中任一项所述的方法,其中该核酸分子被修饰以保护它免受核酸酶活性影响。46.如项45所述的方法,其中该修饰选自掺入甲基化、保护3’和/或5’端、掺入合成核苷酸。47.如项46所述的方法,其中合成核苷酸包括硫代磷酸酯核苷酸和/或锁核酸核苷酸。48.一种检测样品中不存在或存在微生物的方法,该样品含有核酸修饰活性的非微生物来源,该方法包括:(i)用裂解该样品中的非微生物(如果存在的话)但不裂解该样品中的微生物的试剂孵育该样品(ii)任选地将该经裂解的细胞材料与该样品中的完整微生物(如果有的话)分离(iii)使该样品中的(分离的)完整微生物(如果有的话)与高pH试剂接触并孵育不多于5分钟,以抑制核酸修饰活性的非微生物来源(同时不影响该样品中微生物的核酸修饰活性)(iv)添加降pH试剂,以使高pH下的孵育停止(v)将该样品中的微生物(如果存在的话)与pH修饰试剂分离(vi)裂解任何分离的微生物(vii)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(viii)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(ix)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其中该核酸分子被修饰以保护它免受核酸酶活性影响。或(a)用裂解该样品中的非微生物(如果存在的话)但不裂解该样品中的微生物的试剂孵育该样品(b)将该样品离心,以形成含有该样品中的微生物(如果存在的话)的沉淀(c)从该沉淀中去除上清液(d)将该沉淀重悬于高pH试剂中并孵育不多于8分钟,以抑制核酸修饰活性的该非微生物来源(同时不影响该样品中微生物的核酸修饰活性)(e)添加降pH试剂,以使高pH下的孵育停止(f)将该样品第二次离心,以形成含有该样品中的微生物(如果存在的话)的沉淀(g)从该沉淀中去除上清液(h)裂解该沉淀中的任何微生物(i)使该样品与充当该样品中的微生物的核酸修饰活性的底物的核酸分子接触,(j)在适于核酸修饰活性的条件下孵育如此接触的样品;以及(k)特异性确定不存在或存在由于该核酸修饰活性对该底物核酸分子的作用得到的经修饰的核酸分子,以指示不存在或存在该微生物,其中该核酸分子被修饰以保护它免受核酸酶活性影响。49.如项48所述的方法,其中该修饰选自掺入甲基化、保护3’和/或5’端、掺入合成核苷酸。50.如项49所述的方法,其中合成核苷酸包括硫代磷酸酯核苷酸和/或锁核酸核苷酸。51.如项48至50中任一项所述的方法,其特征还在于将该核酸分子以至少2nM且小于50nM的浓度添加至该样品中。52.如项48至51中任一项所述的方法,其中步骤(vii)或(i)分别包括向该样品中添加浓度为至少100μM的脱氧核糖核苷酸三磷酸。53.如项48至52中任一项所述的方法,其中该高pH试剂包括NaOH或Na2CO3。54.如项48至53中任一项所述的方法,其中该高pH试剂的浓度为5mM左右或更大。55.如项48至54中任一项所述的方法,其中该降pH试剂包括缓冲液或酸。56.如项55所述的方法,其中该缓冲液包括Tris-HCl缓冲液(pH7.2或8)57.如项48至56中任一项所述的方法,其中步骤(iv)或(d)分别在15与30摄氏度之间的温度下进行。58.如项48至57中任一项所述的方法,其中步骤(iv)或(d)分别在室温下进行。59.如项48至58中任一项所述的方法,其中该方法在15与30摄氏度之间的温度下进行。60.如项48至59中任一项所述的方法,其中该方法在室温下进行。61如项48至60中任一项所述的方法,其中步骤(vi)或(i)分别包括使该样品与充当该样品中微生物的核酸修饰活性的底物的核酸分子连同内部阳性对照(IPC)核酸分子接触,其中该IPC核酸分子易受核酸酶活性影响并且用于鉴定该沉淀中的污染核酸酶活性。62.如项48至60中任一项所述的方法,其中步骤(vi)或(i)分别包括使该样品与充当该样品中微生物的核酸修饰活性的底物的核酸分子连同内部阳性对照(IPC)核酸分子接触,其中该IPC核酸分子被修饰以保护它免受核酸酶活性影响。63.如项62所述的方法,其中该修饰选自掺入甲基化、保护3’和/或5’端、掺入合成核苷酸。64.如项63所述的方法,其中合成核苷酸包括硫代磷酸酯核苷酸和/或锁核酸核苷酸。65.如项48至64中任一项所述的方法,其中分别一起进行步骤(vi)和(vii)或(h)和(i)。66.如项65所述的方法,其中将该核酸分子连同裂解试剂添加至该样品中。67.如项48至66中任一项所述的方法,其中步骤(xi)或(k)分别包括核酸扩增步骤。68.如项48至67中任一项所述的方法,其中该核酸分子至少部分是双链的并且在互补链中包含尿嘧啶残基,并且步骤(k)包括向该样品中添加尿嘧啶DNA糖基化酶(UDG),以降解该互补链中的尿嘧啶残基。69.如项64至68中任一项所述的方法,其中该IPC核酸分子包含与核酸分子相同的引物结合位点,这样使得分别在步骤(xi)或(k)中存在引物结合竞争。70.如项48至69中任一项所述的方法,其中在(xi)或(k)中分别添加结合至该核酸分子(的有义链)内的靶探针序列上的核酸探针。71.如项70所述的方法,其中在步骤(xi)或(k)中分别添加结合至该IPC核酸分子内的靶探针序列上的另外的核酸探针。72.如项71所述的方法,其中该核酸探针不结合至该IPC核酸分子上并且该另外的核酸探针不结合至该核酸分子上。73.如项70至72中任一项所述的方法,其中对该核酸探针进行标记。74.如项71至73中任一项所述的方法,其中对该另外的核酸探针进行标记。75.如项74所述的方法,其中对该核酸探针和另外的核酸探针进行不同的标记。76.如项68至75中任一项所述的方法,其中该核酸分子的互补链在3’端包含修饰以防止延伸。77.如项76所述的方法,其中该修饰包括掺入不可延伸核苷酸。78.如项77所述的方法,其中该不可延伸核苷酸是双脱氧核苷酸三磷酸(ddNTP)。79.如项78所述的方法,其中该ddNTP是双脱氧胞苷。80.如项1至79中任一项所述的方法,其中该核酸修饰活性包括聚合酶活性。81.根据项1至80中任一项所述的方法用于筛选对针对微生物的试剂的微生物耐受性的用途。82.根据项1至80中任一项所述的方法用于筛选可以能够杀死一种或多种微生物或阻止其生长的候选试剂的用途。83.根据项1至80中任一项所述的方法用于诊断受试者的感染、或与微生物的存在相关的疾病的用途。84.根据项1至80中任一项所述的方法用于检测含有血小板的样品中存在微生物污染的用途。85.一种用于进行根据项1至84中任一项所述的方法的试剂盒,该试剂盒包含:(a)至少一种充当该样品中的微生物的核酸修饰活性的底物的核酸分子,其中该至少一种核酸分子至少部分是双链的并且在互补链中包含尿嘧啶残基,其特征在于该核酸分子被修饰以保护它免受核酸酶活性影响(b)至少一种内部阳性对照(IPC)核酸分子,其包含与该核酸分子相同的引物结合位点,这样使得在含有该核酸分子和该IPC两者的核酸扩增反应中存在引物结合竞争。86.如项85所述的试剂盒,其中该试剂盒进一步包含结合至该核酸分子(的有义链)内的靶探针序列上的核酸探针。87.如项85或86所述的试剂盒,其中该试剂盒进一步包含结合至该IPC核酸分子内的靶探针序列上的另外的核酸探针。88.如项86或87所述的试剂盒,其中该核酸探针不结合至该IPC核酸分子上并且该另外的核酸探针不结合至该核酸分子上。89.如项86至88中任一项所述的试剂盒,其中对该核酸探针进行标记。90.如项87至89中任一项所述的试剂盒,其中对该另外的核酸探针进行标记。91.如项87至90中任一项所述的试剂盒,其中对该核酸探针和另外的核酸探针进行不同的标记。92.如项85至91中任一项所述的试剂盒,其中该核酸分子的互补链在3’端包含修饰以防止延伸。93.如项92所述的试剂盒,其中该修饰包括掺入不可延伸核苷酸。94.如项93所述的试剂盒,其中该不可延伸核苷酸是双脱氧核苷酸三磷酸(ddNTP)。95.如项94所述的试剂盒,其中该ddNTP是双脱氧胞苷。96.如项85至95中任一项所述的试剂盒,其中该IPC被修饰以保护它免受核酸酶活性影响。97.如项96所述的试剂盒,其中该修饰选自掺入甲基化、保护3’和/或5’端、掺入合成核苷酸。98.如项97所述的试剂盒,其中合成核苷酸包括硫代磷酸酯核苷酸和/或锁核酸核苷酸。99.如项85至98中任一项所述的试剂盒,其中该试剂盒进一步包含高pH试剂。100.如项99所述的试剂盒,其中该高pH试剂包括NaOH或Na2CO3。101.如项99或100所述的试剂盒,其中该高pH试剂的浓度为5mM左右或更大。102.如项85至101中任一项所述的试剂盒,该试剂盒进一步包含降pH剂。103.如项102所述的试剂盒,其中该降pH试剂包括缓冲液或酸。104.如项103所述的试剂盒,其中该缓冲液包括Tris-HCl缓冲液(pH7.2或8)。附图描述图1.通过增加dNTP和底物浓度改进微生物的ETGA检测。每个图表都示出了在针对一系列相关微生物的ETGA检测实验中对ETGA靶底物(FAM通道)的检测获得的ct值。在所有情况下,阴性血液培养物对照>39.9ct单位,阴性试剂阴性对照>40ct单位,并且阳性试剂对照<20ct单位。图2.与阴性对照样品相比,通过在微生物裂解混合物(LM)或PCR主混合物(mastermix,MM)中仅添加IPCDNA制备的血液培养物样品中的IPC分子的检测。将一定数量的IPCDNA添加至LM中,以提供与当添加至MM中时相同的ct值。数据显示,当添加至LM中时而非当添加至MM中时,与阴性对照(无血液)相比,在阴性血液培养物样品中的IPC分子的检测(在40个循环的PCR反应中)完全损失。图3.由向LM而非MM中添加IPC导致的背景增加。在图表上标绘的数据示出了使用已经将IPC添加至LM(菱形)和MM(方形)中的方案相对于针对血液培养物样品获得的总活菌计数(TVC)的FAM通道(检测ETGA底物)中的ct值。对于每个PCR反应,与在MM中的相比,添加至LM中的IPC的量为50x。与在MM中使用标准浓度的IPC相比,当在LM中使用50x正常浓度的IPC时,测量到的背景更高。在不含有任何添加的细菌的血液培养物样品中,通过ETGA测试程序用MM(蓝色虚线)或LM(绿色点划线)中的IPC测量背景水平。图4.ETGA测试背景降低并且改进测试敏感性。曲线图示出了来自在血液培养物中的系列稀释的C.albicans上进行的ETGA测试的在qPCR反应中在FAM通道中检测到的荧光。qPCR反应含有能够检测修饰的ETGA底物的FAM标记的探针,所以扩增指示微生物的存在。图4a示出了使用标准底物和IPC寡聚物进行的一组ETGA测试的结果。图4b示出了使用PTO底物和IPC从完全相同的样品中获得的结果。注意图4b中的背景低得多,并且可以在测试中检测到更低数目的酵母细胞。图5.通过使用PTO寡聚物改进酵母检测。曲线图示出了与使用PTO寡聚物的ETGA测试相比,使用标准寡聚物的ETGA测试中的酵母(C.albicans)检测的敏感性。图6.通过ETGA检测较不强壮(robust)的微生物。图表示出了H.influenzae的纤弱(delicate)菌株的检测如何被ETGA测试程序影响。在不同阶段,将S.aureus和H.influenzae(105cfu)的纯培养物添加至一般测试方案(10mL)中。数据显示,当在NaOH重悬步骤之前添加微生物时,检测是显著降低的。图7.控制对NaOH的暴露以改进H.influenzae的检测。曲线图示出了与标准程序相比,在ETGA测试程序中控制含有105cfuH.influenzae的培养样品向NaOH暴露的时间量的效果。在没有血液的BacT/ALERT培养液中的H.influenzae的悬浮液上进行针对10mL的一般方案;重悬于NaOH中并孵育0、0.5、2.5和5min之后,在离心之前添加1mL200mMTris-HCl[pH7.2]。图8.用pH降低步骤改进1mlETGA方案。用原始1ml程序(基于1mLNaOH中的重悬液)和含有pH降低步骤的程序(重悬于0.75mLNaOH中,5min孵育,0.5mL试剂C)对含有:A)无加入、B)H.influenzae(105cfu)、C)H.influenzae(104cfu)、D)S.aureus(105cfu)、E)S.aureus(104cfu)的血液培养物样品进行测试。更低的ct值指示更强烈地检测到微生物。图9A-C.加入了E.coli的血液培养液样品和阳性对照(Pol(+))的CognitorMinus结果。示出了(A)实验2、(B)实验3和(C)实验4的在进行或不进行95℃步骤的情况下,在时间0、2和20小时分析的CognitorMinus样品的数据。实验1的数据未示出,因为仅在时间0小时通过QPCR对样品进行了分析。图10.相对于经对数转化的总cfu值标绘的加入了E.coli的血液培养液样品(n=4)的ct值。在95℃(+)或95℃(-)数据集内标绘每个时间点(0小时、2小时和20小时)的趋势线。这里未示出阳性对照的数据。图11A-B.使用(A)未修饰的寡核苷酸裂解混合物或(B)硫代磷酸酯寡核苷酸裂解混合物处理的95℃(+)和95℃(-)样品的在时间0、2和20小时的加入了E.coli的血液培养液样品和阳性对照(Pol+ve)的ct值。示出的数据来自单个实验(n=1)。图12A-E.加入了(A)E.coli、(B)S.aureus和(C)C.albicans的血液培养液样品、(D)阳性对照(PC和(E)无加入对照(NSC)的CognitorMinus结果。相对于样品储存持续时间标绘了来自三个重复实验(n=3)的ct值。标绘了每个样品集的趋势线:PTO95℃(+);PTO95℃(-);UMO95℃(+);和UMO95℃(-)。仅示出了NSC样品的UMOLM数据,因为由于扩增不充分大部分PTOLM样品产生了‘无Ct’。实验部分将相对于以下非限制性实施例理解本发明:实施例1-ETGA测试修改方法-一般方案对于每个样品,将1mL血液培养物(添加或未添加微生物,具有或不具有血液)与0.333mL试剂A(5%w/v皂苷,5%w/vTween20,8.5g/L氯化钠)在1.5mL微量离心管中混合并在室温下孵育15min。将每个样品以7300g离心3min,然后倒掉上清液并且将管的边缘在干净的实验室薄纸上轻触。然后将每个沉淀重悬于0.75mL试剂B(5mMNaOH)中并孵育5min,然后通过添加0.5mL试剂C(1.32g/L硫酸铵,0.49g/L七水硫酸镁,0.75g/L氯化钾,20mMTris-HCl,pH8.0)使pH降低。孵育之后,将样品再次离心并且通过倒掉去除上清液。将剩余的沉淀重悬于0.5mL试剂C中并立即转移到含有玻璃珠混合物(0.1mm和0.5mm玻璃珠;分别由CamBio目录13118-400和13116-400供应)的新管中。进行另外的离心以用玻璃珠沉淀任何悬浮的细胞,并且再次去除并弃去上清液。将50μL含有ETGA底物(LM;含有比率为7:2:1的试剂L1、L2、L3,参见表1)的微生物裂解混合物添加至玻璃珠中并以2800rpm放置入DisruptorGenie(ScientificIndustries,Inc.)细胞破碎仪中6min以裂解微生物细胞。破碎之后,将样品置于37℃加热块中并孵育20min,并且然后转移到另一个95℃的加热块中并孵育5min。孵育之后,将样品冷却至室温同时制备PCR试剂。冷却之后,将3μL样品上清液添加至SmartCyclerPCR管(Cepheid)中的27μL的PCR主混合物(MM;含有通用Taq聚合酶PCR主混合物(Roche-目录04902343001)、ETGA底物的引物、内部阳性对照–IPC–DNA、ETGA底物的FAM标记的探针、IPC的德克萨斯红标记的探针和(1.2ul)UDG酶(Bioline–目录号BIO-27044))中。将样品置于SmartCyclerPCR中并使其经受以下反应条件;1个循环;40℃10min,50℃10min,95℃5min40-50个循环:95℃5sec,61℃20sec,72℃20sec。贯穿整个反应在SmartCycler的德克萨斯红和FAM激发/检测通道中实时监测扩增。表1.裂解混合物组分PCR反应组分的序列如下;Fam标记的探针(一种分子信标):FAM-cgctgcgaccgaccgataagctagaacaggcagcg-BHQ1(SEQIDNO:1)德克萨斯红标记的探针(一种分子信标):TxR-cgcgatcagcaggccacacgttaaagacatcgcg-BHQ2(SEQIDNO:2)IPCgccgatatcggacaacggccgaactgggaaggcgagatcagcaggccacacgttaaagacagagagacaacaacgctggccgtttgtcaccgacgccta(SEQIDNO:3)正向引物ccgatatcggacaacggccgaactgg(SEQIDNO:4)反向引物taggcgtcggtgacaaacggccagc(SEQIDNO:5)底物组分是;ASuaggcgucggugacaaacggccagcguuguugucucu-DDC(3’末端是双脱氧-C)(SEQIDNO:6)S1gccgatatcggacaacggccgaactgggaaggcgagactgaccgaccgataagctagaacagagagacaacaac(SEQIDNO:7)结果与讨论1-增加底物浓度通过将LM中的ETGA底物的量增加为10倍(从0.001μM到0.01μM)并且将dNTP的量增加为2倍(从50μM到100μM)来修改一般方案。底物和dNTP的量增加使得能够改进对C.albicans(图1a)、E.coli(图1b)、S.aureus(图1c)、E.faecalis(图1d)、P.Aeruginosa(图1e)、或H.Influenzae的2种不同菌株(包括纤弱临床菌株)(图1f和图1g)的检测。数据示于图1中。结果与讨论2-通过修饰寡核苷酸组分改进ETGA测试敏感性并降低背景核酸酶活性的证明与ETGA底物分子同时添加IPC分子被认为是对原始方案的改进。如果在LM中添加IPC,IPC将经受与ETGA底物完全相同的测试条件并且因此提供更准确的测试对照。例如,可能负面地影响底物分子(如可以消化底物的核酸酶活性)的条件也将影响IPC。如果之后添加IPC(例如在MM中),它将不经受相同的条件并且可以导致数据的错误解释。如果与ETGA底物同时添加IPC,则能够测量测试条件对核酸模板的影响幅度。为了对其进行示例,图2显示测试条件对ETGA底物的检测可以具有负面影响;当在LM中而非在MM中添加可比量的IPCDNA时,发现与阴性对照样品(没有血液)相比,检测血液培养物标本中的IPC的能力的确会损失。当在MM中使用IPC时,没有看到相同的检测损失。当添加在LM中时IPC的损失归因于在ETGA方案的37℃孵育步骤期间可以已经具有活性的核酸酶。核酸酶最可能源自血液标本。清楚的是,如果IPC分子在测试期间被损失,则ETGA底物分子也可被损失。ETGA底物分子在阳性血液培养物样品中的损失将显然导致检测敏感性降低或潜在地导致假阴性结果,但是通过向LM中添加IPC,将可以确定(并且可能定量)疑似有的核酸酶活性并且据此解释结果。观察到IPC量下降(如通过与阴性试剂对照相比ct值增加所见的)的样品可以被报告为‘未分辨的’而非‘阴性的’,因此指示样品经受核酸酶活性并且事实上可能是阳性的。向LM中添加IPC分子能够改进ETGA测试。然而,取决于在临床标本中有多经常发现核酸酶活性,这能够提高未分辨结果的总体数量,使得由于高感知失败率,该测试对于潜在用户较不具吸引力(并且因此解释为什么最初将IPC添加至MM而非LM中)。测试显示,IPC分子能够被添加至LM中的测试中并且通过将浓度增加为20-50倍仍在假定核酸酶活性的存在下被检测到,但是即使在阴性血液培养物样品中仍检测到高背景水平(图3)。在这种情况下,背景可能是由于在检测PCR反应中产生干扰的部分消化的寡核苷酸的存在造成的。显然地,高背景水平可以降低测试的敏感性,尤其是当试图检测非常低数量的细菌时。虽然增加LM中IPC的量可以被认为是解决由于核酸酶活性损失靶DNA分子的问题的方案,但是它仅掩盖该问题,并且如前所述的可以造成较高的背景水平。增加污染核酸酶活性低的样品中IPC分子的量也可以通过增加检测PCR中反应组分的竞争而降低测试敏感性,从而降低该测试检测靶底物的能力。需要解决推定核酸酶问题的更好方案。保护ETGA底物和IPC免受核酸酶活性影响基于IPC分子应该被包括在LM中并且核酸酶活性可对ETGA测试具有有害影响的假设,尝试保护DNA靶(IPC和ETGA底物)免受核酸酶降解。可以通过各种手段、通过修饰(例如甲基化、末端修饰)或在合成寡核苷酸的合成期间使用非标准核苷酸(例如锁核酸、硫代磷酸酯核苷酸)来保护DNA免受核酸酶活性影响。已经发现与细菌相比,ETGA测试对酵母较不敏感。出现这种情况的原因未知,但是可能是由于以下原因的组合,如,与细菌酶相比细胞中真菌酶的体外活性或绝对量的差异,或对抑制剂的敏感性。PTO寡聚物在ETGA测试中的用途的证实将一般方案中的LM中的标准ETGA底物和IPC寡聚物用具有相同核苷酸序列的硫代磷酸酯寡聚物(PTO)替代。将PTO修饰的ETGA底物以0.01μM添加至LM中并且将PTO修饰的IPC以足以在50个循环的PCR反应中达到37-41的ct值的量进行添加。使用原始ETGA测试方案,用标准寡聚物并用PTO修饰的寡聚物对血液培养物中的系列稀释的酵母细胞(105、104、103和0cfu/ml)进行测试。在完全相同的掺料血液培养物中运行两个测试(图4)。数据显示,用标准寡聚物进行的ETGA测试产生了包括高背景水平(这可以已经妨碍了低水平酵母细胞的检测)的结果,而用PTO修饰的寡聚物获得的结果并未遭受同样的影响。事实上结果显示,PTO寡聚物将相同培养标本上的总体背景降至不可检测的水平,因此允许降低qPCR反应中的阈值水平并且潜在地增加ETGA测试的敏感性。注意当使用标准寡聚物时,由于检测到的背景荧光的量,将阈值水平设为50个单位,但是当使用PTO寡聚物时,能够将阈值水平降至10个单位或更低(如果需要的话)。与使用标准寡聚物时相比,在PCR反应中稍后检测到PTO寡聚物,但是PTOqPCR反应却能够运行更久(50个而非40个循环),因为背景水平是如此之低。这种背景减少的结果意味着能够用PTO寡聚物检测到更低水平的微生物负载(在这个实施例中,低至103cfu/ml),这是先前在使用标准寡聚物时检测不到的。在一项另外的实验中,在ETGA测试中使用底物分子(MWG-Eurofins)的核酸酶耐受性PTO版本。将系列稀释的酵母过夜培养物用于对血液培养物进行人工掺料(然后将血液培养物的样品涂布在SDA上,以确认总活菌计数)。然后通过使用标准寡聚物的ETGA测试和使用PTO寡聚物的ETGA测试对每个悬浮液进行测试。通过使用PTO大大改进了酵母检测的敏感性。注意PTO结果被标绘在与标准测试不同的y-轴上,这是由于PCR循环的数量不同。虚线指示阴性对照(没有任何微生物的血液培养物)的Ct值。来自这个实验的数据显示,PTO底物被示出将酵母检测(图5)改进了1000倍,并且此外,它没有展现出提高背景水平的效应。PTO底物能够用于增加ETGA测试的敏感性的发现是非常显著的。实施例2-减少ETGA测试中的假阴性测试结果一般方案对于10mL标本对于每个样品,将10mL血液培养物(添加或未添加微生物,具有或不具有血液)与3.33mL试剂A(5%w/v皂苷,5%w/vTween20,8.5g/L氯化钠)在15mLFalcon管中混合并在室温下孵育15min。将每个样品以3600g离心8min,然后倒掉上清液并且将管的边缘在干净的实验室薄纸上轻触。然后将每个沉淀重悬于5mL试剂B(5mMNaOH)中并孵育5min。孵育之后,将样品再次离心并且通过倒掉去除上清液。将剩余的沉淀重悬于1mL试剂C(1.32g/L硫酸铵,0.49g/L七水硫酸镁,0.75g/L氯化钾,20mMTris-HCl,pH8.0)中并立即转移到1.5mL含有玻璃珠混合物的微量离心管中。以7300xg另外离心3min以用玻璃珠沉淀任何悬浮的细胞,并且再次去除并弃去上清液。将50μL微生物裂解混合物(LM;含有ETGA底物,参见以上实施例1中的表1)添加至玻璃珠中并以2800rpm放置在DisruptorGenie细胞破碎仪中6min以裂解微生物细胞。破碎之后,将样品置于37℃加热块中并孵育20min,然后转移到另一个95℃的加热块中并孵育5min。孵育之后,将样品冷却至室温同时制备PCR试剂。冷却之后,将3μL样品上清液添加至SmartCyclerPCR管(Cepheid)中的27μL的PCR主混合物(MM;含有通用Taq聚合酶PCR主混合物、ETGA底物的引物、内部阳性对照–IPC–DNA、ETGA底物的FAM标记的探针、IPC的德克萨斯红标记的探针和UDG酶)中。将样品置于SmartCyclerPCR中并使其经受以下反应条件;1个循环;40℃10min,50℃10min,95℃5min40-50个循环:95℃5sec,61℃20sec,72℃20sec。贯穿整个反应在SmartCycler的德克萨斯红和FAM激发/检测通道中实时监测扩增。对于1mL标本对于每个样品,将1mL血液培养物与0.333mL试剂A(5%w/v皂苷,5%w/vTween20,8.5g/L氯化钠)在1.5mL微量离心管中混合并在室温下孵育15min。将每个样品以7300g离心3min,然后倒掉上清液并且将管的边缘在干净的实验室薄纸上轻触。然后将每个沉淀重悬于1mL试剂B(5mMNaOH)中并孵育5min。孵育之后,将样品再次离心并且通过倒掉去除上清液。将剩余的沉淀重悬于0.5mL试剂C(1.32g/L硫酸铵,0.49g/L七水硫酸镁,0.75g/L氯化钾,20mMTris-HCl,pH8.0)中并立即转移到含有玻璃珠混合物的新管中。进行另外的离心以用玻璃珠沉淀任何悬浮的细胞,并且再次去除并弃去上清液。然后如先前针对10mL方案所描述的进行微生物裂解和PCR检测。PCR反应组分和底物按照以上实施例1.背景被鉴定为Haemophilusinfluenzae的单个临床微生物分离株在临床性能评价期间在ETGA测试中给出了假阴性结果。在BiomerieuxBact/ALERT血液培养基中通过标准自动化血液培养对该微生物进行了检测。当将培养的微生物细胞掺料添加至ETGA测试的不同阶段中时,发现仅当在NaOH洗涤步骤(试剂B)之后添加时检测到H.influenzae菌株。发现其他更强壮的细菌物种当从开始添加至测试中时是可检测到的(参见图6)。结果指示,H.influenzae的菌株对NaOH洗涤步骤(或直到并包括NaOH洗涤步骤的步骤组合)特别敏感。这种结果并非在所有H.influenzae菌株中都是典型的,并且迄今仅与此菌株相关。该分离株被用作用以开发在检测较不强壮的微生物方面更好的新的ETGA程序的模式‘弱’生物体。在NaOH中进行孵育是ETGA方案中必须进行的必要步骤,以使游离聚合酶失活、减少污染物并减少背景。因此尝试减少NaOH的损害效应而不会有害地影响测试结果。不可以降低NaOH的浓度,因为这不会去除足够的污染材料,从而导致测试失败。结果-减少样品向NaOH的暴露在一般10mL方案中,注意离心样品所花的时间将样品向NaOH的暴露总时间增加了8min。缩短时间长度可以通过中和碱,或至少在最佳孵育时间段之后通过向NaOH中添加1mL的200mMTris-HCl缓冲液(pH7.2)降低样品的pH来实现和控制。在取自BacT/ALERTSA瓶(没有添加血液)的培养基中的H.influenzae悬浮液上进行10mL标本的一般方案。结果表明,中和NaOH(或显著降低其pH)导致更低的ct值(来自相同的样品)并且因此改进检测敏感性(参见图7)。数据还表明,更短的孵育时间将是更好的,但是短孵育时间不允许充分地去除污染物以使得PCR扩增可靠,导致反应失败或高背景水平和假阳性结果。NaOH处理之后降低样品的pH能够潜在地通过添加任何适合的缓冲液或酸来实现。降低pH的优选方法将是使用试剂C(Tris-HCl缓冲液,pH8),因为该试剂已经被用于测试中。结果–一种优选的实施方案,1mLH.influenzae和S.aureus两者在1mL标本的一般方案中的检测都能够通过用更复杂的步骤替代原始NaOH步骤来改进,所述更复杂的步骤由重悬于0.75mLNaOH中、在室温下孵育5min、然后添加0.5mL试剂C以降低pH组成。图8中总结的结果显示,与原始1mL方案相比,当使用pH降低方案时来自在所有含微生物样品上的ETGA测试的ct值更低,表明pH降低方案改进了检测。实施例3–95℃的重要性和PTO底物的用途的分析目的在这个实施例中示出的工作的目的是评估95℃步骤对CognitorMinus测试的性能的影响。使用加入了细菌的血液培养液样品进行具有或不具有95℃步骤的CognitorMinus测试,以比较以下特征:·获得的Ct值·完成样品制备后在不同时间点通过QPCR测量的ETGA模板DNA的稳定性·与硫代磷酸酯修饰的寡核苷酸(PTO)ETGA底物对照,当裂解混合物(LM)含有未修饰的寡核苷酸(UMO)ETGA底物时,获得的Ct值和ETGA模板DNA的稳定性。介绍CognitorMinus测试中的早期步骤旨在裂解血细胞并洗掉血液来源的蛋白质(如DNA聚合酶),这将产生非微生物来源的ETGA模板DNA和可以消化微生物来源的ETGA模板DNA的核酸酶。然后通过添加裂解混合物(LM)和珠磨裂解任何的所得完整微生物。微生物裂解和ETGA反应后,样品含有微生物蛋白质、LM组分、新合成的ETGA模板DNA和残余血细胞蛋白质的混合物。95℃步骤旨在使所有蛋白质变性以保护ETGA模板DNA和内部处理对照(IPC)DNA免于被核酸酶消化,这样使得其能够通过QPCR被成功地检测到。为了评估95℃步骤的重要性,使用加入了细菌的血液培养物进行具有或不具有95℃步骤的CognitorMinus测试。在三个时间点通过QPCR对样品进行分析:样品制备之后即刻;在室温下2小时之后;和在4℃另外18小时之后。目的在于比较获得的Ct值和Ct值跨三个时间点的一致性作为ETGA模板DNA稳定性的指标。使用含有UMOETGA底物的LM进行一项另外的实验,以测试所得ETGA模板DNA的稳定性是否与含有PTOETGA底物的LM的不同。材料与方法所使用的试剂试剂A-5%(w/v)皂苷、5%(v/v)Tween20和146mM氯化钠试剂B-5mM氢氧化钠。试剂C-10mM硫酸铵、2mM七水硫酸镁、10mM氯化钾和20mMTris-HCl[pH8.0]。裂解混合物(LM),由L1、L2、L3、dNTP、PTO-IPC原液构成:·L1(252mL,在360mLLM中)-1.46%(w/v)BSA、0.15%(v/v)TritonX100和0.15%(v/v)Tween20;·L2(36mL,在360mLLM中)-100mM硫酸铵、20mM七水硫酸镁、100mM氯化钾和200mMTris-HCl[pH8.0];·L3(36mL,在360mLLM中)-0.1μMPTO-AS寡聚物、0.1μMPTO-S1寡核苷酸、20mMTris-HCl[pH8.5]、10mM氯化钾和10μMEDTA;·10mMdNTP(3.6mL,在360mLLM中)·PTO-IPC原液(约180μL,在360mLLM中)*注意:浓度可变·H2O(约32.22mL,在360mLLM中)方法1:在加入了E.coli的血液培养液上的具有和不具有95℃步骤的CognitorMinus测试使Escherichiacoli(25922TM)在营养培养液中在37℃下生长18小时。用E.coli将BacT/ALERTSA血液培养液(山羊血)接种至大约1x107cfu/mL、1x106cfu/mL、1x105cfu/mL、1x104cfu/mL和1x103cfu/mL。制备两组1ml样品,用于具有或不具有95℃步骤的测试。制备总活菌计数(TVC)板以确认cfu/mL值。还制备了两组仅血液培养液‘无加入’对照(NSC)、阳性对照(仅培养液加DNA聚合酶)和阴性对照(仅培养液),给出了总共16个样品(参见表2)。向每个1mL样品中添加330μL试剂A并通过将管倒置五次进行混合。将样品在室温下(大约19℃)孵育15分钟并且然后以7300RCF离心3分钟。离心后,将上清液倾入临床废物容器中,并且将开口管在无菌薄纸上印迹。通过枪头混合将每个沉淀重悬于750μL试剂B中并在室温下孵育5分钟。接着,将500μL试剂C添加至每个样品中并通过将管倒置三次进行混合。将样品以7300RCF离心3分钟。将所得上清液倾入临床废物容器中,并且将开口管在无菌薄纸上印迹。通过枪头混合将每个沉淀重悬于500μL试剂C中,转移到含有玻璃珠(0.1mm和0.5mm玻璃珠)的珠磨管中,并以7300RCF离心3分钟。离心后,通过移液管将上清液转移到废物中。将50μLLM添加至每个样品中,并且将另外10μL的DNA聚合酶溶液添加至阳性对照样品中。然后将样品放置到DisruptorGenie中并以2800rpm运行6min。珠磨之后,将样品转移到37℃的加热块组中并孵育20分钟。37℃微生物裂解(ETGA)步骤后,将95℃(-)样品(样品9-16)即刻送至QPCR设置,而将95℃(+)样品(样品1-8)在QPCR设置之前在95℃下孵育5分钟。立即通过QPCR对两组样品进行分析。在室温下(大约19℃)2小时之后再次通过QPCR对相同样品进行分析,并且在4℃下另外18小时之后再次进行分析。将这个实验重复四次,以允许对结果进行统计分析。表2–测试样品95℃(+)样品95℃(-)样品1.E.coli1x107cfu/mL9.E.coli1x107cfu/mL2.E.coli1x106cfu/mL10.E.coli1x106cfu/mL3.E.coli1x105cfu/mL11.E.coli1x105cfu/mL4.E.coli1x104cfu/mL12.E.coli1x104cfu/mL5.E.coli1x103cfu/mL13.E.coli1x103cfu/mL6.仅血液培养液(NSC)14.仅血液培养液(NSC)7.阳性对照(Pol+ve)15.阳性对照(Pol+ve)8.阴性对照(Pol-ve)16.仅培养液(Pol-ve)NSC:无加入对照方法2:PTOETGA底物对比UMOETGA底物用E.coli将BacT/ALERT血液培养液SA接种至大约1x107cfu/mL和1x104cfu/mL。制备四组1ml样品,以比较使用和不使用PTO、具有和不具有95℃步骤的CognitorMinus测试结果。制备TVC板以确认cfu/mL值。还制备了NSC和阳性对照(参见表3)。根据在上文的“方法1”中描述的一般方案处理所有样品。37℃微生物裂解(ETGA)步骤后,将95℃(-)样品(样品9-16)即刻送至QPCR设置,而将95℃(+)样品(样品1-8)在QPCR设置之前在95℃下孵育5分钟。立即通过QPCR对两组样品进行分析。在室温下2小时之后通过QPCR对相同样品进行分析,并且在4℃下另外18小时后再次进行分析。表3–测试样品95℃(+)样品95℃(-)样品1.E.coli1x107cfu/mL:UMOLM9.E.coli1x107cfu/mL:UMOLM2.E.coli1x107cfu/mL:PTOLM10.E.coli1x107cfu/mL:PTOLM3.E.coli1x104cfu/mL:UMOLM11.E.coli1x104cfu/mL:UMOLM4.E.coli1x104cfu/mL:PTOLM12.E.coli1x104cfu/mL:PTOLM5.仅血液培养液(NSC):UMOLM13.仅血液培养液(NSC):UMOLM6.仅血液培养液(NSC):PTOLM14.仅血液培养液(NSC):PTOLM7.阳性对照(Pol+ve):UMOLM15.阳性对照(Pol+ve):UMOLM8.阳性对照(Pol+ve):PTOLM16.阳性对照(Pol+ve):PTOLMNSC:无加入对照,UMO:未修饰的寡核苷酸,PTO:硫代磷酸酯寡核苷酸,LM:裂解混合物结果与讨论结果1:除去95℃步骤改进了ETGAQPCR信号并且信号随时间不减少在图9A-C中示出了样品制备(n=3)后在时间0、2和20小时用或不用95℃步骤处理的样品的结果。在单独的实验内,对于所有加入了E.coli的血液培养液稀释物和阳性对照而言,除去95℃步骤导致Ct值减小(ETGA信号增加)(图9A-C)。在时间0、2和20小时针对相同样品获得的Ct值跨三个重复实验是高度一致的,其中95℃(+)样品的最大ΔCt值范围从0.07Ct单位至1.07Ct单位(平均最大ΔCt值为0.30Ct单位),95℃(-)样品的最大ΔCt值范围从0.03Ct单位至0.58Ct单位(平均最大ΔCt值为0.38Ct单位)。所有NSC和阴性对照都产生了大于40的Ct值或者完全没有QPCR扩增(数据未示出)。图10示出了一起标绘的加入了E.coli的血液培养液样品的所有数据,并且若干趋势是明显的。首先,与95℃(-)样品相比95℃(+)样品获得的Ct值之间的差异明显,其中95℃(-)样品的Ct值大约为1.0Ct单位减小。其次,对于95℃(+)和95℃(-)两种样品而言,在不同时间点获得的Ct值之间差异极小。然而,当除去95℃步骤时,随着储存时间增加Ct值有小的降低,这由图10中的趋势线是显而易见的并且在实验3(图9B)中更显著。进行线性建模(使用R),以确定在针对进行或不进行95℃步骤和在不同时间点的加入了E.coli的血液培养液系列稀释获得的Ct值之间是否存在统计学显著差异。表4示出了针对不同比较获得的p-值。使用来自所有四个实验的数据的95℃(+)样品与95℃(-)样品的Ct值比较产生了高度显著的p-值(p<0.001),无论来自单独时间点的数据还是来自所有时间点的数据被包括在分析中。使用来自所有四个实验的数据的在95℃(+)或95℃(-)数据集内的不同时间点的Ct值比较产生了非显著p-值(p>0.05)。在相同实验内的时间点比较对于所有数据集而言产生了非显著p-值(p>0.05),实验3(T3)中的95℃(-)数据集除外,它的p-值为0.016。这个显著性p-值可能是由于Ct值随时间减小更显著,在这个特定实验中观察到了这种现象。表4-用以比较加入了E.coli的血液培养物系列稀释在不同时间点和进行或不进行95℃步骤的Ct值标准曲线的线性模型(使用R)。所分析的数据比较P-值显著性所有数据95℃(+)对比95℃(-)<2x10-16***时间0H:T1-T4数据95℃(+)对比95℃(-)4.82x10-8***时间2H:T2-T4数据95℃(+)对比95℃(-)1.31x10-8***时间20H:T2-T4数据95℃(+)对比95℃(-)1.47x10-10***95℃(+):T1-T4数据时间0.730-95℃(-):T1-T4数据时间0.094-95℃(+):仅T2数据时间0.896-95℃(-):仅T2数据时间0.657-95℃(+):仅T3数据时间0.956-95℃(-):仅T3数据时间0.016*95℃(+):仅T4数据时间0.769-95℃(-):仅T4数据时间0.061-显著性代码:*p<0.05,**p<0.01,***p<0.001。-:不显著。T:实验。结果2:当使用PTOLM而非UMOLM时,跨不同时间点的CognitorMinus结果更一致图11A-B示出了用和不用95℃步骤、使用UMOLM(图11A)或PTOLM(图11B)处理的加入了E.coli的血液培养液样品(1x107cfu/mL和1x104cfu/mL)和阳性对照获得的Ct值。这里示出的数据来自单个实验。使用UMOLM的NSC的Ct值全部比针对加入了1x103cfu/mLE.coli的血液培养液样品获得的Ct值高至少5Ct单位,而PTOLMNSCCt值全部大于42.0Ct单位或者完全没有QPCR扩增(数据未示出)。结果表明,UMOLM样品的Ct值平均比PTOLM样品的Ct值低10.2Ct单位。当除去95℃步骤时,与PTOLM样品的Ct值相比,UMOLM样品的Ct值减小也更大。最重要的是,就ETGA模板DNA稳定性而言,与PTOLM样品的Ct值相比,针对UMOLM样品获得的Ct值跨不同时间点显著地更不一致。在UMOLM95℃(+)数据集中加入了E.coli的血液培养液样品的Ct值从2小时到20小时增加了大约1.0Ct单位,而对应的阳性对照示出了0.24Ct单位的Ct值减小。这指示,尽管存在95℃步骤的蛋白质变性效应,当存在细菌和/或宿主血细胞时,ETGA模板DNA的核酸酶消化仍可在样品中发生,但是不会在仅添加了DNA聚合酶的阳性对照中发生。当除去95℃步骤时,UMOLM样品的Ct值随样品储存时间的增加而降低。这指示,在不存在蛋白质变性的情况下,连续的ETGA模板生成可以胜过核酸酶消化的任何增加,因而使得ETGAQPCR信号增加。PTOLM数据(图11B)表明,针对95℃(+)和95℃(-)两种样品,Ct值跨所有时间点是高度一致的。这些数据指示,37℃ETGA反应后。由PTO底物DNA形成的ETGA模板DNA更耐受由核酸酶降解和/或另外的ETGA模板DNA生成造成的变化。总结这里示出的数据表明,当除去95℃步骤时,ETGA模板DNA检测得到了改进。此外,在不存在95℃步骤的情况下,ETGAQPCR信号不会随样品储存时间的增加而劣化。PTOLM与UMOLM的比较指示,ETGA模板DNA的高稳定性依赖于PTOETGA底物DNA的使用。这里示出的所有数据都支持从CognitorMinus测试中除去95℃步骤。值得注意的是,测试的敏感性增加可以增加检测到背景信号(血液来源的ETGA信号)的机会;然而,优化其他因素(如血液裂解/洗涤性能)和解释QPCR结果应该消除其影响。实施例4–95℃的重要性和PTO底物的用途的分析:主面板微生物目的在此报告中呈现的工作的目的在于:1.比较所有主面板微生物(primarypanelmicroorganisms)(E.coli;S.aureus;和C.albicans)的进行和不进行95℃步骤的CognitorMinus结果2.确认实施例3关于硫代磷酸酯修饰的寡核苷酸(PTO)LM和未修饰的寡核苷酸(UMO)LM之间的比较的发现3.测试延长的样品储存持续时间(长达72小时)对每种主面板微生物的使用PTOLM和UMOLM的QPCR结果的影响介绍CognitorMinus测试中的早期步骤旨在裂解血细胞并洗掉血液来源的蛋白质(如DNA聚合酶),这将产生非微生物来源的ETGA模板DNA和可以消化微生物来源的ETGA模板DNA的核酸酶。这个过程不应该伤害存在于血液样品中的任何微生物。然后通过添加裂解混合物(LM)和珠磨裂解分离的完整微生物。微生物裂解和ETGA反应之后,样品含有微生物蛋白质、LM组分、新合成的ETGA模板DNA和残余血细胞蛋白质的混合物。在当前CognitorMinus测试方案中,95℃步骤旨在使所有蛋白质变性以保护ETGA模板DNA和内部处理对照(IPC)DNA免于被核酸酶消化,这样使得其可以通过QPCR被成功地检测到。95℃步骤也使DNA聚合酶失活,从而淬灭ETGA反应。然而,由于将95℃步骤并入该方案中,用于在LM中形成ETGA底物(和IPC)的UMO已经被具有核酸酶耐受性的PTO替代。虽然形成ETGA模板的ETGA延伸链构建自标准dNTP,但是它所退火的PTO底物DNA可赋予免于被核酸酶消化的保护。归因于除去95℃步骤的益处,如方案简化和运行测试所需的时间减少,重新评价95℃步骤的必要性被认为是重要的。为了评估95℃步骤的重要性,使用加入了微生物的血液培养液进行具有或不具有95℃步骤的CognitorMinus测试。在五个时间点通过QPCR对样品进行分析:样品制备之后即刻;在室温下(大约19℃)储存2小时之后;以及在4℃下储存24小时、48小时和72小时之后。获得的Ct值和Ct值跨五个时间点的一致性用于使用PTOLM或UMOLM评估95℃步骤对每种主面板微生物的CognitorMinus测试性能和样品稳定性的影响。材料与方法关于试剂细节,参见实施例3。使Escherichiacoli(25922TM)、Staphylococcusaureus(25923TM)和Candidaalbicans(10231TM)在液体培养基中(E.Coli和S.Aureus在营养培养液中;并且C.Albicans在沙保培养基中)在37℃下生长大约18小时。分别用E.coli、S.aureus和C.albicans将BacT/ALERTSA血液培养液(山羊血;参见表6)接种至大约1x104cfu/mL、1x104cfu/mL和1x105cfu/mL。制备四组1ml样品,用于针对PTOLM和UMOLM的具有或不具有95℃步骤的测试。还制备了仅血液培养液‘无加入’对照(NSC)和阳性对照(仅培养液加DNA聚合酶(PC)),给出了总共20个样品(参见表5)。制备总活菌计数(TVC)板以确认cfu/mL值(参见表7)和阴性血液培养液。向每个1mL样品中添加330μL试剂A并通过将管倒置五次进行混合。将样品在室温下(大约19℃)孵育15分钟然后以7300RCF离心3分钟。离心后,将上清液倾入临床废物容器中,并且将开口管在无菌薄纸上印迹。通过枪头混合将每个沉淀重悬于750μL试剂B中并在室温下孵育5分钟。然后,将500μL试剂C添加至每个样品中并通过将管倒置三次进行混合。将样品以7300RCF离心3分钟。将所得上清液倾入临床废物容器中,并且将开口管在无菌薄纸上印迹。通过枪头混合将每个沉淀重悬于500μL试剂C中,转移到含有玻璃珠(0.1mm和0.5mm玻璃珠)的珠磨管中,并以7300RCF离心3分钟。离心后,通过移液管将上清液转移到废物中。将50μLLM添加至每个样品中,并且将另外10μL的DNA聚合酶溶液添加至阳性对照样品中。然后将样品放置到DisruptorGenie中并以2800rpm运行6min。珠磨之后,将样品转移到37℃的加热块组中并孵育20分钟。37℃微生物裂解(ETGA)步骤后,将95℃(-)样品(样品11-20)即刻送至QPCR设置,而将95℃(+)样品(样品1-10)在QPCR设置之前在95℃下孵育5分钟。立即通过QPCR对两组样品进行分析。在室温下2小时之后通过QPCR再次对相同样品进行分析,并且在4℃下储存24小时、48小时和72小时之后再次进行分析。将这个实验重复三次,以允许对结果进行统计分析。表5–测试样品95℃(+)样品95℃(-)样品1.E.coli1x104cfu/mL:PTOLM11.E.coli1x104cfu/mL:PTOLM2.S.aureus1x104cfu/mL:PTOLM12.S.aureus1x104cfu/mL:PTOLM3.C.albicans1x105cfu/mL:PTOLM13.C.albicans1x105cfu/mL:PTOLM4.PC:PTOLM14.PC:PTOLM5.NSC:PTOLM15.NSC:PTOLM6.E.coli1x104cfu/mL:UMOLM16.E.coli1x104cfu/mL:UMOLM7.S.aureus1x104cfu/mL:UMOLM17.S.aureus1x104cfu/mL:UMOLM8.C.albicans1x105cfu/mL:UMOLM18.C.albicans1x105cfu/mL:UMOLM9.PC:UMOLM19.PC:UMOLM10.NSC:UMOLM20.NSC:UMOLMPC:阳性对照,NSC:无加入对照,UMO:未修饰的寡核苷酸,PTO:硫代磷酸酯寡核苷酸,LM:裂解混合物表6–材料试剂供应商批号有效期山羊血(重复1)TCSBioscience3011200027/04/2015山羊血(重复2)TCSBioscience3021090025/05/2015山羊血(重复3)TCSBioscience3025530008/06/2015表7-微生物TVC微生物实验1TVC(总cfu)实验2TVC(总cfu)实验3TVC(总cfu)E.coli7,20010,20028,200S.aureus4,20023,00023,200C.albicans271,000191,000246,000结果与讨论在图12A-E中示出了在时间0、2、24、48和72小时(n=3)用或不用95℃步骤、使用PTOLM或UMOLM处理的样品的结果。除去95℃步骤改进了ETGAQPCR信号对于PTOLM和UMOLM两者而言,所有未用95℃步骤处理的加入了微生物的血液培养液样品和阳性对照样品都产生了比用95℃步骤处理的对应样品更低的Ct值(更强的ETGA信号)。E.coli、S.aureus和C.albicans以及阳性对照的PTOLM样品在‘0小时’的平均ΔCt值(95℃(+)减95℃(-))分别是0.98Ct单位、1.41Ct单位、0.12Ct单位和1.21Ct单位。E.coli、S.aureus和C.albicans以及阳性对照的UMOLM样品在‘0小时’的平均ΔCt值(95℃(+)减95℃(-))分别是3.91Ct单位、4.10Ct单位、5.36Ct单位和1.20Ct单位。大多数用PTOLM处理的NSC样品由于低QPCR扩增都没有产生Ct值,并且因此在图12A-E中未示出此数据。然而,与95℃(+)样品相比,95℃(-)样品的Ct值扩增充分的发生率更高(7/15的Ct值,相比于2/15的Ct值没有储存持续时间明显趋势;并且所有NSCPTOLMCt值都在42.0Ct单位与45.0Ct单位之间)。用UMOLM处理的NSC样品在‘0小时’产生了平均比未进行95℃步骤低0.42Ct单位的Ct值。未用95℃步骤处理的NSC样品的这种QPCR信号增加预期给出针对阳性样品观察到的信号的普遍增加。当使用PTOLM而非UMOLM时,跨不同时间点的CognitorMinus结果更一致在PTOLM数据集内,所有加入了微生物的血液培养液样品和阳性对照样品跨72小时储存期都产生了高度一致的Ct值,无论样品是否用95℃步骤进行了处理。在UMOLM95℃(+)数据集内,E.coli、S.aureus和阳性对照样品跨72小时储存期产生了相当一致的Ct值,而C.albicans和NSC样品示出的Ct值随时间增加(ETGA信号减少)。C.albicans和NSC样品的这种Ct值增加可能是由于当起始浓度较低时核酸酶活性对ETGA模板DNA浓度的影响较大,如通过这些样品在‘0小时’的Ct值较高所指示的。UMOLM95℃(-)样品示出的Ct值随时间通常降低(ETGAQPCR信号增加),C.albicans和NSC样品除外,其Ct值跨72小时的时间是高度一致的。这指示,对于未用95℃步骤(蛋白质变性)处理的E.coli、S.aureus和阳性对照样品而言,ETGA反应的继续导致QPCR信号增加,胜过了任何核酸酶活性。然而,在核酸酶降解效应看起来更显著的C.albicans和NSC样品中,连续的ETGA反应可以抵消这种降解以提供随时间更稳定的QPCR信号。结果的统计分析进行线性建模(使用R),以确定在针对用或不用95℃步骤处理在不同时间点获得的PTOLM和UMOLM样品Ct值之间是否存在统计学显著差异。对于每个数据集(例如E.coli用PTOLM数据集),相对于以下解释变量及其相互作用对‘Ct’建模:‘Log10cfu’、‘时间’、和‘95℃步骤’。以逐步方式将非显著(p>0.05)相互作用和变量从模型中去除,导致模型简化。然而,如果非显著变量的任何相互作用是显著的(p<0.05),则不从模型中去除它们。因此,每个数据集的最终模型仅含有显著相互作用、显著变量、和形成显著相互作用的非显著变量。在表8中示出了每个变量和相互作用的显著性代码(显著性代码是基于每个相互作用或在模型简化点(如果从模型从最终模型中去除)时变量的p-值)。表8-使用线性建模(在R中)的每个解释变量及其相互作用的p-值的显著性代码显著性代码:***p<0.001,**p<0.01,*p<0.05,~p<0.1,NS-不显著。95℃步骤对使用PTOLM和UMOLM的所有微生物和阳性对照的Ct值都具有显著影响。样品储存持续时间(‘时间’和‘时间’相互作用)对使用PTOLM的任何微生物或阳性对照的Ct值都没有显著影响;并且对于使用UMOLM的C.albicans和阳性对照而言也是非显著的。然而,样品储存持续时间对于使用UMOLM的E.coli和S.aureus是显著变量:最可能由于在这些样品集中针对未用95℃步骤处理的样品观察到的Ct值随时间的减小。95℃步骤对NSCUMOLM数据集没有显著影响;但是样品储存持续时间与95℃步骤之间存在显著相互作用(‘时间:95℃’)。归因于作为低QPCR扩增的结果丢失Ct值,无法在NSCPTOLM数据集上进行统计分析。总结这里示出的数据表明,当除去95℃步骤时,ETGA模板DNA检测得到了改进。此外,当使用PTOETGA底物DNA处理样品时,在不存在95℃步骤的情况下,ETGAQPCR信号不会随样品储存持续时间的增加而劣化。当使用UMOETGA底物DNA处理样品时,ETGA信号不稳定:在不存在95℃步骤的情况下,ETGAQPCR信号随样品储存持续时间继续增加;并且在具有95℃步骤的情况下,ETGAQPCR信号更可能由于核酸酶降解而不继续产生ETGA模板DNA而劣化。这些结果与实施例3中呈现的结果是一致的。这里示出的所有数据都支持从CognitorMinus测试中除去95℃步骤,并且确认了在LM中使用PTOETGA底物DNA的重要性。这些结果还验证了,使用PTOLM处理的样品可以在4℃下储存长达72小时,而不会对测试结果有害。值得注意的是,当除去95℃步骤时测试的敏感性增加能够增加检测到背景信号(血液来源的ETGAQPCR信号)的机会。然而,虽然NSCPTOLM样品未提供用于比较的完整Ct值集(由于低扩增),但是NSCUMOLM数据集证实与除去95℃相关的ETGAQPCR信号增加对于NSC而言比对于阳性样品而言要低。此外,优化其他因素(如血液裂解/洗涤性能)和解释QPCR结果应该消除其影响。本发明在范围方面不被本文描述的具体实施方案限制。事实上,除本文描述的那些之外,通过以上说明和附图,本发明的不同修改对于本领域技术人员而言都将使显而易见的。此类修改旨在处于所附权利要求书的范围之内。此外,本文所描述的所有实施方案被认为是广泛适用的并且适当时与任何以及所有其他一致的实施方案可结合的。本文引用了多种出版物,其公开内容以其全文通过引用结合。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1