改进的用于制备免疫球蛋白G(IgG)的工艺的制作方法
本发明涉及改进的用于制备免疫球蛋白G(IgG)的工艺。
背景技术:
免疫球蛋白G(IgG)是人体中丰富的抗体同种型。IgG结合至许多不同类型的病原体,包括病毒、细菌和真菌,以保护身体免受感染。因此,IgG在免疫系统的功能中起到关键的作用。人体中存在四种IgG的亚型:IgG1、IgG2、IgG3和IgG4。IgG1和IgG2的是最常见的IgG的类型,占所有IgG的近90%。为便于参考,在涉及IgG的本文件中,IgG旨在涵盖所有的四种类型,以及其任何组合。术语“IgG”还旨在涵盖IVIG(静脉内免疫球蛋白)、SCIG(皮下免疫球蛋白)和IMIG(肌内免疫球蛋白)。
如上所述,IgG在免疫系统的功能中起到关键的作用。已经发现,患有免疫和自身免疫障碍的患者可以从用IgG的治疗获益。可用IgG进行治疗的病症包括原发性免疫缺陷(PID),包括重症联合免疫缺陷(SCID)和普通变化型免疫缺陷(CVID)、和由其他疾病(如慢性淋巴细胞白血病、多发性骨髓瘤或儿童艾滋病)引起的或骨髓移植后的继发性免疫缺陷(SID)。可以治疗的其他病症包括特发性血小板减少性紫癜(ITP)、川崎氏病、系统性红斑狼疮(SLE)、重症肌无力、慢性炎性脱髓鞘性多发性神经病(CIDP)、和多灶性运动神经病(MMN)。IgG还用于许多其他风湿、血液和皮肤病症的治疗。
通常使用常规分馏工艺从汇集的人血浆中分离IgG。在二十世纪40年代早期由科恩(Cohn)开发了冷乙醇分馏工艺,以从人血液中纯化白蛋白(科恩,E.J.(Cohn,E.J.)等人,美国化学会志(J.Am.Chem.Soc.),68:459-475,(1946))。这也称为‘科恩方法6’。
这个工艺基于所希望的蛋白溶解度的差异,溶解度的差异基于pH、乙醇浓度、温度、离子强度和蛋白浓度。在科恩工艺期间中,在分馏过程中将乙醇浓度增加至40%,将pH从中性降低至4.8,并将温度从室温降低至-5℃。随着在工艺期间内条件变化,不同的血浆蛋白依次沉淀出来,其他蛋白保留在溶液中。取决于确切的感兴趣的蛋白,可以进一步加工来自每个分馏步骤的沉淀物和上清液中的任一个或两者。有五个主要的科恩沉淀物馏分,馏分I至V,每个馏分包括不同的蛋白作为其主要组分。例如,从馏分V获得白蛋白,而从馏分II+III可以获得IgG。随后,开发了将科恩馏分II+III(科恩方法6的中间产物)进一步亚分馏成馏分II(更纯化的IgG沉淀物馏分)的方法,并称为‘翁克雷(Oncley)方法9’(翁克雷,J.L.(Oncley,J.L.)等人,美国化学会志,71,541-550(1949))。
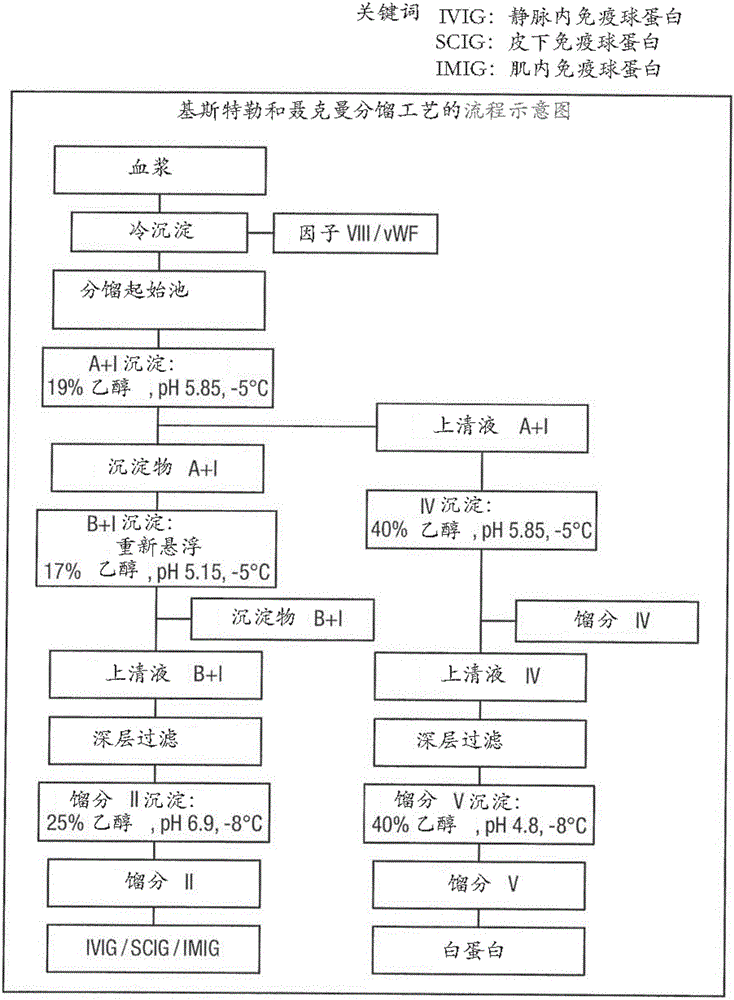
科恩方法存在许多变型,包括盖尔洛(Gerlough)、英克(Hink)和马尔福德(Mulford)方法。基斯特勒和聂克曼(Kistler&Nitschmann)方法是另一个著名的变体(P.基斯特勒(P.Kistler)和Hs.聂克曼(Hs.Nitschmann),血液之声(Vox Sang.)7:414-424(1962))。在该方法中,沉淀物A至C分别代替科恩馏分II+III、III和V。由于它总体上涉及比科恩方法中更少的步骤,具有更快的加工和更低的乙醇使用的优势,该工艺已被广泛接受。
其他纯化IgG的方法包括通过离子交换色谱和聚乙二醇沉淀,从来自科恩方法6的血浆或血浆中间产物II+III直接分离IgG。来自这些工艺的产量是相对高的。由于对纯度,并且尤其是血源性病毒(如肝炎和HIV)传播的担忧,这些方法中的一些已经被停止。然而,特定病毒的灭活步骤的引入导致了近年来在色谱方法中的巨额投资,尽管复杂性,高资本成本和高水/废物处理需求将这种选项限制在除最大和最好资金的血浆分馏器之外的所有方面。
科恩法(及其变体)基本上产生单体IgG。由此,意味着大部分的IgG产物是单体的,不到20%的IgG处于二聚体以及更大的聚集体的形式。一般,IgG聚集体的存在是不期望的,因为在接受源自血浆的IgG的患者中,它已连接至不想要的免疫应答。因此,期望通过任何纯化工艺获得的IgG产物包含尽可能多的单体。
在1998年至2006年之间对IgG的需求增加了一倍以上,并且需求继续增长。2008年,血浆馏分的全球市场估计为120亿美元,几乎一半是IgG。目前,供应必须来自人类供体捐赠的血浆。由于存在有限的血浆供应,因此本领域需要用于分离具有改进的产量的IgG的改进工艺。然而,对于所有临床应用,重要的是具有高纯度的IgG以便最小化任何不希望的副作用,例如,由其他蛋白酶或凝结因子,或其他污染组分,如血源性病毒的存在导致的。
J.A.胡珀(J.A.Hooper)在北美免疫学与变态反应临床(Immunol.Allergy Clin.N.Am.)28(2008)765-778,以及安德里亚布沙尔(Andrea Buchacher)和沃特露德卡尔(Waltrud Kaar)在生产用于治疗用途的血浆蛋白(Production of Plasma Proteins for Therapeutic Use)(约翰·威利父子公司(John Wiley&Sons,Inc.),2013年,约瑟夫·贝尔托利尼(Joseph Bertolini)、尼尔·戈斯(Neil Goss)和约翰柯林(John Curling)编辑)的第13章中描述了各种用于制备商用IgG配制品的方法。大多数批准使用的IgG产物是通过冷乙醇分馏(即科恩/翁克雷方法或其变体),随后通过使用离子交换色谱进行纯化产生的。因为IgG的主要损失发生在科恩/翁克雷(基斯特勒和聂克曼)分馏工艺的后续馏分III(沉淀物B)的阶段,通过使用I+II+III(或II+III,如果纤维蛋白原在馏分I中较早沉淀)作为用于离子交换色谱的起始物质来使IgG的损失最小化。
任何蛋白纯化方案中所固有的是,从被视为对该过程是多余的任何不想要的蛋白和任何其他不想要的物质中分离目标蛋白。此类其他物质可以包括在目标产物中不希望的其他化学部分(包括有害或致病物质)。因此,蛋白纯化工艺通常产生包含感兴趣的蛋白和所谓的“废物”或“副”的馏分的“产物馏分”。然而,这样轻视的分类可能会产生误导,因为这些所谓的“废物馏分”作为其他蛋白或组分物质的来源物质可能仍然具有价值。
在血浆蛋白的领域中,在AU 715427 B2中发现了这种误导性命名的证据,该AU 715427 B2描述了使用“废物馏分”作为用于通过亲和色谱纯化特定的免疫球蛋白的原料的用途。类似地,JPS 601134 A描述了废物馏分作为用于通过梯度电泳纯化免疫球蛋白的原料的用途。WO 2010/132686 A1描述了使用来自IgG的分馏的废弃馏分以纯化存在于该馏分中的聚集的免疫球蛋白。
UA 45557 U通过描述正常血浆分馏工艺证明了术语“废物馏分”的替代使用,该正常血浆分馏工艺程被应用于由于丙型肝炎病原体的标志物的污染而作为“废物”所拒绝的血浆捐赠物。
仍有一个未解决的问题,即在科恩/翁克雷工艺及其变体(在下文中简称为主要工艺流)的IgG产量小于血浆中存在的IgG的总量。这可以反映了在制造工艺中蛋白的一些变性。另外地或可替代地,可以通过捕获在分离的和除去的“废物”馏分(这些馏分还包含其他组分,包括多聚的和聚集的IgG)中,将少量残留量的高质量免疫球蛋白(即非聚集的,主要是单体的IgG)从主要的制造分馏途径中分离。这损害了从稀有血浆起始物质有效回收有价值的免疫球蛋白,从而对患者有益的治疗产物的可用性产生影响。
在本申请的上下文中,术语“废物馏分”定义为与所希望的“主要产物馏分”分离的馏分。产物馏分将通常包含所希望的高纯度的目标蛋白。所谓的废物馏分将包含一些目标蛋白,尽管与可能损害目标蛋白的质量、有效性或安全性的其他组分组合。废物馏分实际上作为除目标蛋白以外的蛋白来源可以是有价值的。在本申请中,目标蛋白是免疫球蛋白IgG。
因此,在纯化血浆以提取IgG的过程中,主要工艺流是生成IgG产物的工艺流。如果主要工艺是科恩分馏工艺,则主要的产物馏分是科恩馏分II。在产生IgG的科恩分馏工艺中,上清液A+I被认为是“废物”,因为它不包含显著量的IgG。然而,如图1所证实的,可进一步纯化这种的废物,以产生其他目标蛋白。例如,可以进一步加工上清液A+I,以产生包含白蛋白的科恩馏分V。因此,当来自血浆分馏工艺的感兴趣的主要蛋白是除了白蛋白以外的任何物质时,上清液A+I仅是“废物馏分”。
已经发现,在科恩/翁克雷工艺中产生的废物馏分(以及其变体)可以包含显著量的IgG。已经显示,该废物馏分可以包含在起始血浆中高达总量30%的IgG。
提供用于生产IgG的改进的工艺将是有利的,这些工艺可以具有比目前可用的方法更高的产量,同时保持高水平的纯度和安全性,并且这些工艺不需要额外的复杂和昂贵的色谱步骤。
技术实现要素:
现在已经令人惊讶地发现,可以相对容易地从沉淀物馏分(这些沉淀物馏分在产生IgG的血浆分馏工艺期间先前被认为是“废物”馏分)获得高纯度的IgG(例如,符合欧洲药典专论0338的正常免疫球蛋白,该正常免疫球蛋白包括不少于85wt.%的单体和二聚体以及不超过10wt.%的聚合物和/或聚集体),而不需要色谱步骤,并且特别是不需要亲和或阴离子交换色谱步骤。通过从这些废物馏分中提取IgG,可以显著提高IgG的总产量,而不需要额外的后续纯化步骤。
因此,本发明提供了在血浆分馏期间产生的废物沉淀物馏分作为IgG来源的用途。优选地,废物沉淀物馏分是在生产包含IgG的液体馏分(上清液)的分馏步骤期间产生的。
更具体地说,本发明提供了一种用于从废物沉淀物馏分中提取IgG的方法,该废物沉淀物馏分在血浆分馏期间产生,并且该废物沉淀物馏分从主要的IgG制造工艺流中分离,该方法包括将废物沉淀物与合适的溶剂接触以从废物沉淀物中提取IgG。优选地,废物沉淀物馏分是在生产包含IgG的液体馏分(上清液)的分馏步骤期间产生的。特别是,本发明的方法不需要任何色谱步骤,如亲和色谱或阴离子交换色谱,并且不需要用于从血浆分馏期间产生的废物沉淀物馏分中分离IgG的电学工艺,例如电泳。
在另一个方面,本发明提供了在产生IgG的血浆分馏期间用于提高IgG产量的方法,该方法包括:使用合适的溶剂从废物沉淀物馏分中提取IgG,该废物沉淀物馏分是在血浆分馏期间产生的并且与主要的IgG制造加工流分离。优选地,废物沉淀物馏分是在生产包含IgG的液体馏分(上清液)的分馏步骤期间产生的。
在另一个方面,本发明提供了用于从血浆或血浆馏分中分离IgG的方法,该方法包括
a)分馏血浆或血浆馏分以产生包含血浆或血浆馏分中大部分IgG的液体馏分,和包含另外的IgG的废物沉淀物馏分;并且
b)使用合适的溶剂从废物沉淀物馏分中提取至少一些另外的IgG。
在一个优选的方面,本发明提供了用于制备IgG的方法,该方法包括:
a)从改良的基斯特勒和聂克曼B+I分馏工艺回收沉淀物和上清液;
b)均质化步骤a)中获得的沉淀物,并通过在0℃下在乙酸盐/磷酸盐水性缓冲液中与17vol.%乙醇混合1至3小时从其中提取IgG;并且然后
c)从任何剩余的沉淀物中分离该包含所提取的IgG的缓冲液。
更优选地,上述方法还包括将步骤c)中获得的包含所提取IgG的缓冲液与步骤a)中获得的改良的基斯特勒和聂克曼B+I上清液组合。可替代地,在上述方法中,步骤c),并且该方法还包括在根据基斯特勒和聂克曼馏分II沉淀的条件在乙醇水溶液中孵育所提取的IgG;并回收所得的富含IgG的馏分II沉淀物。
在本发明的所有方面,废物沉淀物馏分优选基本上等同于科恩馏分III。更优选地,它是科恩馏分III或I+III、基斯特勒和聂克曼沉淀物B或B+I、或改良的基斯特勒和聂克曼沉淀物B或B+I。
在本发明的所有方面,液体馏分优选基本上等同于科恩馏分III。更优选地,它是科恩上清液III或I+III、或基斯特勒和聂克曼上清液B或B+I、或改良的基斯特勒和聂克曼上清液B或B+I。最优选地,可以将液体馏分重新引入主流科恩上清液III或I+III或改良的基斯特勒和聂克曼上清液B或B+I中,用于IgG的继续下游加工。还可以将它作为单独的子馏分继续处理,,并在馏分II处或在任何合适的后续阶段的进一步下游加工之后重新引入主流加工。可替代地,液体馏分可完全独立地加工成纯化的人IgG产物。
本文对改良的基斯特勒和聂克曼工艺的任何引用是指如在罗伯茨(Roberts)等人,生物制剂(Biologicals),第43(2)卷,2015年3月,第123-129页中所描述的工艺。
附图说明
图1是可用于生产人IgG和白蛋白的改良的基斯特勒和聂克曼冷乙醇分馏工艺的示意图。
图2是示意图,该示意图显示了可以如何将本发明的工艺整合到改良的基斯特勒和聂克曼冷乙醇分馏工艺中。
图3是示意图,该示意图显示了用于生产IgG的改良的基斯特勒和聂克曼冷乙醇分馏工艺。
图4是示意图,该示意图显示了合并本发明的另外的馏分B+1洗涤步骤的图3的改良的基斯特勒和聂克曼冷乙醇分馏工艺,该工艺具有用于将另外所回收的IgG重新引入工艺流的可替代阶段。
图5是示意图,该示意图显示了具有本发明的另外的馏分III/I+III洗涤步骤的科恩/翁克雷分馏工艺,该工艺具有用于将另外所回收的IgG重新引入工艺流中的可替代阶段。
具体实施方式
在下文中,术语“液体馏分”和“上清液”是等同的,术语“沉淀物”和“馏分”也是如此。
在本文所述的方法中获得的IgG产物具有高纯度,具有最小的聚集的IgG,并且因此满足欧洲药典专论0338(01/2015)提出的纯度最低标准。因此,通过本文所述的方法直接获得的IgG的产物包含至少90%的丙种球蛋白,如通过电泳所测定的。通过这些方法获得的产物还包含至少85wt.%的单体和二聚体IgG,具有小于10wt.%的聚合的和聚集的IgG,如通过尺寸排阻色谱法测定的。HPLC还可以用于分析聚集体含量。这意味着,从本文所述的分馏工艺获得的产物有足够的纯度和质量以满足欧洲药典标准,并且因此不是一定需要任何进一步的纯化,以形成药品。当然,通过本文所述的分馏工艺获得的IgG可以通过任何合适的手段进一步加工,以获得更高质量的IgG产物,或者以获得例如替代药物用途的不同的产物谱。这样进一步的处理方法是本领域技术人员众所周知的,并且可以特别包括一个或多个的病毒灭活步骤。
冷乙醇分馏是用于从血浆分离IgG的最广泛使用的方法之一。通常,将来自多个供体的汇集的血浆批次进行冷沉淀,以除去作为冷沉淀物的凝结因子如因子VIII。然后使冷沉淀上清液经受一个或多个冷乙醇分馏步骤,以最终产生主要包含IgG的沉淀物馏分。在经典的科恩/翁克雷工艺和基斯特勒和聂克曼方法中,这种富含IgG的馏分被称为馏分II或沉淀物II。然后,使该沉淀物经受进一步纯化和病毒灭活步骤,以提供药学上可接受的IgG最终产物,用于静脉输注、皮下输注或肌内输注。
“正常血浆”,“超免疫血浆”(如超免疫抗-D,破伤风或乙型肝炎血浆)或与其等同的任何血浆可以用于本文所述的冷乙醇分馏工艺中。
在科恩分馏方法中,在第一分馏步骤产生主要包括纤维蛋白原和纤连蛋白的馏分I。将来自该步骤的上清液进一步加工,以沉淀出馏分II+III,并且然后沉淀出馏分III和II。通常,馏分II+III包含约60%的IgG,以及杂质如纤维蛋白原、IgM和IgA。然后在馏分III中除去大部分这些杂质,其被认为是废物馏分并且通常被丢弃。然后处理上清液以沉淀出的主要包含IgG的馏分,馏分II,其可以包含大于90%的IgG。上述%值是指IgG的纯度%。纯度可以通过本领域已知的任何方法来测量,如凝胶电泳。
在基斯特勒和聂克曼方法中,馏分I等同于科恩方法的馏分I。接下来的沉淀物/馏分被称为沉淀物A(馏分A)。该沉淀物与科恩馏分II+III大致等同,但不相同。然后将沉淀物再溶解,并调节条件以沉淀出的沉淀物B(馏分B),该沉淀物B等同于科恩馏分III。同样,这被认为是废物馏分,并通常被弃去。然后进一步加工沉淀物B上清液以产生对应于科恩馏分II的沉淀物II。
在图1所示的基斯特勒和聂克曼工艺的改良版中,可以组合前两个分馏步骤,这样使得不回收馏分I,并且称为A+I的第一沉淀物包括纤维蛋白原和纤连蛋白。当该沉淀物重新悬浮并经受进一步沉淀步骤时,所形成的沉淀物(其可以称为B+I)包含纤维蛋白原和纤连蛋白以及其他杂质,这些其他杂质包括IgM和IgA。然后将来自该沉淀步骤的上清液进一步加工以产生富含IgG的馏分,馏分II。在涉及IgG工艺流的情况下,在该工艺中的B+I沉淀物也被认为是废物馏分。
原则上,本发明的方法可以应用于在生产馏分II(包括科恩馏分III和馏分I+III和基斯特勒和聂克曼沉淀物B或B+I)之前的冷乙醇分馏期间产生的任何沉淀物馏分。优选地,这些方法适用于在分馏工艺中紧接在馏分II之前的沉淀物馏分,该沉淀物馏分通常被认为是废物馏分。优选地,废物沉淀物馏分是科恩馏分III或I+III、基斯特勒和聂克曼沉淀物B或B+I、改良的基斯特勒和聂克曼沉淀物B或B+I、或基本上与其等同的馏分。
已经发现,这些废物沉淀物馏分可以包含来自起始血浆池的显著量的IgG,在一些情况下高达25%-30%。这被推测部分是由于一些上清液被捕获在沉淀物馏分中,并且部分是由于IgG与杂质如IgM和IgA的共沉淀。
令人惊奇的是,已经发现,通过应用于废物馏分的简单洗涤(提取)工艺,可以回收相对纯形式的商业上显著比例的“丢失的”IgG。该结果是出人意料的,因为本领域技术人员预期,考虑到沉淀物中存在的相对高水平的其他蛋白,从废物沉淀物中提取IgG将是困难的,并且可以提取的任何IgG将是低纯度的(例如,聚集和其他不想要的蛋白种类或蛋白水解活性)。
重要的是注意到,本发明的方法不需要任何色谱步骤从废物馏分中进一步提取IgG。因此,本发明的工艺提供了来自废物馏分相对纯的IgG产物,而不需要色谱法。
已发现选择用于洗涤工艺的合适的溶剂允许从废物沉淀物中提取IgG,而不显著提取沉淀物中存在的任何其他蛋白,这些其他蛋白在涉及IgG纯化的情况下,被认为是杂质。因此,应该选择溶剂以特异性地从沉淀物中除去IgG,而不同时从沉淀物中除去不想要的杂质。
废物沉淀物馏分可以在其产生后立即进行洗涤工艺。可替代地,废物馏分可以以冷冻形式存储用于后续加工。在洗涤之前,如果需要,应该将沉淀物平衡至进行洗涤工艺的温度。这种平衡通常是静止的,即将不涉及沉淀物的任何搅拌。
应选择用于洗涤工艺的溶剂的类型和量,这样使得IgG的回收最大化,而不过度损害所回收的IgG的纯度。为了优化IgG回收,同时最小化从废物沉淀物提取杂质,用于洗涤/提取的溶剂优选相与产生所讨论的废物沉淀物的分馏步骤中使用的溶剂相同。
当废物馏分是(改良的)基斯特勒和聂克曼沉淀物B或B+I,或科恩馏分III或I+III是,优选的溶剂是乙醇水溶液。更优选地,这种乙醇溶液是缓冲的。应控制乙醇浓度、温度和pH,这样使得从沉淀物中提取的IgG保留在溶液中。
优选的乙醇浓度是在约10至约20vol.%的范围内。更优选的是约11至约19vol.%的浓度范围,甚至更优选的是约12至约19vol.%的浓度范围,最优选的是约13至约17vol.%的浓度范围。约13vol.%至约17vol.%是最优选的。“约13vol.%”优选为13±2vol.%,而“约17vol.%”优选为17±2vol.%。
进行该洗涤工艺的温度也将影响所回收的IgG的量和纯度。理想的是,洗涤工艺期间的温度保持在产生所讨论的废物沉淀物的分馏步骤所使用的相同温度下。因此,最佳温度范围将取决于所讨论的馏分和分馏工艺。通常优选的是在约-3℃至约-8℃范围内的温度,包括约-3℃至约-7℃。例如,当废物馏分是(改良的)基斯特勒和聂克曼沉淀物B或B+I时,洗涤提取期间的温度优选为-5℃±2.0℃。当废物馏分是科恩馏分III或I+III时,优选的温度通常稍微更冷,优选地-6℃±2.0℃。
通常优选的是在约-3℃至约-8℃范围内的温度,包括约-3℃至约-7℃。例如,当废物馏分是改良的基斯特勒和聂克曼沉淀物B或B+I时,洗涤提取期间的温度优选为-2℃±5℃。当废物馏分是科恩馏分III或I+III时,优选的温度通常稍微更冷,优选地-3℃±5.0℃。
最佳pH范围还取决于馏分。通常优选的是在约4.8至约5.3范围内的pH,更优选地约5.1至约5.3。例如,当废物馏分是(改良的)基斯特勒和聂克曼沉淀物B或B+I时,pH范围优选为5.1±0.05。当废物馏分是科恩馏分III或I+III时,pH可以稍微更高,优选地5.2±0.05。
在一个特别优选的实施例中,当废物馏分是(改良的)基斯特勒和聂克曼沉淀物B或B+I时,溶剂是17±2vol.%乙醇水溶液,温度为-5℃±2.0℃,并且pH范围是5.1±0.05。
在一个特别优选的实施例中,当废物馏分是(改良的)基斯特勒和聂克曼沉淀物B或B+I时,溶剂是17±2vol.%乙醇水溶液,温度为-2℃±5℃,并且pH范围是5.1±0.05。
在另一个特别优选的实施例中,当废物馏分是科恩馏分III或I+III时,溶剂是17±2vol.%乙醇水溶液,温度为-6℃±2.0℃,并且pH范围是5.2±0.05。
在另一个特别优选的实施例中,当废物馏分是科恩馏分III或I+III时,溶剂是17±2vol.%乙醇水溶液,温度为-3℃±5℃,并且pH值范围是5.2±0.05。
在另一个特别优选的实施例中,当废物馏分是从超免疫血浆或等同血浆制备的(改良的)基斯特勒和聂克曼沉淀物B或B+I时,溶剂是13±2vol.%乙醇水溶液,温度为-5℃±2.0℃,并且pH范围是5.1±0.05。
在另一个特别优选的实施例中,当废物馏分是从超免疫血浆或等同血浆制备的(改良的)基斯特勒和聂克曼沉淀物B或B+I时,溶剂是13±2vol.%乙醇水溶液,温度为-2℃±5℃,并且pH范围是5.1±0.05。
在另一个特别优选的实施例中,当废物馏分是从超免疫血浆或等同血浆制备的科恩馏分III或I+III时,溶剂是13±2vol.%乙醇水溶液,温度为-6℃±2.0℃,并且pH范围是5.2±0.05。
在另一个特别优选的实施例中,当废物馏分是从超免疫血浆或等同血浆制备的科恩馏分III或I+III时,溶剂是13±2vol.%乙醇水溶液,温度为-3℃±5℃,并且pH范围是5.2±0.05。
溶剂可以使用已知的缓冲液(包括磷酸盐和乙酸盐)进行缓冲。
通常,洗涤步骤包括将废物馏分在溶剂中悬浮。混合悬浮液,理想地是直到其均质化,并且然后放置足够的时间以将IgG提取到溶剂中。这对应于图2、4和5中所示的“提取”和“调节”步骤。该悬浮/调节/提取步骤没有具体的时间上限。事实上,所花费的时间将受外部因素如过程效率的限制。出于这个原因,提取时间优选为在1和24小时之间,例如在约2和约10小时之间。约2小时例如90-150分钟的时间也可以是合适的。
在一个优选的方面,本发明提供了用于制备IgG的方法,该方法包括:
a)从改良的基斯特勒和聂克曼B+I分馏工艺回收沉淀物和上清液;
b)均质化步骤a)中获得的该沉淀物,并通过在0℃下在乙酸盐/磷酸盐缓冲液中与17vol.%乙醇水溶液混合1至3小时从其中提取IgG;并且然后
c)从任何剩余的沉淀物中分离该包含所提取的IgG的缓冲液。
更优选地,上述方法还包括将步骤c)中获得的包含所提取IgG的缓冲液与步骤a)中获得的改良的基斯特勒和聂克曼B+I上清液组合。可替代地,在上述方法中,通过过滤进行步骤c),并且该方法还包括根据改良的基斯特勒和聂克曼馏分II沉淀的条件在乙醇水溶液中孵育所提取的IgG;并回收所得的富含IgG的馏分II沉淀物。
通过洗涤/提取步骤产生的富含IgG的溶液优选包含与当废物馏分从建立的IgG目标蛋白制造工艺流沉淀出和/或分离出时产生的主要包含IgG的上清液具有相同或相似纯度的IgG。
考虑到IgG的商业和治疗价值,来自起始血浆的IgG产量的任何改进可能是重要的,并且来自废物馏分的甚至相对低%的IgG回收率可以是非常有价值的。
可以通过本领域已知的任何标准方法回收所得的富含IgG的溶液,例如离心或过滤以将其与剩余的沉淀物分离。如果使用离心,则上清液将富含IgG(即将包含所提取的IgG),并且可以弃去沉淀物,根据本发明再次处理,以进一步提取的IgG和/或用于提取其他蛋白。如果使用过滤,则滤液将富含IgG,并且可以弃去所得的滤饼,进一步冲洗以回收残留夹带的IgG,根据本发明再次处理,以进一步提取IgG和/或用于其他蛋白。适合的过滤介质是本领域已知的。可以添加硅酸盐助滤剂如硅藻土,例如或以促进过滤。
任何体积的溶剂可能用于洗涤工艺中,但理想地应针对可用的加工设备进行优化。如果使用非常小的体积,则所得到的悬浮液可能太粘而不能容易地加工,而非常大的体积可能会导致工艺效率低下。出于工艺效率的原因,因此通常优选保持溶剂体积相对低。例如,废物馏分与溶剂的重量通常为约1:2至约1:10。优选地,溶剂的重量可以是约四倍的废物馏分重量,即废物馏分与溶剂的重量比约为1:4。
据美国和欧洲药典设定的标准,使用本发明的工艺获得的富含IgG的溶液可以通过本领域已知的方法进一步加工,以提供药学上可接受的IgG产物。优选地,使用标准条件从溶液中沉淀馏分II,然后将其进一步纯化以提供药品,如静脉内免疫球蛋白(IVIG)或皮下免疫球蛋白(SCIG)。
进一步的纯化可以采用阴离子和/或阳离子交换色谱的形式,与合适的步骤相组合,以确保IVIG或SCIG的病毒安全性(参见罗伯茨等人,生物制剂,第43(2)卷,2015年3月,第123-129页)。
可以将从废物馏分中提取所得的富含IgG的溶液单独加工,与相同的废物馏分的其他溶剂提取物相组合和/或与来自其他工艺批次的废物馏分的溶剂提取物相组合。然而,将这些溶液与主要目标蛋白下游工艺的大量IgG工艺中间产物组合通常更有效。例如,可以将来自“废物馏分”的溶剂提取的IgG与来自产生有关废物沉淀物的分馏步骤中的富含IgG的上清液组合。这可以是来自相同分馏批次或不同批次的上清液。
可替代地,从废物馏分所提取的IgG可以经历如在主要的IgG工艺中所使用的相同的下游制造步骤中一个或多个,随后在下游工艺阶段与大量的IgG中间产物组合。例如,可以将通过从沉淀物B+I洗涤/提取产生的富含IgG的溶液与B+I上清液组合,然后将其进一步加工成最终产物。可替代地,可以将通过从沉淀物B+I洗涤/提取产生的富含IgG的溶液通过下游工艺步骤如乙醇沉淀加工成馏分II,随后与从B+I上清液加工的主要IgG馏分Ⅱ中间产物组合,并加工成最终产物。根据制造设备和相关物流的可用规模,任一选项可以是优选的。用于提取的最佳溶剂可以部分取决于任何预期后续处理步骤。
可以将所提取的IgG与主要的IgG工艺流重组的各种替代点示于图4和5中。
可以以任何方式组合本发明的优选特征。因此,为清楚起见,可以以任何方式组合本文在单独实施例的上下文中描述的某些特征。相反,为简洁起见,也可以单独地或以任何子组合提供在单个优选特征的上下文中描述的各种特征。此外,对范围中所述的值的引用包括该范围内的每个值。
注意,在一般说明中以上描述的活动并非所有都是必需的,可以不需要一部分特定活动,并且除了所描述的那些之外,可以进行一个或多个其他的活动。再者,列出活动的顺序不一定是进行它们的顺序。
实例
以下非限制性实例进一步说明本发明。
在以下实例/表中,使用‘SpaPlus’自动分析仪(英国伯明翰市结合位点公司(The Binding Site))分析沉淀物和上清液的蛋白含量,该自动分析仪是一个比浊分析平台。使用AssayPro ELISA试剂盒(由英国剑桥市通用生物制剂公司(Universal Biologicals)提供)分析凝血因子VII、IX、XI和XII。使用Hyphen BioPhen显色测定试剂盒(由英国埃普索姆市夸德拉泰克诊断公司(Quadratech Diagnostics)提供,埃普索姆,)测量因子XIa。
下表1示出了B+I沉淀物的典型组成,该B+I沉淀物为通过基斯特勒和聂克曼冷乙醇分馏产生的废物馏分(等同于科恩/翁克雷馏分III)。
表1
下述实验起始物质是包含IgG的沉淀物B+I,该沉淀物B+I具有有类似于表1所示的组合物。
在下面的实例中,如下制备17vol.%的乙醇水溶液缓冲溶液:
磷酸氢二钠二水合物7.1mM(1.27g/L)
冰乙酸12.8mM(0.77g/L)
17vol.%的乙醇在磷酸盐/乙酸盐缓冲液中:添加至858.4g磷酸盐/乙酸缓冲液的141.6g的96%的乙醇(最终pH为约5.0-5.1)。
实例1
在第一个实验中,在pH 4.8至5.2下,在1,000g的17vol.%的乙醇缓冲水溶液的存在下,在约-3℃至-7℃的温度范围下,通过匀浆器快速重新悬浮97g沉淀物B+I,以给出1:10的沉淀物与缓冲液的比例。缓冲液由调节至合适的pH的包含磷酸盐和乙酸盐的17vol.%乙醇水溶液(“乙醇缓冲液”)组成。
在第二个实验中,在约-3℃至-7℃的温度范围下,以相同的方式将99g相同的沉淀物B+I重新悬浮在1,000g的17vol.%的乙醇水溶液(即未缓冲的乙醇溶液)中。然后通过适度搅拌将两种重新悬浮液连续混合,并在所述条件下在24小时内调节(熟化)沉淀物。将缓冲和非缓冲的重新悬浮液的样品离心以回收的富含IgG的液体。针对IgG和若干感兴趣的其他蛋白的存在,分析预离心的悬浮液和上清液(表2)。
表2
分析来自缓冲的和未缓冲的17vol.%乙醇水溶液的重新悬浮的沉淀物B+I和上清液馏分
aNQ=无法定量-标准线的空白和最低点之间的样品OD
NTU=比浊法浊度比例单位,使用在NTU中校准的浊度仪测量
从表2可以看出,在磷酸盐/乙酸盐缓冲的17vol.%乙醇水溶液(“乙醇缓冲液”)和未缓冲的乙醇溶液中的重新悬浮成功地提取了IgG。未缓冲的乙醇上清液提取物包含比缓冲上清液更高浓度的IgG,但是缓冲的乙醇上清液提取物包含具有更高质量的IgG和低得多比例的IgA和IgM。蛋白酶活性、因子XI/XIa和因子XII在缓冲的乙醇上清液提取物中也较低。在IVIG产物中血栓栓塞副作用的高速率与因子XI和XIa相关,并且因此非常希望不将这些重新提取到上清液馏分中。不像乙醇/水提取物,乙醇/缓冲液提取物在组分上与上清液B+I馏分(其接着称为馏分II)相似,并且因此混合的两种馏分的可以产生含有较高的产量IgG的相当纯度的单一馏分II。
来自磷酸盐/乙酸盐缓冲的乙醇水溶液上清液的IgG的产量等同于0.55g的IgG/升血浆,这代表约10%血浆IgG的产量增加,该约10%血浆IgG可以转化为10%-20%的额外产量的IgG最终产物。
实例2
在第二组实验中,研究了降低重新悬浮比例的效果以降低总体积。在一项实验中,将500g的B+I沉淀物重新悬浮于1000g的缓冲的乙醇水溶液(一份沉淀物与两份缓冲液)。在另一个实验中,将250g相同的B+I沉淀物重新悬浮于1000g的乙醇缓冲液中(一份沉淀物与四份缓冲液)。在成熟期间间隔采集样品用于分析(表3)。
表3
在24小时内重新悬浮比例(沉淀物:乙醇缓冲液)对B+I悬浮上清液质量的影响
表3中的数据表明,1:2和1:4的比例能够从沉淀物中提取IgG,并且所提取的IgG的产量和质量比1:4比例更高。例如,1:4上清液的浊度(其是物质质量的总指标)比等同的1:2的重新悬浮上清液低两个数量级。此外,与1:2上清液相比,在1:4上清液中污染物如IgM、IgA和因子XIa的浓度显著降低。来自两个实验运行的数据还表明,可以使用约2小时或更长的成熟时间维持IgG的质量和产率。在1:4和1:2上清液中,2小时成熟后的IgG的产量分别为0.47g和0.42g IgG/升血浆。
实例3
以1:4的比例进行若干次重新悬浮以确认实例2的结果。在六次重新悬浮中使用不同批次的起始物质。在每一种情况下,250g的B+I沉淀物重新悬浮于1000g的如上所述的含水乙醇缓冲液。在-5℃下调节沉淀物悬浮液,同时混合最少2小时。在调节结束时,离心重新悬浮液。分析重新悬浮液和上清液。计算上清液的IgG浓度和IgG产量(血浆当量)(表4)。
表4
确认的B+I重新悬浮液的IgG含量和产量
IgG的平均产量是每升血浆0.57g的IgG。通过添加到主要的分馏工艺流中,该产率可以转化为显著的产率增加,代表来自每升所加工的血浆的额外的0.57g IgG。
实例4
将334g的B+I沉淀物重新悬浮于1,335g的17vol.%乙醇缓冲液中,并在-5℃的温度下混合2小时。然后从固相通过离心分离液相(“第一提取物”)。
将274g固相沉淀物重新悬浮于1,096g的17vol.%乙醇缓冲液中,并在-5℃的温度下混合2小时。然后通过离心将液相(“第二提取物”)与固相分离。
针对IgG和若干其他感兴趣的蛋白的存在,分析来自每个程序的预离心的悬浮液和上清液(表5)。这证实了重复顺序提取B+I沉淀物在溶剂上清液相中产生IgG,其他蛋白质等同的减少。
表5
实例5
通过在-5℃的温度下将一份沉淀物与四份17vol.%乙醇缓冲液混合两小时来制备B+I沉淀物的提取物。然后通过离心将提取物与残留的沉淀物分离。
然后将B+I沉淀物的提取物与B+I上清液按体积计以1:10的比例混合。将B+I上清液的组成与组合的B+I上清液和B+I沉淀物提取物的组成进行比较(表6)。这证实了可以将上清液与沉淀物提取物组合以增加IgG浓度,同时保持可接受的IgG纯度曲线。
表6
实例6
根据改良的基斯特勒和聂克曼方法,在0℃±2℃下,调节来自所分馏的血浆分馏的250kg的B+I沉淀物,并在1000kg 17vol.%乙醇缓冲液的存在下,在0℃±2℃下通过均质化重新悬浮1小时。然后将混合物在0℃±2℃下熟化2小时,之后pH为5.14,并且电导率为0.6mS/cm。通过过滤或离心将上清液提取物与沉淀物分离。该提取方法和通过过滤或离心的回收成功地从B+I沉淀物中提取高纯度的IgG(表7)。
表7
实例7
将313kg来自实例6的上清液提取物滤液调节至3.9mS/cm的离子强度,将乙醇浓度提高至25vol.%,并且用1M氢氧化钠通过滴定将pH调节至pH 6.9,并且然后-6.5℃下孵育6小时,以产生通过离心收集的2.4kg馏分II沉淀物。将馏分II(FrII)沉淀物溶解于水中(FrII:水=1:2)。分析显示,B+I沉淀物的上清提取物与产生具有低水平聚集体的IgG的进一步下游纯化相容(表8)。
表8
来自所提取的B+I沉淀的再溶解的馏分II沉淀物的组成
实例8
将在低于-30℃下冷冻储存的100g的B+I沉淀物在控制至0℃的容器(选项(a))中或在控制在0℃的包含17vol.%乙醇缓冲液的容器(选项(b))中在没有任何搅拌的情况下升至0℃。通过在冷冻前放置于沉淀物中的探针测量温度。当沉淀物温度达到0℃±1℃时,向来自选项(a)的沉淀物中添加17vol.%乙醇缓冲液,并且在将IgG萃取到溶剂缓冲液中之前,在搅拌不少于2小时的情况下,将两种沉淀均质化(成熟/调节)。然后将上清液与剩余的沉淀物分离并分析。当有或没有缓冲液的情况下调节至0℃时,存在来自沉淀物的当量IgG提取物表9)。
表9
- 还没有人留言评论。精彩留言会获得点赞!