离子液体及柔粘性结晶的制作方法
本发明涉及一种离子液体或柔粘性结晶。本发明还涉及一种锂二次电池用非水电解质及锂二次电池。
背景技术:
就锂二次电池而言,重视低温下的使用,提出了将离子液体作为电解质使用(专利文献1)。另一方面,寻求太阳光发电或热电联合系统等的普及、在东日本大地震灾害等灾害时也可使用的发电系统,包含车载用的搁置型的锂二次电池的需求增大。已经实用化的使用有机溶剂的锂二次电池在充放电时放热,因此,需要实施安全对策以使其不达到高温。特别是最近对固定配置用的大容量的蓄电装置的需求增加,设置面积尽可能小的方法是重要的。为了将使用有机溶剂时的电池的工作温度抑制在45℃以下,需要考虑热控制的电池组的设置以及用风扇强制地进行空气冷却。这种办法无论如何开发容量密度大的电池组,在将他们组合而设为大型系统的情况下,在综合性的容量的降低或锂二次电池的冷却中消费电力都会成为问题。如果制成在85℃以上的温度域下稳定地工作的电解质,则不需要冷却。
完全不含溶剂的离子液体不会因加热而挥发且具有耐热性,且越是高温,传导度越升高,因此,作为可以在高温下稳定工作的电解液备受关注(专利文献2)。另外,近年来,利用了固体电解质的固体电池中,开发出没有液体泄漏、安全性优异的电池,但由于现有的固体电解质为无机材料,因此经不起冲击,存在开裂的问题。与此相对,已知具有类似于离子液体的结构的盐中存在在常温附近处于柔粘性结晶相的固体,在这些盐中添加有锂盐的物质显示比较高的传导度,且作为挠性的固体电解质备受关注(专 利文献3),在电池工作的期待温度、即零下数十℃的低温到150℃附近的广泛的温度范围形成柔粘性结晶相的盐的构建中,需要结晶内的分子运动变得容易的离子、特别是阴离子。
目前作为锂二次电池的电解质的有机溶剂电解质可以在低温下工作,但因为将挥发性或可燃性的有机溶剂用作电解液,所以在高温下的稳定性方面存在问题。
专利文献4中公开了阳离子成分为含有P-N键的鏻离子的离子液体。
专利文献5中公开了阳离子成分具有噁唑环的离子液体。
专利文献6中公开了阳离子成分为锍、铵或鏻的离子液体。
专利文献7中公开了阳离子成分为脲鎓或硫脲鎓阳离子的离子液体。
现有技术文献
专利文献
专利文献1:日本专利第2981545号
专利文献2:日本特开2013-196922
专利文献3:WO2008/081811(日本专利第4997610)
专利文献4:日本专利第5265197号
专利文献5:日本特开2008-130623
专利文献6:日本特开2008-277001
专利文献7:日本专利第4723480号
技术实现要素:
发明所要解决的课题
本发明的目的在于,提供一种在现有的有机电解液中极其困难的、在85℃以上的中温域或高温域下可稳定地工作的锂二次电池及锂二次电池用非水电解质。
另外,本发明的目的在于,提供一种离子液体或柔粘性结晶。
用于解决课题的技术方案
本发明人发现:作为阴离子,含有[C(SO2F)3]-(以下,有时将该阴离子简称为“[f3C]-”。),阳离子含有选自由1-乙基-3-甲基咪唑鎓([EMI]+)、N,N-二乙基-N-甲基-(2-甲氧基乙基)铵([DEME]+)、N-甲基-N-丙基吡咯烷鎓([Py13]+)、N-甲基-N-丙基哌啶鎓([PP13]+)、四甲基铵([N1111]+)、四乙基铵([N2222]+)、三甲基己基铵([N6111]+)、三乙基己基铵([N6222]+)、N-甲基-N-乙基吡咯烷鎓([Py12]+)、1-丁基-3-甲基咪唑鎓([C4mim]+)及1-己基-3-甲基咪唑鎓([C6mim]+)构成的组中的至少1种的情况下,盐成为离子液体或柔粘性结晶,在将其作为锂二次电池用的非水电解质使用的情况下,稳定性及耐久性高,即使长期间使用,劣化导致的电池的界面电荷移动阻力增加率也非常低。柔粘性结晶为固体中的分子或离子的旋转运动自由地发生、而平移运动被限制的状态的中间相的一种,构成柔粘性结晶的离子、或掺杂于柔粘性结晶的金属阳离子等可以经由固体中存在的晶格缺陷较容易地移动,因此,近年来作为新型的固体电解质备受关注。
本发明提供以下的离子液体或柔粘性结晶、锂二次电池用非水电解质及锂二次电池。
项1.一种离子液体或柔粘性结晶,其由阴离子和阳离子构成,其中,阴离子含有[C(SO2F)3]-,阳离子含有选自由1-乙基-3-甲基咪唑鎓([EMI]+)、N,N-二乙基-N-甲基-(2-甲氧基乙基)铵([DEME]+)、N-甲基-N-丙基吡咯烷鎓([Py13]+)、N-甲基-N-丙基哌啶鎓([PP13]+)、四甲基铵([N1111]+)、四乙基铵([N2222]+)、三甲基己基铵([N6111]+)、三乙基己基铵([N6222]+)、N-甲基-N-乙基吡咯烷鎓([Py12]+)、1-丁基-3-甲基咪唑鎓([C4mim]+)及1-己基-3-甲基咪唑鎓([C6mim]+)构成的组中的至少1种。
项2.根据项1所述的离子液体或柔粘性结晶,其中,阳离子含有选 自由1-乙基-3-甲基咪唑鎓([EMI]+)、N,N-二乙基-N-甲基-(2-甲氧基乙基)铵([DEME]+)、N-甲基-N-丙基吡咯烷鎓([Py13]+)及N-甲基-N-丙基哌啶鎓([PP13]+)构成的组中的至少1种。
项3.根据项1或2所述的离子液体或柔粘性结晶,其为离子液体,且阳离子含有[EMI]+。
项4.一种锂二次电池用非水电解质,其由阴离子和阳离子构成,其中,阴离子含有[C(SO2F)3]-,阳离子含有选自由1-乙基-3-甲基咪唑鎓([EMI] +)、N,N-二乙基-N-甲基-(2-甲氧基乙基铵([DEME]+)、N-甲基-N-丙基吡咯烷鎓([Py13]+)、N-甲基-N-丙基哌啶鎓([PP13]+)、四甲基铵([N1111]+)、四乙基铵([N2222]+)、三甲基己基铵([N6111]+)、三乙基己基铵([N6222]+)、N-甲基-N-乙基吡咯烷鎓([Py12]+)、1-丁基-3-甲基咪唑鎓([C4mim]+)及1-己基-3-甲基咪唑鎓([C6mim]+)构成的组中的至少1种。
项5.根据项4所述的锂二次电池用非水电解质,其中,阳离子含有选自由1-乙基-3-甲基咪唑鎓([EMI]+)、N,N-二乙基-N-甲基-(2-甲氧基乙基)铵([DEME]+)、N-甲基-N-丙基吡咯烷鎓([Py13]+)及N-甲基-N-丙基哌啶鎓([PP13]+)构成的组中的至少1种。
项6.根据项4或5所述的锂二次电池用非水电解质,其中,阳离子含有[EMI]+。
项7.根据项4~6中任一项所述的锂二次电池用非水电解质,其还含有Li[C(SO2F)3]。
项8.一种锂二次电池,其含有项4~7中任一项所述的非水电解质。
项9.根据项8所述的锂二次电池,其中,负极为Li金属负极。
发明效果
本发明的离子液体或柔粘性结晶作为锂二次电池用的电解质,可以在中温域内稳定地工作,因此,可以抑制锂二次电池的盒内的冷却的需要性,可以提供每单位体积的蓄电效率好的锂二次电池。特别是设为车载用等大容量的锂二次电池的情况下,可以在中温域至高温域内工作,高的温度可带来电解质的粘度降低,以及锂二次电池能够密集,从而效率高,特别优 异。
附图说明
图1是在含有Li[f3C]的[EMI][f3C]中,在铂电极上的循环伏安图。
图2是在含有Li[f3C]的[EMI][f3C]中,在镍电极上的循环伏安图。
图3是Li金属对称电池的电化学交流阻抗谱。
图4是[EMI][f3C]和[EMI][Tf2N]的、LiCoO2/Li电池的1C充放电循环特性。(上段)放电容量的循环依赖性。(下段)充放电库仑效率。
图5是LiCoO2/Li电池的充电时的交流阻抗图。a)[EMI][f3C],b)[EMI][Tf2N]。
图6是氮气气氛下的热重量变化。
图7是[EMI][f3C]和[EMI][Tf3C]的DSC的测定结果。
图8是[DEME][f3C]和[DEME][Tf3C]的DSC的测定结果。
图9是[Py13][f3C]、[PP13][f3C]、[Py13][Tf3C]及[PP13][Tf3C]的DSC的测定结果。
具体实施方式
本发明中使用的离子液体或柔粘性结晶的阴离子含有[f3C]-,阳离子含有[EMI]+、[DEME]+、[Py13]+、[PP13]+、[N1111]+、[N2222]+、[N6111]+、[N6222] +、[Py12]+、[C4mim]+及[C6mim]+的至少1种。阳离子为[EMI]+、[N6111]+、[N6222]+、[C4mim]+及[C6mim]+的情况下,成为离子液体,在阳离子为[DEME]+、[Py13]+、[PP13]+、[N1111]+、[N2222]+、[Py12]+的任一种的情况下,为柔粘性结晶。
阴离子可以仅由[f3C]-构成,也可以将[f3C]-和其它阴离子组合而使用。作为其它阴离子,可举出例如FSI-([(FSO2)2N]-)、TFSI-([(CF3SO2)2N]-)、FTA-([(FSO2)(CF3SO2)N]-)、Tf3C-([(CF3SO2)3C]-)等。f3C阴离子为阴离子整体的50摩尔%以上,优选为70摩尔%以上,更优选为80摩尔%以上,进 一步优选为90摩尔%以上,特别优选为95摩尔%以上,最优选为100摩尔%。
阳离子更优选为[EMI]+、[DEME]+、[Py13]+及[PP13]+,进一步优选为[EMI]+,可以将[EMI]+和[DEME]+、[Py13]+、[PP13]+、[N1111]+、[N2222]+、[N6111]+、[N6222]+、[Py12]+、[C4mim]+及[C6mim]+的至少1种组合而使用。在优选的实施方式之一中,阳离子中的[EMI]+的含量为30摩尔%以上,优选为50摩尔%以上,更优选为70摩尔%以上,进一步优选为90摩尔%以上,特别优选为95摩尔%以上,最优选为100摩尔%。
将本说明书中所使用的阳离子和阴离子的简写符号和结构式示于以下。
【化学式1】
本说明书中,离子液体是指在室温下为液体的物质(熔点为35℃以下),柔粘性结晶是如下物质:在低于其熔点的温度下,显示伴有与通常的固体或液体所显示的熔解放热量匹敌的大的热量变化的固体-固体相转变,结果,熔化熵为约20J K-1mol-1以下。本发明的柔粘性结晶可以通过满足在低于其熔点的温度下显示固体-固体相转变及熔化熵为约20J K-1mol-1以下(J.Timmermans,J.Phys.And Chem.Solids,18(1),(1961))这两个条件中的一个或两者来确认。柔粘性结晶与一般的结晶材料完全不同,特征在于为挠性且粘性(sticky)的固体。
具体而言,离子液体为[EMI][f3C]、[N6111][f3C]、[N6222][f3C]、[C4mim][f3C]、[C6mim][f3C],柔粘性结晶为[DEME][f3C]、[Py13][f3C]、[PP13][f3C]、[N1111][f3C]、[N2222][f3C]、[Py12][f3C]。
[f3C]-的碱金属盐为公知物质,可以通过公知的制造方法来制造。将优选的制造法的方案示于以下。
【化学式2】
(式中,M表示碱金属,优选为Na、K或Li。Z表示[EMI]+、[DEME] +、[Py13]+、[PP13]+、[N1111]+、[N2222]+、[N6111]+、[N6222]+、[Py12]+、[C4mim] +或[C6mim]+。)
将原料的化合物(1)用发烟硫酸(oleum)进行硫酸化而得到化合物(2),使其与SF4反应而得到化合物(3)。化合物(3)与碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾、碳酸锂、碳酸氢锂等碱金属碳酸盐、碱金属碳酸氢盐等碱(base)反应而导入于碱金属(M)的盐(4)、使其与[EMI]+、[DEME]+、[Py13]+、[PP13] +、[N1111]+、[N2222]+、[N6111]+、[N6222]+、[Py12]+、[C4mim]+或[C6mim]+反应而进行阳离子交换(cation exchange),由此可以得到目标的本发明的离子液体或柔粘性结晶。
本发明的锂二次电池在集电体上具有活性物质层,作为电解质,可使用本发明的离子液体或柔粘性结晶。1个电极用间隔件隔开。
作为可以用于正极的集电体,除铝、不锈钢、镍、钛等金属板等之外,还可以优选使用对铝或不锈钢的表面进行碳、镍、钛或银处理的、含有或 被覆这些的合金。
作为负极所使用的集电体,优选铜、不锈钢、镍、钛。作为集电体的形状,通常使用膜状、片状的集电体,但也可以使用多孔质体、发泡体等。作为所述集电体的厚度,没有特别限定,优选为1~500μm。另外,集电体表面优选通过表面处理而附加凹凸。
作为正极活性物质,可举出:Li0.3MnO2、Li4Mn5O12、V2O5、LiCoO2、LiMn2O4、LiNiO2、LiFePO4、LiCo1/3Ni1/3Mn1/3O2、Li1.2(Fe0.5Mn0.5)0.8O2、Li1.2(Fe0.4Mn0.4Ti0.2)0.8O2、Li1+x(Ni0.5Mn0.5)1-xO2、LiNi0.5Mn1.5O4、Li2MnO3、Li0.76Mn0.51Ti0.49O2、LiNi0.8Co0.15Al0.05O2、Fe2O3、LiCoPO4、LiMnPO4、Li2MPO4F(M=Fe,Mn)、LiMn0.875Fe0.125PO4、Li2FeSiO4、Li2-xMSi1-xPxO4(M=Fe,Mn)、LiMBO3(M=Fe,Mn)、FeF3、Li3FeF6、Li2TiF6、Li2FeS2、TiS2、MoS2、FeS等,并不限定于这些(其中,x为0~1的范围)。
负极活性物质没有特别限制,可以利用公知的负极活性物质。作为可以在本发明的非水电解液锂二次电池中优选使用的负极活性物质,可举出碳材料,也可举出能够嵌入锂离子的金属氧化物或金属氮化物等。作为碳材料,可举出天然石墨、人造石墨、热分解碳类、焦炭类、中间相碳微珠、碳纤维、活性炭、沥青被覆石墨等,作为能够嵌入锂离子的金属氧化物,可举出含有锡或硅的金属化合物、例如氧化锡或氧化硅等,作为金属氮化物,可举出Li2.6Co0.4N等。进而,可举出石墨或锡合金和粘结剂的混合物、硅薄膜、锂箔。
活性物质层含有上述正极活性物质或负极活性物质,优选进一步含有导电剂及粘结剂,作为其它的材料,可以添加填料、锂盐。作为导电剂,可举出天然石墨、人工石墨、炭黑、乙炔黑、科琴黑、碳纤维或金属粉、金属纤维或聚苯撑衍生物等,作为粘结剂,可举出:羧基甲基纤维素、纤维素、二醋酸纤维素、甲基纤维素、羟基乙基纤维素、羟基丙基纤维素、海藻酸钠、聚丙烯酸、聚丙烯酸钠、聚乙烯基苯酚、聚乙烯基甲醚、聚乙 烯醇、聚乙烯基吡咯烷酮、聚丙烯腈、聚丙烯酰胺、聚(甲基)丙烯酸羟基酯、苯乙烯-马来酸共聚物等水溶性聚合物、聚氯乙烯、聚四氟乙烯、聚偏氟乙烯(PVDF)、四氟乙烯-六氟丙烯共聚物、偏氟乙烯-四氟乙烯-六氟丙烯共聚物、聚乙烯、聚丙烯、乙烯-丙烯-二烯三元聚合物(EPDM)、磺化EPDM、聚乙烯醇缩乙醛树脂、甲基丙烯酸甲酯、丙烯酸2-乙基己酯等含有(甲基)丙烯酸酯的(甲基)丙烯酸酯共聚物、(甲基)丙烯酸酯-丙烯腈共聚物、含有乙酸乙烯酯等乙烯基酯的聚乙烯基酯共聚物、苯乙烯-丁二烯共聚物、丙烯腈-丁二烯共聚物、聚丁二烯、氯丁橡胶、氟橡胶、聚环氧乙烷、聚酯聚氨酯树脂、聚醚聚氨酯树脂、聚碳酸酯聚氨酯树脂、聚酯树脂、酚醛树脂、环氧树脂等的乳液(胶乳)等。
就填料而言,只要是在本发明的非水电解液二次电池中不引起化学变化的纤维状材料,则任何材料都可以使用。通常可使用聚丙烯、聚乙烯等烯烃系聚合物、玻璃、碳等纤维。填料的添加量没有特别限定,优选0~30质量%。
作为锂盐,可以使用在中温域内显示耐热性的物质、例如LiBF4、LiCF3SO3、LiC(CF3SO2)3、LiC(FSO2)3、LiN(CF3SO2)2、LiN(FSO2)2、LiN(CF3CF2SO2)2、LiN(CF3SO2)(C2F5SO2)、LiN(CF3SO2)(C4F9SO2)、LiN(CF3CF2CO)2、LiBOB等盐。予以说明,这些盐可以单独使用1种,也可以并用2种以上。优选的锂盐为LiC(FSO2)3。
在优选的实施方式中,本发明的锂二次电池可以直接使用层压型电池的构成。间隔件优选离子液体的含浸性优异、且耐热性优异的间隔件,具体而言,可以列举含二氧化硅纳米粒子的聚烯烃间隔件或无机玻璃制过滤器。
另外,电池的正极活性物质可以优选例示耐热性优异的LiFePO4。
可认为,高温下工作的电池也可以直接使用在室温下起作用的电池, 但实际上使用有现有的有机溶剂电解液的电池在高温下不工作,因此,需要充分地进行空气冷却。另外,为了形成空气的流通路,空间填充率降低,即使每单位电池的容量大,系统整体的效率也会降低。本发明的耐热性、耐久性优异的锂二次电池用非水电解质联系着耐热性优异的电池的开发,特别是在固定配置用的大型的蓄电池的情况下,效率大幅提高,因此优选。
本发明的锂二次电池也可以适用于片形、方形、圆筒形等任一种形状,可以与也用于电极形状的非水电解液二次电池的形状匹配地选择最佳的形状。
正极活性物质层及负极活性物质层设置于集电体上。正极活性物质层及负极活性物质层可以设置于集电体的一面,也可以设置于两面,更优选使用设置于两面的电极。对负极板的大小相对于正极板的大小的比例没有特别限制。相对于负极板的面积1,优选的正极板的面积优选为0.9~1.1,特别优选为0.95~1.0。电极可通过将含有活性物质的涂布液涂布于集电体表面并进行干燥、进一步进行加压、形成活性物质层而得到。
作为涂敷液,例如根据需要可以使用含有上述导电剂、粘结剂及N-甲基-2-吡咯烷酮(NMP)、水、甲苯等分散介质的浆料状的涂布液。
作为涂布方法,可举出逆转辊法、直接辊法、刮板法、刮刀法、挤压法、幕帘法、凹版法、棒法、浸渍法及挤压法。其中,优选刮板法、刮刀法及挤压法。另外,涂布速度优选以0.1~100m/分钟进行。此时,通过按照涂布液的溶液物性、干燥性来选定上述涂布方法,可以得到良好的涂布层的表面状态。涂布液的涂布可以逐个面逐一地进行,也可以两面同时进行。
作为锂二次电池的电解液,可举出例如在含有耐热性优异的[f3C]-等阴离子的离子液体或柔粘性结晶中溶解或混合有认为具有所期望的耐热性的碱金属盐(支持电解质)的电解液。两者可以通过加热至与本发明中例示 的盐进行混合所得到的混合盐的熔点以上而均匀地混合。作为支持电解质的阴离子,可举出[BF4]-、[(FSO2)2N]―、[(FSO2)(CF3SO2)N]-、[(CF3SO2)2N]-、[(CF3CF2SO2)2]N-、[(C2H4O2)2B]-、[(CF3SO2)3C]-、[CF3SO3]-等以及作为本发明的电解质的阴离子的[f3C]-等,优选使用与本发明的电解质相同的[f3C]阴离子。作为支持电解质的阳离子,优选Li+。
在优选的实施方式中,本发明的锂二次电池具有在间隔件的一个面上具有所述正极活性物质层、在其它面上具有负极活性物质层的叠层体结构,进而在活性物质层中,在与间隔件相反的面上具有集电体。另外,就间隔件层而言,根据需要进行加热而以溶解状态含浸具有支持电解质和本发明的电解质的电解质混合物。
作为叠层体结构,并不仅限定于叠层有一层的方式,可举出:具有多个该叠层体结构的多层叠层体结构、将叠层于集电体的两面的结构组合的方式、进一步将它们卷绕的方式。
搁置型(固定配置用)的锂二次电池的情况下,具有多层叠层体结构,但本发明的电解质在中温域下的稳定性高,因此,可以减少或消除用于冷却的风扇、用于冷却的空气的流路,可以增大将单电池组装而得到的电池组状态下的每单位体积的蓄电量。
【实施例】
以下,基于实施例及比较例,更详细地说明本发明。
在实施例及比较例中,作为阳离子成分的[EMI]+([C2mim]+)、[DEME] +、[Py12]+、[Py13]+、[Py14]+、[PP13]+、[PP14]+、[N1111]+、[N2222]+、[N6111] +、[N6222]+、[C1mim]+、[C4mim]+、[C6mim]+、作为阴离子成分的[Tf2N]-(=[(CF3SO2)2N]-),[f2N]-(=[(FSO2)2N]-)、[Tf3C]-(=[(CF3SO2)3C]-)使用市售品。
热重量测定(TGA)使用Seiko-Insturments TG/DTA 6200,在氮气气流 下、扫描速度10℃/分钟的条件下进行测定。
差示扫描热量测定(DSC)使用Perkin-Elmer Pyris 1,以扫描速度10℃/分钟进行测定。
根据TGA,以热分解温度形式来评价耐热性。根据DSC得到的相转变温度的有无或其温度、以及热量变化进行液体、固体、柔粘性结晶等的判别。
制造例1:阴离子(f3C)的合成
作为市售品,使由ALCATRAZ CHEMICALS(Gujarat,INDIA)获得的58.4mg的化合物(2)和194mg的SF4反应而得到51.6mg的化合物(3)。使92.4mg的化合物(3)与过量的碳酸钾反应而导入于93.9mg的f3C阴离子的钾盐(4)。
实施例1
使制造例1中得到的f3C阴离子的钾盐(4)与等摩尔的[EMI]+、[DEME] +、[Py13]+或[PP13]+的溴化物反应而进行阳离子交换,由此得到作为目标的本发明的离子液体([EMI][f3C])或柔粘性结晶([DEME][f3C]、[Py13][f3C]或[PP13][f3C])。
将得到的离子液体或柔粘性结晶的物性值示于以下。另外,将熔点、玻璃化转变温度、固体-固体相转变温度示于表1。
1)[EMI][f3C]
1H-NMR(CD3CN,300MHz):δ=1.45(t,J=7.2Hz,3H),3.81(s,3H),4.16(q,J=7.2Hz,2H),7.32(s,1H),7.37(s,1H),8.39(s,1H):19F-NMR(CD3CN,283MHz):δ=71.5(s,3F).
元素分析测定值(理论值):H 2.99%(2.98%);C 22.71%(22.58%);N 7.58%(7.52%);F 15.36%(15.31%).25℃下的离子传导度:6.2mS cm-1.25℃下的粘度:39mPa.s.25℃下的密度:1.55g mL-1.熔化熵:40J K-1mol-1.热分解温度(减少10%时):246℃.
2)[DEME][f3C]
1H-NMR(CD3CN,300MHz):δ=1.26(t of t,J=7.2Hz and 1.9Hz,6H),2.92(s,3H),3.27-3.37(complex,9H),3.71(m,2H):19F-NMR(CD3CN,283MHz):δ=71.6(s,3F).
元素分析测定值(理论值):H 4.81%(4.95%);C 26.41%(26.53%);N 3.44%(3.44%);F 14.03%(13.99%).熔化熵:6.1J K-1mol-1.热分解温度(减少10%时):325℃.
3)[Py13][f3C]
1H-NMR(CD3CN,300MHz):δ=0.96(t,J=7.2Hz,3H),1.75(m,2H),2.15(m,4H),2.93(s,3H),3.17(m,2H),3.39(m,4H);19F-NMR(CD3CN,283MHz):δ=71.5(s,3F).
元素分析测定值(理论值):H 4.63%(4.66%);C 27.67%(27.76%);N 3.47%(3.60%);F 14.88%(14.64%).熔化熵:9.3J K-1mol-1热分解温度(减少10%时):343℃.
4)[PP13][f3C]
1H-NMR(CD3CN,300MHz):δ=0.963(t,J=7.2Hz,3H),1.59-1.88(m,8H),2.92(s,3H),3.14-3.24(complex,6H);19F-NMR(CD3CN,283MHz):δ=71.5(s,3F).
元素分析测定值(理论值):H 4.97%(5.00%);C 29.59%(29.77%);N 3.47%(3.47%);F 14.22%(14.13%).熔化熵:8.6J K-1mol-1热分解温度(减少10%时):373℃.
实施例2
使制造例1中得到的f3C阴离子的钾盐(4)与等摩尔的[N6111]+、[N6222] +、[N1111]+、[N2222]+、[Py12]+、[C4mim]+、[C6mim]+的溴化物反应而进行阳离子交换,由此得到作为目标的本发明的离子液体的[N6111][f3C]、[N6222] +[f3C]、[N1111][f3C]、[N2222][f3C]、[PP14][f3C]、[Py12][f3C]、[Py14][f3C]、[C1mim][f3C]、[C4mim][f3C]、[C6mim][f3C]。将得到的离子液体或柔粘性结晶的物性值示于以下。另外,将熔点、玻璃化转变温度、固体-固体相转变温度示于表1。
1)[N1111][f3C]、
1H NMR(DMSO-d6,300MHz):δ=3.06(s,12H);19F NMR(DMSO-d6,283MHz):δ=71.9(s,3F).热分解温度(减少10%时):348℃.
2)[N2222][f3C]、
1H NMR(CDCl3,300MHz):δ=1.35(t,J=7.2Hz,4×3H),3.23(q,J=7.2Hz,4×2H);19F NMR(CDCl3,283MHz):δ=71.2(s,3F).热分解温度(减少10%时):317℃.
3)[N6111][f3C]、
1H NMR(CDCl3,300MHz):δ=0.91(t,J=7.2Hz,3H),1.15-1.47(complex,3×2H),1.76(m,2H),3.13(s,3×3H),3.26(m,2H);19F NMR(CDCl3,283MHz):δ=71.5(s,3F).热分解温度(减少10%时):346℃.
4)[N6222][f3C]
1H NMR(CDCl3,300MHz):δ=0.91(t,J=7.2Hz,3H),1.23-1.41(complex,3×3H,3×2H),1.64(m,2H),3.21(m,2H),3.26(q,J=7.2Hz,3×2H);19F NMR(CDCl3,283MHz):δ=71.2(s,3F).热分解温度(减少10%时):340℃.
5)[Py12][f3C]、
1H NMR(DMSO-d6,300MHz):δ=1.24(t,J=7.2Hz,3H),2.04(br,2×2H),2.92(s,3H),3.23-3.50(complex,3×2H);19F NMR(DMSO-d6,283MHz):δ=71.9(s,3F).热分解温度(减少10%时):284℃.
6)[C4mim][f3C]、
1H NMR(DMSO-d6,300MHz):δ=0.87(t,J=7.2Hz,3H),1.21(m,2H),1.73(m,2H),3.81(s,3H),4.13(t,J=7.2Hz,2H),7.67(t,J=1.7Hz,1H),7.73(t,J=1.7Hz,1H),9.07(s,1H);19F NMR(DMSO-d6,283MHz):δ=71.8(s,3F).热分解温度(减少10%时):320℃.
7)[C6mim][f3C]
1H NMR(DMSO-d6,300MHz):δ=0.83(t,J=7.2Hz,3H),1.15-1.32(complex,3×2H),1.76(m,2H),3.81(s,3H),4.12(t,J=7.2Hz,2H),7.66(t,J=1.7Hz,1H),7.73(t,J=1.7Hz,1H),9.07(s,1H);19F NMR(DMSO-d6,283 MHz):δ=71.9(s,3F).热分解温度(减少10%时):327℃.
比较例1
使制造例1中得到的f3C阴离子的钾盐(4)与等摩尔的[PP14]+、[Py14]+、[C1mim]+的溴化物反应而进行盐交换,由此得到[PP14][f3C]、[Py14][f3C]、[C1mim][f3C]。将得到的离子液体或柔粘性结晶的物性值示于以下。另外,将熔点、玻璃化转变温度、固体-固体相转变温度示于表1。
1)[PP14][f3C]、
1H NMR(DMSO-d6,300MHz):δ=0.91(t,J=7.2Hz,3H),1.29(m,2H),1.49(m,2H),1.61(m,2H),1.74(br,2×2H),2.94(s,3H),3.16-3.42(br,3×2H);19F NMR(DMSO-d6,283MHz):δ=71.9(s,3F).热分解温度(减少10%时):349℃.
2)[Py14][f3C]、
1H NMR(DMSO-d6,300MHz):δ=0.90(t,J=7.2Hz,3H),1.27(m,2H),1.64(m,2H),2.05(br,2×2H),2.94(s,3H),3.30(t,J=7.2Hz,2H),3.40(m,2×2H);19F NMR(DMSO-d6,283MHz):δ=71.9(s,3F).热分解温度(减少10%时):351℃.
3)[C1mim][f3C]、
1H NMR(DMSO-d6,300MHz):δ=3.81(s,2×3H),7.64(s,1H),7.65(s,1H),8.99(s,1H);19F NMR(DMSO-d6,283MHz):δ=71.9(s,3F).热分解温度(减少10%时):333℃.
比较例2
使市售的Tf3C阴离子的钾盐与等摩尔的[EMI]+、[N1111]+、[N6111]+、[N6222]+、[PP14]+、[Py12]+、[Py14]+、[C1mim]+、[C4mim]+、[C6mim]+的溴化物反应而进行盐交换,由此得到[EMI][Tf3C]、[N1111][Tf3C]、[N6111][Tf3C]、[N6222][Tf3C]、[PP14][Tf3C]、[Py12][Tf3C]、[Py14][Tf3C]、[C1mim][Tf3C]、[C4mim][Tf3C]、[C6mim][Tf3C]。将得到的Tf3C盐的熔点或Tg示于表2。
比较例3
使市售的f2N阴离子的钾盐与等摩尔的EMI+的溴化物反应而进行阳 离子交换,由此得到[EMI][f2N],在试验例1(2)中评价相对于Li金属的稳定性。
比较例4
使市售的Tf2N阴离子的钾盐与等摩尔的EMI+的溴化物反应而进行盐交换,得到[EMI][Tf2N],在试验例1(2)及(3)中进行评价。
【表1】
相转变温度和35℃下的状态
1)熔点;2)玻璃化转变温度;固体-固体相转变温度(其中,伴有一般的固体显示的数kJ/mol以上的大的放热的温度);4)固体;5)没有观测到;6)液体;7)柔粘性结晶;8)在熔化前热分解
【表2】
相转变温度和35℃下的状态
1)熔点;2)玻璃化转变温度;固体-固体相转变温度(其中,伴有一般的固体显示的数kJ/mol以上的大的放热的温度);4)固体;5)没有观测到;6)液体
表1、表2中,“PC”表示柔粘性结晶(Plastic Crystal),“L”表示液体(Liquid),“S”表示固体(Solid)。“decomp”表示在为观察到熔化时就已达到分解温度。
表1中,根据柔粘性结晶特有的低温下的伴有与熔化、凝固匹敌的大的热的出入的固体-固体相转变(TS-S)的存在、及在室温下为粘性的状态这2点确认为柔粘性结晶(PC)。
试验例1
(1)电化学稳定性
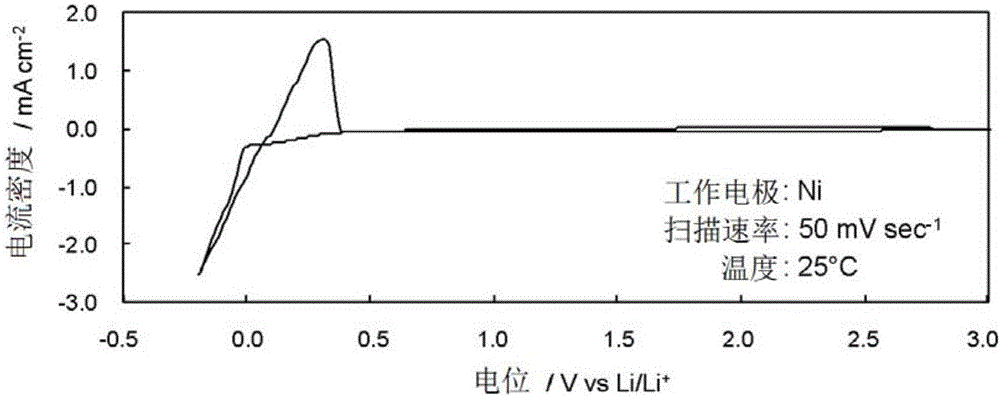
测定含有0.37mol kg-1的Li[f3C]的[EMI][f3C]中的铂电极上的循环伏安图(图1)。另外,测定含有0.37mol kg-1的Li[f3C]的[EMI][f3C]中的镍电极上的循环伏安图(图2)。
得知:含有f3C阴离子的EMI离子液体通过共存有Li盐,显示高的氧化稳定性(也可以与4.5V左右的正极材料对应)和高的还原稳定性(可以进行锂金属析出/再溶解的程度)。
(2)相对于Li金属的稳定性
测定含有实施例1中得到的[EMI][f3C]、比较例2中得到的[EMI][Tf3C]、比较例3中得到的[EMI][f2N]、比较例4中得到的[EMI][Tf2N]的Li金属对称电池的电化学交流阻抗谱(25℃、500kHz~0.1Hz,振幅±10mV)(图3)。
由于Li金属界面上的电荷移动反应速度常数与在交流阻抗测定中所观测的半圆弧的宽度(界面电荷移动阻力)的倒数成正比,因此,在将Li金属用作负极的情况下,优选成为尽可能小的圆弧的阴离子。从该观点出发,在由f2N-构成的体系中,在电池制备后最小为20Ω,接着,Li负极上的反应速度按由Tf2N-构成的体系(80Ω)、由f3C-构成的体系(130Ω)、由Tf3C-构成的体系(1500Ω)的顺序变小。另一方面,Li金属为活性的金属,通过电解液的接触进行的还原分解等而形成表面钝化被膜(通称SEI),显示抑制电解液的分解的效果。图3中还用虚线示出制备Li金属对称电池后大致经过了1.5年的结果,可知圆弧的大小显著地增加。其它比较例显示22倍、45倍、170倍的增加,而本发明的由f3C-构成的体系的增加止步于2.5倍左右,这表明:与其它体系相比,形成优异的表面钝化被膜,由此形成稳定的Li金属|离子液体界面。另外,由图3的结果可以推测:假设即使EMI[f2N]盐以其它循环稳定工作,鉴于Li极侧的阻力值的大幅增加,f3C-的电池的长期保存特性也优异。
(3)新型离子液体LiCoO2/Li循环试验
使用[EMI][f3C](实施例1)和[EMI][Tf2N](比较例4)测定了LiCoO2/Li电池的1C充放电循环特性,将结果示于图4。(上段)[放电容量的循环依赖性。(下段)充放电库仑效率。如(2)所示,在[EMI][Tf3C]中含有Li[Tf3C]的物质因显示大的界面电荷移动阻力、或因其过高的粘度引起的大的内部阻力,电池完全不工作,但本发明的[EMI][f3C]良好地工作,与目前已知的[EMI][Tf2N]相比,循环稳定性压倒性地优异。由于库仑效率大致为1, 因此可知:电解液的分解或电极的劣化等被抑制。
可知:在使用[EMI][f3C]的情况下,在库仑效率大致100%下稳定地工作至500个循环,发挥图3所示的Li界面上的稳定性,同时兼备相对于4V级正极的高的氧化稳定性。
进而,使用[EMI][f3C](实施例1)和[EMI][Tf2N](比较例4)测定LiCoO2/Li电池的充电时的交流阻抗图。将结果示于图5。
由充电时的圆弧的宽度可知电极界面电荷移动阻力,但[EMI][f3C]的一方与目前已知的[EMI][Tf2N]盐相比压倒性地小,另外,在500个循环的充放电后也几乎没有变化,因此,暗示稳定地构建了正极和电解液的界面。
也研究了EMI[Tf3C](比较例2),但由于内部阻力过大,因此,从初次开始就完全不工作。与Tf2N体系的结果相比,得知:仅将Tf3C的CF3SO2基变更为FSO2基,不仅通过粘度的降低或界面电荷移动阻力的降低导致的内部阻力的降低而大幅度提高性能,而且正极界面上的电解液的稳定性也大大提高。
(4)热重量变化
测定氮气气氛下的[EMI][f3C]、[DEME][f3C]、[Py13][f3C]、[PP13][f3C]的热重量变化。将结果示于图6。得知:任一种盐均具有至少250℃左右的耐热性。
(5)DSC
将[EMI][f3C](实施例1)和[EMI][Tf3C](比较例2:[Tf3C]=[(CF3SO2)3C])的DSC(升温时,升温速度10℃/分钟)的测定结果示于图7。
由图7的结果可知:本发明的[f3C]阴离子对离子液体中代表性的EMI阳离子赋予更低熔点的盐。
进一步将[DEME][f3C](实施例1)和[DEME][Tf3C](比较例2:[Tf3C]=[(CF3SO2)3C])的DSC(升温时,升温速度10℃/分钟)的测定结果示于图8。
由图7、8的结果可知:继EMI之后,本发明的[f3C]阴离子对容易形成离子液体的DEME阳离子赋予与室温相比相当高熔点的盐。但是,其熔化熵显著地低,为6.1J K-1mol-1,表示该盐为独特的期待作为固体电解质的柔粘性结晶。进而,就玻璃化转变温度而言,推定[DEME][f3C]压倒性地低,柔粘性结晶中的离子的运动性非常高,因此也得知:为容易形成柔粘性结晶的阴离子。
进而,将[Py13][f3C]及[PP13][f3C](实施例1)和[Py13][Tf3C]及[PP13][Tf3C](比较例1:[Tf3C]=[(CF3SO2)3C])的DSC(升温时,升温速度10℃/分钟)的测定结果示于图9。
在阳离子Py13、PP13中也显示出:f3C盐的熔点比Tf3C盐增加约100℃,并且熔化熵与Timmermans的柔粘性结晶的定义(ΔSm<20J K-1mol-1,J.Timmermans,J.Phys.Chem.Solids,18(1),(1961)and references therein.)相比大幅降低,均为柔粘性结晶。在将柔粘性结晶用于电解质时,作为显示柔粘性结晶相的上限温度的熔点越高,则越可以在广泛的温度范围内用作固体电解质,但f3C阴离子在室温附近显示大的吸热(相当于成为柔粘性结晶的温度),显示为在实用上重要的室温域以上、在广泛的温度范围内形成柔粘性结晶相的优异的阴离子。
- 还没有人留言评论。精彩留言会获得点赞!