能够结合组织因子途径抑制剂(1‑161)上的两个表位的抗体的制作方法
名为“140072 SEQUENCE LISTING_ST25”的序列表(48KB)创建于2015年9月16日,并通过引用并入本文。
发明领域
本发明涉及能够同时结合组织因子途径抑制剂(TFPI)的N-末端区域(残基1-161)内的两个表位的双特异性抗体及其组合物。本发明还涉及这类抗体的制药和治疗用途。
背景
在出血的个体中,当血管外TF暴露于血液中的FVIIa时,组织因子/因子VIIa(TF/FVIIa)复合物引发凝血。TF/FVIIa复合物的形成导致因子X(FX)活化为FXa,该FXa与活化的因子V(FVa)一起生成有限量的凝血酶。小量凝血酶会激活血小板,这继而导致血小板磷脂的表面暴露,该血小板磷脂支持由活化的因子VIII(FVIIIa)和因子IX(IXa)组成的tenase复合物的装配和结合。tenase复合物是非常有效的FX活化催化剂,并且在该第二步中生成的FXa充当引起最终凝血酶爆发的FVa/FXa凝血酶原酶(pro-thrombinase)复合物中的活性蛋白酶。凝血酶切割纤维蛋白原产生纤维蛋白单体,该纤维蛋白单体聚合而形成密封渗漏的血管并阻止出血的纤维蛋白网络。快速且广泛的凝血酶爆发是形成固态和稳定的纤维蛋白凝块的先决条件。
由FVIII或FIX缺乏引起的FXa和凝血酶生成上不充分的放大分别是A型血友病和B型血友病患者中出血素质的潜在原因。在血友病患者中,FXa生成主要由TF/FVIIa复合物驱动,因为FVIII或FIX缺乏仅导致通过tenase复合物的不完全的FXa生成。然而,TF/FVIIa介导的FX向FXa的活化是暂时的,因为组织因子途径抑制剂(TFPI)在自调节环路中抑制因子Xa和TF/FVIIa复合物。反馈抑制导致TF/FVIIa/FXa/TFPI复合物的形成。在凝血启动过程中,中和TFPI抑制使TF/FVIIa介导的FX活化延长,从而促进由于tenase活性受损而导致FXa生成不足的血友病患者中的止血,该tenase活性受损是由例如FVIII或FIX缺乏引起的。
在凝血启动后,TF/FVIIa介导的FXa生成被TFPI紧密下调。TFPI是一种缓慢的紧密结合的竞争性抑制剂,其通过抑制TF-FVIIa和FXa两者来调节FX活化和活性。当FXa与TF/FVIIa复合物结合或在其附近结合到膜上时,TF/FVIIa在作为限速步骤涉及FXa的TFPI抑制的过程中被TFPI抑制(Baugh等人,1998,JBC,273:4378-4386)。FXa的TFPI抑制发生在两相反应中,该反应最初导致松散的TFPI-FXa复合物,该复合物缓慢地重排成紧密结合的TFPI-FXa复合物,其中TFPI的第二Kunitz型抑制剂结构域(KPI-2)结合并阻断FXa的活性位点。TFPI的第一Kunitz型抑制剂结构域(KPI-1)有助于紧密TFPI-FXa复合物的形成,并且其直接结合并阻断TF结合的FVIIa的活性位点。
能够结合TFPI的抗体是本领域已知的。例如,WO2010/072691、WO2012/001087和WO2012/135671公开了单克隆抗体(mAb),其中每一种均能够与TFPI的一个特异性表位结合。以下限制可能适用于靶向单个TFPI表位(例如KPI结构域上的)的这类抗体,这通常局限于由单个可变区限定的抗体的互补位区域。首先,TF/FVIIa/FXa复合物的最终抑制依赖于分散在TFPI上的互补区域与TF/FVIIa/FXa复合物之间的几种相互作用。这不仅适用于TFPI的KPI-1和KPI-2分别与FVIIa和FXa的活性位点的直接结合,还适用于与TF/FVIIa/FXa外结合位点(exosite)的相互作用,该相互作用涉及TFPI的N-和C-末端区的区域。例如结合单个KPI的单克隆抗体可能不能完全阻断TFPI的所有抑制功能,特别是在生理上升高的TFPI浓度下。其次,单特异性抗体的效力可能受到抗体亲和力和/或TPFI分子柔性的阻碍,这两者都将需要高剂量的前者。第三,由于TFPI-mAb复合物的肾清除率降低,或由于因TFPI-mAb复合物形成而减弱的其它清除机制,用单克隆抗体靶向TFPI可能会导致TFPI在循环中积累。
本发明人预期本文公开的双特异性抗体可以解决这些限制。
技术实现要素:
本发明涉及一种能够特异性结合人TFPI(SEQ ID NO:1)的位置1至161内的第一表位和第二表位的双特异性抗体。
在一个方面,该双特异性抗体的第一表位可在人TFPI的位置1-96内,如位置1-76内,如Kunitz型抑制剂1(KPI-1)结构域(残基26-76)内。该KPI-1表位可包含SEQ ID NO:1的氨基酸残基Arg 41、Arg 65和/或Glu 67中的一个或多个,并且可进一步包含SEQ ID NO:1的氨基酸残基Leu 16、Pro 17、Leu 19、Lys 20、Leu 21、Met 22、Phe 25、Cys 35、Ala 37、Met 39、Tyr 56、Gly 57、Gly 58、Cys 59、Glu 60、Gly 61、Asn 62、Gln 63、Phe 66、Glu 71和Met 75中的一个或多个。
在一个方面,该双特异性抗体的第二表位可在人TFPI的位置77-161内,如位置97-161内,如Kunitz型抑制剂2(KPI-2)结构域(残基97-147)内。该KPI-2表位可包含SEQ ID NO:1的氨基酸残基Arg 107,并且可进一步包含SEQ ID NO:1的氨基酸残基Glu 100、Glu 101、Asp 102、Pro 103、Tyr 109、Thr 111、Tyr 113、Phe 114、Asn 116、Gln 118、Gln 121、Cys 122、Glu 123、Arg 124、Phe 125、Lys 126和Leu 140中的一个或多个。
本发明的双特异性抗体可以是IgG形式,如全长IgG形式,或者可以是两个抗体片段的化学缀合物,如两个Fab片段或scFv片段的缀合物,或其组合。该双特异性抗体优选是人抗体或人源化抗体。
本发明还涉及一种包含根据本发明的双特异性抗体和药学上可接受的载体的药物组合物。所述双特异性抗体或包含该抗体的组合物可用作药物。所述药物可用于治疗先天性、获得性和/或医源性凝血障碍,如具有或不具有抑制物的A型血友病,以及具有或不具有抑制物的B型血友病。
附图简述
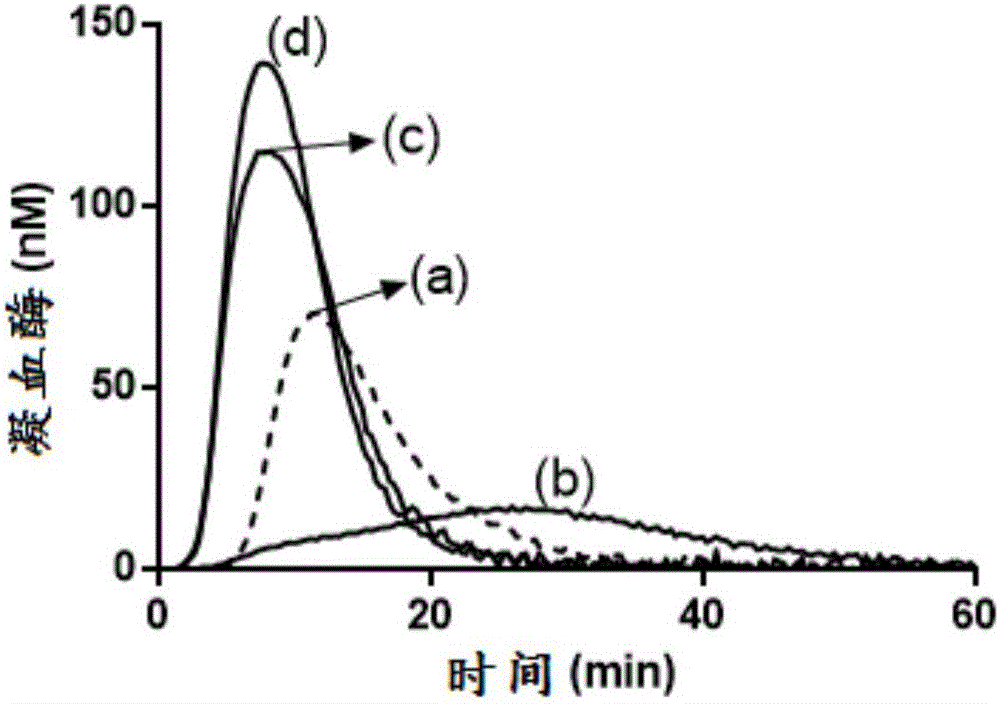
图1:在TFPI水平升高的A型血友病样条件下的人血浆中,某些TFPI(1-79)抗体及TFPI KPI-2抗体mAb 2021增强了凝血酶生成。曲线(a)显示了在没有另外添加的情况下于正常人血浆中获得的结果。曲线(b)显示了通过添加100μg/ml FVIII抗体(HTI PAHFVIII-S)和20nM全长TFPIα获得A型血友病样条件时的结果。由20nM TFPIα联合FVIII中和导致的凝血酶生成的抑制不受添加200nM TFPI(1-79)抗体mAB 1F91(c)的影响。200nM TFPI(1-79)抗体mAb 2F22(d)和KPI-2抗体mAb 2021(e)的添加确实逆转了凝血酶的生成,但没有使其完全恢复至在没有FVIII抗体的情况下于正常人中获得的水平(曲线(a))。
图2:在TFPI水平升高的A型血友病样条件下的人血浆中,通过将TFPI(1-79)与TFPI-KPI-2抗体组合大大增强了凝血酶生成。曲线(a)显示了在没有另外添加的情况下于正常人血浆中获得的结果。曲线(b)显示了通过添加100μg/ml FVIII抗体(HTI PAHFVIII-S)、20nM TFPIα和200nM KPI-2抗体mAb 2021获得A型血友病样条件时的结果。通过将100nM mAb 2021与100nM TFPI(1-79)抗体mAb 1F91(c)或mAb 2F22(d)组合,(b)中采用200nM mAb 2021的不完全中和得到逆转。(c)和(d)中TFPI(1-79)与KPI-2抗体的组合导致了比正常人血浆(a)更高的凝血酶峰值。
图3:来自TFPI FL与被捕获的双特异性抗体mAb 0421和BiFab 9041结合的结果。
序列简述
SEQ ID NO:1代表人TFPIα的氨基酸序列。
SEQ ID NO:2代表TFPI(1-161)的氨基酸序列。
SEQ ID NO:3代表标记的跨越KPI-2的TFPI片段的氨基酸序列。
SEQ ID NO:4代表单克隆抗体(mAb)2F3的可变重链的氨基酸序列。
SEQ ID NO:5代表单克隆抗体(mAb)2F3的可变轻链的氨基酸序列。
SEQ ID NO:6代表单克隆抗体(mAb)2F22的可变重链的氨基酸序列。
SEQ ID NO:7代表单克隆抗体(mAb)2F22的可变轻链的氨基酸序列。
SEQ ID NO:8代表单克隆抗体(mAb)2F45的可变重链的氨基酸序列。
SEQ ID NO:9代表单克隆抗体(mAb)2F45的可变轻链的氨基酸序列。
SEQ ID NO:10代表单克隆抗体(mAb)1F91的可变重链的氨基酸序列。
SEQ ID NO:11代表单克隆抗体(mAb)1F91的可变轻链的氨基酸序列。
SEQ ID NO:12代表用于克隆抗体重链的引物的核酸序列。
SEQ ID NO:13代表用于克隆抗体轻链的引物的核酸序列。
SEQ ID NO:14代表Fab 0296的截短的鼠-人嵌合重链的氨基酸序列。
SEQ ID NO:15代表单克隆抗体mAb 0294、Fab 0296、Fab 0295和mAb 0336的鼠-人嵌合轻链的氨基酸序列。
SEQ ID NO:16代表标记的TFPI KPI-1/N-末端(TFPI(1-79))的氨基酸序列。
SEQ ID NO:17代表单克隆抗体mAb 0294的鼠-人嵌合重链的氨基酸序列。
SEQ ID NO:18代表Fab 0295的截短的鼠-人嵌合重链的氨基酸序列。
SEQ ID NO:19代表mAb 2021的重链可变域(VH)的氨基酸序列。
SEQ ID NO:20代表mAb 2021的轻链可变域(VL)的氨基酸序列。
SEQ ID NO:21代表Fab 0094的重链(HC)的氨基酸序列。
SEQ ID NO:22代表Fab 0094的轻链(LC)的氨基酸序列。
SEQ ID NO:23代表Fab 0088的重链(HC)的氨基酸序列。
SEQ ID NO:24代表Fab 0088的轻链(LC)的氨基酸序列。
SEQ ID NO:25代表Fab 0313的重链(HC)的氨基酸序列。
SEQ ID NO:26代表Fab 0313的轻链(LC)的氨基酸序列。
SEQ ID NO:27代表mAb 0310的重链(HC)的氨基酸序列。
SEQ ID NO:28代表mAb 0310的轻链(LC)的氨基酸序列。
SEQ ID NO:29代表mAb 0336的重链(HC)的氨基酸序列。
详述
在体内,组织因子途径抑制剂(TFPI)存在于若干区室中。TFPI中的大部分与血管内皮相关联,少部分在血液中循环。已经描述了人类中的两种TFPI剪接变体:TFPIα和TFPIβ。TFPIβ可能是在内皮细胞表面上表达的主要形式,而TFPIα的胞内储存可经某些刺激被释放至循环中。TFPIα作为全长或截短的蛋白质在血液中循环,与脂蛋白或血小板相关联。
成熟人TFPIα是由酸性N-末端区域、由连接区穿插的三个串联排列的Kunitz型抑制剂结构域(KPI-1、KPI-2和KPI-3)和碱性C-末端尾部组成的276个氨基酸的蛋白质(SEQ ID NO:1)。KPI-1、KPI-2和KPI-3结构域分别被定义为SEQ ID NO:1的残基26-76、残基97-147和残基189-239。成熟人TFPIβ是经由糖基磷脂酰肌醇(GPI)-锚共价连接至内皮细胞表面的193个氨基酸的蛋白质。TFPIβ的前161个氨基酸与TFPIα相同(对应于SEQ ID NO:1的残基1-161),而C-末端序列的最后12个氨基酸与TFPIα不相关,并且具有连接至残基193的GPI-锚。
本发明涉及结合TFPI的残基1-161内的两个不同和/或独特表位的双特异性抗体。各自具有独特抗原识别位点的两个单特异性抗体形成本发明双特异性抗体的抗原结合片段或“臂”的基础。该双特异性抗体的第一抗原结合片段(或“臂”)针对SEQ ID NO:1的氨基酸残基1-96内的表位;即,针对位于包含N末端、KPI-1结构域(SEQ ID NO:1的残基26-76)以及KPI-1与KPI-2结构域之间的连接区的区域内的表位。所述表位优选位于包含TFPI的氨基酸1-76的区域内。该双特异性抗体的第二抗原结合片段(或“臂”)针对SEQ ID NO:1的氨基酸77-161内的表位;即,包含KPI-1与KPI-2结构域之间的连接区、KPI-2结构域以及KPI-2与KPI-3结构域之间的连接区的TFPI区域。所述表位优选位于TFPI的KPI-2结构域(SEQ ID NO:1的残基97-147)内。
能够在SEQ ID NO:1的氨基酸77-161内,如在KPI-2结构域内结合的双特异性抗体的单臂本身可如同单特异性抗体一样,不能显著阻止TFPI的抑制活性。然而,当该双特异性抗体的另一臂与包含TFPI的氨基酸1-76的区域如TFPI的KPI-1结构域结合时,所述单臂可更显著地促进TFPI抑制的特异性阻断,反之亦然。
优选地,如本文所公开的双特异性KPI-1/KPI-2结合抗体的主要结合模式是分子内的,即其中该双特异性KPI-1/KPI-2结合抗体的两个臂与单个TFPI分子结合;而不是分子间的,即其中该双特异性KPI-1/KPI-2结合抗体的两个臂与不同的TFPI分子结合。分子内结合形成1∶1TFPI抗体复合物,而分子间结合模式可导致不希望的TFPI和双特异性抗体的较大装配体的形成。可通过降低其中一个抗体臂如KPI-1结合臂的亲和力来刺激分子内结合模式。
当比较本发明双特异性抗体的促凝血作用与衍生出该抗体的单特异性抗体的预期累加作用时,前者可具有优异的表现。例如,即使当TFPI的浓度相对于例如正常生理水平升高时,该双特异性抗体也可具有阻断TFPI所有抑制功能的能力。为了获得双特异性抗体如Fab-Fab缀合物(本文也称为BiFab),针对本发明两个不同表位的两个抗原结合片段的连接,由于亲合力效应,可导致比通过这两个不同抗原结合部分的组合效应所获得的更强的TFPI活性中和。
本发明的双特异性抗体可具有调节所有TFPI集合的活性的能力。
如本文中所使用的术语“TFPI”包括可来源于任何合适生物体的天然存在形式的组织因子途径抑制剂(TFPI)。例如,如本文所述使用的TFPI可以是哺乳动物TFPI,如人、小鼠、大鼠、灵长类、牛、羊、兔或猪TFPI。优选地,该TFPI是人TFPI。该TFPI可以是成熟形式的TFPI,如在合适的细胞内经历翻译后加工的TFPI蛋白质。这样的成熟TFPI蛋白质例如可被糖基化。该TFPI可以是全长TFPI蛋白质。术语TFPI还包括这样的TFPI分子的变体、同种型和其它同源物。TFPI活性是指其抑制活性。变异TFPI分子的特征通常在于具有与天然存在的TFPI相同类型的活性,如中和FXa的催化活性的能力或抑制TF-FVIIa/FXa复合物的能力。
本文中的术语“抗体”是指自免疫球蛋白序列衍生的蛋白质,其能够与抗原或其一部分特异性结合。术语抗体包括但不限于任何类别(或同种型)的全长抗体,即IgA、IgD、IgE、IgG、IgM和/或IgY。该术语也可包括全长抗体的一个或多个抗原结合片段。与抗原或其一部分特异性结合的抗体可仅与该抗原或其一部分结合,或者其可以与有限数目的同源性抗原或其部分结合。
天然的全长抗体通常包含至少四条多肽链:通过二硫键连接的两条重(H)链和两条轻(L)链。在一些情况下,天然抗体包含少于四条链,如在骆驼科动物中发现的仅含重链的抗体(VHH片段)和在软骨鱼类(Chondrichthyes)中发现的IgNAR的情况。药学上特别感兴趣的一类免疫球蛋白是IgG。在人类中,根据其重链恒定区的序列,IgG类别可被细分为四个亚类:IgG1、IgG2、IgG3和IgG4。根据其序列组成的差异,轻链可被分为两种类型:κ和λ链。IgG分子由两条通过两个或更多个二硫键相互连接的重链和两条各自通过二硫键连接至重链的轻链组成。IgG重链可包含一个重链可变区(VH)和最多三个重链恒定(CH)区:CH1、CH2和CH3。轻链可包含轻链可变区(VL)和轻链恒定区(CL)。VH和VL区可进一步细分为被称为互补决定区(CDR)或高变区(HvR)的高变性区域,其中散布有被称为框架区(FR)的更加保守的区域。VH和VL区通常由三个CDR和四个FR组成,它们从氨基末端到羧基末端以如下顺序排列:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。重链和轻链的具有高变区的可变域构成能够与抗原相互作用的结构域,而抗体的恒定区可以介导免疫球蛋白与宿主组织或因子的结合,该宿主组织或因子包括但不限于免疫系统的各种细胞(效应细胞)、Fc受体和经典补体系统的C1复合物的第一组分(C1q)。
如本文所使用的,术语“单特异性抗体”是指具有单一抗原识别位点(即,为单价)或各自对一个共同靶抗原具有特异性的两个相同抗原识别位点(即,为二价)的抗体。
本发明的单特异性抗体可以是单克隆抗体,从这种意义上讲,它们代表由单个B细胞或由B细胞的克隆群表达的一组独特的重链和轻链可变域序列。本发明的抗体可采用本领域技术人员已知的各种方法来生产和纯化。例如,抗体可由杂交瘤细胞产生。抗体可通过B细胞扩增来产生。抗体或其片段可以在哺乳动物或微生物表达系统中或通过体外翻译重组表达。抗体或其片段还可通过例如噬菌体展示、细菌展示、酵母展示、哺乳动物细胞展示或核糖体或mRNA展示重组表达为细胞表面结合分子。一旦产生,可以针对其结合TFPI(1-161)、全长TFPIα和TFPIβ,如人TFPI(1-161)、全长人TFPIα和人TFPIβ的能力筛选抗体。
抗体的抗原结合片段也可以是根据本发明的单特异性抗体,因为已经证明,抗体的抗原结合功能可由全长抗体的片段来行使。术语抗体的“抗原结合片段”是指一个或多个保留特异性结合或识别抗原的能力的抗体片段,该抗原例如是TFPIα如人TFPIα(SEQ ID NO:1),如人TFPI(1-161)(SEQ ID NO:2),如人TFPI KPI-2构建体(SEQ ID NO:3),或另一种靶分子,如本文所述。抗原结合片段的例子包括Fab、Fab′、Fab2、Fab′2、FabS、Fv(一般为抗体单臂的VL和VH域)、单链Fv(scFv;参见例如Bird等人,Science(1988)242:42S-426;和Huston等人PNAS (1988)85:5879-5883)、dsFv、Fd(一般为VH和CH1域)和dAb(一般为VH域)片段;VH、VL、VhH和V-NAR域;包含单条VH和单条VL链的单价分子;微体(minibodies)、双抗体(diabodies)、三抗体(triabodies)、四抗体(tetrabodies)和κ体(kappa bodies)(参见例如Ill等人Protein Eng(1997)10:949-57);骆驼IgG;IgNAR;以及一个或多个分离的CDR或功能互补位,其中分离的CDR或抗原结合残基或多肽可以缔合或连接在一起,从而形成功能抗体片段。各种类型的抗体片段已在例如Holliger和Hudson,Nat Biotechnol(2005)23:1126-1136、WO2005040219以及公开的美国专利申请20050238646和20020161201中描述或综述。这些抗体片段可采用本领域技术人员已知的常规技术获得,并且可以以与完整抗体相同的方式针对应用性筛选这些片段。
抗体的“Fab片段”,包括“Fab”、“Fab”’和“Fab’2”片段,可通过在连接抗体重链的铰链半胱氨酸残基的N-末端或C-末端侧上的铰链区中切割重链而由所述抗体得到。“Fab”片段包括轻链的可变域和恒定域以及重链的可变域和第一个恒定域(CH1)。“Fab′2”片段包含一对通常通过其铰链半胱氨酸共价连接的“Fab”’片段。Fab′通过切割Fab′2中连接重链的铰链二硫键而在形式上衍生自Fab′2片段。除了抗体片段的二硫键连接以外的其它化学偶联也是本领域已知的。Fab片段保留了亲本抗体与其抗原结合的能力,潜在地具有更低的亲和力。Fab′2片段能够二价结合,而Fab和Fab’片段可以单价结合。通常,Fab片段缺乏恒定CH2和CH3域,即在其中将发生与Fc受体的相互作用的Fc部分。因此,Fab片段通常缺乏效应子功能。Fab片段可以通过本领域已知的方法通过抗体的酶切而产生,例如使用木瓜蛋白酶以获得Fab或使用胃蛋白酶以获得Fab′2,包括Fab、Fab′、Fab′2在内的Fab片段可以使用本领域技术人员公知的技术重组产生。
“Fv”片段是含有完全抗原识别和结合位点的抗体片段,且一般包含缔合(其在性质上可以是共价的)的一个重链可变域和一个轻链可变域的二聚体,例如在单链可变域片段(scFv)中。以这种构型,每个可变域的三个高变区相互作用,以在VH-VL二聚体表面上限定抗原结合位点。六个高变区或其亚组共同地对抗体赋予抗原结合特异性。然而,即使仅包含三个抗原特异性高变区的单个可变域也可保留识别并结合抗原的能力,尽管其亲和力通常低于完整的结合位点(Cai和Garen,Proc.Natl.Acad.Sci.USA(1996)93:6280-6285)。例如,仅具有重链可变域(VHH)的天然存在的骆驼科抗体可以结合抗原(Desmyter等人,J.Biol.Chem.,(2002)277:23645-23650;Bond等人,J.Mol.Biol.(2003)332:643-655)。
“单链Fv”或“scFv”抗体片段包含抗体的VH和VL域,其中这些结构域存在于单条多肽链中。通常,Fv多肽进一步在VH和VL域之间包含多肽接头,该接头使得scFv能够形成用于抗原结合的所需结构。关于scFv的综述,参见Pluckthun,1994,In:The Pharmacology of Monoclonal Antibodies,Vol.113,Rosenburg and Moore eds.Springer-Verlag,New York,pp.269-315。
术语“双抗体(diabodies)”是指具有两个抗原结合位点的小抗体片段,其中片段包含同一多肽链(VH和VL)中连接至轻链可变域(VL)的重链可变域(VH)。通过使用由于过短而无法允许在同一条链上的两个可变域之间配对的接头,使得这些可变域与另一条链的互补结构域配对,从而产生两个抗原结合位点。双抗体在例如EP 404,097、WO 93/11161以及Hollinger等人,1993,Proc.Natl.Acad.Sci.USA,90:6444-6448中更全面地描述。
表述“线性抗体”是指如在Zapata等人,1995,Protein Eng.8(10):1057-1062中描述的抗体。简言之,这些抗体含有一对串联的Fd区段(VH-CH1-VH-CH1),该区段与互补的轻链多肽一起形成一对抗原结合区。线性抗体可以是双特异性的或单特异性的。
可采用常规的重组或蛋白质工程技术获得抗体片段,并且可以以与完整抗体相同的方式,如本文所述,针对与TFPI(1-161)、全长TFPIα和TFPIβ或TFPI另一部分的结合筛选这些片段。
本发明的抗体片段可通过截短,例如通过从多肽的N-末端和/或C-末端去除一个或多个氨基酸来制备。也可以通过一个或多个内部缺失来生成片段。
本文中的术语“双特异性抗体”是指具有两个不同和/或独特的抗原识别位点的抗体,这使抗体能够结合两种不同的抗原或同一抗原上的两个不同表位。术语“多特异性抗体”是指具有结合两种或更多种不同抗原或者同一抗原上两个或更多个不同表位的能力的抗体。因此,多特异性抗体包括双特异性抗体。
本发明的双特异性抗体可以是IgG形式的全长双特异性抗体。可通过融合两个单独的杂交瘤以形成产生包括双特异性异二聚化抗体一部分的抗体混合物的杂交四源杂交瘤(quadroma),来产生模拟天然抗体的全长IgG形式的双特异性抗体(Chelius D.等人;MAbs.2010年5-6月;2(3):309-319)。或者,可通过使用重组技术产生双特异性异二聚化抗体。也可通过工程改造Fc区的二聚化界面以促进异二聚化来实现异二聚化。其中一个实例是所谓的杵臼(knob-in-hole)突变,其中将空间上大的侧链(杵)引入一个Fc中,该Fc与相对Fc上空间上小的侧链(臼)相匹配,从而创建促进异二聚化的空间互补。用于工程改造异二聚化Fc界面的其它方法是静电互补,与非IgG异二聚化结构域融合,或利用人IgG4的天然Fab-臂交换现象来控制异二聚化。异二聚化的双特异性抗体的实例在文献中详细描述,例如,(Klein C等人;MAbs.2012年11-12月;4(6):653-663)。必须特别注意异二聚体抗体中的轻链。可通过使用共同的轻链来实现LC与HC的正确配对。此外,LC/HC界面的工程化可用来促进异二聚化或如CrossMab中的轻链交叉工程化。来自含有适当突变的两个单独IgG的抗体在温和还原条件下的体外重装配还可用来产生双特异性抗体(例如,Labrijn等人,PNAS,110,5145-5150(2013))。还报道了天然Fab-臂交换方法以确保正确的轻链配对。
还可将基于多特异性抗体的分子重组表达为组合了IgG的天然模块的融合蛋白,以形成如文献中所述的多特异性和多价抗体衍生物。融合抗体的实例是DVD-Ig、IgG-scFV、双抗体、DART等(Kontermann,MAbs.2012年3-4月4(2):182-197)。可将特异性检测或纯化标签、半衰期延长部分或其它组分并入融合蛋白中。也可将其它非IgG模块并入融合蛋白中。不论LC配对方法如何,通常都将基于FC异二聚化的双特异性全长抗体称为不对称IgG。
还可通过化学缀合或偶联各个全长IgG或偶联IgG的片段来产生基于多特异性抗体的分子,以形成如文献中所述的多特异性和多价抗体衍生物。融合抗体的实例是化学偶联的Fab’2、IgG二聚体等(Kontermann,MAbs.2012年3-4月4(2):182-197)。可将特异性检测或纯化标签、半衰期延长分子或其它组分并入缀合蛋白中。还可将其它非IgG多肽并入融合蛋白中。在实施例中提供了这类双特异性抗体的实例。
还可通过组合包括上述方法在内的重组和化学方法来产生多特异性分子。
本发明的双特异性抗体可以是两个抗原结合片段的化学缀合物,如两个Fab片段(BiFab)或两个scFv片段的缀合物。可通过本领域技术人员已知的方法来产生结合TFPI上的两个独特表位的双特异性抗体或两种单特异性抗体。例如,可通过两个抗体片段,如两个Fab或scFv片段的直接化学缀合或经由为正常功能提供所需柔性的接头的化学缀合来制备双特异性形式。一种用于偶联Fab片段的具体方法是使用置于Fab片段适当位置的半胱氨酸残基中的巯基官能团。
可通过两个抗体或其片段(与TFPI的不同表位结合)的化学缀合来获得本发明的双特异性或双功能性抗体,如J Immunol 1987;139:2367-2375或J Immunol 2001;166:1320-1326中所述,或如下所述:
mAb1(或片段)-mAb2(或片段)
mAb1(或片段)-接头-mAb2(或片段)
连接可以是单个共价键(直接连接)或包含二价基团,该二价基团通常描述为:
其中X至少是但不限于一个选自碳、氧、硫、磷和氮的原子。*表示该二价基团的连接位置。术语“二价基团”是指具有两个彼此独立起作用的自由基中心的偶电子化学化合物。
在一个实施方案中,接头是由不多于40个原子组成的链。
在一个实施方案中,在接头中使用的化学部分包括具有以下结构的二价基团:
在一个实施方案中,接头部分包含具有对称结构的二价基团(同型双功能化接头)。
接头还可以是具有与以上描述类似的结构的聚合物。
在一个实施方案中,在接头中使用的化学部分包括聚合物:由通过共价化学键连接的两个或更多个重复结构单元组成的大分子。这样的聚合物可以是亲水的。
术语亲水的或“水溶性的”是指在水中具有某种可检测程度的溶解度的部分。检测和/或定量水溶解度的方法是本领域公知的。
根据本发明的示例性水溶性聚合物包括肽、糖、(聚)醚、(聚)胺、(聚)羧酸等。肽可具有混合序列或可由单种氨基酸组成,例如(聚)赖氨酸。一种示例性多糖是(聚)唾液酸。一种示例性(聚)醚是(聚)乙二醇。(聚)乙烯亚胺是一种示例性聚胺,而(聚)丙烯酸是一种典型的(聚)羧酸。
许多其它聚合物也适用于本发明。水溶性的聚合物主链在本发明中特别有用。合适的聚合物的实例包括但不限于,其它聚(亚烷基二醇)如聚(丙二醇)(“PPG”)、乙二醇和丙二醇的共聚物等,聚(氧乙基化多元醇),聚(乙烯吡咯烷酮),聚(羟丙基甲基丙烯酰胺),聚(α-羟酸),聚(乙烯醇),聚膦腈,聚噁唑啉,聚(N-烯丙酰吗啉),如第5,629,384号美国专利中所述,其整体通过引用并入本文,以及它们的共聚物、三元共聚物及混合物。
聚合接头优选是线性的。
尽管每一单独聚合物链的分子量可以变化,但聚合物的平均分子量通常在约1000Da(1kDa)至约40,000Da(40kDa)的范围内,诸如约1000Da至约12,000Da,如约2,000Da至约11,000Da,如约2000Da至约3,000Da;约3000Da至约4,000Da;约4000至约5,000Da;约5000至约6,000Da;约6,000至约7,000Da;约7,000至约8,000Da;约8,000至约9,000Da;约9,000至约10,000Da;或约10,000至约11,000Da。应当理解,这些大小表示估计值而非精确测量值。根据优选的实施方案,本发明的分子与亲水性聚合物的异质群体缀合。
在一个具体实施方案中,在接头中使用的化学部分包括聚乙二醇(PEG)。
本文中的术语“PEG”是指包含以下结构的二价基团:
其中n’是大于1的整数。
PEG通过环氧乙烷的聚合反应来制备,并且可在大范围的分子量下商购获得。根据本发明使用的PEG优选是线性的。
此外,“PEG”可指具有或不具有偶联剂、偶联或活化部分(例如,具有羧酸/活性酯、酮基、烷氧基胺、硫醇、三氟甲磺酸酯、三氟乙基磺酸酯(tresylate)、吖丙啶、环氧乙烷、炔、叠氮化物或马来酰亚胺部分)的聚乙二醇化合物或其衍生物。本文提及的其它接头也可以具有或不具有偶联剂、偶联或活化部分(例如,具有羧酸/活性酯、酮基、烷氧基胺、硫醇、三氟甲磺酸酯、三氟乙基磺酸酯、吖丙啶、环氧乙烷、炔、叠氮化物或马来酰亚胺部分)
在一个具体实施方案中,根据本发明使用的PEG是单分散的。在另一具体实施方案中,根据本发明使用的PEG是多分散的。
多分散PEG由具有不同分子量的PEG分子组成。大小分布可通过其重均分子量(Mw)和其数均分子量(Mn)在统计学上表征,其比值被称为多分散性指数(Mw/Mn)(参见例如“Polymer Synthesis and Characterization”,J.A.Nairn,University of Utah,2003)。可通过质谱法来测量Mw和Mn。
多分散性指数可以是大于或等于1的数值,并且可由凝胶渗透色谱数据估算。当多分散性指数为1时,产物是单分散的,并因此由具有单一分子量的化合物组成。当多分散性指数大于1时,聚合物是多分散的,并且该多分散性指数表明具有不同分子量的聚合物的分布广泛性。多分散性指数通常随着PEG分子量的增加而增加。在具体实施方案中,根据本发明使用的PEG的多分散性指数:i)低于1.06,ii)低于1.05,iii)低于1.04,iv)低于1.03,或v)在1.02与1.03之间。
根据用于聚合过程的起始剂,可获得不同形式的PEG。
在Advanced Drug Delivery Reviews,2002,54,459-476,Nature Reviews Drug Discovery,2003,2,214-221DOI:10.1038/nrd1033,Adv Polym Sci,2006,192,95-134,DOI 10.1007/12_022,Springer-Verlag,Berlin Heidelberg,2005,以及其中的参考文献中描述了用于PEG取代基缀合的多种方法。或者,可通过使用酶促方法来进行亲水聚合物取代基的缀合。这样的方法例如是使用如WO2006134148中所述的转谷氨酰胺酶。
为了实现聚合物分子与多肽的共价连接,以活化形式提供聚合物分子的端基,即具有反应性官能团。合适的活化聚合物分子可商购获得,例如来自Aldrich Corporation,St.Louis,MO,USA,Rapp Polymere GmbH,Tübingen,Germany或来自PolyMASC Pharmaceuticals plc,UK。或者,可通过本领域已知的常规方法激活聚合物分子,例如,如WO 90/13540中所公开的。在第5,932,462和5,643,575号美国专利中公开了活化的PEG聚合物的具体实例。此外,下列公开文本公开了有用的聚合物分子和/或聚乙二醇化化学反应:WO2003/031464,WO2004/099231。
可通过使用任何常规方法来进行单克隆抗体或其片段与活化的聚合物分子的缀合,例如,如下列参考文献(其也描述了用于聚合物分子活化的合适方法)所述:R.F.Taylor,(1991),″Protein immobilisation.Fundamental and applications″,Marcel Dekker,N.Y.;S.S.Wong,(1992),″Chemistry of Protein Conjugation and Crosslinking″,CRC Press,Boca Raton;G.T.Hermanson等人,(1993),″Immobilized Affinity Ligand Techniques″,Academic Press,N.Y.,Bioconjugate Techniques,第二版,Greg T.Hermanson,2008,Amsterdam,Elsevier。熟练的技术人员将意识到,待使用的活化方法和/或缀合化学反应取决于多肽的连接基团(其实例在上文进一步给出)以及聚合物的官能团(例如,为胺、羟基、羧基、醛、巯基、琥珀酰亚胺基、马来酰亚胺、乙烯基砜或卤代乙酸酯)。聚乙二醇化可针对与多肽上可用的连接基团(即暴露在多肽表面的这类连接基团)缀合,或者可针对一个或多个特定连接基团,例如N-末端氨基或巯基。此外,可在一个步骤中或以逐步的方式实现缀合。
在另一实施方案中,用作接头的化学部分是羟乙基淀粉。如本文中所用的术语“羟乙基淀粉”(HES/HAES)是指非离子淀粉衍生物。不同类型的羟乙基淀粉通常通过它们的平均分子量进行描述,通常约为130至200kDa。
在另一实施方案中,在接头中使用的化学部分包括聚唾液酸。
在另一实施方案中,在接头中使用的化学部分包括在例如Glycobiology(2011)21:1331-1340中描述的肝素前体(heparosan)聚合物。
在另一实施方案中,使用接头中的化学部分使至少一种蛋白质与聚糖连接:与蛋白质连接的多糖或寡糖。
在另一实施方案中,使用接头中的化学部分使至少一种蛋白质与O-连接的聚糖连接。
在另一实施方案中,使用接头中的化学部分使至少一种蛋白质与N-连接的聚糖连接。
通过产生这些蛋白质的细胞使N-聚糖和O-聚糖均与蛋白质如抗体连接。当新生蛋白从核糖体转移至内质网时,细胞N-糖基化机制识别氨基酸链中的N-糖基化信号(N-X-S/T基序)并使其糖基化(Kiely等人,J.Biol.Chem.1976,251:5490;Glabe等人,J.Biol.Chem.,1980,255,9236)。同样,使O-聚糖连接至氨基酸链中的特异性O-糖基化位点,但是触发O-糖基化的基序比N-糖基化信号更异质,并且我们预测氨基酸序列中O-糖基化位点的能力仍然不足(Julenius等人,Glycobiology,2005,15:153)。例如在WO0331464中描述了使多肽与各种聚合的侧基缀合的方法。
在另一实施方案中,在接头中使用的化学部分包括用来连接所述接头与至少一种蛋白质的化学部分,具有以下二价基团的所选结构:
本发明的双特异性抗体可以是人、人源化、嵌合或工程抗体。
如本文所用的,术语“人抗体”旨在包括具有可变区的抗体,在该可变区中,框架区的至少一部分和/或CDR区的至少一部分来源于人种系免疫球蛋白序列。(例如,人抗体可具有其中框架区和CDR区均来源于人种系免疫球蛋白序列的可变区。)此外,如果抗体含有恒定区,则该恒定区或其一部分也来源于人种系免疫球蛋白序列。本发明的人抗体可包括不是由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性突变或通过体内体细胞突变引入的突变)。
这样的人双特异性抗体可以来源于两种人单克隆抗体。人单克隆抗体可以由杂交瘤产生,该杂交瘤包括与无限增殖化细胞融合的B细胞,该B细胞从转基因非人类动物例如转基因小鼠获得,具有包含人免疫球蛋白重链和轻链基因区段的所有组成成分的基因组。
人抗体可以从基于人种系序列的选择而建立的、用天然和合成序列多样性进一步多样化的序列文库中分离。
人抗体可通过人淋巴细胞的体外免疫及随后用EB病毒转化该淋巴细胞来制备。
术语“人抗体衍生物”是指人抗体的任何修饰形式,如抗体与另一种物质或抗体的缀合物。
如本文所用的,术语“人源化抗体”是指含有来源于非人免疫球蛋白的序列元件(CDR区或其部分)的人/非人嵌合抗体。因此,人源化抗体是这样的人免疫球蛋白(接受体抗体),其中至少来自该接受体的高变区的残基被来自非人类物种如小鼠、大鼠、兔或非人灵长类动物的抗体(供体抗体)的高变区的、具有所需特异性、亲和力、序列组成和功能性的残基所替代。在一些情况下,人免疫球蛋白的框架(FR)残基被相应的非人类残基所替代。这种修饰的一个实例是一个或多个所谓的回复突变的引入,该回复突变一般是来源于供体抗体的氨基酸残基。抗体的人源化可采用本领域技术人员已知的重组技术进行(参见,例如,Antibody Engineering,Methods in Molecular Biology,vol.248,由Benny K.Lo编著)。对轻链和重链可变域均适合的人类接受体框架可通过例如序列或结构同源性来鉴定。或者,例如,可基于对结构、生物物理学和生物化学性质的了解使用固定的接受体框架。该接受体框架可以是种系衍生的或衍生自成熟的抗体序列。来自供体抗体的CDR区可以通过CDR移植进行转移。可通过确定关键框架位置来进一步在例如亲和力、功能性和生物物理学性质方面优化CDR移植的人源化抗体,在该关键框架位置处再次引入(回复突变)来自供体抗体的氨基酸残基对人源化抗体的性质具有有利影响。除了来源于供体抗体的回复突变外,还可通过在CDR或框架区中引入种系残基、消除免疫原性表位、定点突变、亲和力成熟等对人源化抗体进行工程化。
此外,人源化抗体可包含在接受体抗体或供体抗体中未发现的残基。进行这些修饰以进一步改善抗体性能。通常,人源化抗体将包含至少一个-一般两个-可变域,其中全部或基本上全部的CDR区对应于非人免疫球蛋白的CDR区,并且其中全部或基本上全部的FR残基是人免疫球蛋白序列的FR残基。人源化抗体也可任选地包含免疫球蛋白恒定区的至少一部分(Fc),一般是人免疫球蛋白的相应部分。
术语“人源化抗体衍生物”是指人源化抗体的任何修饰形式,如抗体与另一种化学剂或抗体或抗体片段或多肽的缀合物。
如本文所用的,术语“嵌合抗体”是指这样的抗体,其轻链和重链基因已经从起源于不同物种的免疫球蛋白可变区和恒定区基因构建,一般是通过遗传工程化构建。例如,来自小鼠单克隆抗体的基因的可变区段可连接到人恒定区。
抗体的片段可结晶区(“Fc区”/“Fc域”)是包含恒定CH2和CH3域的抗体C-末端区。Fc域可与被称为Fc受体的细胞表面受体以及补体系统的一些蛋白质相互作用。Fc区使得抗体能够与免疫系统相互作用。在本发明的一个方面,可对抗体进行工程化以在Fc区内包含修饰,一般用于改变其一种或多种功能性质,如血清半衰期、补体固定、Fc受体结合、蛋白质稳定性和/或抗原依赖性细胞毒性,或这些性质的缺乏,等等。此外,可对本发明的抗体进行化学修饰(例如,可将一个或多个化学部分连接至该抗体)或进行修饰以改变其糖基化,从而再次改变该抗体的一种或多种功能性质。IgG1抗体可携带修饰的Fc域,该Fc域包含以下突变中的一个或多个以及可能全部,这些突变将分别导致对某些Fc受体的亲和力降低(L234A、L235E和G237A)以及C1q介导的补体固定减少(A330S和P331S)(残基根据EU索引编号)。
本发明抗体的同种型可以是IgG,如IgG1,如IgG2,如IgG4。如果需要,抗体的类别可通过已知技术进行“转换”。例如,最初作为IgM分子产生的抗体可类别转换为IgG抗体。类别转换技术还可用来将一个IgG亚类转换成另一个亚类,例如:从IgG1转换成IgG2或IgG4;从IgG2转换成IgG1或IgG4;或从IgG4转换成IgG1或IgG2。还可以进行通过来自不同IgG亚类的区域的组合而生成恒定区嵌合分子的抗体工程化。
在一个实施方案中,对CH1的铰链区进行修饰,使得该铰链区中的半胱氨酸残基的数目改变,例如增加或减少。该方法在例如Bodmer等人的第5,677,425号美国专利中进一步描述。
可对恒定区进行修饰以使抗体稳定化,例如,降低二价抗体分离成两个单价VH-VL片段的风险。例如,在lgG4恒定区中,残基S228(根据EU编号索引,根据Kabat为S241)可突变成脯氨酸(P)残基,以使铰链处的重链间二硫键形成稳定化(参见,例如,Angal等人,Mol Immunol.1993;30:105-8)。
本发明的双特异性抗体可包含mAb 2F3抗体、mAb 2F22抗体(如Fab 0295或Fab 0296)、mAb 2F45抗体或mAb 1F91抗体的抗原结合片段或其变体。
本发明的双特异性抗体可进一步包含mAb 2021抗体的抗原结合片段或其变体,该抗体是在WO2010/072691中首次描述的人源化单克隆抗体,并且由此通过引用而并入。这类抗原结合片段或其变体的实例包括如本文描述的Fab 0088、Fab 0094或Fab 0313。衍生出mAb 2021的单克隆鼠抗体可以如WO2010/072691所述产生。
包含mAb 2F3、mAb 2F22、mAb 2F45或mAb 1F91的抗原结合片段或其变体和mAb 2021的抗原结合片段或其变体的上述双特异性抗体中的任一种可以是IgG形式的全长双特异性抗体或由抗体片段组成的双特异性分子。抗体或其片段可按照其互补决定区(CDR)来定义。术语“互补决定区”或“高变区”在本文中使用时是指参与抗原结合的氨基酸残基位于其中的抗体区域。高变区或CDR可被鉴定为在抗体可变域的氨基酸比对中具有最高可变性的区域。数据库如Kabat数据库可用于CDR鉴定,例如,CDR被定义为包含轻链可变域的氨基酸残基24-34(L1)、50-56(L2)和89-97(L3)以及重链可变域的31-35(H1)、50-65(H2)和95-102(H3);(Kabat等人,Sequences of Proteins of Immunological Interest,1991)Sequences of Proteins of Immunological Interest,第五版,U.S.Department of Health and Human Services,NIH Publication No.91-3242)。或者,CDR可被定义为来自“高变环”的那些残基(轻链可变域中的残基26-33(L1)、50-52(L2)和91-96(L3)以及重链可变域中的26-32(H1)、53-55(H2)和96-101(H3);Chothia和Lesk,J.Mol.Biol 1987;196:901-917)。通常,该区域中氨基酸残基的编号通过在Kabat等人(同上)中描述的方法进行。本文中的短语如“Kabat位置”、“Kabat残基”和“根据Kabat”是指用于重链可变域或轻链可变域的这一编号体系。通过使用Kabat编号体系,肽的实际线性氨基酸序列可含有较少的或额外的氨基酸,这对应于可变域的框架(FR)或CDR的缩短或向其中的插入。例如,重链可变域可包含在CDR H2的残基52后的氨基酸插入(根据Kabat的残基52a、52b和52c)以及在重链FR残基82后插入的残基(例如,根据Kabat的残基82a、82b和82c等)。可通过将抗体序列的同源性区域与“标准的”Kabat编号的序列进行比对,来确定给定抗体的残基的Kabat编号。
术语“框架区”或“FR”残基是指如本文定义的不在CDR内的那些VH或VL氨基酸残基。
本发明双特异性抗体的抗原识别位点可包含来自一种或多种本文公开的特异性抗体或抗体片段的CDR区,如来自SEQ ID NO:4至11、14至15、17至26内的CDR区,如根据本文公开的连续氨基酸编号或使用Kabat编号所定义的。
所述双特异性抗体的第一抗原识别位点可具有重链,该重链包含:
●对应于SEQ ID NO:4的氨基酸31至35(SYGVH)的CDR1序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:4的氨基酸50至65(VIWRGGSTDFNAAFMS)的CDR2序列,其中这些氨基酸中的一个、两个或三个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:4的氨基酸98至110(NSHGNYVGYAMDY)的CDR3序列,其中这些氨基酸残基中的一个或两个可被不同的氨基酸置换。
并且所述第一抗原识别位点可具有轻链,该轻链包含:
●对应于SEQ ID NO:5的氨基酸24至34(KASENVGAAVA)的CDR1序列,其中这些氨基酸残基中的一个、两个或三个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:5的氨基酸50至56(SASNRYT)的CDR2序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换;如/或
●对应于SEQ ID NO:5的氨基酸89至96(QQYTNYPT)的CDR3序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换。
所述双特异性抗体的第一抗原识别位点可具有重链,该重链包含:
●对应于SEQ ID NO:6的氨基酸31至35(NYGVH)的CDR1序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:6的氨基酸50至65(VIWRGGSIDYNAAFMS)的CDR2序列,其中这些氨基酸中的一个、两个或三个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:6的氨基酸98至110(NSHGNYVGYAMDY)的CDR3序列,其中这些氨基酸残基中的一个或两个可被不同的氨基酸置换。
并且所述第一抗原识别位点可具有轻链,该轻链包含:
●对应于SEQ ID NO:7的氨基酸24至34(KASQSVGPAVA)的CDR1序列,其中这些氨基酸残基中的一个、两个或三个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:7的氨基酸50至56(SASNRYT)的CDR2序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:7的氨基酸89至96(QQYTSYPT)的CDR3序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换。
所述双特异性抗体的第一抗原识别位点可具有重链,该重链包含:
●对应于SEQ ID NO:8的氨基酸31至35(GYGVH)的CDR1序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:8的氨基酸50至65(VIWRGGSIDYNAAFMS)的CDR2序列,其中这些氨基酸中的一个、两个或三个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:8的氨基酸98至110(NSHGNYVGYAMDY)的CDR3序列,其中这些氨基酸残基中的一个或两个可被不同的氨基酸置换。
并且所述第一抗原识别位点可具有轻链,该轻链包含:
●对应于SEQ ID NO:9的氨基酸24至34(KASQNVGTAVA)的CDR1序列,其中这些氨基酸残基中的一个、两个或三个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:9的氨基酸50至56(SASNRYT)的CDR2序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:9的氨基酸89至96(QQYTSYPT)的CDR3序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换。
所述双特异性抗体的第一抗原识别位点可具有重链,该重链包含:
●对应于SEQ ID NO:10的氨基酸31至36(SDYAWN)的CDR1序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:10的氨基酸51至66(YISYSGSTSYNPSLKS)的CDR2序列,其中这些氨基酸中的一个、两个或三个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:10的氨基酸99至104(WAYDGP)的CDR3序列,其中这些氨基酸残基中的一个可被不同的氨基酸置换。
并且所述第一抗原识别位点可具有轻链,该轻链包含:
●对应于SEQ ID NO:11的氨基酸24至33(RASSSVSHMH)的CDR1序列,其中这些氨基酸残基中的一个或两个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:11的氨基酸49至55(ATSNLAS)的CDR2序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:11的氨基酸88至96(QQWSSNPFT)的CDR3序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换。
所述双特异性抗体的第二抗原识别位点可具有重链,该重链包含:
●对应于SEQ ID NO:19的氨基酸31至35(NYAMS)的CDR1序列,其中这些氨基酸中的一个可被不同的氨基酸置换;和/或
●对应于SEQ ID NO:19的氨基酸50至66(TISRSGSYSYFPDSVQG)、SEQ ID NO:21的氨基酸50至66(TISRSGSYSYYPDSVKG)或SEQ ID NO:25的氨基酸50至66(TISRSGSYSYYADSVKG)的CDR2序列,其中这些氨基酸中的一个、两个或三个可被不同的氨基酸置换;和/或
●对应于SEQ ID NO:19的氨基酸99至110(LGGYDEGDAMDS)的CDR3序列,其中这些氨基酸中的一个、两个或三个可被不同的氨基酸置换。
并且所述第二抗原识别位点可具有轻链,该轻链包含:
●对应于SEQ ID NO:20的氨基酸24至39(KSSQSLLESDGKTYLN)的CDR1序列,其中这些氨基酸中的一个、两个或三个可被不同的氨基酸置换;和/或
●对应于SEQ ID NO:20的氨基酸55至61(LVSILDS)的CDR2序列,其中这些氨基酸中的一个或两个可被不同的氨基酸置换;和/或
●对应于SEQ ID NO:20的氨基酸94至102(LQATHFPQT)的CDR3序列,其中这些氨基酸中的一个或两个可被不同的氨基酸置换。
所述氨基酸置换可以是如下描述的保守置换。
因此,TFPI(1-79)特异性抗体片段与其KPI-2结构域特异性抗体片段组合以形成尤其为融合形式、IgG片段形式、全长IgG形式或作为Fab-Fab缀合物(BiFab)的双特异性抗体。
在一个这样的实施方案中,携带mAb 1F91的VH和VL区(SEQ ID NO:10,11)的Fab片段与携带mAb 2021的VH、VL区(SEQ ID NO:19,20)的Fab片段组合。
在一个这样的实施方案中,携带mAb 1F91的VH和VL区(SEQ ID NO:10,11)的Fab片段与Fab片段0094(SEQ ID NO:21,22)组合。
在一个这样的实施方案中,携带mAb 1F91的VH和VL区(SEQ ID NO:10,11)的Fab片段与Fab片段0313(SEQ ID NO:25,26)组合。
在一个这样的实施方案中,携带mAb 2F3的VH和VL区(SEQ ID NO:4,5)的Fab片段与携带mAb 2021的VH、VL区(SEQ ID NO:19,20)的Fab片段组合。
在一个这样的实施方案中,携带mAb 2F3的VH和VL区(SEQ ID NO:4,5)的Fab片段与Fab片段0094(SEQ ID NO:21,22)组合。
在一个这样的实施方案中,携带mAb 2F3的VH和VL区(SEQ ID NO:4,5)的Fab片段与Fab片段0313(SEQ ID NO:25,26)组合。
在一个这样的实施方案中,携带mAb 2F22的VH和VL区(SEQ ID NO:6,7)的Fab片段与携带mAb 2021的VH、VL区(SEQ ID NO:19,20)的Fab片段组合。
在一个这样的实施方案中,携带mAb 2F22的VH和VL区(SEQ ID NO:6,7)的Fab片段与Fab片段0094(SEQ ID NO:21,22)组合。
在一个这样的实施方案中,携带mAb 2F22的VH和VL区(SEQ ID NO:6,7)的Fab片段与Fab片段0313(SEQ ID NO:25,26)组合。
在一个这样的实施方案中,携带mAb 2F45的VH、VL区(SEQ ID NO:8,9)的Fab片段与mAb 2021的Fab片段(SEQ ID NO:19,20)组合。
在一个这样的实施方案中,携带mAb 2F45的VH和VL区(SEQ ID NO:8,9)的Fab片段与Fab片段0094(SEQ ID NO:21,22)组合。
在一个这样的实施方案中,携带mAb 2F45的VH和VL区(SEQ ID NO:8,9)的Fab片段与Fab片段0313(SEQ ID NO:25,26)组合。
根据本发明的一种Fab-Fab缀合物(BiFab)可以是与Fab 0295(SEQ ID NO:15,18)缀合的BiFab 9041(Fab 0088(SEQ ID NO:23,24)。
根据本发明的另一种Fab-Fab缀合物(BiFab)可以是BiFab 9042,即与Fab 0295(SEQ ID NO:15,18)缀合的Fab 0313(SEQ ID NO:25,26)。
在一个实施方案中,全长形式的双特异性抗体(mAb 0421)由来自mAb 0310(SEQ ID NO:27,28)和mAb 0336(SEQ ID NO:15,29)的单独臂组成。变异抗体可以包含1、2、3、4、5、可达10个或更多个相对于以上讨论的特定序列和片段的氨基酸置换和/或缺失和/或插入。“缺失”变体可以包含单独氨基酸的缺失,小组氨基酸如1、2、3、4或5个氨基酸的缺失,或更大氨基酸区域的缺失,诸如特定氨基酸结构域或其它特征的缺失。“插入”变体可以包含单独氨基酸的插入,小组氨基酸如1、2、3、4或5个氨基酸的插入,或更大氨基酸区域的插入,诸如特定氨基酸结构域或其它特征的插入。“置换”变体优选地涉及用相同数目的氨基酸替换一个或多个氨基酸,以及进行保守氨基酸置换。例如,可以将氨基酸置换为具有类似性质的替代氨基酸,例如,另一个碱性氨基酸、另一个酸性氨基酸、另一个中性氨基酸、另一个带电荷的氨基酸、另一个亲水氨基酸、另一个疏水氨基酸、另一个极性氨基酸、另一个芳族氨基酸或另一个脂族氨基酸。可以用来选择合适的取代基的20种主要氨基酸的某些性质如下:
优选的“衍生物”或“变体”包括这样的“衍生物”或“变体”,其中出现在序列中的氨基酸不是天然存在的氨基酸,而是它们的结构类似物。也可以衍生化或修饰,例如标记在序列中使用的氨基酸,只要抗体的功能不会显著地受到不利影响即可。
置换可以是但不限于保守置换。
在抗体合成过程中,或通过生产后修饰,或当抗体为重组形式时,可以使用定点突变、随机突变或核酸的酶切和/或连接的已知技术制备如上所述的衍生物和变体。
本发明还涉及编码本发明抗体的多核苷酸。因此,本发明的多核苷酸可编码如本文描述的任何抗体。术语“核酸分子”和“多核苷酸”在本文中可互换使用,并且指代任意长度的核苷酸的聚合形式,该核苷酸是脱氧核糖核苷酸或核糖核苷酸,或它们的类似物。多核苷酸的非限制性实例包括基因、基因片段、信使RNA(mRNA)、cDNA、重组多核苷酸、质粒、载体、任意序列的分离的DNA、任意序列的分离的RNA、核酸探针和引物。本发明的多核苷酸可以以分离的或纯化的形式提供。“编码”所选择的多肽的核酸序列是这样的核酸分子,当置于适当调节序列的控制下时,其在体内被转录(在DNA的情况下)和翻译(在mRNA的情况下)成多肽。编码序列的边界由在5′(氨基)末端的起始密码子和在3′(羧基)末端的翻译终止密码子决定。对于本发明而言,这样的核酸序列可以包括但不限于来自病毒、原核或真核mRNA的cDNA,来自病毒或原核DNA或RNA的基因组序列,以及甚至合成的DNA序列。转录终止序列可以位于编码序列的3′侧。
在一个实施方案中,本发明的多核苷酸包含编码如上所述的VH或VL氨基酸序列的序列。例如,本发明的多核苷酸可以编码如上所述包含SEQ ID NO:4-11、14-15或17-26中任一个的序列的多肽。或者,合适的多核苷酸序列可以是这些具体多核苷酸序列之一的变体。例如,变体可以是任何上述核酸序列的置换、缺失或添加变体。相对于在序列表中给出的序列,变异多核苷酸可以包含1、2、3、4、5、可达10、可达20、可达30、可达40、可达50、可达75个或更多个核酸置换和/或缺失。
合适的变体可与编码本发明多肽的多核苷酸至少70%同源,优选至少80%或90%同源,更优选至少95%、97%或99%同源。测量同源性的方法是本领域公知的,并且本领域技术人员应当理解,在本文中,以核酸同一性为基础来计算同源性。这样的同源性可存在于至少15个,优选至少30个,例如至少40、60、100、200个或更多个连续核苷酸的区域上。这样的同源性可存在于未修饰的多核苷酸序列的整个长度上。
测量多核苷酸同源性或同一性的方法是本领域已知的。例如,UWGCG程序包提供了可用来计算同源性的BESTFIT程序(例如以其默认设置使用)(Devereux等人(1984)Nucleic Acids Research 12:387-395)。
也可使用PILEUP和BLAST算法来计算同源性或排列序列(通常使用其默认设置),例如,如Altschul S.F.(1993)J Mol Evol 36:290-300;Altschul,S.F.等人(1990)J Mol Biol 215:403-10中所述。
用于进行BLAST分析的软件可通过国家生物技术信息中心公开获得(http://www.ncbi.nlm.nih.gov/)。该算法涉及首先通过识别当与数据库序列中相同长度的字词比对时匹配或满足一些正值阈值得分T的查询序列中长度为W的短字词来鉴别高评分序列对(HSP)。T被称为邻近字词得分阈值(Altschul等人,同上)。这些初始邻近字词命中(hit)充当用于启动搜索以查找包含它们的HSP的种子(seed)。字词命中沿着每个序列在两个方向上延伸,使得累积比对得分可以增加。当出现以下情况时,每个方向上字词命中的延伸停止:由于一个或多个负分残基比对的累积使累积比对得分变为零或以下;或到达任一序列的末端。BLAST算法参数W、T和X决定了比对的灵敏度和速度。BLAST程序使用字词长度(W)为11、BLOSUM62评分矩阵(参见Henikoff和Henikoff(1992)Proc.Natl.Acad.Sci.USA 89:10915-10919)比对(B)为50、期望值(E)为10、M=5、N=4以及两条链的比较作为默认设置。
BLAST算法进行两个序列之间相似性的统计分析;参见例如,Karlin和Altschul(1993)Proc.Natl.Acad.Sci.USA 90:5873-5787。
本文中的术语“抗原”(Ag)是指用于对免疫活性脊椎动物进行免疫以产生识别该Ag的抗体(Ab)的实体。在本发明的上下文中,合适的抗原包括人TFPI(1-161)和全长人TFPIα。本文中,Ag的含义更加广泛,并且通常意在包括被Ab特异性识别的靶分子,因此包括在用于产生Ab的免疫过程或其它过程例如噬菌体展示中使用的分子片段或模拟物。
如本文所用的术语“表位”在“抗原结合多肽”如抗体(Ab)与其相应抗原(Ag)之间的分子相互作用的背景下定义。通常,“表位”是指在Ag上的、与Ab特异性结合的区或区域,即与Ab物理接触的区或区域。物理接触可采用针对Ab和Ag分子中的原子的各种标准(例如,距离截止值为如如如或溶剂可及性)来定义。蛋白质表位可包含Ag中的、直接参与Ab结合的氨基酸残基(也称为表位的免疫显性组分)以及其它不直接参与结合的氨基酸残基,如被Ab有效阻断的Ag的氨基酸残基,即在Ab的“溶剂排斥表面(solvent-excluded surface)”和/或“足迹”内的氨基酸残基。
除非另有说明,否则本文中的术语“表位”包括TFPI任何特定区域中的、特异性结合本发明单特异性或双特异性TFPI抗体或另一种TFPI特异性药剂的两种类型的结合区。TFPI可包含许多不同的表位,其可包括但不限于(1)线性肽表位;(2)由在成熟TFPI构象中彼此靠近的一个或多个非连续氨基酸组成的构象表位;以及(3)全部或部分由共价连接至TFPI的分子结构如碳水化合物基团组成的翻译后表位。
可采用多种实验和计算表位作图方法在不同的详细度水平上描述和表征给定抗体(Ab)/抗原(Ag)对的表位。该实验方法包括突变、X射线晶体学、核磁共振(NMR)谱法、氢氘交换质谱法(HX-MS)以及各种竞争结合方法;本领域已知的方法。由于每一种方法均依赖于独特的原理,因此对表位的描述与确定表位的方法紧密相关。因此,根据所采用的表位作图方法,给定Ab/Ag对的表位可有不同地描述。
在其最详细的水平上,针对Ag与Ab之间相互作用的表位可通过限定存在于Ag-Ab相互作用中的原子接触的空间坐标,以及关于其对结合热力学的相对贡献的信息来描述。在详细度较低的水平上,表位可通过限定Ag与Ab之间的原子接触的空间坐标来表征。在详细度更低的水平上,表位可通过其包含的氨基酸残基来表征,该氨基酸残基根据特定的标准,如在Ab:Ag复合物中的原子之间的距离或原子的溶剂可及性来定义。在详细度进一步更低的水平上,表位可通过功能,例如通过与其它Ab的竞争结合来表征。表位也可以更泛泛地定义为包含这样的氨基酸残基,另一种氨基酸对该氨基酸残基的置换将会改变Ab与Ag之间的相互作用特征。
在通过Ab例如Fab片段与其Ag之间复合物的空间坐标限定的X-射线衍生晶体结构的语境中,除非另有说明或与上下文矛盾,否则术语表位在此被具体定义为在距Ab中的重原子的距离内具有重原子(即,非氢原子)的TFPI残基。
根据所使用的表位作图方法,在不同的详细度水平上获得对表位的描述和定义,基于这一事实,可以在不同的详细度水平上类似地进行在相同Ag上针对不同Ab的表位比较。
如果在氨基酸水平上描述的,例如由X射线结构确定的表位含有相同的一组氨基酸残基,则这些表位被称为是相同的。如果表位共有至少一个氨基酸,则这些表位被称为是重叠的。如果表位没有共有氨基酸残基,则这些表位被称为是不同的(独特的)。
术语“互补位”的定义通过反转视角,来源于以上对“表位”的定义。因此,术语“互补位”是指在Ab上的、与Ag特异性结合的区或区域,即与Ag物理接触的区或区域。
在通过Ab如Fab片段与其Ag之间复合物的空间坐标限定的X-射线衍生晶体结构的语境中,除非另有说明或与上下文矛盾,否则术语互补位在此被具体定义为其特征在于在距TFPI中的重原子的距离内具有重原子(即,非氢原子)的Ag残基。
给定抗体(Ab)/抗原(Ag)对的表位和互补位可通过常规方法来鉴定。例如,表位的通常位置可通过评估抗体与不同片段或变异TFPI多肽结合的能力来确定。在TFPI内的、与抗体(表位)接触的具体氨基酸和在抗体中的、与TFPI(互补位)接触的具体氨基酸也可使用常规方法来确定。例如,抗体和靶分子可以组合,并且可以使Ab:Ag复合物结晶。可以确定该复合物的晶体结构,并用其鉴定抗体与其靶标之间相互作用的特异性位点。
与相同抗原结合的抗体可就其同时与其共同抗原结合的能力进行表征,并且可以经历“竞争结合”/“分箱(binning)”。在该语境下,术语“分箱”是指对与相同抗原结合的抗体进行分组的方法。抗体的“分箱”可以基于在以标准技术为基础的试验中两种抗体与其共同抗原的竞争结合,该标准技术例如是表面等离子体共振(SPR)、ELISA或流式细胞术。
使用参考抗体确定抗体的“箱元”。如果第二抗体不能与参考抗体同时与抗原结合,则称第二抗体与参考抗体属于同一“箱元”。在这种情况下,参考抗体和第二抗体竞争性地结合抗原的相同部分,因此被划归为“竞争抗体”。如果第二抗体能够与参考抗体同时与抗原结合,则称第二抗体属于不同的“箱元”。在这种情况下,参考抗体和第二抗体不会竞争性地结合抗原的相同部分,因此被划归为“非竞争抗体”。
抗体“分箱”不提供关于表位的直接信息。竞争抗体,即属于同一“箱元”的抗体,可具有相同的表位、重叠的表位或甚至不同的表位。如果与其在抗原上的表位结合的参考抗体占据了第二抗体与其在抗原上的表位接触所需的空间(“位阻”),则是后一种情况。非竞争抗体通常具有不同的表位。
术语“结合亲和力”在本文中用作两种分子(例如抗体或其片段和抗原)之间的非共价相互作用的强度的度量。术语“结合亲和力”在本文中用于描述单价和双价相互作用(内在活性)两者。
通过测定平衡解离常数(KD),可以定量两种分子(例如抗体或其片段和抗原)之间通过单价相互作用的结合亲和力。反过来,通过测量复合物形成和解离的动力学,例如通过SPR方法,可以测定KD。与单价复合物的结合和解离相对应的速率常数分别被称为结合速率常数ka(或k结合)和解离速率常数kd(或k解离)。通过方程式KD=kd/ka,将KD与ka和kd相关联。
按照上面的定义,通过比较单个抗体/抗原复合物的KD值,可以比较与不同分子相互作用有关的结合亲和力,例如比较不同抗体对给定抗原的结合亲和力。
根据本发明的抗体可以能够与另一种分子如天然存在的配体或受体或另一种抗体竞争结合TFPI,从而影响与这些相互作用相关的功能。抗体与天然配体/受体竞争的能力可以通过测量对TFPI抑制的表观KI的影响的各种活性测定来评估。然后可以由表观KI值推断KD值。一般来说,抗体对于靶标(TFPI)的感兴趣的KD值将为其它TFPI配体的KD的1/2,优选1/5,更优选1/10。更优选地,KD将为1/50,如1/100或1/200;甚至更优选1/500,如1/1000或1/10,000。
可以通过众所周知的方法直接测定该解离常数的值。用来评价诸如抗体等配体与靶标的结合能力的标准试验是本领域已知的,并且包括,例如,ELISA、Western印迹法、RIA、等温滴定量热法和流式细胞术分析。也可以通过本领域已知的标准试验,如SPR,来评估抗体的结合动力学和结合亲和力。
可以进行竞争结合试验,其中将抗体与靶标的结合和该靶标的另一种配体如另一种抗体对该靶标的结合进行比较。
如本文公开的双特异性抗体可以以比其各自“臂”的组合亲和力更高的亲和力和/或亲合力结合全长TFPI或TFPI(1-161)。
如本文公开的双特异性抗体可以以比其结合如本文公开的TFPI(1-96)、TFPI(1-76)、TFPI(26-76)、TFPI(77-161)、TFPI(97-147)和/或其它任何TFPI片段更高的亲和力和/或亲合力结合全长TFPI。
如本文公开的双特异性抗体对全长TFPI或TFPI(1-161)可具有1×10-11M或更低,或1×10-12M或更低,或1×10-13M或更低,或1×10-14M或更低,或1×10-15M或更低的KD。
本发明双特异性抗体的任何“臂”对其靶标可具有1×10-5M或更低,1×10-6M或更低,1×10-7M或更低,1×10-8M或更低,或1×10-9M或更低,或1×10-10M或更低,1×10-11M或更低,或1×10-12M或更低,或1×10-13M或更低,或1×10-14M或更低,或1×10-15M或更低的KD。本发明抗体的KD可以低于0.8nM,如低于0.7nM,如低于0.6nM,如低于0.5nM,如低于0.4nM,如低于0.3nM,如低于0.2nM,如低于0.1nM,如低于0.05nM,如低于0.025nM,如低于0.015nM,如介于0.015nM与0nM之间。
在一个方面,如本文公开的两个(全长)抗体或Fab片段的双特异性缀合物包含TFPI(1-79)结合子(binder)和TFPI KPI-2结合子,其中TFPI(1-79)结合子的KD为2×10-9M或更低,3×10-9M或更低,4×10-9M或更低,5×10-9M或更低,6×10-9M或更低,7×10-9M或更低,8×10-9M或更低,9×10-9M或更低,1×10-8M或更低,2×10-8M或更低,3×10-8M或更低,4×10-8M或更低,5×10-8M或更低,6×10-8M或更低,7×10-8M或更低,8×10-8M或更低,9×10-8M或更低,1×10-7M或更低,2×10-7M或更低,3×10-7M或更低,4×10-7M或更低,5×10-7M或更低,6×10-7M或更低,7×10-7M或更低,8×10-7M或更低,9×10-7M或更低,1×10-6M或更低,2×10-6M或更低,3×10-6M或更低,4×10-6M或更低,5×10-6M或更低,6×10-6M或更低,7×10-6M或更低,8×10-6M或更低,9×10-6M或更低,1×10-5M或更低,2×10-5M或更低,3×10-5M或更低,4×10-5M或更低,5×10-5M或更低,6×10-5M或更低,7×10-5M或更低,8×10-5M或更低,9×10-5M或更低。
在一个方面,TFPI(1-79)结合子的KD在5×10-7M至1×10-5M的范围内。在一个这样的方面,TFPI(1-79)结合子的KD在1×10-7M至1×10-5M的范围内。在一个这样的方面,TFPI(1-79)结合子的KD在1×10-7M至1×10-6M的范围内。
在一个方面,TFPI(1-79)结合子的KD在5×10-7M至1×10-7M的范围内。
在一个方面,TFPI(1-79)结合子的KD在1×10-7M至5×10-5M的范围内。
在一个方面,TFPI(1-79)结合子是包含一个或多个置换的mAb2F22、Fab 0295或Fab 0296的变体。
在一个方面,KPI-2结合子是包含一个或多个置换的mAb 2021、mAb 0310、Fab 0088或Fab 0313的变体。
在一个方面,如本文公开的两个(全长)抗体或Fab片段的双特异性缀合物包含TFPI(1-79)结合子和TFPI KPI-2结合子,其中KPI-2结合子的KD为2×10-9M或更低,3×10-9M或更低,4×10-9M或更低,5×10-9M或更低,6×10-9M或更低,7×10-9M或更低,8×10-9M或更低,9×10-9M或更低,1×10-8M或更低,2×10-8M或更低,3×10-8M或更低,4×10-8M或更低,5×10-8M或更低,6×10-8M或更低,7×10-8M或更低,8×10-8M或更低,9×10-8M或更低,1×10-7M或更低,2×10-7M或更低,3×10-7M或更低,4×10-7M或更低,5×10-7M或更低,6×10-7M或更低,7×10-7M或更低,8×10-7M或更低,9×10-7M或更低,1×10-6M或更低,2×10-6M或更低,3×10-6M或更低,4×10-6M或更低,5×10-6M或更低,6×10-6M或更低,7×10-6M或更低,8×10-6M或更低,9×10-6M或更低,1×10-5M或更低,2×10-5M或更低,3×10-5M或更低,4×10-5M或更低,5×10-5M或更低,6×10-5M或更低,7×10-5M或更低,6×10-5M或更低,5×10-5M或更低,4×10-5M或更低,3×10-5M或更低,2×10-5M或更低,1×10-5M或更低。
在一个方面,KPI-2结合子的KD在5×10-7M至1×10-5M的范围内。在一个这样的方面,KPI-2结合子的KD在1×10-7M至1×10-5M的范围内。在一个这样的方面,KPI-2结合子的KD在1×10-7M至1×10-6M的范围内。
在一个方面,KPI-2结合子的KD在5×10-7M至1×10-7M的范围内。
在一个方面,KPI-2结合子的KD在1×10-7M至5×10-5M的范围内。
在一个方面,如本文公开的双特异性抗体包含KD在1×10-9M至1×10-6M范围内的TFPI(1-79)结合子和KD在1×10-14M至1×10-10M范围内的KPI-2结合子。在一个这样的方面,TFPI(1-79)结合子KD在1×10-8M至1×10-6M的范围内且KPI-2结合子KD在1×10-14M至1×10-11M的范围内。
在一个方面,如本文公开的双特异性抗体包含KD在1×10-14M至1×10-10M范围内的TFPI(1-79)结合子和KD在1×10-12M至1×10-11M范围内的KPI-2结合子。
在一个方面,如本文公开的双特异性抗体包含KD在1×10-12M至1×10-10M范围内的TFPI(1-79)结合子和KD在1×10-12M至1×10-8M范围内的KPI-2结合子。在一个这样的方面,TFPI(1-79)结合子的KD在1×10-11M至5×10-10M的范围内且KPI-2结合子的KD在1×10-10M至1×10-8M的范围内。
在一个方面,TFPI(1-79)结合子是mAb 0336且KPI-2结合子是mAb 0310。
在一个方面,KPI-2结合子是Fab 0088。在一个替代方面,KPI-2结合子是Fab 0094。在另一替代方面,KPI-2结合子是Fab 0313。
在一个方面,Fab 0094、Fab 0313、Fab 0094或Fab 0088与KPI-1结合子组合,该KPI-1结合子是包含一个或多个置换的Fab 0295的变体。
在一个方面,通过将两个分别与TFPI(1-79)和TFPI KPI-2结合的抗体片段组合成双特异性抗体而获得对凝血酶生成的协同效应。
在一个方面,通过将两个分别与TFPI(1-79)和TFPI KPI-2结合的抗体片段组合成双特异性Fab(BiFab)而获得对凝血酶生成的协同效应。
在一个方面,甚至在双特异性抗体或Fab的一个臂对其靶标的亲和力降低的情况下,也可以存在以上提到的协同效应。
在一个方面,本发明的双特异性抗体可与FXa、TF/FVIIa和/或TF/FVIIa/FXa竞争结合TFPI。
在另一个方面,本发明提供了包含本发明分子,如本文所述双特异性抗体的组合物和制剂。例如,本发明提供了包含与药学上可接受的载体一起配制的一种或多种本发明双特异性TFPI抗体的药物组合物。
相应地,本发明的一个目的在于提供一种药物制剂,其包含以0.25mg/ml至250mg/ml的浓度存在的这样的双特异性TFPI抗体,并且其中所述制剂具有2.0至10.0的pH。该制剂可以进一步包含缓冲体系、防腐剂、张度剂、螯合剂、稳定剂或表面活性剂及其各种组合中的一种或多种。防腐剂、等渗剂、螯合剂、稳定剂和表面活性剂在药物组合物中的使用是技术人员公知的。可参考Remington:The Science and Practice of Pharmacy,第19版,1995。
在一个实施方案中,所述药物制剂是水性制剂。这样的制剂一般是溶液或悬浮液,但也可以包括胶体、分散体、乳液和多相物质。术语“水性制剂”被定义为包含至少50%w/w水的制剂。同样,术语“水性溶液”被定义为包含至少50%w/w水的溶液,而术语“水性悬浮液”被定义为包含至少50%w/w水的悬浮液。
在另一个实施方案中,所述药物制剂是冷冻干燥的制剂,在使用前医师或患者向其中添加溶剂和/或稀释剂。
在进一步的方面,所述药物制剂包含这样的抗体的水性溶液和缓冲液,其中该抗体以1mg/ml或以上的浓度存在,并且其中所述制剂具有约2.0至约10.0的pH。
双特异性抗体或包含该抗体的药物制剂可以用来治疗具有凝血障碍的受试者。
如本文所用的,术语“受试者”包括任何人类患者,或非人类脊椎动物。
如本文所用的,术语“凝血障碍”是指增加的出血倾向,这可由正常凝血级联的任意促凝血组分的任何定性或定量缺乏或纤维蛋白溶解的任何上调引起。这类凝血障碍可能是先天性的和/或获得性的和/或医源性的,并且由本领域技术人员确定。
先天性低凝血障碍(hypocoagulopathies)的非限制性实例为A型血友病、B型血友病、因子VII缺乏、因子X缺乏、因子XI缺乏、冯威勒布兰德氏病和血小板减少症如Glanzmann氏血小板机能不全(thombasthenia)和贝-索(Bernard-Soulier)综合征。所述A型或B型血友病可能是重度的、中度的或轻度的。血友病的临床严重程度根据血液中的FIX/FVIII功能单元的浓度来确定,并被分类为轻度的、中度的或重度的。重度血友病被定义为凝血因子水平<0.01U/ml,对应于小于正常水平的1%,而中度和轻度的患者分别具有1-5%和>5%的水平。具有“抑制物”(即抗因子VIII的同种抗体)的A型血友病和具有“抑制物”(即抗因子IX的同种抗体)的B型血友病是部分先天性和部分获得性的凝血障碍的非限制性实例。
获得性凝血障碍的非限制性实例是由维生素K缺乏引起的丝氨酸蛋白酶缺乏;这样的维生素K缺乏可能由维生素K拮抗剂如华法林的施用而引起。获得性凝血障碍也可能在大面积创伤后发生。在这种也称为“血性恶性循环”的情况下,其特征为血液稀释(稀释性血小板减少症和凝血因子的稀释)、低体温、凝血因子的消耗和代谢紊乱(酸中毒)。补液疗法和增加的纤维蛋白溶解可加剧这种情况。所述出血可能来自身体的任何部分。
医源性凝血障碍的一个非限制性实例是可能为了治疗血栓栓塞性疾病而开出的抗凝血药物如肝素、阿司匹林、华法林及其它血小板聚集抑制剂的过高剂量。医源性凝血障碍的第二个非限制性实例是由过度的和/或不当的补液疗法诱发的凝血障碍,诸如可能由输血诱发的凝血障碍。
在本发明的一个实施方案中,出血与A型或B型血友病有关。在另一个实施方案中,出血与具有获得性抑制物的A型或B型血友病有关。在另一个实施方案中,出血与血小板减少症有关。在另一个实施方案中,出血与冯威勒布兰德氏病有关。在另一个实施方案中,出血与严重组织损伤有关。在另一个实施方案中,出血与严重创伤有关。在另一个实施方案中,出血与手术有关。在另一个实施方案中,出血与出血性胃炎和/或肠炎有关。在另一个实施方案中,出血是血崩,诸如在胎盘早剥中。在另一个实施方案中,出血发生在机械性止血可能性受限的器官中,诸如颅内、耳内或眼内。在另一个实施方案中,出血与抗凝治疗有关。
如本文所用的,术语“治疗”是指对任何有需要的人类或其它脊椎动物受试者的药物疗法。所述受试者预期已经经历了由执业医师或执业兽医进行的体格检查,该医师或兽医已经给出了初步或明确的诊断,该诊断指明所述特定治疗的使用对所述人类或其它脊椎动物的健康是有益的。根据受试者健康的现状,所述治疗的时间安排和目的可随个体的不同而不同。因此,所述治疗可以是预防性的、姑息性的、对症的和/或治愈性的。就本发明而言,预防性的、姑息性的、对症的和/或治愈性的治疗可代表本发明的单独的方面。
本发明的抗体可以肠胃外施用,如静脉内,如肌肉内,如皮下施用。皮下施用是优选的。或者,本发明的抗体可通过非肠胃外途径如经口或局部施用。本发明的抗体可以预防性施用。本发明的抗体可治疗性地施用(根据需求)。
在一个实施方案中,本发明的双特异性抗体用来在体外测定TFPIα水平。
以下是本发明的非限制性实施方案:
实施方案1:一种能够特异性结合人TFPI(SEQ ID NO:1)的位置1至161内的第一表位和第二表位的双特异性抗体或BiFab。
实施方案2:根据实施方案1的双特异性抗体,其中所述第一表位在人TFPI的位置1-76内且所述第二表位在位置77-161内。
实施方案3:根据实施方案1的双特异性抗体,其中所述第一表位在人TFPI的位置1-96内且所述第二表位在位置97-161内。
实施方案4:根据实施方案2-3中任一项的双特异性抗体,其中所述第一表位在人TFPI的Kunitz型抑制剂1结构域(残基26-76)内。
实施方案5:根据实施方案2-3中任一项的双特异性抗体,其中所述第二表位在人TFPI的Kunitz型抑制剂2结构域(残基97-147)内。
实施方案6:根据实施方案5的双特异性抗体,其中所述KPI-1表位包含SEQ ID NO:1的氨基酸残基Arg 41、Arg 65和/或Glu 67。
实施方案7:根据实施方案4或6中任一项的双特异性抗体,其中所述KPI-1表位包含SEQ ID NO:1的氨基酸残基Leu 16、Pro 17、Leu 19、Lys 20、Leu 21、Met 22、Phe 25、Cys 35、Ala 37、Met 39、Arg 41、Tyr 56、Gly 57、Gly 58、Cys 59、Glu 60、Gly 61、Asn 62、Gln 63、Arg 65、Phe 66、Glu 67、Glu 71和Met 75。
实施方案8:根据实施方案5的双特异性抗体,其中所述第二表位包含SEQ ID NO:1的氨基酸残基Arg 107。
实施方案9:根据实施方案5的双特异性抗体,其中所述第二表位包含SEQ ID NO:1的氨基酸残基Glu 100、Glu 101、Asp 102、Pro 103、Arg 107、Tyr 109、Thr 111、Tyr 113、Phe 114、Asn 116、Gln 118、Gln 121、Cys 122、Glu 123、Arg 124、Phe 125、Lys 126和Leu 140。
实施方案10:根据实施方案1的双特异性抗体,其中第一抗原识别位点的重链包含:
●对应于SEQ ID NO:4的氨基酸31至35(SYGVH)、SEQ ID NO:6的氨基酸31至35(NYGVH)或SEQ ID NO:8的氨基酸31至35(GYGVH)的CDR1序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:4的氨基酸50至65(VIWRGGSTDFNAAFMS)、SEQ ID NO:6的氨基酸50至65(VIWRGGSIDYNAAFMS)或SEQ ID NO:8的氨基酸50至65(VIWRGGSIDYNAAFMS)的CDR2序列,其中这些氨基酸中的一个、两个或三个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:4的氨基酸98至110(NSHGNYVGYAMDY)、SEQ ID NO:6的氨基酸98至110或SEQ ID NO:8的氨基酸98至110(NSHGNYVGYAMDY)的CDR3序列,其中这些氨基酸残基中的一个或两个可被不同的氨基酸置换;
并且其中所述第一抗原识别位点的轻链包含:
●对应于SEQ ID NO:5的氨基酸24至34(KASENVGAAVA)、SEQ ID NO:7的氨基酸24至34(KASQSVGPAVA)或SEQ ID NO:9的氨基酸24至34(KASQNVGTAVA)的CDR1序列,其中这些氨基酸残基中的一个、两个或三个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:5的氨基酸50至56(SASNRYT)、SEQ ID NO:7的氨基酸50至56或SEQ ID NO:9的氨基酸50至56(SASNRYT)的CDR2序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:5的氨基酸89至96(QQYTNYPT)、SEQ ID NO:7的氨基酸89至96(QQYTSYPT)或SEQ ID NO:9的氨基酸89至96(QQYTSYPT)的CDR3序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换。
实施方案11:根据实施方案1的双特异性抗体,其中第一抗原识别位点的重链包含:
●对应于SEQ ID NO:4的氨基酸31至35(SYGVH)、SEQ ID NO:6的氨基酸31至35(NYGVH)或SEQ ID NO:8的氨基酸31至35(GYGVH)的CDR1序列;和
●对应于SEQ ID NO:4的氨基酸50至65(VIWRGGSTDFNAAFMS)、SEQ ID NO:6的氨基酸50至65(VIWRGGSIDYNAAFMS)或SEQ ID NO:8的氨基酸50至65(VIWRGGSIDYNAAFMS)的CDR2序列;和
●对应于SEQ ID NO:4的氨基酸98至110、SEQ ID NO:6的氨基酸98至110或SEQ ID NO:8的氨基酸98至110(NSHGNYVGYAMDY)的CDR3序列;
并且其中所述第一抗原识别位点的轻链包含:
●对应于SEQ ID NO:5的氨基酸24至34(KASENVGAAVA)、SEQ ID NO:7的氨基酸24至34(KASQSVGPAVA)或SEQ ID NO:9的氨基酸24至34(KASQNVGTAVA)的CDR1序列;和
●对应于SEQ ID NO:5的氨基酸50至56、SEQ ID NO:7的氨基酸50至56或SEQ ID NO:9的氨基酸50至56(SASNRYT)的CDR2序列;和
●对应于SEQ ID NO:5的氨基酸89至96(QQYTNYPT)、SEQ ID NO:7的氨基酸89至96(QQYTSYPT)或SEQ ID NO:9的氨基酸89至96(QQYTSYPT)的CDR3序列。
实施方案12:根据实施方案1的双特异性抗体,其中第一抗原识别位点的重链包含:
●对应于SEQ ID NO:6的氨基酸31至35(NYGVH)的CDR1序列;和
●对应于SEQ ID NO:6的氨基酸50至65(VIWRGGSIDYNAAFMS)的CDR2序列;和
●对应于SEQ ID NO:6的氨基酸98至110(NSHGNYVGYAMDY)的CDR3序列;
并且其中所述第一抗原识别位点的轻链包含:
●对应于SEQ ID NO:7的氨基酸24至34(KASQSVGPAVA)的CDR1序列;和
●对应于SEQ ID NO:7的氨基酸50至56(SASNRYT)的CDR2序列;和
●对应于SEQ ID NO:7的氨基酸89至96(QQYTSYPT)的CDR3序列。
实施方案13:根据实施方案1的双特异性抗体,其中第一抗原识别位点的重链包含:
●对应于SEQ ID NO:10的氨基酸31至36(SDYAWN)的CDR1序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:10的氨基酸51至66(YISYSGSTSYNPSLKS)的CDR2序列,其中这些氨基酸中的一个、两个或三个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:10的氨基酸99至104(WAYDGP)的CDR3序列,其中这些氨基酸残基中的一个可被不同的氨基酸置换,
并且其中所述第一抗原识别位点的轻链包含:
●对应于SEQ ID NO:11的氨基酸24至33(RASSSVSHMH)的CDR1序列,其中这些氨基酸残基中的一个或两个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:11的氨基酸49至55(ATSNLAS)的CDR2序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换;和/或
●对应于SEQ ID NO:11的氨基酸88至96(QQWSSNPFT)的CDR3序列,其中这些氨基酸残基中的一个可被不同的氨基酸残基置换。
实施方案14:根据实施方案10-13中任一项的双特异性抗体,其中第二抗原识别位点的重链包含:
●对应于SEQ ID NO:19的氨基酸31至35(NYAMS)的CDR1序列,其中这些氨基酸中的一个可被不同的氨基酸置换;和/或
●对应于SEQ ID NO:19的氨基酸50至66(TISRSGSYSYFPDSVQG)、SEQ ID NO:21的氨基酸50至66(TISRSGSYSYYPDSVKG)或SEQ ID NO:25的氨基酸50至66(TISRSGSYSYYADSVKG)的CDR2序列,其中这些氨基酸中的一个、两个或三个可被不同的氨基酸置换;和/或
●对应于SEQ ID NO:19的氨基酸99至110(LGGYDEGDAMDS)的CDR3序列,其中这些氨基酸中的一个、两个或三个可被不同的氨基酸置换。
并且其中所述第二抗原识别位点的轻链包含:
●对应于SEQ ID NO:20的氨基酸24至39(KSSQSLLESDGKTYLN)的CDR1序列,其中这些氨基酸中的一个、两个或三个可被不同的氨基酸置换;和/或
●对应于SEQ ID NO:20的氨基酸55至61(LVSILDS)的CDR2序列,其中这些氨基酸中的一个或两个可被不同的氨基酸置换;和/或
●对应于SEQ ID NO:20的氨基酸94至102(LQATHFPQT)的CDR3序列,其中这些氨基酸中的一个或两个可被不同的氨基酸置换。
实施方案15:根据实施方案10-14中任一项的双特异性抗体,其中所述置换是保守置换。
实施方案16:根据前述实施方案中任一项的双特异性抗体,其选自全长双特异性抗体和两个抗原结合片段的化学缀合物。
实施方案17:根据实施方案16的双特异性抗体,其为两个Fab片段的缀合物。
实施方案18:根据实施方案1-17中任一项的双特异性抗体,其为人源化抗体或人抗体。
实施方案19:根据实施方案1-18中任一项的双特异性抗体,其对全长TFPI或TFPI(1-161)具有1×10-11M或更低,或1×10-12M或更低,或1×10-13M或更低,或1×10-14M或更低,或1×10-15M或更低的结合亲和力。
实施方案20:一种药物组合物,其包含根据实施方案1至18中任一项的双特异性抗体和药学上可接受的载体。
实施方案21:根据实施方案1至19中任一项的双特异性抗体或根据实施方案20的药物组合物,其用作药物。
实施方案22:根据实施方案1至19中任一项的双特异性抗体或根据实施方案20的药物组合物,其用于治疗凝血障碍。
实施方案23:用于根据实施方案22使用的双特异性抗体,其中所述受试者具有先天性、获得性和/或医源性凝血障碍,如具有或不具有抑制物的A型血友病,或具有或不具有抑制物的B型血友病。
实施方案24:一种治疗具有凝血障碍的受试者的方法,其包括向所述受试者施用根据实施方案1至19中任一项的双特异性抗体。
实施方案25:根据实施方案1至19中任一项的双特异性抗体在制备用于治疗凝血障碍的药物中的用途。
实施方案26:根据实施方案25的用途,其中所述凝血障碍是先天性、获得性和/或医源性凝血障碍。
实施方案27:根据实施方案26的用途,其中所述凝血障碍是具有或不具有抑制物的A型血友病,或具有或不具有抑制物的B型血友病。
本发明通过以下实施例进一步说明,这些实施例不应理解为进一步限制。所有附图和整个本申请中引用的所有参考文献、专利和公开的专利申请的内容均明确地通过引用并入本文。
实施例
实施例1:免疫、融合和筛选
用人TFPIα(SEQ ID NO:1)或TFPI(1-161)(SEQ ID NO:2)免疫RBF小鼠。向小鼠皮下注射:将20μg人TFPI与完全弗氏佐剂混合以供第一次注射。对于随后的免疫,使用不完全弗氏佐剂与相同浓度的抗原。在最后免疫后10天,使用ELISA针对人TFPI特异性抗体筛选来自小鼠的眼部血液。通过静脉内注射用10μg人TFPIα或TFPI(1-161)加强免疫具有阳性血清滴度的小鼠,并在三天后处死。在无菌条件下取出脾脏,并将其分散成单细胞悬浮液。借助于PEG方法或通过电融合进行脾细胞与骨髓瘤细胞的融合。通过有限稀释将所得杂交瘤细胞克隆至微量滴定板中。首先通过ELISA针对能够与全长TFPIα或TFPI(1-161)结合的抗体的表达筛选来自单个杂交瘤的上清液。为了鉴别产生对TFPI(1-79)为特异性的抗体的杂交瘤,针对与TFPI KPI-2片段(由SEQ ID NO:1的氨基酸残基97-147表示)的结合,反向筛选与全长TFPIα或TFPI(1-161)的结合呈阳性的杂交瘤。分离并扩增与TFPI(1-161)的结合呈阳性且与TFPI KPI-2片段的结合呈阴性的杂交瘤,以产生抗体。
通过标准蛋白A亲和色谱法从上清液中纯化抗体,并用其确定与人TFPIα和TFPI(1-79)的结合和亲和力,以及血浆中的TFPI中和活性(TGT试验)。通过有限稀释对产生感兴趣抗体的杂交瘤(即,对TFPI(1-79)为特异性的那些)进行亚克隆,并且针对来自亚克隆杂交瘤的物质验证原始抗体谱。来自亚克隆杂交瘤的细胞用于分离RNA以及随后的抗体克隆和序列鉴定。
实施例2:小鼠抗人TFPI(1-79)特异性抗体的克隆和测序
本实施例描述了TFPI抗体mAb 2F3、mAb 2F22、mAb 2F45、mAb 1F56和mAb 1F91的鼠重链和轻链序列的克隆和测序。使用来自Qiagen的RNeasy-Mini试剂盒从杂交瘤细胞中提取总RNA,并将其用作cDNA合成的模板。使用来自Clontech的SMARTTM RACE cDNA扩增试剂盒在5′-RACE反应中合成cDNA。使用Phusion Hot Start聚合酶(Finnzymes)和作为正向引物包含在SMARTTM RACE试剂盒中的通用引物混合物(UPM),通过PCR进行随后的HC和LC序列的靶扩增。具有SEQ ID NO:12所示序列的反向引物用于HC(VH域)扩增,而具有SEQ ID NO:13所示序列的反向引物用于LC扩增。将PCR产物通过凝胶电泳进行分离,使用来自GE Healthcare Bio-Sciences的GFX PCR DNA&Gel Band Purification试剂盒进行提取,并使用Zero Blunt TOPO PCR Cloning试剂盒和化学感受态TOP10大肠杆菌(Life Technologies)克隆以供测序。使用来自Applied Biosystems的AmpliTaq Gold Master Mix和M13uni/M13rev引物对选择的菌落进行菌落PCR。使用ExoSAP-IT酶混合物(USB)进行菌落PCR清扫(clean-up)。在MWG Biotech,Martinsried Germany处使用M13uni(-21)/M13rev(-29)测序引物进行测序。使用Vector NTI Advance 11程序(Life Technologies)对序列进行分析和注释。所有试剂盒和试剂均按照制造商的说明书使用。
针对每个杂交瘤鉴定单个独特的鼠κ型LC和单个独特的鼠HC,亚类IgG1:mAb 2F3、mAb 2F22、mAb 2F45和mAb 1F91。mAb 1F56的LC和HC序列显示,该抗体在序列上与mAb 1F91相同。可变重链和可变轻链序列(不包括前导肽序列)的氨基酸序列示于SEQ ID NO 4-11中。
抗体LC和HC表达载体的生成
生成了基于CMV启动子的表达载体(pTT载体),以供mAb 2F22的小鼠-人嵌合形式的瞬时表达。pTT载体由Yves Durocher(Durocher等人.Nucleic Acid Research,2002)开发用于瞬时蛋白质表达。除了CMV启动子外,基于pTT的载体还包含pMB1起点、EBV起点和Amp抗性基因。
生成了嵌合mAb 2F22轻链的表达载体,该嵌合mAb 2F22轻链携带鼠2F22轻链可变区和用于mAb 0294、Fab 0296和Fab 0295表达的人κ恒定区(SEQ ID NO:15)。生成了嵌合mAb 2F22重链的表达载体,该嵌合mAb 2F22重链携带鼠2F22重链可变区和用于mAb 0294表达的全长人IgG4(S241P)恒定区(SEQ ID NO:17)或用于Fab 0296表达(SEQ ID NO:14)或Fab 0295表达(SEQ ID NO:18)的截短的人IgG4恒定区。
生成了基于pTT的LC表达载体,以用于嵌合mAb 2F22抗体和抗体片段的瞬时表达。首先,使用对N-末端和C-末端序列具有特异性的引物,在2步反应中从原始TOPO测序克隆PCR扩增与mAb 2F22的VL域对应的区域。通过2步重叠PCR将原始鼠信号肽交换为人CD33信号肽。第一有义引物携带CD33信号肽序列的C-末端部分,并且第二有义引物含有用于克隆目的的HindIII限制位点、紧邻ATG起始密码子上游的Kozak序列(5′-GCCGCCACC-3′)和CD33信号肽序列的N-末端部分。反义引物在VL/CL过渡序列中含有框内BsiWI限制位点。将扩增的片段克隆至含有人κCL域序列的线性化的基于pTT的载体中,随后转化至大肠杆菌中以供选择。通过DNA测序来验证最终构建体的序列。
生成了基于pTT的HC表达载体,以用于嵌合mAb 2F22和Fab 2F22片段的瞬时表达。嵌合mAb和Fab片段被分别称为mAb 0294、Fab 0296和Fab 0295。首先,使用对N-末端和C-末端序列具有特异性的引物,在2步反应中从原始TOPO测序克隆PCR扩增与mAb 2F22的VH域对应的区域。通过2步重叠PCR将原始鼠信号肽交换为人CD33信号肽。第一有义引物携带CD33信号肽序列的C-末端部分,并且第二有义引物含有用于克隆目的的HindIII限制位点、紧邻ATG起始密码子上游的Kozak序列(5′-GCCGCCACC-3′)和CD33信号肽序列的N-末端部分。反义引物在VH/CH过渡序列中含有框内NheI限制位点。为了生成全长HC表达载体(mAb 0294的HC),对产生的VH域PCR片段进行限制性消化,并将其克隆至含有人IgG4(S241P)恒定区序列的线性化的基于pTT的载体中。包含丝氨酸241向脯氨酸的IgG4铰链突变,以通过消除半抗体的形成来稳定IgG4抗体。突变的铰链位置在根据Kabat编号时被称为S241P,或者在根据EU索引编号时被称为S228P。
为了生成用于Fab 0296表达的截短的HC表达载体,对产生的VH域PCR片段进行限制性消化,并将其克隆至含有截短人IgG4恒定区序列的线性化的基于pTT的载体中。基于IgG4的HC如Fab 0296HC的序列中所见在铰链区中在人IgG4铰链赖氨酸残基之后截短(SEQ ID NO:14)。随后将克隆反应转化到大肠杆菌中以供选择。通过DNA测序来验证最终构建体的序列。
为了生成用于Fab 0295表达的截短的HC表达载体,对产生的VH域PCR片段进行限制性消化,并将其克隆至含有第二截短人IgG4恒定区序列的线性化的基于pTT的载体中。用于Fab 0295的基于IgG4的HC如Fab 0295 HC的序列中所见在铰链区中在人IgG4铰链的第一半胱氨酸残基之后截短(SEQ ID NO:18)。随后将克隆反应转化到大肠杆菌中以供选择。通过DNA测序来验证最终构建体的序列。
mAb和Fab片段的表达和纯化
通过基于pTT的LC和HC表达载体的共转染,在EXPI293F细胞(Life Technologies)的悬浮培养物中瞬时表达抗TFPI抗体和Fab片段。以下程序描述了用于适应悬浮的EXPI293F细胞的通用转染方案。
EXPI293F转染
1)首先制备DNA和转染试剂的单独稀释液。
a)每ml细胞培养物使用总计1μg的载体DNA(0.5μg LC载体和0.5μg HC载体)。将DNA在Opti-MEM培养基(Gibco)中以50μl培养基/μg DNA稀释,混合,并在室温(23-25℃)下温育5min。
b)以2.7μl/μg DNA的浓度使用ExpifectaminTM 293(Life Technologies)作为转染试剂。将ExpifectaminTM溶液在Opti-MEM培养基(Gibco)中稀释18.5倍,混合,并在室温(23-25℃)下温育5min。
2)混合DNA和ExpifectaminTM 293稀释液,并使其在室温(23-25℃)下温育10min。
3)将DNA-ExpifectaminTM 293混合物直接添加至EXPI293F细胞培养物中。
a)在转染时,EXPI293F培养物的细胞密度应为2.8-3.2×106个细胞/ml。
4)将转染的细胞培养物转移至在36.5℃、8%CO2和85-125rpm下的定轨摇床培养箱中。
5)转染后18小时,添加5ul ExpifectaminTM 293Transfection Enhancer1/ml培养物和50μl ExpifectaminTM 293Transfection Enhancer2/ml培养物,并将培养物返回到在36.5℃、8%CO2和85-125rpm下的定轨摇床培养箱中。
6)转染后5天,通过离心收获细胞培养上清液,然后通过0.22μm PES过滤器单元(Coming)过滤。
通用纯化方案
根据制造商的说明书,使用来自GE Healthcare的MabSelect SuRe树脂,通过标准亲和色谱法纯化mAb变体。将纯化的抗体用pH 7.2的PBS缓冲液进行缓冲液交换。
使用由GE Healthcare开发的KappaSelect树脂,通过标准亲和色谱法纯化Fab片段。将纯化的Fab片段用pH 7.2的PBS缓冲液进行缓冲液交换。通过SEC-HPLC进行质量评价和浓度确定。
实施例3:抗体分箱(binning)
使用生物层干涉法(Fortebio Octet RED384仪器,PALL Life Sciences)测量TFPI抗体1F91、2F3、2F22、2F45、MBS532510(MyBioSource.com)、10R-T141A(Fitzgerald Industries International)与Bay 2A8-K95L之间对于与全长TFPIα结合的竞争。(Bay 2A8是于WO2010/017196中公开的2A8Fab的人IgG4(S241P)抗体变体。Bay 2A8-K95L是在HC CDR3中携带K95L置换(Kabat编号)的Bay 2A8的人IgG4(S241P)抗体变体(与WO2012/135671中公开的在“Fab B”中发现的相对于2A8的置换相同)。)使用1∶1.2mol mAb∶mol生物素-试剂(Thermo Scientific,目录号21335)的比例或遵循制造商的说明书,用生物素在赖氨酸残基上随机标记mAb 1F91、mAb 2F3、mAb 2F22、mAb 2F45和Bay 2A8-K95L。在链霉亲和素Fortebio sensortips(PALL Life Sciences)上捕获生物素标记的抗体,然后结合人TFPIα,随后结合mAb 1F91、mAb 2F3、mAb 2F22、mAb 2F45、Bay 2A8-K95L、MBS532510或10R-T141A。结果在表1中示出(黑色表示mAb竞争结合TFPI。灰色表示mAb不竞争结合TFPI)。
这些数据显示抗体落入3个不同的箱元中,表明它们具有不同的结合表位。箱元1:mAb 1F91、MBS532510和10R-T141A。箱元2:mAb 2F3、2F22和2F45。箱元3:Bay2A8K95L。
表1:指定的TFPI抗体之间对于与TFPI结合的竞争
实施例4:与mAb 2F22的Fab片段复合的TFPI(1-79)的晶体结构
使用X射线晶体学,高分辨率地确定由酸性N-末端区和Kunitz型蛋白酶抑制剂结构域1(KPI-1)组成的人TFPI(1-79)的N-末端部分(SEQ ID NO:16)与Fab片段——mAb 2F22的Fab 0296(SEQ ID NO:14和15)复合的3D结构。结果表明,该抗体能够结合TFPI的KPI-1,和前面N-末端的一部分。所得的人TFPI表位残基包含Leu 16、Pro 17、Leu 19、Lys 20、Leu 21、Met 22、Phe 25、Cys 35、Ala 37、Met 39、Arg 41、Tyr 56、Gly 57、Gly 58、Cys 59、Glu 60、Gly 61、Asn 62、Gln 63、Arg 65、Phe 66、Glu 67、Glu 71和Met 75(SEQ ID NO:2)。
材料与方法
为了结晶学目的,如实施例2所述生成了基于CMV启动子的表达载体(pTT载体),用于瞬时表达与mAb 2F22抗体片段对应的Fab片段,以用于结晶学。
如实施例2所述,使mAb 2F22的Fab片段在EXPI293F细胞中以鼠-人嵌合形式Fab 0296(SEQ ID NO:14和15)表达,并通过使用KappaSelect树脂的标准亲和色谱法纯化。
将包括人TFPI的N-末端部分和另外的N-末端连接的GSSGSSG标签的人TFPI KPI-1(SEQ ID NO:16),以及由对应于SEQ ID NO:15的轻链和对应于SEQ ID NO:14的重链片段组成的Fab 0296(两者均在磷酸盐缓冲盐水(PBS)缓冲液(2升水中4片,GIBCO,目录号18912-014,Invitrogen Corporation)中),在TFPI物质稍微摩尔过量(1.1∶1)的情况下混合。然后利用分子量截止值为10,000Da的Amicon Ultra-4离心过滤器将复合物浓缩至约10.0mg/ml。采用来自TTP Lab Tech号:4150-05800的96孔TTP IQ板和每孔100μl沉淀剂溶液,通过坐滴技术(sitting drop-technique)使晶体生长。该沉淀剂溶液含有20%w/v PEG 3350、200mM甲酸钾,并以3∶1的比例与蛋白质溶液混合。初始总液滴大小为200nl,数天后出现晶体。通过将1μl含有75%沉淀剂溶液和25%甘油的冷冻溶液混合物转移至含有晶体的液滴中而制备用于低温冷冻的晶体。使浸泡进行约2分钟。然后将晶体捕获,在液氮中快速冷冻,并在数据采集期间通过低温N2气流保持在100K的温度下。在MAX-lab,Lund,Sweden处,在束线BL911-3下以分辨率采集晶体学数据。通过XDS软件包[Kabsch,W.,J.Appl.Crystallogr.,(1993),Vol.26,第795-800页]进行数据的空间群确定、整合和缩放。空间群被确定为C2,并且同步加速器数据的晶胞参数被分别确定为89.01Q、66.660、106.β角为111.18°。分辨率下的R-sym为8.4%,并且完整性为99.5%。在约的分辨率下,独特反射的强度/西格玛(强度)的平均值等于2.0。
采用蛋白质数据库(PDB)[Berman,H.M.等人,Nucleic Acids Res.,(2000),Vol.28,第235-242页]中登录编号为1NGZ[Yin,J.等人,Proc Natl Acad Sci U S A.2003年2月4日,(100),Vol.100第856-861页]的Fab分子的坐标,使用分子置换(MR)方法进行结构确定。Fab分子被分成两个结构域:可变域和恒定域,二者均在MR计算中用作搜索模型。使用CCP4软件包CCP4[Collaborative Computational Project,N.,Acta crystallographica.Section D,Biological crystallography,(1994),Vol.50,第760-763页]的Molrep软件[Vagin,A.等人,J.Appl.Crystallogr.,(1997),Vol.30,第1022-1025页]来寻找恒定和可变Fab域的位置。在MR步骤中未找到KPI-1结构域,但差异电子密度图显示了在该阶段下KPI-1结构域分子的近似位置。通过CCP软件包的DM软件进行的电子密度改进,以及随后使用ARP-wARP软件[Langer,G.等人,Nat Protoc,(2008),Vol.3,第1171-1179页][Murshudov,G.N.等人,Acta Crystallographica Section D Biological Crystallography,(2011),Vol.67,第355-367页]进行的自动模型构建和相改进,给出了Fab 0296分子和KPI-1结构域结构以及在KPI-1结构域之前的N-末端部分的几乎完整的结构。对于TFPI(SEQ ID NO:2),从15至77的残基被包含在X射线模型中,该X射线模型除KPI-1结构域之外还包含KPI-1N-末端的一些残基(残基26-76)。对于Fab 0296片段,观察到轻链残基1至212和重链残基1至221。进入使用Coot软件程序[Emsley,P.等人,Acta Crystallogr.Sect.D-Biol.Crystallogr.,(2004),Vol.60,第2126-2132页]对电子密度图的计算机图形检查、模型校正和建立的过程,及随后使用CCP4软件包的软件程序Refmac5[Murshudov,G.N.等人,Acta Crystallographica Section D Biological Crystallography,(2011),Vol.67,第355-367页]的晶体学细化。循环该过程,直到无法对该模型进行进一步的显著改进。在分辨率下的所有数据的最终R-和R-free分别为0.192和0.220。
结果
通过CCP4程序套装[Collaborative Computational Project,N.,Acta crystallographica.Section D,Biological crystallography,(1994),Vol.50,第760-763页]的软件程序Areaimol[Lee,B.等人,J Mol Biol,(1971),Vol.55,第379-400页][Saff,E.B.等人,Math Intell,(1997),Vo1.19,第5-11页]计算在成对相互作用中排除的平均面积给出了晶体结构的人TFPI片段/抗TFPI mAb 2F22Fab片段分子复合物。
使用Fab 0296与TFPI片段分子之间的截止距离,通过运行CCP4程序套装[Bailey,S.,Acta Crystallogr.Sect.D-Biol.Crystallogr.,(1994),Vol.50,第760-763页]的Contacts软件来鉴定TFPI KPI-1(包括于晶体结构中观察到的TFPI的N-末端部分)(SEQ ID NO:2)与Fab 0296(SEQ ID NO:14和15)的直接接触。来自可溶性TFPI片段/Fab 0296复合物晶体结构的结果显示在表2中。
发现所得的TFPI KPI-1(包括TFPI N-末端区、Fab 0296的表位)包含TFPI的以下残基(采用SEQ ID NO:2的序列编号):Leu 16、Pro 17、Leu 19、Lys 20、Leu 21、Met 22、Phe 25、Cys 35、Ala 37、Met 39、Arg 41、Tyr 56、Gly 57、Gly 58、Cys 59、Glu 60、Gly 61、Asn 62、Gln 63、Arg 65、Phe 66、Glu 67、Glu 71和Met 75。从距离、电荷-电荷相互作用、氢键、极性和疏水相互作用以及低溶剂可及性评价,以下残基似乎是表位的特别重要的残基:Arg 41、Arg 65和Glu 67(SEQ ID NO.2)。
因此,mAb 2F22(由Fab 0296表示)的TFPI表位包含KPI-1结构域之前的残基(包括短N-末端α-螺旋),KPI-1结构域的β-链1之前的环中的残基,和β-链1起始端中的残基。其还包含β-链2末端中的残基,和β-链2与KPI-1的C-末端α-螺旋之间的残基,以及KPI-1的C-末端α-螺旋内的残基。
因此,结果显示,Fab 0296与TFPI KPI-1及前面N-末端区的部分特异性结合,所以mAb 2F22也与它们特异性结合。
针对TFPI KPI-1的Fab 0296互补位包括重(H)链(SEQ ID NO:14,表2)的残基Val 2、Phe 27、Tyr 32、Trp 52、Arg 53、Gly 54、Gly 55、Ser 56、Ile 57、Asp 58、Tyr 59、Ala 61、Met 64、Lys 97、Ser 99、His 100、Asn 102、Tyr 103、Val 104、Gly 105和Tyr 106,以及轻(L)链(SEQ ID NO:15,表2)的残基Pro 31、Ala 32、Tyr 49、Ser 50、Asn 53、Tyr 55、Thr 56、Tyr 91、Thr 92、Ser 93和Tyr 94。
表2:来自TFPI(1-79)/Fab 0296复合物晶体结构的数据
结晶复合物的TFPI KPI-1,K链(SEQ ID NO:2)与Fab 0296的重链(H链)(SEQ ID NO:14)和Fab 0296的轻链(SEQ ID NO:15)的相互作用。采用的距离截止值。通过CCP4套件[Collaborative Computational Project,N.,Acta crystallographica.Section D,Biological crystallography,(1994),Vol.50,第760-763页]的CONTACT计算机软件程序鉴定接触。在最后一列中,如通过CONTACT计算的,“***”表示在此接触(距离<)处存在较大的氢键可能性,“*”表示较小的可能性(距离>)。空白表示该程序认为不存在氢键的可能性。氢键在供体与接受体之间是特异性的,通常较强,并且容易鉴定。
这些结果显示,抗-TFPI 0296与TFPI KPI-1和前面N-末端的部分特异性结合。
实施例5:mAb 2021和mAb 2021变体的克隆和工程化
本实施例描述了抗-TFPI抗体mAb 2021及其变体的克隆和工程化。
使用来自Qiagen的RNeasy-Mini试剂盒从M-hTFPI 4F36A1B2杂交瘤细胞中提取总RNA,并将其用作cDNA合成的模板。使用来自Clontech的SMARTTM RACE cDNA扩增试剂盒在5′-RACE反应中合成cDNA。使用Phusion Hot Start聚合酶(Finnzymes)和作为正向引物包含在SMARTTM RACE试剂盒中的通用引物混合物(UPM),通过PCR进行随后的HC和LC序列的靶扩增。对于HC(VH域)扩增,使用具有以下序列的反向引物:
5’-CCCTTGACCAGGCATCCCAG-3’(SEQ ID NO:12)
对于LC扩增,使用具有以下序列的反向引物:
5’-GCTCTAGACTAACACTCATTCCTGTTGAAGCTCTTG-3’(SEQ ID NO:13)
将PCR产物通过凝胶电泳进行分离,使用来自GE Healthcare Bio-Sciences的GFX PCR DNA&Gel Band Purification试剂盒进行提取,并使用Zero Blunt TOPO PCR Cloning试剂盒和化学感受态TOP10大肠杆菌(Invitrogen)克隆以供测序。使用来自Applied Biosystems的AmpliTaq Gold Master Mix和M13uni/M13rev引物在选择的菌落上进行菌落PCR。使用ExoSAP-IT酶混合物(USB)进行菌落PCR清除(clean-up)。在Eurofins MWG Operon,Germany处使用M13uni(-21)/M13rev(-29)或T3/T7测序引物进行测序。使用VectorNTI程序对序列进行分析并注释。所有试剂盒和试剂均按照制造商的说明书使用。
鉴定单个独特的鼠κ型LC和单个独特的鼠HC,亚类IgG1。
用于移植的抗-HzTFPI4F36A1B2的表达载体的生成
生成了一系列基于CMV启动子的表达载体(pTT载体),用于在由Yves Durocher开发的基于HEK293-6E EBNA的表达系统(Durocher等人,Nucleic Acid Research,2002)中瞬时表达抗TFPI抗体/抗体片段。除了CMV启动子外,基于pTT的载体还包含pMB1起点、EBV起点和Amp抗性基因。
基于克隆的鼠抗-TFPI4F36A1B2 VH和VL序列,通过在人种系序列上的CDR移植来设计抗TFPI4F36的人源化形式。根据上述抗体的人源化设计,合成(GENEART AG)了移植的HzTFPI4F36 VH和VL区的DNA序列。获得具有基本最小CDR移植并且没有其它回复突变的序列。构建体中包含相应的LC和HC种系前导肽序列,以及紧邻ATG起始密码子上游的Kozak序列(5′-GCCGCCACC-3′)。
生成基于pTT的表达载体以用于将移植的HzTFPI4F36抗体瞬时表达为人κ/IgG4(S241P)同种型。在IgG4铰链区中引入在位置241(根据Kabat编号,对应于根据EU编号系统的残基228(Edelman G.M.等人,Proc.Natl.Acad.USA 63,78-85(1969))处的脯氨酸突变,以消除单体抗体片段的形成,即由一条LC和一条HC组成的“半抗体(half-antibodies)”的形成。
对于HC表达载体,通过对GENEART克隆载体的限制酶消化切下VH片段,并将其克隆至含有人IgG4(S241P)CH域序列的线性化的基于pTT的载体中,随后转化至大肠杆菌中以供选择。通过DNA测序来验证最终构建体的序列。对于LC表达载体,通过对GENEART克隆载体的限制酶消化切下VL片段,并将其克隆至含有人κ CL域序列的线性化的基于pTT的载体中,随后转化至大肠杆菌中以供选择。通过DNA测序来验证最终构建体的序列。
用来分离mAb 2021的定点突变
在移植的HzTFPI4F36的轻链(LC)和重链(HC)中生成一系列人至小鼠反向突变(被称为回复突变)。
进行定点突变以在移植的HzTFPI4F36 LC/HC构建体中的特定残基处引入人至小鼠反向突变(以下称为回复突变),以优化移植的构建体。通过两种不同的方法引入突变:
1.使用来自Stratagene的定点或多位点定向突变试剂盒引入点突变和组合突变。试剂盒根据制造商的方案使用。
2.还使用标准的2步重叠PCR方法引入点突变以及产生组合突变。
将用于移植的HzTFPI4F36的LC和HC表达质粒用作突变的模板。通过DNA测序来验证所有最终构建体的序列。
mAb 2021 HC的最终序列携带具有使得框架序列与原始小鼠FR2相同的4个回复突变的FR2区,和3个CDR2突变体,即,与原始的移植序列相比,总共7个HC回复突变(A40T、G42E、G44R、S49A、Y59F、A60P、K64Q)(根据Kabat编号)。LC序列为移植的HzTFPI4F36 LC序列。根据Kabat限定CDR和框架。
最终mAb 2021的VH和VL区的氨基酸序列分别列为SEQ ID NO:19和SEQ ID NO:20。
为改善表达产量,将HC和LC的原始信号肽序列(人种系序列)交换为人CD33信号肽(SP)。通过用含有Kozak元件(GCCGCCACC)、起始密码子和CD33信号序列的引物(有义引物)以及含有终止密码子和EcoRI限制位点的引物(反义引物)对HC或LC片段进行标准PCR扩增来交换信号肽序列。将扩增的片段克隆至线性化的基于pTT的载体中,并转化至大肠杆菌中以供选择。通过DNA测序来验证最终构建体的序列。
mAb 2021的低亲和力变体的生成
在抗TFPI4F36A1B2的人源化从而获得mAb 2021的过程中,鉴定了许多低亲和力变体。这些变体通过定点突变如上所述生成。mAb 2007代表了这样的低亲和力变体。与移植的HzTFPI4F36的序列相比,mAb 2007在VH域中携带单个A60P回复突变(根据Kabat编号)。该变体具有分别比mAb 2021低至少一个数量级的TFPI结合亲和力。最初移植的HzTFPI4F36变体(mAb 2000)展现出比mAb 2021低约三个数量级的TFPI结合亲和力。
如实施例6所述生成用于表达mAb 2021和mAb 2021变体的Fab片段的表达载体。
实施例6:双特异性分子的Fab组分
对于Fab-Fab化学缀合物,生成了用于表达mAb 2021的截短的HC的表达载体。mAb 2021的克隆、人源化和表达于WO2010/072691中描述,其通过引用并入本文。如SEQ ID NO:23中所见,mAb 2021的基于IgG4的HC在铰链区中在mAb 2021 HC的人IgG4恒定区中的第一半胱氨酸残基之后截短。该截短留下可用于化学缀合的C-末端半胱氨酸。通过使用基于标准限制酶的克隆生成截短的序列,以将mAb 2021 HC的VH片段引入至含有截短的人IgG4 CH域序列的线性化的基于pTT的工具箱(toolbox)载体中。通过DNA测序来验证所有最终构建体的序列。使用mAb 2021 LC载体和上述截短的HC载体(SEQ ID NO:24和SEQ ID NO:23)将mAb 2021的Fab片段表达为Fab 0088。用于Fab 0088的LC表达载体与如上所述生成的用于mAb 2021的LC表达相同,即通过限制酶消化从GENEART克隆载体上切下VL片段,并将其克隆至含有人κ CL域序列的线性化的基于pTT的载体中。还生成了用于表达mAb 2021的低亲和力变体的重链表达载体。该mAb 2021变体源自mAb 2021的人源化,并且于WO2010/072691和实施例5中描述。为了组装表达载体,采用标准的基于限制酶的克隆将与实施例5中描述的mAb 2007和mAb 2000的HC的VH域相对应的区域克隆至含有截短的人IgG4 CH域序列的线性化的基于pTT的工具箱载体中。基于IgG4的HC在IgG4铰链中的第一个半胱氨酸之后截短,从而留下可用于化学缀合的C-末端半胱氨酸。通过DNA测序来验证最终构建体的序列。mAb 2007和mAb 2000的低亲和力Fab片段分别表示为Fab 0094(SEQ ID NO:21和SEQ ID NO:22)和Fab 0313(SEQ ID NO:25和SEQ ID NO:26)。Fab 0094和Fab 0313携带与Fab 0088相同的LC。
实施例7a:1,16-双(2,5-吡咯二酮-1-基)-4,13-二氮杂-7,10-二氧杂-3,14-二氧代十六烷的合成
将3-(2,5-吡咯二酮-1-基)丙酸(3.0g,18mmol)溶于二氯甲烷(20ml)中。将溶液添加至预洗涤的固定的二环己基碳二亚胺树脂(Novabiochem,产品号8.55029.0025,批次:S5092229 036,2.3mmol/g,10g)中,总体积为100ml。将混合物搅拌30分钟。
在60分钟内将1,8-二氨基-3,6-二氧杂辛烷(1.3g,8.9mmol)在二氯甲烷(50ml)中的溶液逐滴添加到搅拌的溶液中。将混合物搅拌2h。将溶液过滤并真空浓缩至干。产量:3.4g淡棕色固体。
通过LCMS([M+H]+:451)和NMR(1H和13C)表征产物。
将一部分制备的物质在乙酸酐中加热至90摄氏度,持续3小时。将溶液冷却,与水混合,冷冻并冻干。
通过LCMS([M+Na]+:473)表征产物。该物质用于以下两个实施例中所述的缀合。
实施例7b:Fab 0088和Fab 0295与1,16-双(2,5-吡咯二酮-1-基)-4,13-二氮杂-7,10-二氧杂-3,14-二氧代十六烷缀合以得到BiFab 9041
将Fab分子(每种Fab 4mg)的溶液在磷酸盐缓冲盐水(PBS)中调节至2.5mg/ml(50微摩尔)。将溶解在PBS中的双(磺酸苯基)苯基膦二钾二水合物盐(CAS:151888-20-9,Sigma-Aldrich)溶液添加至Fab在PBS中的溶液中,直至所得浓度为50微摩尔Fab和200微摩尔的膦试剂。将溶液在环境温度下温育过夜。
使用Amicon Ultracel离心过滤器(MWCO 10kDa,Millipore A/S,Hellerup,Denmark)将Fab 0088用pH 5.0的15mM乙酸钠缓冲液,1.0M NaCl进行缓冲液交换(终体积为1ml)。
使用Amicon Ultracel离心过滤器(MWCO 10kDa,Millipore A/S,Hellerup,Denmark)将Fab 0295用pH4.5的15mM乙酸钠缓冲液进行缓冲液交换。终体积:300微升。
将1,16-双(2,5-吡咯二酮-1-基)-4,13-二氮杂-7,10-二氧杂-3,14-二氧代十六烷(5mg)添加至还原的Fab蛋白质。将所得混合物在室温下温育50分钟。
将样品加载到HiTrap SP HP柱(1ml,在pH 4.5的15mM乙酸钠缓冲液中预处理,GE Healthcare Europe GmbH,DK-2605,Denmark)上。将固定的蛋白质用pH 4.5的15mM乙酸钠缓冲液(15个柱体积)洗涤,并用pH 5.0的15mM乙酸钠缓冲液,1M NaCl洗脱。将两种蛋白质溶液混合并使用Amicon Ultracel离心过滤器(MWCO 10kDa,MWCO 10kDa,Millipore A/S,Hellerup,Denmark)浓缩。终体积:100微升。
将混合物在环境温度下温育20小时。将溶液加载到已在pH7.3的10mM HEPES,150mM NaCl中预处理的Superdex200 16/60柱(GE Healthcare Europe GmbH,DK-2605,Denmark)上。使用所述缓冲液洗脱化合物BiFab 9041。将所选级分合并,浓缩,并使用SDS-PAGE分析、SEC-MALS、LCMS和Edman序列测定进行分析。
实施例7c:Fab 0313和Fab 0295与1,16-双(2,5-吡咯二酮-1-基)-4,13-二氮杂-7,10-二氧杂-3,14-二氧代十六烷缀合以得到BiFAab 9042
将Fab分子(5mg Fab 0313和7mg Fab 0295)的溶液在磷酸盐缓冲盐水(PBS)中调节至2.5mg/ml(50微摩尔)。将溶解在PBS中的双(磺酸苯基)苯基膦二钾二水合物盐(CAS号:151888-20-9,Sigma-Aldrich)溶液添加至Fab在PBS中的溶液中,直至所得浓度为50微摩尔Fab和200微摩尔的膦试剂。将溶液在环境温度下温育过夜。
使用Amicon Ultracel离心过滤器(MWCO 10 kDa,Millipore A/S,Hellerup,Denmark)将Fab 0313用pH 5.0的15mM乙酸钠缓冲液,1.0M NaCl进行缓冲液交换(终体积为1ml)。
使用Amicon Ultracel离心过滤器(MWCO 10kDa,Millipore A/S,Hellerup,Denmark)将Fab 0295用pH 4.5的15mM乙酸钠缓冲液进行缓冲液交换。终体积:300微升。
将1,16-双(2,5-吡咯二酮-1-基)-4,13-二氮杂-7,10-二氧杂-3,14-二氧代十六烷(5mg)添加至还原的Fab蛋白质。将所得混合物在室温下温育50分钟。
将样品加载到HiTrap SP HP柱(1ml,在pH 4.5的15mM乙酸钠缓冲液中预处理,GE Healthcare Europe GmbH,DK-2605,Denmark)上。将固定的蛋白质用pH 4.5的15mM乙酸钠缓冲液(15个柱体积)洗涤,并用pH 5.0的15mM乙酸钠缓冲液,1M NaCl洗脱。
将两种蛋白质溶液混合,并使用Amicon Ultracel离心过滤器(MWCO 10kDa,MWCO 10kDa,Millipore A/S,Hellerup,Denmark)浓缩。终体积:100微升。
将混合物在环境温度下温育20小时。将溶液加载到已在pH 7.3的10mM HEPES,150mM NaCl中预处理的Superdex20016/60柱(GE Healthcare Europe GmbH,DK-2605,Denmark)上。使用所述缓冲液洗脱BiFab 9042化合物。将所选级分合并,浓缩,并使用SDS-PAGE分析、SEC-MALS和LCMS进行分析。
实施例8:结合相互作用分析
在通过表面等离子体共振实时测量分子相互作用的Biacore T200(GEHealthcare)上进行结合研究。实验在25℃下进行,并且样品在15℃下储存在样品室中。由Biacore报告的信号(RU,响应单位)与四个串联流动池中各个传感器芯片表面上的质量直接相关。根据制造商的说明书,将山羊抗Fabκ轻链抗体(Nordic Biosite)固定在CM4传感器芯片的全部四个流动池上。通过将蛋白质稀释至运行缓冲液(10mM Hepes 0.3M NaCl,5mM CaCl2,0.05%表面活性剂P20,10mg/ml BSA,pH 7.4)中来进行纯化的双特异性分子的捕获,并将其注射在流动池2、3或4上,从而在流动池1中产生仅固定有抗Fab抗体的参考表面。双特异性分子为双特异性mAb 0421(SEQ ID NO:27、28和15、29)或BiFab 9041(SEQ ID NO:15、18、23、24)。通过在所有流动池上注射分析物(抗原)来进行TFPI FL(SEQ ID NO:1)、TFPI(1-79)和TFPI KPI-2蛋白的结合,以允许进行与不同经捕获的双特异性分子的结合相对于与参考表面的结合的比较分析。TFPI(1-79)片段跨越TFPI的N-末端和KPI-1结构域,具有N-末端连接的GSSGSSG标签(SEQ ID NO:16)。TFPI KPI-2片段跨越TFPI的KPI-2结构域,具有C-末端HIS6标签(SEQ ID NO:3)。将抗原连续稀释至运行缓冲液中,以30μl/min注射240s,并使其解离600s或14000s。延长监测以接近1E-5s-1的kd缓慢解离的抗原的解离相对获得解离速率的稳健值(robust value)是至关重要的。在每个分析物注射循环后,通过注射pH 2.1的10mM甘氨酸使CM4表面再生。该再生步骤将抗TFPI双特异性分子和任何结合的抗原从固定的捕获抗体表面上除去,并允许下一个相互作用样品对的随后结合。该再生程序没有从芯片表面上除去直接固定的抗Fab捕获抗体。
通过确定平衡解离常数(KD)来定量BiFab或双特异性mAb与抗原之间的结合亲和力,该平衡解离常数通过测量复合物形成和解离的动力学而确定。使用用于数据分析的Biacore评价软件,通过将数据全局拟合至具有局部Rmax的1∶1Langmuir模型来检索与单价复合物的结合和解离相对应的速率常数,如ka(结合速率)和kd(解离速率)。KD通过方程式KD=kd/ka与ka和kd相关。
通过双参考(在数据分析之前在捕获的双特异性分子基础上减去参考表面信号以及空白缓冲液注射)来处理结合曲线。这允许在样品注射期间针对仪器噪声、体积移位和漂移进行校正。
表3:TFPI蛋白与双特异性分子结合的相互作用动力学
人TFPI(1-79)或KPI-2与不同双特异性分子的结合常数ka(结合速率)、kd(解离速率)和KD(平衡解离常数)的测量结果。
在TFPI(1-79)的结合和TFPI KPI-2结合中发现BiFab 9041与mAb 0421没有大的差异(表3)。与单个TFPI结构域相比,TFPI FL的结合显示出不同的与两种双特异性分子的结合谱,因为结合似乎受到多价或亲合力结合的影响(即使在低配体密度下),从而产生更高的表观亲和力。TFPI FL与mAb 0421和BiFab 9041的结合具有类似的结合曲线形状,这表明通过经由两个抗体片段的化学缀合而引入双特异性结合(如同本实施例中使用的BiFab中一样),实现了与双特异性抗体相同的对结合谱的影响(参见图3)。
实施例9:凝血酶生成试验
在正常人血浆(CryoCheck Normal Plasma)中研究抗体对凝血酶生成的影响。通过再钙化并添加1pM组织因子与4μM磷脂囊泡(PPP-Reagent low)而诱导凝血的启动。通过添加100μg/ml绵羊抗人FVIII抗体(Haematologic Technologies Inc.,PAHFVIII-S)获得A型血友病样血浆。当指示时,向血浆中加入10-20nM外源重组人TFPIα(SEQ ID NO:1)。在来自Bachem(Bubendorf,Switzerland)的荧光底物Z-Gly-Gly-Arg-AMC.HCl(I-1140)转化后,连续评价凝血酶活性。使用分别设定在368和460nm的激发和发射波长,在微量滴定板Fluorskan Ascent荧光计(Thermo Labsystems,Helsinki,Finland)中测量荧光。使用校准器来允许计算所形成的凝血酶的量并针对内滤效应和荧光底物消耗来校正所获得的相对荧光单位。此外,减去凝血酶-α2-巨球蛋白复合物对底物转化的贡献。这些校正通过由Thrombinoscope BV(Maastricht,the Netherlands)提供的经校准的自动血栓图(thrombogram)(CAT)计算机软件自动进行。获得产生凝血酶生成曲线的数据的一阶导数,从而允许计算i)滞后时间,ii)曲线下总面积,内源性凝血酶电位(ETP),iii)凝血酶峰高度(峰值),iv)达到峰值的时间(ttPeak),和v)凝血酶生成的最大速率(速率)。
实施例10:TFPI(1-161)特异性抗TFPI抗体对TFPIα水平升高的人FVIII中和的血浆中组织因子诱导的凝血酶生成的影响
根据实施例9(图1),在凝血酶生成试验中研究了抗TFPI(1-79)抗体mAb 1F91、mAb 2F22、mAb 2F45和mAb 2F3以及TFPI KPI-2抗体mAb 2021对凝血酶生成的影响。来自图1中的凝血酶生成的参数可参见表4。达到峰值的时间(ttPeak,min)和凝血酶峰(nM)都是n=3的平均值。将200nM抗体添加至补充有20nM TFPIα的FVIII中和的血浆中。
表4:凝血酶峰高(峰值)和达到峰值的时间(ttPeak)
自凝血酶生成曲线衍生的凝血酶峰高(峰值)和达到峰值的时间(ttPeak),该凝血酶生成曲线在补充有20nM TFPIα的FVIII中和的血浆中获得。
一些但并非全部高亲和力TFPI(1-79)抗体能够部分恢复具有20nM TFPIα的A型血友病样血浆中的凝血酶生成。表4中的数据提示,当循环中TFPI抗体的存在导致血浆TFPI浓度积累和增加时,需要更有效的TFPI抑制阻断。
在根据实施例9的凝血酶生成试验中研究了将每种抗TFPI(1-79)抗体与抗TFPI KPI-2mAb 2021组合对凝血酶生成的影响,并于图2中示出。来自图2中的凝血酶生成的参数可参见表5。达到峰值的时间(ttPeak,min)和凝血酶峰(nM)都是n=3的平均值。将100nM抗体添加至补充有20nM TFPIα和100nM mAb 2021的FVIII中和的血浆中。
表5:凝血酶峰高(峰值)和达到峰值的时间(ttPeak)
自凝血酶生成曲线衍生的凝血酶峰高(峰值)和达到峰值的时间(ttPeak),该凝血酶生成曲线在补充有20nM TFPIα的FVIII中和的血浆中获得。将100nM的每种抗体添加至血浆中。
表5中的数据提示,通过中和参与TF/FVIIa/FXa/TFPI复合物稳定化的超过一个表位,获得了更有效的TFPI抑制阻断。
实施例11:抗TFPI BiFab对人A型血友病血浆中组织因子诱导的凝血酶生成的协同效应
根据实施例2和5-7制备了针对TFPI(1-79)、TFPI的KPI-2结构域的Fab片段和BiFab。将靶向TFPI(1-79)和KPI-2结构域的BiFab对凝血酶生成的影响与单独或组合的相应未缀合Fab片段的影响进行比较。根据实施例9测量对FVIII中和的血浆和补充有10nM TFPIα的FVIII中和的血浆中的凝血酶生成的影响,并且数据于表6中列出。参数衍生自凝血酶生成曲线。达到峰值的时间(ttPeak,min)和凝血酶峰(nM)都是n=2的平均值。
表6:凝血酶峰高(峰值)和达到峰值的时间(ttPeak)
自凝血酶生成曲线衍生的凝血酶峰高(峰值)和达到峰值的时间(ttPeak),该凝血酶生成曲线在具有内源TFPI水平或补充有10nM TFPIα的FVIII中和的血浆中获得。当使用FAb片段的组合时,每种片段被添加至100nM的浓度。
表6中的数据提示,通过中和TFPI上的超过一个表位,获得了更有效的TFPI抑制阻断。显然,由于BiFab 9042与TFPI结合的亲合力效应(实施例8)而获得的高亲和力导致了对凝血酶生成的协同效应,其高于通过将相应的两个未缀合的Fab片段组合而获得的效应。
实施例12:抗TFPI双特异性抗体对人A型血友病血浆中组织因子诱导的凝血酶生成的影响
通过使用经由靶向TFPI(1-79)和TFPI的KPI-2区中的表位的抗体的Fc异二聚化而组装的不对称双特异性抗体,可获得对人A型血友病血浆中组织因子诱导的凝血酶生成的促凝血作用。
不对称双特异性抗体的生成
基于不对称IgG形式,即通过Fc异二聚化,生成双特异性TFPI(1-79)/KPI-2结合抗体。为了实现FC异二聚化,将一组相容的突变工程改造至mAb 2021(KPI-2结合)和mAb 2F22(TFPI(1-79)结合)的hIgG1变体的Fc区中。
通过限制酶消化从实施例5中描述的人源化mAb 2021的HC表达载体和HC表达载体mAb 2F22表达载体上切下VH片段,并将其克隆至含有人IgG1恒定区序列的线性化的基于pTT的工具箱载体中。随后将克隆反应转化到大肠杆菌中以供选择。通过DNA测序来验证最终构建体的序列。
为通过受控的Fab-臂交换来支持FC异二聚化,向mAb 2021的IgG1 HC的CH3域中引入单个赖氨酸至精氨酸的突变,其对应于SEQ ID NO:27的位置413。通过使用来自Stratagene的定点突变试剂盒的定点突变来引入该突变。通过DNA测序来验证所有最终构建体的序列。mAb 2021的工程化IgG1形式如实施例2中所述在EXPI293F细胞中表达为mAb 0310(SEQ ID NO:27和28)。LC表达载体对应于如实施例5中所述的用于mAb 2021表达的载体。根据制造商的说明书,通过使用来自GE Healthcare的MabSelectSuRe树脂的标准亲和色谱法进行纯化。将纯化的抗体用pH 7.2的PBS缓冲液进行缓冲液交换。
向mAb 2F22的IgG1 HC的CH3域中引入匹配的苯丙氨酸至亮氨酸突变,其对应于SEQ ID NO:29中的位置409。通过使用来自Stratagene的定点突变试剂盒的定点突变来引入该突变。通过DNA测序来验证所有最终构建体的序列。mA2 2F22的工程化IgG1形式如实施例2中所述在EXPI293F细胞中表达为mAb 0336(SEQ ID NO:15和29)。LC表达载体对应于如实施例2中所述的用于mAb 2F22表达的载体。根据制造商的说明书,通过使用来自GE Healthcare的MabSelectSuRe树脂的标准亲和色谱法进行纯化。将纯化的抗体用pH 7.2的PBS缓冲液进行缓冲液交换。
通过mAb2021(KPI-2结合)的工程化IgG1变体mAb 0310与mAb 2F22(TFPI(1-79)结合)的工程化IgG1变体mAb 0336之间的受控Fab-臂交换,制备了双特异性TFPI(1-79)/KPI-2结合抗体。基本上根据公开的方法(Labrijn等人,PNAS,110,5145-5150(2013))制备该双特异性抗体。简言之,将mAb 0310(mAb 2021 IgG1 Lys至Arg变体SEQ ID NO:27)与mAb 0336(mAb 2F22 IgG1 Phe至Leu变体SEQ ID NO:29)以1∶1摩尔比(每种抗体1mg/ml)于PBS缓冲液中混合。通过在25mM 2-巯基乙胺(MEA)的存在下于37℃温育该1∶1混合物90分钟来选择性地还原该抗体,以形成半抗体并允许Fab-臂交换。最后,在除去还原剂(渗滤至不含MEA的PBS缓冲液中)并在+5℃下储存至少16小时后获得自发重组装和再氧化。观察到由CH3域突变促进的异二聚化,效率超过90%。衍生自mAb 0310和0336的最终双特异性抗体被命名为mAb 0421(SEQ ID NO:27、28和15、29)。
抗TFPI双特异性抗体对人A型血友病血浆中组织因子诱导的凝血酶生成的影响
通过使用经由靶向TFPI(1-79)和TFPI的KPI-2区中的表位的抗体的Fc异二聚化而组装的不对称双特异性抗体,可获得对人A型血友病血浆中组织因子诱导的凝血酶生成的促凝血作用。根据实施例9于凝血酶生成试验中研究了对FVIII中和的血浆和补充有10nM TFPIα的FVIII中和的血浆中凝血酶生成的影响,并且数据于表7中列出。参数衍生自凝血酶生成曲线。
表7:凝血酶峰高(峰值)和达到峰值的时间(ttPeak)
表7显示,向正常血浆中添加抗人FVIII抗体以模拟A型血友病样条件大大减少了凝血酶生成。凝血酶峰值(峰值)和达到峰值的时间(ttPeak)都受到影响。向FVIII中和的血浆中添加一些抗TFPI抗体,包括mAb 0310(mAb 2021的Fc工程化形式)、mAb 0336(抗TFPI mAb 2F22的Fc工程化形式)和mAb 0421(衍生自mAb 0310和mAb 0336的不对称双特异性抗体),有效地重新确立了凝血酶峰值(峰值)和达到峰值的时间(ttPeak)。据估计,获得半数最大响应(EC50)所需的mAb 0421浓度为1.1nM(使用GraphPad PrismR软件将表7中给出的2次实验平均值的数据拟合至四参数剂量-响应曲线)。
此外,表7显示,向FVIII中和的血浆中添加10nM全长TFPIα完全阻止了可测量的凝血酶生成,并且在这些条件下100nM针对TFPI(1-79)(mAb 0336)或KPI-2(mAb 0310)的高亲和力抗体的添加不能完全消除TFPI抑制。相比之下,不对称双特异性抗体mAb 0421剂量依赖性地建立了稳定的凝血酶峰和缩短的达到峰值的时间(ttPeak),估计的EC50为9.5nM(单次实验)。
表7中的数据提示,通过中和TFPI上的超过一个表位,获得更有效的TFPI抑制阻断。
实施例13:与TFPI KPI-2高亲和力结合且与TFPI KPI-1低亲和力结合的双特异性分子
对于双特异性TFPI(1-79)/KPI-2结合分子的某些应用,一个臂与TFPI KPI-2高亲和力结合而另一个臂与TFPI(1-79)低亲和力结合可能是有利的。
对应于mAb 2F22的Fab 0296(SEQ ID NO:14(重链)和15(轻链))以高亲和力与TFPI(1-79)结合,并且可充当用于设计对TFPI(1-79)的亲和力降低(与Fab 0296相比)的变体的模板。
如实施例4所述,Fab 0296的互补位已经确定,并且包括重链(SEQ ID NO:14)的残基Val 2、Phe 27、Tyr 32、Trp 52、Arg 53、Gly 54、Gly 55、Ser 56、Ile 57、Asp 58、Tyr 59、Ala 61、Met 64、Lys 97、Ser 99、His 100、Asn 102、Tyr 103、Val 104、Gly 105和Tyr 106,以及轻链(SEQ ID NO:15)的残基Pro 31、Ala 32、Tyr 49、Ser 50、Asn 53、Tyr 55、Thr 56、Tyr 91、Thr 92、Ser 93和Tyr 94。
Fab 0296的高亲和力由在其上述互补位残基与TFPI(1-79)上的表位残基之间的几种相互作用,例如静电、极性、疏水和氢键相互作用的组合造成。因此,通过用不同的氨基酸残基置换一个或多个互补位残基,从而弱化或加强互补位-表位相互作用,来调节Fab 0296对TFPI(1-79)的结合亲和力。
通过例如在单个位置的保守取代、在数个位置的保守取代或在一个或多个位置的保守性较低的取代而不同程度地削弱Fab 0296对TFPI(1-79)的亲和力。
除了在重链C-末端处的额外半胱氨酸外,Fab 0295(SEQ ID NO:18(重链)和15(轻链))与Fab 0296相同,并且其具有与Fab 0296相同的互补位。因此,通过使用其中单个或多个互补位残基已被取代的Fab 0295的变体,并如实施例7所述将其与KPI-2结合Fab缀合,来制备对TFPI(1-79)具有低亲和力的双特异性TFPI(1-79)/KPI-2结合分子。KPI-2结合Fab可为例如Fab 0088,但也可为其它KPI-2结合Fab片段。
通过使用与本实施例中描述的Fab片段对应的全长抗体,根据实施例12中描述的方法获得相应的双特异性抗体是可能的。
虽然本文已经示出和描述了本发明的某些特征,但是本领域普通技术人员将会想到许多修改、替换、改变和等同物。因此,应当理解,所附权利要求旨在覆盖落入本发明真正精神内的所有这样的修改和改变。
序列表
<110> 诺和诺德股份有限公司
<120> 能够结合组织因子途径抑制物(1-161)上的两个表位的抗体
<130> 140072
<160> 29
<170> PatentIn version 3.5
<210> 1
<211> 276
<212> PRT
<213> 智人
<400> 1
Asp Ser Glu Glu Asp Glu Glu His Thr Ile Ile Thr Asp Thr Glu Leu
1 5 10 15
Pro Pro Leu Lys Leu Met His Ser Phe Cys Ala Phe Lys Ala Asp Asp
20 25 30
Gly Pro Cys Lys Ala Ile Met Lys Arg Phe Phe Phe Asn Ile Phe Thr
35 40 45
Arg Gln Cys Glu Glu Phe Ile Tyr Gly Gly Cys Glu Gly Asn Gln Asn
50 55 60
Arg Phe Glu Ser Leu Glu Glu Cys Lys Lys Met Cys Thr Arg Asp Asn
65 70 75 80
Ala Asn Arg Ile Ile Lys Thr Thr Leu Gln Gln Glu Lys Pro Asp Phe
85 90 95
Cys Phe Leu Glu Glu Asp Pro Gly Ile Cys Arg Gly Tyr Ile Thr Arg
100 105 110
Tyr Phe Tyr Asn Asn Gln Thr Lys Gln Cys Glu Arg Phe Lys Tyr Gly
115 120 125
Gly Cys Leu Gly Asn Met Asn Asn Phe Glu Thr Leu Glu Glu Cys Lys
130 135 140
Asn Ile Cys Glu Asp Gly Pro Asn Gly Phe Gln Val Asp Asn Tyr Gly
145 150 155 160
Thr Gln Leu Asn Ala Val Asn Asn Ser Leu Thr Pro Gln Ser Thr Lys
165 170 175
Val Pro Ser Leu Phe Glu Phe His Gly Pro Ser Trp Cys Leu Thr Pro
180 185 190
Ala Asp Arg Gly Leu Cys Arg Ala Asn Glu Asn Arg Phe Tyr Tyr Asn
195 200 205
Ser Val Ile Gly Lys Cys Arg Pro Phe Lys Tyr Ser Gly Cys Gly Gly
210 215 220
Asn Glu Asn Asn Phe Thr Ser Lys Gln Glu Cys Leu Arg Ala Cys Lys
225 230 235 240
Lys Gly Phe Ile Gln Arg Ile Ser Lys Gly Gly Leu Ile Lys Thr Lys
245 250 255
Arg Lys Arg Lys Lys Gln Arg Val Lys Ile Ala Tyr Glu Glu Ile Phe
260 265 270
Val Lys Asn Met
275
<210> 2
<211> 161
<212> PRT
<213> 人工序列
<220>
<223> TFPI (1-161)
<400> 2
Asp Ser Glu Glu Asp Glu Glu His Thr Ile Ile Thr Asp Thr Glu Leu
1 5 10 15
Pro Pro Leu Lys Leu Met His Ser Phe Cys Ala Phe Lys Ala Asp Asp
20 25 30
Gly Pro Cys Lys Ala Ile Met Lys Arg Phe Phe Phe Asn Ile Phe Thr
35 40 45
Arg Gln Cys Glu Glu Phe Ile Tyr Gly Gly Cys Glu Gly Asn Gln Asn
50 55 60
Arg Phe Glu Ser Leu Glu Glu Cys Lys Lys Met Cys Thr Arg Asp Asn
65 70 75 80
Ala Asn Arg Ile Ile Lys Thr Thr Leu Gln Gln Glu Lys Pro Asp Phe
85 90 95
Cys Phe Leu Glu Glu Asp Pro Gly Ile Cys Arg Gly Tyr Ile Thr Arg
100 105 110
Tyr Phe Tyr Asn Asn Gln Thr Lys Gln Cys Glu Arg Phe Lys Tyr Gly
115 120 125
Gly Cys Leu Gly Asn Met Asn Asn Phe Glu Thr Leu Glu Glu Cys Lys
130 135 140
Asn Ile Cys Glu Asp Gly Pro Asn Gly Phe Gln Val Asp Asn Tyr Gly
145 150 155 160
Thr
<210> 3
<211> 66
<212> PRT
<213> 人工序列
<220>
<223> TFPI KPI-2构建体
<400> 3
Gln Glu Lys Pro Asp Phe Cys Phe Leu Glu Glu Asp Pro Gly Ile Cys
1 5 10 15
Arg Gly Tyr Ile Thr Arg Tyr Phe Tyr Asn Asn Gln Thr Lys Gln Cys
20 25 30
Glu Arg Phe Lys Tyr Gly Gly Cys Leu Gly Asn Met Asn Asn Phe Glu
35 40 45
Thr Leu Glu Glu Cys Lys Asn Ile Cys Glu Asp Gly His His His His
50 55 60
His His
65
<210> 4
<211> 121
<212> PRT
<213> 小鼠
<400> 4
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Arg Gly Gly Ser Thr Asp Phe Asn Ala Ala Phe Met
50 55 60
Ser Arg Val Ser Phe Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ala Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Lys Asn Ser His Gly Asn Tyr Val Gly Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 5
<211> 107
<212> PRT
<213> 小鼠
<400> 5
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Thr Val Gly
1 5 10 15
Asp Lys Val Ser Ile Pro Cys Lys Ala Ser Glu Asn Val Gly Ala Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Thr Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Ile Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Arg Thr Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Thr Asn Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 6
<211> 121
<212> PRT
<213> 小鼠
<400> 6
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asn Tyr
20 25 30
Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Val Ile Trp Arg Gly Gly Ser Ile Asp Tyr Asn Ala Ala Phe Met
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ala Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Lys Asn Ser His Gly Asn Tyr Val Gly Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 7
<211> 107
<212> PRT
<213> 小鼠
<400> 7
Gly Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Thr Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Ser Val Gly Pro Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Ala Asp Phe Thr Leu Thr Ile Ser Asn Leu His Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Thr Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 8
<211> 121
<212> PRT
<213> 小鼠
<400> 8
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Ser Cys Thr Val Ser Gly Phe Ser Leu Thr Gly Tyr
20 25 30
Gly Val His Trp Ile Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Arg Gly Gly Ser Ile Asp Tyr Asn Ala Ala Phe Met
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ala Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Lys Asn Ser His Gly Asn Tyr Val Gly Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 9
<211> 107
<212> PRT
<213> 小鼠
<400> 9
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Thr Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Glu Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Arg Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Thr Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 10
<211> 115
<212> PRT
<213> 小鼠
<400> 10
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Trp Ala Tyr Asp Gly Pro Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ala
115
<210> 11
<211> 107
<212> PRT
<213> 小鼠
<400> 11
Gln Ile Val Leu Ser Gln Ser Pro Ala Leu Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser His Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Thr Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 12
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 12
cccttgacca ggcatcccag 20
<210> 13
<211> 36
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 13
gctctagact aacactcatt cctgttgaag ctcttg 36
<210> 14
<211> 222
<212> PRT
<213> 人工序列
<220>
<223> Fab 0296的截短的鼠-人嵌合重链
<400> 14
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asn Tyr
20 25 30
Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Val Ile Trp Arg Gly Gly Ser Ile Asp Tyr Asn Ala Ala Phe Met
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ala Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Lys Asn Ser His Gly Asn Tyr Val Gly Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
<210> 15
<211> 213
<212> PRT
<213> 人工序列
<220>
<223> mAb 0294、Fab 0296和Fab 0295和mAb 0336的鼠-人嵌合轻链
<400> 15
Gly Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Thr Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Ser Val Gly Pro Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Ala Asp Phe Thr Leu Thr Ile Ser Asn Leu His Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Thr Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 16
<211> 86
<212> PRT
<213> 人工序列
<220>
<223> 标记的TFPI KPI-1/N-末端(TFPI (1-79))
<400> 16
Gly Ser Ser Gly Ser Ser Gly Asp Ser Glu Glu Asp Glu Glu His Thr
1 5 10 15
Ile Ile Thr Asp Thr Glu Leu Pro Pro Leu Lys Leu Met His Ser Phe
20 25 30
Cys Ala Phe Lys Ala Asp Asp Gly Pro Cys Lys Ala Ile Met Lys Arg
35 40 45
Phe Phe Phe Asn Ile Phe Thr Arg Gln Cys Glu Glu Phe Ile Tyr Gly
50 55 60
Gly Cys Glu Gly Asn Gln Asn Arg Phe Glu Ser Leu Glu Glu Cys Lys
65 70 75 80
Lys Met Cys Thr Arg Asp
85
<210> 17
<211> 448
<212> PRT
<213> 人工序列
<220>
<223> 单克隆抗体mAb 0294的鼠-人嵌合重链
<400> 17
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asn Tyr
20 25 30
Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Val Ile Trp Arg Gly Gly Ser Ile Asp Tyr Asn Ala Ala Phe Met
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ala Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Lys Asn Ser His Gly Asn Tyr Val Gly Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 18
<211> 227
<212> PRT
<213> 人工序列
<220>
<223> Fab 0295的截短的鼠-人嵌合重链
<400> 18
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asn Tyr
20 25 30
Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Val Ile Trp Arg Gly Gly Ser Ile Asp Tyr Asn Ala Ala Phe Met
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ala Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Lys Asn Ser His Gly Asn Tyr Val Gly Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys
225
<210> 19
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> mAb 2021的重链可变域(VH)
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Arg Ser Gly Ser Tyr Ser Tyr Phe Pro Asp Ser Val
50 55 60
Gln Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Gly Tyr Asp Glu Gly Asp Ala Met Asp Ser Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 20
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> mAb 2021的轻链可变域(VL)
<400> 20
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Glu Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Val Ser Ile Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Ala
85 90 95
Thr His Phe Pro Gln Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 21
<211> 227
<212> PRT
<213> 人工序列
<220>
<223> Fab 0094的重链(HC)
<400> 21
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Arg Ser Gly Ser Tyr Ser Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Gly Tyr Asp Glu Gly Asp Ala Met Asp Ser Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys
225
<210> 22
<211> 219
<212> PRT
<213> 人工序列
<220>
<223> Fab 0094的轻链(LC)
<400> 22
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Glu Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Val Ser Ile Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Ala
85 90 95
Thr His Phe Pro Gln Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 23
<211> 227
<212> PRT
<213> 人工序列
<220>
<223> Fab 0088的重链(HC)
<400> 23
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Arg Ser Gly Ser Tyr Ser Tyr Phe Pro Asp Ser Val
50 55 60
Gln Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Gly Tyr Asp Glu Gly Asp Ala Met Asp Ser Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys
225
<210> 24
<211> 219
<212> PRT
<213> 人工序列
<220>
<223> Fab 0088的轻链(LC)
<400> 24
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Glu Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Val Ser Ile Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Ala
85 90 95
Thr His Phe Pro Gln Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 25
<211> 227
<212> PRT
<213> 人工序列
<220>
<223> Fab 0313的重链(HC)
<400> 25
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Arg Ser Gly Ser Tyr Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Gly Tyr Asp Glu Gly Asp Ala Met Asp Ser Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys
225
<210> 26
<211> 219
<212> PRT
<213> 人工序列
<220>
<223> Fab 0313的轻链(LC)
<400> 26
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Glu Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Val Ser Ile Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Ala
85 90 95
Thr His Phe Pro Gln Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 27
<211> 451
<212> PRT
<213> 人工序列
<220>
<223> mAb 0310的重链(HC)
<400> 27
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Arg Ser Gly Ser Tyr Ser Tyr Phe Pro Asp Ser Val
50 55 60
Gln Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Gly Tyr Asp Glu Gly Asp Ala Met Asp Ser Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 28
<211> 219
<212> PRT
<213> 人工序列
<220>
<223> mAb 0310的轻链(LC)
<400> 28
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Glu Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Val Ser Ile Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Leu Gln Ala
85 90 95
Thr His Phe Pro Gln Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 29
<211> 451
<212> PRT
<213> 人工序列
<220>
<223> mAb 0336的重链(HC)
<400> 29
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asn Tyr
20 25 30
Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Val Ile Trp Arg Gly Gly Ser Ile Asp Tyr Asn Ala Ala Phe Met
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ala Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Lys Asn Ser His Gly Asn Tyr Val Gly Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
- 还没有人留言评论。精彩留言会获得点赞!
- 肾外髓质钾通道的抑制剂的制作方法与工艺
- 一种抑制植物细胞组织在培养中褐化的方法与流程
- 干扰素调节因子5及其抑制剂在脑卒中疾病中的应用的制作方法与工艺
- 干扰素调节因子6(IRF6)及其抑制剂在治疗心肌肥厚中的应用的制作方法与工艺
- 人喉组织中水通道的表达定位方法与流程
- 补体因子H抑制剂及与之相关的用途的制作方法与工艺
- 干扰素调节因子5(IRF5)及其抑制剂在治疗心肌肥厚中的应用的制作方法与工艺
- 作为因子XIA抑制剂的环状P1连接体的制作方法与工艺
- 作为补体因子B抑制剂用于治疗眼科疾病的2‑(1H‑吲哚‑4‑基甲基)‑3H‑咪唑并[4,5‑B]吡啶‑6‑甲腈衍生物的制作方法与工艺
- 能够结合组织因子途径抑制剂(1‑161)上的两个表位的抗体的制作方法与工艺
- 干扰素调节因子5(IRF5)及其抑制剂在治疗心肌肥厚中的应用的制作方法与工艺
- 作为因子XIA抑制剂的环状P1连接体的制作方法与工艺
- 能够结合组织因子途径抑制剂(1‑161)上的两个表位的抗体的制作方法与工艺
- 针对组织因子途径抑制剂(TFPI)的优化的单克隆抗体的制作方法与工艺
- 一种作为自分泌运动因子抑制剂的咔唑类化合物及其制备方法和应用与流程
- 外周血单核细胞活化抑制剂在制备治疗急性肝衰竭的药物中的用途的制造方法与工艺
- 对NEDD8活化酶(NAE)抑制剂的反应的生物标记的制造方法与工艺
- 一种肺癌调节因子SRSF5及其抑制剂与应用的制造方法与工艺
- 自分泌运动因子抑制剂的制造方法与工艺
- 一种BCL‑2抑制剂Venetoclax的合成方法与流程