Tim蛋白质结合载体、使用该载体的细胞外膜囊泡及病毒的取得方法、除去方法、检测方法、以及包括该载体的试剂盒与流程
本发明涉及tim蛋白质结合载体、使用该载体的细胞外膜囊泡及病毒的取得方法、除去方法、检测方法、以及包括该载体的试剂盒。
背景技术:
众所周知,细胞外膜囊泡,在其粒子内部存在蛋白质、小分子rna(microrna)等核酸,负责细胞间的物质传递。细胞外膜囊泡也分泌于血液等体液中,细胞外膜囊泡中的蛋白质、小分子rna(microrna)等作为疾病的诊断标记受到瞩目。另外,其作为核酸药物的传递工具的应用也受到瞩目。
另外,病毒中,存在着大量的表面被覆有膜状的包膜的包膜病毒。包膜病毒大多是流感病毒、人类免疫缺陷病毒等引起疾病的病毒,因此,作为研究对象受到瞩目。另外,对包膜病毒进行灭活处理、用作疫苗、载体等,应用于疾病的预防、治疗中。
如此地,在将细胞外膜囊泡应用于诊断或医药品、将包膜病毒用作疫苗或载体、进行细胞外膜囊泡或包膜病毒的功能分析等的基础研究等时,高纯度地取得细胞外膜囊泡、包膜病毒的工序是必不可少的,人们热切地期待一种能够简便地取得高纯度的细胞外膜囊泡、包膜病毒的方法。另外,为了防止来自于生物的细胞外膜囊泡、包膜病毒的污染,人们期待开发一种从使用的来自于体液的材料中有效地除去细胞外膜囊泡、包膜病毒的方法。进一步地,还热切期待一种高感度地检测取得的细胞外膜囊泡、包膜病毒、以及被检体中的细胞外膜囊泡、包膜病毒的方法。
作为取得细胞外膜囊泡的方法,已知最常规的方法是,对样品进行超速离心分离处理,得到作为沉淀组分的细胞外膜囊泡(非专利文献1)。但是,对该方法而言,除细胞外膜囊泡以外,样品中所含的蛋白质复合体或凝集体、hdl等脂蛋白等也产生共沉淀,难以得到纯度高的细胞外膜囊泡。通过蔗糖密度梯度法,对通过所述超速离心分离处理得到的沉淀组分进行密度分级,从而能够分离蛋白质复合体、凝集体,但难以与密度相同的hdl进行分离。另外,对该方法而言,由于需要超速离心分离处理,因此,难以同时处理多个被检体。而且超速离心分离处理需要高价的仪器。
另外,还存在以下方法,即,添加以exoquick(系统生物科学公司(systembiosciences社)制)、总外泌体分离试剂(totalexosomeisolationreagent)(赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)为代表的市售的试剂,进行离心分离处理,由此,得到作为沉淀组分的细胞外膜囊泡(非专利文献1),但是,该方法中存在与利用所述超速离心分离处理的方法相比,得到的细胞外膜囊泡的纯度更低的问题。
除所述现有方法以外,还存在以下方法,即,使用针对细胞外膜囊泡的表面抗原蛋白质的抗体,通过该表面抗原蛋白质与抗体的亲和力取得细胞外膜囊泡的方法(抗cd63抗体固定化法、外泌体-人cd63分离/检测(exosome-humancd63isolation/detection)(赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)等)(非专利文献1)。对于所述方法而言,虽然能取得高纯度的细胞外膜囊泡,但存在以下问题:只能得到具有针对抗体的表面抗原蛋白质的细胞外膜囊泡、细胞外膜囊泡的收量少、为使细胞外膜囊泡从抗体溶出而需要使用表面活性剂、酸性缓冲液等、难以得到完整的(即,在保持细胞外膜囊泡的原本的功能的状态下)细胞外膜囊泡等。
作为取得病毒的方法,已知最常规的方法是,对样品进行超速离心分离处理,得到作为沉淀组分的病毒(非专利文献1)。但是,对于该方法而言,除病毒以外,样品中所含的蛋白质复合体或凝集体、hdl等脂蛋白等也产生共沉淀,难以得到纯度高的病毒。通过蔗糖密度梯度法,对通过所述超速离心分离处理而得到的沉淀组分进行密度分级,从而能够分离蛋白质复合体、凝集体,但是,难以与密度相等的凝集体分离。另外,还存在由于超速离心分离处理而导致病毒的活性下降的问题(非专利文献2)。另外,由于所述方法需要超速离心分离处理,因此,难以同时处理多个被检体。而且,超速离心分离处理需要高价的仪器。
除了所述方法以外,已知通过离子交换层析来纯化病毒的方法(非专利文献3)。但是,对于该方法而言,需要针对各种病毒设定最适条件。另外,有时难以进行条件设定,从而难以应用于所有病毒的纯化中。
作为除去细胞外膜囊泡的方法,已知最常规的方法是,对样品进行超速离心分离处理,对细胞外膜囊泡进行沉淀分级,作为除去样品得到其上清组分。但是,对于该方法而言,难以完全除去细胞外膜囊泡,样品中残留未完全除去的细胞外膜囊泡。
进而,还存在以下方法,即,添加以exoquick(系统生物科学公司(systembiosciences社)制)、总外泌体分离试剂(totalexosomeisolationreagent)(赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)为代表的市售的试剂,进行离心分离处理,从而对细胞外膜囊泡进行沉淀分级,作为除去样品得到其上清组分。但是,即使在该方法中,也不能完全除去细胞外膜囊泡,而残留于样品中,难以完全除去细胞外膜囊泡。另外,由于样品中混入添加的试剂,因此,该试剂有时会导致细胞外膜囊泡的生物活性等发生问题。
作为除去病毒的方法,已知有相同的方法,与除去细胞外膜囊泡的方法存在相同的问题。
作为检测细胞外膜囊泡的方法,已知作为常规方法的使用针对细胞外膜囊泡的表面抗原的抗体的夹心elisa。但是,已报告了对于通常的使用检测显色信号的抗体的夹心elisa系的最低检测灵敏度而言,以纯化外泌体计为3μg左右,在测定血清等体液样品时,不能得到充分的灵敏度(非专利文献4)。作为检测病毒的方法,也已知相同的方法,对于病毒的检测而言,也不能得到充分的灵敏度。
另外,作为其他检测细胞外膜囊泡的方法,已知流式细胞术法。但是,对于使用已固定化针对细胞外膜囊泡的表面抗原的抗体的载体来捕获细胞外膜囊泡的通常的方法而言,不能得到充分的灵敏度,难以从培养上清或体液等的样品中直接进行检测,从而需要从样品中浓缩或纯化细胞外膜囊泡后再进行检测。
现有技术文献
非专利文献
非专利文献1:kennethw.witweretal.journalofextracellularvesicles2013may27;2.doi:10.3402;
非专利文献2:g.y.chenetal.biotechnol.prog.25(2009)1669;
非专利文献3:petragersteretal.journalofchromatographya,1290(2013)36-45;
非专利文献4:mariantonialogozzietal.plosone4(2009)5219。
技术实现要素:
发明所要解决的课题
如上所述,利用已有的获取细胞外膜囊泡或病毒的方法,很难简便有效地在完整的状态下取得纯度高的细胞外膜囊泡或病毒。另外,现有的除去细胞外膜囊泡或病毒的方法难以有效地除去样品中的细胞外膜囊泡或病毒。进一步地,现有的细胞外膜囊泡或病毒的检测方法不能得到充分的灵敏度。
因此,本发明的课题是,纯度良好地且在完整的状态下简便有效地取得或除去存在于试样中的细胞外膜囊泡或病毒,高灵敏度地检测细胞外膜囊泡或病毒。
解决课题的技术方案
本发明是为解决所述课题而进行的,由下述技术方案构成。
1.一种载体(tim载体),其中,其结合有从含t细胞免疫球蛋白及粘蛋白域分子4(tim4)蛋白质、含t细胞免疫球蛋白及粘蛋白域分子3(tim3)蛋白质、以及含t细胞免疫球蛋白及粘蛋白域分子1(tim1)蛋白质中选出的蛋白质(tim蛋白质)。
2.一种取得试样中的细胞外膜囊泡或病毒的方法,其特征在于,其包括下述工序:
(1)在钙离子的存在下,形成结合于载体的tim蛋白质与试样中的细胞外膜囊泡或病毒的复合体的工序(复合体形成工序);
(2)将该复合体与试样分离的工序(复合体分离工序);
(3)从该复合体中分离细胞外膜囊泡或病毒,并且取得细胞外膜囊泡或病毒的工序(取得工序)。
3.一种除去试样中的细胞外膜囊泡或病毒的方法,其特征在于,其包括下述工序:
(1)在钙离子的存在下,形成结合于载体的tim蛋白质与试样中的细胞外膜囊泡或病毒的复合体的工序(复合体形成工序);
(2)将该复合体与试样分离的工序(复合体分离工序)。
4.一种检测试样中的细胞外膜囊泡或病毒的方法,其特征在于,包括下述工序:
(1)在钙离子的存在下,形成结合于载体的tim蛋白质与试样中的细胞外膜囊泡或病毒的复合体的工序(复合体形成工序)
(2)对该复合体进行检测的工序(检测工序)
5.一种细胞外膜囊泡或病毒捕获试剂盒,其中,其含有tim载体而形成。
6.一种细胞外膜囊泡或病毒捕获试剂盒,其中,其含有含tim蛋白质而成的试剂以及含载体而成的试剂而形成。
鉴于所述情况,本发明人等进行了精心的研究,结果发现,通过使用选自tim1蛋白质、tim3蛋白质以及tim4蛋白质中的至少一种蛋白质,能够高纯度地得到表面具有磷脂酰丝氨酸的细胞外膜囊泡或病毒,能够在完整的状态下得到所述细胞外膜囊泡或病毒,能够有效地除去该细胞外膜囊泡或病毒,能够高灵敏度地检测所述细胞外膜囊泡或病毒,直至完成了本发明。
在细胞外膜囊泡的表面存在(露出)磷脂的磷脂酰丝氨酸。作为对磷脂酰丝氨酸具有结合能力的蛋白质(以下,有时简称为“磷脂酰丝氨酸结合蛋白质”“ps蛋白质”),例如,已知annexinv(膜粘连蛋白-5)、mfg-e8、tim1(含t细胞免疫球蛋白及粘蛋白域分子1,t-cellimmunoglobulin-mucin-domain1)、tim1(含t细胞免疫球蛋白及粘蛋白域分子1,t-cellimmunoglobulin-mucin-domain1)蛋白质、tim3(含t细胞免疫球蛋白及粘蛋白域分子3,t-cellimmunoglobulin-mucin-domain3)蛋白质、tim4(含t细胞免疫球蛋白及粘蛋白域的分子4、t-cellimmunoglobulin-mucin-domain4)蛋白质等(thejournalofbiochemistry265,4923-4928(25march1990)、nature417,182-187(9may2002)、nature450,435-439(15november2007)。
但是,已经发现,在所述ps蛋白质中,在使用除了tim1蛋白质、tim3蛋白质以及tim4蛋白质以外的ps蛋白质的情况下,难以取得、除去或检测细胞外膜囊泡或病毒。
发明的效果
通过本发明,能够高纯度且在完整的状态下简便有效地在取得、除去、高灵敏度地检测存在于试样中的细胞外膜囊泡或病毒。
附图说明
图1是在实施例1-8中通过蛋白质免疫印迹法(westernblotting)确认是否取得了细胞外膜囊泡的电泳图。
图2是在实施例9-16中通过蛋白质免疫印迹法确认是否取得了细胞外膜囊泡的电泳图。
图3是在实施例17-18中通过蛋白质免疫印迹法确认是否取得了细胞外膜囊泡的电泳图。
图4a是在实施例19-20以及比较例1-3中通过蛋白质免疫印迹法确认是否取得了细胞外膜囊泡的电泳图。图4-b是在实施例19-20及比较例1-3中通过银染色确认是否取得了细胞外膜囊泡的电泳图。
图5是在实施例21中通过电子显微镜观察的、采用本发明的方法取得的细胞外膜囊泡。
图6是在实施例22-25中通过蛋白质免疫印迹法确认是否取得了细胞外膜囊泡的电泳图。
图7是在实施例26-27及比较例4-9中通过银染色确认是否取得了细胞外膜囊泡的电泳图。
图8是在实施例28-33中通过蛋白质免疫印迹法确认是否取得了细胞外膜囊泡的电泳图。
图9是在实施例34-35及比较例10-13中通过蛋白质免疫印迹法确认是否取得了细胞外膜囊泡的电泳图。
图10是在实施例36-38中通过蛋白质免疫印迹法确认是否取得了细胞外膜囊泡的电泳图。
图11是在实施例39-40中通过蛋白质免疫印迹法确认是否取得了细胞外膜囊泡的电泳图。
图12是在实施例41-47中通过蛋白质免疫印迹法确认是否取得(除去)了细胞外膜囊泡的电泳图。
图13是在实施例48-55中通过蛋白质免疫印迹法确认是否取得(除去)了细胞外膜囊泡的电泳图。
图14是在实施例56-67及比较例14-15中通过蛋白质免疫印迹法确认是否取得了细胞外膜囊泡的电泳图。
图15是在实施例68-79中通过蛋白质免疫印迹法确认是否取得了细胞外膜囊泡的电泳图。
图16是在实施例80-83及比较例16-19中通过蛋白质免疫印迹法确认是否取得了细胞外膜囊泡的电泳图。
图17是在实施例84-95及比较例20-21中通过蛋白质免疫印迹法确认是否取得了病毒的电泳图。
图18是在实施例96-99及比较例22-25中通过蛋白质免疫印迹法确认是否取得了病毒的电泳图。
图19是在实施例100-105及比较例26-33中通过elisa法检测细胞外膜囊泡的结果。
图20是在实施例106-109中通过elisa法检测细胞外膜囊泡的结果。
图21是在实施例110-115及比较例34-39中通过elisa法检测病毒的结果。
图22是在实施例116-119中通过蛋白质免疫印迹法确认是否取得了病毒的电泳图。
图23是在实施例120-121及比较例40-41中通过流式细胞术法检测细胞外膜囊泡的结果。
图24是在实施例122-123及比较例42-43中通过蛋白质免疫印迹法确认是否取得了病毒的电泳图。
图25是在实施例124-125及比较例44-45中通过蛋白质免疫印迹法确认是否取得了病毒的电泳图。
具体实施方式
<1.本发明的细胞外膜囊泡>
作为本发明的细胞外膜囊泡(extracellularmembranevesicles),是由生物体内细胞或培养细胞分泌的、由脂质双层膜构成且在膜表面具有磷脂酰丝氨酸的小型膜囊泡。该囊泡的直径通常为20nm至1000nm,优选为50nm至500nm,更优选为50nm至200nm。
对本发明的细胞外膜囊泡而言,如《naturereviewsimmunology》(9,581-593(august2009))、《肥满研究》(vol.13,no.22007)的主题中青木直人等记载的,可举出根据形成来源以及小型膜囊泡的尺寸等分类的各种各样的囊泡。具体而言,可举出外泌体(exosomes)、微囊泡(microvesicle)、核外颗粒体(ectosomes)、膜颗粒(membraneparticles)、外泌体样囊泡(exosome-likevesicles)、凋亡囊泡(appototicvesicles)、脂肪体(adiposome)等。
外泌体是来源于后期内体的、由脂质双层膜构成且在该膜表面具有磷脂酰丝氨酸的小型膜囊泡。该囊泡的直径通常为50nm至200nm,优选为50nm至150nm,更优选为50nm至100nm。众所周知,外泌体包含cd63、cd9等的四次跨膜蛋白(tetraspanins)、alix、tsg101、lamp-1、flotillin(浮舰蛋白)等的蛋白质。
微囊泡是来源于细胞膜(细胞质膜,plasmamenmbrane)的、由脂质双层膜构成且在该膜表面具有磷脂酰丝氨酸的小型膜囊泡。微囊泡通常为100nm至1000nm,优选为100nm至800nm,更优选为100nm至500nm。众所周知,微囊泡含有整联蛋白、选择蛋白、cd40配体等的蛋白质。
核外颗粒体是来源于细胞膜(细胞质膜,plasmamenmbrane)的、由脂质双层膜构成且在该膜表面具有磷脂酰丝氨酸的小型膜囊泡。核外颗粒体通常为50nm至200nm,优选为50nm至150nm,更优选为50nm至100nm。已知核外颗粒体含有cr1、蛋白质水解酶(proteolyticenzyme),但不含cd63。
膜颗粒是来源于细胞膜(细胞质膜,plasmamenmbrane)的、由脂质双层膜构成且在该膜表面具有磷脂酰丝氨酸的小型膜囊泡。膜颗粒通常为50nm至80nm。已知膜颗粒含有cd133,但不含cd63。
外泌体样囊泡是来源于早期内体的、由脂质双层膜构成且在该膜表面具有磷脂酰丝氨酸的小型膜囊泡。外泌体样囊泡通常为20nm至50nm。已知外泌体样囊泡含有tnfri(肿瘤坏死因子受体i,tumornecrosisfactorreceptori)。
凋亡囊泡是来源于凋亡细胞的、由脂质双层膜构成且在该膜表面具有磷脂酰丝氨酸的小型膜囊泡。凋亡囊泡通常为50nm至500nm,优选为50nm至300nm,更优选为50nm至200nm。已知凋亡囊泡含有组蛋白。
脂肪体是来自于脂肪细胞的、由脂质双层膜构成且在该膜表面具有磷脂酰丝氨酸的小型膜囊泡。脂肪体通常为100nm至1000nm,优选为100nm至800nm,更优选为100nm至500nm。已知脂肪体含有mfg-e8(乳脂肪球表皮生长因子8,milkfatglobule-egffactor8)。
<2.本发明的病毒>
作为本发明的病毒,是在病毒的衣壳(外壳)具有由来源于宿主细胞的细胞膜、核膜、高尔基体、内质网等的脂质双层膜构成的包膜(envelop)、在包膜表面具有磷脂酰丝氨酸的病毒(以下,称作“包膜病毒”)。该本发明的病毒直径通常为20nm~320nm。作为本发明的包膜病毒,可举出属于记载于生化学辞典第2版(东京化学同人,1990,1503p―1505p)中的科的具有包膜的病毒。具体地,可举出痘病毒科(poxviridae)、杆状病毒科(baculoviridae)、弹状病毒科(rhabdoviridae)、布尼亚病毒科(bunyaviridae)、披膜病毒科(togaviridae)、疱疹病毒科(herpesviridae)、副粘病毒科(paramyxoviridae)、正粘病毒科(orthomyxoviridae)、反转录病毒科(retrovirus)、沙粒病毒科(arenaviridae)、冠状病毒科(coronaviridae)等。
<3.本发明的tim蛋白质>
本发明的tim蛋白质是选自本发明的含t细胞免疫球蛋白及粘蛋白域分子1(tim1)蛋白质(以下,有时简称“本发明的tim1蛋白质”)、本发明的含t细胞免疫球蛋白及粘蛋白域分子3(tim3)蛋白质(以下,有时简称“本发明的tim3蛋白质”)、以及本发明的含t细胞免疫球蛋白及粘蛋白域分子4(tim4)蛋白质(以下,有时简称“本发明的tim4蛋白质”)中的至少一种tim蛋白质。
作为本发明的tim4(含t细胞免疫球蛋白及粘蛋白域分子4)蛋白质,只要是能结合于本发明的细胞外膜囊泡或病毒的蛋白质即可,优选来自于动物的tim4蛋白质。其中,优选人或小鼠所具有的tim4蛋白质(以下,有时将人所具有的tim4蛋白质简称为“人源tim4蛋白质”,将小鼠所具有的tim4蛋白质简称为“小鼠源tim4蛋白质”)。
更具体而言,只要是至少具有相对于磷脂酰丝氨酸的结合域(igv域)的氨基酸序列的蛋白质即可,可以是具有tim4蛋白质全长氨基酸序列的蛋白质,也可以是tim4蛋白质的一部分。
作为相对于所述磷脂酰丝氨酸的结合域(igv域)的氨基酸序列,例如,可举出序列号1(小鼠源tim4蛋白质的n末端第22~135位氨基酸域(refseqnp_848874.3)、序列号2(人源tim4蛋白质的n末端第25~137位氨基酸域(refseqnp_612388.2)等。
作为所述tim4蛋白质全长氨基酸序列,可举出序列号3(小鼠源tim4蛋白质全长序列第1~343位氨基酸域(refseqnp_848874.3))、序列号4(人源tim4蛋白质全长序列第1~378位氨基酸域(refseqnp_612388.2))等。
作为所述tim4蛋白质的一部分,可举出序列号5(小鼠源tim4蛋白质的n末端第22~273位氨基酸域(refseqnp_848874.3))、序列号6小鼠源tim4蛋白质的n末端第22~279位氨基酸域(refseqnp_848874.3)、序列号7人源tim4蛋白质的n末端第25~315位氨基酸域(refseqnp_612388.2)等的具有相对于磷脂酰丝氨酸的结合域(igv域)及粘蛋白域的氨基酸序列的序列等。根据需要,所述序列可以具有信号序列。
作为本发明的tim1(含t细胞免疫球蛋白及粘蛋白域分子1)蛋白质,只要是能与本发明的细胞外膜囊泡或病毒结合的蛋白质即可,优选来源于动物的tim1蛋白质。其中,优选人或小鼠所具有的tim1蛋白质(以下,有时将人所含的tim1蛋白质简称“人源tim1蛋白质”,将小鼠所含的tim1蛋白质简称“小鼠源tim1蛋白质”)。
更具体地,只要是至少具有相对于磷脂酰丝氨酸的结合域(igv域)的氨基酸序列的蛋白质即可,可以是具有tim1蛋白质全长氨基酸序列的蛋白质,也可以是tim1蛋白质的一部分。
作为所述相对于磷脂酰丝氨酸的结合域(igv域)的氨基酸序列,例如,可举出序列号8(小鼠源tim1蛋白质的n末端第22~131位氨基酸域(refseqnp_001160104.1)、序列号9(人源tim1蛋白质的n末端第21~130位氨基酸域(refseqnp_036338.2)等。
作为所述tim1蛋白质全长氨基酸序列,可举出序列号10(小鼠源tim1蛋白质全长序列第1~282位氨基酸域(refseqnp_001160104.1)))、序列号11(人源tim1蛋白质全长序列第1~364位氨基酸域(refseqnp_036338.2)等。
作为所述tim1蛋白质的一部分,可举出序列号12(小鼠源tim1蛋白质的n末端第22~212位氨基酸域(refseqnp_001160104.1))、序列号13人源tim1蛋白质的n末端第21~295位氨基酸域(refseqnp_612388.2)等的具有相对于磷脂酰丝氨酸的结合域(igv域)及粘蛋白域的氨基酸序列的序列等。根据需要,所述序列可以具有信号序列。
作为本发明的tim3(含t细胞免疫球蛋白及粘蛋白域分子3)蛋白质,只要是能与本发明的细胞外膜囊泡或病毒结合的蛋白质即可,优选来源于动物的tim3蛋白质。其中,优选人或小鼠所具有的tim3蛋白质(以下,有时将人所具有的tim3蛋白质简称“人源tim3蛋白质”,将小鼠所具有的tim3蛋白质简称“小鼠源的tim3蛋白质”)。
更具体地,只要是至少具有相对于磷脂酰丝氨酸的结合域(igv域)的氨基酸序列的蛋白质即可,可以是具有tim3蛋白质全长氨基酸序列的蛋白质,也可以是tim3蛋白质的一部分。
作为所述相对于磷脂酰丝氨酸的结合域(igv域)的氨基酸序列,例如,可举出序列号14(小鼠源tim3蛋白质的n末端第22~134位氨基酸域(refseqnp_599011.2)、序列号15(人源tim3蛋白质的n末端第22~135位氨基酸域(refseqnp_116171.3)等。
作为所述tim3蛋白质全长氨基酸序列,可举出序列号16(小鼠源tim3蛋白质全长序列第1~281位氨基酸域(refseqnp_599011.2)))、序列号17(人源tim3蛋白质全长序列第1~301位氨基酸域(refseqnp_116171.3)等。
作为该tim3蛋白质的一部分,可举出序列号18(小鼠源tim3蛋白质的n末端第22~189位氨基酸域(refseqnp_599011.2))、序列号19人源tim3蛋白质的n末端第22~200位氨基酸域(refseqnp_116171.3)等的具有相对于磷脂酰丝氨酸的结合域(igv域)及粘蛋白域的氨基酸序列的序列等。根据需要,所述序列可以具有信号序列。
另外,对本发明的tim蛋白质而言,只要能与本发明的细胞外膜囊泡或病毒结合,也可以是上述氨基酸序列经一个或多个氨基酸的缺失、取代、插入和/或添加而形成的变异体。
本发明的tim蛋白质只要具备上述性质即可,能够使用从小鼠或人等动物、植物等具有tim蛋白质的生物的细胞(例如,巨噬细胞等免疫细胞)、组织等中提取的蛋白质、以及在其基础上通过基因重组技术制备而成的蛋白质等的任意蛋白质。
作为本发明的tim蛋白质,使用通过基因重组技术制备而成的蛋白质时,从便于纯化的方面考虑,优选具有一个或多个亲和标签的蛋白质。
作为该亲和标签,只要是通过基因重组技术制备蛋白质时使用的亲和标签,就可以使用任意标签,可举出例如fc标签、flag标签、his标签、gst标签、mbp标签、ha标签、myc标签、strep(ii)标签、pa标签等亲和标签。
该亲和标签与本发明的tim蛋白质的c末端一侧融合。
因此,本发明的tim蛋白质中,不仅包含仅由tim蛋白质的氨基酸序列(全长或一部分序列)构成的蛋白质,还包含具有tim蛋白质的氨基酸序列(全长或一部分序列)和如上所述的亲和标签的氨基酸序列的蛋白质。
另外,所述亲和标签与tim蛋白质可以直接结合,也可以通过《使用来源于昆虫培养细胞的无细胞蛋白质合成试剂盒(transdirectinsectcell)的蛋白质表达》(《昆虫培養細胞由来無細胞蛋白質合成試薬キットtransdirectinsectcellを用いた蛋白質発現》)(江连彻、铃木崇、伊东昌章、四方正光(岛津制作所/分析计测事业部),公开日2008/6/9,蛋白质科学会档案,1,e005(2008))等记载的间隔臂(spacer)进行结合。因此,本发明的tim蛋白质中,还包含具有tim蛋白质的氨基酸序列(全长或一部分序列)、如上所述的亲和标签的氨基酸序列以及间隔臂的氨基酸序列的蛋白质。
<4.本发明的tim蛋白质的制备方法>
本发明的tim蛋白质能够根据其氨基酸序列,通过常规的化学制造方法进行制造。例如,通过芴甲氧羰基法(fmoc法)、叔丁氧羰基法(tboc法)等通常的化学制造方法(化学合成法),能够得到本发明的tim蛋白质。另外,能够使用市售的肽合成机进行化学合成。
进而,本发明的tim蛋白质也能够通过下述采用基因重组技术的公知方法来获得,即,将编码本发明的tim蛋白质的核酸分子组合至适当的质粒、噬菌体等表达用载体中,用重组表达载体转化(或转导)宿主细胞,使得到的宿主细胞扩增,分泌至细胞内或细胞外。
针对本发明的tim蛋白质的制备方法,对通过基因重组技术进行制备的情况进行以下说明。
<本发明的表达用载体>
对于为了使本发明的tim蛋白质进行表达的表达用载体(以下,称作本发明的表达用载体)而言,只要包含对本发明的tim蛋白质进行编码的核酸序列(以下,有时也简称“本发明的tim编码序列”),就可以使用任意的载体。
在本发明的tim编码序列中,作为编码tim4蛋白质的核酸序列,可举出:例如序列号20(对小鼠源tim4蛋白质全长序列第1~343位氨基酸域进行编码的cdna的碱基序列(refseqno.nm_178759.4)。末端3个碱基包含终止密码子(tga))、序列号21(对人源tim4蛋白质全长序列第1~378位氨基酸域进行编码的cdna的碱基序列(refseqno.nm_138379.2)。末端3个碱基包含终止密码子(taa))等。
作为编码本发明的tim1蛋白质的核酸序列,可举出,例如序列号22(对小鼠源tim1蛋白质全长序列第1~282位氨基酸域进行编码的cdna的碱基序列(refseqno.nm_001166632.1)。末端3个碱基包含终止密码子(tga))、序列号23(对人源tim1蛋白质全长序列第1~364位氨基酸域进行编码的cdna的碱基序列(refseqno.nm_012206.3)。末端3个碱基包含终止密码子(taa))等。
作为对本发明的tim3蛋白质进行编码的核酸序列,可举出,例如序列号24(对小鼠源tim3蛋白质全长序列第1~281位氨基酸域进行编码的cdna的碱基序列(refseqno.nm_134250.2)。末端3个碱基包含终止密码子(tga))、序列号25(对人源tim3蛋白质全长序列第1~301位氨基酸域进行编码的cdna的碱基序列(refseqno.nm_032782.4)。末端3个碱基包含终止密码子(tag))等。
作为本发明的表达用载体,可以根据常规的克隆方法,在市售的载体中基因导入本发明的tim编码序列。作为本发明的表达用载体,可举出,例如根据常规的克隆技术,将序列号26(对小鼠源tim4蛋白质的n末端第1~273位氨基酸域进行编码的cdna,末端3个碱基包含终止密码子(tga))、序列号27(对小鼠源tim4蛋白质的n末端第1~279位氨基酸域进行编码的cdna,末端3个碱基包含终止密码子(tga))、序列号28(对人源tim4蛋白质的n末端第1~315位氨基酸域进行编码的cdna,末端3个碱基包含终止密码子(tga))、序列号29(对小鼠源tim1蛋白质的n末端第1~212位氨基酸域进行编码的cdna,末端3个碱基包含终止密码子(tga))、序列号30(对人源tim1蛋白质的n末端第1~295位氨基酸域进行编码的cdna,末端3个碱基包含终止密码子(tga))、序列号31(对小鼠源tim3蛋白质的n末端第1~189位氨基酸域进行编码的cdna,末端3个碱基包含终止密码子(tga))、或者序列号32(对人源tim3蛋白质的n末端第1~200位氨基酸域进行编码的cdna,末端3个碱基包含终止密码子(tga))组合至例如市售的pcag-neo载体(和光纯药工业(株)制)等的表达载体中而成的载体等。作为基因导入tim编码序列的载体,只要是具备在宿主细胞中表达、产生本发明的tim蛋白质的功能的载体即可,使用市售的载体则很方便。作为用于所述目的市售的载体,在宿主为动物细胞的情况下,可举出pcag-neo载体、pcdna载体等。
<宿主>
作为宿主,可以使用能表达本发明的tim蛋白质的任意宿主,例如,可举出大肠杆菌、昆虫细胞、哺乳类细胞、植物细胞、酵母细胞等,优选哺乳类细胞。作为哺乳类细胞,例如,可举出hek293t细胞、cos-7细胞、cho-k1细胞、cho-s细胞等。
<基因导入宿主>
根据《按目的选择的蛋白质表达方案》(目的別で選べるタンパク質発現プロトコール)(第3章蛋白质表达方案,isbn978-4-7581-0175-2,羊土社)等记载的在宿主中基因导入载体的常规方法,在宿主中基因导入本发明的表达用载体。
<宿主的培养>
对于经基因导入的宿主,按照培养宿主的常规方法进行培养。作为培养条件,根据经基因导入的宿主而各不相同,但依照各宿主的常规方法即可,例如,如果宿主为动物细胞,则可以在通常为5~10%、优选为5~8%co2、且通常为36℃~38℃、优选为36.5℃~37.5℃的条件下培养1天~10天,优选培养3天~4天。需要说明的是,由于本发明的tim蛋白质不含有跨膜区及胞内区,因此,在培养上清中表达、分泌。
<本发明的tim蛋白质的纯化>
然后,对得到的经基因导入的宿主的培养液进行离心分离处理(通常在200~400×g的条件下进行3分钟~10分钟,优选在300×g的条件下进行3分钟~6分钟),回收培养上清,根据需要,可以(i)通常在1000~2000×g的条件下对回收的培养上清进行20分钟~60分钟的离心分离处理,优选在1200×g的条件下对回收的培养上清进行20分钟~40分钟的离心分离处理,和/或(ii)利用过滤器进行过滤处理,将杂质分离,得到培养上清过滤液。
进而,根据需要,可以根据超滤等常规方法,将得到的培养上清过滤液浓缩成通常为5倍~20倍、优选为8倍~12倍,从而得到培养上清过滤液的浓缩液。
然后,在本发明的tim蛋白质具有亲和标签的情况下,可以根据《按目的选择的蛋白质表达方案》(目的別で選べるタンパク質発現プロトコール)(第3章蛋白质表达方案,第6节蛋白质的纯化,利用标签进行的纯化,isbn978-4-7581-0175-2,羊土社)等记载的对应于各亲和标签的利用亲和标签进行蛋白质纯化的常规方法(例如,使用已固定化对亲和标签具有亲和性的物质的载体的方法),从得到的培养上清、得到的培养上清过滤液、或者得到的培养上清过滤液的浓缩液中对本发明的tim蛋白质(tim蛋白质与亲和标签的融合蛋白质)进行纯化。
在本发明的tim蛋白质不具有亲和标签的情况下,可以根据《按目的选择的蛋白质表达方案》(目的別で選べるタンパク質発現プロトコール)(第3章蛋白质表达方案,第6节蛋白质的纯化,利用色谱法进行的纯化,isbn978-4-7581-0175-2,羊土社)等记载的蛋白质纯化的常规方法,通过各种色谱,从得到的培养上清、得到的培养上清过滤液、或者得到的培养上清过滤液的浓缩液中对本发明的tim蛋白质进行纯化。
可以适当组合上述纯化方法进行纯化。
<本发明的tim蛋白质的具体制备方法>
作为本发明的tim蛋白质的具体制备方法,例如,将fc标签用作亲和标签时,可举出以下方法。首先,按照常规方法,将本发明的tim编码序列组合到pef-fc载体或市售的载体中,构建本发明的表达用载体。然后,按照常规方法,在宿主细胞中基因导入本发明的表达用载体,在通常为5~10%、优选为5~8%co2的条件下,在通常为36℃~38℃、优选为36.5℃~37.5℃的温度培养1天~10天,优选培养3天~4天。然后,对得到的经基因导入的宿主的培养液进行离心分离处理(通常在200~400×g的条件下3分钟~10分钟,优选在300×g的条件下3分钟~6分钟),回收培养上清,根据需要,可以(i)通常在1000~2000×g的条件下对回收的培养上清进行20分钟~60分钟的离心分离处理,优选在1200×g的条件下进行20分钟~40分钟的离心分离处理,和/或(ii)利用过滤器进行过滤处理,将杂质分离,得到培养上清过滤液。进一步地,根据需要,可以根据超滤等常规方法,将得到的培养上清过滤液浓缩成通常5倍~20倍、优选8倍~12倍,从而得到培养上清过滤液的浓缩液。然后,在本发明的tim蛋白质具有亲和标签的情况下,根据对应于各亲和标签的、利用亲和标签进行纯化的常规方法,从得到的培养上清、得到的培养上清过滤液、或者得到的培养上清过滤液的浓缩液中对本发明的tim蛋白质进行纯化,从而得到本发明的tim蛋白质。
<5.本发明的tim载体>
本发明的结合有tim蛋白质的载体(以下,有时简称“本发明的tim载体”)是使如上述的本发明的tim蛋白质与本发明的载体结合而形成的载体。
具体而言,作为本发明的tim载体,可举出结合有本发明的tim1蛋白质的载体(以下,有时简称“本发明的tim1载体”)、结合有本发明的tim3蛋白质的载体(以下,有时简称“本发明的tim3载体”)、结合有本发明的tim4蛋白质的载体(以下,有时简称“本发明的tim4载体”)等。另外,结合有选自本发明的tim1蛋白质、本发明的tim3蛋白质以及本发明的tim4蛋白质中的两种以上的蛋白质的载体也包含在本发明的tim载体中。
作为本发明的tim载体,特别优选本发明的tim4载体。
<本发明的载体>
作为本发明的载体,只要是在常规的免疫学测定法中使用的不溶性载体,就能使用任意载体,例如聚苯乙烯、聚丙烯酸、聚甲基丙烯酸、聚甲基丙烯酸甲酯、聚丙烯酰胺、聚甲基丙烯酸缩水甘油酯、聚丙烯、聚烯烃、聚酰亚胺、聚氨酯、聚酯、聚氯乙烯、聚乙烯、聚氯碳酸酯(ポリクロロカーボネート)、硅酮树脂、硅酮橡胶、琼脂糖、葡聚糖、乙烯-马来酸酐共聚物等有机物质;玻璃、氧化硅、硅藻土、多孔玻璃、磨砂玻璃、氧化铝、硅胶、金属氧化物等无机物质;铁、钴、镍、磁铁矿、铬铁矿等磁性物质;以及以所述磁性物质的合金为材料制备的物质。另外,所述载体能以微孔板、管、盘状片、粒子(珠)等多种多样的形式进行使用。
需要说明的是,在用于后述本发明的取得方法及本发明的除去方法的情况下,优选以粒子(珠)的形式使用,对粒子的尺寸没有特别限定,但根据目的、用途,可举出通常为10nm~100μm、优选为100nm至10μm的粒子。
另外,在用于后述的本发明的检测方法的情况下,优选粒子(珠)或微孔板,对粒子的尺寸没有特别限定,但根据目的、用途,可举出通常为10nm~100μm、优选为100nm至10μm的粒子,另外,对微孔板的孔的数目、尺寸没有特别限定,但根据目的、用途,可举出通常为12孔至1536孔、优选为96孔至384孔的微孔板。
<本发明的tim蛋白质与本发明的载体的结合方法>
作为本发明的tim蛋白质与本发明的载体的结合方法,可以根据使蛋白质结合于载体这一本身已知的方法进行,可举出:例如,通过亲和结合进行结合的方法;通过化学结合进行结合的方法(例如,日本特许3269554号公报、wo2012/039395公报中记载的方法);通过物理吸附进行结合的方法(例如,日本特公平5-41946号公报中记载的方法)等,但优选通过亲和结合进行结合的方法以及通过物理吸附进行结合的方法。
需要说明的是,当用于后述的本发明的取得方法及除去方法时,优选通过亲和结合进行结合的方法。另外,当用于后述的本发明的检测方法时,优选通过亲和结合进行结合的方法或物理吸附。
<本发明的tim蛋白质与本发明的载体的结合方式>
作为本发明的tim蛋白质与本发明的载体的结合方式,只要本发明的载体与本发明的tim蛋白质结合,对结合方式就没有限定,但优选本发明的载体与本发明的tim蛋白质的巯基(sh基)结合的方式。另外,可以使本发明的tim蛋白质与本发明的载体直接结合,也可以使其通过化学连接物、亲和物质[例如,对亲和标签具有亲和性的物质(后述)、针对本发明的tim蛋白质的抗体、生物素类(后述)、亲和素类(后述)、抗体等]等间接地结合。
<通过亲和结合进行结合的方法>
作为上述通过亲和结合进行结合的方法,只要是利用物质间的亲和结合(亲和性)进行结合的方法,就可以使用任意方法,例如,可举出下述(a)~(c)。
(a)通过生物素类与亲和素类的亲和结合进行结合的方法
例如,通过使用由生物素类(生物素、亚氨基生物素、脱硫生物素、生物胞素、生物素亚砜等)以及亲和素类(亲和素、中性亲和素(tamavidin)、中性亲和素2(tamavidin2)、链霉亲和素等)的组合等组成的、相互具有亲和力(亲和性)的两种以上的物质(亲和物质),能够通过该亲和物质使本发明的tim蛋白质与本发明的载体结合。
需要说明的是,可以预先使亲和物质中的任意一者与本发明的tim蛋白质结合、使剩余的一者与本发明的载体结合,但是,例如在使用生物素类与亲和素类的情况下,通常,预先使亲和素类与本发明的载体结合,使生物素类与本发明的tim蛋白质结合。
(b)通过亲和标签与对亲和标签具有亲和性的物质的亲和结合进行结合的方法
例如,通过使用对亲和标签具有亲和性的物质(a蛋白(proteina)、g蛋白(proteing)等)等的与本发明的tim蛋白质具有亲和力(亲和性)的物质(亲和物质),从而能够通过该亲和物质使本发明的tim蛋白质与本发明的载体结合。
需要说明的是,通常预先使亲和物质与本发明的载体结合。
(c)通过针对本发明的tim蛋白质的抗体与本发明的tim蛋白质的亲和结合进行结合的方法
例如,通过使用针对本发明的tim蛋白质的抗体(抗flag标签抗体、抗his标签抗体、抗ha标签抗体、抗myc标签抗体、抗mbp标签抗体、抗gst标签抗体、抗strep(ii)标签抗体等的针对亲和标签的抗体、以及抗tim4抗体(anti-tim4antibody)(克隆rmt4-54)(生命周期生物科学(lifespanbiosciences)公司制)等)等的对本发明的tim蛋白质具有亲和力(亲和性)的物质(亲和物质),能够通过该亲和物质使本发明的tim蛋白质与本发明的载体结合。
需要说明的是,通常预先使亲和物质与本发明的载体结合。
需要说明的是,在上述方法中,能够使用使本发明的tim蛋白质或/和本发明的载体与亲和物质结合的方法、通过本身已知的物理吸附法使其结合的方法、通过化学结合法使其结合的方法,可以直接地结合,也可以通过连接物(linker)等间接地结合。
<结合于本发明的载体的本发明的tim蛋白质的量>
对于结合于本发明的载体的本发明的tim蛋白质的量而言,例如,当本发明的载体是珠时,相对于载体1mg,所述蛋白质的量通常为0.1μg~50μg,优选为0.5μg~30μg,更优选为1.0μg~20μg。
另外,当本发明的载体为微孔板时,相对于1个孔,所述蛋白质的量通常为0.1μg~10μg,优选为0.2μg~5μg,更优选为0.5μg~2μg。
<本发明的tim载体的具体的制备方法>
以下,以采用所述(a)-(c)的方法来制备本发明的tim载体的情况为例,说明本发明的tim载体的具体制备方法。
<(a)通过生物素类与亲和素类的亲和结合进行结合的方法>
首先,在(a)方法中,按照所述本发明的tim蛋白质的制备方法,制备本发明的tim蛋白质。然后,使本发明的tim蛋白质与生物素类结合(以下,有时简称为“生物素标记”或“生物素化”),使本发明的tim蛋白质-生物素类复合体形成。另一方面,使亲和素类与本发明的载体结合,使本发明的载体-亲和素类复合体形成(以下,有时简称为“结合有亲和素类的本发明的载体”)。使得到的本发明的tim蛋白质-生物素类复合体、与本发明的载体-亲和素类复合体接触,从而使本发明的tim蛋白质-生物素类复合体中的生物素类、与载体-亲和素类复合体中的亲和素类结合,从而得到本发明的tim载体。
-本发明的tim蛋白质与生物素类的结合(生物素标记)-
在所述(a)方法中,对本发明的tim蛋白质与生物素类的结合而言,可以使用市售的蛋白质的生物素标记试剂盒进行,也可以适当地调整所需的试剂类、通过蛋白质的生物素标记的常规方法进行。作为使用市售的蛋白质的生物素标记试剂盒(生物素化试剂盒)的方法,可以按照附带于生物素标记试剂盒-巯基(biotinlabelingkit-sh)((株)同仁科学研究所)或生物素标记试剂盒-氨基(biotinlabelingkit-nh2)((株)同仁科学研究所)中的方案所记载的方法进行。
与本发明的tim蛋白质1μg结合的生物素类的量,通常为10ng~1.0μg,优选为20ng~200ng,更优选为30ng~150ng。
作为使生物素类与本发明的tim蛋白质结合的部位,优选本发明的tim蛋白质的巯基。
-本发明的载体-亲和素类复合体(结合有亲和素类的本发明的载体)-
所述(a)方法中,本发明的载体-亲和素类复合体(结合有亲和素类的本发明的载体)可以使用市售的复合体,也可以适当地调整所需试剂类、按照常规方法进行制备。作为本发明的载体-亲和素类复合体,例如,可举出结合有亲和素的珠或微孔板、结合有中性亲和素(tamavidin)的珠或微孔板、结合有中性亲和素2(tamavidin2)的珠或微孔板、结合有链霉亲和素(streptavidin)的珠或微孔板等,作为市售的复合体,可举出dynabeadsm-270链霉亲和素c1珠(dynabeadsm-270streptavidinc1)(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)、链霉亲和素fg珠(fgビーズストレプトアビジン)(多摩川精机社制)、亲和素板(アビジンプレート)(住友电木公司(住友ベークライト社)制)等。
对本发明的载体与亲和素类的结合而言,例如,当本发明的载体为珠时,与本发明的载体1mg接触的亲和素类的量通常为5.0~150μg,优选为10~100μg,更优选为20~50μg。例如,当本发明的载体为微孔板时,与1个孔接触的亲和素类的量通常为0.1μg~10μg,优选为0.2μg~5μg,更优选为0.5μg~2μg。
-本发明的载体-亲和素类复合体与本发明的tim蛋白质-生物素类复合体的结合
所述(a)方法中,为了(使本发明的载体-亲和素类复合体与本发明的tim蛋白质-生物素类复合体结合)得到本发明的tim载体,例如当本发明的载体为珠时,可以使通常为0.1mg~10mg、优选为0.3mg~5.0mg、更优选为0.5~3.0mg的本发明的载体-亲和素类复合体、与相对于1mg的本发明的载体-亲和素类复合体通常为1.0~50μg、优选为1.0~30μg、更优选为1.0~20μg的本发明的tim蛋白质-生物素类复合体进行接触,或者当本发明的载体为微孔板时,可以使每孔中的本发明的载体-亲和素类复合体、与通常为1.0~10μg、优选为1.0~5.0μg、更优选为1.0~2.0μg的本发明的tim蛋白质-生物素类复合体进行接触,在通常为4.0℃~37℃、优选为11℃~30℃、更优选为20℃~25℃的条件下,进行通常为0.5小时~24小时、优选为0.5小时~8.0小时、更优选为0.5小时~2.0小时的反应,使亲和素类与生物素类结合。由此,本发明的载体-亲和素类复合体与本发明的tim蛋白质-生物素类复合体结合,得到本发明的tim载体。
需要说明的是,通常,可以通过使含有本发明的tim蛋白质-生物素类复合体的溶液与本发明的载体-亲和素类复合体接触来进行本发明的载体-亲和素类复合体与本发明的tim蛋白质-生物素类复合体的接触。
作为使含有本发明的tim蛋白质-生物素类复合体的溶液,只要是使本发明的tim蛋白质-生物素类复合体在稳定的状态下溶解的溶液即可,可举出例如纯净水、例如在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液(例如,pbs、tbs、hbs等)。另外,作为所述缓冲液中的缓冲剂浓度,通常从5.0~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。另外,在所述溶液中,只要是在使本发明的载体-亲和素类复合体与含有本发明的tim蛋白质-生物素类复合体的溶液接触后、不会阻碍本发明的载体-亲和素类复合体与本发明的tim蛋白质-生物素类复合体的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、蛋白质等。作为表面活性剂,可举出例如吐温20(tween20)等,使含有本发明的tim蛋白质-生物素类复合体的溶液中的表面活性剂浓度通常为0.00001~0.2%,优选为0.0005~0.1%。需要说明的是,有时将在所述溶剂中溶解本发明的tim蛋白质-生物素类复合体而成的溶液简记为“含有本发明的tim蛋白质-生物素类复合体的溶液”。
-基于所述(a)方法的本发明的tim载体的具体制备方法-
所述(a)方法中的本发明的tim载体的具体制备方法可以通过例如下述方法进行。
首先,按照所述本发明的tim蛋白质的制备方法,制备本发明的tim蛋白质。然后,按照附带于生物素标记试剂盒-巯基(biotinlabelingkit-sh)((株)同仁科学研究所)、生物素标记试剂盒-氨基(biotinlabelingkit-nh2)((株)同仁科学研究所)中的方案、或者蛋白质的生物素标记的常规方法,使生物素类与本发明的tim蛋白质结合,从而形成本发明的tim蛋白质-生物素类复合体。
然后,当本发明的载体为珠时,使通常为0.1mg~10mg、优选为0.3mg~5.0mg、更优选为0.5~3.0mg的本发明的载体-亲和素类复合体、与通常为50μl~1500μl、优选为100μl~1000μl、更优选为200μl~500μl的、含有相对于1mg的本发明的载体-亲和素类复合体通常为1.0~50μg、优选为1.0~30μg、更优选为1.0~20μg的本发明的tim蛋白质-生物素类复合体的溶液(例如,在纯净水、或者在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液等中含有本发明的tim蛋白质-生物素类复合体的溶液)进行接触,在通常为4.0℃~37℃、优选为11℃~30℃、更优选为20℃~25℃的温度,进行通常为0.5小时~24小时、优选为0.5小时~8.0小时、更优选为0.5小时~2.0小时的反应,使本发明的载体-亲和素类复合体中的亲和素类、与本发明的tim蛋白质-生物素类复合体中的生物素类结合,从而得到本发明的tim载体。
当本发明的载体为微孔板时,使每孔中的本发明的载体-亲和素类复合体与通常为50μl~300μl、优选为50μl~200μl、更优选为100μl~200μl的、含有通常为1.0~10μg、优选为1.0~5.0μg、更优选为1.0~2.0μg的本发明的tim蛋白质-生物素类复合体的溶液(例如,在纯净水、或在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液等中含有本发明的tim蛋白质-生物素类复合体的溶液)进行接触,在通常为4.0℃~37℃、优选为11℃~30℃、更优选为20℃~25℃的温度,进行通常为0.5小时~24小时、优选为0.5小时~8.0小时、更优选为0.5小时~2.0小时的反应,使本发明的载体-亲和素类复合体中的亲和素类、与本发明的tim蛋白质-生物素类复合体中的生物素类结合,从而得到本发明的tim载体。
<(b)通过亲和标签与对亲和标签具有亲和性的物质的亲和结合来进行结合的方法>
(b)方法中,首先,按照所述本发明的tim蛋白质的制备方法,制备具有亲和标签的本发明的tim蛋白质。另外,使对亲和标签具有亲和性的物质(亲和物质)与本发明的载体结合,使本发明的载体-亲和物质复合体形成(以下,有时简记为“结合有亲和物质的本发明的载体”)。使得到的本发明的载体-亲和物质复合体与具有亲和标签的本发明的tim蛋白质接触,使本发明的载体-亲和物质复合体中的亲和物质与具有亲和标签的本发明的tim蛋白质中的亲和标签结合,使本发明的载体-亲和物质复合体与具有亲和标签的本发明的tim蛋白质结合,从而得到本发明的tim载体。
-本发明的载体-亲和物质复合体-
所述(b)方法中,作为本发明的载体-亲和物质复合体,可以使用市售的商品,也可以适当地调整所需试剂类,按照常规方法进行制备。作为本发明的载体-亲和物质复合体,可举出例如结合有g蛋白的珠或微孔板、结合有a蛋白的珠或微孔板等,作为市售的商品,可举出dynabeadsg蛋白(dynabeadsproteing)(赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)、dynabeadsa蛋白(dynabeadsproteina)(赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)、fg珠g蛋白(fgbeadsproteing)(多摩川精机制)、fg珠a蛋白(fgbeadsproteina)(多摩川精机制)等。
对于本发明的载体与亲和物质的结合而言,作为与本发明的载体1mg接触的亲和物质的量,当本发明的载体为珠时,所述的量通常为5.0~50μg,优选为10~50μg,更优选为20~50μg。当本发明的载体为微孔板时,与1个孔接触的亲和物质的量通常为0.1μg~10μg,优选为0.2μg~5μg,更优选为0.5μg~2μg。
-本发明的载体-亲和物质复合体与具有亲和标签的本发明的tim蛋白质的结合-
所述(b)方法中,为了(通过本发明的载体-亲和物质复合体与具有亲和标签的本发明的tim蛋白质的结合)得到本发明的tim载体,可采用例如以下方法进行。当本发明的载体为珠时,使通常为0.1mg~10mg、优选为0.3mg~5.0mg、更优选为0.5~3.0mg的本发明的载体-亲和物质复合体、与相对于1mg的本发明的载体-亲和物质复合体通常为1.0~50μg、优选为1.0~30μg、更优选为1.0~20μg的具有亲和标签的本发明的tim蛋白质进行接触,当本发明的载体为微孔板时,使每孔中的本发明的载体-亲和物质复合体与通常为1.0~10μg、优选为1.0~5.0μg、更优选为1.0~2.0μg的具有亲和标签的本发明的tim蛋白质进行接触,在通常为4.0℃~37℃、优选为11℃~30℃、更优选为20℃~25℃的温度,进行通常为0.5小时~24小时、优选为0.5小时~8.0小时、更优选为0.5小时~2.0小时的反应,使本发明的载体-亲和物质复合体与具有亲和标签的本发明的tim蛋白质结合,从而得到本发明的tim载体。
需要说明的是,通常,在所述(b)方法中,本发明的载体-亲和物质复合体与具有亲和标签的本发明的tim蛋白质的接触是通过使本发明的载体-亲和物质复合体与含有具有亲和标签的本发明的tim蛋白质的溶液进行接触来进行的。
作为使含有具有亲和标签的本发明的tim蛋白质的溶液,只要是使具有亲和标签的本发明的tim蛋白质在稳定的状态下溶解的溶液即可,可举出例如纯净水、例如在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液(例如,pbs、tbs、hbs等)。另外,作为所述缓冲液中的缓冲剂浓度,通常从5.0~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。
另外,在所述溶液中,只要是在使含有具有亲和标签的本发明的tim蛋白质的溶液与本发明的载体-亲和物质复合体接触后、不会阻碍具有亲和标签的本发明的tim蛋白质与本发明的载体-亲和物质复合体的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、蛋白质等。作为表面活性剂,可举出例如吐温20(tween20)等,使含有具有亲和标签的本发明的tim蛋白质的溶液中的表面活性剂的浓度,通常为0.00001~0.2%,优选为0.0005~0.1%。需要说明的是,有时将在所述溶液中溶解具有亲和标签的本发明的tim蛋白质而成的溶液简记为“含有具有亲和标签的本发明的tim蛋白质的溶液”。
-基于所述(b)方法的本发明的tim载体的具体制备方法-
所述(b)方法中,本发明的tim载体的具体制备方法可以采用例如以下方法进行。
首先,按照所述本发明的tim蛋白质的制备方法,制备具有亲和标签的本发明的tim蛋白质。
然后,当本发明的载体为珠时,使通常为0.1mg~10mg、优选为0.3mg~5.0mg、更优选为0.5~3.0mg的本发明的载体-亲和物质复合体、与通常为50μl~1500μl、优选为100μl~1000μl、更优选为200μl~500μl的、含有相对于1mg的本发明的载体-亲和物质复合体通常为1.0~50μg、优选为1.0~30μg、更优选为1.0~20μg的具有亲和标签的本发明的tim蛋白质的溶液(例如,在纯净水、ph7.0~8.0的缓冲液等中含有具有亲和标签的本发明的tim蛋白质的溶液)进行接触,在通常为4.0℃~37℃、优选为11℃~30℃、更优选为20℃~25℃的温度,进行通常为0.5小时~24小时、优选为0.5小时~8.0小时、更优选为0.5小时~2.0小时的反应,使本发明的载体-亲和物质复合体中的亲和物质、与具有亲和标签的本发明的tim蛋白质中的亲和标签结合,从而得到本发明的tim载体。
当本发明的载体为微孔板时,使每孔的本发明的载体-亲和物质复合体与通常为50μl~300μl、优选为50μl~200μl、更优选为100μl~200μl的、含有1.0~10μg、优选为1.0~5.0μg、更优选为1.0~2.0μg的本发明的具有亲和标签的本发明的tim蛋白质的溶液(例如,在纯净水、或在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液等中含有本发明的tim蛋白质-生物素类复合体的溶液)进行接触,在通常为4.0℃~37℃、优选为11℃~30℃、更优选为20℃~25℃的温度,进行通常为0.5小时~24小时、优选为0.5小时~8.0小时、更优选为0.5小时~2.0小时的反应,使本发明的载体-亲和物质复合体中的亲和物质与具有亲和标签的本发明的tim蛋白质中的亲和标签结合,从而得到本发明的tim载体。
<(c)通过针对本发明的tim蛋白质的抗体与本发明的tim蛋白质的亲和结合进行结合的方法>
首先,按照所述本发明的tim蛋白质的制备方法,制备本发明的tim蛋白质。另一方面,使针对本发明的tim蛋白质的抗体(以下,有时简记为“抗tim抗体”)与本发明的载体结合,使形成本发明的载体-抗tim抗体复合体。使得到的本发明的载体-抗tim抗体复合体与本发明的tim蛋白质接触,使本发明的载体-抗tim抗体复合体中的针对tim蛋白质的抗体与本发明的tim蛋白质结合,从而得到本发明的tim载体。
需要说明的是,上述中,作为本发明的tim蛋白质,使用具有亲和标签的tim蛋白质(具有tim蛋白质的氨基酸序列以及亲和标签的氨基酸序列的蛋白质)时,作为抗tim抗体,可以使用识别tim蛋白质的抗体(基于tim蛋白质的氨基酸序列而识别蛋白质部分的抗体),也可以使用识别亲和标签的抗体(基于亲和标签的氨基酸序列而识别蛋白质部分的抗体)。另外,作为本发明的tim蛋白质,使用不具有亲和标签的tim蛋白质(仅由tim蛋白质的氨基酸序列构成的蛋白质)时,作为抗tim抗体,可以使用识别tim蛋白质的抗体(基于tim蛋白质的氨基酸序列而识别蛋白质部分的抗体)。
-本发明的载体-抗tim抗体复合体(结合有抗体的本发明的载体)-
所述(c)方法中,作为本发明的载体-抗tim抗体复合体,可以使用市售的商品,也可以适当地调整所需试剂类,按照常规方法进行制备。作为本发明的载体-抗tim抗体复合体,可举出例如结合有抗fc标签抗体的珠或微孔板、结合有抗flag标签抗体的珠或微孔板、结合有抗his标签抗体的珠或微孔板、结合有抗gst标签的珠或微孔板、结合有抗mbp标签的珠或微孔板、结合有抗ha标签的珠或微孔板、结合有抗myc标签的珠或微孔板、结合有抗strep(ii)标签的珠或微孔板、结合有针对抗tim蛋白质的抗体的珠或微孔板等,作为市售的商品,可举出抗dykddddk标签抗体磁珠(和光纯药工业(株)制)等。
对所述抗tim抗体的来源没有特别限定。而且,可以是多克隆抗体,也可以是单克隆抗体,但优选单克隆抗体。另外,所述抗tim抗体可以使用市售的抗体,也可以适当地调整所需试剂类,按照常规方法进行制备。抗tim抗体的具体示例如上所述。
对于本发明的载体与抗tim抗体的结合而言,在本发明的载体为珠的情况下,作为针对与本发明的载体1mg接触的本发明的tim蛋白质的抗体的量,在用于本发明的取得方法及本发明的除去方法的情况下,所述量通常为5.0~50μg,优选为10~50μg,更优选为20~50μg。当本发明的载体为微孔板时,每孔通常为0.1μg~10μg,优选为0.2μg~5μg,更优选为0.5μg~2μg。
-本发明的载体-抗tim抗体复合体与本发明的tim蛋白质的结合-
所述(c)方法中,作为通过本发明的载体-抗tim抗体复合体与本发明的tim蛋白质的结合而得到本发明的tim载体的方法,可举出例如以下方法。即,本发明的载体为珠时,使通常为0.1mg~10mg、优选为0.3mg~5.0mg、更优选为0.5~3.0mg的本发明的载体-抗tim抗体复合体、与相对于1mg的本发明的载体-抗tim抗体复合体通常为1.0~50μg、优选为1.0~30μg、更优选为1.0~20μg的本发明的tim蛋白质进行接触,本发明的载体为微孔板时,使每孔的本发明的载体-抗tim抗体复合体与通常为1.0~10μg、优选为1.0~5.0μg、更优选为1.0~2.0μg的本发明的tim蛋白质进行接触,在通常为4.0℃~37℃、优选为11℃~30℃、更优选为20℃~25℃的温度,进行通常为0.5小时~24小时、优选为0.5小时~8.0小时、更优选为0.5小时~2.0小时的反应,使本发明的载体-抗tim抗体复合体中的抗tim抗体与本发明的tim蛋白质结合,从而得到本发明的tim4载体。
需要说明的是,通常,所述(c)的方法中的本发明的载体-抗tim抗体复合体与本发明的tim蛋白质的接触是通过使本发明的载体-抗tim抗体复合体与含有本发明的tim蛋白质的溶液接触而进行的。
作为使含有本发明的tim蛋白质的溶液,只要是使本发明的tim蛋白质在稳定的状态下溶解的溶液即可,可举出例如纯净水、例如在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液(例如pbs、tbs、hbs等)。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。另外,在所述溶液中,只要是在含有了本发明的tim蛋白质的溶液与本发明的载体-抗tim抗体复合体接触后、不会阻碍本发明的tim蛋白质与本发明的载体-抗tim抗体复合体的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、蛋白质等。作为表面活性剂,可举出例如吐温20(tween20)等,该含有了本发明的tim蛋白质的溶液中的表面活性剂的浓度通常为0.00001~0.2%,优选为0.0005~0.1%。需要说明的是,有时将在所述溶液中溶解本发明的tim蛋白质而成的溶液简记为“含有本发明的tim蛋白质的溶液”。
-利用所述(c)的方法的本发明的tim载体的具体的制备方法-
所述(c)的方法中的本发明的tim载体的具体的制备方法,可以采用例如以下的方法进行。
首先,按照所述本发明的tim蛋白质的制备方法,制备本发明的tim蛋白质。然后,当本发明的载体为珠时,使通常为0.1mg~10mg、优选为0.3mg~5.0mg、更优选为0.5~3.0mg的本发明的载体-抗tim抗体复合体与通常为100~1000μl、优选为200~500μl的、含有相对于1mg的本发明的载体-抗tim抗体复合体通常为1.0~50μg、优选为1.0~30μg、更优选为1.0~20μg的本发明的tim蛋白质的溶液(在例如纯净水、例如ph7.0~8.0的缓冲液等中含有本发明的tim蛋白质的溶液)进行接触,在通常为4℃~37℃、优选为11℃~30℃、更优选为20℃~25℃的温度,进行通常为0.5小时~24小时、优选为0.5小时~8.0小时、更优选为0.5小时~2.0小时的反应,通过使本发明的载体-抗tim抗体复合体中的针对本发明的tim蛋白质的抗体与本发明的tim蛋白质结合,从而得到本发明的tim载体。当本发明的载体为微孔板时,使每孔的本发明的载体-抗tim抗体复合体与通常为50μl~300μl、优选为50μl~200μl、更优选为100μl~200μl的、含有1.0~10μg、优选为1.0~5.0μg、更优选为1.0~2.0μg的本发明的tim蛋白质的溶液(在例如纯净水、或者在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液等中含有本发明的tim蛋白质-生物素类复合体的溶液)进行接触,在通常为4.0℃~37℃、优选为11℃~30℃、更优选为20℃~25℃的温度,进行通常为0.5小时~24小时、优选为0.5小时~8.0小时、更优选为0.5小时~2.0小时的反应,使本发明的载体-亲和物质复合体中的亲和物质与具有亲和标签的本发明的tim蛋白质中的亲和标签结合,从而得到本发明的tim载体。
<通过物理吸附进行结合的方法>
作为通过物理吸附而使本发明的tim蛋白质与本发明的载体进行结合的方法,可以根据本身公知的方法,在本发明的tim蛋白质与本发明的载体结合的条件下,使本发明的tim蛋白质与本发明的载体接触。
作为本发明的tim蛋白质与本发明的载体的反应温度,通常为2℃~37℃,优选为4℃~11℃。
作为本发明的tim蛋白质与本发明的载体的反应时间,通常为4小时~48小时,优选为12小时~24小时。
作为本发明的tim蛋白质,当本发明的载体为珠时,与本发明的载体1mg接触的本发明的tim蛋白质的量通常为5.0~50μg,优选为10~50μg,更优选为20~50μg。当本发明的载体为微孔板时,与1个孔接触的本发明的tim蛋白质的量通常为0.1μg~10μg,优选为0.2μg~5μg,更优选为0.5μg~2μg。
需要说明的是,通常,所述本发明的tim蛋白质与本发明的载体的物理吸附是通过使含有本发明的tim蛋白质的溶液与本发明的载体接触而进行的。
作为使含有本发明的tim蛋白质的溶液,只要是使本发明的tim蛋白质在稳定的状态下溶解的溶液即可,可举出例如纯净水、例如在ph6.0~9.5、优选7.0~8.0的条件下具有缓冲作用的缓冲液(例如,mops(3-(n-吗啉代)丙磺酸)等两性离子缓冲液(good's缓冲液)、碳酸缓冲液、pbs、tbs、hbs等)。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~100mm的范围、优选从10~50mm的范围中适当地选择,添加nacl时的浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。另外,在所述溶液中,只要是在含有本发明的tim蛋白质的溶液与本发明的载体接触后、不会阻碍本发明的载体与细胞外膜囊泡或病毒的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、蛋白质等。需要说明的是,有时将在所述溶液中溶解本发明的tim蛋白质而成的溶液简记为“含有本发明的tim蛋白质的溶液”。
在本发明的tim蛋白质与本发明的载体的结合方法中,作为通过物理吸附进行结合的方法的具体示例,可举出例如以下方法。
首先,按照所述本发明的tim蛋白质的制备方法,制备本发明的tim蛋白质。然后,当本发明的载体为珠时,使通常为50μl~300μl、优选为50μl~200μl、更优选为50μl~100μl的、含有通常为5.0~50μg、优选为10~50μg、更优选为20~50μg的tim蛋白质的溶液(在例如纯净水、例如ph7.0~8.0的缓冲液等中含有本发明的tim蛋白质的溶液)接触本发明的载体1mg,或者,当本发明的载体为微孔板时,使通常为50μl~300μl、优选为50μl~200μl、更优选为50μl~100μl的、含有通常为0.1μg~10μg、优选为0.2μg~5μg、更优选为0.5μg~2μg的tim蛋白质的溶液(在例如纯净水、例如ph7.0~8.0的缓冲液等中含有本发明的tim蛋白质的溶液)与1个孔接触,在通常为2℃~37℃、优选为4℃~11℃的温度,进行通常为4小时~48小时、优选为12小时~24小时的反应,使本发明的载体与本发明的tim蛋白质结合,从而得到本发明的tim载体。
<本发明的tim载体的处理>
可以对以所述方式得到的本发明的tim载体实施通常在该领域中进行的封闭处理。
根据需要,可以对以所述方式得到的本发明的tim载体实施通常在该领域中进行的纯化处理。作为纯化处理,只要能够除去附着于载体表面的杂质即可,例如,可举出使用洗涤溶液对本发明的tim载体进行洗涤的方法(以下,有时简记为“洗涤操作”)。
作为本发明的载体,举出使用磁性粒子的情况为例进行说明。
首先,将装有含有以所述方式得到的本发明的tim载体的溶液的容器设置于磁力架,使用磁力使本发明的tim载体集合于管壁,丢弃所述容器内的溶液。然后,在容器内添加洗涤溶液,进行搅拌。然后,与前述同样地将所述容器设置于磁力架,使用磁力使本发明的tim载体集合于管壁,丢弃所述容器内的溶液。根据需要,可以反复进行多次所述洗涤操作。作为在该洗涤操作中使用的洗涤溶液,只要是不会对本发明的tim载体中的本发明的tim蛋白质与本发明的载体的结合产生影响的溶液即可,例如纯净水、例如在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液(例如pbs、tbs、hbs等)。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。所述溶液中,只要是不会阻碍本发明的tim蛋白质与本发明的载体的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、蛋白质等。
作为表面活性剂,可举出例如吐温20(tween20)等,该洗涤溶液中的表面活性剂的浓度通常为0.00001~0.2%,优选为0.0005~0.1%。
如果使用本发明的tim载体,则能够有效地取得细胞外膜囊泡或病毒,能够高纯度地取得试样中的细胞外膜囊泡或病毒。另外,能够高效地除去试样中的细胞外膜囊泡或病毒。进而,能够高灵敏度地检测试样中的细胞外膜囊泡或病毒。
<6.试样中的细胞外膜囊泡或病毒的取得方法>
本发明的取得细胞外膜囊泡或病毒的方法(以下,有时简记为“本发明的取得方法”)的特征是,包括以下工序。
(1)在钙离子的存在下,使结合于载体的tim蛋白质与试样中的细胞外膜囊泡或病毒形成复合体的工序(以下,有时简记为“复合体形成工序”)
(2)将该复合体与试样分离的工序(以下,有时简记为“复合体分离工序”)
(3)从该复合体中分离细胞外膜囊泡或病毒、从而取得细胞外膜囊泡或病毒的工序(以下,有时简记为“取得工序”)。
<6-1.关于复合体形成工序>
复合体形成工序是在钙离子的存在下,使tim蛋白质及载体与试样中的细胞外膜囊泡或病毒形成复合体的工序。
<本发明的试样>
本发明的试样可以是液体中含有本发明的细胞外膜囊泡或病毒的试样,或者是有可能含有本发明的细胞外膜囊泡或病毒的试样中的任意试样。本发明的试样可以是来自于生物体的试样、使本发明的细胞外膜囊泡或病毒溶解或悬浮于培养基或缓冲液等溶液中而成的试样中的任意试样。作为本发明的试样,具体地,可举出血液、唾液、尿、乳汁、羊水、腹水等体液;细胞培养上清等。
作为该使含有(溶解或悬浮)本发明的细胞外膜囊泡或病毒的溶液,只要是使本发明的细胞外膜囊泡或病毒在稳定的状态下溶解或悬浮、且不会阻碍结合于载体的tim蛋白质与试样中的细胞外膜囊泡或病毒的复合体的结合的溶液即可,可举出例如水、在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液(例如tbs、hbs等)等。需要说明的是,由于磷酸缓冲液与钙结合而生成沉淀,因此不优选。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。
在所述溶液中,只要是不会阻碍结合于载体的tim蛋白质与试样中的细胞外膜囊泡或病毒的复合体的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、蛋白质等。作为表面活性剂,可举出例如吐温20(tween20)等,该使含有本发明的细胞外膜囊泡或病毒的溶液中的表面活性剂的浓度通常为0.00001~0.2%,优选为0.0005~0.1%。
<钙离子浓度/钙离子的来源>
本发明中,使钙离子在使本发明的tim蛋白质与载体及试样中的细胞外膜囊泡或病毒形成复合体时存在。更具体地,在使本发明的tim蛋白质与试样中的细胞外膜囊泡接触时,使钙离子存在。
使本发明的tim蛋白质与本发明的试样中的细胞外膜囊泡或病毒接触时的钙离子浓度通常为0.5~100mm,优选为1.0~10mm,更优选为2.0~5.0mm。需要说明的是,应当注意,在本发明的tim蛋白质与本发明的试样中的细胞外膜囊泡或病毒形成复合体、并截止至实施取得工序为止,也即在截止至实施分离该复合体的工序为止的含有该复合体的溶液中,需要如上所述的浓度的钙离子。
另外,对钙离子的来源没有特别限定,可举出例如氯化钙、氢氧化钙、碳酸氢钙、碘化钙、溴化钙、乙酸钙等,优选氯化钙、碳酸氢钙、碘化钙,更优选氯化钙、碳酸氢钙。
需要说明的是,作为在使本发明的tim蛋白质与试样中的细胞外膜囊泡或病毒接触时使钙离子存在的方法,通常,可以使含有本发明的tim载体的溶液、试样、含有本发明的tim蛋白质的溶液或/和含有本发明的载体的溶液中含有如上述的钙离子,以使在使本发明的tim蛋白质及本发明的载体与试样中的细胞外膜囊泡或病毒接触时的钙离子浓度成为上述范围。另外,可以使用含有了钙离子的溶液,并使该溶液与含有本发明的tim载体的溶液、试样、含有本发明的tim蛋白质的溶液或/和本发明的载体混合,以使在使本发明的tim蛋白质及本发明的载体与试样中的细胞外膜囊泡或病毒接触时的钙离子浓度成为上述范围。
作为使含有钙离子的溶液,与所述使含有(溶解或悬浮)本发明的细胞外膜囊泡或病毒的溶液相同,具体示例等也相同。
<试样的量>
在复合体形成工序中,作为与本发明的tim蛋白质1μg接触的试样的量,通常为0.1~100ml,优选为0.1~10ml,更优选为0.1~1.0ml。
<温度>
在复合体形成工序中,作为使本发明的tim蛋白质与试样中的细胞外膜囊泡或病毒接触时的温度,通常为4~37℃,优选为4~25℃,更优选为4~11℃。
<时间>
在复合体形成工序中,作为本发明的tim蛋白质与试样的接触时间,通常为0.5~24小时,优选为0.5~8小时,更优选为0.5~4小时。
复合体形成工序分为以下两个情况:(1-a)使用预先制备的本发明的tim载体的情况(即,使用结合有本发明的tim蛋白质的载体的情况)、以及(1-b)分别使用本发明的tim蛋白质与本发明的载体的情况。
<关于(1-a)>
(1-a)是在钙离子的存在下,使本发明的tim载体与试样中的细胞外膜囊泡或病毒接触、从而使结合于本发明的载体的tim蛋白质与试样中的细胞外膜囊泡或病毒的复合体(以下,有时简记为“本发明的复合体”)形成的方法。(1-a)中,可以在使本发明的tim载体与试样中的细胞外膜囊泡或病毒接触时使钙离子存在。具体地,可以使用使钙离子包含于含有结合有本发明的tim蛋白质的载体的溶液或/和试样中而成的溶液或/和试样,也可以使用含有结合有本发明的tim蛋白质的载体的溶液、试样以及含有钙离子的溶液。
-本发明的试样的量-
(1-a)中,作为与本发明的tim载体1mg接触的试样的量,通常为0.1~100ml,优选为0.1~10ml,更优选为0.1~1.0ml。
-接触温度-
(1-a)中,作为使本发明的tim载体与试样接触时的温度,通常为4.0~37℃,优选为4.0~25℃,更优选为4.0~11℃。
-接触时间-
(1-a)中,作为本发明的tim载体与试样(细胞外膜囊泡或病毒)的接触时间,通常为0.5~24小时,优选为0.5~8.0小时,更优选为0.5~4.0小时。
-本发明的tim载体的量-
(1-a)中,作为本发明的tim载体的量,相对于使本发明的复合体形成时的溶液1ml,通常为0.1~20mg,优选为0.3~10mg,更优选为0.5~6.0mg。
-1-a的具体例-
(1-a)可以通过例如以下方法进行。即,使相对于1ml的混合了本发明的tim载体、试样及含有钙离子的溶液后的溶液(使本发明的复合体形成时的溶液)通常为0.1~20mg、优选为0.3~10mg、更优选为0.5~6.0mg的本发明的tim载体、含有使本发明的复合体形成时的溶液中的钙离子浓度成为通常0.5~100mm、优选1.0~10mm、更优选2.0~5.0mm的量的钙离子的溶液、以及相对于1mg的本发明的tim载体通常为0.1~100ml、优选为0.1~10ml、更优选为0.1~1.0ml的试样,在通常为4.0~37℃、优选为4.0~25℃、更优选为4.0℃~11℃的温度,接触通常0.5~24小时、优选0.5~8.0小时、更优选0.5~4.0小时,使结合于本发明的载体的tim蛋白质与试样中的细胞外膜囊泡或病毒的复合体形成。
<关于(1-b)>
(1-b)是分别地使用本发明的tim蛋白质与本发明的载体的方法。例如,利用亲和结合使本发明的tim蛋白质与本发明的载体结合时,可以如以下(1-b-i)、(1-b-ii)、或(1-b-iii)所示地进行。
(1-b-i)在钙离子的存在下,使本发明的tim蛋白质、本发明的载体以及试样中的细胞外膜囊泡或病毒同时接触,使本发明的复合体形成。
(1-b-ii)在钙离子的存在下,使本发明的tim蛋白质与试样中的细胞外膜囊泡或病毒接触,在使本发明的tim蛋白质与细胞外膜囊泡或病毒的复合体形成后,进而使该复合体与本发明的载体接触,使本发明的复合体形成。
(1-b-iii)在使本发明的载体与试样中的细胞外膜囊泡或病毒接触后,进一步地,使其在钙离子的存在下与本发明的tim蛋白质接触,从而使本发明的复合体形成。
-关于(1-b-i)-
(1-b-i)是在钙离子的存在下使本发明的tim蛋白质与本发明的载体以及试样中的细胞外膜囊泡或病毒同时接触、使由[细胞外膜囊泡或病毒-(本发明的tim蛋白质)-亲和物质-(本发明的载体)]构成的本发明的复合体形成的方法。
具体地,例如,将相互具有亲和性的两种以上的物质用作亲和物质时,在钙离子的存在下,使结合有其中一种亲和物质的本发明的tim蛋白质(亲和物质结合tim蛋白质)与结合有剩余亲和物质的载体(亲和物质结合载体)以及试样中的细胞外膜囊泡或病毒同时接触,使亲和物质结合tim蛋白质中的本发明的tim蛋白质与细胞外膜囊泡或病毒结合,并且使亲和物质结合tim蛋白质中的亲和物质与亲和物质结合载体中的亲和物质结合,从而使由[试样中的细胞外膜囊泡或病毒-(本发明的tim蛋白质)-亲和物质-(本发明的载体)]构成的本发明的复合体形成。
(1-b-i)中,可以在使本发明的tim蛋白质与本发明的载体以及试样中的细胞外膜囊泡或病毒同时接触时使钙离子存在。具体地,可以使用使钙离子包含于含有本发明的tim蛋白质的溶液、含有本发明的载体的溶液、以及试样中的至少一种以上中而成的溶液或试样,也可以通过将含有本发明的tim蛋白质的溶液、含有本发明的载体的溶液、试样以及含有钙离子的溶液接触来进行。
-本发明的试样的量-
(1-b-i)中,作为与本发明的tim蛋白质1μg接触的试样的量,通常为0.1~100ml,优选为0.1~10ml,更优选为0.1~1.0ml。
-本发明的tim蛋白质的量-
(1-b-i)中,作为本发明的tim蛋白质的量,相对于使本发明的复合体形成时的溶液1ml,通常为0.01~200μg,优选为0.15~50μg,更优选为0.5~24μg。
-本发明的载体的量-
在(1-b-i)中,作为本发明的载体的量,相对于使本发明的复合体形成时的溶液1ml,通常为0.1~20mg,优选为0.3~10mg,更优选为0.5~6.0mg。
-接触温度-
在(1-b-i)中,作为使本发明的tim蛋白质与本发明的载体以及试样中的细胞外膜囊泡或病毒接触时的温度,通常为4~37℃,优选为4~25℃,更优选为4~11℃。
-接触时间-
作为本发明的tim蛋白质与本发明的载体以及试样中的细胞外膜囊泡或病毒的接触时间,通常为0.5~24小时,优选为0.5~8小时,更优选为0.5~4小时。
需要说明的是,本发明的tim蛋白质与本发明的载体以及试样中的细胞外膜囊泡或病毒的接触,通常是通过将含有本发明的tim蛋白质的溶液、本发明的载体、试样中的细胞外膜囊泡或病毒、以及含有钙离子的溶液接触而进行的。
作为使含有本发明的tim蛋白质的溶液,只要是使本发明的tim蛋白质在稳定的状态下溶解、且不会阻碍本发明的tim蛋白质与本发明的载体以及细胞外膜囊泡或病毒的结合的溶液即可,可举出例如纯净水、例如在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液(例如pbs、tbs、hbs等)。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。在所述溶液中,只要是使本发明的tim蛋白质在稳定的状态下溶解、且不会阻碍本发明的tim蛋白质与本发明的载体以及细胞外膜囊泡或病毒的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、蛋白质等。作为表面活性剂,可举出例如吐温20(tween20)等,该使含有本发明的tim蛋白质的溶液中的表面活性剂的浓度通常为0.00001~0.2%,优选为0.0005~0.1%。
作为使含有钙离子的溶液,与所述使含有(溶解或悬浮)本发明的细胞外膜囊泡或病毒的溶液相同,具体示例等也相同。
作为含有了钙离子的溶液,是在使含有钙离子的溶液中,含有使本发明的复合体形成时的溶液中的钙离子浓度成为通常0.5~100mm、优选1~10mm、更优选2~5mm的量的钙离子的溶液。
-(1-b-i)的具体示例-
(1-b-i)可通过例如以下方法进行。即,使通常为0.5μl~1ml、优选为0.5μl~100μl、更优选为0.5μl~10μl的、含有相对于使本发明的复合体形成时的溶液1ml通常为0.01~200μg、优选为0.15~50μg、更优选为0.5~24μg的本发明的tim蛋白质的溶液(使本发明的tim蛋白质包含于例如纯净水、例如在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液中而成的溶液);相对于1μg的本发明的tim蛋白质通常为0.1~100ml、优选为0.1~10ml、更优选为0.1~1ml的试样;含有使本发明的复合体形成时的溶液中的钙离子浓度成为通常0.5~100mm、优选1~10mm、更优选2~5mm的量的钙离子的溶液;以及相对于混合了含有本发明的tim蛋白质的溶液、试样、含有钙离子的溶液以及本发明的载体后的溶液(使本发明的复合体形成时的溶液)1ml通常为0.1~20mg、优选为0.3~10mg、更优选为0.5~6mg的本发明的载体接触通常0.5~24小时、优选0.5~8小时、更优选0.5~4小时,使本发明的复合体形成。
-关于(1-b-ii)-
(1-b-ii)是在钙离子的存在下使本发明的tim蛋白质与试样中的细胞外膜囊泡或病毒接触、在使本发明的tim蛋白质与细胞外膜囊泡或病毒的复合体形成后、进而使该复合体与本发明的载体接触、从而使由[细胞外膜囊泡或病毒-(本发明的tim蛋白质)-亲和物质-(本发明的载体)]构成的复合体形成的方法。
具体地,例如,将相互具有亲和性的两种以上的物质用作亲和物质时,在钙离子的存在下,使结合有其中一种亲和物质的tim蛋白质(亲和物质结合tim蛋白质)与试样中的细胞外膜囊泡或病毒接触,使亲和物质结合tim蛋白质中的tim蛋白质与细胞外膜囊泡结合,从而使[细胞外膜囊泡或病毒-(本发明的tim蛋白质-亲和物质)]复合体形成。然后,使[细胞外膜囊泡-(本发明的tim蛋白质-亲和物质)]复合体与结合有另外的亲和物质的载体(亲和物质结合载体)接触,使[细胞外膜囊泡或病毒-(本发明的tim蛋白质-亲和物质)]复合体中的亲和物质与亲和物质结合载体中的亲和物质结合,由此,使[细胞外膜囊泡或病毒-(本发明的tim蛋白质-亲和物质)-(亲和物质-本发明的载体)]复合体形成。
另外,例如,将对亲和标签具有亲和性的物质、抗tim抗体用作亲和物质时,在钙离子的存在下,使本发明的tim蛋白质与试样中的细胞外膜囊泡或病毒接触,使本发明的tim蛋白质与细胞外膜囊泡或病毒结合,从而使[细胞外膜囊泡或病毒-本发明的tim蛋白质]复合体形成。然后,使[细胞外膜囊泡或病毒-本发明的tim蛋白质]复合体与结合有亲和物质的载体(亲和物质结合载体)接触,使[细胞外膜囊泡或病毒-本发明的tim蛋白质]复合体中的本发明的tim蛋白质与亲和物质结合载体中的亲和物质结合,从而使[细胞外膜囊泡或病毒-本发明的tim蛋白质-(亲和物质-本发明的载体)]复合体形成。
在(1-b-ii)中,可以在使本发明的tim蛋白质与试样中的细胞外膜囊泡或病毒接触时使钙离子存在。具体地,可以使用使钙离子包含于含有本发明的tim蛋白质的溶液或/和试样中而成的溶液或/和试样,也可以使用含有本发明的tim蛋白质的溶液、试样以及含有钙离子的溶液。
-本发明的试样的量-
在(1-b-ii)中,作为与本发明的tim蛋白质1μg接触的试样的量,通常为0.1~100ml,优选为0.1~10ml,更优选0.1~1.0ml。
-本发明的tim蛋白质的量-
在(1-b-ii)中,作为本发明的tim蛋白质的量,相对于使本发明的复合体形成时的溶液1ml,通常为0.01~200μg,优选为0.15~50μg,更优选为0.5~24μg。
-本发明的载体的量-
在(1-b-ii)中,作为本发明的载体的量,相对于使本发明的复合体形成时的溶液1ml,通常为0.1~20mg,优选为0.3~10mg、更优选为0.5~6mg。
-接触温度-
在(1-b-ii)中,作为使本发明的tim蛋白质与试样中的细胞外膜囊泡或病毒接触时的温度,通常为4~37℃,优选为4~25℃,更优选为4~11℃。
在(1-b-ii)中,作为在使本发明的tim蛋白质与细胞外膜囊泡或病毒的复合体形成后、进而使该复合体与本发明的载体接触时的温度,通常为4~37℃,优选为4~25℃,更优选为4~11℃。
-接触时间-
(1-b-ii)中,作为本发明的tim蛋白质与本发明的载体以及本发明的试样中的细胞外膜囊泡或病毒的接触时间,通常为0.5~24小时,优选为0.5~8小时,更优选为0.5~4小时。
(1-b-ii)中,作为在使本发明的tim蛋白质与细胞外膜囊泡或病毒的复合体形成后、进一步使该复合体与本发明的载体接触的时间,通常为0.5~24小时,优选为0.5~8小时,更优选为0.5~4小时。
需要说明的是,通常,本发明的tim蛋白质与试样中的细胞外膜囊泡或病毒的接触,是通过将含有本发明的tim蛋白质的溶液与试样以及含有钙离子的溶液接触而进行的。
作为使含有本发明的tim蛋白质的溶液,只要是使本发明的tim蛋白质在稳定的状态下溶解、且不会阻碍本发明的tim蛋白质与本发明的载体以及本发明的细胞外膜囊泡或病毒的结合的溶液即可,可举出例如纯净水、例如在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液(例如,tbs、hbs等)。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。在所述溶液中,只要是使本发明的tim蛋白质在稳定的状态下溶解、且不会阻碍本发明的tim蛋白质与本发明的载体以及细胞外膜囊泡或病毒的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、蛋白质等。作为表面活性剂,可举出例如吐温20(tween20)等,该使含有本发明的tim蛋白质的溶液中的表面活性剂的浓度通常为0.00001~0.2%,通常优选为0.0005~0.1%。
作为使含有钙离子的溶液,与所述的使含有(溶解或悬浮)本发明的细胞外膜囊泡或病毒的溶液相同,具体示例等也相同。
作为含有钙离子的溶液,是在使含有钙离子的溶液中,含有使本发明的复合体形成时的溶液中的钙离子的浓度成为通常0.5~100mm、优选1~10mm、更优选2~5mm的量的钙离子的溶液。
-(1-b-ii)的具体示例-
对(1-b-ii)而言,例如,其可采用以下方法进行。即,使通常为0.5μl~1ml、优选为0.5μl~100μl、更优选为0.5μl~10μl的、含有相对于使本发明的复合体形成时的溶液1ml通常为0.01~200μg、优选为0.15~50μg、更优选为0.5~24μg的本发明的tim蛋白质的溶液(在例如纯净水、例如在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液中含有本发明的tim蛋白质的溶液);相对于1μg的本发明的tim蛋白质通常为0.1~100ml、优选为0.1~10ml、更优选为0.1~1ml的试样;以及含有钙离子的溶液,在通常为4~37℃、优选为4~25℃、更优选为4~11℃的温度,接触通常0.5~24小时、优选0.5~8小时、更优选0.5~4小时,所述含有钙离子的溶液中的钙离子的量是使在混合了含有试样与钙离子的溶液和含有本发明的tim蛋白质的溶液而成的溶液中、以及进一步使该溶液与本发明的载体接触后的溶液中的钙离子的浓度成为通常0.5~100mm、优选1~10mm、更优选2~5mm的量,在使本发明的tim蛋白质与细胞外膜囊泡或病毒的复合体形成后,进而加入相对于使本发明的复合体形成时的溶液1ml通常为0.1~20mg、优选为0.3~10mg、更优选为0.5~6mg的本发明的载体,在通常为4~37℃、优选为4~25℃、更优选为4~11℃的温度,使得到的本发明的tim蛋白质与细胞外膜囊泡或病毒的复合体、与本发明的载体接触通常0.5~24小时、优选0.5~8小时、更优选0.5~4小时,使本发明的复合体形成。
-关于(1-b-iii)-
(1-b-iii)是使本发明的载体与试样中的细胞外膜囊泡或病毒接触后、进而在钙离子的存在下使本发明的tim蛋白质与其接触、从而使由[细胞外膜囊泡或病毒-(本发明的tim蛋白质)-亲和物质-(本发明的载体)]构成的本发明的复合体形成的方法。
具体而言,例如,将相互具有亲和性的两种以上的物质用作亲和物质时,使结合有其中一种亲和物质的载体(亲和物质结合载体)与试样中的细胞外膜囊泡或病毒接触,接着,在钙离子的存在下,使其与结合有另外的亲和物质的tim蛋白质(亲和物质结合tim蛋白质)同时接触,使亲和物质结合tim蛋白质中的tim蛋白质与细胞外膜囊泡或病毒结合,并且使亲和物质结合tim蛋白质中的亲和物质与亲和物质结合载体中的亲和物质结合,从而使[细胞外膜囊泡或病毒-(本发明的tim蛋白质-亲和物质)-(亲和物质-本发明的载体)]复合体形成。
另外,例如,将对亲和标签具有亲和性的物质、抗tim抗体作为亲和物质时,使结合有亲和物质的载体(亲和物质结合载体)与试样中的细胞外膜囊泡或病毒接触,然后,在钙离子的存在下,使其与本发明的tim蛋白质同时接触,使本发明的tim蛋白质与细胞外膜囊泡或病毒结合,并且使本发明的tim蛋白质与亲和物质结合载体中的亲和物质结合,从而使[细胞外膜囊泡或病毒-本发明的tim蛋白质-(亲和物质-本发明的载体)]复合体形成。
(1-b-iii)中,可以在使本发明的tim蛋白质与试样中的细胞外膜囊泡或病毒接触时使钙离子存在。具体地,可以使用使钙离子包含于含有本发明的tim蛋白质的溶液、或/和试样中的细胞外膜囊泡或病毒中而成的溶液或/和试样,也可以使用含有本发明的tim4蛋白质的溶液、试样中的细胞外膜囊泡或病毒、以及含有钙离子的溶液。
-本发明的试样的量-
在(1-b-iii)中,对于与本发明的tim蛋白质1μg接触的试样的量而言,通常为0.1~100ml,优选为0.1~10ml,更优选为0.1~1ml。
-本发明的tim蛋白质的量-
在(1-b-iii)中,作为本发明的tim蛋白质的量,相对于使本发明的复合体形成时的溶液1ml,通常为0.01~200μg,优选为0.15~50μg,更优选为0.5~24μg。
-本发明的载体的量-
在(1-b-iii)中,作为本发明的载体的量,相对于使本发明的复合体形成时的溶液1ml,通常为0.1~20mg,优选为0.3~10mg,更优选为0.5~6mg。
-接触温度-
在(1-b-iii)中,作为使本发明的载体与试样中的细胞外膜囊泡或病毒接触时的温度,通常为4~37℃,优选为4~25℃,更优选为4~11℃。
在(1-b-iii)中,作为在使本发明的载体与试样中的细胞外膜囊泡或病毒接触后、进而使本发明的tim蛋白质与其接触时的温度,通常为4~37℃,优选为4~25℃,更优选为4~11℃。
-接触时间-
在(1-b-iii)中,作为使本发明的载体与试样接触时的接触时间,通常为0.5~24小时,优选为0.5~8小时,更优选为0.5~4小时。
在(1-b-iii)中,作为在使本发明的载体与试样中的细胞外膜囊泡或病毒接触后、进而使本发明的tim蛋白质与其接触时的接触时间,通常为0.5~24小时,优选为0.5~8小时,更优选为0.5~4小时。
需要说明的是,通常,在使本发明的载体与试样中的细胞外膜囊泡或病毒接触后、进而与本发明的tim蛋白质的接触,是使用含有本发明的tim蛋白质的溶液以及含有钙离子的溶液来进行的。
作为使含有本发明的tim蛋白质的溶液,只要是使本发明的tim蛋白质在稳定的状态下溶解、且不会阻碍本发明的tim蛋白质与本发明的载体以及细胞外膜囊泡或病毒的结合的溶液即可,可举出例如纯净水、例如在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液(例如pbs、tbs、hbs等)。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。在所述溶液中,只要是使本发明的tim4蛋白质在稳定的状态下溶解、且不会阻碍本发明的tim蛋白质与本发明的载体以及细胞外膜囊泡或病毒的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、蛋白质等。作为表面活性剂,可举出例如吐温20(tween20)等,作为该使含有本发明的tim蛋白质的溶液中的表面活性剂的浓度,通常为0.00001~0.2%,优选为0.0005~0.1%。
作为使含有钙离子的溶液,与所述的使含有(溶解或悬浮)本发明的细胞外膜囊泡或病毒的溶液相同,具体示例等也相同。
作为含有钙离子的溶液,是在使含有钙离子的溶液中,含有使本发明的复合体形成时的溶液中的钙离子浓度成为通常0.5~100mm、优选1~10mm、更优选2~5mm的量的钙离子的溶液。
-(1-b-iii)的具体例-
(1-b-iii)可以通过例如以下方法进行。即,使相对于1μg的本发明的tim蛋白质通常为0.1~100ml、优选0.1~10ml、更优选0.1~1ml的本发明的试样、与相对于使本发明的复合体形成时溶液1ml通常为0.1~20mg、优选为0.3~10mg、更优选为0.5~6mg的本发明的载体在通常4~37℃、优选4~25℃、更优选4~11℃的温度接触通常0.5~24小时、优选0.5~8小时、更优选0.5~4小时,然后,加入含有钙离子的溶液、以及相对于使本发明的复合体形成时溶液1ml通常为0.5μl~1ml、优选为0.5μl~100μl、更优选为0.5μl~10μl的、含有通常为0.01~200μg、优选为0.15~50μg、更优选为0.5~24μg的本发明的tim蛋白质的溶液(在例如纯净水、例如在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液中含有本发明的tim蛋白质的溶液),在通常为4~37℃、优选为4~25℃、更优选为4~11℃的温度接触通常0.5~24小时、优选0.5~8小时、更优选0.5~4小时,使本发明的复合体形成,所述含有钙离子的溶液中的钙离子的量是,使含有本发明的试样和钙离子的溶液与本发明的载体接触、进而使其与含有本发明的tim蛋白质的溶液接触而成的溶液中的钙离子的浓度成为通常0.5~100mm、优选1.0~10mm、更优选2~5mm的量。
<6-2.复合体分离工序>
本发明的取得方法中的复合体分离工序是,在复合体形成工序后,将得到的结合于本发明的载体的tim蛋白质(本发明的tim载体)与试样中的细胞外膜囊泡或病毒的复合体(本发明的复合体)、与试样进行分离,取得分离的本发明的复合体的工序。
对于本发明的取得方法中的复合体分离工序而言,只要能够将本发明的复合体与试样分离并取得本发明的复合体,就可以使用任意方法,例如,可举出如下方法。
(1)将磁性载体用作本发明的载体时,根据需要将进行了复合体形成工序的容器设置于磁力架,通过用磁力使本发明的复合体集合于管壁、除去上清的试样、从而将它们分离的方法。
(2)当本发明的载体为珠状时,通过对进行了复合体形成工序的容器进行离心分离处理,使本发明的复合体作为沉淀集合后,除去上清的试样,从而将它们分离的方法。
(3)当本发明的载体使用非珠状的板等时,通过仅除去试样而将它们分离的方法。
(4)通过过滤而将本发明的复合体与试样分离的方法。
在以此方式将本发明的复合体与试样分离后,可以通过本身公知的方法取得(回收)分离的本发明的复合体。
-复合体分离工序的具体示例-
将磁性载体用作本发明的载体时,根据需要将进行了复合体形成工序的容器设置于磁力架,用磁力使本发明的复合体集合于管壁,除去上清的试样。
<6-3.洗涤操作>
在复合体形成工序、复合体分离工序后,根据需要,可以使用含有钙离子的洗涤溶液对得到的本发明的复合体进行洗涤(以下,有时简记为“洗涤操作”)。通过洗涤操作,能够除去附着于本发明的载体表面的来自于细胞的成分等的本发明的试样中的夹杂物。作为洗涤方法,除了使用如上述的含钙离子的洗涤液以外,还能够使用通常在该领域中进行的洗涤方法。作为在该洗涤操作中使用的含有钙离子的洗涤溶液,只要是含有通常为0.5~100mm、优选为1~10mm、更优选为2~5mm的钙离子、且不会对该复合体中的本发明的细胞外膜囊泡或病毒与本发明的tim4蛋白质及本发明的载体的结合产生影响的溶液即可,例如,可举出含有通常为0.5~100mm、优选为1~10mm、更优选为2~5mm的钙离子、在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用且不会使钙沉淀的缓冲液(例如tbs、hbs)。需要说明的是,由于磷酸缓冲液与钙结合而生成沉淀,因此不优选。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。在所述溶液中,只要是不会阻碍该复合体中的本发明的细胞外膜囊泡或病毒与本发明的tim蛋白质及本发明的载体的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、蛋白质等。作为表面活性剂,可举出例如吐温20(tween20)(和光纯药工业(株)制)等,该洗涤溶液中的表面活性剂的浓度通常为0.00001~0.2%、优选为0.0005~0.1%。
例如,举出使用磁性粒子作为本发明的载体的情况为例进行说明。首先,在含有通过复合体分离工序而得到的本发明的复合体的容器内加入含有钙离子的洗涤溶液,进行搅拌。然后,将所述容器设置于磁力架,使用磁力使该复合体集合于管壁,丢弃所述容器内的溶液。所述洗涤操作可以根据需要反复进行多次。
-洗涤操作的具体示例-
首先,在含有通过复合体分离工序而得到的本发明的复合体的容器内加入含有钙离子的洗涤溶液(例如,含有通常为0.5~100mm、优选为1~10mm、更优选为2~5mm的钙离子、在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用且不会使钙沉淀的缓冲液。但是,由于磷酸缓冲液与钙结合而生成沉淀,因此,不优选。),进行搅拌。然后,将所述容器设置于磁力架,使用磁力使该复合体集合于管壁,丢弃所述容器内的溶液。所述洗涤操作可以根据需要而反复进行多次。
<6-4.关于取得工序>
取得工序是在进行了复合体形成工序、复合体分离工序、根据需要的洗涤工序(洗涤操作)之后、从得到的结合于本发明的载体的tim蛋白质与试样中的细胞外膜囊泡或病毒的复合体分离细胞外膜囊泡或病毒、从而取得本发明的细胞外膜囊泡或病毒的工序。
由此,能够高纯度地取得本发明的细胞外膜囊泡或病毒。
作为取得工序的具体示例,可举出例如以下(2-a)及(2-b)。
(2-a)使用蛋白质改性剂的方法
(2-b)使钙离子浓度降低的方法
<(2-a):使用蛋白质改性剂的方法>
(2-a)是在进行了复合体形成工序、复合体分离工序后以及根据需要的洗涤操作之后,使蛋白质改性剂作用于得到的本发明的复合体从而使本发明的复合体中的本发明的tim蛋白质改性、从而从本发明的复合体分离细胞外膜囊泡或病毒的方法。由此,能够高纯度地取得本发明的细胞外膜囊泡或病毒。
-蛋白质改性剂-
作为(2-a)中使用的蛋白质改性剂,只要是在该领域中通常用作使蛋白质改性的化合物,就可以使用任意物质,例如,可举出sds(十二烷基硫酸钠)、n-月桂酰肌氨酸等阴离子型表面活性剂;chaps(3-(3-胆酰胺丙基)二甲氨基-1-丙磺酸盐)、zwittergent3-12(n-十二烷基-n,n-二甲基-3-铵基-1-丙磺酸盐)等两性离子型表面活性剂;brij35(宝生物工程有限公司(タカラバイオ(株))制)、n-十二烷基-β-d-麦芽糖苷(dodecyl-β-d-maltoside)、乙基苯基聚乙二醇(nonidetp-40)、辛基-β-d-葡萄糖苷(octyl-β-d-glucoside)、tritonx-100(聚氧乙烯(10)辛基苯基醚)、吐温20(tween20)(聚氧乙烯(20)脱水山梨糖醇单月桂酸酯)等非离子型表面活性剂;尿素、甲酰胺、胍等离液剂等,优选阴离子型表面活性剂,特别优选sds。
在(2-a)中,为了使所述蛋白质改性剂作用于本发明的复合体,通常,通过使含有蛋白质改性剂的溶液(以下,有时也简记为“含蛋白质改性剂的溶液”)、和结合于本发明的载体的tim蛋白质与试样中的细胞外膜囊泡或病毒的复合体接触,使含蛋白质改性剂的溶液作用于本发明的复合体来进行。
需要说明的是,含蛋白质改性剂的溶液与本发明的复合体的接触能够通过例如使该复合体悬浮于溶液中的方法(载体为珠的情况等)、使该复合体浸渍于该溶液中的方法(载体为盘状片、管的情况等)、在该溶液中添加该复合体(载体)的方法(载体为微孔板、管的情况等)等来进行。
-使含有蛋白质改性剂的溶液-
在(2-a)中,作为使含有蛋白质改性剂的溶液,可举出纯净水、能够使蛋白质改性剂溶解的缓冲液等。作为该缓冲液,可举出在通常ph6~9、优选7~8的条件下具有缓冲作用的缓冲液(例如tris(三羟甲基氨基甲烷)、hepes等)。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~100mm的范围、优选从10~50mm的范围中适当地选择。
-含有蛋白质改性剂的溶液-
在(2-a)中,含有蛋白质改性剂的溶液的ph通常为6.0~9.0、优选为7.0~8.0。作为含有蛋白质改性剂的溶液中的蛋白质改性剂的浓度,根据蛋白质改性剂的种类而不同,但是,只要是通常在该领域中使用的浓度范围即可,例如,在sds的情况下,通常为0.1~10%,优选为0.3~4%,更优选为0.5~2%。另外,含有蛋白质改性剂的溶液可以含有例如糖类、nacl等盐类、防腐剂、蛋白质等。在(2-a)中,对于含有蛋白质改性剂的溶液而言,相对于本发明的tim载体1mg,通常使用10μl~500μl,优选使用20μl~200μl,更优选使用50μl~100μl。
-作用(接触)条件-
在(2-a)中,作为使蛋白质改性剂作用(接触)于复合体的温度、时间,温度通常为4.0~37℃,优选为10~30℃,更优选为20~30℃,时间通常为5.0~60秒,优选为10~30秒,更优选为10~20秒。
-tim蛋白质-
在使蛋白质改性剂作用(接触)于复合体(即(2-a))的情况下,作为取得细胞外膜囊泡时的本发明的tim蛋白质,只要是所述本发明的tim蛋白质,就能够使用任意蛋白质,但是,优选本发明的tim4蛋白质及本发明的tim1蛋白质,特别优选本发明的tim4蛋白质,另外,在取得病毒的情况下,特别优选本发明的tim4蛋白质及本发明的tim3蛋白质。
-(2-a)的具体示例-
(2-a)可以通过例如以下方法进行。即,在进行了复合体形成工序、复合体分离工序、根据需要的洗涤操作之后,在得到的本发明的复合体中,添加相对于本发明的tim载体1mg通常为10μl~500μl、优选为20μl~200μl、更优选为50μl~100μl的、含有通常为0.1~10%、优选为0.3~4.0%、更优选为0.5~2.0%的蛋白质改性剂的溶液(在纯净水、或在通常ph6~9、优选7~8的条件下具有缓冲作用的缓冲液中含有蛋白质改性剂的溶液),一边使用漩涡混合器等进行搅拌,一边在通常为4~37℃、优选为10~30℃、更优选为20~30℃的温度进行通常为5~60秒、优选为10~30秒、更优选为10~20秒的反应,使本发明的复合体中的本发明的tim蛋白质与蛋白质改性剂接触从而使蛋白质改性剂发挥作用,使细胞外膜囊泡或病毒从本发明的复合体分离。
<(2-b):使钙离子浓度降低的方法>
(2-b)是在进行了复合体形成工序、复合体分离工序、根据需要的洗涤操作之后,使与得到的本发明的复合体结合的钙离子以及含有复合体的溶液中的钙离子的浓度降低,从而使本发明的细胞外膜囊泡或病毒从本发明的复合体分离的方法。
由此,能够高纯度地且在完整的状态下取得本发明的细胞外膜囊泡或病毒。
另外,已知钙离子介于tim蛋白质与磷脂酰丝氨酸的结合中(immunity2007december;27(6):941-951)。在进行了复合体形成工序、复合体分离工序、根据需要的洗涤操作后,对于得到的本发明的复合体而言,为了保持本发明的复合体中的本发明的tim蛋白质与试样中的细胞外膜囊泡或病毒的结合,必须预先使钙离子共存。例如,在使本发明的复合体在溶液中共存的情况下,需要本发明的复合体的溶液中具有0.5mm以上的钙离子。其中,使本发明的复合体在溶液中共存时,也包括进行了复合体形成工序、复合体分离工序、根据需要的洗涤操作后的颗粒状态的载体。
需要说明的是,即使进行复合体形成工序、复合体分离工序、根据需要的洗涤操作后的本发明的复合体发生干燥,只要不进行取得工序,钙离子就不会从该复合体中溶出,从而本发明的载体与细胞外膜囊泡或病毒的结合得以保持。
(2-b)通过使由结合于本发明的复合体的钙离子带来的钙离子的浓度低于如上所述的为了保持本发明的tim蛋白质与细胞外膜囊泡或病毒的结合所需的浓度(有效浓度),从而能使本发明的细胞外膜囊泡或病毒从本发明的复合体分离。
具体而言,可以将含有本发明的复合体的溶液中的钙离子浓度设为通常小于0.5mm、优选小于0.4mm、更优选小于0.2mm。
作为降低钙离子的(有效)浓度的方法,例如,可举出下述(2-b-i)、(2-b-ii)等。
(2-b-i)使用钙离子螯合剂的方法
(2-b-ii)使用不含有钙离子的溶液的方法
-(2-b-i):使用钙离子螯合剂的方法-
(2-b-i)是在进行了复合体形成工序、复合体分离工序、根据需要的洗涤操作之后,使钙离子螯合剂作用于由含有与得到的本发明的复合体结合的钙离子以及复合体的溶液带入的钙离子,然后,使由含有与本发明的复合体结合的钙离子以及复合体的溶液带入的钙离子的(有效)浓度降低(使钙离子螯合),从而使细胞外膜囊泡或病毒从本发明的复合体分离的方法。
由此,能够高纯度地且在完整的状态取得本发明的细胞外膜囊泡或病毒。
-钙离子螯合剂-
作为钙离子螯合剂,只要是能螯合钙离子的化合物,就可以使用任意化合物,例如,可举出edta(乙二胺四乙酸)、nta(次氮基三乙酸)、dtpa(二乙烯三胺五乙酸)、glda(l-谷氨酸二乙酸)、hedta(羟乙基乙二胺三乙酸)、gedta(乙二醇双(β-氨基乙基醚)-n,n,n,n-四乙酸)、ttha(三亚乙基四胺-n,n,n’,n”,n”’,n”’-六乙酸)、hida(2-羟乙基亚氨基二(乙酸))、dheg(n,n-双(2-羟乙基)甘氨酸)、cydta(反式1,2-环己二胺-n,n,n’,n’-四乙酸单水合物)(trans-1,2-diaminocyclohexane-n,n,n’,n’-tetraaceticacid,monohydrate)等,优选edta、gedta、cydta。为了使所述钙离子螯合剂作用于与本发明的复合体结合的钙离子,通常,通过使含有了钙离子螯合剂的溶液(以下,有时也简记为“含有钙离子螯合剂的溶液”)与颗粒状的本发明的复合体接触、从而使与本发明的复合体结合的钙离子和含有钙离子螯合剂的溶液中的钙离子螯合剂进行反应来进行。
需要说明的是,含有钙离子螯合剂的溶液与本发明的复合体的接触能够通过例如使该复合体悬浮于该溶液中的方法(载体为珠的情况等)、使该复合体浸渍于该溶液中的方法(载体为盘状片、管的情况等)、在该复合体(载体)中添加该溶液的方法(载体为微孔板、管的情况等)等来进行。
-含有钙离子螯合剂的溶液-
在(2-b-i)中,作为使含有钙离子螯合剂的溶液,只要是使钙离子螯合剂溶解的溶液即可,可举出例如纯净水、缓冲液等。作为缓冲液,优选在通常ph为7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液(例如pbs、tbs、hbs等)。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。含有钙离子螯合剂的溶液可以含有例如糖类、nacl等盐类、防腐剂、蛋白质等。
在(2-b-i)中,作为含有钙离子螯合剂的溶液中的钙离子螯合剂的浓度,通常为0.5~500mm,优选为0.5~100mm,更优选为0.5~50mm。
在(2-b-i)中,含有钙离子螯合剂的溶液的ph通常为6.0~9.0,优选为7.0~8.0,更优选为7.2~7.6。
在(2-b-i)中,作为混合于反应溶液中的含有钙离子螯合剂的溶液的量,只要是使反应溶液中的钙离子浓度小于有效浓度、从而使细胞外膜囊泡或病毒从本发明的复合体分离的量即可。
-作用(接触)条件-
在(2-b-i)中,作为使钙离子螯合剂作用(接触)于复合体的温度、时间,温度通常为4.0~37℃,优选为10~30℃,更优选为20~30℃,时间通常为5~60秒,优选为10~30秒,更优选为10~20秒。
-tim载体-
在(2-b-i)中,作为本发明的tim蛋白质与本发明的载体的结合方式,只要本发明的载体与本发明的tim蛋白质结合,对结合方式就没有限定。在使用钙离子螯合剂以使细胞外膜囊泡或病毒溶出的情况下(即(2-b-i)的情况),从能取得大量的细胞外膜囊泡或病毒出发,优选本发明的载体与本发明的tim蛋白质的巯基结合的方式,特别优选本发明的载体与本发明的tim4蛋白质的巯基结合的方式。
-(2-b-i)的具体示例-
(2-b-i)可以通过例如以下方法进行。即,在进行了复合体形成工序、复合体分离工序、根据需要的洗涤操作之后,在得到的本发明的复合体中,添加相对于1mg的本发明的tim载体通常为10~500μl、优选为20~200μl、更优选为50~100μl的、含有通常为0.5~500mm、优选为0.5~100mm、更优选为0.5~50mm的钙离子螯合剂的溶液(在纯净水、或者在通常ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液中含有钙离子螯合剂的溶液),一边使用漩涡混合器等进行搅拌,一边在通常为4.0~37℃、优选为10~30℃、更优选为20~30℃的温度,进行通常为5~60秒、优选为10~30秒、更优选为10~20秒的反应,使细胞外膜囊泡或病毒从本发明的复合体分离。
-(2-b-ii):使用不含钙离子的溶液的方法-
(2-b-ii)是在进行了复合体形成工序、复合体分离工序、根据需要的洗涤操作之后,通过使得到的本发明的复合体与不含钙离子的溶液接触从而使与本发明的复合体结合的钙离子的(有效)浓度降低(稀释),从而使细胞外膜囊泡或病毒从本发明的复合体分离的方法。
即,通过使不含钙离子的溶液与本发明的复合体接触,能使为保持本发明的复合体中的本发明的tim蛋白质与试样中的细胞外膜囊泡或病毒的结合所需的钙离子的(有效)浓度降低(稀释),从而使细胞外膜囊泡从本发明的复合体分离。
需要说明的是,不含钙离子的溶液与本发明的复合体的接触能够通过例如使该复合体悬浮于该溶液中的方法(载体为珠的情况等)、使该复合体浸渍于该溶液中的方法(载体为盘状片、管的情况等)、在该复合体(载体)中添加该溶液的方法(载体为微孔板、管的情况等)等来进行。
-不含钙离子的溶液-
在(2-b-ii)中,作为添加于得到的本发明的复合体中的不含钙离子的溶液,只要是不会使细胞外膜囊泡或病毒改性的溶液即可,可举出例如纯净水、缓冲液等。作为缓冲液,优选在通常ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液(例如pbs、tbs、hbs等)。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。不含钙离子的溶剂可以含有例如糖类、nacl等盐类、防腐剂、蛋白质等。
在(2-b-ii)中,作为添加于得到的本发明的复合体中的不含钙离子的溶液的量,只要是能使钙离子的浓度小于有效浓度的量即可。
-(2-b-ii)的具体示例-
在进行了复合体形成工序、复合体分离工序以及根据需要的洗涤操作之后,在得到的本发明的复合体中,添加不含钙离子的溶液,以使含有本发明的复合体的溶液中的钙离子的浓度成为通常小于0.5mm、优选小于0.1mm、更优选小于0.01mm,由此来进行。
需要说明的是,在进行了复合体形成工序、复合体分离工序以及根据需要的洗涤操作之后,当得到的本发明的复合体存在于含有钙离子的溶液中(例如,进行了复合体形成工序后的反应液、含有钙离子的洗涤液)时,可以将该含有钙离子的溶液置换为不含钙离子的溶液、或/和通过不含钙离子的溶液进行稀释,以使最终钙离子的浓度成为小于上述有效浓度。
对于通过取得工序而得到的含有细胞外膜囊泡的溶液的(体积增加)量而言,(2-b-ii)比(2-b-i)更多,因此更优选(2-b-i)。
在上述中,在与复合体接触/作用了的溶液(含蛋白质改性剂的溶液、含钙离子螯合剂的溶液、不含钙离子的溶液)中,含有载体、以及从载体(复合体)分离(游离)的细胞外膜囊泡或病毒。因此,如果从该溶液中除去载体、仅回收溶液,则能够得到含有细胞外膜囊泡或病毒的溶液。
如果使用本发明的tim载体,则能够从试样中高效地除去细胞外膜囊泡或病毒,从而能够得到夹杂物少的试样。
本发明的除去方法能够精度良好且有效地除去通过超速离心分离法、聚合物沉淀处理等现有方法不能完全除去的试样中的细胞外膜囊泡或病毒。
<7.试样中的细胞外膜囊泡或病毒的除去方法>
本发明的取得细胞外膜囊泡或病毒的方法(以下,有时简记为“本发明的除去方法”)的特征在于,包括以下工序。
(1)在钙离子的存在下,使结合于载体的tim蛋白质与试样中的细胞外膜囊泡或病毒的复合体形成的工序(以下,有时简记为“复合体形成工序”)
(2)将该复合体与试样分离的工序(以下,有时简记为“复合体分离工序”)。
<7-1.复合体形成工序>
本发明的除去方法中的复合体形成工序,与本发明的取得方法中的复合体形成工序相同,各种优选的条件也相同。
<7-2.复合体分离工序>
本发明的除去方法中的复合体分离工序是在进行了复合体形成工序之后,将得到的结合于本发明的载体的tim蛋白质(本发明的tim载体)与试样中的细胞外膜囊泡或病毒的复合体(本发明的复合体)和试样分离并且取得分离的试样的工序。
由此,能够得到除去了细胞外膜囊泡或病毒的试样。
对于本发明的除去方法中的复合体分离工序而言,只要能够从试样中除去本发明的复合体,就可以是任意的方法,可举出与所述本发明的取得方法中的复合体分离工序相同的方法。如此地将本发明的复合体与试样分离后,可以通过本身已知的方法来取得(回收)分离的试样。
由此,能够高精度且有效地除去通过超速离心分离法、聚合物沉淀处理等现有方法不能完全除去的试样中的细胞外膜囊泡或病毒。
另外,通过反复多次进行所述复合体形成工序及复合体分离工序,能够更有效地从试样中除去细胞外膜囊泡或病毒。反复进行所述复合体形成工序及复合体分离工序时,能够使用新的载体,也能够对使用后的载体进行再利用。对载体的再利用而言,可以使用含钙离子螯合剂的溶液或不含钙离子的溶液,对通过本发明的除去方法中的复合体分离工序而除去的本发明的复合体实施与本发明的取得方法的取得工序((2-b)使钙离子浓度降低方法)相同的处理。由此,能够使本发明的tim载体和细胞外膜囊泡或病毒从本发明的复合体分离。即,由于本发明的tim载体能够再度用于本发明的除去方法,因此,通过对该本发明的tim载体进行再利用,能够精度良好且有效地除去试样中的细胞外膜囊泡或病毒。
如果使用本发明的tim载体,则能够以精度良好且高灵敏度的方式检测试样中的细胞外膜囊泡或病毒。
<8.检测试样中的细胞外膜囊泡或病毒的方法>
本发明的检测细胞外膜囊泡或病毒的方法(以下,有时简记为“本发明的检测方法”)的特征是,包括以下工序。
(1)在钙离子的存在下,使结合于载体的tim蛋白质与试样中的细胞外膜囊泡或病毒的复合体形成的工序(复合体形成工序)
(2)检测该复合体的工序(检测工序)
<8-1.复合体形成工序>
本发明的检测方法中的复合体形成工序是在钙离子的存在下,使本发明的tim载体与试样中的细胞外膜囊泡或病毒的复合体形成的工序。
-本发明的试样-
本发明的试样与本发明的取得方法中的试样相同。
-钙离子浓度/钙离子的来源-
在本发明的检测方法中,在使本发明的tim载体与试样中的细胞外膜囊泡或病毒的复合体(本发明的复合体)形成时使钙离子存在。
在本发明的检测方法中,使本发明的tim载体与本发明的试样中的细胞外膜囊泡或病毒接触时的钙离子浓度通常为0.5~100mm,优选为1~10mm,更优选为2~5mm。需要说明的是,应当注意,在本发明的tim载体与本发明的试样中的细胞外膜囊泡或病毒的复合体形成、并截止至实施检测工序为止、即在截止至实施检测该复合体的工序为止的含有该复合体的溶液中,需要如上所述的浓度的钙离子。
另外,对钙离子的来源没有特别限定,可举出与本发明的取得方法中的钙离子的来源相同的具体示例。
需要说明的是,作为在使本发明的tim载体与试样中的细胞外膜囊泡或病毒接触时使钙离子存在的方法,通常,可以使试样中含有如上所述的钙离子,从而使本发明的tim载体与试样中的细胞外膜囊泡或病毒接触时的钙离子浓度成为上述范围。
作为使含有钙离子的溶液,与所述的使含有(溶解或悬浮)本发明的细胞外膜囊泡或病毒的溶液相同,具体示例等也相同。
-试样的量-
在本发明的检测方法的复合体形成工序中,对于试样的量而言,将珠用作本发明的载体时,相对于1mg的本发明的tim载体,通常为0.1~1000ml,优选为0.1~500ml,更优选为0.1~100ml,将微孔板用作本发明的载体时,每孔通常为50μl~300μl,优选为100μl~200μl。
-温度-
在本发明的检测方法的复合体形成工序中,使本发明的tim载体与试样中的细胞外膜囊泡或病毒接触时的温度,通常为2~37℃,优选为2~30℃。
-时间-
在本发明的检测方法的复合体形成工序中,作为本发明的tim蛋白质与试样的接触时间,通常为0.5~24小时,优选为1~20小时,更优选为1~12小时。
-tim蛋白质-
作为本发明的检测方法中的本发明的tim蛋白质,只要是上述本发明的tim蛋白质,就能够使用任意蛋白质,但是,特别优选本发明的tim4蛋白质。
-tim载体-
作为本发明的tim蛋白质与本发明的载体的结合方式,只要本发明的载体与本发明的tim蛋白质结合,对结合方式就没有限定,但是,从能高灵敏度地检测细胞外膜囊泡或病毒出发,优选本发明的载体与本发明的tim蛋白质的巯基结合的方式,特别优选本发明的载体与本发明的tim4蛋白质的巯基结合的方式。
-本发明的检测方法中的复合体形成工序的具体示例-
本发明的检测方法中的复合体形成工序可以通过例如以下方法进行。
即,将珠用作本发明的载体时,使相对于1ml的混合了本发明的tim载体、试样以及含有钙离子的溶液后的溶液(使本发明的复合体形成时的溶液)通常为0.001~20mg、优选为0.005~10mg、更优选为0.01~6.0mg的本发明的tim载体;含有钙离子的溶液;相对于1mg的本发明的tim载体通常为0.1~1000ml、优选为0.1~500ml、更优选为0.1~100ml的试样,在通常为2~37℃、优选为2~30℃的温度条件下接触通常0.5~24小时、优选1~20小时、更优选1~12小时,使结合于本发明的载体的tim蛋白质与试样中的细胞外膜囊泡或病毒形成复合体,所述含有钙离子的溶液中的钙离子的量是,使本发明的复合体形成时的溶液中的钙离子浓度成为通常0.5~100mm、优选1.0~10mm、更优选2.0~5.0mm的量。
将微孔板用作本发明的载体时,在已固定化tim蛋白质的微孔板的各孔(本发明的tim载体)中,以每孔通常为50μl~300μl、优选为100μl~200μl的方式,添加含有钙离子的溶液以及本发明的试样,在通常为2℃~37℃、优选为2℃~30℃的温度条件下,进行通常为0.5小时~24小时、优选为1小时~20小时、更优选为1~12小时的反应,由此,使本发明的tim载体与试样中的细胞外膜囊泡或病毒的复合体(本发明的复合体)形成,所述含有钙离子的溶液中的钙离子浓度是,使本发明的复合体形成时的溶液中的钙离子浓度成为通常0.5~100mm、优选1.0~10mm、更优选2.0~5.0mm的量。
<8-2.本发明的检测方法中的检测工序>
本发明的检测方法中的检测工序是在进行了复合体形成工序后、根据需要进行试样的复合体分离工序、进而根据需要进行洗涤操作之后,对本发明的tim载体与试样中的细胞外膜囊泡或病毒的复合体(本发明的复合体)进行检测的工序。
-复合体分离工序-
本发明的检测方法中的复合体分离工序是在复合体形成工序之后、根据需要从得到的结合于本发明的载体的tim蛋白质(本发明的tim载体)与试样中的细胞外膜囊泡或病毒的复合体(本发明的复合体)中除去试样的工序。
对本发明的检测方法中的复合体分离工序而言,只要能够将本发明的复合体与试样分离、换言之只要能够进行所谓的b/f分离,就可以采用任意方法,能够采用该领域中使用的b/f分离法。作为这种方法,与本发明的取得方法中的复合体分离工序相同。
-复合体分离工序的具体示例-
本发明的检测方法中的复合体分离工序可以按照该领域中的常规方法进行,但是,将磁珠用作本发明的载体时,例如,根据需要将进行了复合体形成工序的容器设置于磁力架,使用磁力使本发明的复合体集合于管壁,除去上清中的试样。
将微孔板用作本发明的载体时,例如,根据需要使用微量吸液管或洗板机,从进行了复合体形成工序的微孔板中除去试样。
<8-3.洗涤操作>
复合体形成工序后,可以根据需要进行复合体分离工序,进而可以根据需要使用含有钙离子的洗涤溶液对得到的本发明的复合体进行洗涤(以下,有时简记为“洗涤操作”)。通过洗涤操作,能够除去附着于本发明的载体表面的来源于细胞的成分等的本发明的试样中的夹杂物。洗涤方法等的各种条件与本发明的取得方法中的洗涤操作相同。
-洗涤操作的具体示例-
将磁珠用作本发明的载体并采用1.5ml容量的管进行时,首先,在包含通过复合体分离工序得到的本发明的复合体的容器内,添加通常为100μl~1500μl、优选为200μl~1000μl的含有钙离子的洗涤溶液(例如,含有通常为0.5~100mm、优选为1~10mm、更优选为2~5mm的钙离子、在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用且不会使钙沉淀的缓冲液。但是,由于磷酸缓冲液与钙结合而生成沉淀,因此不优选。),进行搅拌。然后,将所述容器设置于磁力架,使用磁力使该复合体集合于管壁,丢弃所述容器内的溶液。所述洗涤操作可以根据需要反复进行多次。
将微孔板用作本发明的载体时,首先,在含有通过复合体分离工序而得到的本发明的复合体的孔中,添加通常为100μl~300μl、优选为200μl~300μl的含有钙离子的洗涤溶液(例如,含有通常为0.5~100mm、优选为1~10mm、更优选为2.0~5.0mm的钙离子、在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用且不会使钙沉淀的缓冲液。但是,由于磷酸缓冲液与钙结合而沉淀,因此不优选。),然后除去加入的洗涤液。所述洗涤操作可以根据需要反复进行多次。
<8-4.检测工序>
对本发明的检测方法中的检测工序而言,只要是能检测本发明的复合体的有无和/或量的方法,就可以使用任意方法,能够使用本身已知的用于免疫学测定方法中的任意方法。
本发明的检测工序除了使用通过如上所述的方法制备的本发明的tim载体以外,没有特别限定。作为这种免疫学测定法,可举出:例如反向被动凝集反应法(东京化学同人,续生物化学实验讲座5,免疫生物化学研究法,p.36-37;金原出版株式会社,《临床检查法提要》,第30版,p.844-845等)等的利用凝集反应的测定法;例如散射浊度法(比ろう法)(金原出版株式会社,《临床检查法提要》,第30版,p.851-853等)、免疫比浊法(金原出版株式会社,《临床检查法提要》,第30版,p.853-854等)等的应用凝集反应的光学测定法;放射免疫分析法(ria)(东京化学同人,续生物化学实验讲座5,免疫生物化学研究法,p.57-61;金原出版株式会社,《临床检查法提要》,第30版,p.856-862等)、免疫放射测定法(immunoradiometricassay,irma)(金原出版株式会社,《临床检查法提要》,第30版,p.856-862等)、酶联免疫法(eia)(东京10化学同人,续生物化学实验讲座5,免疫生物化学研究法p.62-65;金原出版株式会社,《临床检查法提要》,第30版,p.862-865;日本特开昭56-106154号公报;日本特开昭58-23796号公报等)、酶联免疫吸附测定法(elisa)(金原出版株式会社,《临床检查法提要》,第30版,p.1145-1149等)、荧光/发光免疫测定法(金原出版株式会社,《临床检查法提要》,第30版,p.865-867等)、流式细胞术法等的本身公知的免疫学测定方法中的所有方法,优选酶联免疫吸附测定法(elisa)或流式细胞术法。
通过酶联免疫吸附测定法(elisa法)或流式细胞术法进行本发明的检测工序时,在以本发明的复合体为检测对象的范围内,可以按照本身公知的方法来进行。例如,可举出使用与细胞外膜囊泡或病毒结合的抗细胞外膜囊泡抗体的方法、使用以抗病毒抗体等标记物标记初级抗体而成的标记初级抗体的方法、或者使用该初级抗体及与该初级抗体结合的标记次级抗体的方法。作为该标记初级抗体及标记次级抗体,只要是用于elisa法或流式细胞术法的标记抗体的抗体,就可以使用任意抗体,可举出,例如,用cy3、cy5、fitc、罗丹明、pe等荧光物质标记的荧光标记抗体;用过氧化物酶、碱性磷酸酶等酶标记的酶标记抗体;磁珠标记抗体;红外标记抗体等。所述标记抗体的荧光等可以通过与该标记抗体的标记方法(标记物)相应的本身公知的方法进行测定。
-标记抗体的稀释液-
本发明的检测方法中,作为与本发明的复合体反应的标记初级抗体的稀释液、或初级抗体及标记次级抗体的稀释液,除含有钙离子以外,只要不阻碍tim蛋白质与试样中的细胞外膜囊泡或病毒的复合体、和该抗体的结合即可,可举出例如水、在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用的缓冲液(例如tbs、hbs等)等。需要说明的是,由于磷酸缓冲液与钙结合而生成沉淀,因此不优选。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。在所述溶液中,只要是不会阻碍本发明的tim载体与试样中的细胞外膜囊泡或病毒的复合体的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、蛋白质等。作为表面活性剂,可举出例如吐温20(tween20)等,该使含有本发明的细胞外膜囊泡或病毒的溶液中的表面活性剂的浓度通常为0.00001~0.2%、优选为0.0005~0.1%。另外,该稀释液所含钙离子的浓度通常为0.5~100mm、通常优选1~10mm、通常更优选2~5mm。
本发明的检测方法中,与本发明的复合体反应的标记初级抗体、或初级抗体及标记次级抗体的稀释倍率根据抗体的活性、浓度而不同,但是,通常为10倍~1000000倍,优选为1000倍~100000倍。
本发明的检测方法中,对于与本发明的复合体反应的标记初级抗体、或初级抗体及标记次级抗体溶液的稀释溶液的量而言,当本发明的载体为珠时,相对于本发明的载体1mg,通常为0.1ml~1000ml,优选为0.1ml~500ml,更优选为0.1ml~100ml,当本发明的载体为微孔板时,每孔通常为50μl~300μl,优选为50μl~200μl,更优选为50μl~100μl。
-反应(接触)温度-
本发明的检测方法中,本发明的复合体与标记初级抗体、或与初级抗体及标记次级抗体的反应温度通常为2~37℃、优选11~337℃、更优选20~30℃。
-反应(接触)时间-
本发明的检测方法中,本发明的复合体与标记初级抗体、或与初级抗体及标记次级抗体的反应时间通常为0.5~12小时,优选为1~4小时,更优选为1~2小时。
本发明的检测方法中的检测工序的检测操作中,使用标记初级抗体时,在使本发明的复合体与标记初级抗体反应后,通过洗涤操作,能够除去未反应的标记初级抗体。另外,使用初级抗体和标记次级抗体时,在使本发明的复合体与初级抗体反应后、使本发明的复合体与初级抗体的复合体和标记次级抗体反应后,通过洗涤操作,能够除去未反应的初级抗体及标记次级抗体。作为洗涤方法,除使用如上所述的含有钙离子的洗涤液以外,能够使用通常在该领域中实施的洗涤方法。作为用于该洗涤操作中的含有钙离子的洗涤溶液,只要是含有通常为0.5~100mm、优选为1~10mm、更优选为2~5mm的钙离子、不会对该复合体中的本发明的细胞外膜囊泡或病毒与本发明的tim蛋白质及本发明的载体的结合产生影响的溶液即可,可举出例如含有通常为0.5~100mm、通常优选为1~10mm、通常更优选为2~5mm的钙离子、在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用且不会使钙沉淀的缓冲液(例如tbs、hbs)。需要说明的是,由于磷酸缓冲液与钙结合而生成沉淀,因此不优选。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。在所述溶液中,只要是不会阻碍该复合体中的本发明的细胞外膜囊泡或病毒与本发明的tim蛋白质及本发明的载体的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、蛋白质等。作为表面活性剂,可举出例如吐温20(tween20)(和光纯药工业(株)制)等,该洗涤溶液中的表面活性剂的浓度通常为0.00001~0.2%、通常优选为0.0005~0.1%。当本发明的载体为珠时,相对于本发明的载体1mg,通常为0.1ml~1000ml,优选为0.1ml~500ml,更优选为0.1ml~100ml,当本发明的载体为微孔板时,1个孔中使用的洗涤液的量通常为100μl~300μl,优选为200μl~300μl,添加后除去洗涤液。根据需要,可以反复进行多次所述洗涤操作。
-检测-
本发明的检测方法中的检测工序为显色检测时,作为标记初级抗体或标记次级抗体的标记物,可举出过氧化物酶、碱性磷酸酶等。所述标记物可以按照与各标记物相应的本身公知的方法进行检测。
作为显色检测中的显色用基质液,只要是通常在该领域中使用的显色用基质液,就可以是任意显色用基质液,例如,使用过氧化物酶作为标记物时,可举出tmb(四甲基联苯胺)溶液或opd(邻苯二胺)溶液,优选举出tmb溶液。
对于显色检测中的显色用基质的量而言,当本发明的载体为珠时,相对于本发明的载体1mg,通常为0.1ml~1000ml,优选为0.1ml~500ml,更优选为0.1ml~100ml,当本发明的载体为微孔板时,每孔中通常为50μl~300μl,优选为50μl~200μl,更优选为50μl~100μl。
本发明的检测方法中的检测工序为显色检测时,与显色用基质液的反应时间通常为5分钟~60分钟,优选为10分钟~40分钟。
本发明的检测方法中的检测工序为显色检测时,与显色用基质液的反应温度通常为2℃~37℃,优选为20℃~30℃。
本发明的检测方法中的检测工序为显色检测时,为使显色反应停止,通常加入与显色基质液等量的作为反应停止液的1mol/l盐酸或1mol/l硫酸等强酸,使显色反应停止。
当本发明的检测方法中的检测工序为荧光检测、且将荧光物质用于标记初级抗体或标记次级抗体的标记体时,在本发明的复合体与标记初级抗体的复合体中、或者在本发明的复合体与初级抗体及标记次级抗体的复合体中添加荧光测定液,测定荧光。对荧光测定液而言,使用含有钙离子的荧光测定液以外,还能够使用通常能用于该领域的荧光测定液(以下,有时简记为“测定液”)。作为用作该荧光测定液的含有钙离子的测定液,只要是含有通常为0.5~100mm、通常优选为1~10mm、通常更优选为2~5mm的钙离子、且不会对该复合体中的本发明的细胞外膜囊泡或病毒与本发明的tim蛋白质及本发明的载体的结合产生影响的溶液即可,例如,可举出含有通常为0.5~100mm、通常优选为1~10mm、通常更优选为2~5mm的钙离子、且在ph7.0~8.0、优选7.2~7.6的条件下具有缓冲作用且不会使钙沉淀的缓冲液(例如tbs、hbs)。需要说明的是,由于磷酸缓冲液与钙结合而生成沉淀,因此不优选。另外,作为所述缓冲液中的缓冲剂浓度,通常从5~50mm的范围、优选从10~30mm的范围中适当地选择,nacl浓度通常从100~200mm的范围、优选从140~160mm的范围中适当地选择。在所述溶液中,只要是不会阻碍该复合体中的本发明的细胞外膜囊泡或病毒与本发明的tim蛋白质及本发明的载体的结合的量,就可以含有例如糖类、nacl等盐类、表面活性剂、防腐剂、bsa等的蛋白质等。作为表面活性剂,可举出例如吐温20(tween20)(和光纯药工业(株)制)等,该洗涤溶液中的表面活性剂的浓度通常为0.00001~0.2%,通常优选为0.0005~0.1%。对用于本发明的检测方法的荧光测定液的量而言,当本发明的检测法为elisa法、本发明的载体为微孔板时,1孔中使用的测定液的量通常为50μl~300μl,优选为50μl~200μl。当本发明的检测法为流式细胞术法、本发明的载体为珠时,相对于本发明的载体1mg,所述测定液的量通常为0.1ml~1000ml,优选为0.1ml~500ml,更优选为0.1ml~100ml。
-本发明的检测方法中的检测工序的具体示例-
例如,将微孔板用作本发明的载体并采用elisa法进行时,在复合体形成工序、根据需要的复合体分离工序之后、进而根据需要进行了洗涤操作后,对于得到的已固定化本发明的tim蛋白质的微孔板的各孔,在每孔中添加通常为50μl~300μl、优选为50μl~200μl、更优选为50μl~100μl的稀释溶液,在通常为2~37℃、优选为11~37℃的温度条件下,进行通常为0.5~12小时、优选为1~4小时的反应,然后,使用含有钙离子的洗涤用缓冲液(含有通常为0.5~100mm、优选为1~10mm、更优选为2~5mm的钙离子、且不会对该复合体中的本发明的细胞外膜囊泡或病毒与本发明的tim蛋白质及本发明的载体的结合产生影响的溶液)洗涤各孔,所述稀释溶液是,用含有通常为0.5~100mm、通常优选为1~10mm、通常更优选为2~5mm的钙离子的稀释液将过氧化物酶标记的针对细胞外膜囊泡或病毒的初级抗体或非标记的初级抗体稀释成通常为10倍~1000000倍、优选为1000倍~100000倍而成的稀释溶液。使用非标记的初级抗体时,进而采用与初级抗体相同的方法使过氧化物酶标记的次级抗体进行反应后,使用通常为100μl~300μl、优选为200μl~300μl的含有钙离子的洗涤用缓冲液(含有通常为0.5~100mm、通常优选为1~10mm、通常更优选为2~5mm的钙离子、且不会对该复合体中的本发明的细胞外膜囊泡或病毒与本发明的tim蛋白质及本发明的载体的结合产生影响的溶液)洗涤各孔。然后,在各孔中添加通常为50μl~300μl、优选为50μl~200μl、更优选为50μl~100μl的tmb溶液或opd溶液等的显色用基质液,在通常为2℃~37℃、优选为20℃~30℃的温度进行5分钟~60分钟、优选10分钟~40分钟的反应。然后,加入与显色基质液等量的1mol/l盐酸或1mol/l硫酸等反应停止液,使显色反应停止,用酶标仪测定吸光度。
例如,将珠用作本发明的载体并采用流式细胞术法进行时,在复合体形成工序、根据需要的复合体分离工序之后、进而根据需要进行了洗涤操作后,对于得到的已固定化本发明的tim蛋白质的珠,相对于本发明的载体1mg,添加通常为0.1ml~1000ml、优选为0.1ml~500ml、更优选为0.1ml~100ml的稀释溶液,在通常为2~37℃、优选为11~37℃的温度进行0.5~12小时、优选1~4小时的反应,然后,使用含有钙离子的洗涤用缓冲液(含有通常为0.5~100mm、通常优选为1~10mm、通常更优选为2~5mm的钙离子、且不会对该复合体中的本发明的细胞外膜囊泡或病毒与本发明的tim蛋白质及本发明的载体的结合产生影响的溶液)对珠进行洗涤,所述稀释溶液是,用含有通常为0.5~100mm、通常优选为1~10mm、通常更优选为2~5mm的钙离子的稀释液将荧光标记的初级抗体或非标记的初级抗体稀释成通常为10倍~1000000倍、优选为1000倍~100000倍而成的稀释溶液。使用非标记的初级抗体时,进而采用与初级抗体相同的方法使荧光标记的次级抗体进行反应后,用含有钙离子的洗涤用缓冲液(含有通常为0.5~100mm、通常优选为1~10mm、通常更优选为2~5mm的钙离子、且不会对该复合体中的本发明的细胞外膜囊泡或病毒与本发明的tim蛋白质及本发明的载体的结合产生影响的溶液)对珠进行洗涤。然后,相对于本发明的载体1mg,添加通常为0.1ml~1000ml、优选为0.1ml~500ml、更优选为0.1ml~100ml的荧光测定液使珠悬浮后,用流式细胞仪测定荧光强度。
认为抗体对抗原的亲和性通常为10nm~100pm水平的kd。另一方面,已报告了tim4蛋白质与磷脂酰丝氨酸的结合力kd=约2nm(nature(影响因子:41.46).12/2007;450(7168):435-9.doi:10.1038/nature06307)。尽管针对细胞外膜囊泡或病毒包膜的表面抗原的抗体与该表面抗原的亲和性,和细胞外膜囊泡或病毒包膜表面的磷脂酰丝氨酸与本发明的tim蛋白质之间的亲和性的程度相同,但是,意料不到的是,与使用抗体来进行细胞外膜囊泡或病毒的检测等的现有方法相比,使用本发明的tim蛋白质进行细胞外膜囊泡或病毒的检测等的本发明的检测方法具有更高的灵敏度。
通过本发明的方法得到的细胞外膜囊泡或病毒,能够用于其粒子表面、内部具有的蛋白质、小分子rna(microrna)等的核酸的分析,也能够用于细胞外膜囊泡或病毒的功能分析等的基础研究中。另外,还能够用于诊断药、医药品、疫苗等中。
<9.本发明的细胞外膜囊泡或病毒捕获试剂盒>
本发明的细胞外膜囊泡或病毒捕获试剂盒包括以下构成要素:1.包括本发明的tim蛋白质而成的试剂以及包括本发明的载体而成的试剂,或者,2.包括本发明的tim载体而成的试剂。
所述试剂盒可以进一步包括选自所述含有钙离子的洗涤溶液、含有蛋白质改性剂的溶液以及含钙离子螯合剂的溶液中的至少一种。对于各构成要素的具体示例、优选方式等,如上所述。
另外,在所述试剂盒所含的试剂中,可以包括通常在该领域中使用的试剂类,例如缓冲剂、敏化剂、表面活性剂、防腐剂(例如叠氮化钠、水杨酸、苯甲酸等)、稳定化剂(例如白蛋白、球蛋白、水溶性明胶、表面活性剂、糖类等)、活化剂、共存物质影响回避剂、以及在其他领域中使用的、不会阻碍与共存的试剂的稳定性、不会阻碍本发明的tim蛋白质与载体的反应或结合、不会阻碍结合于本发明的载体的本发明的tim蛋白质与试样中的细胞外膜囊泡的反应或结合的试剂。而且,为了发挥各试剂类所具备的效果,所述试剂类等的浓度范围等也可以适当地选择通常使用的浓度范围等进行使用。
进一步地,本发明的试剂盒中,可以包括本发明的取得方法、本发明的除去方法、本发明的检测方法的说明书等。该“说明书”是指,通过文章或图表等实质性地记载有该方法的特征/原理/操作步骤、判定步骤等的该试剂盒的使用说明书、附带文件、或者手册(传单)等。
下面,举出实验例、实施例及比较例,更详细地说明本发明,但本发明并不受其任何限定。
需要说明的是,有时将本发明的tim蛋白质与含t细胞免疫球蛋白及粘蛋白域分子2(tim2)蛋白质(以下,有时简记为“tim2蛋白质”)一并简记为“tim家族蛋白质”。
实施例
实验例1.fc标签融合tim4蛋白质的制备
通过以下方法,制备fc标签融合tim4蛋白质。
<(1)载体的构建/培养>
首先,按照miyanishietal.nature2007,vol.450:15中记载的方法,构建fc标签融合tim4蛋白质表达用载体(以下,有时简记为“pef-tim4-fc”),该载体是将对小鼠源tim4蛋白质的n末端第1~273位氨基酸域进行编码的cdna(序列号26)组合至pef-fc载体的sali-ecorv位点而成的。
另一方面,在25个150mm细胞培养皿中,分别用含10%fbs(拜力公司(biowest公司)制)的dmem(杜尔贝科改良伊格尔培养基,dulbecco'smodifiedeaglemedium)(纳卡拉技术公司(ナカライテスク(株))制)20ml,将293t细胞(理研brc)培养1天。然后,对于各培养皿,将含10%fbs的dmem25ml置换为不含fbs的dmem25ml。
然后,按照常规方法,使用聚乙烯亚胺(polyethylenimine)“max”(保利科技公司(ポリサイエンス社)制),分别在293t细胞中基因导入20μg的pef-tim4-fc。进行基因导入后,在37℃、5%co2条件下,将经基因导入的293t细胞分别培养4天。
<(2)纯化>
分别对得到的经基因导入的293t细胞的培养液进行离心分离处理(800×g,5分钟),回收培养上清并汇总。用rf(商品名,rapidflow,快速流动)0.2μm过滤器单元(赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)对得到的培养上清进行过滤处理,从而分离杂质,得到培养上清过滤液。
然后,在填充有用pbs20ml洗涤的天然a蛋白琼脂糖凝胶4ff(nproteinasepharose4fastflow)(通用电气医疗日本公司(geヘルスケアジャパン社)制,a蛋白(proteina)对fc标签具有亲和性)700μl的poly-prep层析柱(聚合准备层析柱)(伯乐公司(バイオラッド社)制)中,添加得到的培养上清过滤液500ml,使培养上清过滤液中的fc标签融合tim4蛋白质结合于天然a蛋白琼脂糖凝胶4ff。然后,用20ml的pbs洗涤该天然a蛋白琼脂糖凝胶4ff。然后,分别用0.1m甘氨酸-盐酸缓冲液(ph3.0)600μl,在作为中和溶液的1mtris缓冲液(三羟甲基氨基甲烷缓冲液)(ph8.0)100μl中溶出5次,得到各为600μl的五个溶出组分。
对于得到的5个溶出组分,分别测定280nm处的吸光度,判断蛋白质的有无。将含有蛋白质的组分混合为一体后,使用amiconultra-0.5ml10k离心式过滤柱(商品名称及型号)(密理博公司(ミリポア社)制),采用超滤法进行浓缩后,使用所述柱,将溶剂置换为pbs40μl。然后,采用二喹啉甲酸(bicinchoninicacid,bca)法对置换为pbs的溶出液中的蛋白量进行定量后,使用pbs将蛋白质的浓度调节为88μg/ml,得到含有fc标签融合小鼠源tim4蛋白质(有时简记为“fc标签融合mtim4蛋白质”)的pbs溶液(有时简记为“含有fc标签融合mtim4蛋白质的pbs溶液”)。
实验例2.flag标签融合tim4蛋白质的制备
采用以下方法,制备flag标签融合tim4蛋白质。
<(1)载体的构建、培养>
首先,按照常规方法,将flag标签融合小鼠源tim4cdna(对在小鼠源tim4蛋白质的n末端第1~273氨基酸域的c末端融合了1×flag而成的氨基酸序列进行编码的cdna、序列号33(末端具有终止密码子(taa)以及编码1×flag的碱基序列、但不含限制性酶切位点)、fasmac公司制)组合至pcag-neo载体(和光纯药工业(株)制)的xhoi/bamhi位点,构建flag标签融合tim4蛋白质表达用载体(以下,有时简记为“pcag-tim4-flag”)。
另一方面,在225cm2烧瓶中,使用含10%fbs(biosera公司制)的dmem(和光纯药工业(株)制)50ml,在基因导入时将293t细胞(理研brc)以使细胞汇合70-90%的方式进行播种,培养1天。然后,按照常规方法,使用lipofectamine2000(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制),在已培养1天的293t细胞中基因导入pcag-tim4-flag60μg。基因导入后,在37℃、5%co2条件下,将经基因导入的293t细胞培养1天。然后,除去全部培养液,用pbs10ml将经基因导入的293t细胞洗涤2次,将培养液换成opti-mem(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)50ml,在37℃、5%co2条件下培养3天。
<(2)纯化>
对培养了3天后的经基因导入的293t细胞的培养液进行离心分离处理(300×g,5分钟),回收培养上清。进而对回收的培养上清进行三次离心分离处理(第一次:300×g,3分钟;第二次:1200×g,20分钟;第三次:10000×g,20分钟),得到分离了杂质的上清。使用vivaspin(商品名,截留分子量30000,通用电气公司(ge社)制)对得到的上清进行超滤,浓缩至10倍,得到培养上清浓缩液。在得到的培养上清浓缩液5ml中,加入用pbs洗涤的anti-flagm2亲和凝胶(西格玛公司(シグマ社)制)500μl(培养上清浓缩液的1/10量),颠倒混合3小时,使培养上清浓缩液中的flag标签融合tim4蛋白质与抗flagm2亲和凝胶(anti-flagm2affinitygel)反应,使flag标签融合tim4蛋白质结合于抗flagm2亲和凝胶。然后,用5μl的pbs将该抗flagm2亲和凝胶洗涤3次。
然后,将200μg/ml的flag肽溶液(用pbs稀释dykddddk肽(和光纯药工业(株)制)而成的溶液)250μl(所使用的抗flagm2亲和凝胶的一半的量)添加至该抗flagm2亲和凝胶中,在4℃颠倒混合30分钟,进行离心分离处理(4℃,8000×g,1分钟)后,回收上清(溶出液)。为了除去回收的上清(溶出液)中的flag肽,在该上清(溶出液)中加入pbs20ml进行超滤,得到浓缩液。在得到的浓缩液中添加pbs,将液量调整至500μl,得到含有flag标签融合小鼠源tim4蛋白质(有时简记为“flag标签融合mtim4蛋白质”)的pbs溶液(有时简记为“含有flag标签融合mtim4蛋白质的pbs溶液”)(实验例2)。
实验例3.his标签融合tim4蛋白质的制备
采用以下方法,制备his标签融合tim4蛋白质。
<(1)载体的构建/培养>
按照常规方法,将his标签融合小鼠源tim4cdna(对在小鼠源tim4蛋白质的n末端第1~273氨基酸域的c末端融合了6×his标签而成的氨基酸序列进行编码的cdna、序列号34(末端具有终止密码子(tga)以及对6×his标签进行编码的cdna))组合至pcag-neo载体(和光纯药工业(株)制)的xhoi/bamhi位点,构建his标签融合tim4蛋白质表达用载体(以下,有时简记为“pcag-tim4-his”)。
另一方面,在225cm2烧瓶中,用含10%fbs(biosera公司制)的dmem(和光纯药工业(株)制)50ml将293t细胞(理研brc)培养1天。然后,按照常规方法,用lipfectamine2000(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制),在293t细胞中基因导入pcag-tim4-his60μg。基因导入后,在37℃、5%co2条件下,将经基因导入的293t细胞培养1天。然后,除去全部培养液,用pbs10ml将经基因导入的293t细胞洗涤2次,将培养液换成opti-mem(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)50ml,在37℃、5%co2条件下培养3天。
<(2)纯化>
对培养了3天后的经基因导入的293t细胞的培养液进行离心分离处理(300×g,5分钟),回收培养上清。进而对回收的培养上清进行三次离心分离处理(第一次:300×g,3分钟;第二次:1200×g,20分钟;第三次:10000×g,20分钟),得到分离了杂质的上清。使用vivaspin(商品名,截留分子量30000,通用电气公司(ge社)制)对得到的上清进行超滤,浓缩至10倍,得到培养上清浓缩液。
按照附带于镍螯合琼脂糖凝胶6ff(nisepharose6fastflow)的方案制备镍螯合琼脂糖凝胶6ff(通用电气公司(ge社)制)2.7ml,转移至柱。一边以约1ml/min的流速测定od280nm,一边在柱中添加结合缓冲液(50mmtris-hcl,500mmnacl,20mm咪唑)至od280nm的吸光度稳定为止。将得到的培养上清浓缩液5ml添加于柱后,充分添加结合缓冲液至吸光度稳定为止,进行洗涤。然后,将溶出缓冲液(50mmtris-hcl,500mmnacl,300mm咪唑)添加于柱,回收10个各1ml的溶出组分。
<(3)电泳/银染色>
从各溶出组分中各取15μl,分别与4×试样用缓冲液(和光纯药工业(株)制)5μl混合,在98℃加热5分钟,分别得到电泳用试样20μl。在supersepace5-20%凝胶(商品名,和光纯药工业(株)制)中,分别加入该电泳用试样15μl,以25ma的电流进行电泳65分钟。
用和光银染色ii试剂盒(和光纯药工业(株)制)对凝胶进行染色,选择含有目的蛋白质的5个组分并将它们汇集(汇总成一个)后,为了除去溶出液中所含的咪唑,加入pbs20ml,使用vivaspin(商品名,截留分子量30000,通用电气公司(ge社)制)进行超滤,得到浓缩液。在得到的浓缩液中添加pbs,将液量调整为500μl,得到含有his标签融合小鼠源tim4蛋白质(有时简记为“his标签融合mtim4蛋白质”)的pbs溶液(有时简记为“含有his标签融合mtim4蛋白质的pbs溶液”)。
实施例1-8.使用本发明的tim4载体取得细胞外膜囊泡(本发明的取得方法)
如下所述地制备本发明的tim4载体,并使用该载体取得本发明的细胞外膜囊泡。
<(1)含有钙离子的培养上清样品的制备>
使用80ml的x-vivo15培养基(商品名,龙沙公司(lonza社)制),在37℃、5%co2的条件下,将分泌细胞外膜囊泡的人慢性髄系白血病细胞株k562细胞1×107个细胞培养3天后,进行离心分离处理(300×g,5分钟),使细胞沉淀,除去上清。用含有10μm莫能菌素钠(mp生物医学公司(mpbiomedicals社)制)的x-vivo15培养基60ml使沉淀的细胞悬浮后,在37℃、5%co2条件下培养24小时。
然后,对培养液进行离心分离处理(300×g,5分钟),回收培养上清。进一步地对回收的培养上清60ml进行三次离心分离处理(第一次:300×g,3分钟;第二次:1200×g,20分钟;第三次:10000×g,20分钟),分离杂质,得到上清。使用vivaspin(商品名,截留分子量30000,通用电气公司(ge社)制)对得到的上清进行超滤直至其成为6ml以下,得到浓缩液。在得到的浓缩液中添加含有10μm莫能菌素钠(mp生物医学公司(mpbiomedicals社)制)的x-vivo15培养基,将液量调节至6ml,得到10倍浓缩的k562细胞培养浓缩液样品(以下,有时简记为“培养上清样品”)。
另外,在得到的培养上清样品中添加cacl2,使终浓度成为2mm,得到含有2mmcacl2的k562细胞培养上清浓缩液样品(以下,有时简记为“含有钙离子的培养上清样品”)。
<(2)fc标签融合小鼠源tim4蛋白质的生物素标记>
对于通过与实验例1相同的方法制备的含有fc标签融合mtim4蛋白质的pbs溶液114μl(含有fc标签融合mtim4蛋白质10μg),使用生物素标记试剂盒-氨基(同仁化学研究所制),按照附带于该试剂盒中的方案,对fc标签融合mtim4蛋白质的氨基进行生物素标记,得到含有氨基生物素标记的fc标签融合小鼠源tim4蛋白质(有时简记为“氨基生物素标记的fc标签融合mtim4蛋白质”)3.8μg的pbs溶液100μl(有时简记为“含有氨基生物素标记的fc标签融合mtim4蛋白质的pbs溶液”)。
另外,对于通过与实验例1相同的方法制备的含有fc标签融合mtim4蛋白质的pbs溶液114μl(含有fc标签融合小鼠源tim4蛋白质10μg),使用生物素标记试剂盒-巯基(同仁化学研究所制),按照附带于该试剂盒中的方案,对fc标签融合小鼠源tim4蛋白质的巯基进行生物素标记,得到含有巯基生物素标记的fc标签融合小鼠源tim4蛋白质(有时简记为“巯基生物素标记的fc标签融合mtim4蛋白质”)5.9μg的pbs溶液100μl(有时简记为“含有巯基生物素标记的fc标签融合mtim4蛋白质的pbs溶液”)。
<(3)含有fc标签融合小鼠源tim4蛋白质的pbs溶液的稀释>
将采用与实验例1相同的方法制备的含有fc标签融合mtim4蛋白质的pbs溶液11.4μl与pbs188.6μl混合,得到含有生物素非标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl。
将上述制备的含有氨基生物素标记的fc标签融合mtim4蛋白质的pbs溶液26.3μl(含有氨基生物素标记的fc标签融合mtim4蛋白质1μg)与pbs173.7μl混合,得到含有氨基生物素标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl。
另外,将上述制备的含有巯基生物素标记的fc标签融合mtim4蛋白质的pbs溶液16.9μl(含有巯基生物素标记的fc标签融合mtim4蛋白质1μg)与pbs183.1μl混合,得到含有巯基生物素标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl。
<(4)珠的洗涤>
分别将含有30μg/μl的dynabeadsg蛋白的pbs-t溶液(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)20μl(含有0.6mg的dynabeadsg蛋白)分注于3个1.5ml管(bm设备公司(ビーエム机器社)制)中。然后,将500μl的pbs分别加入1.5ml管中,进行搅拌后,将1.5ml管分别设置于磁力架,使用磁力使dynabeadsg蛋白集合于管壁,用移液器将1.5ml管内的溶液丢弃(以下,有时简记为“洗涤操作”)。
另外,将含有10μg/μl的dynabeadsm-270链霉亲和素c1珠(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs溶液60μl(含有0.6mg的dynabeadsm-270链霉亲和素c1珠)分注于1.5ml管(bm设备公司(ビーエム机器社)制)中,用500μl的pbs与上述同样地进行洗涤操作。
<(5)fc标签融合小鼠源tim4蛋白质固定于珠>
在3个含有dynabeadsg蛋白(0.6mg)的1.5ml管中,在其中的1个中添加上述制备的含有生物素非标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl的总量,在8℃温度反应1小时,得到含有结合有生物素非标记的fc标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液200μl。
在剩余的2个含有dynabeadsg蛋白(0.6mg)的1.5ml管中,在其中一个中添加上述制备的含有氨基生物素标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl的总量,在8℃温度反应1小时,得到含有结合有氨基生物素标记的fc标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液200μl。
在另一个中添加上述制备的含有巯基生物素标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl的总量,在8℃温度反应1小时,得到含有结合有巯基生物素标记的fc标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液200μl。
对于一个含有dynabeadsm-270链霉亲和素c1珠的1.5ml管,添加采用与上述相同方法制备的含有巯基生物素标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl,在8℃温度进行1小时的反应,得到含有结合有巯基生物素标记的fc标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液200μl。
由此,得到分别含有0.6mg的下表1所示的4种mtim4载体的pbs溶液200μl。
表1
<(6)利用本发明的取得方法取得细胞外膜囊泡>
用500μl的pbs对上述得到的表1中记载的4种mtim4载体0.6mg分别进行3次洗涤操作,然后,在颗粒状态的各mtim4载体中,加入所述(1)中制备的含有钙离子的培养上清样品200μl,在8℃温度反应3小时。
用含有2mmcacl2的tbs-t(三羟甲基氨基甲烷(tris)缓冲液(trisbuffer),0.05%吐温20(tween20),2mmcacl2)500μl分别对反应后的mtim4载体进行3次洗涤操作。在进行第三次洗涤操作时,分别将4种mtim4载体各250μl分注于2个1.5ml管中。
在颗粒状态的4种mtim4载体各0.3mg中,添加作为溶出液的1%sds水溶液或1mmedta水溶液20μl,然后,通过漩涡混合器在室温条件下混合10秒,停止转动(spindown)。将1.5ml管分别设置于磁力架,使用磁力使mtim4载体集合于管壁,回收上清(溶出液)。
需要说明的是,将各实施例中使用的mtim4蛋白质及载体的种类、用于从mtim4载体取得细胞外膜囊泡的溶出液的种类、以及后述蛋白质免疫印迹中的泳道号示于下表2中。
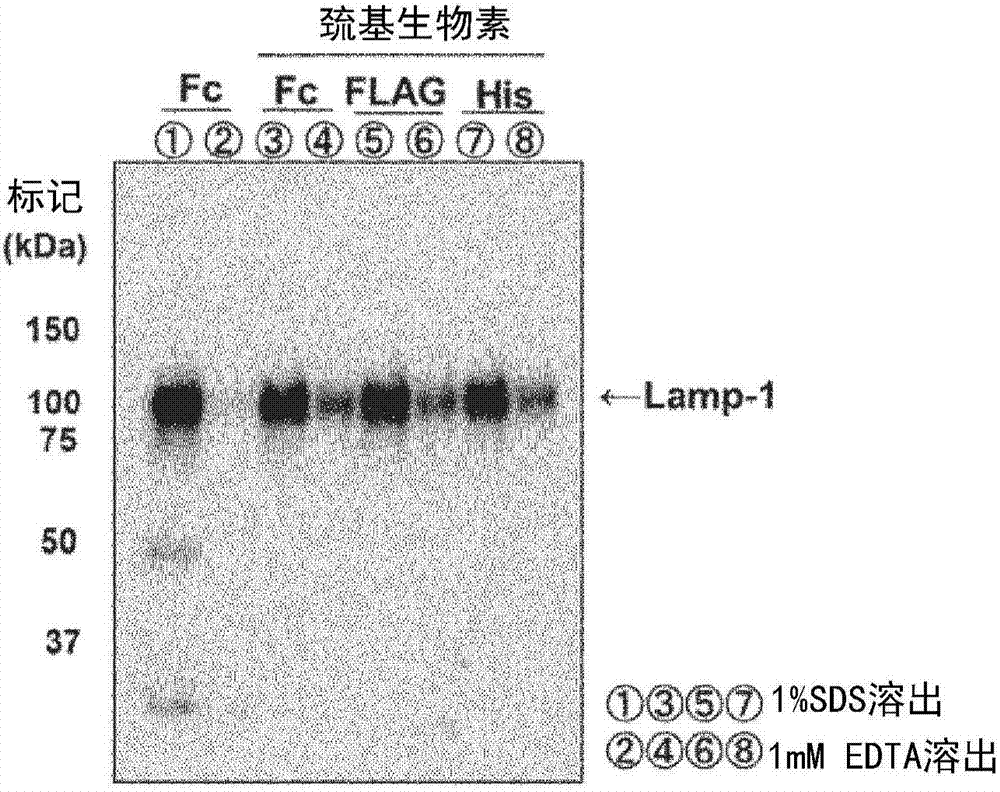
表2
<(7)蛋白质免疫印迹>
在实施例1-8中得到的各上清(溶出液)7.5μl中,加入4×试样用缓冲液(和光纯药工业(株)制)2.5μl,在98℃加热5分钟,得到蛋白质免疫印迹用各试样。在supersepace5-20%凝胶(商品名,和光纯药工业(株)制)中,加入该蛋白质免疫印迹用各试样10μl,以25ma进行65分钟的电泳。使用半干印迹仪与不连续缓冲液(阳极缓冲液(anodebuffer)1:0.3mtris/20%甲醇;阳极缓冲液2:0.025mtris/20%甲醇;阴极缓冲液(cathodebuffer):0.025mtris/0.04m氨基己酸/20%甲醇),在1ma/cm2的条件下,将得到的电泳凝胶转印至pvdf膜(密里博公司(millipore社)制)60分钟。
在pvdf膜中加入用pbs-t(pbs缓冲液,0.1%吐温20(tween20))稀释的3%脱脂奶,在室温条件下进行1小时的反应,进行封闭,将用pbs-t稀释了250倍的抗人lamp-1小鼠单克隆抗体(bd生物科学公司(bdバイオサイエンス社)制,以下有时简记为“抗人lamp-1抗体”)2ml在8℃温度反应一夜。
然后,用pbs-t将反应后的pvdf膜洗涤3次,在室温条件下,将用pbs-t稀释了10000倍的次级抗体{抗小鼠igg(h+l)、兔、igg组分、过氧化物酶结合抗体}(和光纯药工业(株)制)进行1小时的反应。用pbs-t洗涤5次后,添加immunostarzeta(商品名,和光纯药工业(株)制),使用las-4000(通用电气公司(ge社)制)检测发光信号。需要说明的是,抗人lamp-1抗体是针对作为外泌体的标记蛋白质之一的lamp-1的抗体。
<结果>
将得到的蛋白质免疫印迹的结果示于图1。图1中,各泳道如下。
泳道1:实施例1的结果(使用使生物素非标记的fc标签融合mtim4蛋白质结合于g蛋白珠而成的mtim4载体、并将1%sds水溶液用作溶出液时的结果);
泳道2:实施例2的结果(使用使生物素非标记的fc标签融合mtim4蛋白质结合于g蛋白珠而成的mtim4载体、并将1mmedta溶液用作溶出液时的结果);
泳道3:实施例3的结果(使用使氨基生物素标记的fc标签融合mtim4蛋白质结合于g蛋白珠而成的mtim4载体、并将1%sds水溶液用作溶出液时的结果);
泳道4:实施例4的结果(使用使氨基生物素标记的fc标签融合mtim4蛋白质结合于g蛋白珠而成的mtim4载体、并将1mmedta溶液用作溶出液时的结果);
泳道5:实施例5的结果(使用使巯基生物素标记的fc标签融合mtim4蛋白质结合于g蛋白珠而成的mtim4载体、并将1%sds水溶液用作溶出液时的结果);
泳道6:实施例6的结果(使用使巯基生物素标记的fc标签融合mtim4蛋白质结合于g蛋白珠而成的mtim4载体、并将1mmedta溶液用作溶出液时的结果);
泳道7:实施例7的结果(使用使巯基生物素标记的fc标签融合mtim4蛋白质结合于链霉亲和素珠而成的mtim4载体、并将1%sds水溶液用作溶出液时的结果);
泳道8:实施例8的结果(使用使巯基生物素标记的fc标签融合小鼠源tim4蛋白质结合于链霉亲和素珠而成的mtim4载体、并将1mmedta溶液用作溶出液时的结果)。
根据图1,在实施例1-8中的任意情况下,都在100kda附近得到作为外泌体标记物的lamp-1的条带,由此可知,通过本发明的取得方法,能取得含有外泌体的细胞外膜囊泡(实施例1-8:泳道1-8)。
特别地,通过对比实施例2、4、6、8可知,将钙离子螯合剂用作溶出液时,相比于tim4蛋白质与载体通过氨基而结合的情况(实施例4:泳道4)、通过亲和标签而结合的情况(实施例2:泳道2;实施例6:泳道6),当tim4蛋白质与载体通过tim4蛋白质的巯基而结合时(实施例8:泳道8),能取得更多的细胞外膜囊泡(实施例2:泳道2;实施例4:泳道4;实施例6:泳道6;实施例8:泳道8)。
实施例9-16.使用本发明的tim4载体取得细胞外膜囊泡(本发明的取得方法)
如下所示地制备本发明的tim4载体,并使用该载体取得本发明的细胞外膜囊泡。
<(1)培养上清样品的制备>
通过与实施例1-8的“(1)培养上清样品的制备”相同的方法进行。
<(2)fc标签融合小鼠源tim4蛋白质的生物素标记>
对于通过与实验例1“(2)fc标签融合小鼠源tim4蛋白质的生物素标记”相同的方法制备的含有fc标签融合mtim4蛋白质的pbs溶液114μl(含有fc标签融合mtim4蛋白质10μg),采用与实施例1相同的方法,对fc标签融合mtim4蛋白质的巯基进行生物素标记,得到含有巯基生物素标记的fc标签融合mtim4蛋白质3.9μg的pbs溶液100μl(以下,有时简记为“含有巯基生物素标记的fc标签融合mtim4蛋白质的pbs溶液”)。
<(3)flag标签融合小鼠源tim4蛋白质的生物素标记>
使用通过与实验例2相同的方法制备的含有flag标签融合mtim4蛋白质的pbs溶液99μl(含有flag标签融合mtim4蛋白质10μg),使用生物素标记试剂盒-巯基((株)同仁化学研究所制),按照附带于该试剂盒中的方案,对flag标签融合mtim4蛋白质的巯基进行生物素标记,得到含有巯基生物素标记的flag标签融合mtim4蛋白质4.6μg的pbs溶液(以下,有时简记为“含有巯基生物素标记的flag标签融合mtim4蛋白质的pbs溶液”)100μl。
<(4)his标签融合小鼠源tim4蛋白质的生物素标记>
对于通过与实验例3相同的方法制备的含有his标签融合mtim4蛋白质的pbs溶液54μl(含有his标签融合mtim4蛋白质10μg),使用生物素标记试剂盒-巯基((株)同仁化学研究所制),按照附带于该试剂盒中的方案,对his标签融合mtim4蛋白质的巯基进行生物素标记,得到含有巯基生物素标记的his标签融合mtim4蛋白质7.2μg的pbs溶液(以下,有时简记为“含有巯基生物素标记的his标签融合mtim4蛋白质的pbs溶液”)100μl。
<(5)标签融合型小鼠源tim4蛋白质的稀释>
将通过与实验例1相同的方法制备的含有fc标签融合mtim4蛋白质的pbs溶液11.4μl(含有fc标签融合小鼠源tim4蛋白质1μg)与pbs188.6μl混合,得到含有生物素非标记的fc标签融合小鼠源tim4蛋白质1μg的pbs溶液200μl。
将上述(2)中制备的含有巯基生物素标记的fc标签融合mtim4蛋白质的pbs溶液16.9μl(含有巯基生物素标记的fc标签融合mtim4蛋白质1μg)与pbs183.1μl混合,得到含有巯基生物素标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl。
另外,将所述(3)中制备的含有巯基生物素标记的flag标签融合mtim4蛋白质的pbs溶液21.6μl(含有巯基生物素标记的flag标签融合mtim4蛋白质1μg)与pbs178.4μl混合,得到含有巯基生物素标记的flag标签融合mtim4蛋白质1μg)的pbs溶液200μl。
将所述(4)中制备的含有巯基生物素标记的his标签融合mtim4蛋白质的pbs溶液13.9μl(含有巯基生物素标记的his标签融合mtim4蛋白质1μg)与pbs186.1μl混合,得到含有巯基生物素标记的his标签融合mtim4蛋白质1μg的pbs溶液200μl。
<(6)珠的洗涤>
将含有30μg/μl的dynabeadsg蛋白的pbs-t溶液(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)20μl(含有0.6mg的dynabeadsg蛋白)分注于1个1.5ml管(bm设备公司(ビーエム机器社)制)中,采用与实施例1-8的“(4)珠的洗涤”相同的方法,使用500μl的pbs进行洗涤操作。
另外,分别将含有10μg/μl的dynabeadsm-270链霉亲和素(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs溶液60μl(含有0.6mg的dynabeadsm-270链霉亲和素)分注于3个1.5ml管(bm设备公司(ビーエム机器社)制)中,采用与实施例1-8的“(4)珠的洗涤”相同的方法,使用500μl的pbs分别进行洗涤操作。
<(7)标签融合小鼠源tim4蛋白质固定于珠>
然后,在含有0.6mg的经洗涤操作后的颗粒状态的dynabeadsg蛋白的1.5ml管中,添加含有生物素非标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl的总量,在8℃温度进行1小时的反应,得到含有结合有生物素非标记的fc标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液200μl。
进一步地,在含有0.6mg的洗涤操作后的颗粒状态的dynabeadsm-270链霉亲和素的3个1.5ml管中,在其中一个中,添加上述制备的含有巯基生物素标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl的总量,在8℃进行1小时的反应,得到含有结合有巯基生物素标记的fc标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液200μl。
在剩余的2个含有0.6mg的经洗涤操作后的颗粒状态的dynabeadsm-270链霉亲和素的1.5ml管中,在其中一个中添加上述制备的含有巯基生物素标记的flag标签融合mtim4蛋白质1μg的pbs溶液200μl的总量,在8℃温度进行1小时的反应,得到含有结合有巯基生物素标记的flag标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液200μl。
在另一个中添加上述制备的含有巯基生物素标记的his标签融合mtim4蛋白质1μg的pbs溶液200μl的总量,在8℃温度进行1小时的反应,得到含有结合有巯基生物素标记的his标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液200μl。
由此,得到分别含有0.6mg的下表3所示的4种mtim4载体的pbs溶液200μl。
表3
<(8)利用本发明的取得方法取得细胞外膜囊泡>
使用“表3中记载的4种mtim4载体0.6mg”来代替“表1中记载的4种mtim4载体0.6mg”,除此以外,采用与实施例1-8的“(6)利用本发明的取得方法取得细胞外膜囊泡”相同的方法进行,得到各上清(溶出液)。需要说明的是,将各实施例中使用的mtim4蛋白质及载体的种类、用于从mtim4载体取得细胞外膜囊泡的溶出液的种类、以及后述蛋白质免疫印迹中的泳道号示于下表4中。
表4
<(7)蛋白质免疫印迹>
使用“实施例9-16(所述(8))中得到的各上清(溶出液)7.5μl”来替代“实施例1-8中得到的各上清(溶出液)7.5μl”,除此以外,采用与实施例1-8的“(7)蛋白质免疫印迹”相同的方法进行。
<结果>
将得到的蛋白质免疫印迹的结果示于图2中。图2中,各泳道如下。
分别示出了:
泳道1:实施例9的结果(使用使生物素非标记的fc标签融合mtim4蛋白质结合于g蛋白珠而成的mtim4载体、并将1%sds水溶液用作溶出液时的结果);
泳道2:实施例10的结果(使用使生物素非标记的fc标签融合mtim4蛋白质结合于g蛋白珠而成的mtim4载体、并将1mmedta溶液用作溶出液时的结果);
泳道3:实施例11的结果(使用使巯基生物素标记的fc标签融合mtim4蛋白质结合于链霉亲和素珠而成的mtim4载体、并将1%sds水溶液用作溶出液时的结果);
泳道4:实施例12的结果(使用使巯基生物素标记的fc标签融合mtim4蛋白质结合于链霉亲和素珠而成的mtim4载体、并将1mmedta溶液用作溶出液时的结果);
泳道5:实施例13的结果(使用使巯基生物素标记的flag标签融合mtim4蛋白质结合于链霉亲和素珠而成的mtim4载体、并将1%sds水溶液用作溶出液时的结果);
泳道6:实施例14的结果(使用使巯基生物素标记的flag标签融合mtim4蛋白质结合于链霉亲和素珠而成的mtim4载体、并将1mmedta溶液用作溶出液时的结果);
泳道7:实施例15的结果(使用使巯基生物素标记的his标签融合mtim4蛋白质结合于链霉亲和素珠而成的mtim4载体、并将1%sds水溶液用作溶出液时的结果);
泳道8:实施例16的结果(使用使巯基生物素标记的his标签融合mtim4蛋白质结合于链霉亲和素珠而成的mtim4载体、并将1mmedta溶液用作溶出液时的结果)。
根据图2可知,在实施例9-16中的任意情况下,在100kda附近都得到了作为外泌体的标记蛋白质的lamp-1的条带,因此,通过本发明的取得方法,能取得含有外泌体的细胞外膜囊泡(实施例9-16:泳道1-8)。
另外可知,如果使用本发明的tim4载体,则无论标签的种类、长度如何、是否存在,都能取得细胞外膜囊泡(实施例9-16:泳道1-8)。
通过比较实施例10、12、14、16可知,将作为钙离子螯合剂的edta用作溶出液时,相比于tim4蛋白质与载体通过亲和标签而结合的情况(实施例10:泳道2),当tim4蛋白质与载体通过tim4蛋白质的巯基而结合时(实施例12:泳道4;实施例14:泳道6;实施例16:泳道8),能取得更多的细胞外膜囊泡。
实施例17-18.使用本发明的tim4载体取得细胞外膜囊泡(本发明的取得方法)
如下所述地制备本发明的tim4载体,并使用该载体取得本发明的细胞外膜囊泡。
<(1)培养上清样品的制备>
通过与实施例1-8的“(1)培养上清样品的制备”相同的方法进行。
<(2)生物素非标记的flag标签融合小鼠源tim4蛋白质的稀释>
将通过与实验例2相同的方法制备的含有生物素非标记的flag标签融合mtim4蛋白质5μg的pbs溶液47μl(含有生物素非标记的flag标签融合小鼠源tim4蛋白质的pbs溶液)与pbs153μl混合,得到含有生物素非标记的flag标签融合mtim4蛋白质5μg的pbs溶液200μl。
<(3)珠的洗涤>
将含有10μg/μl的抗dykddddk标签抗体磁珠的50%甘油tbs溶液(和光纯药工业(株)制)50μl(含有抗dykddddk标签抗体磁珠0.5mg)分注于1.5ml管(bm设备公司(ビーエム机器社)制)中,使用pbs500μl进行洗涤操作。
<(4)flag标签融合小鼠源tim4蛋白质固定于载体>
然后,在经洗涤操作后的颗粒状态的抗dykddddk标签抗体磁珠中,添加含有flag标签融合mtim4蛋白质5μg的pbs溶液200μl的总量,在8℃进行1小时的反应,得到含有mtim4载体的pbs溶液200μl。
由上所述,得到含有下表5所示的mtim4载体0.5mg的pbs溶液200μl。
表5
<(5)利用本发明的取得方法取得细胞外膜囊泡>
使用“表5中记载的mtim4载体0.5mg”来替代“表1中记载的4种mtim4载体0.6mg”,除此以外,采用与实施例1-8的“(6)利用本发明的取得方法取得细胞外膜囊泡”相同的方法,得到各上清(溶出液)。
需要说明的是,将各实施例中使用的mtim4蛋白质及载体的种类、用于从mtim4载体取得细胞外膜囊泡的溶出液的种类、以及后述蛋白质免疫印迹中的泳道号示于下表6中。
表6
<(6)蛋白质免疫印迹>
使用“实施例17-18(所述(5))中得到的各上清(溶出液)7.5μl”来替代“实施例1-8中得到的各上清(溶出液)7.5μl”,除此以外,通过与实施例1-8的“(7)蛋白质免疫印迹”相同的方法进行。
<结果>
将得到的蛋白质免疫印迹的结果示于图3。图3中,各泳道如下。
泳道1:实施例17的结果(使用使生物素非标记的flag标签融合mtim4蛋白质结合于抗dykddddk标签抗体珠而成的mtim4载体、并将1%sds水溶液用作溶出液时的结果);
泳道2:实施例18的结果(使用使生物素非标记的flag标签融合mtim4蛋白质结合于抗dykddddk标签抗体珠而成的mtim4载体、并将1mmedta溶液用作溶出液时的结果)。
根据图3可知,在实施例17-18中的任意情况下,都在100kda附近观察到了作为外泌体标记物的lamp-1的条带,因此,通过本发明的取得方法,即使使用通过抗标签抗体而固定化tim4蛋白质的载体,也能取得含有外泌体的细胞外膜囊泡(实施例17-18:泳道1-2)。
实施例19-20以及比较例1-3.通过本发明的取得方法及现有方法得到的细胞外膜囊泡的纯度的比较
如下所述,对通过利用sds溶出的本发明的取得方法(实施例19)、利用edta溶出的本发明的取得方法(实施例20)、超速离心分离法(比较例1)、exoquick(比较例2)以及总外泌体分离法(totalexosomeisolation)(比较例3)分别得到的细胞外膜囊泡的纯度进行比较。
<利用本发明的取得方法取得细胞外膜囊泡(实施例19-20)>
使用“含有钙离子的培养上清样品500μl”来替代“含有钙离子的培养上清样品200μl”,并且,作为溶出液,使用“1%sds水溶液50μl”来替代“1%sds水溶液20μl”、使用“1mmedta水溶液50μl”来替代“1mmedta水溶液20μl”,除此以外,采用与实施例13-14相同的方法,使mtim4蛋白质与含有钙离子的培养上清样品中的细胞外膜囊泡进行反应,并分别通过作为溶出液的1%sds水溶液及1mmedta水溶液使细胞外膜囊泡溶出,分别得到上清(溶出液),所述mtim4蛋白质是使巯基生物素标记的flag标签融合mtim4蛋白质结合于dynabeadsm-270链霉亲和素c1珠(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)而形成的。
将得到的上清(溶出液)分别作为样品1(用1%sds水溶液进行溶出时)、样品2(用1mmedta水溶液进行溶出时)。
需要说明的是,将实施例19-20中使用的mtim4蛋白质及载体的种类、以及用于从mtim4载体取得细胞外膜囊泡的溶出液的种类示于下表7。
表7
<利用超速离心分离法取得细胞外膜囊泡(比较例1)>
对通过与实施例1相同的方法制备的培养上清样品1ml进行离心分离处理(20000×g,30分钟),分离杂质,得到上清。然后,对得到的上清1ml进行超速离心分离处理(110000×g,70分钟),得到沉淀组分。然后,用1ml的pbs将得到的沉淀组分悬浮。对沉淀组分的悬浮液再次进行超速离心分离处理(110000×g,70分钟)后,将得到的沉淀组分悬浮于pbs50μl。将得到的悬浮液作为样品3(比较例1)。
<通过使用市售的试剂的离心分离法取得细胞外膜囊泡(利用exoquick取得细胞外膜囊泡)(比较例2)>
对通过与实施例1相同的方法制备的培养上清样品1ml进行离心分离处理(20000×g,30分钟),分离杂质,得到上清。然后,将得到的上清1ml与exoquick-tc试剂(exoquick-tcreagent)(商品名,系统生物科学公司(systembiosciences社))0.2ml混合,在8℃将该混合液静置一晚。然后,对已静置一晚的该混合液进行离心分离处理(1500×g,30分钟),将得到的沉淀组分悬浮于pbs100μl。将得到的悬浮液作为样品4(比较例2)。
<通过使用市售的试剂的离心分离法取得细胞外膜囊泡(利用总外泌体分离法(totalexosomeisolation)取得细胞外膜囊泡)(比较例3)>
对通过与实施例1相同的方法制备的k562细胞培养上清浓缩液样品1ml进行离心分离处理(20000×g,30分钟),分离杂质,得到上清。然后,将得到的上清1ml与总外泌体分离试剂(totalexosomeisolationreagent)(赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)0.5ml混合,在8℃静置1天。将通过对该混合液进行离心分离处理(10000×g,1小时)而得到的沉淀组分悬浮于pbs100μl。将得到的悬浮液作为样品5(比较例3)。
需要说明的是,将各实施例及比较例中使用的方法、得到的样品以及后述蛋白质免疫印迹及银染色中的泳道号示于下表8中。
表8
<蛋白质免疫印迹>
采用bca法对通过各方法得到的样品1-5中的蛋白质量进行测定,基于测定结果,将蛋白质量分别作为电泳的基准量,进行蛋白质免疫印迹。即,分别将含有样品1-5中的各蛋白质0.25μg的pbs溶液37.5μl与4×试样用缓冲液(和光纯药工业(株)制)12.5μl混合,然后,在98℃加热5分钟,分别得到蛋白质免疫印迹用各试样50μl。
然后,在supersepace5-20%凝胶(商品名,和光纯药工业(株)制)中,分别将得到的蛋白质免疫印迹用各试样各20μl添加于两块凝胶中,以25ma进行60分钟的电泳。使用半干印迹仪和不连续缓冲液(阳极缓冲液1:0.3mtris/20%甲醇;阳极缓冲液2:0.025mtris/20%甲醇;阴极缓冲液:0.025mtris/0.04m氨基己酸/20%甲醇),在1ma/cm2的条件下,将得到的两块凝胶中的一块转印于pvdf膜(密里博公司(millipore社)制)60分钟。在pvdf膜中添加用pbs-t稀释的3%脱脂奶,在室温条件下进行1小时的反应,进行封闭,在室温条件下,将用pbs-t稀释了250倍的抗人lamp-1小鼠单克隆抗体(bd生物科学公司(bdbiosciences社)制)2ml进行1小时的反应。用pbs-t洗涤3次后,在室温条件下,将用pbs-t稀释了10000倍的次级抗体{抗小鼠igg(h+l)、兔、igg组分、过氧化物酶结合抗体(和光纯药工业(株)制)}进行1小时的反应。用pbs-t洗涤5次后,添加eclprime(商品名,通用电气公司(ge社)制),使用las-4000(商品名,通用电气公司(ge社)制),分别检测发光信号。
另外,用和光银染色ii试剂盒(商品名,和光纯药工业(株)制)对另一块凝胶进行银染色。
<结果>
分别将得到的蛋白质免疫印迹的结果示于图4-a、将银染色的结果示于图4-b。图4-a及图4-b中,各泳道如下。
泳道1:实施例19的结果(使用使巯基生物素标记的flag标签融合mtim4蛋白质结合于链霉亲和素珠而成的mtim4载体、并将1%sds水溶液用作溶出液来实施本发明的取得方法时的结果);
泳道2:实施例20的结果(使用使巯基生物素标记的flag标签融合mtim4蛋白质结合于链霉亲和素珠而成的mtim4载体、并将1mmedta溶液用作溶出液来实施本发明的取得方法时的结果);
泳道3:比较例1的结果(通过超速离心分离法取得细胞外膜囊泡时的结果);
泳道4:比较例2的结果(通过exoquick取得细胞外膜囊泡时的结果);
泳道5:比较例3的结果(通过总外泌体分离法(totalexosomeisolation)取得细胞外膜囊泡时的结果)。
根据图4-a,在作为本发明的取得方法的实施例19-20中的任意实施例中,都在100kda附近观察到了作为外泌体标记物的lamp-1的条带,可知通过本发明的取得方法,能取得含有外泌体的细胞外膜囊泡(实施例19-20:泳道1-2)。
另一方面,根据图4-a,对于任何现有方法(超速离心分离法(比较例1)、exoquick(比较例2)以及总外泌体分离法(totalexsomeisolation)(比较例3))而言,在100kda附近都仅观察到了较浅且微量的外泌体标记物lamp-1的条带(比较例1-3:泳道3-5)。
另外,根据图4-b,本发明的取得方法(实施例19-20)与任何现有方法(超速离心分离法(比较例1)、exoquick(比较例2)以及总外泌体分离法(totalexsomeisolation)(比较例3))相比,来自于夹杂的蛋白质等的条带较少(实施例19-20:泳道1-2、比较例1-3:泳道3-5)。
根据上述结果可知,本发明的取得方法(实施例19及20)与任何现有方法((超速离心分离法(比较例1)、exoquick(比较例2)以及总外泌体分离法(totalexsomeisolation)(比较例3))相比,能够以更良好的纯度取得细胞外膜囊泡(泳道1-5)。
实施例21.利用电子显微镜观察通过本发明的取得方法得到的细胞外膜囊泡
为了检测通过本发明的取得方法取得的细胞外膜囊泡的状态,利用电子显微镜进行观察。
<(1)小鼠巨噬细胞培养上清样品的制备>
为了得到腹腔巨噬细胞,将3%巯基乙酸盐溶液(弗鲁卡试剂公司(フルカ试剂社)制)2ml注射于6只8周龄雌性c57bl/6j小鼠(购自日本slc(株)公司)的腹腔中。3天后,从腹腔回收巨噬细胞,在4个150mm细胞培养皿中,用含10%fbs(biowest公司制)的dmem(纳卡拉技术公司(ナカライテスク(株))制)80ml对回收的巨噬细胞培养2天,回收培养上清,得到小鼠巨噬细胞培养上清样品。
<(2)tim4载体的制备>
使用1mg的dynabeadsmyone链霉亲和素c1珠(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制),代替0.6mg的dynabeadsmyone链霉亲和素c1珠(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制),使用含有巯基生物素标记的fc标签融合mtim4蛋白质100μg的pbs溶液100μl,替代含有巯基生物素标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl,将dynabeads与含有巯基生物素标记的fc标签融合mtim4蛋白质的pbs溶液的反应时间调整为2小时以替代1小时,除此以外,通过与实施例11-12相同的方法,制备使巯基生物素标记的fc标签融合mtim4蛋白质结合于dynabeadsmyone链霉亲和素c1珠而成的mtim4载体。
<(3)使用tim4载体取得细胞外膜囊泡>
对小鼠巨噬细胞培养上清样品32ml进行离心分离处理(第一次:800×g,10分钟;第二次:12000×g,30分钟),得到上清。在得到的上清中,添加cacl2以使终浓度成为2mm后,加入上述制备的mtim4载体1mg,在室温搅拌混合1小时。然后,回收在室温经搅拌混合1小时的mtim4载体,用含有终浓度为2mm的cacl2的tbs-t5ml进行3次洗涤操作后,进而用1ml进行2次洗涤操作,然后,用含有1mmedta的tbs100μl进行3次溶出,得到细胞外膜囊泡组分300μl。
然后,为了可靠地回收小鼠巨噬细胞培养上清样品中的细胞外膜囊泡,再次通过下述方法,从用含有1mmedta的tbs100μl进行3次溶出后的小鼠巨噬细胞培养上清样品中回收细胞外膜囊泡,得到细胞外膜囊泡组分300μl。即,在用含有1mmedta的tbs100μl进行3次溶出后的小鼠巨噬细胞培养上清样品中,添加cacl2以使终浓度成为2mm后,加入用含有1mmedta的tbs100μl进行3次溶出后的mtim4载体1mg,在室温搅拌混合1小时。然后,回收在室温搅拌混合1小时后的mtim4载体,用含有终浓度为2mmcacl2的tbs-t5ml进行3次洗涤操作后,进而用1ml进行2次洗涤操作,然后用含有1mmedta的tbs100μl进行3次溶出,得到细胞外膜囊泡组分300μl。
然后,为了更可靠地回收小鼠巨噬细胞培养上清样品中的细胞外膜囊泡,再次进行上述操作,从用含有1mmedta的tbs100μl进行6次溶出后的小鼠巨噬细胞培养上清样品中回收细胞外膜囊泡,得到细胞外膜囊泡组分300μl。
使用amiconultra-0.5ml10k离心式过滤柱,将通过上述9次溶出操作得到的细胞外膜囊泡组分共计900μl浓缩成60μl,得到电子显微镜观察用试样。
<(4)利用电子显微镜观察通过本发明的取得方法取得的细胞外膜囊泡>
使电子显微镜观察用试样10μl吸附于载网,用滤纸吸取剩余的电子显微镜观察用试样。然后,对载网进行水洗,利用醋酸铀水溶液进行2次染色后,使用透射电子显微镜,利用阴性(负)染色法进行观察。
需要说明的是,将实施例21中使用的mtim4蛋白质及载体的种类、以及用于从mtim4载体取得细胞外膜囊泡的溶出液的种类示于下表9。
表9
<结果>
将得到的电子显微镜的观察图像示于图5。根据图5,通过本发明的取得方法,能够在保持球形形状的状态下,取得直径50~150nm左右的细胞外膜囊泡。
根据上述内容可知,通过本发明的取得方法,能够在完整的状态下取得细胞外膜囊泡。
实施例22-25.利用本发明的tim4载体取得细胞外膜囊泡(本发明的取得方法)
使用将人源tim4蛋白质固定化于珠而成的载体(以下,有时简记为“htim4载体”)以及mtim4载体,取得本发明的细胞外膜囊泡。
<(1)培养上清样品的制备>
通过与实施例1-8的“(1)培养上清样品的制备”相同的方法进行。
<(2)fc标签融合tim4蛋白质的稀释>
将生物素非标记的fc标签融合人源tim4蛋白质(和光纯药工业(株)制,序列号7(在人源tim4蛋白质的n末端第25~315位的氨基酸域(基因银行:genbanknp_612388.2)融合了fc标签而成的人源tim4蛋白质))冷冻干燥品100μg溶于pbs1ml中,制作含有100μg/ml的生物素非标记的fc标签融合htim4蛋白质的pbs溶液。将含有生物素非标记的fc标签融合htim4蛋白质的pbs溶液10μl与pbs190μl混合,得到含有生物素非标记的fc标签融合htim4蛋白质1μg的pbs溶液200μl。
另外,将生物素非标记的fc标签融合小鼠源tim4蛋白质(和光纯药工业(株)制,序列号6(在小鼠源tim4蛋白质的n末端第22~279位的氨基酸域(基因银行:genbanknp_848874.3))融合了fc标签而成的mtim4蛋白质)冷冻干燥品100μg溶于pbs1ml,制作含有100μg/ml的生物素非标记的fc标签融合mtim4蛋白质的pbs溶液。将含有生物素非标记的fc标签融合mtim4蛋白质的pbs溶液10μl与pbs190μl混合,得到含有生物素非标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl。
<(3)珠的洗涤>
分别将含有30μg/μl的dynabeadsg蛋白的pbs-t溶液(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)20μl(含有dynabeadsg蛋白0.6mg)分注于2个1.5ml管(bm设备公司(ビーエム机器社)制)中,使用pbs500μl进行洗涤操作。
<(4)生物素非标记的fc标签融合tim4蛋白质固定于珠>
在含有dynabeadsg蛋白(0.6mg)的2个1.5ml管中,在其中一个中添加上述制备的含有生物素非标记的fc标签融合htim4蛋白质1μg的pbs溶液200μl的总量,在8℃进行1小时的反应,得到含有结合有生物素非标记的fc标签融合htim4蛋白质的载体(htim4载体)的pbs溶液200μl。
在剩余的一个含有dynabeadsg蛋白(0.6mg)的1.5ml管中,添加上述制备的含有生物素非标记的fc标签融合mtim4蛋白质1μg的pbs溶液200μl的总量,在8℃进行1小时反应,得到含有结合有生物素非标记的fc标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液200μl。
<(5)利用本发明的取得方法取得细胞外膜囊泡>
用pbs500μl分别对上述得到的htim4载体及mtim4载体0.6mg进行3次洗涤操作,然后,在颗粒状态的htim4载体及mtim4载体中,分别添加含有钙离子的培养上清样品200μl,在8℃分别进行3小时的反应。然后,用含有2mmcacl2的tbs-t500μl分别对反应后的htim4载体及mtim4载体进行3次洗涤操作。
进行第三次洗涤时,分别将htim4载体及mtim4载体各250μl(载体0.3mg)分注于两个1.5ml管中。在颗粒状态的mtim4载体及htim4载体各0.3mg中,添加20μl的作为溶出液的1%sds水溶液或1mmedta水溶液,然后,通过漩涡混合器在室温条件下混合10秒,停止转动(spindown)。将1.5ml管分别设置于磁力架,使用磁力使htim4载体及mtim4载体集合于管壁,分别回收上清(溶出液)。
需要说明的是,将实施例22-25中使用的tim4蛋白质及载体的种类、用于从tim4载体取得细胞外膜囊泡的溶出液的种类、以及后述蛋白质免疫印迹中的泳道号示于下表10。
表10
<(6)蛋白质免疫印迹>
使用“实施例22-25(所述(5))中得到的各上清(溶出液)7.5μl”来替代“实施例1-8中得到的各上清(溶出液)7.5μl”,除此以外,通过与实施例1-8的“(7)蛋白质免疫印迹”相同的方法进行。
<结果>
将得到的蛋白质免疫印迹的结果示于图6。图6中,各泳道如下。
泳道1:实施例22的结果(使用使生物素非标记的fc标签融合htim4蛋白质结合于g蛋白珠而成的htim4载体、并将1%sds水溶液用作溶出液时的结果);
泳道2:实施例23的结果(使用使生物素非标记的fc标签融合htim4蛋白质结合于g蛋白珠而成的htim4载体、并将1mmedta水溶液用作溶出液时的结果);
泳道3:实施例24的结果(使用使生物素非标记的fc标签融合mtim4蛋白质结合于g蛋白珠而成的mtim4载体、并将1%sds水溶液用作溶出液时的结果);
泳道4:实施例25的结果(使用使生物素非标记的fc标签融合mtim4蛋白质结合于g蛋白珠而成的mtim4载体、并将1mmedta水溶液用作溶出液时的结果)。
由图6可知,在实施例22-25中的任意实施例中,都在100kda附近观察到了作为外泌体标记物的lamp-1的条带,因此,通过本发明的取得方法,能取得含有外泌体的细胞外膜囊泡(实施例22-25:泳道1-4)。
另外可知,tim4蛋白质无论来自于何种生物物种,都能够用于本发明的tim4载体及本发明的取得方法。
实施例26-27/比较例4-9.利用tim4载体及已固定化ps蛋白质的载体取得的细胞外膜囊泡的量的比较
使用tim4载体以及将ps蛋白质(来自于人的膜粘连蛋白-5(annexinv)、来自于人的mfg-e8以及来自于小鼠的mfg-e8)分别固定化于珠而成的载体,取得本发明的细胞外膜囊泡。
<(1)含有ps蛋白质的pbs溶液的稀释>
将his标签融合人源膜粘连蛋白-5(创意生物公司(creativebiomart社)制,有时简记为“his标签融合h膜粘连蛋白-5”)20μg溶于pbs100μl中,以使其浓度成为200μg/ml,制作含有his标签融合h膜粘连蛋白-5的pbs溶液。将含有his标签融合h膜粘连蛋白-5蛋白质1μg的pbs溶液5μl与pbs195μl混合并稀释。
将his标签融合人源mfg-e8(r&d系统公司(r&dsystems社)制,有时简记为“his标签融合hmfg-e8”)50μg溶于pbs500μl中,以使其浓度成为100μg/ml,制作含有his标签融合hmfg-e8的pbs溶液。将含有his标签融合hmfg-e8蛋白质1μg的pbs溶液10μl与pbs190μl混合并稀释。将his标签融合小鼠源mfg-e8(r&d系统公司(r&dsystems社)制,有时简记为“his标签融合mmfg-e8”)50μg溶于pbs500μl中以使其浓度成为100μg/ml,制作含有his标签融合mmfg-e8的pbs溶液。将含有his标签融合小鼠源mfg-e8蛋白质1μg的pbs溶液10μl与pbs190μl混合并稀释。
<(2)抗his标签抗体固定化珠的制备>
将含有30μg/μl的dynabeadsm-270羧酸(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的溶液100μl(含有dynabeadsm-270羧酸3mg)分注于1.5ml管(bm设备公司(ビーエム机器社)制)中,使用反应缓冲液(0.1mmes,ph5.0)进行洗涤操作。
然后,加入用反应缓冲液490μl稀释的6×his抗体(和光纯药工业(株)制)溶液60μl(含有6×his抗体60μg),在室温颠倒混合30分钟,然后,加入6mg/mlwsc(同仁化学研究所制)50μl,在室温颠倒混合4小时。用tbs-t对颠倒混和后的dynabeadsm-270羧酸进行洗涤操作后,用100μlpbs进行稀释,得到抗his标签抗体固定化珠3mg。
<(3)将tim4载体及已固定化各种ps蛋白质的载体的制备>
然后,将得到的含有抗his标签抗体固定化珠的pbs溶液100μl(含有抗his标签抗体固定化珠3mg)分别以20μl(含有抗his标签抗体固定化珠0.6mg)分注于4个1.5ml管(bm设备公司(ビーエム机器社)制)中,用500μlpbs分别进行洗涤操作。
然后,在4个含有洗涤操作后的颗粒状态的抗his标签抗体固定化珠0.6mg的1.5ml管中,在其中一个中添加上述制备的含有his标签融合mtim4蛋白质的pbs溶液200μl(含有his标签融合mtim4蛋白质1μg),在8℃进行1小时反应。
在一个中添加上述制备的含有his标签融合h膜粘连蛋白-5质的pbs溶液200μl(含有1μg的his标签融合h膜粘连蛋白-5),在8℃进行1小时的反应。
在一个中添加上述制备的含有his标签融合hmfg-e8的pbs溶液200μl(含有1μg的his标签融合hmfg-e8),在8℃进行1小时的反应。
在一个中添加上述制备的含有his标签融合mmfg-e8的pbs溶液200μl(含有1μg的his标签融合mmfg-e8),在8℃进行1小时的反应。
根据上述内容,得到分别含有0.6mg的下表11所示的4种载体的pbs溶液200μl。
表11
<(4)细胞外膜囊泡的取得>
用500μl的pbs分别对上述得到的含有4种载体0.6mg的pbs溶液200μl进行3次洗涤操作后,在颗粒状态的5种载体中,分别加入通过与实施例1-8相同的方法制备的含有钙离子的培养上清样品200μl,在8℃分别进行3小时的反应。
然后,用含有2mmcacl2的tbs-t500μl分别对使含有钙离子的培养上清样品反应的4种载体进行3次洗涤操作。
在进行第三次洗涤时,分别将4种载体各250μl分注于两个1.5ml管中。在颗粒状态的4种载体各0.3mg中,添加20μl的作为溶出液的1%sds水溶液或1mmedta水溶液,然后,通过漩涡混合器,在室温10秒,停止转动(spindown)。将1.5ml管分别设置于磁力架,使用磁力使得到的4种载体集合于管壁,分别回收上清(溶出液)。
需要说明的是,将各实施例中使用的ps蛋白质及载体的种类、用于从载体取得细胞外膜囊泡的溶出液的种类、以及后述蛋白质免疫印迹中的泳道号示于下表12。
表12
<(5)蛋白质免疫印迹>
使用“实施例26-27、比较例4-9(所述(4))中得到的各上清(溶出液)7.5μl”替代“实施例1-8中得到的各上清(溶出液)7.5μl”,通过与实施例1-8的“(7)蛋白质免疫印迹”相同的方法进行。
<结果>
将得到的蛋白质免疫印迹的结果示于图7。图7中,各泳道如下。
泳道1:实施例26的结果(使用使his标签融合mtim4蛋白质结合于抗his标签抗体固定化珠而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道2:实施例27的结果(使用使his标签融合mtim4蛋白质结合于抗his标签抗体固定化珠而成的载体、并将1mmedta水溶液用作溶出液时的结果);
泳道3:比较例4的结果(使用使his标签融合h膜粘连蛋白-5结合于抗his标签抗体固定化珠而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道4:比较例5的结果(使用使his标签融合h膜粘连蛋白-5结合于抗his标签抗体固定化珠而成的载体、并将1mmedta水溶液用作溶出液时的结果);
泳道5:比较例6的结果(使用使his标签融合hmfg-e8结合于抗his标签抗体固定化珠而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道6:比较例7的结果(使用使his标签融合hmfg-e8结合于抗his标签抗体固定化珠而成的载体、并将1mmedta水溶液用作溶出液时的结果);
泳道7:比较例8的结果(使用使his标签融合mmfg-e8结合于抗his标签抗体固定化珠而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道8:比较例9的结果(使用使his标签融合mmfg-e8结合于抗his标签抗体固定化珠而成的载体、并将1mmedta水溶液用作溶出液时的结果)。
由图7可知,在实施例26-27中的任意实施例中,都在100kda附近得到作为外泌体标记物的lamp-1的条带,因此,通过本发明的取得方法,能取得含有外泌体的细胞外膜囊泡(实施例26-27:泳道1-2)。
另一方面,由图7可知,在比较例4-9中的任意比较例中,都未在100kda附近观察到lamp-1的条带,因此,对于已固定化tim4蛋白质以外的ps蛋白质(膜粘连蛋白-5、mfg-e8)的载体而言,不能取得含有外泌体的细胞外膜囊泡(比较例4-9:泳道3-8)。
实施例28-33.利用本发明的取得方法取得细胞外膜囊泡(复合体形成工序的探讨)
如下所述地分别通过本发明的取得方法取得细胞外膜囊泡。
对实施例28-29而言,在使通过与实施例13-14相同的方法制备的巯基生物素标记的flag标签融合小鼠源tim4蛋白质与本发明的载体反应后,进而加入试样,取得本发明的细胞外膜囊泡。
对于实施例30-31而言,在使通过与实施例13-14相同的方法制备的巯基生物素标记的flag标签融合小鼠源tim4蛋白质与试样反应后,进而加入本发明的载体,取得本发明的细胞外膜囊泡。
对于实施例32-33而言,同时添加通过与实施例13-14相同的方法制备的巯基生物素标记的flag标签融合小鼠源tim4蛋白质、试样以及本发明的载体,取得本发明的细胞外膜囊泡。
<珠的洗涤>
分别将含有10μg/μl的dynabeadsm-270链霉亲和素c1珠(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs溶液60μl(含有dynabeadsm-270链霉亲和素c1珠0.6mg)分注于3个1.5ml管(bm设备公司(ビーエム机器社)制)中,用pbs500μl分别进行洗涤操作。
通过与实施例13-14相同的方法,对含有his标签融合mtim4蛋白质的pbs溶液270μl(含有his标签融合mtim4蛋白质50μg)进行生物素标记,得到含有巯基生物素标记的flag标签融合mtim4蛋白质39.2μg的pbs溶液200μl。在得到的含有巯基生物素标记的flag标签融合mtim4蛋白质1μg的pbs溶液5.1μl中,加入pbs溶液194.9μl,得到含有巯基生物素标记的flag标签融合mtim4蛋白质1μg的pbs溶液200μl。
<使巯基生物素标记的flag标签融合mtim4蛋白质与本发明的载体反应后、进而使本发明的试样中的细胞外膜囊泡与其反应的情况(实施例28-29)>
在含有经洗涤操作后的颗粒状的dynabeadsm-270链霉亲和素c1珠0.6mg的1.5ml管中,加入含有巯基生物素标记的flag标签融合mtim4蛋白质1μg的pbs溶液200μl,使dynabeadsm-270链霉亲和素c1珠与巯基生物素标记的flag标签融合mtim4蛋白质接触,在8℃反应1小时,得到mtim4载体。然后,用pbs500μl对得到的mtim4载体进行3次洗涤操作,在含有该洗涤后的mtim4载体0.6mg的1.5ml管中,加入通过与实施例1相同的方法制备的含有钙离子的培养上清样品200μl,使其在8℃进行3小时的反应。然后,用添加有终浓度为2mmcacl2的tbs-t500μl对使含有钙离子的培养上清样品反应而得的mtim4载体进行三次洗涤操作。在第三次洗涤时,分别将mtim4载体各250μl分注于2个1.5ml管中。在颗粒状态的mtim4载体各0.3mg中添加20μl的作为溶出液的1%sds水溶液或1mmedta水溶液,然后,通过漩涡混合器在室温混合10秒,停止转动(spindown)。将1.5ml管分别设置于磁力架,用磁力使mtim4载体集合于管壁,分别回收上清(溶出液)。
<使巯基生物素标记的flag标签融合mtim4蛋白质与本发明的试样反应后、进而使本发明的载体与其反应的情况(实施例30-31)>
将通过与实施例1相同的方法制备的含有钙离子的培养上清样品200μl分注于1.5ml管中,加入含有巯基生物素标记的flag标签融合mtim4蛋白质1μg的pbs溶液5.1μl,使含有钙离子的培养上清样品中的细胞外膜囊泡与巯基生物素标记的flag标签融合mtim4蛋白质接触,在8℃进行3小时反应。
在含有经洗涤操作的颗粒状的dynabeadsm-270链霉亲和素c1珠0.6mg的1.5ml管中,添加使含有钙离子的培养上清样品中的细胞外膜囊泡与巯基生物素标记的flag标签融合mtim4蛋白质在8℃进行3小时反应而得的溶液,在8℃进行1小时的反应,得到细胞外膜囊泡与mtim4载体的复合体。然后,用添加有终浓度为2mmcacl2的tbs-t500μl对得到的细胞外膜囊泡与mtim4载体的复合体进行3次洗涤操作。在进行第三次洗涤时,分别将细胞外膜囊泡与mtim4载体的复合体各250μl分注于2个1.5ml管中。在颗粒状态的细胞外膜囊泡与mtim4载体的复合体各0.3mg中,添加20μl的作为溶出液的1%sds水溶液或1mmedta水溶液,然后,通过漩涡混合器在室温混合10秒,停止转动(spindown)。将1.5ml管分别设置于磁力架,用磁力使mtim4载体集合于管壁,分别回收上清(溶出液)。
<使巯基生物素标记的flag标签融合mtim4蛋白质、本发明的试样、以及本发明的载体同时反应的情况(实施例32-33)>
在含有经洗涤操作的颗粒状的dynabeadsm-270链霉亲和素c1珠0.6mg的1.5ml管中,加入通过与实施例1相同的方法制备的含有钙离子的培养上清样品200μl、以及含有巯基生物素标记的flag标签融合mtim4蛋白质1μg的pbs溶液5.1μl,在8℃进行4小时的反应。用添加有终浓度为2mmcacl2的tbs-t500μl对反应后的颗粒状的dynabeadsm-270链霉亲和素c1珠进行3次洗涤操作。在进行第三次洗涤时,分别将mtim4载体各250μl分注于2个1.5ml管中,在mtim4载体各0.3mg中,添加20μl的作为溶出液的1%sds水溶液或1mmedta水溶液,然后,通过漩涡混合器在室温混合10秒,停止转动(spindown)。将1.5ml管分别设置于磁力架,用磁力使dynabeadsm-270链霉亲和素c1珠集合于管壁,分别回收上清(溶出液)。
需要说明的是,将各实施例中使载体、mtim4蛋白质、含有钙离子的培养上清样品进行接触的顺序、以及用于从载体取得细胞外膜囊泡的溶出液的种类示于下表13。
表13
<蛋白质免疫印迹>
使用“实施例28-33中得到的各上清(溶出液)7.5μl”,替代“实施例1-8中得到的各上清(溶出液)7.5μl”,除此以外,通过与实施例1-8的“(7)蛋白质免疫印迹”相同的方法进行。
<结果>
将得到的蛋白质免疫印迹的结果分别示于图8中。图8中,各泳道如下。
泳道1:实施例28的结果(通过使载体与mtim4蛋白质接触后、进而使其与钙离子细胞培养上清样品接触的方法取得细胞外膜囊泡、并将1%sds水溶液用作溶出液时的结果);
泳道2:实施例29的结果(通过使载体与mtim4蛋白质接触后、进而使其与钙离子细胞培养上清样品接触的方法取得细胞外膜囊泡、并将1mmedta水溶液用作溶出液时的结果);
泳道3:实施例30的结果(通过使mtim4蛋白质与钙离子细胞培养上清样品接触后、进而使其与载体接触的方法取得细胞外膜囊泡、并将1%sds水溶液用作溶出液时的结果);
泳道4:实施例31的结果(通过使mtim4蛋白质与钙离子细胞培养上清样品接触后、进而使其与载体接触的方法取得细胞外膜囊泡、并将1mmedta水溶液用作溶出液时的结果);
泳道5:实施例32的结果(通过使载体与钙离子细胞培养上清样品以及mtim4蛋白质同时接触的方法取得细胞外膜囊泡、并将1%sds水溶液用作溶出液时的结果);
泳道6:实施例33的结果(通过使载体与钙离子细胞培养上清样品以及mtim4蛋白质同时接触的方法取得细胞外膜囊泡、并将1mmedta水溶液用作溶出液时的结果)。
根据图8,在实施例28-33中的任意实施例中,都在100kda附近得到作为外泌体标记物的lamp-1的条带(实施例28-33:泳道1-6)。
另外,根据实施例28-33的结果可知,对于使结合于载体的tim4蛋白质与试样中的细胞外膜囊泡的复合体形成的工序(复合体形成工序)而言,与本发明的tim4蛋白质和本发明的载体以及试样中的细胞外膜囊泡的接触顺序无关,作为结果,只要形成结合于载体的mtim4蛋白质与试样中的细胞外膜囊泡的复合体即可。
实施例34-35/比较例10-13本发明的取得方法与现有方法的比较
如下所述,通过利用sds溶出的本发明的取得方法(实施例34)、利用edta溶出的本发明的取得方法(实施例35)、抗cd63抗体固定化法(比较例10-11)、外泌体-人cd63分离/检测(exosome-humancd63isolation/detection)(比较例12-13),取得细胞外膜囊泡。
<tim4蛋白质固定于载体>
将含有10μg/μl的dynabeadsm-270链霉亲和素(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的溶液15μl(含有1×107个dynabeadsm-270链霉亲和素)分注于1.5ml管(bm设备公司(ビーエム机器社)制)中,用pbs进行洗涤操作。
然后,在含有洗涤操作后的dynabeadsm-270链霉亲和素的1.5ml管中,加入通过与实施例11-12相同的方法制备的含有巯基生物素标记的flag标签融合小鼠源tim4蛋白质0.25μg的pbs溶液200μl的总量,在冷藏条件下进行1小时反应,得到含有mtim4载体的pbs溶液。
<抗cd63抗体(h5c6)固定化载体的制备>
将含有30μg/μl的dynabeadsm-270羧酸(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的溶液50μl(含有1×108个dynabeadsm-270羧酸)分注于1.5ml管(bm设备公司(ビーエム机器社)制)中,用反应缓冲液(0.1mmes,ph5.0)进行洗涤操作。
另外一方面,用反应缓冲液(0.1mmes,ph5.0)490μl,对抗cd63抗体(h5c6)(bdpharmingen公司制)30g(60μl)进行稀释,得到反应缓冲液稀释抗cd63抗体溶液。
然后,在含有洗涤操作后的dynabeadsm-270羧酸的1.5ml管中,加入所述反应缓冲液稀释抗cd63抗体溶液550μl,在室温颠倒混合30分钟。然后,进一步加入3mg/mlwsc(同仁化学研究所社制)50μl,在室温颠倒混合4小时,用tbs-t进行洗涤操作后,用50μlpbs进行稀释,得到含有抗cd63抗体(h5c6)载体的pbs溶液。
根据上述内容,得到下表14所示的2种载体。
表14
<利用本发明的取得方法取得细胞外膜囊泡>
在用pbs500μl对上述得到的含有mtim4载体的pbs溶液200μl(含有1×107个mtim4载体)进行3次洗涤操作后,在颗粒状态的mtim4载体中,加入通过与实施例1-8相同的方法制备的含有钙离子的培养上清样品50μl,在8℃进行3小时反应。
然后,用含有2mmcacl2的tbs-t500μl对反应后的mtim4载体进行3次洗涤操作。在第三次洗涤时,分别将mtim4载体各250μl分注于2个1.5ml管中。在颗粒状态的mtim4载体各0.3mg中,分别加入20μl的作为溶出液的1%sds水溶液以及1mmedta水溶液,然后,通过漩涡混合器在室温混合10秒,停止转动(spindown)。将1.5ml管分别设置于磁力架,用磁力使mtim4载体集合于管壁,回收上清(溶出液)。
<利用抗cd63抗体固定化法取得细胞外膜囊泡>
使用“含有抗cd63抗体(h5c6)载体的pbs溶液5μl(含有载体1×107个)”替代“含有mtim4载体的pbs溶液200μl”,除此以外,通过与所述<利用本发明的取得方法取得细胞外膜囊泡>相同的方法,取得含有钙离子的培养上清样品中的细胞外膜囊泡,通过1%sds水溶液或1mmedta水溶液使细胞外膜囊泡溶出,回收上清(溶出液)。
<利用外泌体-人cd63分离/检测(exosome-humancd63isolation/detection)取得细胞外膜囊泡>
使用“外泌体-人cd63分离/检测(exosome-humancd63isolation/detection)(赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)1ml(含有载体1×107个)”替代“含有mtim4载体的pbs溶液200μl”,除此以外,通过与所述<利用本发明的取得方法取得细胞外膜囊泡>相同的方法,取得含有钙离子的培养上清样品中的细胞外膜囊泡,通过1%sds水溶液或1mmedta水溶液使细胞外膜囊泡溶出,回收上清(溶出液)。
需要说明的是,将各实施例、比较例中使用的载体的种类、用于从载体取得细胞外膜囊泡的溶出液的种类、以及后述蛋白质免疫印迹中的泳道号示于下表15。
表15
<蛋白质免疫印迹>
使用“实施例34-35、比较例10-13中得到的各上清(溶出液)7.5μl”替代“实施例1-8中得到的各上清(溶出液)7.5μl”,除此以外,通过与实施例1-8的“(7)蛋白质免疫印迹”相同的方法进行。
<结果>
将得到的蛋白质免疫印迹的结果示于图9。图9中,各泳道如下。
泳道1:实施例34的结果(利用本发明的取得方法取得细胞外膜囊泡、并将1%sds水溶液用作溶出液时的结果);
泳道2:实施例35的结果(利用本发明的取得方法取得细胞外膜囊泡、并将1mmedta水溶液用作溶出液时的结果);
泳道3:比较例10的结果(利用抗cd63抗体法取得细胞外膜囊泡、并将1%sds水溶液用作溶出液时的结果);
泳道4:比较例11的结果(利用抗cd63抗体法取得细胞外膜囊泡、并将1mmedta水溶液用作溶出液时的结果);
泳道5:比较例12的结果(利用外泌体-人cd63分离/检测(exosome-humancd63isolation/detection)取得细胞外膜囊泡、并将1%sds水溶液用作溶出液时的结果);
泳道6:比较例13的结果(利用外泌体-人cd63分离/检测(exosome-humancd63isolation/detection)取得细胞外膜囊泡、并将1mmedta水溶液用作溶出液时的结果)。
根据图9,在利用本发明的取得方法取得细胞外膜囊泡的实施例34-35中,在25-60kda附近得到作为外泌体标记物之一的cd63的条带(实施例34-35:泳道1-2)。
另一方面,根据图9,在利用抗cd63抗体法取得细胞外膜囊泡的比较例10-11以及利用外泌体-人cd63分离/检测(exosome-humancd63isolation/detection)取得细胞外膜囊泡的比较例12-13中,在25-60kda附近仅得到较浅的cd63的条带(比较例10-13:泳道3-6)。
根据上述内容可知,与抗cd63抗体法、外泌体-人cd63分离/检测(exosome-humancd63isolation/detection)等的、使用针对细胞外膜囊泡的表面抗原蛋白质的抗体并通过该表面抗原蛋白质与抗体的亲和力而取得细胞外膜囊泡的方法相比,通过本发明的取得方法能回收更多的细胞外膜囊泡。
实施例36-38.利用本发明的取得方法从超速离心分离处理后的试样中取得残留的细胞外膜囊泡
如下所述地,对于通过作为现有方法的超速离心分离法(以下,有时简记为超速离心分离处理)除去并取得细胞外膜囊泡后的试样,实施本发明的取得方法。
<(1)利用超速离心分离法除去细胞外膜囊泡>
对fbs(康宁公司(corning社)制)15ml进行离心分离处理(10000×g,20分钟),分离杂质,将上清移至新的管中,得到离心分离处理后的fbs。然后,分别对得到的离心分离处理后的fbs各5ml进行超速离心分离处理(110000×g,一夜)或超速离心分离处理(450000×g,一夜),将上清移至新的管中,得到超速离心分离处理(110000×g)后的fbs以及超速离心分离处理(450000×g)后的fbs各5ml。
<(2)珠的洗涤>
分别将含有10μg/μl的dynabeadsmyone链霉亲和素c1珠(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs溶液180μl(含有1.8mg的dynabeadsmyone链霉亲和素c1珠)分注于3个管中。然后,将pbs1500μl分别添加至各管中,搅拌后,将管分别设置于磁力架,用磁力使dynabeadsmyone链霉亲和素c1珠集合于管壁,用移液器丢弃管内的溶液(以下,有时简记为洗涤操作)。
<(3)将fc标签融合小鼠源tim4蛋白质固定于珠>
在洗涤操作后的颗粒状态的1.8mg的dynabeadsmyone链霉亲和素c1珠中,分别添加含有巯基生物素标记的fc标签融合小鼠源tim4蛋白质3μg的pbs溶液1500μl,在8℃反应10分钟,分别得到含有结合有巯基生物素标记的fc标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液1500μl。
<(4)利用本发明的取得方法取得细胞外膜囊泡>
用pbs1500μl对得到的mtim4载体1.8mg分别进行3次洗涤操作,得到颗粒状态的mtim4载体。然后,分别将离心分离处理后的fbs、超速离心分离处理(110000×g)后的fbs、以及超速离心分离处理(450000×g)后的fbs各5ml分注于3个15ml离心分离管(康宁公司(corning社)制)中,添加颗粒状态的mtim4载体1.8mg,在8℃进行2小时反应。反应后,将15ml离心分离管分别设置于磁力架,用磁力使mtim4载体集合于管壁,将各上清(各fbs)分别回收至新的15ml离心分离管中。在用含有2mmcacl2的tbs-t(tris缓冲液,0.0005%吐温20(tween20),2mmcacl2)3ml分别对残留于离心分离管的颗粒状态的mtim4载体进行洗涤操作后,在颗粒状态的mtim4载体中分别添加含有2mmcacl2的tbs-t1ml,进行悬浮,将全部悬浮液移至1.5ml管中后,分别进行2次洗涤操作。
在颗粒状态的mtim4载体1.8mg中,分别添加作为溶出液的含有1mmedta的tbs溶液50μl,然后,通过漩涡混合器在室温混合10秒,停止转动(spindown)。将1.5ml管分别设置于磁力架,用磁力使mtim4载体集合于管壁,回收溶出液。再次添加含有1mmedta的tbs溶液50μl,使用上述使用的mtim4载体,采用同样的方法回收溶出液。
然后,将两次回收溶出液时使用的珠再次添加于已回收至15ml离心分离管的各上清(各fbs)中,通过与上述相同的方法,进一步重复两次回收各上清(各fbs)中的细胞外膜囊泡的操作,分别得到各溶出液。
<(5)蛋白质免疫印迹>
使用vivaspin500(mvco10000)(商品名,赛多利斯公司(ザルトリウス社)制)对得到的各溶出液100μl进行超滤,以使其成为30μl。在超滤后的各溶出液15μl中,加入4×试样用缓冲液(和光纯药工业(株)制)5μl,在98℃进行5分钟加热,得到蛋白质免疫印迹用各试样。在supersepace5-20%凝胶(商品名,和光纯药工业(株)制)中,加入该蛋白质免疫印迹用各试样20μl,以25ma进行65分钟电泳。使用半干印迹仪与不连续缓冲液(阳极缓冲液1:0.3mtris/20%甲醇;阳极缓冲液2:0.025mtris/20%甲醇;阴极缓冲液:0.025mtris/0.04m氨基己酸/20%甲醇),在1ma/cm2的条件下,将得到的电泳凝胶转印至pvdf膜(密里博公司(millipore社)制)60分钟。在转印后的pvdf膜中,加入用pbs-t(pbs缓冲液,0.1%吐温20(tween20))稀释的3%脱脂奶,在室温条件下反应1小时,进行封闭,将用pbs-t稀释1000倍的抗牛cd9抗体(诺夫斯生物公司(novusbiologicals社)制,以下有时简记为“抗牛cd9抗体”)2ml在室温条件下反应1小时。用pbs-t将反应后的pvdf膜洗涤3次,将用pbs-t稀释10000倍的次级抗体{抗小鼠igg(h+l)、兔、igg组分、过氧化物酶结合抗体}(和光纯药工业(株)制)在室温条件下进行1小时的反应。用pbs-t洗涤5次后,在使抗牛cd9抗体反应后的膜上添加immunostarbasic(商品名,和光纯药工业(株)制),在使抗浮舰蛋白-2抗体反应后的膜上添加immunostarzeta(商品名,和光纯药工业(株)制),使用las-4000(商品名,通用电气公司(ge社)制)检测发光信号。需要说明的是,抗牛cd9抗体与抗浮舰蛋白-2抗体是分别识别作为外泌体的标记蛋白质的cd9和浮舰蛋白-2(flotillin-2)的抗体。
<(6)平均粒子数及平均粒子尺寸的测定>
用离心过滤器(0.45μm,pvdf)(密里博公司(millipore社)制)对得到的各溶出液100μl进行处理后,用水稀释5倍,使用nanosightlm10(商品名,nanosight公司制),依照nanosight公司的使用说明书,对稀释液中所含的粒子各进行3次测定,检测平均粒子数(particles)和平均粒子尺寸(meansize)。
需要说明的是,对于各实施例中使用的试样的处理方法、试样中残留的细胞外膜囊泡的取得方法等,示于下表16中。
表16
<结果>
将得到的蛋白质免疫印迹的结果示于图10,将利用nanosight测定的平均粒子数及平均粒子尺寸的结果示于表17。图10中,各泳道为下述结果。
泳道1:实施例36的结果(对试样进行离心分离处理、利用本发明的取得方法取得细胞外膜囊泡时的结果);
泳道2:实施例37的结果(对试样进行离心分离处理、以110000×g进行超速离心分离处理后、利用本发明的取得方法取得细胞外膜囊泡时的结果);
泳道3:实施例38的结果(对试样进行离心分离处理、以450000×g进行超速离心分离处理后、利用本发明的取得方法取得细胞外膜囊泡时的结果)。
根据图10可知,对试样进行离心分离处理、以110000×g或450000×g进行超速离心分离处理后、利用本发明的取得方法取得细胞外膜囊泡时(实施例37-38),也确认了作为外泌体标记物的cd9与浮舰蛋白-2的条带,通过超速离心分离处理不能完全除去(取得)试样中所含的细胞外膜囊泡,试样中残留有大量的细胞外膜囊泡(实施例37-38:泳道2-3)。进一步地可知,通过本发明的取得方法,能够取得(除去)通过所述超速离心分离法不能完全除去(取得)且残留于试样中的细胞外膜囊泡(实施例37-38:泳道2-3)。
根据表17,对试样进行离心分离处理、以110000×g或450000×g进行超速离心分离处理后、利用本发明的取得方法取得细胞外膜囊泡时(实施例37-38)、以及对试样进行离心分离处理后、利用本发明的取得方法取得细胞外膜囊泡时(实施例36),取得的细胞外膜囊泡的尺寸(粒径)几乎相同。因此,通过超速离心分离法不能完全除去的、残留于试样中的细胞外膜囊泡没有形成碎片,而作为粒子存在。
表17
实施例39-40.利用本发明的取得方法从总外泌体分离(totalexosomeisolation)(聚合物沉淀)处理后的试样中取得残留细胞外膜囊泡
如下所述地,对于通过利用作为现有方法的总外泌体分离(totalexosomeisolation(聚合物沉淀))进行除去(以下,有时简记为“聚合物沉淀处理”)试样中所含的细胞外膜囊泡从而除去(取得)细胞外膜囊泡后的试样,实施本发明的取得方法。
<(1)利用总外泌体分离(totalexosomeisolation)(聚合物沉淀)法除去细胞外膜囊泡>
对fbs(康宁公司(corning社)制)10ml进行离心分离处理(10000×g,20分钟),分离杂质,得到离心分离处理后的fbs。然后,在得到的离心分离处理后的fbs5ml中,添加总外泌体分离(totalexosomeisolation)试剂(来自血清)(赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)1ml,在冷藏条件下静置30分钟,进行离心分离处理(10000×g,20分钟),回收上清,得到总外泌体分离(totalexosomeisolation)处理后的fbs6ml。
<(2)珠的洗涤>
分别将含有10μg/μl的dynabeadsmyone链霉亲和素c1珠(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs溶液180μl(含有1.8mg的dynabeadsmyone链霉亲和素c1珠)分注于2个管中。然后,在管中分别添加pbs1500μl,进行搅拌,然后,将管分别设置于磁力架,用磁力使dynabeadsmyone链霉亲和素c1珠集合于管壁,用移液器丢弃管内的溶液(以下,有时简记为洗涤操作)。
<(3)fc标签融合小鼠源tim4蛋白质固定于珠>
在洗涤操作后的颗粒状态的1.8mg的dynabeadsmyone链霉亲和素c1珠中,添加通过与实施例5-8相同的方法制备的含有巯基生物素标记的fc标签融合小鼠源tim4蛋白质3μg的pbs溶液1500μl,在8℃反应10分钟,分别得到含有结合有巯基生物素标记的fc标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液1500μl。
<(4)利用本发明的取得方法取得细胞外膜囊泡>
用pbs1500μl分别对得到的mtim4载体1.8mg进行3次洗涤操作,得到颗粒状态的mtim4载体。然后,在已分注于15ml离心分离管(康宁公司(corning社)制)中的离心分离处理后的fbs5ml或总外泌体分离(totalexosomeisolation)处理后的fbs6ml中,分别添加颗粒状态的mtim4载体各1.8mg,在8℃进行2小时反应。
反应后,将15ml离心分离管分别设置于磁力架,用磁力使小鼠源tim4载体集合于管壁,将各上清(各fbs)分别回收于新的15ml离心分离管。用含有2mmcacl2的tbs-t(tris缓冲液,0.0005%吐温20(tween20),2mmcacl2)3ml分别对残留于离心分离管的颗粒状态的mtim4载体进行洗涤操作,然后,在颗粒状态的mtim4载体中分别添加1ml的含有2mmcacl2的tbs-t进行悬浮,将悬浮液全部移至1.5ml管中后,分别进行2次洗涤操作。
在颗粒状态的各mtim4载体1.8mg中,分别添加作为溶出液的含有1mmedta的tbs溶液50μl,然后,通过漩涡混合器在室温混合10秒,停止转动(spindown)。将1.5ml管分别设置于磁力架,用磁力使mtim4载体集合于管壁,回收溶出液。再次添加含有1mmedta的tbs溶液50μl,使用上述使用的mtim4载体,采用相同的方法回收溶出液。
然后,在已回收于15ml离心分离管中的各上清(各fbs)中,再次添加两次回收溶出液时使用的mtim4载体(珠),进一步地,采用与上述相同的方法,重复两次回收各上清(各fbs)中的细胞外膜囊泡的操作,得到各溶出液。
<(5)蛋白质免疫印迹>
使用vivaspin500(mvco10000)(商品名,赛多利斯公司(ザルトリウス社)制)对得到的各溶出液300μl进行超滤,以使其成为30μl。在超滤后的各溶出液30μl中,添加4×试样用缓冲液(和光纯药工业(株)制)10μl,在98℃加热5分钟,得到蛋白质免疫印迹用各试样。在supersepace5-20%凝胶(商品名,和光纯药工业(株)制)中,将该蛋白质免疫印迹用各试样20μl分别添加于两处位置,以25ma进行65分钟电泳。使用半干印迹仪和不连续缓冲液(阳极缓冲液1:0.3mtris/20%甲醇;阳极缓冲液2:0.025mtris/20%甲醇;阴极缓冲液:0.025mtris/0.04m氨基己酸/20%甲醇),在1ma/cm2的条件下,将得到的电泳凝胶转印至pvdf膜(密里博公司(millipore社)制)60分钟。在转印后的pvdf膜中,添加用pbs-t(pbs缓冲液,0.1%吐温20(tween20))稀释的3%脱脂奶,在室温条件下反应1小时,进行封闭,将用pbs-t稀释1000倍的抗牛cd9抗体(novusbiologicals公司制,以下有时简记为“抗牛cd9抗体”)2ml或用pbs-t稀释250倍的抗人浮舰蛋白-2抗体(bd生物科学公司(bdbiosciences社)制,以下有时简记为“抗人浮舰蛋白-2抗体”)在室温条件下反应1小时。用pbs-t将反应后的pvdf膜洗涤3次,将用pbs-t稀释10000倍的次级抗体{抗小鼠igg(h+l)、兔、igg组分、过氧化物酶结合抗体}(和光纯药工业(株)制)在室温条件下反应1小时。用pbs-t洗涤5次后,在使抗牛cd9抗体反应后的膜上添加immunostarbasic(商品名,和光纯药工业(株)制),在使抗浮舰蛋白-2抗体反应后的膜上添加immunostarzeta(商品名,和光纯药工业(株)制),使用las-4000(商品名,通用电气公司(ge社)制)检测发光信号。需要说明的是,抗牛cd9抗体是针对作为外泌体的标记蛋白质之一的cd9的抗体,抗人浮舰蛋白-2抗体是针对作为外泌体的标记蛋白质之一的浮舰蛋白-2的抗体。
需要说明的是,对于各实施例中使用的试样的处理方法、试样中残留的细胞外膜囊泡的取得方法以及蛋白质免疫印迹中的泳道号,示于下表18中。
表18
<结果>
将得到的蛋白质免疫印迹的结果示于图11。图11中,各泳道表示以下的结果。
泳道1:实施例39的结果(对试样进行离心分离处理后、利用本发明的取得方法取得细胞外膜囊泡时的结果);
泳道2:实施例40的结果(对试样进行离心分离处理、聚合物沉淀处理后、利用本发明的取得方法取得细胞外膜囊泡时的结果)。
根据图11可知,对试样进行离心分离处理、聚合物沉淀后、利用本发明的取得方法取得细胞外膜囊泡时(实施例40),也确认了作为外泌体标记物的cd9和浮舰蛋白-2的条带,因此,通过总外泌体分离(totalexsomeisolation)(聚合物沉淀)法不能完全除去(取得)试样中所含的细胞外膜囊泡,试样中残留大量的细胞外膜囊泡(实施例40:泳道2)。
进而可知,利用本发明的取得方法,能取得通过总外泌体分离(totalexsomeisolation)(聚合物沉淀)法不能完全除去(取得)的残留于试样中的细胞外膜囊泡(实施例40:泳道2)。
实施例41-47.利用本发明的除去方法和/或现有方法(超速离心分离法、总外泌体分离(totalexsomeisolation)(聚合物沉淀)法)从试样中取得(除去)细胞外膜囊泡
如下所述,利用本发明的除去方法和/或现有方法(超速离心分离法、总外泌体分离(totalexsomeisolation)(聚合物沉淀)法),从试样中取得(除去)细胞外膜囊泡。
<(1)利用超速离心分离法除去细胞外膜囊泡>
对fbs(康宁公司(corning社)制)28ml进行离心分离处理(10000×g,20分钟),分离杂质,得到离心分离处理后的fbs(以下,有时简记为“除去试样1”)。然后,对得到的离心分离处理后的fbs(“除去试样1”)12ml进行超速离心分离处理(110000×g,一夜),得到超速离心分离处理(110000×g)后的fbs(以下,有时简记为“除去试样2”)。
<(2)利用总外泌体分离(totalexsomeisolation)(聚合物沉淀)法除去细胞外膜囊泡>
然后,在离心分离处理后的fbs(“除去试样1”)8ml中,添加总外泌体分离(totalexosomeisolation)(来自血清)试剂(赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)1.6ml,在冷藏条件下分别静置30分钟,进行离心分离处理(10000×g,20分钟),分别回收上清,得到总外泌体分离(totalexosomeisolation)处理后的fbs(以下,有时简记为“除去试样3”)9.6ml。
另外,在超速离心分离处理(110000×g)后的fbs(“除去试样2”)4ml中,添加总外泌体分离(totalexosomeisolation)试剂0.8ml,在冷藏条件下分别静置30分钟,进行离心分离处理(10000×g,20分钟),分别回收上清,得到超速离心分离处理(110000×g)/总外泌体分离(totalexosomeisolation)处理后的fbs(以下,有时简记为“除去试样4”)4.8ml。
<(3)珠的洗涤>
分别将含有10μg/μl的dynabeadsmyone链霉亲和素c1珠(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs溶液240μl(含有2.4mg的dynabeadsmyone链霉亲和素c1珠)分注于3个管中。然后,在管中分别加入pbs2000μl,搅拌后,将管分别设置于磁力架,用磁力使dynabeadsmyone链霉亲和素c1珠集合于管壁,用移液器丢弃管内的溶液(以下,有时简记为“洗涤操作”)。
<(4)fc标签融合小鼠源tim4蛋白质固定于珠>
在洗涤操作后的颗粒状态的2.4mg的dynabeadsmyone链霉亲和素c1珠中,分别添加含有巯基生物素标记的fc标签融合小鼠源tim4蛋白质4μg的pbs溶液2000μl,在8℃进行10分钟的反应,分别得到含有结合有巯基生物素标记的fc标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液2000μl。
<(5)细胞外膜囊泡的除去>
用pbs2000μl分别对得到的mtim4载体2.4mg进行3次洗涤操作,分别得到颗粒状的mtim4载体。
然后,分别将离心分离处理后的fbs(“除去试样1”)或超速离心分离处理(110000×g)后的fbs(“除去试样2”)4ml、总外泌体分离(totalexosomeisolation)处理后的fbs(“除去试样3”)4.8ml分注于管中,分别在8℃进行1小时的反应。反应后,将管分别设置于磁力架,用磁力使mtim4载体集合于管壁,将各上清(各fbs)分别回收于新的管中。
用tbs-t(tris缓冲液,0.0005%吐温20(tween20))4ml对残留于管中的颗粒状态的mtim4载体分别进行3次洗涤操作,分别再次添加各上清(各fbs),分别重复从反应至洗涤为止的操作共计5次。第五次反应后,将各上清(各fbs)移至新的管中进行离心分离处理(10000×g,20分钟),回收上清,得到超速离心分离处理(110000×g)/tim4处理后的fbs(以下,有时简记为“除去试样5”)4ml、总外泌体分离(totalexosomeisolation)处理/tim4处理后的fbs(以下,有时简记为“除去试样6”)4.8ml、tim4处理后的fbs(以下,有时简记为“除去试样7”)4ml。
<(6)利用本发明的取得方法取得细胞外膜囊泡>
通过与所述方法相同的方法,重新准备7份的mtim4载体0.6mg,分别进行洗涤操作。将下表19中记载的规定的除去试样,以除去试样添加于小鼠源tim4载体的量分别添加于颗粒状态的mtim4载体0.6mg中,在8℃分别进行3小时的反应。
表19
反应后,将1.5ml管分别设置于磁力架,用磁力使mtim4载体集合于管壁,回收各上清(各fbs),得到颗粒状态的mtim4载体。
用含有2mmcacl2的tbs-t(tris缓冲液,0.0005%吐温20(tween20),2mmcacl2)1ml分别对得到的颗粒状态的mtim4载体进行3次洗涤操作,然后,在颗粒状态的各mtim4载体0.6mg中,分别添加作为溶出液的含有1mmedta的tbs溶液50μl,通过漩涡混合器在室温混合10秒,停止转动(spindown)。将1.5ml管分别设置于磁力架,用磁力使mtim4载体集合于管壁,分别回收溶出液。再次添加50μl的含有1mmedta的tbs溶液,采用相同的方法分别回收溶出液。
<(7)蛋白质免疫印迹>
在得到的各溶出液中,以使100μl成为30μl的方式,使用vivaspin500(mvco10000)(商品名,赛多利斯公司(ザルトリウス社)制)进行超滤。在超滤后的各溶出液30μl中,加入4×试样用缓冲液(和光纯药工业(株)制)10μl,在98℃加热5分钟,得到蛋白质免疫印迹用各试样。在supersepace5-20%凝胶(商品名,和光纯药工业(株)制)中,分别将该蛋白质免疫印迹用各试样20μl添加于两个位置,以25ma进行65分钟的电泳。使用半干印迹仪与不连续缓冲液(阳极缓冲液1:0.3mtris/20%甲醇;阳极缓冲液2:0.025mtris/20%甲醇;阴极缓冲液:0.025mtris/0.04m氨基己酸/20%甲醇),在1ma/cm2的条件下,将得到的电泳凝胶转印至pvdf膜(密里博公司(millipore社)制)60分钟。在转印后的pvdf膜上添加用pbs-t(pbs缓冲液,0.1%吐温20(tween20))稀释的3%脱脂奶,在室温条件下反应1小时,进行封闭,将用pbs-t稀释1000倍的抗牛cd9抗体(诺夫斯生物公司(novusbiologicals社)制,以下有时简记为“抗牛cd9抗体”)2ml或用pbs-t稀释250倍的抗人浮舰蛋白-2抗体(bd生物科学公司(bdbiosciences社)制,以下有时简记为“抗人浮舰蛋白-2抗体”)在室温条件下反应1小时。用pbs-t将反应后的pvdf膜洗涤3次,将用pbs-t稀释10000倍的次级抗体{抗小鼠igg(h+l)、兔、igg组分、过氧化物酶结合抗体}(和光纯药工业(株)制)在室温条件下反应1小时。用pbs-t洗涤5次后,在使抗牛cd9抗体反应后的膜上添加immunostarbasic(商品名,和光纯药工业(株)制),在使抗浮舰蛋白-2抗体反应后的膜上添加immunostarzeta(商品名,和光纯药工业(株)制),用las-4000(商品名,通用电气公司(ge社)制)检测发光信号。需要说明的是,抗牛cd9抗体是针对作为外泌体的标记蛋白质之一的cd9的抗体,抗人浮舰蛋白-2抗体是针对作为外泌体的标记蛋白质之一的浮舰蛋白-2的抗体。
需要说明的是,将各实施例中使用的试样的处理方法、残留于试样中的细胞外膜囊泡的取得(除去)方法、以及后述蛋白质免疫印迹中的泳道号等示于下表20。
表20
<结果>
将得到的蛋白质免疫印迹的结果示于图12。图12中,各泳道表示以下的结果。
泳道1:实施例41的结果(在对试样进行离心分离处理、超速离心分离处理、进一步地采用本发明的除去方法进行处理后、利用本发明的取得方法取得细胞外膜囊泡时的结果);
泳道2:实施例42的结果(在对试样进行离心分离处理、聚合物沉淀处理、进一步地采用本发明的除去方法进行处理后、利用本发明的取得方法取得细胞外膜囊泡时的结果);
泳道3:实施例43的结果(在对试样进行离心分离处理、超速离心分离处理、进一步地进行聚合物沉淀处理后、利用本发明的取得方法取得细胞外膜囊泡时的结果);
泳道4:实施例44的结果(对试样进行离心分离处理、超速离心分离处理、利用本发明的取得方法取得细胞外膜囊泡时的结果);
泳道5:实施例45的结果(对试样进行离心分离处理、聚合物沉淀处理、利用本发明的取得方法取得细胞外膜囊泡时的结果);
泳道6:实施例46的结果(在对试样进行离心分离处理、采用本发明的除去方法进行处理后、利用本发明的取得方法取得细胞外膜囊泡时的结果);
泳道7:实施例47的结果(在对试样进行离心分离处理后、利用本发明的取得方法取得细胞外膜囊泡时的结果)。
根据图12可知,采用作为现有方法的超速离心分离法、总外泌体分离(totalexsomeisolation)(聚合物沉淀)法时,确认了作为外泌体标记物的cd9与浮舰蛋白-2的条带,不能完全除去试样中所含的细胞外膜囊泡,试样中残留大量的细胞外膜囊泡(实施例44-45:泳道4-5)。另外还可知,即使组合所述现有方法,也确认了cd9与浮舰蛋白-2的条带,不能充分除去细胞外膜囊泡,而是发生残留(实施例43:泳道3)。相对于此,通过将作为现有方法的超速离心分离法或总外泌体分离(totalexsomeisolation)(聚合物沉淀)法与本发明的除去方法进行结合,没有确认到cd9与浮舰蛋白-2的条带,可知能除去(取得)仅采用现有方法不能完全除去的试样中的细胞外膜囊泡(实施例41-42:泳道1-2)。进一步地,仅采用本发明的方法,未确认到cd9与浮舰蛋白-2的条带,可知能充分地除去(取得)细胞外膜囊泡(实施例46:泳道6)。另外,也启示了,通过本发明的除去(取得)方法,对于病毒,也能与细胞外膜囊泡同样地除去。
实施例48-55.本发明的除去方法中的本发明的tim载体的再利用
如下所述,使用本发明的tim载体,重复本发明的除去方法。
<(1)试样的准备>
对fbs(康宁公司(corning社)制)1ml进行离心分离处理(10000×g,20分钟),分离杂质,得到离心分离处理后的fbs1ml。
<(2)珠的洗涤>
将含有10μg/μl的dynabeadsmyone链霉亲和素c1珠(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs溶液60μl(含有dynabeadsmyone链霉亲和素c1珠0.6mg)分注于1.5ml管(bm设备公司(ビーエム机器社)制)中。然后,将pbs500μl分别添加于1.5ml管中,搅拌后,将1.5ml管设置于磁力架,用磁力使dynabeadsmyone链霉亲和素c1珠集合于管壁,用移液器将1.5ml管内的溶液丢弃(以下,有时简记为洗涤操作)。
<(3)fc标签融合小鼠源tim4蛋白质固定于珠>
在洗涤操作后的颗粒状态的0.6mg的dynabeadsmyone链霉亲和素c1珠中,添加含有巯基生物素标记的fc标签融合小鼠源tim4蛋白质1μg的pbs溶液500μl,在8℃进行10分钟的反应,得到含有结合有巯基生物素标记的fc标签融合mtim4蛋白质的载体(mtim4载体)的pbs溶液500μl。
<(4)利用本发明的除去方法除去细胞外膜囊泡>
将1.5ml管设置于磁力架,用磁力使mtim4载体集合于管壁,用移液器将1.5ml管内的溶液丢弃后,用pbs500μl分别对mtim4载体进行3次洗涤操作,得到颗粒状态的mtim4载体。然后,在颗粒状态的mtim4载体中,添加离心分离处理后的fbs1ml,在8℃进行1小时的反应。
反应后,将1.5ml管设置于磁力架,用磁力使mtim4载体集合于管壁,将上清(fbs)回收至新的1.5ml管中(作为上清1)。用含有2mmcacl2的tbs-t(tris缓冲液,0.0005%吐温20(tween20),2mmcacl2)500μl对颗粒状态的mtim4载体进行3次洗涤操作。
在颗粒状态的各mtim4载体0.6mg中,添加作为溶出液的含有1mmedta的tbs溶液50μl,然后,通过漩涡混合器在室温混合10秒,停止转动(spindown)。将1.5ml管设置于磁力架,用磁力使mtim4载体集合于管壁,回收溶出液(作为溶出液1)。在该mtim4载体中再次添加含有1mmedta的tbs溶液50μl,采用同样的方法回收溶出液(作为溶出液2)。将得到的溶出液1与溶出液2混合,得到除去试样8。
在溶出操作后(在得到溶出液2的溶出操作后)的mtim4载体中,再次添加所述上清1,重复进行回收上清1中的细胞外膜囊泡的操作共8次,分别得到各溶出液。
得到的除去试样以及后述蛋白质免疫印迹中的泳道号如下表21所示。
表21
<(5)蛋白质免疫印迹>
使用vivaspin500(mvco10000)(商品名,赛多利斯公司(ザルトリウス社)制)对得到的各溶出液100μl进行超滤,以使其成为30μl。在经超滤的各溶出液15μl中,加入4×试样用缓冲液(和光纯药工业(株)制)5μl,在98℃加热5分钟,得到蛋白质免疫印迹用各试样。在supersepace5-20%凝胶(商品名,和光纯药工业(株)制)中,加入该蛋白质免疫印迹用各试样20μl,以25ma进行65分钟电泳。使用半干印迹仪及不连续缓冲液(阳极缓冲液1:0.3mtris/20%甲醇;阳极缓冲液2:0.025mtris/20%甲醇;阴极缓冲液:0.025mtris/0.04m氨基己酸/20%甲醇),在1ma/cm2的条件下,将得到的电泳凝胶转印于pvdf膜(密里博公司(millipore社)制)60分钟。在转印后的pvdf膜中,加入用pbs-t(pbsbuffer,0.1%吐温20(tween20))稀释的3%脱脂奶,在室温条件下反应1小时,进行封闭,将用pbs-t稀释1000倍的抗牛cd9抗体(诺夫斯生物公司(novusbiologicals社)制,以下有时简记为“抗牛cd9抗体”)2ml在室温反应1小时。用pbs-t将反应后的pvdf膜洗涤3次,将用pbs-t稀释10000倍的次级抗体{抗小鼠igg(h+l)、兔、igg组分、过氧化物酶结合抗体}(和光纯药工业(株)制)在室温反应1小时。用pbs-t洗涤5次后,添加immunostarzeta(商品名,和光纯药工业(株)制)添加,用las-4000(商品名,通用电气公司(ge社)制)检测发光信号。需要说明的是,抗牛cd9抗体是针对作为外泌体的标记蛋白质之一的cd9的抗体。
<结果>
将得到的蛋白质免疫印迹的结果示于图13。图13中,各泳道表示以下结果。
泳道1:实施例48的结果(使用未经使用的本发明的tim4载体、通过本发明的取得除去方法来除去试样中的细胞外膜囊泡时的结果);
泳道2:实施例49的结果(使用已用过1次的本发明的tim4载体、通过本发明的取得除去方法来除去已用过1次的试样中的细胞外膜囊泡时的结果);
泳道3:实施例50的结果(使用已用过2次的本发明的tim4载体、通过本发明的取得除去方法来除去已用过2次的试样中的细胞外膜囊泡时的结果);
泳道4:实施例51的结果(使用已用过3次的本发明的tim4载体、通过本发明的取得除去方法来除去已用过3次的试样中的细胞外膜囊泡时的结果);
泳道5:实施例52的结果(使用已用过4次的本发明的tim4载体、通过本发明的取得除去方法来除去已用过4次的试样中的细胞外膜囊泡时的结果);
泳道6:实施例53的结果(使用已用过5次的本发明的tim4载体、通过本发明的取得除去方法来除去已用过5次的试样中的细胞外膜囊泡时的结果);
泳道7:实施例54的结果(使用已用过6次的本发明的tim4载体、通过本发明的取得除去方法来除去已用过6次的试样中的细胞外膜囊泡时的结果);
泳道8:实施例55的结果(使用已用过7次的本发明的tim4载体、通过本发明的取得除去方法来除去已用过7次的试样中的细胞外膜囊泡时的结果)。
根据图13可知,在反复使用本发明的tim4载体进行除去操作时,确认了由试样回收的外泌体的量变少,通过反复利用本发明的tim4载体,能够更可靠地除去细胞外膜囊泡。另外可知,使用作为钙离子螯合剂的edta,从结合于载体的tim4蛋白质与试样中的细胞外膜囊泡的复合体中分离细胞外膜囊泡,从而能再利用本发明的tim4载体。
实施例56-67以及比较例14-15.利用已固定化tim家族蛋白质的载体取得细胞外膜囊泡
如下所述地,使用分别将作为tim家族的tim1蛋白质、tim3蛋白质或tim4蛋白质固定化于珠而成的载体,取得本发明的细胞外膜囊泡。
<(1)含有钙离子的培养上清(原液)的制备>
使用80ml的x-vivo15培养基(商品名,龙沙公司(lonza社)制),在37℃、5%co2条件下,将分泌细胞外膜囊泡的人慢性髄系白血病细胞株k562细胞1×107细胞培养3天,然后,进行离心分离处理(300×g,5分钟),使细胞沉淀,除去上清。用含有10μm莫能菌素钠(mp生物医学公司(mpbiomedicals社)制)的x-vivo15培养基60ml使沉淀的细胞悬浮后,在37℃、5%co2条件下培养24小时。
然后,对培养液进行离心分离处理(300×g,5分钟),回收培养上清。进而对回收的培养上清60ml进行3次离心分离处理(第一次:300×g,3分钟;第二次:1200×g,20分钟;第三次:10000×g,20分钟),分离杂质,得到上清(以下,有时简记为“培养上清(原液)”)。
另外,在得到的培养上清原液中添加cacl2,以使其终浓度成为2mm,得到含有2mmcacl2的k562细胞培养上清浓缩液样品(以下,有时简记为“含有钙离子的培养上清(原液)”)。
<(2)珠的洗涤>
将含有30μg/μl的dynabeadsg蛋白(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs-t溶液20μl(含有dynabeadsg蛋白0.6mg)分别移至7个1.5ml管(bm设备公司(ビーエム机器社)制)中,分别进行洗涤操作。
<(3)fc标签融合tim蛋白质固定于珠>
在含有洗涤操作后的颗粒状态的dynabeadsg蛋白0.6mg的1.5ml管中,分别添加含有fc标签融合小鼠源tim1蛋白质、fc标签融合小鼠源tim3蛋白质、fc标签融合小鼠源tim4蛋白质、fc标签融合人源tim1蛋白质、fc标签融合人源tim3蛋白质、或fc标签融合人源tim4蛋白质(均为和光纯药工业(株)制)1μg的tbs溶液200μl,在8℃反应1小时,分别得到fc标签融合mtim1蛋白质结合载体、fc标签融合mtim3蛋白质结合载体、fc标签融合mtim4蛋白质结合载体、fc标签融合htim1蛋白质结合载体、fc标签融合htim3蛋白质结合载体以及fc标签融合htim4蛋白质结合载体。需要说明的是,将所述得到的6种载体示于下表22中。有时将它们一并简记为“tim蛋白质结合载体”。
表22
<(4)利用本发明的方法取得细胞外膜囊泡>
分别用tbs-t(tris缓冲液,0.1%吐温20(tween20))500μl对上述得到的6种tim蛋白质结合载体进行3次洗涤操作,用tbs500μl进行2次洗涤操作,得到颗粒状态的tim蛋白质结合载体。然后,在颗粒状态的tim蛋白质结合载体以及仅经洗涤操作的dynabeadsg蛋白(以下,有时简记为“tim蛋白质非结合载体”)中,分别添加上述(1)中制备的含有钙离子的培养上清(原液)1ml,在8℃分别进行3小时的反应。
然后,用含有钙离子的tbs-t(tris缓冲液,0.0005%吐温20(tween20)、2mmcacl2)500μl,分别对反应后的tim蛋白质结合载体或tim蛋白质非结合载体进行3次洗涤操作。在进行第三次洗涤操作时,分别将含有tim蛋白质结合载体或tim蛋白质非结合载体的含cacl2的tbs-t溶液500μl以各250μl的方式分注于2个1.5ml管中,将管设置于磁力架后,除去洗涤液。
在颗粒状态的tim蛋白质结合载体或tim蛋白质非结合载体0.3mg中,分别添加作为溶出液的1%sds水溶液50μl、或者添加含有1mmedta的tbs溶液25μl,然后,通过漩涡混合器在室温混合10秒,停止转动(spindown)。在添加了edta的管中再次添加含有1mmedta的tbs溶液25μl,进行相同的操作,得到各上清(溶出液)。
<(5)蛋白质免疫印迹>
在上述(4)中得到的各上清(各溶出液)11.25μl中,添加4×试样用缓冲液(和光纯药工业(株)制)3.75μl,在95℃加热3分钟,得到蛋白质免疫印迹用各试样。在supersepace5-20%凝胶(商品名,和光纯药工业(株)制)中,加入该蛋白质免疫印迹用各试样15μl,以30ma进行60分钟电泳。使用半干印迹仪和不连续缓冲液(阳极缓冲液1:0.3mtris/20%甲醇;阳极缓冲液2:0.025mtris/20%甲醇;阴极缓冲液:0.025mtris/0.04m氨基己酸/20%甲醇),在1ma/cm2的条件下,将得到的电泳凝胶转印于pvdf膜(密里博公司(millipore社)制)60分钟。在转印后的pvdf膜中,加入用tbs-t(tbs缓冲液,0.1%吐温20(tween20))稀释的5%脱脂奶,在室温反应1小时,进行封闭,将用tbs-t稀释250倍的抗人lamp-1抗体(bd生物科学公司(bdbiosciences社)制)、用tbs-t稀释250倍的抗人浮舰蛋白-2抗体(bd生物科学公司(bdbiosciences社))2ml在室温进行1小时的反应。用tbs-t将反应后的pvdf膜洗涤3次,将用tbs-t稀释5000倍的次级抗体{抗小鼠igg(h+l)、兔、igg组分、过氧化物酶结合抗体}(和光纯药工业(株)制)在室温进行1小时的反应。用tbs-t洗涤5次后,在使各抗体反应后的pvdf膜中添加immunostarzeta(商品名,和光纯药工业(株)制),用las-4000(商品名,通用电气公司(ge社)制)检测发光信号。
需要说明的是,将各实施例、比较例中使用的tim蛋白质及载体的种类、以及用于从tim蛋白质(非)结合载体中取得细胞外膜囊泡的溶出液的种类示于下表23。
表23
<结果>
将得到的蛋白质免疫印迹的结果示于图14。在图14中,各泳道如下。
泳道1:比较例14的结果(使用仅dynabeadsg蛋白磁性珠的载体、并将1%sds水溶液用作溶出液时的结果);
泳道2:比较例15的结果(使用仅dynabeadsg蛋白磁性珠的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道3:实施例56的结果(使用使人源tim1蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道4:实施例57的结果(使用使人源tim1蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道5:实施例58的结果(使用使小鼠源tim1蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道6:实施例59的结果(使用使小鼠源tim1蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道7:实施例60的结果(使用使人源tim3蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道8:实施例61的结果(使用使人源tim3蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道9:实施例62的结果(使用使小鼠源tim3蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道10:实施例63的结果(使用使小鼠源tim3蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道11:实施例64的结果(使用使人源tim4蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道12:实施例65的结果(使用使人源tim4蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道13:实施例66的结果(使用使小鼠源tim4蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道14:实施例67的结果(使用使小鼠源tim4蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果)。
根据图14可知,在泳道3-14中,观察到了作为外泌体的标记蛋白质的lamp-1或浮舰蛋白-2的条带,因此,通过使用结合有tim1蛋白质、tim3蛋白质或tim4蛋白质的载体(本发明的tim蛋白质结合载体),无论蛋白质的来源、溶出方法如何,都能取得细胞外膜囊泡。
另外可知,通过sds进行溶出时,能够取得更多的细胞外膜囊泡,按顺序为结合有tim4蛋白质的载体>结合有tim1蛋白质的载体>结合有tim3蛋白质的载体。
实施例68-79.利用已固定化tim蛋白质的载体取得细胞外膜囊泡
使用分别已固定化生物素标记的tim1蛋白质、生物素标记的tim3蛋白质或生物素标记的tim4蛋白质的载体,取得本发明的细胞外膜囊泡。
<(1)培养上清样品的制备>
通过与实施例50-67、比较例14-15的“(1)含有钙离子的培养上清(原液)的制备”相同的方法进行,得到含有钙离子的培养上清(原液)。
<(2)fc标签融合tim1蛋白质的巯基生物素标记>
对于含有fc标签融合小鼠源tim1蛋白质(和光纯药工业(株)制)的pbs溶液200μl(含有fc标签融合小鼠源tim1蛋白质20μg),使用生物素标记试剂盒-巯基(同仁化学研究所制),按照附带于该试剂盒的方案,对fc标签融合小鼠源tim1蛋白质的巯基进行生物素标记,得到含有巯基生物素标记的fc标签融合mtim1蛋白质的pbs溶液200μl。
<(3)fc标签融合tim3蛋白质的巯基生物素标记>
对于含有fc标签融合小鼠源tim3蛋白质(和光纯药工业(株)制)的pbs溶液200μl(含有fc标签融合小鼠源tim3蛋白质20μg),使用生物素标记试剂盒-巯基(同仁化学研究所制),按照附带于该试剂盒的方案,对fc标签融合小鼠源tim3蛋白质的巯基进行生物素标记,得到含有巯基生物素标记的fc标签融合mtim3蛋白质的pbs溶液200μl。
<(4)fc标签融合tim4蛋白质的巯基生物素标记>
对于含有fc标签融合小鼠源tim4蛋白质(和光纯药工业(株)制)的pbs溶液100μl(含有fc标签融合小鼠源tim4蛋白质10μg),使用生物素标记试剂盒-巯基(同仁化学研究所制),按照附带于该试剂盒的方案,对fc标签融合小鼠源tim4蛋白质的巯基进行生物素标记,得到含有巯基生物素标记的fc标签融合mtim4蛋白质的pbs溶液100μl。
<(5)标签融合tim蛋白质的稀释>
将含有fc标签融合mtim1蛋白质(和光纯药工业(株)制)的pbs溶液10μl(含有fc标签融合mtim1蛋白质1μg)与tbs190μl混合,得到含有生物素非标记的fc标签融合mtim1蛋白质1μg的溶液200μl。
将所述(2)中制备的含有巯基生物素标记的fc标签融合mtim1蛋白质的tbs溶液11.5μl(含有巯基生物素标记的fc标签融合mtim1蛋白质1μg)与tbs188.5μl混合,得到含有生物素标记的fc标签融合mtim1蛋白质1μg的溶液200μl。
将含有fc标签融合mtim3蛋白质(和光纯药工业(株)制)的pbs溶液10μl(含有fc标签融合mtim3蛋白质1μg)与tbs190μl混合,得到含有生物素非标记的fc标签融合mtim3蛋白质1μg的溶液200μl。
将所述(3)中制备的含有巯基生物素标记的fc标签融合mtim3蛋白质的tbs溶液9.0μl(含有巯基生物素标记的fc标签融合mtim3蛋白质1μg)与tbs191.0μl混合,得到含有生物素标记的fc标签融合mtim3蛋白质1μg的溶液200μl。
将含有fc标签融合mtim4蛋白质(和光纯药工业(株)制)的pbs溶液10μl(含有fc标签融合mtim4蛋白质1μg)与tbs190μl混合,得到含有生物素非标记的fc标签融合mtim4蛋白质1μg的溶液200μl。
将所述(4)中制备的含有巯基生物素标记的fc标签融合mtim4蛋白质的tbs溶液10μl(含有巯基生物素标记的fc标签融合mtim4蛋白质1μg)与tbs190μl混合,得到含有生物素标记的fc标签融合mtim4蛋白质1μg的溶液200μl。
<(6)珠的洗涤>
将含有30μg/μl的dynabeadsg蛋白珠(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs-t溶液20μl(含有dynabeadsg蛋白珠0.6mg)分别移至6个1.5ml管(bm设备公司(ビーエム机器社)制)中,分别进行洗涤操作。
另外,分别将含有10μg/μl的dynabeadsm270链霉亲和素c1珠(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs溶液60μl(含有0.6mg的dynabeadsm270链霉亲和素c1珠)分注于1.5ml管(bm设备公司(ビーエム机器社)制)中,用tbs500μl与前述同样地进行洗涤操作。
<(7)fc标签融合tim蛋白质固定于珠>
在含有洗涤操作后的颗粒状态的dynabeadsg蛋白珠0.6mg的6个1.5ml管中,分别添加含有巯基生物素非标记的fc标签融合mtim1蛋白质1μg的溶液200μl、含有巯基生物素非标记的fc标签融合mtim3蛋白质1μg的溶液200μl、或者含有巯基生物素非标记的fc标签融合mtim4蛋白质1μg的溶液200μl,在8℃进行1小时的反应,分别得到结合有巯基生物素非标记的fc标签融合mtim1的载体(有时简记为“生物素非标记的fc标签融合mtim1载体”)、结合有巯基生物素非标记的fc标签融合mtim3的载体(有时简记为“生物素非标记的fc标签融合mtim3载体”)、结合有巯基生物素非标记的fc标签融合mtim4的载体(有时简记为“生物素非标记的fc标签融合mtim4载体”)。
另外,在含有0.6mg的洗涤操作后的dynabeadsm270链霉亲和素c1珠的1.5ml管中,加入含有巯基生物素标记的fc标签融合mtim1蛋白质1μg的溶液200μl、含有巯基生物素标记的fc标签融合mtim3蛋白质1μg的溶液200μl、含有巯基生物素标记的fc标签融合mtim4蛋白质1μg的溶液200μl,与前述同样地与珠结合,分别得到结合有巯基生物素标记的fc标签融合mtim1的载体(有时简记为“生物素标记的fc标签融合mtim1载体”)、结合有巯基生物素标记的fc标签融合tim3的载体(有时简记为“生物素标记的fc标签融合mtim3载体”)、结合有巯基生物素标记的fc标签融合tim4的载体(有时简记为“生物素标记的fc标签融合mtim4载体”)。
需要说明的是,有时将所述得到的6种载体一并简记为“tim蛋白质结合载体”。
<(8)利用本发明的取得方法取得细胞外膜囊泡>
用tbs-t(tris缓冲液,0.1%吐温20(tween20))500μl对上述得到的所述tim蛋白质结合载体进行3次洗涤操作,用tbs500μl进行2次洗涤操作,得到颗粒状态的tim蛋白质结合载体。然后,在得到的6种颗粒状态的tim蛋白质结合载体中,分别加入含有钙离子的培养上清(原液)1ml,在8℃分别反应3小时。然后,用含有钙离子的tbs-t(tris缓冲液,0.0005%吐温20(tween20),2mmcacl2)500μl分别对反应后的tim蛋白质结合载体进行3次洗涤操作。在进行第三次洗涤操作时,分别将含有tim蛋白质结合载体的含cacl2的tbs-t溶液500μl以各250μl的方式分注于2个1.5ml管中,将管设置于磁力架后,除去洗涤液。
在颗粒状态的6种tim蛋白质结合载体0.3mg中,分别添加作为溶出液的1%sds水溶液50μl、或者添加含有1mmedta的tbs溶液25μl,然后,通过漩涡混合器在室温混合10秒,停止转动(spindown)。在添加了edta的管中,再次添加含有1mmedta的tbs溶液25μl,进行同样的操作,得到溶出液。
需要说明的是,将各实施例中使用的tim蛋白质及载体的种类、以及tim蛋白质(非)结合载体的种类示于下表24。
表24
<(9)蛋白质免疫印迹>
在实施例56-67的<(5)蛋白质免疫印迹>中,使用所述(6)中得到的各溶出液11.25μl替代“所述(4)中得到的各溶出液11.25μl”,作为次级抗体,使用经tbs-t稀释30000倍的“次级抗体{抗小鼠igg(h+l)、驴、igg组分、过氧化物酶结合抗体}(杰克逊免疫研究公司(jacksonimmunoresearch社)制)”替代“次级抗体{抗小鼠igg(h+l)、兔、igg组分、过氧化物酶结合抗体}(和光纯药工业(株)制)”,除此以外,通过与实施例56-67的“(5)蛋白质免疫印迹”相同的方法进行。
需要说明的是,将各实施例中使用的tim蛋白质及载体的种类、用于从tim蛋白质(非)结合载体取得细胞外膜囊泡的溶出液的种类、以及蛋白质免疫印迹中的泳道号示于下表25。
表25
<结果>
将得到的蛋白质免疫印迹的结果示于图15。图15中,各泳道为以下的结果。
泳道1:实施例68的结果(使用使巯基生物素非标记的fc标签融合mtim1蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道2:实施例69的结果(使用使巯基生物素非标记的fc标签融合mtim1蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道3:实施例70的结果(使用使巯基生物素标记的fc标签融合mtim1蛋白质结合于dynabeadsm270链霉亲和素而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道4:实施例71的结果(使用使巯基生物素标记的fc标签融合mtim1蛋白质结合于dynabeadsm270链霉亲和素而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道5:实施例72的结果(使用使巯基生物素非标记的fc标签融合mtim3蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道6:实施例73的结果(使用使巯基生物素非标记的fc标签融合mtim3蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道7:实施例74的结果(使用使巯基生物素标记的fc标签融合mtim3蛋白质结合于dynabeadsm270链霉亲和素而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道8:实施例75的结果(使用使巯基生物素标记的fc标签融合mtim3蛋白质结合于dynabeadsm270链霉亲和素而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道9:实施例76的结果(使用使巯基生物素非标记的fc标签融合mtim4蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道10:实施例77的结果(使用使巯基生物素非标记的fc标签融合mtim4蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1%1mmedta的tbs溶液用作溶出液时的结果);
泳道11:实施例78的结果(使用使巯基生物素标记的fc标签融合mtim4蛋白质结合于dynabeadsm270链霉亲和素而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道12:实施例79的结果(使用使巯基生物素标记的fc标签融合mtim4蛋白质结合于dynabeadsm270链霉亲和素而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果)。
根据图15可知,对泳道1-12而言,无论在哪一种情况下都观察到了作为外泌体的标记蛋白质的lamp-1的条带,因此,通过使用结合有tim1、tim3、或tim4的载体(tim蛋白质结合载体),能取得细胞外膜囊泡。
另外可知,按顺序为结合有tim4蛋白质的载体>结合有tim1蛋白质的载体>结合有tim3蛋白质的载体,能够取得更多的细胞外膜囊泡。在利用钙螯合剂进行溶出时,通过tim4蛋白质的巯基而固定化于珠(载体),从而与通过标签进行固定化时相比能够取得更多的细胞外膜囊泡(泳道9-12)。
实施例80-83以及比较例16-19.利用已固定化tim家族蛋白质的载体取得细胞外膜囊泡
使用分别将作为tim家族蛋白质的tim1蛋白质、tim2蛋白质或tim4蛋白质固定化于珠而成的载体,取得本发明的细胞外膜囊泡。
<(1)含有钙离子的培养上清样品的制备>
采用与实施例1-8的“(1)培养上清样品的制备”相同的方法,得到含有钙离子的培养上清样品。
<(2)珠的洗涤>
分别将含有30μg/μl的dynabeadsg蛋白(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs-t溶液20μl(含有dynabeadsg蛋白4.8mg)分注于4个1.5ml管(bm设备公司(ビーエム机器社)制)中,分别进行洗涤操作。
<(3)6×his标签融合tim家族蛋白质固定于珠>
在4个含有洗涤操作后的颗粒状态的dynabeadsg蛋白珠0.6mg的1.5ml管中,分别添加含有抗6×his抗体(克隆编号28-75,和光纯药工业社制)4μg的tbs溶液100μl,在8℃分别进行30分钟的反应,得到含有结合有抗6×his抗体的载体的tbs溶液100μl。用tbs-t(tris缓冲液,0.1%吐温20(tween20))250μl分别对所述结合有抗6×his抗体的载体进行3次洗涤操作,然后,用tbs250μl分别进行2次洗涤操作。
然后,在洗涤操作后的抗6×his抗体结合dynabeadsg蛋白载体中,分别添加含有6×his标签融合小鼠源tim1蛋白质(r&d系统公司(r&dシステムズ社)制)1μg的tbs溶液100μl、含有6×his标签融合小鼠源tim2蛋白质(r&d系统公司(r&dシステムズ社)制)1μg的tbs溶液100μl、或者含有6×his标签融合小鼠源tim4蛋白质(r&d系统公司(r&dシステムズ社)制)1μg的tbs溶液100μl,在8℃分别进行1小时反应,通过抗6×his抗体分别得到结合有tim1蛋白质的载体(有时简记为“6×his标签融合mtim1蛋白质结合载体”)、结合有tim2蛋白质的载体(有时简记为“6×his标签融合mtim2蛋白质结合载体”)、结合有tim4蛋白质的载体(有时简记为“6×his标签融合mtim4蛋白质结合载体”)。
需要说明的是,有时将得到的6×his融合mtim1蛋白质结合载体及6×his融合mtim4蛋白质结合载体一并简记为“tim蛋白质结合载体”。
将各实施例中使用的tim蛋白质及载体的种类、以及tim家族蛋白质(非)结合载体的种类示于下表26。
表26
<(4)利用本发明的取得方法取得细胞外膜囊泡>
对于所述(3)中得到的抗6×his抗体结合dynabeadsg蛋白载体、6×his标签融合mtim1蛋白质结合载体、6×his标签融合mtim2蛋白质结合载体、6×his标签融合mtim2蛋白质结合载体,分别用tbs-t(tris缓冲液,0.1%吐温20(tween20))250μl进行3次洗涤操作,用tbs250μl进行2次洗涤操作,得到颗粒状态的各载体。然后,在颗粒状态的各载体中,分别添加含有钙离子的培养上清样品200μl,在8℃分别进行3小时的反应。用含有钙离子的tbs-t(tris缓冲液,0.0005%吐温20(tween20),2mmcacl2)500μl对反应后的各载体进行3次洗涤操作。在进行第三次洗涤操作时,将含有各载体的含cacl2的tbs-t溶液500μl分别以各250μl的方式分注于2个1.5ml管中,将管设置于磁力架后,除去洗涤液。
在颗粒状态的各载体0.3mg中,分别加入作为溶出液的1%sds水溶液50μl、或者添加含有1mmedta的tbs溶液25μl,然后,通过漩涡混合器在室温混合10秒,停止转动(spindown)。在添加了edta的管中,再次添加含有1mmedta的tbs溶液25μl,进行同样的操作,得到溶出液。
<(5)蛋白质免疫印迹>
使用所述(4)中得到的各溶出液11.25μl,除此以外,采用与实施例68-79的“(7)蛋白质免疫印迹”相同的方法进行。
需要说明的是,将各实施例中使用的tim家族蛋白质及载体的种类、用于从tim蛋白质(非)结合载体取得细胞外膜囊泡的溶出液的种类、以及蛋白质免疫印迹中的泳道号示于下表27。
表27
<结果>
将得到的蛋白质免疫印迹的结果示于图16。在图16中,各泳道表示以下的结果。
泳道1:比较例16的结果(使用使抗6×his抗体结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道2:比较例17的结果(使用使抗6×his抗体结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道3:实施例80的结果(使用通过抗6×his抗体而使6×his标签融合mtim1蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道4:实施例81的结果(使用通过抗6×his抗体而使6×his标签融合mtim1蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道5:比较例18的结果(使用通过抗6×his抗体而使6×his标签融合mtim2蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道6:比较例19的结果(使用通过抗6×his抗体而使6×his标签融合mtim2蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道7:实施例82的结果(使用通过抗6×his抗体而使6×his标签融合mtim4蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道8:实施例83的结果(使用通过抗6×his抗体而使6×his标签融合mtim4蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果)。
根据图16可知,在结合有6×his标签融合tim2蛋白质时,无论采用何种溶出法,都未观察到作为外泌体标记物蛋白质的lamp-1的条带(泳道5-6)。另一方面,对于结合有6×his标签融合mtim1蛋白质、或结合有6×his标签融合mtim4蛋白质的载体,无论采用何种溶出法,都观察到了作为外泌体的标记蛋白质的抗lamp-1的条带(泳道3-4、泳道7-8)。根据该结果可知,通过已固定化tim2蛋白质的载体,不能取得细胞外膜囊泡。
另外,通过sds进行溶出时,能取得更多的细胞外膜囊泡,按顺序为结合有tim4蛋白质的载体>结合有tim1蛋白质的载体。
实施例84-95以及比较例20-21.利用已固定化tim蛋白质的载体取得病毒
如下所述地,使用分别将作为tim蛋白质的tim1蛋白质、tim3蛋白质或tim4蛋白质固定化于珠而成的载体,取得本发明的病毒。
<(1)共转染细胞培养上清的制备>
在播种于25cm2烧瓶中的1.0×106个sf9细胞中,加入含有小鼠il23表达载体dna约2μg、线性acnpvdna90ng以及昆虫细胞系专用转染试剂(transit-insect)(商品名,mirus公司)3μl的psfm-j1培养基(商品名,和光纯药工业社制)100μl。在28℃培养7天后,回收培养上清(共转染溶液)。
<(2)含有杆状病毒的昆虫细胞培养上清样品的制备>
准备以使细胞浓度成为1.5×106个细胞/ml的方式用psfm-j1培养基稀释的sf9细胞50ml。在其中加入培养液的1/200的量的所述共转染溶液,在130rpm、27℃的条件下进行振荡培养。72小时后,回收细胞培养液,在3000×g、4℃的条件下离心30分钟后,分离沉淀与上清。将得到的上清作为表达小鼠il23的重组杆状病毒溶液(以下,有时简记为“杆状病毒溶液”)。
另外,在得到的杆状病毒溶液中添加cacl2,以使其终浓度成为2mm,得到含有2mmcacl2的杆状病毒溶液(以下,有时简记为“含有钙离子的杆状病毒溶液”)。
<(3)珠的洗涤>
采用与实施例56-67及比较例14-15的“(2)珠的洗涤”相同的方法进行。
<(4)fc标签融合tim蛋白质固定于珠>
采用与实施例56-67及比较例14-15的“(3)fc标签融合tim蛋白质固定于珠”相同的方法进行,得到下表28所示的6种tim蛋白质结合载体。
表28
<(5)利用本发明的方法取得杆状病毒>
使用“所述(2)中制备的含有钙离子的杆状病毒溶液1ml”替代“含有钙离子的培养上清样品1ml”,除此以外,与实施例56-67及比较例14-15的“(4)利用本发明的方法取得细胞外膜囊泡”同样地进行,得到各溶出液。
<(6)蛋白质免疫印迹>
使用“用tbs-t稀释500倍的抗杆状病毒gp64抗体(诺夫斯生物公司(novusbiologicals社)制)”替代“用tbs-t稀释250倍的抗人lamp-1抗体(商品名,bd生物科学公司(bdbiosciences社)制)、用tbs-t稀释250倍的抗人浮舰蛋白-2抗体(bd生物科学公司(bdbiosciences社)制)2ml”,除此以外,采用与实施例56-67及比较例14-15的“(5)蛋白质免疫印迹”相同的方法进行。
需要说明的是,将各实施例、比较例中使用的tim蛋白质及载体的种类、用于从tim蛋白质(非)结合载体取得细胞外膜囊泡的溶出液的种类、以及蛋白质免疫印迹中的泳道号示于下表29。
表29
<结果>
将得到的蛋白质免疫印迹的结果示于图17。图17中,各泳道表示以下结果。
泳道1:比较例20的结果(使用仅dynabeadsg蛋白磁珠的载体、并将1%sds水溶液用作溶出液时的结果);
泳道2:比较例21的结果(使用仅dynabeadsg蛋白磁珠的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道3:实施例84的结果(使用使htim1蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道4:实施例85的结果(使用使htim1蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道5:实施例86的结果(使用使mtim1蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道6:实施例87的结果(使用使mtim1蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道7:实施例88的结果(使用使htim3蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道8:实施例89的结果(使用使htim3蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道9:实施例90的结果(使用使mtim3蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道10:实施例91的结果(使用使mtim3蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道11:实施例92的结果(使用使htim4蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道12:实施例93的结果(使用使htim4蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道13:实施例94的结果(使用使mtim4蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道14:实施例95的结果(使用使mtim4蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果)。
根据图17可知,泳道3-14中,观察到了杆状病毒的标记蛋白质gp64的条带,因此,通过使用结合有tim1蛋白质、tim3蛋白质或tim4蛋白质的载体(tim蛋白质结合载体),无论tim蛋白质的来源、溶出方法如何,都能取得杆状病毒。
另外可知,通过sds进行溶出时,能取得更多的病毒,对于结合有tim3蛋白质的载体与结合有tim4蛋白质的载体而言,所取得的杆状病毒的程度相同,按顺序接着是结合有tim1蛋白质的载体。
在使用钙离子螯合剂进行溶出的情况下,能取得更多的病毒,可知结合有tim3蛋白质的载体取得的杆状病毒最多,按顺序接着为结合有tim1蛋白质的载体与结合有tim4蛋白质的载体。
实施例96-99以及比较例22-25.利用固定化tim家族蛋白质的载体取得病毒
如下所述,使用分别将作为tim家族蛋白质的tim1蛋白质、tim2蛋白质或tim4蛋白质固定化于珠而成的载体,取得本发明的病毒。
<(1)共转染细胞培养上清的制备>
与实施例84-95、比较例20-21的“(1)共转染细胞培养上清的制备”同样地进行。
<(2)含有钙离子的含杆状病毒的昆虫细胞培养上清样品的制备>
采用与实施例84-95、比较例20-21的“(2)含有杆状病毒的昆虫细胞培养上清样品的制备”相同的方法得到含有钙离子的杆状病毒溶液。
<(3)珠的洗涤>
分别将含有30μg/μl的dynabeadsg蛋白(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs-t溶液20μl(含有dynabeadsg蛋白4.8mg)分注于4个1.5ml管(bm设备公司(ビーエム机器社)制)中,分别进行洗涤操作。
<(4)6×his标签融合tim家族蛋白质固定于珠>
与实施例80-83及比较例16-19的“(3)6×his标签融合tim家族蛋白质固定于珠”同样地进行,分别得到6×his标签融合mtim1蛋白质结合载体、6×his标签融合mtim2蛋白质结合载体、6×his标签融合mtim4蛋白质结合载体。
将各实施例中使用的tim家族蛋白质及载体的种类、以及tim家族蛋白质(非)结合载体的种类示于下表30。
表30
<(5)利用本发明的取得方法取得杆状病毒>
使用所述(2)中制备的“含有钙离子的杆状病毒溶液200μl”替代“含有钙离子的培养上清样品200μl”,除此以外,采用与实施例80-83及比较例16-19的“(4)利用本发明的取得方法取得细胞外膜囊泡”相同的方法进行,得到溶出液。
<(6)蛋白质免疫印迹>
“在所述(5)利用本发明的取得方法取得杆状病毒中得到的各溶出液3μl中添加4×试样用缓冲液(和光纯药工业(株)制)1μl”替代“在得到的各溶出液11.25μl中添加4×试样用缓冲液(和光纯药工业(株)制)3.75μl”,使用“蛋白质免疫印迹用各试样4μl”替代“蛋白质免疫印迹用各试样15μl”,使用“抗杆状病毒gp64抗体”替代“抗lamp-1抗体”,除此以外,采用与实施例80-83及比较例16-19的“(5)蛋白质免疫印迹”相同的方法进行。
需要说明的是,将各实施例中使用的tim家族蛋白质及载体的种类、用于从tim家族蛋白质(非)结合载体取得细胞外膜囊泡的溶出液的种类、以及蛋白质免疫印迹中的泳道号示于下表31。
表31
<结果>
将得到的蛋白质免疫印迹的结果示于图18。图18中,各泳道表示以下的结果。
泳道1:比较例22的结果(使用使抗6×his标签抗体结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道2:比较例23的结果(使用使抗6×his标签抗体结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道3:实施例96的结果(使用通过抗6×his标签抗体而使6×his标签融合mtim1蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道4:实施例97的结果(使用通过抗6×his标签抗体而使6×his标签融合mtim1蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道5:比较例24的结果(使用通过抗6×his标签抗体而使6×his标签融合mtim2蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道6:比较例25的结果(使用通过抗6×his标签抗体而使6×his标签融合mtim2蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道7:实施例98的结果(使用通过抗6×his标签抗体而使6×his标签融合mtim4蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道8:实施例99的结果(使用通过抗6×his标签抗体而使6×his标签融合mtim4蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果)。
根据图18,在结合有tim2蛋白质的情况下,无论采用何种溶出法,都未观察到杆状病毒的标记蛋白质gp64的条带(泳道5-6)。另一方面,对于结合有tim1蛋白质、或tim4蛋白质的载体而言,无论采用何种溶出法,都观察到了gp64的条带(泳道3-4、泳道7-8)。
根据该结果可知,通过已固定化tim2蛋白质的载体,不能取得杆状病毒。
实施例100-105以及比较例26-33.通过利用ps蛋白质的elisa检测细胞外膜囊泡时的灵敏度比较
如下所述地,使用已固定化ps蛋白质或针对外泌体的表面标记蛋白质(以下,有时简记为“标记蛋白质”)的抗体的板(孔),将hrp标记的抗cd63抗体用作检测抗体,进行夹心elisa,检测来自于k562细胞培养上清的细胞外膜囊泡。
<(1)培养上清(原液)的制备>
使用80ml的x-vivo15培养基(商品名,龙沙公司(lonza社)制),在37℃、5%co2条件下,将分泌细胞外膜囊泡的人慢性髄系白血病细胞株k562细胞1×107细胞培养3天后,进行离心分离处理(300×g,5分钟),使细胞沉淀,除去上清。用含有10μm莫能菌素钠(mp生物医学公司(mpbiomedicals社)制)的x-vivo15培养基60ml将沉淀的细胞悬浮后,在37℃、5%co2条件下培养24小时。
然后,对培养液进行离心分离处理(300×g,5分钟),回收培养上清。进一步对回收的培养上清60ml进行3次离心分离处理(第一次:300×g,3分钟;第二次:1200×g,20分钟;第三次:10000×g,20分钟),分离杂质,得到上清(以下,有时简记为“培养上清(原液)”)。
<(2)含有钙离子的k562细胞培养上清的超速离心沉淀组分的稀释系列的制备>
对所述(1)中得到的培养上清原液10ml进行离心分离处理(10000×g,20分钟),分离杂质,将上清移至新的管中,得到离心分离处理后的k562细胞培养上清10ml。然后,对得到的离心分离处理后的k562细胞培养上清10ml进行超速离心分离处理(110000×g,70分钟),除去上清后,在沉淀中加入tbs10ml进行悬浮。对悬浮液进行超速离心分离处理(110000×g,70分钟),除去上清后,在沉淀中加入tbs200μl进行悬浮,得到k562细胞培养上清超速离心沉淀组分。使用bca蛋白检测试剂盒(bcaproteinassaykit)(和光纯药工业(株)制),按照附带于该试剂盒的方案,测定k562细胞培养上清超速离心沉淀组分的蛋白质浓度。以使蛋白质浓度成为125、250、500、1000、2000ng/ml的方式,分别用含有2mmcacl2的tbs进行稀释,制备含有钙离子的k562细胞培养上清超速离心沉淀组分的稀释系列。
<(3)hrp标记的抗cd63小鼠单克隆抗体的制备>
使用过氧化物酶标记试剂盒-氨基(peroxidaselabelingkit-nh2)((株)同仁化学研究所制),并按照附带于该试剂盒的方案,对抗cd63小鼠单克隆抗体h5c6(bd生物科学公司(bdバイオサイエンス社)制)100μl(50μg)进行hrp标记,得到hrp标记的抗cd63小鼠单克隆抗体200μl。在得到的标记体中添加甘油200μl,进行混合,作为hrp标记的抗cd63小鼠单克隆抗体保存液,在-20℃进行保存。将hrp标记的抗cd63小鼠单克隆抗体保存液用含有2mmcacl2的tbs稀释2000倍,制备hrp标记的抗cd63小鼠单克隆抗体稀释液。
<(4)ps蛋白质及抗标记蛋白质抗体的固定化溶液的制备>
如下所述,制备各种ps蛋白质及抗标记蛋白质抗体的固定化溶液。将抗cd9小鼠单克隆抗体m-l13(bd生物科学公司(bdバイオサイエンス社)制)16μl(8μg)与50mmmops(ph7.5)溶液784μl混合,制备抗cd9抗体固定化溶液800μl。将抗cd63小鼠单克隆抗体h5c6(bd生物科学公司(bdバイオサイエンス社)制)16μl(8μg)与50mmmops(ph7.5)溶液784μl混合,制备抗cd63抗体固定化溶液800μl。将抗cd81小鼠单克隆抗体js-81(bd生物科学公司(bdバイオサイエンス社)制)16μl(8μg)与50mmmops(ph7.5)溶液784μl混合,制备抗cd81抗体固定化溶液800μl。将his标签融合小鼠mfg-e8蛋白质(r&d系统公司(r&dシステムズ社)制)80μl(8μg)与50mmmops(ph7.5)溶液720μl混合,制备mmfg-e8固定化溶液800μl。将his标签融合人mfg-e8蛋白质(r&d系统公司(r&dシステムズ社)制)80μl(8μg)与50mmmops(ph7.5)溶液720μl混合,制备hmfg-e8固定化溶液800μl。将his标签融合人膜粘连蛋白-5(annexinv)蛋白质(创意生物公司(creativebiomart社)制)40μl(8μg)与50mmmops(ph7.5)溶液760μl混合,制备h膜粘连蛋白-5固定化溶液800μl。将fc标签融合小鼠tim1蛋白质(和光纯药工业(株)制)32μl(8μg)与50mmmops(ph7.5)溶液768μl混合,制备mtim1固定化溶液800μl。将his标签融合小鼠tim2蛋白质(r&d系统公司(r&dシステムズ社)制)80μl(8μg)与50mmmops(ph7.5)溶液720μl混合,制备mtim2固定化溶液800μl。将fc标签融合小鼠tim3蛋白质(和光纯药工业(株)制)32μl(8μg)与50mmmops(ph7.5)溶液768μl混合,制备mtim3固定化溶液800μl。将fc标签融合mtim4蛋白质(和光纯药工业(株)制)32μl(8μg)与50mmmops(ph7.5)溶液768μl混合,制备mtim4固定化溶液800μl。将fc标签融合人tim1蛋白质(和光纯药工业(株)制)32μl(8μg)与50mmmops(ph7.5)溶液768μl混合,制备htim1固定化溶液800μl。将fc标签融合人tim3蛋白质(和光纯药工业(株)制)32μl(8μg)与50mmmops(ph7.5)溶液768μl混合,制备htim3固定化溶液800μl。将fc标签融合人tim4蛋白质(和光纯药工业(株)制)32μl(8μg)与50mmmops(ph7.5)溶液768μl混合,制备htim4固定化溶液800μl。
<(5)elisa测定>
在maxisorpc96酶标板(immuno-platemaxisorpc96)(商品名,能肯公司(nunc社)制)中,在各孔中分别注入100μl的ps蛋白质的固定化溶液或抗标记蛋白质抗体的固定化溶液,每种蛋白质分注于6孔中,在8℃静置一夜。除去分注液后,在每孔中分别添加300μl的封闭溶液(含有25%blockace封闭剂(商品名)的tbs),一边使用微孔板混合器以500rpm进行混合,一边在室温进行1小时的反应。除去封闭溶液后,对于得到的已固定化各ps蛋白质或抗标记蛋白质抗体的孔,将蛋白质浓度分别为125、250、500、1000、2000ng/ml的含有钙离子的k562细胞培养上清的超速离心沉淀组分的稀释系列各100μl分别添加于5个孔的各孔中,作为空白对照(blank),在各孔中分别添加含有2mmcacl2的tbs100μl,一边用微孔板混合器以500rpm进行混合,一边在室温进行1小时的反应。用含有2mmcacl2的tbs-t300μl洗涤3次后,将hrp标记的抗cd63小鼠单克隆抗体稀释液100μl添加于各孔中,一边用微孔板混合器以500rpm进行混合,一边在室温进行1小时的反应。用含有2mmcacl2的tbs-t300μl洗涤5次后,在各孔中添加tmb溶液(和光纯药工业(株)制)100μl,在室温静置反应30分钟。添加1mhcl100μl使反应停止后,用酶标仪tecanultra(商品名,帝肯公司(tecan社)制)测定450nm处的吸光度。
需要说明的是,将各实施例、比较例中固定化于微孔板的蛋白质及可否检测(结果)示于下表32。
表32
<结果>
将得到的elisa测定的结果示于图19。图19分别表示已固定化ps蛋白质或抗标记蛋白质抗体的孔中的、来自于与含有钙离子的k562细胞培养上清的超速离心沉淀组分的各蛋白质浓度稀释系列所含的外泌体结合的hrp标记的抗cd63小鼠单克隆抗体的检测信号(450nm处的吸光度)。横轴表示已固定化于孔的ps蛋白质或抗标记蛋白质抗体的种类,对于已固定化相同ps蛋白质等的孔的检测结果,使用的含有钙离子的k562细胞培养上清的超速离心沉淀组分中的蛋白质浓度从左开始依次为0、125、250、500、1000、2000ng/ml。另外,纵轴表示来自于与k562细胞培养上清的超速离心沉淀组分的各蛋白质浓度稀释系列所含的外泌体结合的hrp标记的抗cd63小鼠单克隆抗体的检测信号。
对于分别已固定化tim1蛋白质、tim3蛋白质或tim4蛋白质的孔而言,与分别已固定化作为抗标记蛋白质抗体的抗cd9抗体、抗cd63抗体或抗cd81抗体的孔、已固定化作为ps蛋白质的mfg-e8、膜粘连蛋白-5的孔、已固定化作为tim家族蛋白质的tim2蛋白质的孔(比较例27-33)相比,能够高灵敏度地检测细胞外膜囊泡(实施例100-105)。即,与现有方法相比,可知使用本发明的tim蛋白质的本发明的检测方法能够高灵敏度地检测细胞外膜囊泡。特别地,在tim蛋白质中,使用tim4蛋白质时,能够特别高灵敏度地检测细胞外膜囊泡。
实施例106-109.根据tim蛋白质的固定化方法的不同、利用elisa检测细胞外膜囊泡时的灵敏度比较
如下所示,对将tim1蛋白质或tim4蛋白质分别直接固定化于微孔板时的细胞外膜囊泡的检测灵敏度、以及通过链霉亲和素将对巯基进行了生物素标记的tim1蛋白质或对巯基进行了生物素标记的tim4蛋白质分别固定化于微孔板时的细胞外膜囊泡的检测灵敏度进行比较。
<(1)k562细胞培养上清的超速离心沉淀组分的制备>
“用含有2mmcacl2的tbs分别进行稀释以使蛋白质浓度成为500、1000ng/ml”替代“用含有2mmcacl2的tbs进行稀释以使蛋白质浓度成为125、250、500、1000、2000ng/ml”,除此以外,通过采用实施例100-105及比较例26-33的“(2)含有钙离子的k562细胞培养上清的超速离心沉淀组分的制备”相同的方法,制备含有钙离子的k562细胞培养上清的超速离心沉淀组分的稀释系列。
<(2)hrp标记的抗cd63小鼠单克隆抗体的制备>
通过与实施例100-105及比较例26-33的“(3)hrp标记的抗cd63小鼠单克隆抗体的制备”相同的方法,制备hrp标记的抗cd63小鼠单克隆抗体稀释液。
<(3)tim1蛋白质及tim4蛋白质的生物素标记/固定化溶液的制备>
对于fc标签融合小鼠源tim1蛋白质(和光纯药工业(株)制)40μl(10μg)及fc标签融合小鼠源tim4蛋白质(和光纯药工业(株)制)40μl(10μg),使用生物素标记试剂盒-巯基(biotinlabelingkit-sh)((株)同仁化学研究所制),按照附带于该试剂盒的方案分别进行生物素标记,得到巯基生物素标记的fc标签融合mtim1蛋白质及巯基生物素标记的fc标签融合mtim4蛋白质。使用bca蛋白检测试剂盒(和光纯药工业(株)制),按照附带于该试剂盒的方案,分别对巯基生物素标记的fc标签融合mtim1蛋白质及巯基生物素标记的fc标签融合mtim4蛋白质的蛋白质浓度进行测定。用tbs进行稀释以使蛋白质浓度成为5μg/ml,分别制备巯基生物素标记的fc标签融合mtim1蛋白质及巯基生物素标记的fc标签融合mtim4蛋白质溶液。
将fc标签融合小鼠源tim1蛋白质(和光纯药工业(株)制)或fc标签融合小鼠源tim4蛋白质(和光纯药工业(株)制)8μl(2μg)与50mmmops(ph7.5)溶液392μl混合,分别制备mtim1蛋白质固定化溶液或mtim4蛋白质固定化溶液400μl。
另外,将链霉亲和素(和光纯药工业(株)制)2μl(10μg)与50mmmops(ph7.5)溶液998μl混合,制备链霉亲和素固定化溶液1000μl。
<(4)固定化>
在maxisorpc96酶标板(immuno-platemaxisorpc96)(商品名,能肯公司(nunc社)制)中,在3孔中以每孔100μl(0.5μg)的方式分别添加各蛋白质固定化溶液,在8℃静置一夜。除去添加液后,在各孔中分别添加300μl的封闭溶液(含有25%blockace封闭剂(商品名)的tbs),一边用微孔板混合器以500rpm进行混合,一边在室温进行1小时反应。
另外,在maxisorpc96酶标板(商品名,能肯公司(nunc社)制)中,在6个孔中,以每孔为100μl的方式分别添加链霉亲和素固定化溶液,在8℃静置一夜。除去添加液后,在各孔中分别添加300μl的封闭溶液(含有25%blockace封闭剂(商品名)的tbs),一边用微孔板混合器以500rpm进行混合,一边在室温进行1小时的反应。除去封闭溶液后,将巯基生物素标记的fc标签融合mtim1蛋白质及巯基生物素标记的fc标签融合mtim4蛋白质溶液以每孔为100μl(0.5μg)的方式添加于3个孔中,一边用微孔板混合器以500rpm进行混合,一边在室温进行1小时的反应。
<(5)elisa测定>
“对于各蛋白质固定化孔,分别将蛋白质浓度为500或1000ng/ml的含有钙离子的k562细胞培养上清的超速离心沉淀组分稀释系列各100μl添加于2个孔的各孔中”替代“对于已固定化各ps蛋白质或标记蛋白质的孔,分别将蛋白质浓度分别为125、250、500、1000、2000ng/ml的含有钙离子的k562细胞培养上清的超速离心沉淀组分稀释系列各100μl添加于5个孔的各孔中”,除此以外,通过与实施例100-105及比较例26-33相同的方法,进行elisa测定。
需要说明的是,将各实施例、比较例中固定化于微孔板的蛋白质、蛋白质固定化于微孔板的方法、以及可否检测(结果)示于下表33。表33中的可否检测分别是实施例106与107、实施例108与109的对比。
表33
将得到的elisa测定的结果示于图20。图20表示在直接将mtim1蛋白质固定化于微孔板的孔、直接将mtim4蛋白质固定化于微孔板的孔、将mtim1蛋白质通过生物素-链霉亲和素结合而固定化的孔、以及将mtim4蛋白质通过生物素-链霉亲和素结合而固定化的孔中的、来自于与含有钙离子的k562细胞培养上清的超速离心沉淀组分的各蛋白质浓度稀释系列所含的外泌体结合的hrp标记的抗cd63小鼠单克隆抗体的检测信号(450nm处的吸光度)。
横轴表示固定化于孔的tim蛋白质的种类。另外,纵轴表示来自于与含有钙离子的k562细胞培养上清的超速离心沉淀组分的各蛋白质浓度稀释系列所含的外泌体结合的hrp标记的抗cd63小鼠单克隆抗体的检测信号。
根据图20可知,通过使用tim1蛋白质或tim4蛋白质的elisa,无论相对于微孔板固定tim蛋白质的方法如何,都能够检测试样中的细胞外膜囊泡(实施例106-109)。特别地,与直接固定化tim蛋白质的孔(将mtim1直接固定化于微孔板的实施例106以及将mtim4直接固定化于微孔板而固定化的实施例108)相比,在通过链霉亲和素将tim蛋白质固定化的孔(通过mtim1的巯基的生物素与链霉亲和素的结合而使微孔板与tim蛋白质结合的实施例107、及通过mtim4的巯基的生物素与链霉亲和素的结合而使微孔板与tim蛋白质结合的实施例109)中,能够高灵敏度地检测细胞外膜囊泡。
因此可知,作为tim蛋白质与固相的结合方式,更优选的是,通过tim蛋白质的巯基的生物素与链霉亲和素的结合,使微孔板与tim蛋白质结合。
实施例110-115以及比较例34-39.通过使用ps蛋白质的elisa来检测病毒时的灵敏度比较
如下所示,使用已固定化各种ps蛋白质或针对杆状病毒的表面标记蛋白质gp64的抗体的微孔板,并将hrp标记的抗gp64抗体用作检测抗体,进行夹心elisa,检测含有杆状病毒的昆虫细胞培养上清样品中的杆状病毒。
<(1)共转染细胞培养上清的制备>
与实施例84-95、比较例20-21的“(1)共转染细胞培养上清的制备”同样地进行。
<(2)含有钙离子的含杆状病毒的昆虫细胞培养上清样品的制备>
与实施例84-95、比较例20-21的“(2)含有杆状病毒的昆虫细胞培养上清样品的制备”同样地进行,得到含有钙离子的杆状病毒溶液。
<(3)含有杆状病毒的昆虫细胞培养上清样品稀释系列的制备>
将含有杆状病毒的昆虫细胞培养上清样品50μl与psfm-j1培养基4950μl混合,制备100倍稀释液,将100倍稀释液2.0ml与psfm-j1培养基2.0ml混合,制备200倍稀释液4.0ml,将200倍稀释液2.0ml与psfm-j1培养基2.0ml混合,制备400倍稀释液4.0ml,将400倍稀释液2.0ml与psfm-j1培养基2.0ml混合,制备800倍稀释液4.0ml。
<(4)hrp标记的抗gp64小鼠单克隆抗体的制备>
使用过氧化物酶标记试剂盒-氨基(peroxidaselabelingkit-nh2)((株)同仁化学研究所制),按照附带于该试剂盒中的方案,对抗gp64小鼠单克隆抗体acv1(商品名,诺夫斯生物公司(novusbiologicals社)制)200μl(100μg)进行hrp标记,得到hrp标记的抗gp64小鼠单克隆抗体溶液200μl。用含有2mmcacl2的tbs将hrp标记的抗gp64小鼠单克隆抗体溶液稀释1000倍,制备hrp标记的抗gp64小鼠单克隆抗体稀释液。
<(5)ps蛋白质及抗gp64抗体的固定化溶液的制备>
如下所述,分别制备各种ps蛋白质及标记蛋白质的固定化溶液。将抗gp64小鼠单克隆抗体acv1(商品名,诺夫斯生物公司(novusbiologicals社)制)12μl(6μg)与50mmmops(ph7.5)溶液588μl混合,制备抗gp64抗体固定化溶液600μl。将his标签融合小鼠源mfg-e8蛋白质(r&d系统公司(r&dsystems社)制)60μl(6μg)与50mmmops(ph7.5)溶液540μl混合,制备mmfg-e8固定化溶液600μl。将his标签融合人源mfg-e8蛋白质(r&d系统公司(r&dsystems社)制)60μl(6μg)与50mmmops(ph7.5)溶液540μl混合,制备hmfg-e8固定化溶液600μl。将his标签融合人源膜粘连蛋白-5蛋白质(创意生物公司(creativebiomart社)制)30μl(6μg)与50mmmops(ph7.5)溶液570μl混合,制备h膜粘连蛋白-5固定化溶液600μl。将fc标签融合小鼠源tim1蛋白质(和光纯药工业(株)制)24μl(6μg)与50mmmops(ph7.5)溶液576μl混合,制备mtim1固定化溶液600μl。将his标签融合小鼠源tim2蛋白质(r&d系统公司(r&dsystems社)制)60μl(6μg)与50mmmops(ph7.5)溶液540μl混合,制备mtim2固定化溶液600μl。将fc标签融合小鼠源tim3蛋白质(和光纯药工业(株)制)24μl(6μg)与50mmmops(ph7.5)溶液576μl混合,制备mtim3固定化溶液600μl。将fc标签融合小鼠源tim4蛋白质(和光纯药工业(株)制)24μl(6μg)与50mmmops(ph7.5)溶液576μl混合,制备mtim4固定化溶液600μl。将fc标签融合人源tim1蛋白质(和光纯药工业(株)制)24μl(6μg)与50mmmops(ph7.5)溶液576μl混合,制备htim1固定化溶液600μl。将fc标签融合人源tim3蛋白质(和光纯药工业(株)制)24μl(6μg)与50mmmops(ph7.5)溶液576μl混合,制备htim3固定化溶液600μl。将fc标签融合人源tim4蛋白质(和光纯药工业(株)制)24μl(6μg)与50mmmops(ph7.5)溶液576μl混合,制备htim4固定化溶液600μl。
<(6)elisa测定>
在maxisorpc96酶标板(immuno-platemaxisorpc96)(商品名,能肯公司(nunc社)制)中,在每孔中注入100μl的ps蛋白质或抗gp64抗体的固定化溶液,每种蛋白注入5个孔中,在8℃静置一夜。除去分注液后,在各孔中分别添加300μl的封闭溶液(含有25%blockace封闭剂(商品名)的tbs),一边用微孔板混合器以500rpm进行混合,一边在室温进行1小时的反应。除去封闭溶液后,对于得到的已固定化各ps蛋白质或抗gp64抗体的孔,将所述(3)中制备的含有钙离子的含杆状病毒的昆虫细胞培养上清样品稀释系列(100倍稀释、200倍稀释、400倍稀释、800倍稀释)各100μl分别添加于4个孔中的各孔中,作为空白对照,将pmsf-j1培养基100μl分别添加于1个孔中,一边用微孔板混合器以500rpm进行混合,一边在室温进行1小时的反应。用含有2mmcacl2的tbs-t300μl洗涤3次后,将hrp标记的抗gp64小鼠单克隆抗体稀释液100μl添加于各孔,一边用微孔板混合器以500rpm进行混合,一边在室温进行1小时的反应。用含有2mmcacl2的tbs-t300μl洗涤5次后,将tmb溶液(和光纯药工业(株)制)100μl添加于各孔,在室温静置反应30分钟。添加1mhcl100μl,使反应停止,然后,用酶标仪tecanultra(商品名,帝肯公司(tecan社)制)测定450nm处的吸光度。
需要说明的是,将各实施例、比较例中固定化于微孔板的蛋白质及可否检测(结果)示于下表34。
表34
<结果>
将得到的elisa测定的结果示于图21。图21分别表示在已固定化各种ps蛋白质及抗gp64抗体的孔中的、来自于与含有钙离子的含杆状病毒的昆虫细胞培养上清的各稀释系列所含的外泌体结合的hrp标记的抗gp64小鼠单克隆抗体的检测信号(450nm处的吸光度)。横轴表示固定化于孔的ps蛋白质或抗标记蛋白质抗体的种类,对于已固定化同一ps蛋白质等的孔的检测结果,从左开始依次表示空白对照、使用的含有钙离子的含杆状病毒的昆虫细胞培养上清样品稀释系列分别稀释800倍、稀释400倍、稀释200倍、稀释100倍。另外,纵轴表示来自于hrp标记的抗gp64小鼠单克隆抗体的检测信号(450nm处的吸光度)。
对于已分别固定化tim1蛋白质、tim3蛋白质或tim4蛋白质的孔而言,与已固定化作为杆状病毒的表面标记蛋白质的抗gp64抗体的孔、已固定化作为ps蛋白质的mfg-e8、膜粘连蛋白-5的孔、已固定化作为tim家族蛋白质的tim2蛋白质的孔相比(比较例34-39),能够高灵敏地检测病毒(实施例110-115)。即,可知与现有方法相比,使用本发明的tim蛋白质的本发明的检测方法能够高灵敏度地检测病毒。特别地,可知在tim蛋白质中,使用tim4蛋白质时,能够特别高灵敏度地检测病毒。
实施例116-119.利用已固定化tim蛋白质的载体取得病毒
使用已固定化生物素标记的tim4蛋白质的载体,取得本发明的病毒。
<(1)共转染细胞培养上清的制备>
与实施例84-95、比较例20-21的“(1)共转染细胞培养上清的制备”同样地进行。
<(2)含有钙离子的含杆状病毒的昆虫细胞培养上清样品的制备>
与实施例84-95、比较例20-21的“(2)含有杆状病毒的昆虫细胞培养上清样品的制备”同样地进行,得到含有钙离子的含杆状病毒的昆虫细胞培养上清样品。
<(3)含有杆状病毒的昆虫细胞培养上清样品稀释液的制备>
将含有钙离子的含杆状病毒的昆虫细胞培养上清样品100μl与psfm-j1培养基800μl混合,制备9倍稀释液900μl。
<(4)tim4蛋白质的巯基生物素标记>
对于含有fc标签融合小鼠源tim4蛋白质(和光纯药工业(株)制)的pbs溶液100μl(含有fc标签融合小鼠源tim4蛋白质10μg),使用生物素标记试剂盒-巯基(同仁化学研究所制),按照附带于该试剂盒的方案,对fc标签融合小鼠源tim4蛋白质的巯基进行生物素标记,得到含有巯基生物素标记的fc标签融合mtim4蛋白质的pbs溶液100μl。
<(5)标签融合tim蛋白质的稀释>
将含有fc标签融合mtim4蛋白质(和光纯药工业(株)制)的pbs溶液5μl(含有fc标签融合mtim4蛋白质0.5μg)与tbs95μl混合,得到含有生物素非标记的fc标签融合mtim4蛋白质0.5μg的溶液100μl。
将所述(4)中制备的含有巯基生物素标记的fc标签融合mtim4蛋白质的tbs溶液5μl(含有巯基生物素标记的fc标签融合mtim4蛋白质0.5μg)与tbs95μl混合,得到含有生物素标记的fc标签融合mtim4蛋白质1μg的溶液100μl。
<(6)珠的洗涤>
将含有30μg/μl的dynabeadsg蛋白(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)的pbs-t溶液5μl(含有dynabeadsg蛋白0.3mg)移至1.5ml管(bm设备公司(ビーエム机器社)制),用tbs-t(tbs,0.0005%吐温20(tween20))500μl洗涤2次后,将管设置于磁力架,除去洗涤液。
另外,将含有magcapturetamavidin2-rev(商品名,和光纯药工业(株)制)的pbs溶液30μl(含有珠0.3mg)移至1.5ml管(bm设备公司(ビーエム机器社)制)中,用tbs-t(tbs,0.0005%吐温20(tween20))500μl洗涤2次后,将管设置于磁力架,除去洗涤液。
<(7)tim蛋白质固定于珠>
在含有洗涤操作后的颗粒状态的dynabeadsg蛋白0.3mg的1.5ml管中,添加含有巯基生物素非标记的fc标签融合mtim4蛋白质0.5μg的溶液100μl,使用热混合器,在8℃以1200rpm反应1小时,得到结合有巯基生物素非标记的fc标签融合mtim4的载体(有时简记为“生物素非标记的fc标签融合mtim4载体”)。
另外,在含有洗涤操作后的magcapturetamavidin2-rev0.3mg的1.5ml管中,加入含有巯基生物素标记的fc标签融合mtim4蛋白质0.5μg的溶液100μl,与所述同样地与珠结合,得到结合有巯基生物素标记的fc标签融合mtim4的载体(有时简记为“生物素标记的fc标签融合mtim4载体”)。
需要说明的是,有时将所述得到的2种载体一并简记为“tim蛋白质结合载体”。
<(8)利用本发明的取得方法取得杆状病毒>
用tbs-t(tbs,0.0005%吐温20(tween20))250μl对所述得到的所述tim蛋白质结合载体进行3次洗涤操作,得到颗粒状态的tim蛋白质结合载体。然后,在得到的2种颗粒状态的tim蛋白质结合载体中,分别加入所述(3)中制备的含有钙离子的含杆状病毒的昆虫细胞培养上清样品稀释液100μl,使用热混合器,在8℃以1200rpm进行12小时的反应。然后,用含有钙离子的tbs-t(tris缓冲液,0.0005%吐温20(tween20),2mmcacl2)250μl分别对反应后的tim蛋白质结合载体进行3次洗涤操作。在进行第三次洗涤操作时,分别将含有tim蛋白质结合载体的含cacl2的tbs-t溶液250μl分别以125μl分注于2个1.5ml管中,将管设置于磁力架后,除去洗涤液。
在颗粒状态的2种tim蛋白质结合载体0.15mg中,分别添加作为溶出液的1%sds水溶液50μl、或者添加含有1mmedta的tbs溶液25μl后,通过漩涡混合器在室温混合10秒,停止转动(spindown)。在添加了edta的管中,再次添加含有1mmedta的tbs溶液25μl,进行同样的操作,得到溶出液。
需要说明的是,将各实施例中使用的tim蛋白质及载体的种类、以及tim蛋白质(非)结合载体的种类示于下表35。
表35
<(9)蛋白质免疫印迹>
“在所述(8)利用本发明的取得方法取得杆状病毒中得到的各溶出液15μl中加入4×试样用缓冲液(和光纯药工业(株)制)15μl”替代“在得到的各溶出液11.25μl中加入4×试样用缓冲液(和光纯药工业(株)制)3.75μl”,使用“抗杆状病毒gp64抗体”替代“抗lamp-1抗体”,除此以外,采用与实施例80-83及比较例16-19的“(5)蛋白质免疫印迹”相同的方法进行。
需要说明的是,各实施例中使用的tim蛋白质及载体的种类、用于从tim蛋白质结合载体取得病毒的溶出液的种类、以及蛋白质免疫印迹中的泳道号示于下表36。
表36
<结果>
将得到的蛋白质免疫印迹的结果示于图22。图22中,各泳道为以下的结果。
泳道1:实施例116的结果(使用使巯基生物素非标记的fc标签融合mtim4蛋白质结合于dynabeadsg蛋白而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道2:实施例117的结果(使用使巯基生物素非标记的fc标签融合mtim4蛋白质结合于dynabeadsg蛋白而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果);
泳道3:实施例118的结果(使用使巯基生物素标记的fc标签融合mtim4蛋白质结合于magcapturetamavidinrev-2而成的载体、并将1%sds水溶液用作溶出液时的结果);
泳道4:实施例119的结果(使用使巯基生物素标记的fc标签融合mtim4蛋白质结合于magcapturetamavidinrev-2而成的载体、并将含有1mmedta的tbs溶液用作溶出液时的结果)。
根据图22可知,在泳道1-4中,无论在哪一种情况下都观察到了作为杆状病毒的标记蛋白质的gp64的条带,因此,通过使用结合有巯基生物素非标记或标记的tim4的载体,能取得病毒。
另外,通过比较泳道2与泳道4可知,在通过钙螯合剂进行溶出的情况下,通过tim蛋白质的巯基而固定化于珠(载体),从而与通过标签进行固定化时相比,能够取得更多的病毒。
实施例120-121以及比较例40-41.利用流式细胞仪比较细胞外膜囊泡的检测灵敏度
如下所述,使用已固定化tim4蛋白质或针对外泌体的表面标记蛋白质的cd63的抗体的载体、以及作为检测抗体的pe标记的抗cd63抗体,通过流式细胞仪,检测来自于k562细胞培养上清的细胞外膜囊泡。
<(1)含有钙离子的培养上清(原液)的制备>
使用80ml的x-vivo15培养基(商品名,龙沙公司(lonza社)制),在37℃、5%co2条件下,将分泌细胞外膜囊泡的人慢性髄系白血病细胞株k562细胞1×107个细胞培养3天后,进行离心分离处理(300×g,5分钟),使细胞沉淀,除去上清。用含有10μm莫能菌素钠(mp生物医学公司(mpbiomedicals社)制)的x-vivo15培养基60ml将沉淀的细胞悬浮后,在37℃、5%co2条件下培养24小时。
然后,对培养液进行离心分离处理(300×g,5分钟),回收培养上清。进一步地对回收的培养上清60ml进行3次离心分离处理(第一次:300×g,3分钟;第二次:1200×g,20分钟;第三次:10000×g,20分钟),分离杂质,得到上清(以下,有时简记为“培养上清(原液)”)。
另外,在得到的培养上清原液中添加cacl2以使其终浓度成为2mm,得到含有2mmcacl2的k562细胞培养上清浓缩液样品(以下,有时简记为“含有钙离子的培养上清(原液)”)。
<(2)培养上清样品稀释液的制备>
将所述得到的含有钙离子的培养上清(原液)500μl与x-vivo15培养基500μl混合,制备2倍稀释液1.0ml,将2倍稀释液200μl与x-vivo15培养基800μl混合,制备10倍稀释液1.0ml,分别得到含有钙离子的培养上清2倍稀释液(原液)、以及含有钙离子的培养上清10倍稀释液(原液)。
<(3)tim4蛋白质的巯基生物素标记>
对于含有fc标签融合小鼠源tim4蛋白质(和光纯药工业(株)制)的pbs溶液100μl(含有fc标签融合小鼠源tim4蛋白质10μg),使用生物素标记试剂盒-巯基(同仁化学研究所制),按照附带于该试剂盒中的方案,对fc标签融合小鼠源tim4蛋白质的巯基进行生物素标记,得到含有巯基生物素标记的fc标签融合mtim4蛋白质的pbs溶液100μl。
<(5)珠的洗涤>
将外泌体-链霉亲和素分离/检测试剂(商品名,赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)(含有1×107/ml的dynabeads链霉亲和素4.5μm珠)20μl分注于2个1.5ml管(bm设备公司(ビーエム机器社)制)中,用tbs200μl进行洗涤操作。
分别将外泌体-人cd63分离/检测试剂(exosome-humancd63isolation/detectionreagent)(赛默飞世尔科技公司(サーモフィッシャーサイエンティフィック社)制)(含有1×107/ml的已固定化抗cd63抗体后的dynabeads4.5μm珠)20μl分注于2个1.5ml管(bm设备公司(ビーエム机器社)制)中,用tbs200μl进行洗涤操作。
<(6)tim4蛋白质固定于珠>
在含有洗涤操作后的颗粒状态的dynabeads链霉亲和素的2个1.5ml管中,添加含有巯基生物素标记的fc标签融合mtim4蛋白质0.1μg的溶液100μl,用热混合器在8℃以1200rpm反应30分钟,得到含有结合有巯基生物素标记的fc标签融合mtim4的载体(有时简记为“生物素标记的fc标签融合mtim4载体”)的溶液(有时简记为“含有生物素标记的fc标签融合mtim4载体的溶液”)。
<(7)与细胞外膜囊泡的反应>
在将所述得到的含有生物素标记的fc标签融合mtim4载体的溶液100μl设置于磁力架后,除去含有生物素标记的fc标签融合mtim4载体的溶液中的溶液。用含有0.1%bsa的tbs200μl,将颗粒状态的生物素标记的fc标签融合mtim4载体及洗涤操作后的颗粒状态的外泌体-人cd63分离/检测试剂(exosome-humancd63isolation/detectionreagent)洗涤2次,得到颗粒状态的载体。然后,在得到的颗粒状态的各载体中,分别加入所述(2)中制备的含有钙离子的培养上清2倍稀释液(原液)和培养上清10倍稀释液(原液)100μl,用热混合器在8℃以1200rpm分别进行12小时的反应。然后,用含有钙离子—0.1%bsa的tbs(tbs,0.1%bsa,2mmcacl2)300μl对反应后的载体进行1次洗涤操作,用含有钙离子—0.1%bsa的tbs400μl进行1次洗涤操作,用含有钙离子—0.1%bsa的tbs(tbs,0.1%bsa,2mmcacl2)300μl分别将洗涤操作后的颗粒状态的各载体悬浮,分别得到下表37中记载的2种载体的悬浮液。
表37
<(8)利用pe标记的抗cd63抗体进行检测>
分别将所述(7)中得到的2种载体的悬浮液以100μl分注于2个1.5ml管中,在通过磁选分离使载体成为颗粒状态后,分别添加20μl的pe标记的抗cd63小鼠单克隆抗体h5c6(bd生物科学公司(bdバイオサイエンス社)制)或pe标记的对照小鼠igg(bd生物科学公司(bdバイオサイエンス社)制),用热混合器在25℃分别以1000rpm进行1小时的反应。然后,在用含有钙离子和0.1%bsa的tbs(tbs,0.1%bsa,2mmcacl2)300μl分别进行2次洗涤操作后,用含有钙离子和0.1%bsa的tbs(tbs,0.1%bsa,2mmcacl2)500μl将载体悬浮。然后,用falcon细胞滤网(falconcellstrainers)(商品名,康宁公司(コーニング社)制)回收过滤的滤液,用流式细胞仪gallios(商品名,美国贝克曼库尔特公司(ベックマンコールター社)制)进行测定及分析。需要说明的是,测定时的激光波长为488nm,检测波长为575nm。
需要说明的是,将各实施例中使用的tim蛋白质、载体的种类以及试样示于下表38。
表38
<结果>
将得到的流式细胞仪的测定结果示于图23。图23分别表示对于使用生物素标记的fc标签融合mtim4载体和抗cd63抗体载体从以各倍率稀释的含有钙离子的培养上清(原液)中捕获的外分泌体、采用pe标记的抗cd63小鼠单克隆抗体所检测的信号与采用pe标记的对照小鼠igg所检测的噪声的比(信号/噪声比:signal/noise比)。横轴表示使用的含有钙离子的培养上清(原液)的稀释倍率,纵轴表示采用pe标记的抗cd63小鼠单克隆抗体所检测的信号与采用pe标记的对照小鼠igg所检测的噪声的比。
根据图23可知,通过使用结合有本发明的tim蛋白质的载体,能检测细胞外膜囊泡。另外,相比于使用已固定化抗cd63抗体的载体,使用已固定化tim4的载体能够以更高的信噪比(signal/noise比)(检测灵敏度)进行流式细胞仪测定。即,可知通过使用本发明的tim载体的流式细胞仪分析,与现有方法相比,能够高灵敏度地检测细胞外膜囊泡。
实施例122-123以及比较例42-43.利用已固定化tim蛋白质的载体取得病毒
使用已固定化tim蛋白质的载体,取得本发明的病毒。
<(1)fc标签融合mtim4蛋白质的巯基生物素标记>
使用生物素标记试剂盒-巯基(同仁化学研究所制),按照附带于该试剂盒中的方案,对含有fc标签融合小鼠源tim4蛋白质(和光纯药工业(株)制)的pbs溶液100μl(含有fc标签融合小鼠源tim4蛋白质10μg)中的fc标签融合小鼠源tim4蛋白质的巯基进行生物素标记,得到含有巯基生物素标记的fc标签融合mtim4蛋白质的pbs溶液100μl。
<(2)巯基生物素标记的fc标签融合mtim4蛋白质的稀释>
将所述(1)中制备的含有巯基生物素标记的fc标签融合mtim4蛋白质的tbs溶液10μl(含有巯基生物素标记的fc标签融合mtim4蛋白质1μg)与tbs190μl混合,得到含有巯基生物素标记的fc标签融合mtim4蛋白质1μg的溶液200μl。
<(3)珠的洗涤>
将含有magcapturetamavidin2-rev(商品名,和光纯药工业(株)制)的pbs溶液60μl(含有magcapturetamavidin2-rev0.6mg)分别移至2个1.5ml管(bm设备公司(ビーエム机器社)制)中,用tbs-t(tris缓冲液,0.0005%吐温20(tween20))500μl分别洗涤2次后,将管设置于磁力架,除去洗涤液。
<(4)巯基生物素标记的fc标签融合mtim4蛋白质固定于珠>
在含有洗涤操作后的magcapturetamavidin2-rev0.6mg的2个1.5ml管中,加入含有巯基生物素标记的fc标签融合mtim4蛋白质1μg的溶液200μl或tbs200μl,用热混合器在8℃以1200rpm分别进行1小时的反应,得到结合有巯基生物素标记的fc标签融合mtim4的载体(有时简记为“生物素标记的fc标签融合mtim4结合载体”)与未结合有巯基生物素标记的fc标签融合mtim4的载体(有时简记为“生物素标记的fc标签融合mtim4非结合载体”)。需要说明的是,有时将生物素标记的fc标签融合mtim4结合载体与生物素标记的fc标签融合mtim4非结合载体一并简记为“tim蛋白质(非)结合载体”。
<(5)利用本发明的取得方法取得流感病毒>
用tbs-t(tris缓冲液,0.0005%吐温20(tween20))500μl分别对所述得到的2种tim蛋白质(非)结合载体进行3次洗涤操作。在洗涤操作后的2种tim蛋白质(非)结合载体中,分别加入添加有终浓度为2mm的氯化钙的含有钙离子的流感a病毒溶液(h1n1a/ws/33病毒株)(atcc编码:vr-825)60μl,用热混合器在8℃以1200rpm分别反应2个小时。用含有钙离子的tbs-t(tris缓冲液,0.0005%吐温20(tween20),2mmcacl2)500μl分别对反应后的2种tim蛋白质(非)结合载体进行3次洗涤操作。在进行第三次洗涤操作后,在2种tim蛋白质(非)结合载体中,分别添加含有钙离子的tbs-t(tris缓冲液,0.0005%吐温20(tween20),2mmcacl2)500μl进行悬浮,分别得到悬浮液500μl。分别将该悬浮液以250μl的方式分注于2个1.5ml管中,将管设置于磁力架后,分别除去洗涤液,分别得到颗粒状态的tim蛋白质(非)结合载体。
需要说明的是,将各实施例及比较例中使用的载体的种类以及tim蛋白质的种类示于下表39。
表39
在得到的含有颗粒状态的tim蛋白质(非)结合载体0.3mg的4个1.5ml管中,对于含有tim蛋白质结合载体的1个1.5ml管以及含有tim蛋白质非结合载体的1个1.5ml管,分别添加作为溶出液的1%sds水溶液20μl,然后,通过漩涡混合器在室温混合10秒,停止转动(spindown),分别得到溶出液。
另外,在含有该颗粒状态的tim蛋白质(非)结合载体0.3mg的4个1.5ml管中,对于含有tim蛋白质结合载体的1个1.5ml管以及含有tim蛋白质非结合载体的1个1.5ml管,分别添加作为溶出液的含有50mmedta的tbs溶液10μl,然后,通过漩涡混合器在室温混合10秒,停止转动(spindown)。在停止转动后的管中,分别再次添加含有50mmedta的tbs溶液10μl,然后,通过漩涡混合器在室温混合10秒,停止转动,分别得到溶出液。
在得到的4种溶出液20μl中,分别添加含有10%β-丙内酯的tbs溶液2.2μl,用漩涡混合器混合后,在冰上静置3小时,分别得到4种β-丙内酯处理后的溶出液22.2μl。
<(6)蛋白质免疫印迹>
在所述含有钙离子的流感a病毒溶液(h1n1a/ws/33病毒株)(atcc编码:vr-825)30μl中,添加含有10%β-丙内酯的tbs溶液3.3μl,用漩涡混合器混合后,在已在冰上静置了3小时的溶液中加入4×试样用缓冲液(和光纯药工业(株)制)11.1μl,在95℃加热3分钟,得到蛋白质免疫印迹用的投入试样(共44.4μl)。另外,在所述4种β-丙内酯处理后的溶出液22.2μl中分别加入4×试样用缓冲液(和光纯药工业(株)制)7.4μl,在95℃加热3分钟,分别得到蛋白质免疫印迹用各溶出液试样(共29.6μl)。在supersepace5-20%凝胶(商品名,和光纯药工业(株)制)中分别加入该蛋白质免疫印迹用投入试样20μl以及蛋白质免疫印迹用各溶出液试样20μl,以30ma进行60分钟电泳。使用半干印迹仪以及不连续缓冲液(阳极缓冲液1:0.3mtris/20%甲醇;阳极缓冲液2:0.025mtris/20%甲醇;阴极缓冲液:0.025mtris/0.04m氨基己酸/20%甲醇),在1.2ma/cm2的条件下,将得到的电泳凝胶转印于pvdf膜(密里博公司(millipore社)制)60分钟。在转印后的pvdf膜中加入用tbs-t(tbs缓冲液,0.1%吐温20(tween20))稀释的5%脱脂奶,在室温反应1小时,进行封闭,将用tbs-t稀释300倍的抗流感a病毒核蛋白(nucleoprotein)抗体c43(abcam公司制)2ml在室温条件下反应1小时。用tbs-t将反应后的pvdf膜洗涤3次,将用tbs-t稀释30000倍的次级抗体抗{小鼠igg(h+l)、驴、igg组分、过氧化物酶结合抗体}(杰克逊免疫研究公司(jacksonimmunoresearch社)制)在室温条件下反应1小时。用tbs-t洗涤5次后,在使各抗体反应后的pvdf膜中添加immunostarzeta(商品名,和光纯药工业(株)制),用las-4000(通用电气公司(ge社)制)检测发光信号。
需要说明的是,将各实施例中使用的载体的种类、tim蛋白质的种类以及来自于载体的溶出液的种类示于下表40。
表40
<结果>
将得到的蛋白质免疫印迹的结果示于图24。图24中,各泳道为以下的结果。
泳道1:对流感a病毒进行电泳的结果;
泳道2:比较例42的结果(使用生物素标记的fc标签融合mtim4非结合载体、并将1%sds溶液用作溶出液时的结果);
泳道3:比较例43的结果(使用生物素标记的fc标签融合mtim4非结合载体、并将含有50mmedta的tbs溶液用作溶出液时的结果);
泳道4:实施例122的结果(使用生物素标记的fc标签融合mtim4结合载体、并将1%sds溶液用作溶出液时的结果);
泳道5:实施例123的结果(使用生物素标记的fc标签融合mtim4结合载体、并将含有50mmedta的tbs溶液用作溶出液时的结果)。
根据图24可知,对于泳道2-3(使用生物素标记的fc标签融合mtim4非结合载体时)而言,无论哪一种情况下,都未观察到作为流感a病毒的标记蛋白质的核蛋白的条带,相对于此,对于泳道4-5(使用生物素标记的fc标签融合mtim4结合载体时)而言,无论哪一种情况下,都观察到了作为流感a病毒的标记蛋白质的核蛋白的条带,由此可知结合有tim蛋白质的载体能取得流感病毒。
另外,通过比较泳道1(对流感a病毒进行电泳的结果)与泳道4-5(使用生物素标记的fc标签融合mtim4结合载体时的结果)可知,通过使用结合有tim蛋白质的载体,能够高效地取得流感病毒。
实施例124-125以及比较例44-45.利用已固定化tim蛋白质的载体取得病毒
使用已固定化tim蛋白质的载体,取得本发明的病毒。
<(1)含有rs病毒的hep-2细胞培养上清样品的制备>
将含有1.5×106个hep-2细胞的含10%fbs的d-mem高葡萄糖型培养基(和光纯药工业(株)制)20ml加入75cm2烧瓶中,在37℃、5%co2的条件下培养4天。从培养后的培养液中除去上清,添加含有5.3×105tcid50/ml的rs病毒液(atcc、编码:vr-26)的含2%fbs的e-mem培养基5ml,在36℃、5%co2的条件下静置1小时。进一步添加含有2%fbs的e-mem培养基20ml,在36℃、5%co2条件下培养3天。从该培养后的培养液中除去上清,添加含有2%fbs的e-mem培养基20ml,在36℃、5%co2的条件下培养2天。然后,用移液器(pipetting)将细胞从烧瓶剥离,与培养上清一同回收至50ml离心分离管,以1500rpm进行10分钟离心,仅回收培养上清。在得到的培养上清中添加氯化钙以使其终浓度成为2mm,制成“含有钙的rs病毒溶液”。
<(2)fc标签融合mtim4蛋白质的巯基生物素标记>
采用与实施例122-123及比较例42-43中的<(1)fc标签融合mtim4蛋白质的巯基生物素标记>同样的方法,得到含有巯基生物素标记的fc标签融合mtim4蛋白质的pbs溶液100μl。
<(3)巯基生物素标记的fc标签融合mtim4蛋白质的稀释>
采用与实施例122-123及比较例42-43的<(2)巯基生物素标记的fc标签融合mtim4蛋白质的稀释>相同的方法,得到含有巯基生物素标记的fc标签融合mtim4蛋白质1μg的溶液200μl。
<(4)珠的洗涤>
采用与实施例122-123及比较例42-43的<(3)珠的洗涤>相同的方法,得到经洗涤操作的magcapturetamavidin2-rev。
<(5)巯基生物素标记的fc标签融合mtim4蛋白质固定于珠>
采用与实施例122-123及比较例42-43的<(4)巯基生物素标记的fc标签融合mtim4蛋白质固定于珠>相同的方法,分别得到生物素标记的fc标签融合mtim4结合载体及生物素标记的fc标签融合mtim4(非)结合载体。
需要说明的是,有时将生物素标记的fc标签融合mtim4结合载体与生物素标记的fc标签融合mtim4非结合载体一并简记为“tim蛋白质(非)结合载体”。
<(6)利用本发明的取得方法取得rs病毒>
使用“所述(1)中制备的含有钙离子的rs病毒溶液120μl”替代“添加有终浓度为2mm的氯化钙的含有钙离子的流感a病毒溶液((h1n1a/ws/33病毒株)(atcc编码:vr-825)60μl”,除此以外,实施与实施例122-123及比较例42-43的<(5)利用本发明的取得方法取得流感病毒>相同的方法,分别得到β-丙内酯处理后的溶出液22.2μl。
需要说明的是,将各实施例中使用的载体的种类以及tim蛋白质的种类示于下表41。
表41
<(7)蛋白质免疫印迹>
使用“所述含有钙离子的rs病毒溶液30μl”替代“含有钙离子的流感a病毒溶液(h1n1a/ws/33病毒株)(atcc编码:vr-825)30μl”,使用“用tbs-t稀释500倍的抗rs病毒f蛋白质抗体2f7(abcam公司制)2ml”替代“用tbs-t稀释300倍的抗流感a病毒核蛋白抗体c43(abcam公司制)2ml”,除此以外,通过与实施例122-123及比较例42-43的<(6)蛋白质免疫印迹>相同的方法进行,检测发光信号。
需要说明的是,将各实施例中使用的载体的种类、tim蛋白质的种类以及来自于载体的溶出液的种类示于下表42。
表42
<结果>
将得到的蛋白质免疫印迹的结果示于图25。图25中,各泳道为以下的结果。
泳道1:对rs病毒进行电泳的结果;
泳道2:比较例44的结果(使用生物素标记的fc标签融合mtim4非结合载体、并将1%sds溶液用作溶出液时的结果);
泳道3:比较例45的结果(使用生物素标记的fc标签融合mtim4非结合载体、并将含有50mmedta的tbs溶液用作溶出液时的结果);
泳道4:实施例124的结果(使用生物素标记的fc标签融合mtim4结合载体、并将1%sds溶液用作溶出液时的结果);
泳道5:实施例125的结果(使用生物素标记的fc标签融合mtim4结合载体、并将含有50mmedta的tbs溶液用作溶出液时的结果)。
根据图25可知,泳道2-3(使用生物素标记的fc标签融合mtim4非结合载体时)中,无论在哪种情况下都未观察到作为rs病毒的标记蛋白质的f蛋白质的条带,相对于此,在泳道4-5(使用生物素标记的fc标签融合mtim4结合载体时)中,无论在哪种情况下,都观察到了作为rs病毒的标记蛋白质的f蛋白质的条带,因此,结合有tim蛋白质的载体能取得rs病毒。
另外,通过对比泳道1(对rs病毒进行电泳的结果)与泳道4-5(使用生物素标记的fc标签融合mtim4结合载体时的结果)可知,通过使用结合有tim蛋白质的载体,能够高效地取得rs病毒。
工业实用性
本发明的tim蛋白质结合载体、使用该载体的细胞外膜囊泡及病毒的取得方法、除去方法以及包括该载体的试剂盒,与现有的细胞外膜囊泡及病毒的取得方法以及包括用于该取得方法的抗体等的试剂盒相比,能够高纯度地且在完整的状态下简便而有效地取得或除去试样中存在的细胞外膜囊泡或病毒。
通过本发明的取得方法取得的细胞外膜囊泡用作医药品等,而且取得的病毒用作疫苗、载体等,因此,本发明的tim蛋白质结合载体及本发明的取得方法具有实用性。
通过本发明的除去方法除去细胞外膜囊泡或病毒的试样,成为已防止了来自于生物的细胞外膜囊泡、包膜病毒的污染的试样,用于使用该试样的研究等中,因此,本发明的tim蛋白质结合载体及本发明的除去方法具有实用性。
本发明的tim蛋白质结合载体、使用该载体的细胞外膜囊泡及病毒的检测方法,与现有的细胞外膜囊泡及病毒的检测方法相比,能够高灵敏度地检测试样中的细胞外膜囊泡及病毒。
通过本发明的检测方法,即使在检测被检体中的微量的细胞外膜囊泡及病毒的情况下,能不对被检体进行浓缩、纯化等而直接进行测定,因此,本发明的tim蛋白质结合载体及本发明的检测方法具有实用性。
序列表
<110>和光纯药工业株式会社
<120>tim蛋白质结合载体、使用该载体的细胞外膜囊泡及病毒的取得方法、除去方法、检测方法、以及包括该载体的试剂盒
<130>2001pct
<150>jp2014-246876
<151>2014-12-05
<160>34
<170>patentinversion3.5
<210>1
<211>114
<212>prt
<213>小鼠tim4
<400>1
alaalasergluaspthrileileglypheleuglyglnprovalthr
151015
leuprocyshistyrleusertrpserglnserargasnsermetcys
202530
trpglylysglysercysproasnserlyscysasnalagluleuleu
354045
argthraspglythrargileileserarglysserthrlystyrthr
505560
leuleuglylysvalglnpheglygluvalserleuthrileserasn
65707580
thrasnargglyaspserglyvaltyrcyscysargilegluvalpro
859095
glytrppheasnaspvallyslysasnvalargleugluleuargarg
100105110
alathr
<210>2
<211>113
<212>prt
<213>人tim4
<400>2
gluthrvalvalthrgluvalleuglyhisargvalthrleuprocys
151015
leutyrsersertrpserhisasnserasnsermetcystrpglylys
202530
aspglncysprotyrserglycyslysglualaleuileargthrasp
354045
glymetargvalthrserarglysseralalystyrargleuglngly
505560
thrileproargglyaspvalserleuthrileleuasnproserglu
65707580
seraspserglyvaltyrcyscysargilegluvalproglytrpphe
859095
asnaspvallysileasnvalargleuasnleuglnargalaserthr
100105110
thr
<210>3
<211>343
<212>prt
<213>小鼠tim4
<400>3
metserlysglyleuleuleuleutrpleuvalthrgluleutrptrp
151015
leutyrleuthrproalaalasergluaspthrileileglypheleu
202530
glyglnprovalthrleuprocyshistyrleusertrpserglnser
354045
argasnsermetcystrpglylysglysercysproasnserlyscys
505560
asnalagluleuleuargthraspglythrargileileserarglys
65707580
serthrlystyrthrleuleuglylysvalglnpheglygluvalser
859095
leuthrileserasnthrasnargglyaspserglyvaltyrcyscys
100105110
argilegluvalproglytrppheasnaspvallyslysasnvalarg
115120125
leugluleuargargalathrthrthrlyslysprothrthrthrthr
130135140
argprothrthrthrprotyrvalthrthrthrthrprogluleuleu
145150155160
prothrthrvalmetthrthrservalleuprothrthrthrpropro
165170175
glnthrleualathrthralapheserthralavalthrthrcyspro
180185190
serthrthrproglyserpheserglngluthrthrlysglyserala
195200205
phethrthrglusergluthrleuproalaserasnhisserglnarg
210215220
sermetmetthrileserthraspilealavalleuargprothrgly
225230235240
serasnproglyileleuproserthrserglnleuthrthrglnlys
245250255
thrthrleuthrthrsergluserleuglnlysthrthrlysserhis
260265270
glnileasnserargglnthrileleuileilealacyscysvalgly
275280285
phevalleumetvalleuleupheleualapheleuleuargglylys
290295300
valthrglyalaasncysleuglnarghislysargproaspasnthr
305310315320
gluaspseraspservalleuasnaspmetserhisglyargaspasp
325330335
gluaspglyilephethrleu
340
<210>4
<211>378
<212>prt
<213>人tim4
<400>4
metserlysgluproleuileleutrpleumetilegluphetrptrp
151015
leutyrleuthrprovalthrsergluthrvalvalthrgluvalleu
202530
glyhisargvalthrleuprocysleutyrsersertrpserhisasn
354045
serasnsermetcystrpglylysaspglncysprotyrserglycys
505560
lysglualaleuileargthraspglymetargvalthrserarglys
65707580
seralalystyrargleuglnglythrileproargglyaspvalser
859095
leuthrileleuasnprosergluseraspserglyvaltyrcyscys
100105110
argilegluvalproglytrppheasnaspvallysileasnvalarg
115120125
leuasnleuglnargalaserthrthrthrhisargthralathrthr
130135140
thrthrargargthrthrthrthrserprothrthrthrargglnmet
145150155160
thrthrthrproalaalaleuprothrthrvalvalthrthrproasp
165170175
leuthrthrglythrproleuglnmetthrthrilealavalphethr
180185190
thralaasnthrcysleuserleuthrproserthrleuprogluglu
195200205
alathrglyleuleuthrprogluproserlysgluglyproileleu
210215220
thralaglusergluthrvalleuproseraspsertrpserserval
225230235240
gluserthrseralaaspthrvalleuleuthrserlysgluserlys
245250255
valtrpaspleuproserthrserhisvalsermettrplysthrser
260265270
aspservalserserproglnproglyalaseraspthralavalpro
275280285
gluglnasnlysthrthrlysthrglyglnmetaspglyilepromet
290295300
sermetlysasnglumetproileserglnleuleumetileileala
305310315320
proserleuglyphevalleuphealaleuphevalalapheleuleu
325330335
argglylysleumetgluthrtyrcysserglnlyshisthrargleu
340345350
asptyrileglyaspserlysasnvalleuasnaspvalglnhisgly
355360365
arggluaspgluaspglyleuphethrleu
370375
<210>5
<211>252
<212>prt
<213>小鼠tim4
<400>5
alaalasergluaspthrileileglypheleuglyglnprovalthr
151015
leuprocyshistyrleusertrpserglnserargasnsermetcys
202530
trpglylysglysercysproasnserlyscysasnalagluleuleu
354045
argthraspglythrargileileserarglysserthrlystyrthr
505560
leuleuglylysvalglnpheglygluvalserleuthrileserasn
65707580
thrasnargglyaspserglyvaltyrcyscysargilegluvalpro
859095
glytrppheasnaspvallyslysasnvalargleugluleuargarg
100105110
alathrthrthrlyslysprothrthrthrthrargprothrthrthr
115120125
protyrvalthrthrthrthrprogluleuleuprothrthrvalmet
130135140
thrthrservalleuprothrthrthrproproglnthrleualathr
145150155160
thralapheserthralavalthrthrcysproserthrthrprogly
165170175
serpheserglngluthrthrlysglyseralaphethrthrgluser
180185190
gluthrleuproalaserasnhisserglnargsermetmetthrile
195200205
serthraspilealavalleuargprothrglyserasnproglyile
210215220
leuproserthrserglnleuthrthrglnlysthrthrleuthrthr
225230235240
sergluserleuglnlysthrthrlysserhisgln
245250
<210>6
<211>258
<212>prt
<213>小鼠tim4
<400>6
alaalasergluaspthrileileglypheleuglyglnprovalthr
151015
leuprocyshistyrleusertrpserglnserargasnsermetcys
202530
trpglylysglysercysproasnserlyscysasnalagluleuleu
354045
argthraspglythrargileileserarglysserthrlystyrthr
505560
leuleuglylysvalglnpheglygluvalserleuthrileserasn
65707580
thrasnargglyaspserglyvaltyrcyscysargilegluvalpro
859095
glytrppheasnaspvallyslysasnvalargleugluleuargarg
100105110
alathrthrthrlyslysprothrthrthrthrargprothrthrthr
115120125
protyrvalthrthrthrthrprogluleuleuprothrthrvalmet
130135140
thrthrservalleuprothrthrthrproproglnthrleualathr
145150155160
thralapheserthralavalthrthrcysproserthrthrprogly
165170175
serpheserglngluthrthrlysglyseralaphethrthrgluser
180185190
gluthrleuproalaserasnhisserglnargsermetmetthrile
195200205
serthraspilealavalleuargprothrglyserasnproglyile
210215220
leuproserthrserglnleuthrthrglnlysthrthrleuthrthr
225230235240
sergluserleuglnlysthrthrlysserhisglnileasnserarg
245250255
glnthr
<210>7
<211>291
<212>prt
<213>人tim4
<400>7
gluthrvalvalthrgluvalleuglyhisargvalthrleuprocys
151015
leutyrsersertrpserhisasnserasnsermetcystrpglylys
202530
aspglncysprotyrserglycyslysglualaleuileargthrasp
354045
glymetargvalthrserarglysseralalystyrargleuglngly
505560
thrileproargglyaspvalserleuthrileleuasnproserglu
65707580
seraspserglyvaltyrcyscysargilegluvalproglytrpphe
859095
asnaspvallysileasnvalargleuasnleuglnargalaserthr
100105110
thrthrhisargthralathrthrthrthrargargthrthrthrthr
115120125
serprothrthrthrargglnmetthrthrthrproalaalaleupro
130135140
thrthrvalvalthrthrproaspleuthrthrglythrproleugln
145150155160
metthrthrilealavalphethrthralaasnthrcysleuserleu
165170175
thrproserthrleuprogluglualathrglyleuleuthrproglu
180185190
proserlysgluglyproileleuthralaglusergluthrvalleu
195200205
proseraspsertrpserservalgluserthrseralaaspthrval
210215220
leuleuthrserlysgluserlysvaltrpaspleuproserthrser
225230235240
hisvalsermettrplysthrseraspservalserserproglnpro
245250255
glyalaseraspthralavalprogluglnasnlysthrthrlysthr
260265270
glyglnmetaspglyileprometsermetlysasnglumetproile
275280285
serglnleu
290
<210>8
<211>110
<212>prt
<213>小鼠tim1
<400>8
tyrvalgluvallysglyvalvalglyhisprovalthrleuprocys
151015
thrtyrserthrtyrargglyilethrthrthrcystrpglyarggly
202530
glncysproserseralacysglnasnthrleuiletrpthrasngly
354045
hisargvalthrtyrglnlysserserargtyrasnleulysglyhis
505560
ilesergluglyaspvalserleuthrilegluasnservalgluser
65707580
aspserglyleutyrcyscysargvalgluileproglytrppheasn
859095
aspglnlysvalthrpheserleuglnvallysprogluile
100105110
<210>9
<211>110
<212>prt
<213>人tim1
<400>9
servallysvalglyglyglualaglyproservalthrleuprocys
151015
histyrserglyalavalthrsermetcystrpasnargglysercys
202530
serleuphethrcysglnasnglyilevaltrpthrasnglythrhis
354045
valthrtyrarglysaspthrargtyrlysleuleuglyaspleuser
505560
argargaspvalserleuthrilegluasnthralavalseraspser
65707580
glyvaltyrcyscysargvalgluhisargglytrppheasnaspmet
859095
lysilethrvalserleugluilevalproprolysvalthr
100105110
<210>10
<211>282
<212>prt
<213>小鼠tim1
<400>10
metasnglnileglnvalpheileserglyleuileleuleuleupro
151015
glyalavalaspsertyrvalgluvallysglyvalvalglyhispro
202530
valthrleuprocysthrtyrserthrtyrargglyilethrthrthr
354045
cystrpglyargglyglncysproserseralacysglnasnthrleu
505560
iletrpthrasnglyhisargvalthrtyrglnlysserserargtyr
65707580
asnleulysglyhisilesergluglyaspvalserleuthrileglu
859095
asnservalgluseraspserglyleutyrcyscysargvalgluile
100105110
proglytrppheasnaspglnlysvalthrpheserleuglnvallys
115120125
progluileprothrargproproargargprothrthrthrargpro
130135140
thralathrglyargprothrthrileserthrargserthrhisval
145150155160
prothrserthrargvalserthrserthrproprothrserthrhis
165170175
thrtrpthrhislysproasptrpasnglythrvalthrsersergly
180185190
aspthrtrpserasnhisthrglualaileproproglylysprogln
195200205
lysasnprothrlysglyphetyrvalglyilecysilealaalaleu
210215220
leuleuleuleuleuvalserthrvalalailethrargtyrileleu
225230235240
metlysarglysseralaserleuservalvalalapheargvalser
245250255
lysileglualaleuglnasnalaalavalvalhisserargalaglu
260265270
aspasniletyrilevalgluaspargpro
275280
<210>11
<211>364
<212>prt
<213>人tim1
<400>11
methisproglnvalvalileleuserleuileleuhisleualaasp
151015
servalalaglyservallysvalglyglyglualaglyproserval
202530
thrleuprocyshistyrserglyalavalthrsermetcystrpasn
354045
argglysercysserleuphethrcysglnasnglyilevaltrpthr
505560
asnglythrhisvalthrtyrarglysaspthrargtyrlysleuleu
65707580
glyaspleuserargargaspvalserleuthrilegluasnthrala
859095
valseraspserglyvaltyrcyscysargvalgluhisargglytrp
100105110
pheasnaspmetlysilethrvalserleugluilevalproprolys
115120125
valthrthrthrproilevalthrthrvalprothrvalthrthrval
130135140
argthrserthrthrvalprothrthrthrthrvalprometthrthr
145150155160
valprothrthrthrvalprothrthrmetserileprothrthrthr
165170175
thrvalleuthrthrmetthrvalserthrthrthrservalprothr
180185190
thrthrserileprothrthrthrservalprovalthrthrthrval
195200205
serthrphevalproprometproleuproargglnasnhisglupro
210215220
valalathrserproserserproglnproalagluthrhisprothr
225230235240
thrleuglnglyalaileargarggluprothrserserproleutyr
245250255
sertyrthrthraspglyasnaspthrvalthrgluserseraspgly
260265270
leutrpasnasnasnglnthrglnleupheleugluhisserleuleu
275280285
thralaasnthrthrlysglyiletyralaglyvalcysileserval
290295300
leuvalleuleualaleuleuglyvalileilealalyslystyrphe
305310315320
phelyslysgluvalglnglnleuservalserpheserserleugln
325330335
ilelysalaleuglnasnalavalglulysgluvalglnalagluasp
340345350
asniletyrilegluasnserleutyralathrasp
355360
<210>12
<211>191
<212>prt
<213>小鼠tim1
<400>12
tyrvalgluvallysglyvalvalglyhisprovalthrleuprocys
151015
thrtyrserthrtyrargglyilethrthrthrcystrpglyarggly
202530
glncysproserseralacysglnasnthrleuiletrpthrasngly
354045
hisargvalthrtyrglnlysserserargtyrasnleulysglyhis
505560
ilesergluglyaspvalserleuthrilegluasnservalgluser
65707580
aspserglyleutyrcyscysargvalgluileproglytrppheasn
859095
aspglnlysvalthrpheserleuglnvallysprogluileprothr
100105110
argproproargargprothrthrthrargprothralathrglyarg
115120125
prothrthrileserthrargserthrhisvalprothrserthrarg
130135140
valserthrserthrproprothrserthrhisthrtrpthrhislys
145150155160
proasptrpasnglythrvalthrserserglyaspthrtrpserasn
165170175
histhrglualaileproproglylysproglnlysasnprothr
180185190
<210>13
<211>275
<212>prt
<213>人tim1
<400>13
servallysvalglyglyglualaglyproservalthrleuprocys
151015
histyrserglyalavalthrsermetcystrpasnargglysercys
202530
serleuphethrcysglnasnglyilevaltrpthrasnglythrhis
354045
valthrtyrarglysaspthrargtyrlysleuleuglyaspleuser
505560
argargaspvalserleuthrilegluasnthralavalseraspser
65707580
glyvaltyrcyscysargvalgluhisargglytrppheasnaspmet
859095
lysilethrvalserleugluilevalproprolysvalthrthrthr
100105110
proilevalthrthrvalprothrvalthrthrvalargthrserthr
115120125
thrvalprothrthrthrthrvalprometthrthrvalprothrthr
130135140
thrvalprothrthrmetserileprothrthrthrthrvalleuthr
145150155160
thrmetthrvalserthrthrthrservalprothrthrthrserile
165170175
prothrthrthrservalprovalthrthrthrvalserthrpheval
180185190
proprometproleuproargglnasnhisgluprovalalathrser
195200205
proserserproglnproalagluthrhisprothrthrleuglngly
210215220
alaileargarggluprothrserserproleutyrsertyrthrthr
225230235240
aspglyasnaspthrvalthrgluserseraspglyleutrpasnasn
245250255
asnglnthrglnleupheleugluhisserleuleuthralaasnthr
260265270
thrlysgly
275
<210>14
<211>113
<212>prt
<213>小鼠tim3
<400>14
leugluasnalatyrvalphegluvalglylysasnalatyrleupro
151015
cyssertyrthrleuserthrproglyalaleuvalprometcystrp
202530
glylysglyphecysprotrpserglncysthrasngluleuleuarg
354045
thraspgluargasnvalthrtyrglnlysserserargtyrglnleu
505560
lysglyaspleuasnlysglyaspvalserleuileilelysasnval
65707580
thrleuaspasphisglythrtyrcyscysargileglnpheprogly
859095
leumetasnasplyslysleugluleulysleuaspilelysalaala
100105110
lys
<210>15
<211>114
<212>prt
<213>人tim3
<400>15
sergluvalglutyrargalagluvalglyglnasnalatyrleupro
151015
cysphetyrthrproalaalaproglyasnleuvalprovalcystrp
202530
glylysglyalacysprovalpheglucysglyasnvalvalleuarg
354045
thraspgluargaspvalasntyrtrpthrserargtyrtrpleuasn
505560
glyaspphearglysglyaspvalserleuthrilegluasnvalthr
65707580
leualaaspserglyiletyrcyscysargileglnileproglyile
859095
metasnaspglulyspheasnleulysleuvalilelysproalalys
100105110
valthr
<210>16
<211>281
<212>prt
<213>人tim3
<400>16
metpheserglyleuthrleuasncysvalleuleuleuleuglnleu
151015
leuleualaargserleugluasnalatyrvalphegluvalglylys
202530
asnalatyrleuprocyssertyrthrleuserthrproglyalaleu
354045
valprometcystrpglylysglyphecysprotrpserglncysthr
505560
asngluleuleuargthraspgluargasnvalthrtyrglnlysser
65707580
serargtyrglnleulysglyaspleuasnlysglyaspvalserleu
859095
ileilelysasnvalthrleuaspasphisglythrtyrcyscysarg
100105110
ileglnpheproglyleumetasnasplyslysleugluleulysleu
115120125
aspilelysalaalalysvalthrproalaglnthralahisglyasp
130135140
serthrthralaserproargthrleuthrthrgluargasnglyser
145150155160
gluthrglnthrleuvalthrleuhisasnasnasnglythrlysile
165170175
serthrtrpalaaspgluilelysaspserglygluthrileargthr
180185190
alailehisileglyvalglyvalseralaglyleuthrleualaleu
195200205
ileileglyvalleuileleulystrptyrsercyslyslyslyslys
210215220
leuserserleuserleuilethrleualaasnleuproproglygly
225230235240
leualaasnalaglyalavalargileargserglugluasniletyr
245250255
thrileglugluasnvaltyrgluvalgluasnserasnglutyrtyr
260265270
cystyrvalasnserglnglnproser
275280
<210>17
<211>301
<212>prt
<213>人tim3
<400>17
metpheserhisleupropheaspcysvalleuleuleuleuleuleu
151015
leuleuthrargsersergluvalglutyrargalagluvalglygln
202530
asnalatyrleuprocysphetyrthrproalaalaproglyasnleu
354045
valprovalcystrpglylysglyalacysprovalpheglucysgly
505560
asnvalvalleuargthraspgluargaspvalasntyrtrpthrser
65707580
argtyrtrpleuasnglyaspphearglysglyaspvalserleuthr
859095
ilegluasnvalthrleualaaspserglyiletyrcyscysargile
100105110
glnileproglyilemetasnaspglulyspheasnleulysleuval
115120125
ilelysproalalysvalthrproalaprothrargglnargaspphe
130135140
thralaalapheproargmetleuthrthrargglyhisglyproala
145150155160
gluthrglnthrleuglyserleuproaspileasnleuthrglnile
165170175
serthrleualaasngluleuargaspserargleualaasnaspleu
180185190
argaspserglyalathrileargileglyiletyrileglyalagly
195200205
ilecysalaglyleualaleualaleuilepheglyalaleuilephe
210215220
lystrptyrserhisserlysglulysileglnasnleuserleuile
225230235240
serleualaasnleuproproserglyleualaasnalavalalaglu
245250255
glyileargserglugluasniletyrthrileglugluasnvaltyr
260265270
gluvalglugluproasnglutyrtyrcystyrvalserserarggln
275280285
glnproserglnproleuglycysargphealametpro
290295300
<210>18
<211>168
<212>prt
<213>小鼠tim3
<400>18
leugluasnalatyrvalphegluvalglylysasnalatyrleupro
151015
cyssertyrthrleuserthrproglyalaleuvalprometcystrp
202530
glylysglyphecysprotrpserglncysthrasngluleuleuarg
354045
thraspgluargasnvalthrtyrglnlysserserargtyrglnleu
505560
lysglyaspleuasnlysglyaspvalserleuileilelysasnval
65707580
thrleuaspasphisglythrtyrcyscysargileglnpheprogly
859095
leumetasnasplyslysleugluleulysleuaspilelysalaala
100105110
lysvalthrproalaglnthralahisglyaspserthrthralaser
115120125
proargthrleuthrthrgluargasnglysergluthrglnthrleu
130135140
valthrleuhisasnasnasnglythrlysileserthrtrpalaasp
145150155160
gluilelysaspserglygluthr
165
<210>19
<211>179
<212>prt
<213>人tim3
<400>19
sergluvalglutyrargalagluvalglyglnasnalatyrleupro
151015
cysphetyrthrproalaalaproglyasnleuvalprovalcystrp
202530
glylysglyalacysprovalpheglucysglyasnvalvalleuarg
354045
thraspgluargaspvalasntyrtrpthrserargtyrtrpleuasn
505560
glyaspphearglysglyaspvalserleuthrilegluasnvalthr
65707580
leualaaspserglyiletyrcyscysargileglnileproglyile
859095
metasnaspglulyspheasnleulysleuvalilelysproalalys
100105110
valthrproalaprothrargglnargaspphethralaalaphepro
115120125
argmetleuthrthrargglyhisglyproalagluthrglnthrleu
130135140
glyserleuproaspileasnleuthrglnileserthrleualaasn
145150155160
gluleuargaspserargleualaasnaspleuargaspserglyala
165170175
thrilearg
<210>20
<211>1032
<212>dna
<213>小鼠tim4
<400>20
atgtccaaggggcttctcctcctctggctggtgacggagctctggtggctttatctgaca60
ccagctgcctcagaggatacaataatagggtttttgggccagccggtgactttgccttgt120
cattacctctcgtggtcccagagccgcaacagtatgtgctggggcaaaggttcatgtccc180
aattccaagtgcaatgcagagcttctccgtacagatggaacaagaatcatctccaggaag240
tcaacaaaatatacacttttggggaaggtccagtttggtgaagtgtccttgaccatctca300
aacaccaatcgaggtgacagtggggtgtactgctgccgtatagaggtgcctggctggttc360
aatgatgtcaagaagaatgtgcgcttggagctgaggagagccacaacaaccaaaaaacca420
acaacaaccacccggccaaccaccaccccttatgtgaccaccaccaccccagagctgctt480
ccaacaacagtcatgaccacatctgttctcccaaccaccacaccaccccagacactagcc540
accactgccttcagtacagcagtgaccacgtgcccctcaacaacacctggctccttctca600
caagaaaccacaaaagggtccgccttcactacagaatcagaaactctgcctgcatccaat660
cactctcaaagaagcatgatgaccatatctacagacatagccgtactcaggcccacaggc720
tctaaccctgggattctcccatccacttcacagctgacgacacagaaaacaacattaaca780
acaagtgagtctttgcagaagacaactaaatcacatcagatcaacagcagacagaccatc840
ttgatcattgcctgctgtgtgggatttgtgctaatggtgttattgtttctggcgtttctc900
cttcgagggaaagtcacaggagccaactgtttgcagagacacaagaggccagacaacact960
gaagatagtgacagcgtcctcaatgacatgtcacacgggagggatgatgaagacgggatc1020
ttcactctctga1032
<210>21
<211>1137
<212>dna
<213>人tim4
<400>21
atgtccaaagaacctctcattctctggctgatgattgagttttggtggctttacctgaca60
ccagtcacttcagagactgttgtgacggaggttttgggtcaccgggtgactttgccctgt120
ctgtactcatcctggtctcacaacagcaacagcatgtgctgggggaaagaccagtgcccc180
tactccggttgcaaggaggcgctcatccgcactgatggaatgagggtgacctcaagaaag240
tcagcaaaatatagacttcaggggactatcccgagaggtgatgtctccttgaccatctta300
aaccccagtgaaagtgacagcggtgtgtactgctgccgcatagaagtgcctggctggttc360
aacgatgtaaagataaacgtgcgcctgaatctacagagagcctcaacaaccacgcacaga420
acagcaaccaccaccacacgcagaacaacaacaacaagccccaccaccacccgacaaatg480
acaacaaccccagctgcacttccaacaacagtcgtgaccacacccgatctcacaaccgga540
acaccactccagatgacaaccattgccgtcttcacaacagcaaacacgtgcctttcacta600
accccaagcacccttccggaggaagccacaggtcttctgactcccgagccttctaaggaa660
gggcccatcctcactgcagaatcagaaactgtcctccccagtgattcctggagtagtgtt720
gagtctacttctgctgacactgtcctgctgacatccaaagagtccaaagtttgggatctc780
ccatcaacatcccacgtgtcaatgtggaaaacgagtgattctgtgtcttctcctcagcct840
ggagcatctgatacagcagttcctgagcagaacaaaacaacaaaaacaggacagatggat900
ggaatacccatgtcaatgaagaatgaaatgcccatctcccaactactgatgatcatcgcc960
ccctccttgggatttgtgctcttcgcattgtttgtggcgtttctcctgagagggaaactc1020
atggaaacctattgttcgcagaaacacacaaggctagactacattggagatagtaaaaat1080
gtcctcaatgacgtgcagcatggaagggaagacgaagacggcctttttaccctctaa1137
<210>22
<211>849
<212>dna
<213>小鼠tim1
<400>22
atgaatcagattcaagtcttcatttcaggcctcatactgcttctcccaggcgctgtggat60
tcttatgtggaagtaaagggggtggtgggtcaccctgtcacacttccatgtacttactca120
acatatcgtggaatcacaacgacatgttggggccgagggcaatgcccatcttctgcttgt180
caaaatacacttatttggaccaatggacatcgtgtcacctatcagaagagcagtcggtac240
aacttaaaggggcatatttcagaaggagatgtgtccttgacgatagagaactctgttgag300
agtgacagtggtctgtattgttgtcgagtggagattcctggatggtttaatgatcagaaa360
gtgaccttttcattgcaagttaaaccagagattcccacacgtcctccaagaagacccaca420
actacaaggcccacagctacaggaagacccacgactatttcaacaagatccacacatgta480
ccaacatcaaccagagtctctacctccactcctccaacatctacacacacatggactcac540
aaaccagactggaatggcactgtgacatcctcaggagatacctggagtaatcacactgaa600
gcaatccctccagggaagccgcagaaaaaccctactaagggcttctatgttggcatctgc660
atcgcagccctgctgctactgctccttgtgagcaccgtggctatcaccaggtacatactt720
atgaaaaggaagtcagcatctctaagcgtggttgccttccgtgtctctaagattgaagct780
ttgcagaacgcagcggttgtgcattcccgagctgaagacaacatctacattgttgaagat840
agaccttga849
<210>23
<211>1095
<212>dna
<213>人tim1
<400>23
atgcatcctcaagtggtcatcttaagcctcatcctacatctggcagattctgtagctggt60
tctgtaaaggttggtggagaggcaggtccatctgtcacactaccctgccactacagtgga120
gctgtcacatccatgtgctggaatagaggctcatgttctctattcacatgccaaaatggc180
attgtctggaccaatggaacccacgtcacctatcggaaggacacacgctataagctattg240
ggggacctttcaagaagggatgtctctttgaccatagaaaatacagctgtgtctgacagt300
ggcgtatattgttgccgtgttgagcaccgtgggtggttcaatgacatgaaaatcaccgta360
tcattggagattgtgccacccaaggtcacgactactccaattgtcacaactgttccaacc420
gtcacgactgttcgaacgagcaccactgttccaacgacaacgactgttccaatgacgact480
gttccaacgacaactgttccaacaacaatgagcattccaacgacaacgactgttctgacg540
acaatgactgtttcaacgacaacgagcgttccaacgacaacgagcattccaacaacaaca600
agtgttccagtgacaacaactgtctctacctttgttcctccaatgcctttgcccaggcag660
aaccatgaaccagtagccacttcaccatcttcacctcagccagcagaaacccaccctacg720
acactgcagggagcaataaggagagaacccaccagctcaccattgtactcttacacaaca780
gatgggaatgacaccgtgacagagtcttcagatggcctttggaataacaatcaaactcaa840
ctgttcctagaacatagtctactgacggccaataccactaaaggaatctatgctggagtc900
tgtatttctgtcttggtgcttcttgctcttttgggtgtcatcattgccaaaaagtatttc960
ttcaaaaaggaggttcaacaactaagtgtttcatttagcagccttcaaattaaagctttg1020
caaaatgcagttgaaaaggaagtccaagcagaagacaatatctacattgagaatagtctt1080
tatgccacggactaa1095
<210>24
<211>846
<212>dna
<213>小鼠tim3
<400>24
atgttttcaggtcttaccctcaactgtgtcctgctgctgctgcaactactacttgcaagg60
tcattggaaaatgcttatgtgtttgaggttggtaagaatgcctatctgccctgcagttac120
actctatctacacctggggcacttgtgcctatgtgctggggcaagggattctgtccttgg180
tcacagtgtaccaacgagttgctcagaactgatgaaagaaatgtgacatatcagaaatcc240
agcagataccagctaaagggcgatctcaacaaaggagacgtgtctctgatcataaagaat300
gtgactctggatgaccatgggacctactgctgcaggatacagttccctggtcttatgaat360
gataaaaaattagaactgaaattagacatcaaagcagccaaggtcactccagctcagact420
gcccatggggactctactacagcttctccaagaaccctaaccacggagagaaatggttca480
gagacacagacactggtgaccctccataataacaatggaacaaaaatttccacatgggct540
gatgaaattaaggactctggagaaacgatcagaactgctatccacattggagtgggagtc600
tctgctgggttgaccctggcacttatcattggtgtcttaatccttaaatggtattcctgt660
aagaaaaagaagttatcgagtttgagccttattacactggccaacttgcctccaggaggg720
ttggcaaatgcaggagcagtcaggattcgctctgaggaaaatatctacaccatcgaggag780
aacgtatatgaagtggagaattcaaatgagtactactgctacgtcaacagccagcagcca840
tcctga846
<210>25
<211>906
<212>dna
<213>人tim3
<400>25
atgttttcacatcttccctttgactgtgtcctgctgctgctgctgctactacttacaagg60
tcctcagaagtggaatacagagcggaggtcggtcagaatgcctatctgccctgcttctac120
accccagccgccccagggaacctcgtgcccgtctgctggggcaaaggagcctgtcctgtg180
tttgaatgtggcaacgtggtgctcaggactgatgaaagggatgtgaattattggacatcc240
agatactggctaaatggggatttccgcaaaggagatgtgtccctgaccatagagaatgtg300
actctagcagacagtgggatctactgctgccggatccaaatcccaggcataatgaatgat360
gaaaaatttaacctgaagttggtcatcaaaccagccaaggtcacccctgcaccgactcgg420
cagagagacttcactgcagcctttccaaggatgcttaccaccaggggacatggcccagca480
gagacacagacactggggagcctccctgatataaatctaacacaaatatccacattggcc540
aatgagttacgggactctagattggccaatgacttacgggactctggagcaaccatcaga600
ataggcatctacatcggagcagggatctgtgctgggctggctctggctcttatcttcggc660
gctttaattttcaaatggtattctcatagcaaagagaagatacagaatttaagcctcatc720
tctttggccaacctccctccctcaggattggcaaatgcagtagcagagggaattcgctca780
gaagaaaacatctataccattgaagagaacgtatatgaagtggaggagcccaatgagtat840
tattgctatgtcagcagcaggcagcaaccctcacaacctttgggttgtcgctttgcaatg900
ccatag906
<210>26
<211>822
<212>dna
<213>小鼠tim4
<400>26
atgtccaaggggcttctcctcctctggctggtgacggagctctggtggctttatctgaca60
ccagctgcctcagaggatacaataatagggtttttgggccagccggtgactttgccttgt120
cattacctctcgtggtcccagagccgcaacagtatgtgctggggcaaaggttcatgtccc180
aattccaagtgcaatgcagagcttctccgtacagatggaacaagaatcatctccaggaag240
tcaacaaaatatacacttttggggaaggtccagtttggtgaagtgtccttgaccatctca300
aacaccaatcgaggtgacagtggggtgtactgctgccgtatagaggtgcctggctggttc360
aatgatgtcaagaagaatgtgcgcttggagctgaggagagccacaacaaccaaaaaacca420
acaacaaccacccggccaaccaccaccccttatgtgaccaccaccaccccagagctgctt480
ccaacaacagtcatgaccacatctgttctcccaaccaccacaccaccccagacactagcc540
accactgccttcagtacagcagtgaccacgtgcccctcaacaacacctggctccttctca600
caagaaaccacaaaagggtccgccttcactacagaatcagaaactctgcctgcatccaat660
cactctcaaagaagcatgatgaccatatctacagacatagccgtactcaggcccacaggc720
tctaaccctgggattctcccatccacttcacagctgacgacacagaaaacaacattaaca780
acaagtgagtctttgcagaagacaactaaatcacatcagtga822
<210>27
<211>840
<212>dna
<213>小鼠tim4
<400>27
atgtccaaggggcttctcctcctctggctggtgacggagctctggtggctttatctgaca60
ccagctgcctcagaggatacaataatagggtttttgggccagccggtgactttgccttgt120
cattacctctcgtggtcccagagccgcaacagtatgtgctggggcaaaggttcatgtccc180
aattccaagtgcaatgcagagcttctccgtacagatggaacaagaatcatctccaggaag240
tcaacaaaatatacacttttggggaaggtccagtttggtgaagtgtccttgaccatctca300
aacaccaatcgaggtgacagtggggtgtactgctgccgtatagaggtgcctggctggttc360
aatgatgtcaagaagaatgtgcgcttggagctgaggagagccacaacaaccaaaaaacca420
acaacaaccacccggccaaccaccaccccttatgtgaccaccaccaccccagagctgctt480
ccaacaacagtcatgaccacatctgttctcccaaccaccacaccaccccagacactagcc540
accactgccttcagtacagcagtgaccacgtgcccctcaacaacacctggctccttctca600
caagaaaccacaaaagggtccgccttcactacagaatcagaaactctgcctgcatccaat660
cactctcaaagaagcatgatgaccatatctacagacatagccgtactcaggcccacaggc720
tctaaccctgggattctcccatccacttcacagctgacgacacagaaaacaacattaaca780
acaagtgagtctttgcagaagacaactaaatcacatcagatcaacagcagacagacctga840
<210>28
<211>948
<212>dna
<213>人tim4
<400>28
atgtccaaagaacctctcattctctggctgatgattgagttttggtggctttacctgaca60
ccagtcacttcagagactgttgtgacggaggttttgggtcaccgggtgactttgccctgt120
ctgtactcatcctggtctcacaacagcaacagcatgtgctgggggaaagaccagtgcccc180
tactccggttgcaaggaggcgctcatccgcactgatggaatgagggtgacctcaagaaag240
tcagcaaaatatagacttcaggggactatcccgagaggtgatgtctccttgaccatctta300
aaccccagtgaaagtgacagcggtgtgtactgctgccgcatagaagtgcctggctggttc360
aacgatgtaaagataaacgtgcgcctgaatctacagagagcctcaacaaccacgcacaga420
acagcaaccaccaccacacgcagaacaacaacaacaagccccaccaccacccgacaaatg480
acaacaaccccagctgcacttccaacaacagtcgtgaccacacccgatctcacaaccgga540
acaccactccagatgacaaccattgccgtcttcacaacagcaaacacgtgcctttcacta600
accccaagcacccttccggaggaagccacaggtcttctgactcccgagccttctaaggaa660
gggcccatcctcactgcagaatcagaaactgtcctccccagtgattcctggagtagtgtt720
gagtctacttctgctgacactgtcctgctgacatccaaagagtccaaagtttgggatctc780
ccatcaacatcccacgtgtcaatgtggaaaacgagtgattctgtgtcttctcctcagcct840
ggagcatctgatacagcagttcctgagcagaacaaaacaacaaaaacaggacagatggat900
ggaatacccatgtcaatgaagaatgaaatgcccatctcccaactatga948
<210>29
<211>639
<212>dna
<213>小鼠tim1
<400>29
atgaatcagattcaagtcttcatttcaggcctcatactgcttctcccaggcgctgtggat60
tcttatgtggaagtaaagggggtggtgggtcaccctgtcacacttccatgtacttactca120
acatatcgtggaatcacaacgacatgttggggccgagggcaatgcccatcttctgcttgt180
caaaatacacttatttggaccaatggacatcgtgtcacctatcagaagagcagtcggtac240
aacttaaaggggcatatttcagaaggagatgtgtccttgacgatagagaactctgttgag300
agtgacagtggtctgtattgttgtcgagtggagattcctggatggtttaatgatcagaaa360
gtgaccttttcattgcaagttaaaccagagattcccacacgtcctccaagaagacccaca420
actacaaggcccacagctacaggaagacccacgactatttcaacaagatccacacatgta480
ccaacatcaaccagagtctctacctccactcctccaacatctacacacacatggactcac540
aaaccagactggaatggcactgtgacatcctcaggagatacctggagtaatcacactgaa600
gcaatccctccagggaagccgcagaaaaaccctacttga639
<210>30
<211>888
<212>dna
<213>人tim1
<400>30
atgcatcctcaagtggtcatcttaagcctcatcctacatctggcagattctgtagctggt60
tctgtaaaggttggtggagaggcaggtccatctgtcacactaccctgccactacagtgga120
gctgtcacatccatgtgctggaatagaggctcatgttctctattcacatgccaaaatggc180
attgtctggaccaatggaacccacgtcacctatcggaaggacacacgctataagctattg240
ggggacctttcaagaagggatgtctctttgaccatagaaaatacagctgtgtctgacagt300
ggcgtatattgttgccgtgttgagcaccgtgggtggttcaatgacatgaaaatcaccgta360
tcattggagattgtgccacccaaggtcacgactactccaattgtcacaactgttccaacc420
gtcacgactgttcgaacgagcaccactgttccaacgacaacgactgttccaatgacgact480
gttccaacgacaactgttccaacaacaatgagcattccaacgacaacgactgttctgacg540
acaatgactgtttcaacgacaacgagcgttccaacgacaacgagcattccaacaacaaca600
agtgttccagtgacaacaactgtctctacctttgttcctccaatgcctttgcccaggcag660
aaccatgaaccagtagccacttcaccatcttcacctcagccagcagaaacccaccctacg720
acactgcagggagcaataaggagagaacccaccagctcaccattgtactcttacacaaca780
gatgggaatgacaccgtgacagagtcttcagatggcctttggaataacaatcaaactcaa840
ctgttcctagaacatagtctactgacggccaataccactaaaggatga888
<210>31
<211>570
<212>dna
<213>小鼠tim3
<400>31
atgttttcaggtcttaccctcaactgtgtcctgctgctgctgcaactactacttgcaagg60
tcattggaaaatgcttatgtgtttgaggttggtaagaatgcctatctgccctgcagttac120
actctatctacacctggggcacttgtgcctatgtgctggggcaagggattctgtccttgg180
tcacagtgtaccaacgagttgctcagaactgatgaaagaaatgtgacatatcagaaatcc240
agcagataccagctaaagggcgatctcaacaaaggagacgtgtctctgatcataaagaat300
gtgactctggatgaccatgggacctactgctgcaggatacagttccctggtcttatgaat360
gataaaaaattagaactgaaattagacatcaaagcagccaaggtcactccagctcagact420
gcccatggggactctactacagcttctccaagaaccctaaccacggagagaaatggttca480
gagacacagacactggtgaccctccataataacaatggaacaaaaatttccacatgggct540
gatgaaattaaggactctggagaaacgtga570
<210>32
<211>603
<212>dna
<213>人tim3
<400>32
atgttttcacatcttccctttgactgtgtcctgctgctgctgctgctactacttacaagg60
tcctcagaagtggaatacagagcggaggtcggtcagaatgcctatctgccctgcttctac120
accccagccgccccagggaacctcgtgcccgtctgctggggcaaaggagcctgtcctgtg180
tttgaatgtggcaacgtggtgctcaggactgatgaaagggatgtgaattattggacatcc240
agatactggctaaatggggatttccgcaaaggagatgtgtccctgaccatagagaatgtg300
actctagcagacagtgggatctactgctgccggatccaaatcccaggcataatgaatgat360
gaaaaatttaacctgaagttggtcatcaaaccagccaaggtcacccctgcaccgactcgg420
cagagagacttcactgcagcctttccaaggatgcttaccaccaggggacatggcccagca480
gagacacagacactggggagcctccctgatataaatctaacacaaatatccacattggcc540
aatgagttacgggactctagattggccaatgacttacgggactctggagcaaccatcaga600
tga603
<210>33
<211>846
<212>dna
<213>小鼠tim4
<220>
<221>flag标签
<222>(820)..(843)
<400>33
atgtccaaggggcttctcctcctctggctggtgacggagctctggtggctttatctgaca60
ccagctgcctcagaggatacaataatagggtttttgggccagccggtgactttgccttgt120
cattacctctcgtggtcccagagccgcaacagtatgtgctggggcaaaggttcatgtccc180
aattccaagtgcaatgcagagcttctccgtacagatggaacaagaatcatctccaggaag240
tcaacaaaatatacacttttggggaaggtccagtttggtgaagtgtccttgaccatctca300
aacaccaatcgaggtgacagtggggtgtactgctgccgtatagaggtgcctggctggttc360
aatgatgtcaagaagaatgtgcgcttggagctgaggagagccacaacaaccaaaaaacca420
acaacaaccacccggccaaccaccaccccttatgtgaccaccaccaccccagagctgctt480
ccaacaacagtcatgaccacatctgttctcccaaccaccacaccaccccagacactagcc540
accactgccttcagtacagcagtgaccacgtgcccctcaacaacacctggctccttctca600
caagaaaccacaaaagggtccgccttcactacagaatcagaaactctgcctgcatccaat660
cactctcaaagaagcatgatgaccatatctacagacatagccgtactcaggcccacaggc720
tctaaccctgggattctcccatccacttcacagctgacgacacagaaaacaacattaaca780
acaagtgagtctttgcagaagacaactaaatcacatcaggattacaaggatgacgacgat840
aagtaa846
<210>34
<211>840
<212>dna
<213>小鼠tim4
<220>
<221>his标签
<222>(820)..(837)
<400>34
atgtccaaggggcttctcctcctctggctggtgacggagctctggtggctttatctgaca60
ccagctgcctcagaggatacaataatagggtttttgggccagccggtgactttgccttgt120
cattacctctcgtggtcccagagccgcaacagtatgtgctggggcaaaggttcatgtccc180
aattccaagtgcaatgcagagcttctccgtacagatggaacaagaatcatctccaggaag240
tcaacaaaatatacacttttggggaaggtccagtttggtgaagtgtccttgaccatctca300
aacaccaatcgaggtgacagtggggtgtactgctgccgtatagaggtgcctggctggttc360
aatgatgtcaagaagaatgtgcgcttggagctgaggagagccacaacaaccaaaaaacca420
acaacaaccacccggccaaccaccaccccttatgtgaccaccaccaccccagagctgctt480
ccaacaacagtcatgaccacatctgttctcccaaccaccacaccaccccagacactagcc540
accactgccttcagtacagcagtgaccacgtgcccctcaacaacacctggctccttctca600
caagaaaccacaaaagggtccgccttcactacagaatcagaaactctgcctgcatccaat660
cactctcaaagaagcatgatgaccatatctacagacatagccgtactcaggcccacaggc720
tctaaccctgggattctcccatccacttcacagctgacgacacagaaaacaacattaaca780
acaagtgagtctttgcagaagacaactaaatcacatcagcatcatcatcatcatcattga840
- 还没有人留言评论。精彩留言会获得点赞!