用于基底上的单分子放置的组合物和方法与流程
本申请要求于2014年12月15日提交的美国临时专利申请no.62/092,171的权益,其在此通过引用完整并入用于所有目的。
发明领域
本公开涉及分子生物学领域,更具体地涉及用于将单一靶分子置于图案化基底上的组合物和方法。
发明背景
单分子放置在诸如生物分子动力学研究、药物发现和核酸测序等领域中具有有用的应用。例如,已经通过将单个聚合酶置于具有纳米大小的波导中实现了单分子dna测序。使用纳米孔结构已经实现了单分子dna测序,所述纳米孔结构将单个纳米孔形成蛋白质加载到脂质双层中。
目前,主要通过经由将锚定空间限制到单分子大小的水平的分子大小排阻效应来实现单分子放置。这种方法需要利用高分辨率光刻法(lithography),并且由于目标面积小而导致相对较低的加载效率。将单个纳米孔加载到脂质双层中主要通过监测加载过程期间的离子电流变化来实现,所述其与大规模生产缺乏相容性。
因此,存在对将单分子置于靶区域上的有效方法的需要。本发明也满足了此需要并且提供了相关的优点。
发明概述
本文中特别提供了可用于将单分子置于靶区域上的基底和方法。在第一方面中是基底,其包含固定化到所述基底上的特征(feature)的多个第一和第二捕捉引物。至少一个靶多核苷酸,一个末端附着到所述捕捉引物之一而另一个末端与靶分子连接,其中所述靶多核苷酸包含侧翼有与所述第一和第二捕捉引物互补的第一和第二捕捉引物结合区的靶区域,所述第二捕捉引物结合区包含与所述第二捕捉引物的碱基对错配,和与固定化到所述特征的所述靶多核苷酸互补的多个克隆扩增子。在一些实施方案中,碱基对错配是1,2,3,4,5,6,7,8,9或10个碱基对错配。在一些实施方案中,碱基对错配是3个碱基对错配。
在一些实施方案中,基底还包含多个特征。在一些实施方案中,特征包含单一靶分子。在一些实施方案中,用所述多个克隆扩增子填满所述特征。用所述多个克隆扩增子填满所述特征(thefeatureisfilledtocapacitywiththepluralityofclonalamplicons)。在一些实施方案中,多个特征包含单一靶分子。在一些实施方案中,所述特征中的两个或更多个包含不同单一靶分子。在一些实施方案中,用所述多个克隆扩增子填满所述特征。
在一些实施方案中,所述靶多核苷酸包含一种或多种选自下组的多核苷酸:rna、dna和pna。在一些实施方案中,所述靶多核苷酸包含双链dna(dsdna)。在一些实施方案中,所述靶多核苷酸包含小于1,000个核苷酸。在一些实施方案中,所述靶多核苷酸包含10-25、26-50、51-100、101-200、201-300、301-400、401-500、501-600、601-700、701-800、801-900、或901-1000个核苷酸。
在一些实施方案中,靶分子包括多肽、多核苷酸、碳水化合物、氨基酸、核苷酸、单糖、半抗原、配体、抗原、分析物、小分子有机化合物或无机化合物。在一些实施方案中,靶分子包含多肽。在一些实施方案中,多肽选自纳米孔、结合多肽和酶。在一些实施方案中,纳米孔选自mspa、ompf、ompg、nalp、wza、clya毒素、α-溶血素、炭疽毒素、杀白细胞素、离子通道、蛋白质纳米孔和dna折纸纳米孔(origaminanopore)。
在一些实施方案中,结合多肽选自:抗体、fab、fab'、f(ab')2、scfv、双抗体(diabody)、三抗体(triabody)、微型抗体和单域抗体(sdab)、t细胞受体、小菌素(microcin)、神经肽、g蛋白偶联受体、抗体、表皮生长因子受体和her2。在一些实施方案中,酶选自:重组酶、聚合酶、解旋酶、转座酶、连接酶、脱氨酶、氧化酶和激酶。
在一些实施方案中,基底包含一种或多种选自玻璃、硅、塑料和生物聚合物的材料。在一些实施方案中,所述特征由缺少靶多核苷酸的间隙区域分开。在一些实施方案中,特征包括珠、孔、通道、脊(ridge)、突起(projection)或其组合。在一些实施方案中,孔是微孔或纳米孔。在一些实施方案中,基底还包含水凝胶或共价连接的凝胶。
本文中还提供了将单一靶分子置于基底的特征上的方法。在一方面,方法是将单一靶分子置于基底的特征上的方法,通过杂交固定化到基底上的特征的多个第一和第二捕捉引物与至少一个靶多核苷酸进行,其中所述靶多核苷酸包含侧翼有与所述第一和第二捕捉引物互补的第一和第二捕捉引物结合区的靶区域,其中所述第二捕捉引物结合区包含与所述第二捕捉引物的碱基对错配并且与靶分子连接。方法进一步包括以平均扩增速率扩增所述至少一种靶多核苷酸以产生与所述靶多核苷酸互补的多个克隆扩增子,所述平均扩增速率超过靶多核苷酸至特征的平均转运速率。方法还包括以平均扩增速率扩增所述至少一种靶多核苷酸以产生与所述靶多核苷酸互补的多个克隆扩增子,所述平均扩增速率超过靶多核苷酸至特征的平均转运速率。
在本文中所述的方法的一些实施方案中,碱基对错配是1、2、3、4、5、6、7、8、9或10个碱基对错配。在本文中所述的方法的一些实施方案中,碱基对错配是三碱基对错配。在本文中所述的方法的一些实施方案中,基底包括多个特征。在本文中所述的方法的一些实施方案中,特征包括单一靶分子。在本文中所述的方法的一些实施方案中,用所述多个克隆扩增子填满所述特征。在本文中所述的方法的一些实施方案中,多个特征包含单一靶分子。在本文中所述的方法的一些实施方案中,特征中的两个或更多个包含不同的单一靶分子。在本文中所述的方法的一些实施方案中,用所述多个克隆扩增子填满所述特征。
在本文中所述的方法的一些实施方案中,扩增包括等温扩增。在本文中所述的方法的一些实施方案中,等温扩增还包含单链结合多肽。在本文中所述的方法的一些实施方案中,等温扩增包括动力学排除扩增。在本文中所述的方法的一些实施方案中,等温扩增还包括动力学排除扩增。
在本文中所述的方法的一些实施方案中,在所述特征处产生的随后扩增子的平均扩增速率超过第一扩增子的平均扩增速率。在本文中所述的方法的一些实施方案中,所述靶多核苷酸包含一种或多种选自rna、dna和pna的多核苷酸。在本文中所述的方法的一些实施方案中,所述靶多核苷酸包括双链dna(dsdna)。在一些实施方案中,所述靶多核苷酸包含少于1,000个核苷酸。在本文中所述的方法的一些实施方案中,所述靶多核苷酸的长度包括10至25、26至50、51至100、101至200、201至300、301至400、401至500、501至600、601至700、701至800、801至900、或901至1000个碱基对。
在本文中所述的方法的一些实施方案中,靶分子包括多肽、多核苷酸、碳水化合物、氨基酸、核苷酸、单糖、半抗原、配体、抗原、分析物、小分子有机化合物或无机化合物。在本文中所述的方法的一些实施方案中,靶分子包括多肽。在本文中所述的方法的一些实施方案中,多肽选自纳米孔、结合多肽和酶。在本文中所述的方法的一些实施方案中,纳米孔选自mspa、ompf、ompg、nalp、wza、clya毒素、α-溶血素、炭疽毒素、杀白细胞素和dna折纸纳米孔。在本文中所述的方法的一些实施方案中,结合多肽选自:抗体、fab、fab'、f(ab')2、scfv、双抗体、三抗体、微型抗体和单域抗体(sdab)、t细胞受体、小菌素、神经肽、g蛋白偶联受体、抗体、表皮生长因子受体和her2。
在本文中所述的方法的一些实施方案中,酶选自:重组酶、聚合酶、解旋酶、转座酶、连接酶、脱氨酶、氧化酶和激酶。在本文中所述的方法的一些实施方案中,基底包含一种或多种选自玻璃、硅、塑料和生物聚合物的材料。在本文中所述的方法的一些实施方案中,特征由缺少靶多核苷酸的间隙区域分开。在本文中所述的方法的一些实施方案中,特征包括珠、孔、通道、脊、突起或其组合。在本文中所述的方法的一些实施方案中,孔是微孔或纳米线。在本文中所述的方法的一些实施方案中,基底还包含水凝胶或共价连接的凝胶。
附图简述
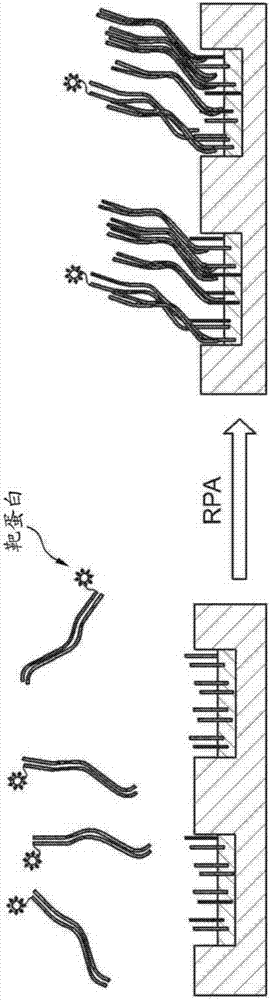
图1显示了使用附着到靶分子的靶多核苷酸的动力学排除扩增(kea),在多个特征中的每个中放置单一靶分子。
图2显示了例示性基底。
图3a-d显示了例示性靶多核苷酸。
图4显示了靶多核苷酸上的捕捉引物结合区的设计,所述捕捉引物结合区可以用于在远端从捕捉引物结合区扩增附着到靶分子的链,同时指数扩增由其产生的扩增子。
图5显示了包含至少两个特征的例示性基底。
图6显示了在双链靶多核苷酸中使用错配捕捉引物区的第一和第二轮等温扩增。
图7显示了用于生成基底的例示性工作流程。
图8显示了例示性试剂盒。
图9显示了使用匹配和错配的捕捉引物/捕捉引物结合区的动力学排除扩增(kea)反应中使用的靶多核苷酸和捕捉引物结合区设计。
图10显示了图9所示的靶多核苷酸的扩增子产物。
发明详述
本公开涉及用于将单分子置于选定的基底区域上的组合物和方法。单分子的放置或单分子放置可用于多种应用中,其中与群体之间的平均测量相反期望测定单分子相互作用。当期望使用单分子询问单分子水平的另一个分子实体时,单分子的放置也可以是有用的。
在图1所示的一个例示性实施方案中,本公开涉及使用动力学排除测定(kea)将单分子置于基底的靶区域上。在该实施方案中,首先用kea引物官能化基底的靶区域,并将靶分子与通过kea快速扩增的双链核酸连接。当靶分子落在基底上时,连接的核酸快速扩增以填充整个垫,并防止不同分子的进一步着陆。该例示性方法是不太受目标区域的临界维度(criticaldimension,cd)限制的,并且加载通量将高于基于大小排阻效应的方法。此外,kea是自限制的过程,因此与大规模生产相容。
如本文所用,术语“基底”旨在表示固体支持物。该术语包括可用作产生特征的固体或半固体基础的任何材料,如沉积生物聚合物,包括核酸,多肽和/或其它聚合物的孔。本发明的基底可以通过本领域技术人员众所周知的各种方法进行改性,或者可以进行修饰以适应生物聚合物的附着。基底材料的例示性类型包括玻璃,改性玻璃,官能化玻璃,无机玻璃,微球,包括惰性和/或磁性颗粒,塑料,多糖,尼龙,硝化纤维素,陶瓷,树脂,二氧化硅,基于二氧化硅的材料,碳,金属,光纤或光纤束,除上述例示的物质以外的各种聚合物和多孔微量滴定板。具体类型的例示性塑料包括丙烯酸树脂,聚苯乙烯,苯乙烯和其它材料的共聚物,聚丙烯,聚乙烯,聚丁烯,聚氨酯和teflontm(例如聚四氟乙烯,全氟烷氧基,氟化乙烯丙烯及其衍生物)。例示性基于二氧化硅的材料的具体类型包括硅和各种形式的改性硅。
在本文呈现的方法和组合物中,可以将多核苷酸固定化到本文所述的基底。在一些实施方案中,多核苷酸共价固定化到基底。当提及将分子(例如核酸)固定化到基底时,术语“固定化”和“附着”在本文中可互换使用,并且两个术语旨在包括直接或间接,共价或非共价附着,除非明确或根据上文另有指示。在本发明的某些实施方案中,共价连接可以是优选的,但通常所需要的是分子(例如核酸)在其旨在使用基底的条件下保持固定化或附着到支持物。
本发明的某些实施方案可以使用包括惰性基底或基质(例如玻璃载片,聚合物珠等)的基底,所述惰性基底或基质已被官能化,例如通过施加中间材料的层或涂层,所述中间材料包括允许共价附着到生物分子,如多核苷酸的反应性基团。这种支持物的实例包括但不限于在惰性基底如玻璃上支持的聚丙烯酰胺水凝胶,特别是如wo2005/065814和us2008/0280773中所述的聚丙烯酰胺水凝胶,其内容通过引用方式整体并入本文。在此类实施方案中,生物分子(例如多核苷酸)可以直接共价附着到中间材料(例如水凝胶),但中间材料本身可以非共价附着到基底或基质(例如玻璃基底)上。术语“共价附着到固体支持物”和“共价附着到基底”可互换使用,并且相应解释为包括这种类型的布置。
例示性的共价连接包括例如由使用点击化学技术产生的那些。例示性非共价连接包括但不限于非特异性相互作用(例如氢键键合,离子键键合,范德华相互作用等)或特异性相互作用(例如亲和力相互作用,受体-配体相互作用,抗体-表位相互作用,亲合素-生物素相互作用,链霉亲合素-生物素相互作用,凝集素-碳水化合物相互作用等)。例示性的连接在美国专利no.6,737,236;7,259,258;7,375,234和7,427,678;和美国专利公开no.2011/0059865a1,其各自通过引用并入本文。共价连接可以包括使用如本文所述的缀合化学形成的那些。
术语“固体表面”,“固体支持物”和本文中的其它语法等同物是指适合于或可以修饰为适合于附着多核苷酸的任何材料。如本领域技术人员将理解,可能的基底数目非常大。可能的基底包括但不限于玻璃和改性或官能化的玻璃,塑料(包括丙烯酸类,聚苯乙烯和苯乙烯和其它材料的共聚物,聚丙烯,聚乙烯,聚丁烯,聚氨酯,teflontm等),多糖,尼龙或硝基纤维素,陶瓷,树脂,二氧化硅或基于二氧化硅的材料,包括硅和改性硅,碳,金属,无机玻璃,塑料,光纤束和各种其它聚合物。对于一些实施方案特别有用的固体支持物和固体表面位于流动池装置内。例示性的流动池在下面进一步详细阐述。
本领域技术人员将知道或理解本发明的基底的组成和几何形状可以根据用户的预期用途和偏好而变化。因此,尽管平面基底如载玻片,芯片或晶片在本文中参照用于说明的微阵列例示,但是鉴于本文提供的教导和指导,本领域技术人员将理解,本文中例示或本领域中公知的极其多种其它基底也可以用于本发明的方法和/或组合物中。
在一些实施方案中,固体支持物包含流动池的一个或多个表面。如本文所用,术语“流动池”是指包含一个或多个流体试剂可以流过的固体表面的室。例如在bentleyetal.,nature456:53-59(2008),wo04/018497中描述了可容易地用于本公开的方法中的流动池和相关流体系统和检测平台的实例。us7,057,026;wo91/06678;wo07/123744;us7,329,492;us7,211,414;us7,315,019;us7,405,281和us2008/0108082,其各自通过引用并入本文。
在一些实施方案中,固体支持物或其表面是非平面的,如管或容器的内表面或外表面。在一些实施方案中,固体支持物包含微球或珠。本文中的“微球”或“珠”或“颗粒”或语法等同物是指小的离散颗粒。合适的珠组合物包括但不限于塑料,陶瓷,玻璃,聚苯乙烯,甲基苯乙烯,丙烯酸聚合物,顺磁材料,氧化钍溶胶,碳石墨,二氧化钛,胶乳或交联葡聚糖如琼脂糖凝胶,纤维素,尼龙,交联胶束和teflon,以及本文概述的固体支持物的任何其它材料都可以使用。来自bangslaboratories,fishersind.的“microspheredetectionguide”是一个有用的指南。在某些实施方案中,微球是磁性微球或珠。珠不需要是球形的;可以使用不规则的颗粒。或者或另外,珠可以是多孔的。珠的大小范围从纳米,即100nm到毫米,即1mm,优选约0.2微米至约200微米的珠,特别优选约0.5至约5微米,尽管在一些实施方案中,可以使用更小或更大的珠。
在一些实施方案中,固体支持物包括图案化表面。“图案化表面”是指在固体支持体的暴露层中或其上的不同区域的布置。例如,一个或多个区域可以是其中存在一个或多个扩增引物的特征。特征可以通过不存在扩增引物的间隙区分开。在一些实施方案中,图案可以是行和列中的特征的x-y格式。在一些实施方案中,图案可以是特征和/或间隙区域的重复排列。在一些实施方案中,图案可以是特征和/或间隙区域的随机排列。可用于本文提出的方法和组合物中的例示性图案化表面描述于usser.no.13/661,524或美国专利申请公开no.2012/0316086a1,其各自通过引用并入本文。
在一些实施方案中,固体支持物包括表面中的孔或凹陷的阵列。这可以如本领域中通常已知使用各种技术制造,包括但不限于光刻法、冲压技术、模制技术和微蚀刻技术。如本领域技术人员所理解的,所使用的技术将取决于阵列基底的组成和形状。
图案化表面中的特征可以是在玻璃,硅,塑料或具有图案化共价连接的凝胶如聚(n-(5-叠氮基乙酰胺基戊基)丙烯酰胺-共-丙烯酰胺)(pazam,参见例如美国临时专利申请序列号61/753,833,其通过引用并入本文)的其它合适的固体载体上的孔(例如,微孔或纳米孔)阵列中的孔。该过程产生用于测序的凝胶垫,其可以在具有大量循环的测序运行中稳定。在各种用途期间,聚合物与孔的共价连接有助于在结构化基底的整个寿命期间将凝胶维持在结构化特征中。然而,在许多实施方案中,凝胶不需要与孔共价连接。例如,在某些条件下,无硅烷的丙烯酰胺(sfa,参见例如美国专利申请公开号2011/0059865a1,其通过引用并入本文)(其不共价附着到结构化基底的任何部分)可用作凝胶材料。
在具体的实施方案中,结构化基底可以如下制备:用孔(例如微孔或纳米孔)图案化固体支持材料,用凝胶材料(例如,pazam,sfa或其化学修饰的变体,如sfa(叠氮-sfa)的叠氮化形式)包被图案化的支持物,并且例如通过化学或机械抛光来研磨凝胶包被的载体,从而将凝胶保留在孔中,但是从孔间结构化基底表面上的间隙区域中除去或灭活基本上所有的凝胶。引物核酸可以附着到凝胶材料。然后,可以将靶多核苷酸(例如,片段化的人基因组)的溶液与抛光的基底接触,使得通过与附着到凝胶材料的引物的相互作用,各个靶多核苷酸接种单个孔;然而,由于凝胶材料的不存在或不活动,靶多核苷酸不会占据间隙区域。靶多核苷酸的扩增将被限制在孔中,因为间隙区域中凝胶的不存在或不活动阻止了生长核酸菌落的向外迁移。该方法可方便地制造,可扩展并利用常规的微米或纳米制造方法。
图案化基底可以包括例如刻蚀成载玻片或芯片的孔。只要这种特征在物理上或功能上可彼此分离,孔的蚀刻和几何形状的图案可以采用各种不同的形状和大小。具有这种结构特征的特别有用的基底是可以选择固体支持物颗粒如微球的大小的图案化基底。具有这些特征的例示化基底是与beadarray技术(illumina,inc.,sandiego,calif)结合使用的蚀刻基底。其它实例描述于美国专利no.6,770,441,其通过引用并入本文。
阵列是指可以根据相对位置彼此区分的位点群体。位于阵列不同位点的不同分子可以根据阵列中位点的位置彼此区分。阵列的单个位点可以包括一种或多种特定类型的分子。例如,位点可以包括具有特定序列的单靶多核苷酸分子,或者位点可以包括具有相同序列(和/或其互补序列)的几个核酸分子。阵列的位置可以是位于同一基底上的不同特征。例示性特征包括但不限于基底中的孔,基底中或基底上的珠(或其它颗粒)、从基底的突起、在基底上的脊或基底中的通道。阵列的位点可以是分别的基底,每个都带有不同的分子。可以根据与基底结合的表面上的基底位置或根据在液体或凝胶中的基底位置来鉴定附着到分离基底的不同分子。分离的基底位于表面上的例示性阵列包括但不限于在孔中具有珠的那些。
如本文所用,术语“微球”或“珠”或“颗粒”或本文中的语法等同物是指小的离散颗粒。合适的珠组合物包括但不限于塑料,陶瓷,玻璃,聚苯乙烯,甲基苯乙烯,丙烯酸聚合物,顺磁材料,氧化钍溶胶,碳石墨,二氧化钛,胶乳或交联葡聚糖如sepharose,纤维素,尼龙,交联胶束和teflon,以及本文概述的固体支持物的任何其它材料都可以使用。来自bangslaboratories,fishersind.的“microspheredetectionguide”是一个有用的指南。在某些实施方案中,微球是磁性微球或珠。
如本文所用,术语“多个”旨在表示两个或更多个不同成员的群体。多个的大小范围可以从小、中等、大到非常大。较小大小的多个的范围可以是例如从几个成员到数十个成员。中等大小的多个的范围可以例如从数十个成员到大约100个成员或数百个成员。例如,较大的多个可以从大约数百个成员到约1000个成员,至数千个成员且直至几万个成员。非常大的多个的范围可以从数万个成员到几十万,一百万,数百万,数千万,甚至大于数亿个成员。因此,多个的大小范围可以在两个到完全超过1亿个成员以及在上述例示性范围之间和大于上述例示性范围的所有大小,如通过成员的数目测量。微阵列中的特征的例示性数目包括在1.28cm2内多个约500,000或更多个离散特征。例示性核酸多个包括例如约1×105,5×105和1×106或更多不同核酸种类的群体。因此,术语的定义旨在包括大于2的所有整数值。本发明的多个上限可以例如通过本发明的核酸样品中的核苷酸序列的理论多样性来设定。
如本文所用,当涉及多核苷酸使用时,术语“固定化”旨在表示通过共价或非共价键直接或间接附着至固体支持物。在本发明的某些实施方案中,可以使用共价连接,但是所需要的全部是多核苷酸在期望使用载体的条件下保持静止或附着到支持物,例如在需要核酸扩增和/或测序的应用中。用作捕捉引物或扩增引物的寡核苷酸可以是固定化的,使得3'-末端可用于酶促延伸,并且该序列的至少一部分能够与互补序列杂交。固定化可以通过与表面附着的寡核苷酸的杂交发生,在这种情况下,固定化的寡核苷酸或多核苷酸可以是3'-5'取向。或者,固定化可以通过除碱基配对杂交以外的方法发生,例如上述共价附着。
如本文所用,术语“多核苷酸”旨在表示核糖核酸或脱氧核糖核酸或其类似物,包括在任何上下文中呈现的多核苷酸分析物;例如探针,靶物或引物。本发明的多核苷酸的特定形式包括在生物体中发现的所有类型的核酸,以及合成核酸,例如通过化学合成产生的多核苷酸。适用于通过掺入通过本发明方法产生的微阵列进行分析的核酸的特定实例包括基因组dna(gdna),dna复制的信使rna(cdna),rna复制的信使rna(crna),线粒体dna或基因组,rna,信使rna(mrna)和/或其它rna群体。多核苷酸的另外的实例包括双链dna(dsdna),单链dna(ssdna),基因或基因片段(例如,探针,引物,表达序列标签(est)或基因表达连续分析(sage)标签),基因组dna,外显子,内含子,转移rna(trna),核糖体rna(rrna),核酶,重组多核苷酸,合成多核苷酸,支链多核苷酸,质粒,载体,任何序列的分离的dna,任何序列的分离的rna或任何前述物质的扩增拷贝。上述例示性核酸的片段和/或部分也包括在该术语的含义内,如其在本文中使用。
术语“核酸”,“多核苷酸”和“寡核苷酸”在本文中可互换使用。除非另有特别说明,否则不同的术语并不旨在表示大小,序列或其它特性中的任何特定差异。为了描述的清楚,当描述包括几种核酸种类的特定方法或组合物时,术语可用于区分一种核酸与另一种。
如本文所用,当涉及多核苷酸使用时,术语“双链”是指多核苷酸的互补链之间的一些或全部核苷酸是氢键键合在一起的,以形成部分或完全双螺旋。部分双链多核苷酸可具有与互补核苷酸键合键合的至少10%,25%,50%,60%,70%,80%,90%或95%的其核苷酸。
单链多核苷酸是指与另一多核苷酸几乎没有或没有氢键的多核苷酸,使得双螺旋未形成或在给定的一组杂交条件下不稳定。
如本文所用,术语“靶多核苷酸”旨在表示作为分析,作用,询问或使用的对象的多核苷酸。分析,作用或询问包括对靶多核苷酸进行例如用于核酸询问的复制,扩增,测序和/或其它程序。分析或使用还可以包括使用靶多核苷酸作为系统中的组分来分析,执行动作或询问其它分子实体。组件可以是结构或功能的。靶多核苷酸可以包括待分析或使用的靶序列额外的核苷酸序列。例如,靶多核苷酸可以包括一个或多个衔接头,包括用作引物结合位点的衔接头,其在待在系统中分析或使用的靶多核苷酸序列的侧翼。与捕获寡核苷酸或捕捉引物杂交的靶多核苷酸可以含有以下述方式延伸超过捕获寡核苷酸的5'或3'末端,使得不是所有的靶多核苷酸都适合于延伸的核苷酸。在具体实施方案中,如下文更详细地阐述的,多个靶多核苷酸包括其靶多核苷酸序列不同,但具有对于两种或更多种不同种类相同的衔接头的不同种类。可以位于特定靶多核苷酸序列侧翼的两个衔接头可以具有相同的序列,或者两个衔接头可以具有不同的序列。因此,多个不同的靶多核苷酸可以在靶多核苷酸序列的每个末端具有相同的衔接头序列或两个不同的衔接头序列。因此,多个靶多核苷酸中的种类可以包括将通过例如测序来评估的未知序列的区域侧翼的已知序列区域。此外,多个靶多核苷酸可以是相同的种类或不同种类,并且可以包括将被用作系统中的组分的已知序列的区域侧翼的已知序列区域。在靶多核苷酸在单一末端处携带衔接头的情况下,衔接头可以位于靶多核苷酸的3'末端或5'末端。靶多核苷酸可以在没有任何衔接头的情况下使用,在这种情况下,引物结合序列可以直接来自靶多核苷酸中发现的序列。
如本文所用,术语“靶分子”旨在表示作为分析,作用,询问或使用的对象的任何分子。分析,作用或询问包括使分子进行例如测序,结合测定,亲和力测量,催化测量,底物或产物特异性和其它分子测定。分析或使用还可以包括使用靶分子作为系统中的组分来分析,执行动作或询问其它分子实体。组分可以是结构或功能的。例如,靶分子可以是用于核酸的纳米孔测序的纳米孔。适用于纳米孔测序的其它靶分子包括例如解旋酶和聚合酶。靶分子的其它例示性分析或用途包括例如分子结合亲和筛选,酶筛选,化合物筛选和其中期望确定或测量分子相互作用的所有其它测定。因此,靶分子可以是分析,作用或询问的主题,或者可以用于分析,执行动作或询问其它分子。例示性的靶分子包括例如生物聚合物,包括多肽,多核苷酸或多糖,氨基酸,核苷酸,单糖,二糖,其它碳水化合物,受体,半抗原,配体,抗原,分析物,小分子有机化合物或无机化合物,维生素,代谢物,抗氧化剂,免疫抑制剂,抗癌药物或其任何组合。
另外,应当理解,靶分子可以以任何数目的方式附着到多肽(靶多肽)上。例如,靶分子可以使用本领域已知并在此描述的缀合化学技术进行附着。有利的缀合化学种类包括在相对温和的条件下进行的化学反应。这些包括但不限于亲核取代(例如,胺和醇与酰基卤化物,活性酯的反应),亲电取代(例如烯胺反应)和对碳-碳和碳-杂原子多键的添加(例如,迈克尔(michael)反应,diels-alder加成)。这些和其它有用的反应在例如march,advancedorganicchemistry,3rded.,johnwiley&sons,newyork,1985;hermanson,bioconjugatetechniques,academicpress,sandiego,1996;以及feeneyetal.,modificationofproteins;advancesinchemistryseries,vol.198,americanchemicalsociety,washington,d.c.,1982中讨论。
可用于缀合化学技术的例示性反应性官能团包括羧基(例如,n-羟基琥珀酰亚胺酯,n-羟基苯并三唑酯,酸卤化物,酰基咪唑,硫酯,对硝基苯基酯,烷基,烯基,炔基和芳族酯);羟基(即转化为例如酯,醚或醛);卤代烷基;亲双烯体(例如diels-alder反应);醛基;酮基;磺酰基;胺基;烯烃(即环加成和迈克尔加成);环氧化物;亚磷酰胺基团;膦基;叠氮基(即用于点击化学);和硫醇基团。此类反应性基团可以在靶分子或多肽上进行官能化。
在一个说明性实施方案中,半胱氨酸残基的还原硫醇(-sh)基团(即巯基)可以与具有硫醇-反应性基团的系链反应。这些基团的实例包括马来酰亚胺和碘乙酰胺。初级硫醇反应试剂,包括碘乙酰胺,马来酰亚胺,苄基卤化物和溴甲基酮可以通过硫醇的s-烷基化反应,以产生稳定的硫醚产物;芳基化试剂如7-硝基苯并-2,1,3-氧代二唑(7-nitrobenz-2,1,3-oxadiazole,nbd)卤化物可以与硫醇或胺反应,通过亲核试剂对芳族卤化物的类似取代进行;并且由于硫醇盐阴离子是比中性硫醇更好的亲核试剂,半胱氨酸在其pka以上更具反应性。另外的巯基反应性化学基团包括卤代乙酰基,马来酰亚胺,氮丙啶(zairidines),丙烯酰基,芳基化剂,乙烯基砜,吡啶基二硫化物,tnb-硫醇(2-硝基-5-硫代苯甲酸)和二硫化物还原剂。此类基团可以通过烷基化(例如通过形成硫醚键)或二硫键交换(例如形成二硫键)与巯基偶联。也可以适当使用巯基交换反应。
或者,胺(-nh2)可以是靶向的。例如,赖氨酸残基的伯胺和多肽n-末端是相对反应的。胺残基可以用可形成稳定酰胺键的n-羟基琥珀酰亚胺酯(nhs酯)或可与伯胺反应形成脒键的亚氨酸酯(imidoester)交联剂进行靶向。有许多其它胺反应性化合物。例如,可以与伯胺形成化学键的合成化学基团包括异硫氰酸酯,异氰酸酯,酰基叠氮化物,nhs酯,磺酰氯,醛,乙二醛,环氧化物,环氧乙烷,碳酸酯,芳基卤化物,亚氨酸酯,碳二亚胺,酸酐和氟代苯酯;此类基团可以与胺结合,例如通过酰化或烷基化。
在其它实施方案中,修饰的靶分子可以用于引入与点击化学一起使用的新型官能性,如叠氮化物或炔烃。例如,如上所述的硫醇或胺反应性可以与允许添加叠氮化物或炔属官能团的接头一起使用,以进一步用于点击化学反应。
创建在图案化表面上间隔开的单分子阵列的能力包括许多特征以及用于化学和生物传感的应用。单分子阵列的一个特征包括受到检测约束的填充密度的优化。可以使用标准光学检测进行检测。对于标准光学检测,分子间间隔可以为约500nm(例如,检测光的波长的顺序)。可以使用诸如例如cmos芯片上的电子读出的电子读出来执行检测。
电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约1至约15um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约1至约12um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约1至约10um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约1至约9um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约1至约8um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约1至约7um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约1至约6um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约1至约5um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约1至约4um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约1至约3um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约1um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约2um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约3um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约4um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约5um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约6um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约7um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约8um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约9um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约10um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约11um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约12um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约13um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约14um的大小。电子读出(例如在cmos芯片上)的单分子的间隔可以使得单分子占据约15um的大小。在实施方案中,单分子占据约单个像素(例如1-10um的大小)。
单分子传感器可以用于多种应用,包括但不限于使用抗体等的dna测序,化学感测和蛋白质/抗原测定等。在实施方案中,单个聚合酶分子可用于在dna序列中实时测序dna。在其它实施方案中,可以使用基于纳米孔的dna测序,其中双层中单个纳米孔的放置可用于产生可解释数据。
如本文所用,术语“扩增子”当用于提及核酸时,意指将核酸复制的产物,其中产物具有与复制核酸的核苷酸序列的至少一部分相同或互补的核苷酸序列。可以通过使用核酸或其扩增子作为模板的各种扩增方法中的任一种来产生扩增子,包括例如重组酶聚合酶扩增,动力学排除扩增,聚合酶延伸,聚合酶链反应(pcr),滚环扩增(rca),连接延伸或连接链反应。扩增子可以是具有特定核苷酸序列(例如pcr产物)的单拷贝或核苷酸序列的多个拷贝(例如rca的连环化产物)的核酸分子。靶核酸的第一扩增子可以是互补拷贝。随后的扩增子是在靶多核苷酸或第一扩增子产生第一扩增子后产生的拷贝。随后的扩增子可以具有与靶多核苷酸基本上互补的或与靶多核苷酸基本上相同的序列。
可以通过适当修饰扩增反应来调节可产生的模板拷贝或扩增子的数目,包括例如改变扩增循环运行的次数,在扩增反应中使用不同可持续性的聚合酶和/或变化扩增反应运行的时间长度以及本领域已知的影响扩增产率的其它条件的修饰。核酸模板的拷贝数可以是至少1,10,100,200,500,1000,2000,3000,4000,5000,6000,7000,8000,9000和10,000个拷贝,并且可以根据具体应用变化。
当用于提及扩增子或多个扩增子时,术语“克隆”旨在表示就特定核苷酸序列而言同质的核酸群体。同质的序列可以是至少10个核苷酸长,或更长,例如至少50,100,250,500或1000个核苷酸长。克隆群体可以衍生自单个靶多核苷酸或模板核酸。克隆群体中的基本上所有核酸都具有相同的核苷酸序列。应当理解,克隆群体中可以发生少量突变(例如由于扩增伪影)而不脱离克隆性。
如本文所用,术语“捕捉引物”旨在表示具有核苷酸序列的寡核苷酸,该核苷酸序列能够特异性退火到待分析或经受在例如扩增或测序反应的引物退火步骤中遇到的条件下的核酸询问的单链多核苷酸序列。该术语还旨在表示具有能够对用于分析,询问另一分子实体或对另一分子实体进行作用的单链多核苷酸序列特异性退火的核苷酸序列的寡核苷酸。
如本文所用,当提及捕捉引物或其它寡核苷酸使用时,术语“靶物特异性”旨在表示捕捉引物或其它寡核苷酸,其包括对靶多核苷酸序列特异性的核苷酸序列,即能够选择性退火到靶多核苷酸的鉴定区的核苷酸序列。靶物特异性捕捉引物可以具有单种寡核苷酸,或者它可以包括具有不同序列的两种或更多种。因此,靶物特异性捕捉引物可以是两个或更多个序列,包括3,4,5,6,7,8,9或10个或更多个不同的序列。靶物特异性捕获寡核苷酸可以包括靶物特异性捕捉引物序列和通用捕捉引物序列。其它序列如测序引物序列等也可以包括在靶物特异性捕捉引物中。
相比之下,当提及捕捉引物或其它寡核苷酸序列使用时,术语“通用”旨在表示捕捉引物或在多个捕捉引物中具有共同核苷酸序列的其它寡核苷酸。共同序列可以是例如与相同衔接头序列互补的序列。通用捕捉引物适用于询问多个不同的多核苷酸,而不必区分不同的种类,而靶物特异性捕捉引物适用于区分不同的种类。
本公开提供了基底,包括:(a)固定化到所述基底上的特征的多个第一和第二捕捉引物;(b)至少一个靶多核苷酸,一个末端附着到所述捕捉引物之一而另一个末端与靶分子连接,其中所述靶多核苷酸包含侧翼有与所述第一和第二捕捉引物互补的第一和第二捕捉引物结合区的靶区域,所述第二捕捉引物结合区包含与所述第二捕捉引物的碱基对错配,并且(c)与固定化到所述特征的所述靶多核苷酸互补的多个克隆扩增子。
在一个实施方案中,本公开的基底可以包含定位于基底上的位点的至少一个单分子。用于单分子分析和/或询问的实施方案,本公开的基底将具有定位到基底上的位点的单一靶分子。单一靶分子可以使用例如本文所述的方法和分子成分定位于基底上的一个或多个位点。
用于定位单一靶分子的基底可以包括先前描述的那些材料和形式,以及本领域公知的其它材料和形式。例如,在一些实施方案中,基底可以是可以附着生物分子(包括例如多核苷酸)的任何不溶性固体支持物,半固体支持物或基质。例示性固体支持物包括玻璃,改性玻璃,官能化玻璃,无机玻璃,微球(例如惰性和/或磁性颗粒),塑料,多糖,尼龙,硝化纤维素,陶瓷,树脂,二氧化硅,基于二氧化硅的材料,碳,金属,光纤或光纤束,聚合物和多孔(例如微量滴定板)。例示性塑料包括丙烯酸树脂,聚苯乙烯,苯乙烯和其它材料的共聚物,聚丙烯,聚乙烯,聚丁烯,聚氨酯和teflontm。例示性的基于二氧化硅的材料包括硅,包括硅晶片和各种形式的改性硅。可用作基底的其它固体支持物包括例如乳胶珠,葡聚糖珠,聚丙烯酰胺凝胶,金表面,氮化硅表面或金属氧化物表面。
在一些实施方案中,表面可以是任何期望的形状,包括例如适用于如本文所述的单分子放置的平面,球形或多孔材料。例如,固体支持体可以是平面玻璃表面。
在具体的实施方案中,基底可以在诸如孔,管,通道,比色皿,培养皿,瓶等的容器内或容器的部分内,以允许与各种试剂的溶液相互作用。特别有用的容器是流动池,例如如us2010/01111768a1或bentleyetal,nature456:53-59(2008)中所述。例示性流动池包括可从illumina,inc.(sandiego,ca)商购的那些。另一个特别有用的容器是在多孔板或微量滴定板中的孔。
在一些实施方案中,用于定位至少一种靶分子的基底上的位点可以是特征。如上所述和下文所述,特征可以以各种期望的格式的任何一种存在。例如,特征可以是孔,坑(pit),通道,脊,隆起区域,钉(peg),柱等。如前所述,特征可以是珠或可以含有珠。
在具体的实施方案中,特征不需要包含珠或颗粒。例示性特征包括存在于基底中的孔,所述基底用于例如由454lifesciences(roche子公司,baselswitzerland)或iontorrent(lifetechnologies子公司,carlsbadcalifornia)出售的商业测序平台中使用。具有孔的其它基底包括例如us6,266,459;us6,355,431;us6,770,441;us6,859,570;us6,210,891;us6,258,568;us6,274,320;us2009/0026082a1;us2009/0127589a1;us2010/0137143a1;us2011/0282617a1或pct公开号wo00/63437中描述的蚀刻光纤和其它基底。在几种情况下,对于使用孔中的珠的应用,在这些参考文献中例示了基底。在本公开的组合物中,可以与或不与珠一起使用含有孔的基底。
在一些实施方案中,基底的孔可以包括如美国临时申请no61/769,289中列出的凝胶材料,其通过引用并入本文。
在一个实施方案中,特征可以是非金属表面上的金属特征,例如上面例示的玻璃,塑料或其它材料。金属层可以使用本领域已知的方法沉积在表面上,例如湿等离子体蚀刻,干等离子体蚀刻,原子层沉积,离子束蚀刻,化学气相沉积,真空溅射等。可以适当地使用各种商业仪器中的任何一种,包括例如
本公开的基底可以固定化到在基底上的特征上的第一和第二捕捉引物。第一和第二捕捉引物可以是多个第一捕捉引物和多个第二捕捉引物。在一些实施方案中,第一和第二捕捉引物可以针对靶多核苷酸的不同序列,因此对靶多核苷酸的不同区域表现出特异性。在其它实施方案中,第一和第二捕捉引物可以针对不同的靶多核苷酸。
图2中描绘了例示性的基底。如图2中所示,基底(201)可以包含多个第一捕捉引物(202,203,204)和多个第二捕捉引物(205,206,207)。基底(201)还可以包含靶多核苷酸(208),其在一端附着到捕捉引物(202)。基底(201)还可以包含靶多核苷酸(208)的扩增子(210,211,212,213和214)。另外,基底(201)可以包含附着于靶多核苷酸(208)的靶分子(209)。
在一个实施方案中,本公开提供了包括第一特征的基底,其中第一特征包括(a)多个第一捕捉引物;(b)多个第二捕捉引物;和(c)靶多核苷酸,其中:(i)靶多核苷酸是双链的;(ii)靶多核苷酸包括第二捕捉引物结合区;(iii)第二捕捉引物结合区包含至少一个核苷酸错配;和(iv)第二捕捉引物结合区的一条链是第二捕捉引结物的反向互补物,而第二捕捉引物结合区的另一条链与第二捕捉引物小于100%相同。第二捕捉引物结合区可以含有两个以上的核苷酸错配。第二捕捉引物结合区可以含有三个以上的核苷酸错配。第二捕捉引物结合区可能含有四个以上的核苷酸错配。靶多核苷酸可以进一步包含一个或多个另外的捕捉引物结合区。靶多核苷酸还可以包括可以与第一捕捉引物杂交的第一捕捉引物结合区。第一个捕捉引物结合区可以以100%的互补性与第一个捕捉引物杂交。例如,第一捕捉引物结合区可以包含与第一捕捉引物的100%核苷酸匹配。第一特征可以进一步包含多个扩增子。多个扩增子可以包含靶多核苷酸的扩增子。第一特征可以进一步包括靶分子。靶分子可以附着到靶多核苷酸。第一特征可以进一步包含一个或多个另外的靶分子。一个或多个另外的靶分子可以悬浮于特征内的捕捉引物,靶多核苷酸或扩增子。或者或另外,一个或多个另外的靶分子不附着或固定到特征上。一个或多个另外的靶分子可以在特征中的溶液中。基底可以进一步包括一个或多个另外的特征。一个或多个另外的特征可以包括多个第一捕捉引物,多个第二捕捉引物,靶多核苷酸,靶分子,多个扩增子或其组合。
两个或更多个捕捉引物可以任何比率存在于特征中。例如,多个第一捕捉引物和多个第二捕捉引物可以以相等的量或以任何其它比率,例如摩尔比存在。特征可以具有相对于第二捕捉引物过量大于1.1x,大于1.2x,大于1.3x,大于1.4x,大于1.5x,大于2.0x,大于2.5x,大于3.0x,大于5.0x,大于10x,大于15x,大于20x,大于20x,大于25x,大于30x,大于50x,大于100x,大于300x,大于500x,或大于1,000x的第一捕捉引物。在使用多个特征的实施方案中,如例如在微阵列中,不同的特征可以具有两个或更多个捕捉引物的相同比率或不同的比率。
捕捉引物可以包括一个或多个捕捉区域。捕捉引物区可以包括例如通用捕获区,测序引物结合位点(sbs),靶物特异性捕获区,预定的切割位点,如限制性位点和接头区,例如,分离捕捉引物的两个或更多个区域的接头区域。一些捕捉引物可以包括例如通用捕捉区域和sbs。其它捕捉引物可以包括通用捕捉区域和靶物特异性捕捉区域。其它捕捉引物可以包括例如通用捕捉区域,sbs和靶物特异性区域。捕捉引物可以在3'末端处封闭(3'封闭)或在3'末端处未封闭(3’未封闭)。具有封闭的3'-末端的引物例如可以在酶或化学反应中解封闭。捕捉引物也可以包括预定(非随机)切割位点。例示性的预定切割位点例如在美国专利号8,715,966b2中描述。在预定位点处的切割可以发生,例如,作为酶切割或非酶切割,如使用本领域技术人员熟知的方法的化学切割。鉴于本文提供的教导和指导,本领域技术人员将理解,捕捉引物可以包含在一个或多个应用中有用的任何数目的不同区域。
通用捕获区可以是在多个捕捉引物中作为共同序列包括的任何已知或预定的核苷酸序列。通常,通用捕捉区域将足够长以在不同序列的群体中具有独特的核苷酸序列,如基因组中包含的不同核苷酸序列的数目。本领域技术人员将理解,鉴于靶群体的序列多样性,通用捕捉区域的何种长度足以是独特的。
通用捕捉区域可以从头设计,或者可以从本领域熟知的来源获得。例如,通用捕捉引物或与这种通用捕捉引物特异性杂交的区域可从商业来源获得。两个典型的通用捕捉引物包括例如核苷酸序列5'-aatgatacggcgaccaccga-3'和5'-caagcagaagacggcatacga-3'(分别为p5和p7,illumina,sandiego,ca)。与上述捕获引物特异性杂交的区域可以包括例如对应于5'-tcggtggtcgccgtatcatt-3'或5'-tcgtatgccgtcttctgcttg-3'的反向互补序列(分别为p5'和p7',illumina,sandiego,ca)。
与通用捕获区一样,sbs可以是足够长度以与互补测序引物进行特异性退火的任何已知或设计的序列。例示性的sbs包括例如核苷酸序列5'-acactctttccctacacgacgctcttccgatct-3'和5'-cggtctcggcattcctgctgaaccgctcttccgatct-3'(分别为sbs3和sbs8,illumina,sandiego,ca)。与上述sbs特异性杂交的区域可以包括例如对应于5'-agatcggaagagcgtcgtgtagggaaagagtgt-3'和5'-agatcggaagagcggttcagcaggaatgccgagaccg-3'(分别为“sbs3”和“sbs81”的方向互补序列,illumina,sandiego,ca)。
如前所述,捕捉引物可以具有区域的任何组合,例如上述例示的p5,p7,sbs3或sbs8引物区或其互补序列(例如,p5',p7'sbs3'或sbs8')的任何组合。上述特定序列的例示性组合包括例如组合,例如p5-sbs3,p5-sbs8,p7-sbs8和p7-sbs3,其互补序列或其组合。
固定化到特征的第一和第二捕捉引物可以包括任何捕捉区域或捕捉区域的任何组合。例如,第一捕捉引物可以包括第一通用捕捉区域,并且第二捕捉引物可以包括相同的通用捕捉区域或第二通用捕捉区域。第一和第二捕捉引物可进一步包括相同或不同的sbs。例如,第一捕捉引物可以包括第一通用捕捉引物区域和第一sbs,而第二捕捉引物可以包括第二通用捕捉区域和第二sbs。
例如,在一些实施方案中,第一捕捉引物包括p5引物核苷酸序列,而第二捕捉引物包括p7引物核苷酸序列。
在其它实施方案中,第一捕捉引物包括p5引物核苷酸序列和sbs3引物核苷酸序列,而第二捕捉引物包括p7引物核苷酸序列和sbs8引物核苷酸序列。在其它实施方案中,第一捕捉引物包括p5引物核苷酸序列和sbs8引物核苷酸,而第二捕捉引物包括p7引物核苷酸序列和sbs3引物核苷酸序列。
固定化到基底上的特征的捕捉引物可以是多个捕捉引物。在一些实施方案中,特征可以具有单一多个捕捉引物,如当需要引物延伸反应时或当多核苷酸的扩增在两端使用相同的捕捉引物结合区时。在其它实施方案中,特征可以具有多个第一捕捉引物和多个第二捕捉引物。另外,除了多个第一和第二捕捉引物之外,基底上的特征也可以具有多个捕捉引物。例如,在某些实施方案中,基底上的特征可以包括多个第三,第四,第五和/或第六或更多捕捉引物。包括多个捕捉引物的数目将取决于应用。例如,在某些实施方案中,可以期望使用多个第一和第二捕捉引物执行第一桥接扩增,然后使用多个第三和第四捕捉引物执行第二桥接扩增。在此类实施方案中,靶多核苷酸对于第一,第二,第三和第四捕捉引物中的每个将具有捕捉引物结合区。鉴于本文提供的教导和指导,本领域技术人员将理解使用给定特定应用或期望构造的多个捕捉引物和相应的捕捉引物结合区域的数目。
多个可以是两个或更多个成员的群体。在一些实施方案中,多个是两个或多个不同多核苷酸或其它参考分子,例如捕捉引物或靶分子的群体。在其它实施方案中,多个是两个或更多个相同成员(例如多核苷酸或其它参考分子,如捕捉引物,靶多核苷酸或靶分子)的群体。或者或另外,多个可以是两个或更多个相似成员(例如,多核苷酸或其它参考分子,例如捕捉引物,靶多核苷酸或靶分子)的群体。因此,除非另有明确说明,否则术语“多个”与群体同义使用。
在一些实施方案中,多个是群体的2,3,4,5,6,7,8,9,10,20,30,40,50,60,70,80,90或100或更多不同成员。在其它实施方案中,多个是200,300,400,500,1000,5000,10000,50000,1x105,2x105,3x105,4x105,5x105,6x105,7x105,8x105,9x105,1x106,2x106,3x106,4x106,5x106,6x106,7x106,8x106,9x106或1x107或更多不同成员。
在一些实施方案中,多个是群体的2,3,4,5,6,7,8,9,10,20,30,40,50,60,70,80,90或100或更多相似的成员。在其它实施方案中,多个是200,300,400,500,1000,5000,10000,50000,1x105,2x105,3x105,4x105,5x105,6x105,7x105,8x105,9x105,1x106,2x106,3x106,4x106,5x106,6x106,7x106,8x106,9x106或1x107或更多相似的成员。
在一些实施方案中,多个是群体的2,3,4,5,6,7,8,9,10,20,30,40,50,60,70,80,90或100或更多相同的成员。在其它实施方案中,多个是200,300,400,500,1000,5000,10000,50000,1x105,2x105,3x105,4x105,5x105,6x105,7x105,8x105,9x105,1x106,2x106,3x106,4x106,5x106,6x106,7x106,8x106,9x106或1x107或更多相同的成员。
在一些实施方案中,多个是群体的不同和相似成员的混合物。在其它实施方案中,多个是群体的不同和相同成员的混合物。在一些实施方案中,多个中的群体的至少1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,15%,20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,70%,75%,80%,85%,90%或95%或更多的成员是相同的。在一些实施方案中,多个中的群体的至少10%成员是相同的。在一些实施方案中,多个中的群体的至少20%成员是相同的。在一些实施方案中,多个中的群体的至少30%成员是相同的。
在一些实施方案中,多个中的群体的至少1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,15%,20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,70%,75%,80%,85%,90%或95%或更多个成员是不同的。在一些实施方案中,在一些实施方案中,多个中的群体的至少10%成员是不同的。在一些实施方案中,多个中的群体的至少20%成员是不同的。在一些实施方案中,多个中的群体的至少30%成员是不同的。
在一些实施方案中,多个中的群体的至少2,3,4,5,6,7,8,9,10,11,12,13,14,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95或100或更多成员是至少约1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,15%,20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,70%,75%,80%,85%,90%或95%或更多同源的。在一些实施方案中,多个中的群体的至少两个或更多个成员是至少约1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,15%,20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,70%,75%,80%,85%,90%或95%或更多同源的。在一些实施方案中,多个中的群体的至少三个或更多个成员是至少约1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,15%,20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,70%,75%,80%,85%,90%或95%或更多同源的。在一些实施方案中,多个中的群体的至少四个或更多个成员是至少约1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,15%,20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,70%,75%,80%,85%,90%或95%或更多同源的。在一些实施方案中,多个中的群体的至少五个或更多个成员是至少约1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,15%,20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,70%,75%,80%,85%,90%或95%或更多同源的。在一些实施方案中,在一些实施方案中,多个中的群体的至少十个或更多个成员是至少约1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,15%,20%,25%,30%,35%,40%,45%,50%,55%,60%,65%,70%,75%,80%,85%,90%或95%或更多同源的。
在一些实施方案中,多个中的群体的至少2,3,4,5,6,7,8,9,10,11,12,13,14,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95或100个或更多个成员是相同的。在一些实施方案中,多个中的群体的至少2个成员是相同的。在一些实施方案中,多个中的群体的至少3个成员是相同的。在一些实施方案中,多个中的群体的至少5个成员是相同的。在一些实施方案中,多个中的群体的至少10个成员是相同的。在一些实施方案中,多个中的群体的至少20个成员是相同的。
在一些实施方案中,多个中的群体的至少2,3,4,5,6,7,8,9,10,11,12,13,14,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95或100个或更多个成员是相似的。在一些实施方案中,多个中的群体的至少2个成员是相似的。在一些实施方案中,多个中的群体的至少3个成员是相似的。在一些实施方案中,多个中的群体的至少5个成员是相似的。在一些实施方案中,多个中的群体的至少10个成员是相似的。在一些实施方案中,多个中的群体的至少20个成员是相似的。
在一些实施方案中,多个中的群体的至少2,3,4,5,6,7,8,9,10,11,12,13,14,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95或100个或更多个成员是不同的。在一些实施方案中,多个中的群体的至少2个成员是不同的。在一些实施方案中,多个中的群体的至少3个成员是不同的。在一些实施方案中,多个中的群体的至少5个成员是不同的。在一些实施方案中,多个中的群体的至少10个成员是不同的。在一些实施方案中,多个中的群体的至少20个成员是不同的。
本公开的基底可包含至少一个靶多核苷酸,其一端附着于固定化到特征的捕捉引物。在一些实施方案中,本公开的基底将包含一个靶多核苷酸,其一端附着于固定化到特征的捕捉引物。虽然本文参考至少一种靶多核苷酸的附着或参照一端附着到固定化到特征的捕捉引物的靶多核苷酸描述,但理解的是在其它实施方案中,基底可以含有两个或更多的靶多核苷酸,其在一端附着到固定化到特征的捕捉引物。在这些其它实施方案中,靶多核苷酸的数目可以是例如2,3,4,5,6,7,8,9,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95或100或更多不同的靶多核苷酸。或者,靶多核苷酸的数目可以是例如2,3,4,5,6,7,8,9,10,15,20,25,30,35,40,45,50,50,55,60,65,70,75,80,85,90,95或100或更多相同的靶多核苷酸。在其它实施方案中,靶多核苷酸的数目为例如2,3,4,5,6,7,8,9,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95或100或更多相似的靶多核苷酸。
参考在一端附着至固定化到特征的捕捉引物的至少一种靶多核苷酸,靶多核苷酸可以是能够以拷贝数扩增的任何多核苷酸,包括例如dna,rna或蛋白质核酸(pna)。靶多核苷酸可以包含两个或更多个核苷酸。两个或多个核苷酸可以包含核糖核苷酸,脱氧核糖核苷酸,锁定核酸(lna),肽核酸(pna)或其任何组合。靶多核苷酸可以包含嘌呤碱基,嘧啶碱基或两者。靶多核苷酸可以包含天然的,化学修饰的,生物化学修饰的,非天然的或衍生化的核苷酸碱基。靶多核苷酸可以包含一个或多个配对核苷酸碱基。靶多核苷酸可以是双链核酸。在一些实施方案中,靶多核苷酸可以是双链核酸,例如双链dna(dsdna)。靶多核苷酸可以是双链rna(dsrna)。靶多核苷酸可以是双链dna/rna杂交体。靶多核苷酸可以包含一个或多个未配对核苷酸碱基。靶多核苷酸可以是单链的。在其它实施方案中,靶多核苷酸可以是单链核酸,如单链dna(ssdna)。靶多核苷酸可以是单链rna。靶多核苷酸可以包含配对和未配对核苷酸碱基的混合物。
为了在特征上放置单分子,靶多核苷酸作用为靶分子到特征的系链或锚。因此,靶多核苷酸可以是期望长度的任何序列。在一些实施方案中,在多个靶分子各自锚定到多个不同的特征的情况下,多个靶多核苷酸可以具有相同的序列或不同的序列。在其它实施方案中,各自锚定多个靶分子到不同的特征的多个靶多核苷酸的一些或全部可以具有不同的序列。因此,靶多核苷酸可以是任何期望的序列或序列混合物。鉴于本文提供的教导和指导,本领域技术人员将理解在将多个靶分子固定化到多个不同特征的情况下是否使用相同的靶多核苷酸序列或不同靶多核苷酸序列。
靶多核苷酸可以包含一个或多个靶多核苷酸区。靶多核苷酸区可以包含捕捉引物结合区、靶区域、引物结合区、条形码区、接头区或衔接头区域。例如,靶多核苷酸可以含有包含捕捉引物结合区的靶多核苷酸区。靶多核苷酸可以含有包含第一捕捉引物结合区的靶多核苷酸区。靶多核苷酸可以含有包含第二捕捉引物结合区的靶多核苷酸区。或者或另外,靶多核苷酸可以含有包含靶区域的靶多核苷酸区。靶多核苷酸可以含有包含引物结合区的靶多核苷酸区。靶多核苷酸可以含有包含条形码区的靶多核苷酸区。靶多核苷酸可以含有包含接头区的靶多核苷酸区。或者或另外,靶多核苷酸可以包含含有衔接头区域的靶多核苷酸区。
靶多核苷酸可以包含多个靶多核苷酸区。靶多核苷酸可以包含1,2,3,4,5,6,7,8,9或10或更多个靶多核苷酸区。靶多核苷酸可以包含2或更多个靶多核苷酸区。靶多核苷酸可以包含3或更多个靶多核苷酸区。靶多核苷酸可以包含4或更多个靶多核苷酸区。靶多核苷酸可以包含5或更多个靶多核苷酸区。靶多核苷酸可以包含6或更多个靶多核苷酸区。靶多核苷酸可以包含多个靶多核苷酸区,其包含一个或多个第一捕捉引物结合区、第二捕捉引物结合区、靶区域、引物结合区、条形码区、接头区、衔接头区域、或其任何组合。靶多核苷酸可以包含多个靶多核苷酸区,其包含两个或更多个第一捕捉引物结合区、第二捕捉引物结合区、靶区域、引物结合区、条形码区、接头区、衔接头区域、或其任何组合。靶多核苷酸可以包含多个靶多核苷酸区,其包含三个或更多个第一捕捉引物结合区、第二捕捉引物结合区、靶区域、引物结合区、条形码区、接头区、衔接头区域、或其任何组合。
图3a-d中描绘了包含两个或更多个靶多核苷酸区的例示性靶多核苷酸。如图3a中所示,靶多核苷酸可以包含两个或多个靶多核苷酸区(301,302)。第一靶多核苷酸区(301)可以是第一捕捉引物结合区。第二靶多核苷酸区(302)可以是第二捕捉引物结合区。如图3b中所示,靶多核苷酸可以包含三个或更多个靶多核苷酸区(301,302,303)。第一靶多核苷酸区(301)可以是第一捕捉引物结合区。第二靶多核苷酸区(302)可以是第二捕捉引物结合区。第三靶多核苷酸区(303)可以是靶区域。如图3c中所示,靶多核苷酸可以包含四个或更多个靶多核苷酸区(301,302,303,304)。第一靶多核苷酸区(301)可以是第一捕捉引物结合区。第二靶多核苷酸区(302)可以是第二捕捉引物结合区。第三靶多核苷酸区(303)可以是靶区域。第四靶多核苷酸区(304)可以是引物结合区。如图3d中所示,靶多核苷酸可以包含五个或更多个靶多核苷酸区(301,302,303,304,305)。第一靶多核苷酸区(301)可以是第一捕捉引物结合区。第二靶多核苷酸区(302)可以是第二捕捉引物结合区。第三靶多核苷酸区(303)可以是靶区域。第四靶多核苷酸区(304)可以是引物结合区。第五靶多核苷酸区(305)可以是条形码区。或者或另外,一个靶多核苷酸区可以是接头区。或者或另外,一个靶多核苷酸区可以是一个衔接头区域。
包含例如,靶区域、捕捉引物结合区和/或本文中描述或本领域技术人员公知的其它区域的靶多核苷酸或靶多核苷酸区(靶多核苷酸或其区域)可以包含两个或更多个核苷酸。靶多核苷酸或其区域可以包含2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19或20或更多个核苷酸。靶多核苷酸可以包含25,30,35,40,45,50,55,70,65,70,75,80,85,90,95,100或更多个核苷酸。靶多核苷酸或其区域可以包含150,200,250,300,350,400,450,500,550,700,650,700,750,800,850,900,950,1000或更多个核苷酸。靶多核苷酸或其区域可以包含1100,1200,1300,1400,1500,2000,2500,3000,3500,4000,4500,5000,5500,7000,6500,7000,7500,8000,8500,9000,9500,10000或更多个核苷酸。靶多核苷酸或其区域可以包含100或更多个核苷酸。靶多核苷酸或其区域可以包含300或更多个核苷酸。靶多核苷酸或其区域可以包含400或更多个核苷酸。靶多核苷酸或其区域可以包含500或更多个核苷酸。靶多核苷酸或其区域可以包含600或更多个核苷酸。
靶多核苷酸或其区域可以包含10至25,26至50,51至100,101至200,201至300,301至400,401至500,501至600,601至700,701至800,801至900或901至1000个核苷酸。靶多核苷酸或其区域可以包含约5至2000,5至1500,5至1000,5至800,5至600,5至400,5至200,5至100或5至50个核苷酸。靶多核苷酸或其区域可以包含约10至2000,10至1500,10至1000,10至800,10至600,10至400,10至200,10至100或10至50个核苷酸。靶多核苷酸或其区域可以包含约20至2000,20至1500,20至1000,20至800,20至600,20至400,20至200,20至100或20至50个核苷酸。
靶多核苷酸或其区域可以包含小于约5000,4500,4000,3500,3000,2500,2000,1500或1000或更少个核苷酸。靶多核苷酸或其区域可以包含小于约950,900,850,800,750,700,650,600,550,500,450,400,350,300,250,200,150或100或更少个核苷酸。靶多核苷酸或其区域可以包含小于约95,90,85,80,75,70,65,60,55,50,45,40,35,30,25,20,15或10或更少个核苷酸。
靶多核苷酸或其区域可以包含双链多核苷酸。靶多核苷酸或其区域可以包含一个或多个碱基对。靶多核苷酸可以包含2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19或20或更多个碱基对。靶多核苷酸或其区域可以包含25,30,35,40,45,50,55,70,65,70,75,80,85,90,95,100或更多个碱基对。靶多核苷酸或其区域可以包含150,200,250,300,350,400,450,500,550,700,650,700,750,800,850,900,950,1000或更多个碱基对。靶多核苷酸或其区域可以包含1100,1200,1300,1400,1500,2000,2500,3000,3500,4000,4500,5000,5500,7000,6500,7000,7500,8000,8500,9000,9500,10000或更多个碱基对。靶多核苷酸或其区域可以包含100或更多个碱基对。靶多核苷酸或其区域可以包含300或更多个碱基对。靶多核苷酸或其区域可以包含400或更多个碱基对。靶多核苷酸或其区域可以包含500或更多个碱基对。靶多核苷酸可以包含600或更多个碱基对。
靶多核苷酸或其区域可以包含10至25,26至50,51至100,101至200,201至300,301至400,401至500,501至600,601至700,701至800,801至900或901至1000个碱基对。靶多核苷酸或其区域可以包含约5至2000,5至1500,5至1000,5至800,5至600,5至400,5至200,5至100或5至50个碱基对。靶多核苷酸或其区域可以包含约10至2000,10至1500,10至1000,10至800,10至600,10至400,10至200,10至100或10至50个碱基对。靶多核苷酸或其区域可以包含约20至2000,20至1500,20至1000,20至800,20至600,20至400,20至200,20至100或20至50个碱基对
靶多核苷酸或其区域可以包含小于约5000,4500,4000,3500,3000,2500,2000,1500或1000或更少个碱基对。靶多核苷酸或其区域可以包含小于约950,900,850,800,750,700,650,600,550,500,450,400,350,300,250,200,150或100或更少个碱基对。靶多核苷酸或其区域可以包含小于约95,90,85,80,75,70,65,60,55,50,45,40,35,30,25,20,15或10或更少个碱基对。
双链靶多核苷酸或其区域可以包含1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19或20或更多个错配。作为双链的靶多核苷酸或其区域可以包含一个或多个错配。双链靶多核苷酸或其区域可以包含两个或更多个错配。双链靶多核苷酸或其区域可以包含三个或更多个错配.双链靶多核苷酸或其区域可以包含四个或更多个错配。双链靶多核苷酸或其区域可以包含五个或更多个错配。
双链靶多核苷酸或其区域可以包含小于10,9,8,7,6,5,4,3,2或1个错配。双链靶多核苷酸或其区域可以包含五个或更少个错配。双链靶多核苷酸或其区域可以包含四个或更少个错配。双链靶多核苷酸或其区域可以包含三个或更少个错配。双链靶多核苷酸或其区域可以包含两个或更少个错配。双链靶多核苷酸或其区域可以包含一个或更少个错配。
如先前例示,靶多核苷酸可以包含一个或多个区域,其包含一个或多个捕捉引物结合区。一般地,捕捉引物结合区与捕捉引物互补。靶多核苷酸区可以包含5’端的捕捉引物结合区。靶多核苷酸区可以包含3’端的捕捉引物结合区。靶多核苷酸区可以包含靶区域的5’端的第一捕捉引物结合区和靶区域3’端的第二捕捉引物结合区。或者或另外,包含捕捉引物结合区的靶多核苷酸区可以位于靶多核苷酸的内部区域。
靶多核苷酸可以包含两个或更多个捕捉引物结合区。靶多核苷酸可以包含三个或更多个捕捉引物结合区。靶多核苷酸可以包含四个或更多个捕捉引物结合区。两个或更多个捕捉引物结合区可以是相同的。或者或另外,两个或更多个捕捉引物结合区可以是不同的。两个或更多个捕捉引物结合区在靶多核苷酸上可以彼此接近。或者或另外,两个或更多个捕捉引物结合区在多核苷酸上可以彼此不接近。
与相应的捕捉引物一样,捕捉引物结合区可以包含一个或多个捕捉引物结合区。捕捉引物结合区可以包含例如通用捕捉引物结合区、测序引物结合区(sbs)、靶物特异性捕捉引物结合区、预定的切割位点,如限制性位点,和接头区,例如,分开捕捉引物结合区的两个或更多个区域的接头区。一些捕捉引物结合区可以包含例如,通用捕捉引物结合区和sbs。其它捕捉引物结合区可以包含通用捕捉引物结合区和靶物特异性捕捉引物结合区。其它捕捉引物结合区可以包含例如,通用捕捉引物结合区、sbs和靶物特异性捕捉引物结合区。捕捉引物结合区可以在3'或5'端封闭或未封闭的。鉴于本文提供的教导和指导,本领域技术人员将理解,捕捉引物结合区可以包含在一个或多个应用中有用的任何数量的不同区域。
例如,先前例示的通用捕捉引物也可以用作通用捕捉引物结合区,本文所示或本领域公知的其它捕捉引物区也可以。参考前述的通用捕捉引物,例示的p5,p7,p5'和/或p7'序列可以用作通用捕捉引物结合区域以与互补捕捉引物(例如,分别为p5',p7'p5和/或p7)退火。类似地,先前列出的sbs序列或本领域中设计或已知的其它序列可以被包括在捕捉引物区域中的区域中。在一个实施方案中,例如可以包括例示性sbs序列sbs3,sbs8,sbs3'和/或sbs8'。
例如,多个靶多核苷酸结合区可以具有捕捉引物结合区的任意组合,例如,上述例示的p5,p7,sbs3或sbs8引物区或其互补序列的任何组合(例如,p5',p7',sbs3'或sbs8')的任意组合。上述具体序列的例示性组合包括例如组合,如p5-sbs3,p5-sbs8,p7-sbs8和p7-sbs3,其互补序列或其组合。
如图4所示,侧翼有捕捉引物结合区域的靶区域的一个例示性组合是靶多核苷酸的第一端的p5-sbs3捕捉引物结合区和第二端的p7'-sbs8'捕捉引物结合区。相应的互补链包括第一端的p5'-sbs3'捕捉引物结合区和第二端的p7-sbs8捕捉引物结合区。
捕捉引物结合区可以包含5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29或30或更多个核苷酸。捕捉引物结合区可以包含35,40,45,50,55,60,65,70,75,80,85,90,95或100或更多个核苷酸。捕捉引物结合区可以包含5或更多个核苷酸。捕捉引物结合区可以包含10或更多个核苷酸。捕捉引物结合区可以包含15或更多个核苷酸。捕捉引物结合区可以包含20或更多个核苷酸。捕捉引物结合区可以包含25或更多个核苷酸。
捕捉引物结合区可以包含400,375,350,325,300,275,250,225,200,190,180,170,160,150,140,130,120,110,100或更少个核苷酸。捕捉引物结合区可以包含300或更少个核苷酸。捕捉引物结合区可以包含200或更少个核苷酸。捕捉引物结合区可以包含100或更少个核苷酸。捕捉引物结合区可以包含50或更少个核苷酸。捕捉引物结合区可以包含40或更少个核苷酸。捕捉引物结合区可以包含30或更少个核苷酸。
靶多核苷酸的捕捉引物结合区可以与捕捉引物是100%互补的。靶多核苷酸的捕捉引物结合区可以与捕捉引物是至少60%,65%,70%,75%,77%,80%,82%,85%,87%,90%,92%,95%或97%或更多个互补的。靶多核苷酸的捕捉引物结合区可以与捕捉引物是80%互补的。引靶多核苷酸的捕捉引物结合区可以与捕捉引物是85互补的。靶多核苷酸的捕捉引物结合区可以与捕捉引物是9%互补的。靶多核苷酸的捕捉引物结合区可以与捕捉引物是95互补的。
靶多核苷酸的引物结合区可以包含与捕捉引物的1,2,3,4,5,6,7,8,9或10或更多个核苷酸错配。靶多核苷酸的捕捉引物结合区可以包含与捕捉引物的一个或多个核苷酸错配。靶多核苷酸的捕捉引物结合区可以包含与捕捉引物的两个或多个核苷酸错配。靶多核苷酸的捕捉引物结合区可以包含与捕捉引物的三个或多个核苷酸错配。靶多核苷酸的捕捉引物结合区可以包含与捕捉引物的四个或多个核苷酸错配。
靶多核苷酸可以包含一个或多个靶区域。靶多核苷酸可以具有位于靶多核苷酸的内部区域的靶区域。例如,靶区域可以在其5'和3'端侧翼有捕捉引物结合区或其它区域。或者或另外,靶区域可以位于例如靶多核苷酸的5'端。靶多核苷酸可以包含靶多核苷酸的3'端、5'端或这两端的捕捉引物结合区,如上文例示的。靶多核苷酸可以包含靶多核苷酸的5'端的第一靶区域和靶多核苷酸的3'端的第二靶区域。靶区域可以在任一端或两端侧翼有一个或多个捕捉引物结合区。
靶多核苷酸可以包含两个或更多个靶区域。靶多核苷酸可以包含三个或更多个靶区域。靶多核苷酸可以包含四个或更多个靶区域。两个或更多个靶区域可以是相同的。或者或另外,两个或更多个靶区域可以是不同的。两个或更多个靶区域在靶多核苷酸上可以彼此接近。或者或另外,两个或更多个靶区域在靶多核苷酸上可以彼此不接近。
靶区域的大小或长度可以是上文就靶多核苷酸或靶多核苷酸区而言例示的任何长度。例示性的长度包括5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29或30或更多个核苷酸。靶区域可以包含35,40,45,50,55,60,65,70,75,80,85,90,95或100或更多个核苷酸。靶区域可以包含150,200,250,300,350,400,450,500,550,600,650,700,750,800,850,900,950或100或更多个核苷酸。靶区域可以包含5或更多个核苷酸。靶区域可以包含10或更多,20或更多,50或更多,100或更多,200或更多或400或更多个核苷酸。其它例示性长度包括例如,1000,950,900,850,800,750,700,650,600,550,500,450,400,375,350,325,300,275,250,225,200,190,180,170,160,150,140,130,120,110,100或更少个核苷酸。其它例示性的长度包括例如,700或更少,500或更少,300或更少,200或更少,100或更少或50或更少个核苷酸。
本公开的基底可以包含至少一个靶分子。至少一个靶分子可以附着到靶多核苷酸。至少一个靶分子可以附着到靶多核苷酸,其附着于捕捉引物。至少一个靶分子可以附着于固定化到捕捉引物的靶多核苷酸,所述捕捉引物固定化到特征。尽管本文参照至少一个靶分子,参考附着于靶多核苷酸的至少一个靶分子,参考附着于与捕捉引物附着的靶多核苷酸的至少一个靶分子,或参照附着于与固定化到特征的捕捉引物附着的靶多核苷酸的至少一个靶分子描述,应当理解,在其他实施方案中,基底可以在每个参考情况下包含多个的两种或更多种靶分子。如下面进一步例示的,多个靶分子可以单独固定化到基底上的不同特征。或者,多个靶分子可以固定化到基底上的相同特征。在多个靶分子被单独固定化到不同特征的实施方案中,多个靶分子可以是与上述和下文中例示的相同的靶分子或不同类型或种类的靶分子。在这些实施例中,多个中的靶分子的数目可以是例如2,3,4,5,6,7,8,9,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,250,500,1,000,5,000,10,000或更多不同,相同和/或相似的靶分子。
例如,多个靶分子可以包含两个或更多个相同靶分子。在此实施方案中,第一和第二或更多种靶分子都可以是例如特定多肽,如mspa纳米孔。或者或另外,多个靶分子可以包含两个或更多个不同靶分子。例如,多个靶分子的第一靶分子可以是酶,并且多个靶分子的第二靶分子可以是多核苷酸。多个靶分子可以包含三个或更多不同的靶分子。例如,多个靶分子的第一靶分子可以是酶,多个靶分子的第二靶分子可以是多核苷酸,而多个靶分子的第三靶分子可以是小的有机物化合物。或者或另外,多个靶分子可以包含两个或更多相似的靶分子。两个或更多个相似的靶分子可以是相同类型的分子。例如,第一靶分子可以是mspa纳米孔,第二靶分子可以是naip纳米孔。在这种情况下,第一和第二靶分子具有相同类型的分子(例如纳米孔)。两个或更多个相似的靶分子可以是同源物或变体。例如,第一靶分子可以是多肽的人形式,第二靶分子可以是多肽的小鼠形式。变体可以包含不同等位基因编码的多肽或通过位点特异性诱变,定向进化等获得的多肽。两个或更多个相似的靶分子可以是相同蛋白质的可变剪接变体。例如,第一靶分子可以是多肽的全长形式,并且第二靶分子可以是多肽的截短形式。两个或更多个相似的靶分子可以是化学类似物或衍生物。例如,第一靶分子可以是化合物x,第二靶分子可以是化合物x的衍生物。在一个例示性实施方案中,多个相似靶分子可以是酶变体的文库。例示性靶分子在下面进一步描述。
在一些实施方案中,至少一个靶分子或多个靶分子可以附着到基底和/或附着到基底上的特征。至少一个靶分子或多个靶分子可以附着到捕捉引物或多个捕捉引物,其分别固定化到基底上的特征。至少一个靶分子或多个靶分子可以附着到靶多核苷酸,所述靶多核苷酸附着到捕捉引物或其多个,其分别固定化到基底上的特征。附着可以是靶分子与上文所述的任何区域或组分的共价或非共价附着。参考至少一个靶分子,例如,至少一个靶分子可以共价附着到基底和/或基底上的特征。至少一个靶分子可以共价附着到捕捉引物,所述捕捉引物固定化到基底上的特征。至少一个靶分子可以共价附着到靶多核苷酸,所述靶多核苷酸共价附着到捕捉引物,所述捕捉引物固定化到基底上的特征。下文参考将至少一个靶分子置于基底的特征上的方法进一步描述了经由共价磷酸二酯键将靶多核苷酸共价附着到捕捉引物的例示性实施方案。另外,例如,至少一个靶分子可以非共价附着到基底和/或基底上的特征。至少一个靶分子可以非共价附着到捕捉引物,其固定化到基底上的特征。至少一个靶分子可以非共价附着到靶多核苷酸,所述靶多核苷酸非共价附着到固定化到基底上的特征的捕捉引物。用于多核苷酸和靶分子与基底以及彼此的共价和非共价附着的方法是本领域中公知的。
除了通过上述构造固定化的至少一个靶分子外,基底上的特征或多个特征还可以包含靶多核苷酸的多个扩增子。扩增子可以与靶多核苷酸互补。在靶多核苷酸或靶多核苷酸区包含一个或多个核苷酸错配的实施方案中,除了一个或多个核苷酸错配之外,扩增子可以与靶多核苷酸互补。类似地,在该实施方案中,靶多核苷酸的双链扩增子可以具有与靶多核苷酸互补(除了一个或多个核苷酸错配)的一条链和与靶多核苷酸在序列上相同(除了一个或多个核苷酸错配)的另一条链。在其他实施方案中,扩增子可以是上文例示的多个不同的扩增子种类。多个扩增子可以最小化填充特征,部分填充特征或填满基底上的特征。因此,扩增子密度可以是低,中等或高。靶多核苷酸设计,生成这种扩增子的方法和控制密度的方法在下文中进一步参考在基底的特征上放置至少一个靶分子的方法描述。扩增子的密度在大小约为100nm的特征中可以为约10至100),或者在大小约为100nm至1μm的特征中约100至10000。
扩增子的密度可以是约10至100,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至95,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至90,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至85,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至80,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至75,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至70,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至65,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至60,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至55,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至50,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至45,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至40,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至35,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至30,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至25,在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至20在具有小于约100nm的大小的特征中。扩增子的密度可以是约10至15,在具有小于约100nm的大小的特征中。
在具有小于约100nm的大小的特征中,扩增子的密度可以大于约10,20,30,40,50,60,70,80,90,或100。
扩增子的密度可以是约100至10000,在具有约100nm至1μm的大小的特征中。扩增子的密度可以是约100至9000,在具有约100nm至1μm的大小的特征中。扩增子的密度可以是约100至8000,在具有约100nm至1μm的大小的特征中。扩增子的密度可以是约100至7000,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至6000,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至5000,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至4000,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至3000,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至2000,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至1000,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至900,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至800,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至700,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至600,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至500,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至400,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至300,在具有约100nm至1μm的大小的特征中,扩增子的密度可以是约100至200,在具有约100nm至1μm的大小的特征中。
适用于本公开的基底上的单分子放置并用于本公开的方法的靶分子可以是任何期望的分子。靶分子的例示性类别包括例如多肽,多核苷酸,碳水化合物,氨基酸,核苷酸,单糖,半抗原,配体,抗原,分析物,离子通道,小分子有机化合物或无机化合物。下文进一步描述上述类别中的每个的例示性种类。
本公开的靶分子可以包含多肽。多肽可以包含一个或多个氨基酸。多肽可包含2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19或20个或更多个氨基酸。多肽可以包含20,30,40,50,60,70,80,90,100,110,120,130,140,150,160,170,180,190或200个或更多个氨基酸。多肽可包含200,300,400,500,600,700,800,900,1000,1100,1200,1300,1400,1500,1600,1700,1800,1900或2000个或更多个氨基酸。氨基酸可以是天然氨基酸。氨基酸可以是非天然氨基酸。氨基酸可以是d-氨基酸。氨基酸可以是l-氨基酸。一个或多个氨基酸可以包含一个或多个天然氨基酸,非天然氨基酸,d-氨基酸,l-氨基酸或其组合。氨基酸的实例包括但不限于对乙酰基苯丙氨酸,间乙酰基苯丙氨酸,丙氨酸,β-丙氨酸,γ-氨基丁酸(gaba),氨基异丁酸,δ-氨基乙酰丙酸,4-氨基苯甲酸(paba),精氨酸,天冬酰胺,天门氨酸,对苯氧基-1-苯丙氨酸,瓜氨酸,胱硫醚,半胱氨酸,胱氨酸,二氨基庚二酸,今可豆氨酸(djenkolicacid),谷氨酸,谷氨酰胺,甘氨酸,组氨酸,异亮氨酸,羊毛硫氨酸,亮氨酸,赖氨酸,甲硫氨酸,鸟氨酸,苯丙氨酸,苯基硒基丙氨酸(phenylselenidylalanine),脯氨酸,硒代半胱氨酸,丝氨酸,苏氨酸,色氨酸,酪氨酸和缬氨酸。多肽的实例包括但不限于核糖体肽,非核糖体肽,蛋白胨,肽片段或其任何组合。本公开的多肽可以是重组的,合成的或天然存在的。
本公开的靶分子可以包含核糖体多肽。通常,核糖体肽可以是通过翻译mrna合成的肽。核糖体蛋白可以经历一个或多个翻译后修饰。翻译后修饰的实例包括但不限于磷酸化,羟基化,磺化,棕榈酰化,糖基化,泛素化,sumo化(sumoylation)和二硫键形成。核糖体肽的实例包括但不限于酶,受体,抗体,转录因子,激素,配体,抗原和半抗原。
本公开的靶分子可以包含非核糖体肽。通常,非核糖体肽可以是由每种肽特异的酶而不是由核糖体组装的肽。非核糖体肽可以具有环状和/或支链结构。非核糖体肽可以含有一种或多种非蛋白质氨基酸,如d-氨基酸。非核糖体多肽可以包括修饰如n-甲基和n-甲酰基(n-formal)。非核糖体多肽可以被糖基化,酰化,脱水或羟基化。非核糖体多肽可以经历一个或多个丝氨酸的脱水,导致脱氢丙氨酸。非核糖体肽可以是多聚体。非核糖体肽可以是二聚体或三聚体。非核糖体肽的实例包括但不限于毒素,铁载体,颜料,抗生素,抗生素前体,细胞抑制剂和免疫抑制剂。
本公开的靶分子可以包含组装成纳米孔的一种或多种多肽。纳米孔可选自耻垢分枝杆菌(mycobacteriumsmegmatis)孔蛋白a(mspa),外膜磷脂酶a(ompa),ompc,ompf,ompg,奈瑟氏球菌(neisseria)自身转运蛋白(nalp),wza,clya毒素,α-溶血素,炭疽毒素,短杆菌肽a,麦芽糖孔蛋白,phoe,tsx,f-pilus,sp1,线粒体孔蛋白(vdac),tom40,杀白细胞素和dna折纸纳米孔。
本公开的靶分子可以包含抗生素。抗生素可以是青霉素,头孢菌素,多粘菌素,利福霉素,闰年霉素(lipiarmycin),喹诺酮,磺酰胺,大环内酯,氨基糖苷,环状脂肽,甘氨酰环素(glycylcycline),恶唑烷酮(oxazolidinone)或小菌素(microcin)。抗生素的实例包括但不限于放线菌素,杆菌肽,钙依赖性抗生素,达托霉素,短杆菌肽,短杆菌酪肽(tyrocidine),万古霉素,两性霉素a,普拉佐米星(plazomicin),eravacycline,brilacidin,阿维巴坦(avibactam),阿奇霉素,克拉霉素,红霉素,卡波霉素(carbomycin),交沙霉素,吉他霉素(kitasamycin),麦迪霉素(midecamycin),竹桃霉素(oleandomycin),solithromycin,螺旋霉素,醋竹桃霉素,泰乐菌素,罗红霉素,塞红霉素(cethromycin),利福布汀(ansamycin),卡波霉素(carbomycin),泰乐菌素和泰利霉素。
本公开的靶分子可以包含毒素。毒素可以是血毒素。血红蛋白会引起红细胞的破坏。毒素可以是光毒素。光毒素可引起光敏性。毒素可以是外毒素。外毒素可以被生物或细胞排泄。毒素可以是内毒素。内毒素可以是当细胞或生物被裂解时释放的毒素。毒素可以是生物毒素。生物毒素可以是具有生物起源的毒素。例如,由真菌产生的毒素可以称为生物毒素。毒素可以是坏死毒素。坏死蛋白会导致坏死。毒素可以是神经毒素。神经毒素可以影响动物的神经系统。毒素可以是细胞毒素。细胞毒素在个别细胞水平上可以是有毒的。毒素可以是真菌毒素。真菌毒素的实例包括黄曲霉毒素,赭曲霉毒素,桔霉素,麦角类生物碱,棒曲霉素和镰孢菌。毒素的实例包括但不限于微囊藻毒素,节球藻素,变性毒素(anatoxin)-a,变性毒素-a(s),柱孢藻毒素(cylindrospermopsins),鞘丝藻毒素a,蛤蚌毒素,海兔毒素,蓝藻毒素,hc-毒素,am毒素,维生素,蓖麻毒素,蜂毒素,串珠镰孢菌素(fumonisins),单端孢霉烯类(trichothecenes),玉米赤霉烯酮,白僵菌毒素(beauvercin),恩镰孢菌素(enniatins),丁烯羟酸内酯(butenolide),伊快霉素(equisetin),破伤风毒素,肉毒杆菌毒素,河豚毒素和镰菌素(fusarins)。
本公开的靶分子可以包含激素。激素可以是胺激素,肽激素,蛋白激素,类固醇激素或其组合。胺激素可以包含一个或多个具有一个或多个修饰基团的氨基酸。例如,可以用诸如苯环等化学基团代替氨基酸的羧基。肽激素可以包含连接的氨基酸的短链。蛋白质激素可以包含连接的氨基酸的长链。类固醇激素可以衍生自脂质胆固醇。激素的实例包括但不限于褪黑激素,三碘甲腺原氨酸,甲状腺素,前列腺素,白细胞三烯,前列环素,thrombaxane,淀粉素(amylin),抗穆勒激素(anti-mullerianhormone),adinopectin,促肾上腺皮质激素,促皮质激素(corticotrophin),血管紧张素原,血管紧张素,抗利尿激素,加压素,心房-利钠肽,心房肽,脑利钠肽,降钙素,胆囊收缩素,促皮质素释放激素,皮质抑素(cortistatin),脑啡肽,内皮缩血管肽,促红细胞生成素,促卵泡激素,加兰肽(galanin),胃抑制多肽,胃泌素,饥饿激素(ghrelin),胰高血糖素,胰高血糖素样肽-1,促性腺激素释放激素,生长激素释放激素,hepcidin,人绒毛膜促性腺激素,人胎盘催乳激素,生长激素,抑制素,胰岛素,胰岛素样生长因子,生长调节素,瘦蛋白,促脂解素,黄体生成素,黑素细胞刺激素,促胃动素,阿立新(orexin),催产素,胰腺多肽,甲状旁腺激素,垂体腺苷酸环化酶活化肽,促乳素,促乳素释放激素,松弛素,肾素,分泌素,促生长素抑制素,血小板生成素,促甲状腺激素,促甲状腺激素,血管活性肠肽,雄激素,盐皮质激素,雌激素,糖皮质激素,孕激素和开环甾类化合物(secosteroid)。
本公开的靶分子可以包含半抗原。通常,半抗原可以是当附着到大载体如蛋白质时可以引发免疫应答的小分子。半抗原的实例包括但不限于苯胺,邻氨基苯甲酸,间氨基苯甲酸,对氨基苯甲酸,uroshiol,奎宁,肼苯哒嗪,荧光素,生物素,地高辛配基(digoxigenin)和二硝基苯酚。
本公开的靶分子可以包括离子通道(即,孔蛋白)或受体。受体可以来自免疫细胞。免疫细胞可以是t细胞,b细胞,k细胞或吞噬细胞。吞噬细胞可以是单核细胞,嗜酸性粒细胞,巨噬细胞,嗜中性粒细胞,肥大细胞或嗜碱性粒细胞。受体可以来自非免疫细胞。例如,非免疫细胞可以是器官或组织。非免疫细胞可以是皮肤细胞,肺细胞,心脏细胞,乳腺细胞,肌肉细胞,肾细胞,神经胶质瘤和卵巢细胞。受体可以是细胞表面受体。受体可以是内部受体。受体可以是离子通道受体,g蛋白受体或酶联蛋白受体。受体可以是跨膜受体。受体可以包含外部配体结合结构域(例如细胞外结构域),跨疏水跨膜的结构域,细胞内结构域或其任何组合。受体的实例包括但不限于烟碱乙酰胆碱受体,甘氨酸受体,gaba受体,谷氨酸受体,5-ht3受体,p2x受体,环核苷酸门控离子通道,ip3受体,细胞内atp受体,兰尼碱(ryanodine)受体,t细胞受体(tcr),b细胞受体(bcr),模式识别受体(prr),toll样受体(tlr),杀伤活化受体(kar),杀伤抑制因子受体(kir),补体受体,fc受体,趋化因子受体,干扰素受体,生长因子受体,包括例如表皮生长因子受体(egfr)和人表皮生长因子受体2(her2)。受体可以是细胞因子受体,丝氨酸/苏氨酸激酶受体,酪氨酸激酶受体,ifn-α/β受体(ifnar),ifngr,il10r2,ifnlr1或肿瘤坏死因子受体(tnf-r)。
本公开的靶分子可以包含细胞因子。细胞因子包括但不限于趋化因子,干扰素,白介素,淋巴因子和肿瘤坏死因子(tnf)。趋化因子可以来自cxc,cc,cx3c或xc亚族。趋化因子可以是ccl2,ccl3,ccl5,ccl7,ccl8,ccl13,ccl17和ccl22。趋化因子可以是ccr1,ccr2,ccr3,ccr4,ccr5,cxcr2和cxcr4。趋化因子可以是ccll1,ccl24,ccl26,ccl5,ccl7,ccl13和ccl3。趋化因子可以是ccl2,ccll,ccl22和ccl17。趋化因子可以是cxc趋化因子。趋化因子可以是cxc8。干扰素可以是i型干扰素,ii型干扰素,或iii型干扰素。干扰素可以是ifn-a,ifn-β,ifn-ε,ifn-κ,ifn-co,ifn-γ。白介素(il)可以是il-1,il-2,il-3,il-4,il-5,il-6,il-7,il-8,il-9,il-10,il-11,il-12,il-13,il-15,或il-17。淋巴因子可以是粒细胞-巨噬细胞集落刺激因子或干扰素-gamma。肿瘤坏死因子可以是tnf,淋巴因子-alpha,cd40l,cd27l,cd30l,fasl,4-1bbl,ox40l,和tnf相关凋亡诱导配体(trail)。本公开的靶分子也可以是神经肽。
本公开的靶分子可以包含酶。酶可以分为氧化还原酶,转移酶,水解酶,裂合酶,异构酶和连接酶。氧化还原酶可以催化氧化/还原反应。转移酶可以转移官能团(例如甲基或磷酸基团)。水解酶可以催化各种键的水解。裂合酶可以通过除水解和氧化以外的手段切割各种键。异构酶可以催化单分子内的异构化变化。连接酶可以用共价键连接两个分子。酶可以是乳糖酶,还原酶,脱氢酶和聚合酶。该酶可以是醇脱氢酶,醇脱氢酶,高丝氨酸脱氢酶,氨基丙醇氧化还原酶,二乙酰还原酶,甘油脱氢酶,丙二醇-磷酸脱氢酶,甘油-3-磷酸脱氢酶,d-木酮糖还原酶,l-木酮糖还原酶,乳酸脱氢酶,苹果酸脱氢酶,异柠檬酸脱氢酶,hmg-coa还原酶,脱羧酶,脱水酶,醛裂合酶,含氧酸裂合酶,碳-碳裂合酶,碳-氮裂合酶,碳-硫裂合酶,碳-卤化物裂合酶,磷-氧裂合酶,亚铁螯合酶,腺苷酸环化酶,脱氨酶,氧化酶,激酶或细菌自身诱导剂的酶。
本公开的靶分子可以包含聚合酶。聚合酶可以是dna聚合酶,rna聚合酶或dna/rna聚合酶。聚合酶可以是真核聚合酶。聚合酶可以是原核聚合酶。dna聚合酶可以是poli,polii,poliii,poliv或polv。dna聚合酶可以是聚合酶beta,聚合酶lambda,聚合酶sigma,聚合酶mu,聚合酶alpha,聚合酶δ,聚合酶epsilon,聚合酶eta,聚合酶iota,聚合酶kappa,聚合酶rev1,聚合酶zata,端粒末端转移酶,聚合酶gamma和聚合酶theta。rna聚合酶可以是rna聚合酶i,rna聚合酶ii,rna聚合酶iii,rna聚合酶iv或rna聚合酶v。rna聚合酶可以是rnap。rna聚合酶可以包含rnap的亚基。rnap的亚基可以是β',β,α',a”和ω,聚合酶可以是rna依赖型dna聚合酶(rddp),rddp可以是逆转录酶。聚合酶可以是
本公开的靶分子可以包含连接酶。连接酶可以是真核连接酶。连接酶可以是原核连接酶。连接酶可以是单链连接酶。连接酶可以是双链连接酶。连接酶可以是dna连接酶。dna连接酶可以是t4dna连接酶,taqdna连接酶,t7dna连接酶,t3dna连接酶,9°ntmdna连接酶和大肠杆菌dna连接酶。连接酶可以是rna连接酶。rna连接酶可以是t4rna连接酶1,t4rna连接酶2,t4rna连接酶截短,t4rna连接酶2截短k227q,t4rna连接酶2截短kq和热稳定性5'appdna/rna连接酶。连接酶可以是热稳定连接酶。连接酶可以是dna/rna连接酶。连接酶可以是
本公开的靶分子可以包含逆转录酶。逆转录酶可以是病毒逆转录酶。病毒逆转录酶可以是逆转录病毒逆转录酶。逆转录酶可以是真核逆转录酶。逆转录酶可以是amv逆转录酶,
本公开的靶分子可以包含核酸酶。核酸酶可以是dna酶。核酸酶可以是rna酶。核酸酶可以是外切核酸酶。外切核酸酶可以是λ外切核酸酶,外切核酸酶vii,t5外切核酸酶,t7外切核酸酶,外切核酸酶t,外切核酸酶i(大肠杆菌),外切核酸酶v(recbcd)或外切核酸酶iii(大肠杆菌)。核酸酶可以是内切核酸酶。内切核酸酶可以是内切核酸酶iv,t7内切核酸酶i,内切核酸酶v,内切核酸酶viii,tma内切核酸酶iii,内切核酸酶iii(nth),t4pdg(t4内切核酸酶v)或tth内切核酸酶iv。rna酶可以是rna酶h,rna酶hii,rna酶if,
本公开的靶分子可以包括解旋酶。解旋酶可以是真核解旋酶。解旋酶可以是原核解旋酶。解旋酶可以是dna解旋酶。解旋酶可以是rna解旋酶。解旋酶可以是dna/rna解旋酶。解旋酶可以是atp依赖性解旋酶。解旋酶可以是单链解旋酶。解旋酶可以是双链解旋酶。解旋酶可以是色结构域解旋酶dna结合蛋白。解旋酶可能是dead盒/dead/deah盒解旋酶。解旋酶的实例包括但不限于atxr,xpd,recq,ascc3,blm,brip1,dna2,fbx018,fbxo30,helb,hells,helq,helz,hfm1,hltf,ifih1,nav2,pif1,recql,rtel1,shprh,smarca4,smarcal1,wrn,wrnip1,ddx3x,ddx5,ddx6,ddx10,ddx11,ddx12,ddx58,dhx8,dhx9,dhx37,dhx40,dhx58,chd1,chd1l,chd2,chd3,chd4,chd5,chd6,chd7,chd8和chd9。
本公开的靶分子可以包含转座酶。转座酶可以是dna转座酶。转座酶可以是tn5转座酶或mosldna转座酶。转座酶可以是整合酶。整合酶可以是病毒整合酶。转座酶可以是hiv-1in,asvin和mua转座酶。
本公开的靶分子可以包含抗体或抗体片段。抗体可以包含免疫球蛋白(ig)。免疫球蛋白可以是igg,igm,iga,igd,ige。抗体可以包含抗体轻链。抗体轻链可以是κ或λ轻链。抗体可以包含抗体重链。抗体重链可以包含α,γ,δ,ε或μ重链。抗体可以包含抗体片段。抗体可以包含片段抗原结合(fab),fab2,可结晶片段(fc),可变片段(fv),可变单链片段(scfv),二聚单链可变片段(di-scfv),单结构域抗体sdab),scfv-fc,微型抗体,双抗体,重链可变结构域(vh结构域),轻链可变域(vl结构域),重链恒定结构域(ch结构域),轻链恒定结构域(cl结构域),互补决定区(cdr)。抗体可以是单体。抗体可以是二聚体。二聚体可以是同二聚体。二聚体可以是异二聚体。抗体可以是多聚体。抗体可以是五聚体。抗体可以是双特异性抗体。抗体可以是骆驼科的(camelid)。抗体可以是三功能抗体。抗体可以是双特异性t细胞结合剂(bite)。抗体可以是单克隆抗体。抗体可以是多克隆抗体。抗体可以是嵌合抗体。嵌合抗体可以指包含衍生自两个或更多个来源的区域的抗体。两个或更多来源可以来自不同的物种。或者,两个或更多个来源可以来自不同的细胞。细胞可以是相同的细胞类型的。或者,细胞可以是不同细胞类型的。抗体可以是人抗体。抗体可以是人源化抗体。抗体可以来自哺乳动物、爬行动物、飞禽和鱼。哺乳动物可以是人,非人灵长类,狗,猫,牛,绵羊,兔,山羊,大鼠,小鼠,熊,马,骆驼和猪。抗体的实例包括但不限于阿巴伏单抗(abagovomab),阿昔单抗(abciximab),actoxumab,阿达木单抗(adalimumab),adecatumumab,aducanumab,阿非莫单抗(afelimomab),afutuzumab,培化阿珠单抗(alacizumabpegol),ald518,阿伦单抗(alemtuzumab),alirocumab,altumomabpentetate,amatuximab,马安莫单抗anatumomabmafenatox,阿尼法鲁单抗anifrolumab,安非他珠单抗(anrukinzumab),阿泊珠单抗(apolizumab),奥美珠单抗(arcitumomab),阿曲珠单抗(aselizumab),阿沙单抗(atinumab),阿托木单抗(atorolimumab),bapineuzumab,巴利昔单抗basiliximab,巴维昔单抗(bavituximab),贝妥莫单抗bectumomab,贝利单抗belimumab,benralizumab,柏替木单抗(bertilimumab),besilesomab,贝伐单抗(bevacizumab),bezlotoxumab,比西单抗(biciromab),bimagrumab,bivatuzumabmertansine,blinatumomabblosozumab,布妥昔单抗(brentuximabvedotin),briakinumab,brodalumab,康纳单抗(canakinumab),cantuzumabmertansine,cantuzumabravtansine,caplacizumab,capromabpendetide,carlumab,卡妥索单抗(catumaxomab),cc49,cbr96-多柔比星免疫缀合物,西利珠单抗(cedelizumab),聚乙二醇化塞妥珠单抗(certolizumabpegol),西妥昔单抗(cetuximab),citatuzumabbogatox,西妥木单抗(cixutumumab),clazakizumab,克立昔单抗(clenoliximab),clivatuzumabtetraxetan,conatumumab,concizumab,克雷内治单抗(crenezumab),cr6261,达西珠单抗(dacetuzumab),达利珠单抗(daclizumab),dalotuzumab,daratumumab,demcizumab,德尼单抗(denosumab),地莫单抗(detumomab),阿托度单抗(dorlimomabaritox),drozitumab,duligotumab,dupilumab,dusigitumab,ecromeximab,艾库组单抗(eculizumab),埃巴单抗(edobacomab),依决洛单抗(edrecolomab),依法利珠单抗(efalizumab),依芬古单抗(efungumab),eldelumab,埃罗妥珠单抗(elotuzumab),elsilimomab,enavatuzumab,培恩莫单抗enlimomabpegol,enokizumab,enoticumab,ensituximab,epitumomabcituxetan,依帕珠单抗(epratuzumab),厄立珠单抗(erlizumab),ertumaxomab,伊瑞西珠(etaracizumab),etrolizumab,evolocumab,艾韦单抗(exbivirumab),fanolesomab,faralimomab,farletuzumab,fasinumab,fbta05,泛维珠单抗(felvizumab),fezakinumab,ficlatuzumab,figitumumab,flanvotumab,fontolizumab,foralumab,foravirumab,fresolimumab,fulranumab,futuximab,加利昔单抗(galiximab),盖尼塔单抗(ganitumab),gantenerumab,gavilimomab,吉妥珠单抗奥唑米星(gemtuzumabozogamicin),gevokizumab,girentuximab,glembatumumabvedotin,戈利木单抗(golimumab),gomiliximab,guselkumab,ibalizumab,替伊莫单抗(ibritumomabtiuxetan),icrucumab,伊戈伏单抗(igovomab),imab362,英西单抗(imciromab,imgatuzumab,inclacumab,indatuximabravtansine,英夫利昔单抗(infliximab),intetumumab,伊诺莫单抗(inolimomab),inotuzumabozogamicin,普利姆玛(ipilimumab),iratumumab,itolizumab,ixekizumab,keliximab,labetuzumab,lambrolizumab,lampalizumab,lebrikizumab,lemalesomab,lerdelimumab,lexatumumab,libivirumab,ligelizumab,林妥珠单抗(lintuzumab),linlumab,lodelcizumab,lorvotuzumabmertansine,鲁卡木单抗(lucatumumab),鲁昔单抗(lumiliximab),mapatumumab,margetuximab,maslimomab,mavrilimumab,马妥珠单抗(matuzumab),美泊利单抗(mepolizumab),metelimumab,milatuzumab,明瑞莫单抗(minretumomab),mitumomab,mogamulizumab,morolimumab,motavizumab,moxetumomabpasudotox,muromonab-cd3,nacolomabtafenatox,namilumab,naptumomabestafenatox,narnatumab,natalizumab,nebacumab,necitumumab,nerelimomab,nesvacumab,nimotuzumab,nivolumab,nofetumomabmerpentan,ocaratuzumab,ocrelizumab,odulimomab,ofatumumab,olaratumab,olokizumab,omalizumab,onartuzumab,ontuxizumab,oportuzumabmonatox,oregovomab,orticumab,otelixizumab,otlertuzumab,oxelumab,ozanezumab,ozoralizumab,pagibaximab,palivizumab,panitumumab,pankomab,panobacumab,parsatuzumab,pascolizumab,pateclizumab,patritumab,pemtumomab,perakizumab,pertuzumabpexelizumab,pidilizumab,pinatuzumabvedotin,pintumomab,placulumab,polatuzumabvedotin,ponezumab,pnliximab,pritoxaximab,pritumumab,pro140,quilizumab,racotumomab,radretumab,rafivirumab,ramucirumab,ranibizumab,raxibacumab,regavirumab,reslizumab,rilotumumab,rituximab,robatumumab,roledumab,romosozumab,rontalizumab,rovelizumabruplizumab,samalizumab,sarilumab,satumomabpendetide,secukinumab,seribantumab,setoxaximab,sevirumab,sibrotuzumab,sgn-cdl9a,sgn-cd33a,sifalimumab,siltuximab,simtuzumab,siplizumab,sirukumab,solanezumab,solitomab,sonepcizumab,sontuzumab,stamulumab,sulesomab,suvizumab,tabalumab,tacatuzumabtetraxetan,tadocizumab,talizumab,tanezumab,taplitumomabpaptox,tefibazumab,telimomabaritox,tenatumomab,teneliximab,teplizumab,teprotumumab,tgnl412,ticilimumab,tremelimumab,tildrakizumab,tigatuzumab,tnx-650,tocilizumab,atlizumab,toralizumab,tositumomab,tovetumab,tralokinumab,trastuzumab,trbs07,tregalizumab,tremelimumab,tucotuzumabcelmoleukin,tuvirumab,ublituximab,urelumab,urtoxazumab,ustekinumab,vantictumab,vapaliximab,vatelizumab,vedolizumab,veltuzumab,维帕莫单抗(vepalimomab),vesencumab,visilizumab,volociximab,vorsetuzumabmafodotin,伏妥莫单抗(votumumab),zalutumumab,zanolimumab,zatuximab,ziralimumab和阿佐莫单抗(zolimomabaritox)。
本公开的靶分子可以包含多核苷酸。多核苷酸可以包含一个或多个核苷酸。多核苷酸可以包含2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,或20个或更多个核酸。多核苷酸可以包含20,30,40,50,60,70,80,90,100,110,120,130,140,150,160,170,180,190或200个或更多个核酸。多核苷酸可以包含200,300,400,500,600,700,800,900,1000,1100,1200,1300,1400,1500,1600,1700,1800,1900或2000或更多个核酸。一个或多个核苷酸可以包含核糖核苷酸,脱氧核糖核苷酸,锁定核酸(lna),肽核酸(pna)或其任何组合。多核苷酸可以包含嘌呤碱基,嘧啶碱基或两者。多核苷酸可以包含或天然的,化学修饰的,生物化学修饰的,非天然的或衍生的核苷酸碱基。多核苷酸可以包含一个或多个未配对的核苷酸碱基。多核苷酸可以是单链的。多核苷酸可以包含一个或多个配对核苷酸碱基。多核苷酸可以是双链的。多核苷酸可以包含双链dna,双链rna或双链dna/rna杂合体。多核苷酸可以是合成的多核苷酸。在某些情况下,多核苷酸的序列是已知的。例如,多核苷酸可以包含多聚腺苷酸化的序列。在某些情况下,多核苷酸的序列是未知的。例如,随机序列的多核苷酸可以包含简并序列。在某些情况下,仅多核苷酸序列的一部分是已知的。例如,多核苷酸可以包含多聚腺苷酸化序列,但序列的其余部分是未知的。
本公开的靶分子可以包含寡核苷酸引物。寡核苷酸引物可以是扩增或测序引物。扩增或测序引物可用于另一多核苷酸的扩增或测序。例如,扩增或测序引物可以包含与基因部分互补的序列。扩增或测序引物可以与基因杂交,并能够扩增或测序基因。扩增或测序引物可以是特异性引物。通常,特异性引物与多核苷酸(例如,基因,外显子区等)的序列互补。多核苷酸的序列可以对于多核苷酸是独特的。例如,特异性引物可以与抗体基因的至少一部分杂交。扩增或测序引物可以是通用引物。通常,通用引物与两种或更多种类型的多核苷酸共有的序列互补。例如,通用引物可以包含可以与两个或多个多核苷酸(例如mrna)的多聚腺苷酸化序列杂交的oligodt序列。扩增或测序引物可以与多核苷酸天然的序列(例如,mrna的polya序列,限制性位点,外显子区)杂交。扩增或测序引物可以与多核苷酸非天然的序列(例如,衔接子序列或条形码序列)杂交。扩增或测序引物可以包含随机或简并序列。例如,扩增或测序引物可以包含随机六聚体序列。扩增或测序引物的实例包括但不限于oligodt,随机引物,基因特异性引物和启动子引物。oligodt引物可以是寡聚(dt)20,寡聚(dt)18或寡聚(dt)12-18引物。随机引物可以是随机的9聚体引物或随机6聚体引物。随机引物可以包含寡脱氧核糖核苷酸。或者,随机引物包括寡脱氧核苷酸。基因特异性引物的实例包括但不限于细胞因子基因引物和持家基因引物。启动子引物可以是例如sp6引物,t7启动子引物,runx2启动子引物,gapdh启动子引物,u6启动子引物,t3启动子引物和camv35s启动子引物。靶分子可以包含选自下组的寡核苷酸引物:3’οx1(用于具有aox1终止子的序列,反向引物),5’aοx1(用于具有aox1启动子的序列,正向引物),35s启动子(camv35s启动子,正向引物),ac5(果蝇(drosophila)肌动蛋白5c启动子,正向引物),alpha-因子(alpha因子信号序列,正向引物),amp-r(氨苄青霉素抗性基因的5'端,反向引物),aug1正向(用于具有aug1启动子的序列,正向引物),aug1反向(用于具有aug1启动子的序列,反向引物),bgh反向(牛生长激素终止子,反向引物),bglob-intron-f(兔beta-珠蛋白内含子,正向引物),bglob-intron-r(兔beta-珠蛋白内含子,反向引物),bglob-pa-r(兔beta-珠蛋白polya区,反向引物),cat-r(氯霉素抗性基因的5'端,反向引物),cmv正向(人cmv立即早期启动子,正向引物),cre-r(cre重组酶的5'端,反向引物),cyc1(cyc1转录终止信号,反向引物),dsred1-c(dsred1的3'端,正向引物),dsred1-n(dsred1的5'端,反向引物),ebv反向(sv40polya终止子,反向引物),蜕皮激素正向(果蝇热休克启动子,正向引物),ef-1a正向(人延长因子-1a启动子,正向引物),egfp-c(egfp的3'端,正向引物),egfp-n(egfp的5’端,反向引物),exfp-r(用于区分egfp与ecfp与eyfp,反向引物),f1ori-f(f1起源,正向引物),gal1(酿酒酵母gal1启动子,正向引物),gal10pro-f(酿酒酵母gal10启动子,正向引物),gal4n-term(gal4dna结合端的3'端,正向引物),gal4-ad(gal4活化域的3’端,正向引物),gfp-f(gfp的3'端,正向引物),gfp-r(gfp的5’端,反向引物),gpdpro-f(酿酒酵母gpd启动子,正向引物),gw-3'(gatewaycassette的3’端,正向引物),gw-5'(gateway盒的5’端,反向引物),h1(人h1启动子,正向引物),ha-f(ha标签,正向引物),ha-r(ha标签,反向引物),hat(组氨酸亲和标签,正向引物),hgh-pa-r(人生长激素终止子,反向引物),hrgfp-r(hrgfp(人源化renillagfp),正向引物),hubcpro-f(人泛素c(ubc)启动子,正向引物),ires-f(ires的3’端,正向引物),ires-r(ires的5’端,反向引物),l4440(l4440载体中的mcs的5',正向引物),laci-r(laci的5’端,反向引物),lacz-r(lacz的5’端,反向引物),lexa(lexadna结合域的3’端,正向引物),lko.15'(人u6启动子,正向引物),lncx(人cmv启动子,正向引物),luc-f(萤光素酶的3’端,正向引物),lucnrev(萤光素酶的5’端,反向引物),m13(-21)正向(在lacz基因中),m13(-40)(在lacz基因中),m13反向(在lacz基因中),m13/puc正向(在lacz基因中),m13/puc反向(在lacz基因中),mbp-f(麦芽糖结合蛋白的3’端,正向引物),mcherry-f(mcherry的3’端,正向引物),mcherry-r(mcherry的5’端,反向引物),mt正向(果蝇金属硫蛋白启动子,正向引物),mmlv-f(moloney鼠白血病病毒ltr(momulv),正向引物),mpgk-f(小鼠pgk启动子,正向引物),mscv(鼠干细胞病毒,正向引物),mscv-rev(鼠干细胞病毒,反向引物),mt1-f(小鼠金属硫蛋白1启动子,正向引物),mu6-f(小鼠u6启动子,正向引物),myc(myc标签,正向引物),neo-f(新霉素抗性基因的3’端,正向引物),neo-r(新霉素抗性基因的5’端,反向引物),nos-f(nopaline合酶启动子,正向引物),nmtl-f(裂殖酵母(s.pombe)nmt1启动子,正向引物),opie2正向(opie2启动子,正向引物),pacyc-f(p15a起源,正向引物),pad-cmv(用于pad-cmv载体中sali后的克隆位点),pbabe3'(sv40增强子,pbabe载体中mcs的3’,反向引物),pbabe5'(psi包装信号,pbabe载体中的mcs的5',正向引物),pbad正向(用于具有大肠杆菌arabad启动子的序列,正向引物),pbad反向(用于具有大肠杆菌arabad启动子的序列,反向引物),pbluescriptks(用于pbluescript载体序列),pbluescriptsk(用于pbluescript载体序列),pbmn5'(mmlv序列,用于pbmn逆转录病毒中的插入物),pbr322ori-f(pbrs322起源,正向引物),pbrforbam(在pbr322tet区中,bamhi上游,正向引物),pbrforeco(在pbr322中,在ecori位点上游,正向引物),pbrrevbam(在pbr322tet区中,在bamhi下游,反向引物),pcag-f(兔beta-珠蛋白内含子,用于pcag质粒,正向引物),pcasper-f(果蝇mini-white基因的5’端,反向引物),pcasper-hs(果蝇hsp70启动子,正向引物),pcdl-f(pcdl载体中的ecori位点的5',正向引物),pentr-f(pentr载体中的attll的5',正向引物),pentr-r(pentr载体中的attl2的3',反向引物),pgex3'(pgex载体中的mcs的3',反向引物),pgex5'(谷胱甘肽-s-转移酶的3’端,正向引物),pgp704-r(r6kgamma起源,pgp704载体中的mcs的3',反向引物),phyblex反向(adh终止子,反向引物),pltet-f(lambda噬菌体早期左边(pl)启动子,正向引物),p1xsn5'(鼠干细胞病毒,与mscv相同,正向引物),pmrb10l-f(hcmv主要立即早期蛋白(ie),正向引物),pmt2-f(合成内含子的3’端,正向引物),pmx-s1811(mmlv序列,pmx载体中的mcs的5',正向引物),多角体蛋白(polyhedrin)正向(多角体蛋白启动子,正向引物),多角体蛋白反向(具有多角体蛋白启动子的对于杆状病毒载体,反向引物),pqe启动子(在pqe载体中的mcs的5',正向引物),prep正向(劳斯肉瘤病毒(rsv)启动子,正向引物),prs-标志物(以对prs载体中的酵母选择标志物测序),pry1(pzp-元件,反向引物),ptrchis正向(在ptrchis载体中的mcs的5',正向引物),ptrchis反向(在ptrchis载体中的mcs的3',与pbad-r相同,反向引物),puro-f(嘌呤霉素抗性基因的3'端,正向引物),pzip(鼠白血病病毒(mulv),反向引物),rcas-f(劳斯肉瘤病毒(rsv)env基因的3',正向引物),rluc-f(renilla萤光素酶的3’端,正向引物),rvprimer3(在pgl3载体中的mcs的5',正向引物),sffv-f(脾焦点形成病毒(spleenfocusformingvirus)5'ltr,正向引物),sp6(sp6启动子,正向引物),sv40pa-r(sv40polya,反向引物),sv40pro-f(sv40启动子/起点,正向引物),sv40-splicer(sv40剪接序列,反向引物),t3(t3启动子,正向引物),t7(t7启动子,正向引物),t7terminal(t7终止子,反向引物),tac启动子(tac启动子,正向引物),tdtomato-fwd(tdtomato的3’端,正向引物),tdtomato-rev(tdtomato的5’端,反向引物),tet-r(四环素抗性基因的5’端,反向引物),tk-pa-r(胸苷激酶polya,反向引物),tn7-end(细菌转座子tn7),trc-f(人u6启动子,正向引物),ubx-f(果蝇ultrabithorax基因,正向引物),v5反向(v5表位,反向引物),wpre-r(wpre的5’端,反向引物),xbg-r(爪蟾beta-珠蛋白3'utr,反向引物),xef1a(爪蟾ef1alpha增强子/启动子,正向引物),和xpress正向(xpress表位,正向引物)。
本公开的靶分子可以包含rna分子。rna可以是蛋白质编码性rna。蛋白质编码性rna可以是mrna。rna可以是非编码rna(ncrna)。ncrna可以是核糖体rna(rrna),转移rna(trna),小干扰rna(sirna),微小rna(mirna),小核rna(snrna),小核仁rna(snorna),长非编码rna(incrna)和piwi相互作用的rna(pirna)。rna可以是合成的rna。合成rna的实例包括但不限于反义rna,短发夹rna(shrna),互补rna(crna)。rna可以从外显子衍生。rna可以从内含子衍生。rna可以在非翻译区(utr)上衍生。rna可以是聚腺苷酸化的。在某些情况下,rna不是聚腺苷酸化的。
本公开的靶分子可以包含dna分子。dna可以是基因组dna(gdna)或互补dna(cdna)。dna可以是b-dna。dna可以是a-dna。dna可以是z-dna。dna可以包含蛋白质编码区的至少一部分。dna可以包含基因的至少一部分。dna可以包含外显子。dna可以包含内含子。dna可以包含非翻译区(utr)。dna可以包含非编码dna的至少一部分。非编码dna可以包含转录成非编码rna的序列。非编码dna可以包含调节元件。调节元件可以是顺式调节元件。调节元件可以是反式调节元件。调节元件可以是启动子。启动子可以促进基因的转录。该启动子可以位于编码区的上游。调节元件可以是增强子。增强子可以对基因的转录水平发挥远距离的作用。非编码dna可以包含假基因。非编码dna可以包含转座子或反转录转座子。非编码dna可以包含重复序列,例如长散在核元件(lines)和短散在核元件(sines)。sine可以包含alu序列。非编码dna可以包含病毒元件。非编码dna可以包含端粒。
本公开的靶分子可以包含碳水化合物。碳水化合物可以是单糖,二糖,寡糖或多糖。单糖的实例包括但不限于甘油醛,半乳糖胺,葡糖胺,唾液酸,n-乙酰葡糖胺,磺基金鸡纳糖(sulfoquinovose),吡喃糖,吡喃葡萄糖,呋喃糖,葡萄糖,果糖和半乳糖。二糖可以是蔗糖,乳糖,海藻糖,纤维二糖或麦芽糖。寡糖可以是低聚果糖(fructo-oligosaccharide),低聚半乳糖(galactooligosaccharide)和甘露聚糖寡糖。多糖可以是储存多糖。多糖可以是结构多糖。多糖的实例包括但不限于淀粉,糖原,甲壳质,淀粉酶,支链淀粉,愈创葡聚糖(callose)或昆布多糖,金藻昆布多糖(chrysolaminarin),木聚糖,阿拉伯木聚糖,甘露聚糖,岩藻依聚糖半乳甘露聚糖和纤维素。
本公开的靶分子可以包含有机化合物。通常,有机化合物是其分子含有碳的化合物。有机化合物可以是天然化合物。通常天然有机化合物是指由植物或动物产生的化合物。天然有机化合物的实例包括大多数糖,一些生物碱和萜类化合物,某些营养物质如维生素b12。有机化合物可以是合成化合物。通常,合成有机化合物可以通过其它化合物的反应制备,称为“合成的”。聚合物,包括塑料和橡胶,可以是有机合成或半合成化合物。一些有机化合物可以使用细菌和酵母等生物体的生物化学制造。有机化合物可以是小分子,醇,脂肪酸,聚酮,激素或碳水化合物。
本公开的靶分子可以包含无机化合物。通常,不称为有机化合物的化合物是无机化合物。含碳无机化合物的实例包括但不限于碳化物,碳酸盐,碳的简单氧化物(例如co和co2)和氰化物。无机化合物可以包括量子点,金属纳米粒子,金属氧化物纳米颗粒等。无机化合物还可以包括矿物质,硫化物,有机金属化合物和生物有机化合物。矿物质可以是滑石,石膏,方解石,萤石,磷灰石,正长石,石英,黄玉,刚玉或金刚石。
本公开的靶分子可以包含小分子。小分子可以包含肽。肽包含一个或多个氨基酸。氨基酸可以是天然氨基酸。氨基酸可以是非天然氨基酸。氨基酸可以是d-氨基酸。氨基酸可以是l-氨基酸。氨基酸的实例包括但不限于对乙酰基苯丙氨酸,间乙酰基苯丙氨酸,丙氨酸,β-丙氨酸,γ-氨基丁酸(gaba),氨基异丁酸,δ-氨基乙酰丙酸,4-氨基苯甲酸(paba),精氨酸,天冬酰胺,天门氨酸,对苯氧基-1-苯丙氨酸,瓜氨酸,胱硫醚,半胱氨酸,胱氨酸,二氨基庚二酸,今可豆氨酸(djenkolicacid),谷氨酸,谷氨酰胺,甘氨酸,组氨酸,异亮氨酸,羊毛硫氨酸,亮氨酸,赖氨酸,甲硫氨酸,鸟氨酸,苯丙氨酸,苯基硒基丙氨酸(phenylselenidylalanine),脯氨酸,硒代半胱氨酸,丝氨酸,苏氨酸,色氨酸,酪氨酸和缬氨酸。小分子可以包含治疗剂。
本公开的靶分子可以包含代谢物。代谢物的实例包括但不限于生物碱,糖苷,脂质,非核糖体肽,如放线菌素d,吩嗪,天然酚(包括类黄酮),聚酮化合物,萜烯,包括类固醇和四吡咯。
本公开的靶分子可以包含治疗剂。治疗剂可以包含有机化合物,无机化合物,肽,激素,小分子,抗体,抗原,半抗原或其任何组合。治疗剂可以是解热药,镇痛药,抗疟药,抗生素,防腐剂,情绪稳定剂,激素替换,口服避孕药,兴奋剂,安定药,抗病毒药,抗癌药,免疫抑制剂和他汀类。安定药可以是甲丙氨酯,氯丙嗪,利血平,氯氮卓,安定和阿普唑仑。他汀可以是洛伐他汀,普伐他汀或辛伐他汀。
在一些实施方案中,本文提供的基础包含多个特征。基底上的多个特征在这里也称为特征阵列或阵列。
图5中描绘了包含两个或更多个特征的例示性基底。如图5中所示,基底(501)可以包含两个或更多个特征(502,503)。第一特征(502)可以包含多个第一捕捉引物(504,505,506)和多个第二捕捉引物(507,508,509)。第一特征(502)可以进一步包含第一靶多核苷酸(510)。第一靶多核苷酸(510)可以通过将第一靶多核苷酸(510)附着于第一捕捉引物(504)而附于第一特征(502)。第一特征(502)可以进一步包含多个扩增子(512,513,514,515,516)。多个扩增子(512,513,514,515,516)可以包含第一靶多核苷酸(510)的扩增子。第一特征(502)可以进一步包含第一靶分子(511)。可以将第一靶分子(511)附着于第一靶多核苷酸(510)。第二特征(503)可以包含多个第一捕捉引物(520,521,522)和多个第二捕捉引物(523,524,525)。第二特征(503)可以进一步包含第二靶多核苷酸(526)。第二靶多核苷酸(526)可以通过将第二靶多核苷酸(526)附着于第二捕捉引物(520)而附于第二特征(503)。第二特征(503)可以进一步包含多个扩增子(528,529,530,531,532)。多个扩增子(528,529,530,531,532)可以包含第二靶多核苷酸(526)的扩增子。第二特征(503)可以进一步包含第二靶分子(527)。可以将第二靶分子(527)附着于第二靶多核苷酸(526)。基底可以包含两个或更多个相同特征。例如,第一特征(502)和第二特征(503)可以是相同的。基底可以包含两个或更多个不同特征。例如,第一特征(502)和第二特征(503)可以是不同的。第一特征(502)和第二特征(503)可以相差与每个特征结合的第一捕捉引物。例如,第一特征(502)的多个第一捕捉引物(504,505,506)可以不同于第二特征(503)的多个第一捕捉引物(520,521,522)。第一特征(502)和第二特征(503)可以相差与每个特征结合的第二捕捉引物。例如,第一特征(502)的多个第二捕捉引物(507,508,509)可以不同于第二特征(503)的多个第二捕捉引物(523,524,525)。第一特征(502)和第二特征(503)可以相差与每个特征结合的靶多核苷酸。例如,第一特征(502)的第一靶多核苷酸(510)可以不同于第二特征(503)的第二靶多核苷酸(526)。随后,第一特征(502)的多个扩增子(512,513,514,515,516)可以不同于第二特征(503)的多个扩增子(528,529,530,531,532)。第一特征(502)和第二特征(503)可以相差与每个特征结合的靶分子。例如,第一特征(502)的第一靶分子(511)可以不同于第二特征(503)的第二靶分子(527)。第一特征可以进一步包含一个或多个另外的靶分子。第二特征可进一步包含一个或多个另外的靶分子。来自第一特征的一个或多个另外的靶分子可以与第二特征中的一个或多个另外的靶分子相同。或者或另外,来自第一特征的一个或多个另外的靶分子可以不同于来自第二特征的一个或多个另外的靶分子。
具有多个特征的基底可以表现为点或斑块的网格。特征可以以重复图案定位。或者或另外,特征可以以不规则的非重复图案定位。在一些实施方案中,图案是六边形图案,直线图案,网格图案,具有反射对称性的图案,具有旋转对称性的图案等。非对称图案也可以是有用的。间距(pitch)在最近邻近特征的不同对之间可以是相同的,或者间距在最近邻近特征的不同对之间可以变化。
具有多个特征的基底以及使用这种阵列的本文所阐述的方法可以具有各种密度中的任一种的特征,包括例如至少约10个特征/cm2,100个特征/cm2,500个特征/cm2,1,000个特征/cm2,5,000个特征/cm2,10,000个特征/cm2,50,000个特征/cm2,100,000个特征/cm2,1,000,000个特征/cm2,5,000,000个特征/cm2或更高。
在具体实施方案中,阵列的特征可以各自具有大于约100nm2,250nm2,500nm2,1μm2,2.5μm2,5μm2,10μm2,100μm2,或500μm2的面积。或者或另外,阵列的特征可以各自具有小于约1mm2,500μm2,100μm2,25μm2,10μm2,5μm2,1μm2,500nm2或100nm2的面积。实际上,区域可以具有例如从上面例示的那些选择的上限和下限之间的范围内的大小。
在一些实施方案中,阵列基底的表面上的特征是不连续的,由表面的间隙区域分开。与阵列的特征相比具有基本上更低的量或浓度的捕捉引物或其它捕获剂的间隙区域可以是有用的。缺乏捕捉引物或其它捕获剂的间隙区是特别有用的。例如,在间隙区域处相对少量或不存在捕获剂有利于至少一种靶多核苷酸的定位,并随后对期望的特征产生扩增子簇。
在具体的实施方案中,特征是表面(例如孔)中的凹特征,并且特征可以含有凝胶材料。含凝胶的特征在表面上彼此以间隙区域分开,在那里基本上不存在凝胶,或者如果存在的话,则凝胶基本上不能支持包含例如捕捉引物的多核苷酸的定位。
在一些实施方案中,孔是微孔或纳米孔。用于制备和使用具有含有特征(如孔)的凝胶的基底的方法和组合物列于例如us2014/0243224中,其通过引用并入本文。
在一些实施方案中,阵列上的特征大小(例如,面积,直径等)在有利于动力学排除扩增(kea)和特征中形成单分子放置的范围内选择。通过参考采用孔作为特征的实施方案例示,孔的大小(例如,直径)可以在约30nm和约1μm之间,在约50nm和约800nm之间,在约70nm和约600nm之间,或在100nm和约400nm之间变化。在一些实施方案中,孔具有约400nm的直径。在一些实施方案中,孔具有小于约1μm的直径。例示性的微阵列包括在
在包括表面上的特征阵列的一些实施方案中,特征可以是离散的,由间隙区域分开。特征的大小和/或区域之间的间隔可以变化,使得阵列可以是高密度,中密度或较低密度。
在一些实施方案中,阵列是高密度,中密度或低密度阵列。高密度阵列的特征在于具有以小于约15μm分开的区域。中密度阵列具有以约15至30μm分开的区域,而低密度阵列具有以大于30μm分开的区域。可用于本发明的阵列可以具有分开小于100μm,50μm,10μm,5μm,1μm或0.5μm的区域。
在一些实施方案中,阵列含有珠。在一些实施方案中,珠位于表面上,包括下述那些,其中珠位于孔中,诸如beadchip阵列(illuminainc.,sandiegoca)或者来自454lifesciences(roche子公司,baselswitzerland)或iontorrent(lifetechnologies子公司,carlsbadcalifornia)的测序平台中使用的基底。具有位于表面上的珠的其它阵列记载于us6,266,459;us6,355,431;us6,770,441;us6,859,570;us6,210,891;us6,258,568;us6,274,320;us2009/0026082a1;us2009/0127589a1;us2010/0137143a1;us2010/0282617a1或pct公开no.wo00/63437,其各自通过引用并入本文。几个上述参考文献描述了在阵列基底之中或之上加载珠前将靶多核苷酸(或捕捉引物)附着于珠的方法。然而,应当理解,珠可以制成包括捕捉引物,然后可以将珠用于加载阵列,从而形成用于本文所述方法的扩增位点。如本文中先前列出,可以在没有珠的情况下使用基底。
在一些实施方案中,例示性珠组合物包括但不限于塑料,陶瓷,玻璃,聚苯乙烯,甲基苯乙烯,丙烯酸聚合物,顺磁材料,氧化钍溶胶,碳石墨,二氧化钛,胶乳或交联葡聚糖例如sepharose,纤维素,尼龙,交联胶束和teflon,以及本文概述的固体支持物的任何其它材料都可以使用。来自bangslaboratories,fishersind.的“microspheredetectionguide”是一个有用的指南。在某些实施方案中,微球是磁性微球或珠。
因此,本公开提供了基底,其具有(a)固定化到特征的多个第一和第二捕捉引物;(b)至少一个靶多核苷酸,一个末端附着到所述捕捉引物之一而另一个末端与靶分子连接,其中所述靶多核苷酸包含侧翼有与所述第一和第二捕捉引物互补的第一和第二捕捉引物结合区的靶区域,所述第二捕捉引物结合区包含与所述第二捕捉引物的碱基对错配,并且(c)与固定化到所述特征的所述靶多核苷酸互补的多个克隆扩增子。基底可以具有一个特征或多个特征。一个或多个特征可以是珠,孔,包括微孔或纳米孔,通道,脊,突起或其组合。一个或多个特征包含单一靶分子。可以用靶多核苷酸的多个克隆扩增子填满一个或多个特征。多个特征之间的间隙区域可以缺乏靶多核苷酸。具有多个特征,包括两个或更多个特征的基底在多个内的每个不同特征中可以具有不同单一靶分子。特征上的靶多核苷酸包含一个或多个选自下组的多核苷酸:rna,dna,pna或双链dna(dsdna)。特征上的靶多核苷酸的长度可以小于1,000个核苷酸。特征上的靶多核苷酸长度可以是10至25,26至50,51至100,101至200,201至300,301至400,401至500,501至600,601至700,701至800,801至900,或901至1000个核苷酸。靶分子可以是多肽、多核苷酸、碳水化合物、氨基酸、核苷酸、单糖、半抗原、配体、抗原、分析物、小分子有机化合物或无机化合物。多肽靶分子可以是纳米孔、结合多肽和酶。纳米孔可以是mspa、ompf、ompg、nalp、wza、clya毒素、α-溶血素、炭疽毒素、杀白细胞素和dna折纸纳米孔。结合多肽可以是抗体、fab、fab'、f(ab')2、scfv、双抗体、三抗体、微型抗体和单域抗体(sdab)或t细胞受体。酶可以是聚合酶、解旋酶、重组酶、转座酶或连接酶。基底可以是选自下组的一个或多个材料:玻璃、硅、塑料或生物聚合物。基底可以进一步包含水凝胶或共价连接的凝胶。
本公开进一步提供了将单一靶分子置于基底的特征上的方法。方法包括(a)杂交固定化到基底上的特征的多个第一和第二捕捉引物与(b)至少一个靶多核苷酸,所述靶多核苷酸包含侧翼有与所述第一和第二捕捉引物互补的第一和第二捕捉引物结合区的靶区域,其中所述第二捕捉引物结合区包含与所述第二捕捉引物的碱基对错配并且与靶分子连接,并且(c)以平均扩增速率扩增所述至少一种靶多核苷酸以产生与所述靶多核苷酸互补的多个克隆扩增子,所述平均扩增速率超过靶多核苷酸至特征的平均转运速率。
动力学排除扩增(kea)允许在包括例如具有孔的图案化流动池的基底上单个特征扩增单一靶多核苷酸,以及在一个或多个孔中产生单克隆靶多核苷酸群体。实施kea的方法在本领域中是公知的,并且描述于例如us2013/0338042a1中。在kea中,特征中第一捕获靶多核苷酸的扩增速率相对于靶多核苷酸转运和捕获的慢得多的速率快得多。特征中捕获的第一靶多核苷酸可以快速扩增,并且填充整个特征,防止在同一特征中捕获另外的靶多核苷酸。
本公开部分地基于以下认识:关于在特征(如图案化流动池的纳米孔)中产生单克隆靶多核苷酸群体的kea有效性随着特征或纳米孔的大小增加而降低。第一次捕获的靶多核苷酸的扩增以及用靶多核苷酸的单克隆群体填充特征在较大特征中比在较小的特征中更高,而第二靶多核苷酸的捕获在较大特征中比在较小的特征中更快。因此,在特征中捕获和扩增多于一种靶多核苷酸的可能性随着特征的大小而增加。来自特征的分子询问的数据质量对于靶多核苷酸的单克隆群体是最佳的。来自特征的数据质量随着除了第一固定化靶多核苷酸以外的靶多核苷酸的份额增加而降低。
在图1中显示了使用kea用于在多个特征中的每个中放置单一靶分子的具体实例。简言之,用固定化的捕捉引物图案化基底的特征,例如植入有p5和p7捕捉引物对的纳米孔内的pazam。靶分子,如聚合酶或纳米孔多肽(图1中显示为星)通过化学缀合连接到双链靶多核苷酸的末端。靶多核苷酸能够用例如商业化的twistdx试剂盒使用kea(也称为重组酶聚合酶扩增(rpa))扩增。rpa是一类主要用于自由溶液的扩增方法。但是,kea是一类局部化rpa反应,其中扩增可以在半封闭的空间如固体基底或珠表面中进行,以产生靶向核苷酸的单克隆簇。扩增快速消耗特征中的引物,预防和/或显著减少来自不同靶多核苷酸的接种和扩增,因此消除或降低了其它靶分子的加载的可能性。
在一些实施方案中,可以使用动力学排除扩增(kea),也称为排除扩增(examp)进行等温扩增。本公开的核酸文库可以使用方法制备,所述方法包括使扩增试剂反应以产生多个扩增位点的步骤,所述多个扩增位点各自包含来自已经接种该位点的单个靶核酸的扩增子的基本上克隆的群体。在一些实施方案中,进行扩增反应直到产生足够数目的扩增子以填充相应扩增位点的容量。以这种方式填满已经接种的位点抑制靶核酸在所述位点处着陆和扩增,从而在该位点产生扩增子的克隆群体。在一些实施方案中,即使在第二靶核酸到达位点前没有填满扩增位点,也可以实现表观克隆性。在一些条件下,第一靶核酸的扩增可以进行到下述的点,即产生足够数目的拷贝以有效地胜过或压倒从被运送到该位点的第二靶核酸产生拷贝。例如在对直径小于500nm的圆形特征使用桥接扩增方法的实施方案中,已经确定在第一靶核酸的指数扩增的14个循环后,来自在同一个位点处第二靶核酸的污染将产生不足以对illumina测序平台上的合成测序分析产生不利影响的污染扩增子的数目。
如上述实例所证明的,在具体的实施方案中,阵列中的扩增位点可以是但不一定完全克隆的。相反,对于一些应用,个别扩增位点可以主要地使用来自第一靶核酸的扩增子定殖,并且还可以具有来自第二靶核酸的低水平的污染扩增子。阵列可以具有一个或多个具有低水平的污染扩增子的扩增位点,因此污染水平对随后的阵列使用没有不可接受的影响。例如,当阵列用于检测应用中时,可接受的污染水平将是不会以不可接受的方式影响信号与噪声或检测技术的分辨率的水平。因此,表观克隆性通常与通过本文所阐述的方法制成的阵列的特定用途或应用相关。在特定应用的个别扩增位点可接受的例示性污染水平包括但不限于至多0.1%,0.5%,1%,5%,10%或25%的污染扩增子。阵列可以包括具有这些例示性水平的污染扩增子的一个或多个扩增位点。例如,阵列中的多达5%,10%,25%,50%,75%或甚至100%的扩增位点可以具有一些污染扩增子。应当理解,在阵列或其它的位点集合中,至少50%,75%,80%,85%,90%,95%或99%或更多的位点可以是克隆的或表观克隆的。
在一些实施方案中,当过程以足够快的速率发生以有效地排除另一事件或过程发生时,可以发生动力学排除。例如,制备核酸阵列,其中阵列的位点用溶液中的靶核酸随机接种,并且在扩增过程中产生靶核酸的拷贝以将每个接种的位点填满。根据本公开的动力学排除方法,接种和扩增过程可以在扩增率超过接种速率的条件下同时进行。因此,在由第一靶核酸接种的位点产生拷贝的相对较快的速率将有效地排除第二核酸接种该位点进行扩增。动力学排除扩增方法可以如美国申请公开no.2013/0338042的公开内容中详细讨论的那样实施,其全部内容通过引用并入本文。
动力学排除可以利用相对较慢的速率启动扩增(例如,制备靶核酸的第一拷贝的慢速率)对用于制备靶核酸的后续拷贝(或靶核酸的第一拷贝)的相对较快的速率。在前一段的实例中,由于靶核酸接种的相对缓慢速率(例如相对慢的扩散或转运)对发生扩增以用核酸种子拷贝填充位点的相对快速的速率而发生动力学排除。在另一个例示性实施方案中,由于形成已经接种了位点的靶核酸的第一拷贝的延迟(例如延迟或慢激活)对制备后续拷贝以填充位点的相对较快的速率,可发生动力学排除。在该实例中,单独的位点可以已经接种了几种不同的靶核酸(例如,几个靶核酸可以在扩增之前存在于每个位点)。然而,对于任何给定的靶核酸的第一拷贝形成可以随机激活,使得与产生后续拷贝的速率相比,第一拷贝形成的平均速率是相对较慢的。在这种情况下,尽管单独位点可以已经接种了几种不同的靶核酸,但是动力学排除将允许仅扩增那些靶核酸之一。更具体地,一旦第一靶核酸已被激活用于扩增,则该位点将迅速用其拷贝填满,从而防止在该位点产生第二靶核酸的拷贝。
扩增试剂可以包括促进扩增子形成,并且在一些情况下增加扩增子形成的速率的其它成分。一个实例是重组酶。重组酶可以通过允许重复侵入/延伸促进扩增子形成。更具体地,重组酶可以促进通过聚合酶对靶核酸的侵入和使用靶核酸作为扩增子形成的模板通过聚合酶延伸引物。该过程可以作为链式反应重复,其中从每轮侵入/延伸产生的扩增子在随后的轮次中充当模板。由于不需要变性循环(例如通过加热或化学变性),该方法可以比标准pcr更快地发生。因此,重组酶促进的扩增可以等温进行。通常期望在重组酶促进的扩增试剂中包括atp或其它核苷酸(或在一些情况下不可水解的其类似物)以促进扩增。重组酶和单链结合(ssb)蛋白的混合物特别有用,因为ssb可进一步促进扩增。用于重组酶促进扩增的例示性制剂包括由twistdx(cambridge,uk)以twistamp试剂盒商业销售的那些。在us5,223,414和us7,399,590中列出了重组酶促进扩增试剂的有用组分和反应条件,其各自通过引用并入本文。
可以包含在扩增试剂中以促进扩增子形成和在一些情况下增加扩增子形成速率的组分的另一个实例是解旋酶。螺旋酶可以通过允许扩增子形成的链式反应促进扩增子的形成。因为不需要变性循环(例如通过加热或化学变性),所以该方法可以比标准pcr更快地发生。因此,解旋酶促进的扩增可以等温进行。解旋酶和单链结合(ssb)蛋白的混合物特别有用,因为ssb可进一步促进扩增。用于解旋酶促进扩增的例示性制剂包括以biohelix(beverly,ma)作为isoamp试剂盒商业出售的那些。此外,us7,399,590和us7,829,284中描述了包括解旋酶蛋白的有用制剂的实例,其各自通过引用并入本文。
可以包含在扩增试剂中以促进扩增子形成并且在一些情况下增加扩增子形成速率的组分的另一个实例是起点结合蛋白。
可以在桥式扩增方案中使用kea或其它等温扩增方法,以将具有单个靶分子的单个靶多核苷酸锚定到特征。尽管可以从两端进行靶多核苷酸的扩增,但是有用的是从远离附着的靶分子的末端线性扩增,以避免或减少从一些特征损失靶多核苷酸(和附着的靶分子)。靶多核苷酸的线性扩增可以通过将一个或多个碱基对错配掺入在附着靶分子近端的靶多核苷酸的捕捉引物结合区中来实现。不附着于靶分子的互补链的捕捉引物结合区可以与基底上其相应的捕捉引物互补。根据该例示性构造,第一轮kea将线性扩增靶多核苷酸的两条链。然而,随后的扩增轮次将线性扩增与靶分子附着的靶多核苷酸链,并以指数方式扩增由互补链产生的扩增子。
可以在任何位置放置捕捉引物结合区内的错配,只要它抑制或延缓关联捕捉引物的侵入和/或用聚合酶延伸引物。如图4和6中例示的在与关联捕捉引物互补的结合区的末端处放置错配是特别有用的,因为它创建使用重组酶的链侵入的低可能性和/或减少通过聚合酶的延伸,因为捕捉引物在3'端不与靶多核苷酸杂交。
在图4中显示了通过kea在特征中放置至少一个靶分子或在多个特征中每个中放置至少一个靶分子的上述例示性设计。简言之,由于在kea置换与靶分子接合的多核苷酸链时靶多核苷酸可以扩散开来,因此靶多核苷酸可以在捕捉引物区中用一个或多个错配的碱基对构建。图4显示了由侧翼有捕捉引物区域的phix靶区域组成的靶多核苷酸。ds靶多核苷酸的3'末端(下链)显示包含测序引物结合区(sbs3’)的捕捉引物结合区(p5')。5'末端(下链)表示包含测序引物结合区(sbs8)的捕捉引物结合区(p7)。互补链构造示于靶多核苷酸的上链中。虽然可以利用任何碱基对配配,但是在该说明性实施方案中,p7/p7'捕捉引物结合区包含与在p7序列的3'端引入的ccc/cta错配序列对应的三碱基对错配。在突变或错配的p7链的5'末端,化学缀合可用于将靶多核苷酸连接到靶分子,其由图4中的星显示。或者,无碱基位点或聚-8氧代-g(7,8-二氢-8-氧代-鸟嘌呤)可用于保留一级模板分子(p7序列)。
图6描绘了使用上面例示的靶多核苷酸设计的第一和第二轮kea。特征通过靶多核苷酸的右端和左端的影线平面标记显示。附着于特征的是捕捉引物,表示为p5和p7。装饰捕捉引物的椭圆形表示包含ssb蛋白质。这些捕捉引物与靶多核苷酸的靶区域侧翼的p5'和p7'捕捉引物结合区互补。与附着的靶分子相邻或接近的p7捕捉引物结合区不与p7相同或互补,从而防止或减少kea期间的链侵入。如图6所示,与p7捕捉引物互补的p5-sbs3-phix-sbs8'-p7'的规则或标准链将在kea期间进行指数扩增,以消耗特征,如纳米孔上的p5/p7引物。相比之下,从突变或错配的链的p7端将会抑制链侵入。因此,附着于靶多核苷酸的靶分子将与基底结合的扩增子保持杂交。
因此,使用如上文例示的第一对捕捉引物,本文提供的方法可以采用图案化基底,如流动池的每个特征或孔的单一靶多核苷酸的初始捕捉和固定化。初始靶多核苷酸捕获可以继之以单一靶多核苷酸的初步扩增来产生特征内靶多核苷酸扩增子的单克隆群体,例如通过kea产生。具有附着靶分子的初始靶多核苷酸将通过例如与靶分子远端的末端固定化的捕捉引物杂交而保持固定化到特征。
此外,本文提供的方法可以采用先前所述的任何组分,例如捕捉引物,捕捉引物结合区,靶多核苷酸,靶分子等,参考本文提供的基底,或其任何组合。例如,这些组分可以与例示的错配捕捉引物结合区设计和等温扩增方法一起采用,该等温扩增方法以超过靶多核苷酸到特征的平均转运速率的平均扩增速率扩增至少一种靶多核苷酸,以产生本文所述的基底的任何构造,其至少具有附着于固定化到特征的靶分子的靶多核苷酸。
因此,本文提供的方法可以使用上述任何例示性基底进行,包括例如可以附着生物分子(包括例如多核苷酸)的任何形状的任何不溶性固体支持物,半固体支持物或基质。例示性的固体支持物包括如前所述的玻璃,改性玻璃,官能化玻璃,无机玻璃,微球(例如惰性和/或磁性颗粒),塑料,尼龙,基于二氧化硅的材料等。
另外,例如,本文提供的方法可以使用包括流动池的基底进行,例如,如us2010/0111768a1或bentleyetal,nature456:53-59(2008)中所述以及先前例示的。
这里提供的方法可以在基底上的一个或多个特征上进行,包括例如孔,坑,通道,脊,凸起区域,钉,柱,珠,金属等,如先前参考本文提供的基底所述。在一些实施方案中,将至少一种靶分子置于特征上的方法可以利用孔作为特征,并且可以包括如us2014-0243224中所述并且先前描述的凝胶材料。
本文提供的方法可以利用具有固定化到基底上的特征的第一和第二捕捉引物的基底。第一和第二捕捉引物可以是多个第一捕捉引物和多个第二捕捉引物。在一些实施方案中,第一和第二捕捉引物可以针对靶多核苷酸的不同序列,因此对靶多核苷酸的不同区域表现出特异性。在其它实施方案中,第一和第二捕捉引物可以针对不同的靶多核苷酸。图2中描述了可以在用于在特征上放置至少一个靶分子的方法中的例示性基底,如先前所述。
在本文提供的方法中使用的两种或更多种捕捉引物可以以任何比率存在于特征中。例如,多个第一捕捉引物和多个第二捕捉引物可以以大约相同的量或以任何其它比率,例如摩尔比存在,包括例如相对于第二捕捉引物,大于1.1x至大于1,000x过量的第一捕捉引物,如先前例示的。类似地,采用多个特征的本文提供的方法,不同特征可以具有两个或更多个捕捉引物的相同比率或不同比率。
简言之,例如,在特征上放置至少一个靶分子的方法中使用的捕捉引物可以包括一个或多个捕捉区域,包括例如通用捕捉区域,测序引物结合位点(sbs),靶物特异性捕获区,预定的切割位点,如限制性位点,以及接头区,例如分离捕捉引物的两个或更多个区域的接头区域。捕捉引物可以使用先前例举的任何设计,如通用捕捉区域和sbs,包括p5,p5',p7,p7',sbs3,sbs3',sbs8和sbs8'的任何组合和/或任何其它序列,其是足够独特的以发挥通用引物,测序引物或任何其它序列如衔接头的功能。
因此,本文提供的方法可以采用第一和第二捕捉引物,其固定化到可以包括任何捕捉区域或捕捉区域的任何组合的特征。例如,第一捕捉引物可以包括第一通用捕捉区域,并且第二捕捉引物可以包括相同的通用捕捉区域或第二通用捕捉区域。第一和第二捕捉引物可进一步包括相同或不同的sbs。例如,第一捕捉引物可以包括第一通用捕捉引物区域和第一sbs,第二捕捉引物可以包括第二通用捕捉区域和第二sbs。
本文提供的方法可以利用固定化到特征的多个捕捉引物,如先前参考由本文提供的方法制成的基底所述。多个可以是单一多个(singleplurality)、多个第一捕捉引物和多个第二捕捉引物。或者或另外,本文提供的方法可以使用多个第三,第四,第五和/或第六或更多捕捉引物。包括的多个捕捉引物的数目将取决于如先前例示的应用。多个可以是两个或更多个成员的群体,包括例如多个是2,3,4,5,6,7,8,9,10,20,30,40,50,60,70,80,90或100或更多不同的群体成员的。在其它实施方案中,多个是200,300,400,500,1000,5000,100,000,50000,1x105,2x105,5x105,4x105,5x105,6x105,7x105,8x105,9x105,1x106,2x106,3x106,5x106,6x106,7x106,8x106,9x106或1x107,或更多不同的成员以及之前例示的多个的其它成员之任一。多个可以包含不同的成员,类似的成员和/或相同的成员,包括例如来自至少1%直至并且包括99%或更多的成员的不同的,相似的和/或相同的成员的任何组合的混合物。
本文提供的方法可用于在特征上固定化至少一种靶多核苷酸,其在一端附着至捕捉引物。本文提供的方法还可用于在特征上固定化单一靶多核苷酸,其在一端附着于捕捉引物。虽然本文中参考至少一个靶多核苷酸的附着或参照一端附着到固定化到特征的捕捉引物的单一靶多核苷酸描述,但是应当理解在其它实施方案中,本文提供的方法可以用于固定化两个或更多个靶多核苷酸,其一端附着于固定化到特征的捕捉引物。在这些其它实施方案中,靶多核苷酸的数目可以是例如2,3,4,5,6,7,8,9,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95或100或更多不同的靶多核苷酸。或者或另外,本文提供的方法可用于固定例如2至100个或更多相同,相似或不同的靶多核苷酸,包括其混合物,如先前例示的。
先前例示的靶多核苷酸中的任何一种可以在将至少一种靶分子置于特征上或本文提供的多个特征中的每个上的方法中采用。因此,本文提供的方法中的靶多核苷酸可以包含两个或更多个核苷酸,包括例如核糖核苷酸,脱氧核糖核苷酸,锁定核酸(lna),肽核酸(pna)或其任何组合。靶多核苷酸可以包含嘌呤碱基,嘧啶碱基,嘌呤和嘧啶碱基两者,天然的,化学修饰的,生物化学修饰的,非天然的或衍生化的核苷酸碱基,一个或多个配对核苷酸碱基。本文提供的方法中采用的靶多核苷酸可以是双链核酸,如dsdna,dsrna,双链dna/rna杂合物,并且还可以包括或更多未配对的核苷酸碱基。单链靶多核苷酸也可以在本文提供的方法中采用,如先前所例示的。因此,靶多核苷酸可以是任何期望类型的多核苷酸,序列或多核苷酸和/或序列的类型的混合物。
类似地,本文提供的方法中采用的靶多核苷酸可以包含一个或多个如前列出的靶多核苷酸酸区,包括例如捕捉引物结合区,靶区域,引物结合区,条形码区域,接头区域和/或衔接头区域。一个或多个靶多核苷酸酸区可以是多个靶多核苷酸酸区域,包括例如1,2,3,4,5,6,7,8,9或10个或更多个靶多核苷酸区域。包含两个或更多个靶多核苷酸酸区的例示性靶多核苷酸在图3a-d中描述,如前所述。
本文提供的方法可以采用靶多核苷酸或靶多核苷酸区(靶多核苷酸或其区域),其包括例如靶区域,捕捉引物结合区和/或具有两个或更多个核苷酸的本文中描述或本领域技术人员公知的其它区域。其它长度包括2至100个或更多个核苷酸以及直至10000个或更多个核苷酸以及先前所例示的各种大小中的任何一种。
在特征上放置至少一种靶多核苷酸的方法可以采用靶多核苷酸或其区域,其包含前面列出和/或例示的各种长度中任何一种的双链多核苷酸,包括例如,2,25,150,1100,10000或更多的碱基对以及其间的所有整数。
本文提供的方法可以采用双链靶多核苷酸或其区域,其包含其捕捉引物区的区域,可以包含任何数目的错配。特别有用数目的错配包括例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19或20或更多个与其互补序列或者例如捕捉引物或其它捕获剂的错配。这种错配在图4和6中例示,并且就通过本文提供的方法产生的基底而言描述。
如先前关于本文提供的基底例示的,本公开的方法可以采用包含具有一个或多个捕捉引物结合区的一个或多个区域的靶多核苷酸。捕捉引物结合区可以位于靶多核苷酸酸区域的5'端,3'末端或5'和3'末端,或者备选或另外它可以位于在靶多核苷酸的内部区域。靶多核苷酸可以包含两个或多个捕捉引物结合区,直到任何数目的捕捉引物区域适用于任何期望的目的。类似地,与相应的捕捉引物一样,捕捉引物结合区可以包括一个或多个捕捉引物结合区,包括例如通用捕捉引物结合区,测序引物结合位点(sbs),靶物特异性捕捉引物结合区,预定的切割位点,如限制性位点,以及接头区域,例如分离捕捉引物结合区域的两个或更多个区域的接头区域。任何和所有可能的组合和排列可以在本文提供的如先前例示的方法中采用。例如,本文提供的方法可以采用先前例示的任何捕捉引物结合区域设计,如通用捕捉区域和sbs,包括p5,p5',p7,p7',sbs3,sbs3',sbs8'和/或任何其它序列的任何组合,所述任何其它序列是足够独特的以发挥通用引物,测序引物或任何其它序列如衔接头的功能。捕捉引物结合区的长度可包括5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,35,40,45,50,55,60,65,70,75,80,85,90,95或100个或更多个核苷酸,以及400下至100或更少个核苷酸,如关于通过本文提供的方法产生的基底所例示的。
靶多核苷酸的捕捉引物结合区可以与捕捉引物为100%互补。本文提供的方法中采用的靶多核苷酸的捕捉引物结合区可以例如与捕捉引物是至少60%,65%,70%,75%,77%,80%,82%,85%,87%,90%,92%,95%或97%或更多互补,包括例如包含与捕捉引物的1,2,3,4,5,6,7,8,9或10个或更多个核苷酸错配。除了一个或多个捕捉引物结合区之外,靶多核苷酸可以包括一个或多个靶区域,包括两个或更多个靶区域,如先前所例示。靶区域的大小或长度可以是上文关于靶多核苷酸或靶多核苷酸区域所例示的任何长度。
本文提供的方法可以通过例如附着到靶多核苷酸将至少一个靶分子置于基底的特征上,所述靶多核苷酸可以例如附着于捕捉引物。本文提供的方法还可以将多个两个或更多个靶分子置于如前面例示的每个参考情况中,包括例如2,3,4,5,6,7,8,9,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,250,500,1,000,5,000,10,000或更多不同,相同和/相似的靶分子,如前例示。靶分子与靶多核苷酸,捕捉引物,特征和/或基底的附着可以是共价或非共价的。
除通过上述构造固定化的至少一种靶分子之外,本文提供的方法还可以在基底上的特征或多个特征上产生靶多核苷酸的多个扩增子,如图4和6中例示。多个扩增子可以最小程度地填充特征,部分填充特征或填满基底上的特征。因此,扩增子密度可以是低,中等或高。靶多核苷酸设计,生成这种扩增子的方法和控制密度的方法下文参考在基底的特征上放置至少一个靶分子的方法进一步描述。扩增子的密度如本文所述。
本文提供的用于在基底或特征上单分子放置靶分子的方法可以利用任何期望的分子。靶分子的例示性类别包括例如多肽,多核苷酸,碳水化合物,氨基酸,核苷酸,单糖,半抗原,配体,抗原,分析物,小分子有机化合物或无机化合物。下文进一步描述了对于上述类别中的每个的例示性种类。先前已经描述了这些类别中的每个的例示性种类,其中每一种可以在本文提供的方法中同样地采用以生成本文中提供的基底,如先前描述。
作为例示,本文提供的方法中采用的靶分子可以包括例如任何大小或活性并且含有任何天然或非天然氨基酸的多肽;核糖体多肽,包括但不限于酶,受体,抗体,转录因子,激素,配体,抗原和半抗原;非核糖体肽,包括但不限于毒素,铁载体,色素,抗生素,抗生素前体,细胞抑制剂和免疫抑制剂;包括mspa,外膜磷脂酶a(ompa),ompc,ompf,ompg,奈瑟氏球菌(neisseria)自身转运蛋白(nalp),wza,clya毒素,α-溶血素,炭疽毒素,短杆菌肽a,麦芽糖孔蛋白,phoe,tsx,f-pilus,sp1,线粒体孔蛋白(vdac),tom40,杀白细胞素和dna折纸纳米孔;如先前例示的抗生素;如先前例示的毒素;激素,如先前例示的激素;半抗原,包括但不限于苯胺,邻氨基苯甲酸,间氨基苯甲酸,对氨基苯甲酸,uroshiol,奎宁,肼苯哒嗪,荧光素,生物素,地高辛配基(digoxigenin)和二硝基苯酚;受体,包括例如受体可以来自免疫细胞或非免疫细胞,如先前所例示的;细胞因子如先前例示的趋化因子,干扰素,白细胞介素,淋巴因子,肿瘤坏死因子(tnf)和神经肽;任何类型的酶,包括例如先前例示的代谢酶,聚合酶,连接酶,逆转录酶,核酸酶,解旋酶和转座酶;如先前所例示的抗体或抗体片段;多核苷酸或寡核苷酸,包括例如先前例示的任何长度或序列的dna或rna;无机化合物,包括但不限于碳化物,碳酸盐,碳的简单氧化物(例如co和co2),氰化物量子点,金属纳米颗粒,金属氧化物纳米颗粒等,矿物质,硫化物,有机金属化合物和生物有机物化合物和矿物质,如先前例示;如先前例示的小分子;代谢物,包括但不限于生物碱,糖苷,脂质,非核糖体肽,例如放线菌素d,吩嗪,天然酚(包括类黄酮),聚酮化合物,萜烯,包括类固醇和四吡咯;治疗剂,包括例如有机化合物,无机化合物,肽,激素,小分子,抗体,抗原,半抗原或其任何组合。如前所述,治疗剂可以是解热药,镇痛药,抗疟药,抗生素,防腐剂,情绪稳定剂,激素替换,口服避孕药,兴奋剂,安定药,抗病毒药,抗癌药,免疫抑制剂和他汀类。
在一些实施方案中,本文提供的方法可用于将至少一个靶分子放置在基底上的多个特征中的每个中或(本文中也称为阵列或特征阵列),如图5中所示的多个特征。例如,本文提供的方法可以与具有多个特征的基底一起使用,该特征以任何特殊图案排列,如先前例示的,包括例如点或斑块的网格,重复图案,不规则非重复图案,六边形图案,直线图案,网格图案,具有反射对称性的图案,具有旋转对称性的图案等。特征可以是先前例示的各种密度中的任何一种,例如从至少约10个特征/cm2至约5,000,000个特征/cm2或更高。在本文提供的方法中采用的阵列的特征面积可以各自具有大于约100nm2至约500μm2的面积以及其间的任何面积。阵列基底表面上的特征可以是不连续的,由表面的间隙区域分隔开。在具体实施方案中,所述方法与在包括例如微孔或纳米孔的表面(例如孔)中为凹特征的特征一起使用,并且特征可以包含如先前所例示的凝胶材料。制备和使用含有特征(如孔)的凝胶的基底的方法和组合物列于例如us2014/0243224中,其通过引用并入本文。方法可以用具有高密度,中等密度或低密度的特征的阵列进行,如前所述。本文描述的方法可以用作为珠或在孔中的珠的特征进行。珠可以由将多核苷酸固定化到表面的任何材料组成,包括但不限于塑料,陶瓷,玻璃,聚苯乙烯,碳石墨等,以及本文概述的用于固体支持物的任何其它材料都可以使用。
在一些实施方案中,提供的方法用于在特征上或在多个特征中的每个中放置至少一个靶分子,其中特征大小选自有利于动力学排除扩增(kea)和特征中形成单分子放置的范围。如先前通过参考纳米孔所例示,孔直径可以在约30nm至约1μm之间,约50nm至约800nm之间,约70nm至约600nm之间或在约100μm和约400nm之间变化。在一些实施方案中,该孔具有约400nm的直径。在一些实施方案中,孔具有小于约1μm的直径。
作为例示,在一个具体的实施方案中,本文中公开的方法可以包含(a)将多个第一捕捉引物附着于表面;(b)将多个第二捕捉引物附着于表面;并且(c)将双链靶多核苷酸附着于第二捕捉引物的第二捕捉引物,其中(i)双链靶多核苷酸包含第一亲本链和第二亲本链;(ii)双链靶多核苷酸包含第一和第二亲本链中的第二捕捉引物结合区;(iii)第一亲本链的第二捕捉引物结合区与多个第二捕捉引物的第二捕捉引物是100%互补的;并且(iv)第二亲本链的第二捕捉引物结合区与多个第二捕捉引物的第二捕捉引物是至少100%相同的。方法可以进一步包括将靶分子附着于靶多核苷酸。可以将靶分子附着于靶多核苷酸,之后将靶多核苷酸附着于第二捕捉引物。可以在将多个第二捕捉引物附着于表面前发生将多个第一捕捉引物附着于表面。或者,可以与将多个第二捕捉引物附着于表面同时发生将多个第一捕捉引物附着于表面。靶多核苷酸可以进一步包含第一捕捉结合区。第一捕捉结合区的至少一条链可以与多个第一捕捉引物的第一捕捉引物杂交。方法可以进一步包括生成多个扩增子。多个扩增子可以包含靶多核苷酸的拷贝。可以通过进行扩增反应生成多个扩增子。扩增反应可以包含第一重组酶聚合酶扩增(rpa)。第一rpa可以包含延伸与靶多核苷酸杂交的第一捕捉引物和第二捕捉引物以生成靶多核苷酸的多个第一扩增子。可以通过进行多个一个或多个另外的扩增反应生成扩增子。一个或多个另外的扩增反应可以包含一个或多个另外的重组酶聚合酶扩增(rpa)。一个或多个另外的rpas可以包含(a)将多个捕捉引物的一个或多个第一捕捉引物附着于多个第一扩增子的一个或多个扩增子;并且(b)延伸一个或多个第一捕捉引物以生成多个另外的扩增子。一个或多个另外的rpa可以包含(a)延伸多个第二捕捉引物的一个或多个第二捕捉引物;并且(b)延伸一个或多个第二捕捉引物以生成多个另外的扩增子。在一些实例中,第二捕捉引物不与含有第二亲本链的互补物的扩增子杂交。在一些实例中,第二捕捉引物不与扩增子的第二捕捉引物结合区杂交,所述扩增子是第二亲本链的第二捕捉引物结合区的互补物。
图7中描绘了生成基底的例示性方法。如图7的步骤1中所示,使包含多个第一捕捉引物(707,711,714)和多个第二捕捉引物(708,713,715)的表面(706)与靶多核苷酸(701)接触。靶多核苷酸(701)包含第一亲本链(703)和第二亲本链(702)。第一亲本链(703)和第二亲本链(702)含有第一捕捉引物结合区(717)和第二捕捉引物结合区(718)。在第二捕捉引物结合区(718)内,存在有第一亲本链(703)和第二亲本链(702)之间的错配区。第二亲本链(702)的第二捕捉引物结合区(718)含有与多个第二捕捉引物(708,713,715)的第二捕捉引物的至少一个核苷酸差异(704)。第一亲本链(703)的第二捕捉引物结合区(718)与多个第二捕捉引物(708,713,715)的第二捕捉引物是100%互补的。如步骤2中所示,多个第一捕捉引物(707,711,714)的第一捕捉引物(707)与第二亲本链(702)的第一捕捉引物结合区(717)杂交。多个第二捕捉引物(708,713,715)的第二捕捉引物(708)与第一亲本链(703)的第二捕捉结合区(718)杂交。如步骤3中所示,扩增第一和第二亲本链以生成第一多个扩增子。第一捕捉引物(707)置换第一亲本链(703),并且延伸以生成第二亲本链(709)的扩增子。第二亲本链(709)的扩增子含有第二亲本链的互补物。因此,第二亲本链(709)的扩增子含有第二亲本链(702)的第二捕捉引物结合区(718)的互补物。如也在步骤3中所示,第二捕捉引物(708)置换第二亲本链(702),并且延伸以生成第一亲本链(710)的扩增子。如步骤4中所示,进行一个或多个另外的扩增反应以生成第二多个扩增子。在步骤4a中,第一捕捉引物(711)与第二亲本链的第一捕捉引物结合区杂交,并且置换第一捕捉引物(707)。在步骤4b中,第二捕捉引物(713)试图与第二亲本链(709)的扩增子的第二捕捉引物结合区杂交。
然而,由于第二亲本链(709)的扩增子的第二捕捉引物结合区是第二亲本链的第二捕捉引物结合区的互补物,第二亲本链(709)的扩增子的第二捕捉引物结合区不与第二捕捉引物(711)是100%互补的。第二捕捉引物(711)不能从第二亲本链置换第二亲本链(709)的扩增子。因此,含有与第二亲本链的第二捕捉结合区互补的第二捕捉引物结合区的第二亲本链的扩增子不能起模板作用以延伸第二捕捉引物。如步骤4c中所示,由于第一亲本链(710)的扩增子的第一捕捉引物结合区与第一捕捉引物(714)是100%互补的,第一捕捉引物(714)可以置换第一亲本链(703),并且与第一亲本链(710)的扩增子的第一捕捉引物结合区杂交。第一亲本链(710)的扩增子可以充当模板以延伸第一捕捉引物(714)。如步骤4d中所示,第二捕捉引物,第二捕捉引物(715)可以与第一亲本链(703)的第二捕捉引物结合区杂交,从而置换第二捕捉引物(708)。如步骤5中所示,可以延伸第一捕捉引物(711)以生成第一亲本链(716)的扩增子。也在步骤5中显示,可以延伸第一捕捉引物(714)以生成第一亲本链(717)扩增子的扩增子。也在步骤5中显示,可以延伸第二捕捉引物(715)以生成第一亲本链(718)的扩增子。
因而,本公开提供了将单一靶分子置于基底的特征上的方法。方法包括:(a)杂交固定化到基底上的特征的多个第一和第二捕捉引物与至少一个靶多核苷酸,所述靶多核苷酸包含侧翼有与所述第一和第二捕捉引物互补的第一和第二捕捉引物结合区的靶区域,其中所述第二捕捉引物结合区包含与所述第二捕捉引物的碱基对错配并且与靶分子连接,(c)以平均扩增速率扩增所述至少一种靶多核苷酸以产生与所述靶多核苷酸互补的多个克隆扩增子,所述平均扩增速率超过靶多核苷酸至特征的平均转运速率。方法可以利用具有一个特征或多个特征的基底。一个或多个特征可以是珠,孔,包括微孔或纳米孔,通道,脊,突起或其组合。方法可以在特征或多个特征的每个中放置至少一个靶分子,包括单一靶分子。方法可以用靶多核苷酸的多个克隆扩增子填满一个或多个特征。多个特征之间的间隙区可以缺乏靶多核苷酸。方法可以与具有多个特征,包括两个或更多个特征的基底一起使用,并且可以在多个内的不同特征之每个中放置不同单一靶分子。方法可以与选自下组的靶多核苷酸一起使用:rna,dna,pna或双链dna(dsdna)。由本文中提供的方法的靶多核苷酸使用的长度可以小于1,000个核苷酸和/或它可以是10至25,26至50,51至100,101至200,201至300,301至400,401至500,501至600,601至700,701至800,801至900,或901至1000个核苷酸。通过方法置于一个或多个特征上的靶分子可以是多肽、多核苷酸、碳水化合物、氨基酸、核苷酸、单糖、半抗原、配体、抗原、分析物、小分子有机化合物或无机化合物。多肽靶分子可以是纳米孔、结合多肽和酶。纳米孔可以是mspa、ompf、ompg、nalp、wza、clya毒素、α-溶血素、炭疽毒素、杀白细胞素和dna折纸纳米孔。结合多肽可以是抗体、fab、fab'、f(ab')2、scfv、双抗体、三抗体、微型抗体和单域抗体(sdab)或t细胞受体。酶可以是聚合酶、解旋酶、重组酶、转座酶或连接酶。方法可以与选自下组的一个或多个材料的基底一起使用:玻璃、硅、塑料或生物聚合物。基底可以进一步包含水凝胶或共价连接的凝胶。
具有特征中的单一靶分子或在多个特征中的每个中具有单个靶分子的本公开的基底可用于询问单分子实体。待询问的一个或多个分子可以在溶液中,并且固定化的靶分子可以用于确定待询问的一个或多个分子的特征。例如,单个多核苷酸或多个单个多核苷酸的序列可以通过纳米孔测序确定,其中纳米孔对应于固定化的靶分子。或者,待询问的一个或多个分子可以是固定化的靶分子,并且溶液中的一个或多个分子可用于探测或确定每个固定的靶分子的特征。例如,固定化的靶分子可以是不同酶变体的文库,并且溶液中的探针可以是基底或多个不同的基底,以确定每种不同酶变体的催化特性。也可以使用相反的方向,其中基底例如对应于特征上的固定化的靶分子,并与不同的酶变体接触以测量催化特性。鉴于本文提供的教导和指导,本领域技术人员将理解,在本文提供的基底中可以使用大量不同的靶分子来询问或被询问以确定一种或多种分子特征。例示性特征包括例如确定多核苷酸序列,多肽序列,结合活性,催化活性等。
作为关于测序的进一步的例示,一些实施方案可以利用纳米孔测序(deamer,d.w.&akeson,m."nanoporesandnucleicacids:prospectsforultrarapidsequencing."trendsbiotechnol.18,147-151(2000);deamer,d.andd.branton,"characterizationofnucleicacidsbynanoporeanalysis".acc.chem.res.35:817-825(2002);li,j.,m.gershow,d.stein,e.brandin,andj.a.golovchenko,"dnamoleculesandconfigurationsinasolid-statenanoporemicroscope"nat.mater.2:611-615(2003),其公开内容通过引用整体并入本文)。在此类实施方案中,待测序的多核苷酸通过纳米孔。纳米孔可以是合成孔或生物膜蛋白,如α-溶血素。当靶核酸通过纳米孔时,可以通过测量孔的电导率的波动来鉴定每个碱基对。(u.s.pat.no.7,001,792;soni,g.v.&meller,"a.progresstowardultrafastdnasequencingusingsolid-statenanopores."clin.chem.53,1996-2001(2007);healy,k."nanopore-basedsingle-moleculednaanalysis."nanomed.2,459-481(2007);cockroft,s.l.,chu,j.,amorin,m.&ghadiri,m.r."asingle-moleculenanoporedevicedetectsdnapolymeraseactivitywithsingle-nucleotideresolution."j.am.chem.soc.130,818-820(2008),其公开内容通过引用整体并入本文)。从纳米孔测序获得的数据可以如本文所述进行存储,处理和分析。特别地,可以根据本文所阐述的光学图像和其它图像的例示性处理将数据作为图像处理。
这里的方法也可用于分子结合亲和力筛选。在实施方案中,单分子抗体可以锚定在本文所述的基底上。单抗原结合事件可以通过荧光染色检测。荧光染色技术包括本领域公知的技术,包括例如illuminainfinium测定或elisa(酶联免疫吸附测定)技术。在某些实施方案中,可以通过计数单分子荧光点(本领域中已知的此类技术)来定量分析溶液中抗原的浓度。(t.blicharz,etal."fiber-opticmicrospherebeadantibodyarrayfortheanalysisofinflammatorycytokinesinsaliva"anal.chem.2009,81,2106.)。在实施方案中,本文所述的方法适用于体外诊断。
本文中列出的方法的优点在于它们提供并行地快速且有效地检测多个靶核酸。因此,本公开提供了能够使用本领域已知的技术,例如上面例示的那些技术制备和检测核酸的集成系统。因此,本公开的集成系统可以包括能够将扩增试剂和/或测序试剂递送到一个或多个固定化靶分子的流体组件,所述系统包括诸如泵,阀,储存器,流体管线等的组件。可以在集成系统中配置和/或使用流动池进行询问。例示性的流动池描述于例如us2010/0111768a1和usser.no.13/273,666,其各自通过引用并入本文。如对流动池所例示的,集成系统的一个或多个流体组件可用于询问中的不同步骤。以结合反应实施方案为例,集成系统的一种或多种流体组件可用于结合步骤和用于检测的试剂的递送。或者,集成系统可以包括单独的流体系统以执行结合步骤并实施检测方法。能够产生扩增核酸并也确定核酸序列的集成测序系统的实例包括但不限于miseqtm平台(illumina,inc.,sandiego,ca)和usser.no.13/273,666,其通过引用并入本文。
本文中进一步公开了试剂盒,其包含本文中公开的任何基底。试剂盒可以包含(a)包含特征的基底,其中特征包含(i)多个第一捕捉引物;和(ii)多个第二捕捉引物;和(b)包含第一双链靶多核苷酸区的靶多核苷酸,其中(i)第一双链靶多核苷酸区包含第二捕捉引物结合区;(ii)第二捕捉引物结合区的第一链与第二捕捉引物的第二捕捉引物是100%互补的;并且(iii)第二捕捉引物结合区包含第一链和第二链之间的至少一个核苷酸错配。
试剂盒可以包含含有特征的基底,其中特征包含(a)多个第一捕捉引物;(b)多个第二捕捉引物;和(c)靶多核苷酸,其包含第一双链靶多核苷酸区,其中(i)第一双链靶多核苷酸区包含第二捕捉引物结合区;(ii)第二捕捉引物结合区的第一链与第二捕捉引物的第二捕捉引物是100%互补的;并且(iii)第二捕捉引物结合区包含第一链和第二链之间的至少一个核苷酸错配。
试剂盒可以包含(a)包含特征的基底,其中所述特征包括(i)多个第一捕捉引物;和(ii)多个第二捕捉引物;和(b)靶多核苷酸,其包含第一双链靶多核苷酸区和第二双链靶多核苷酸区,其中(i)第一双链靶多核苷酸区包含第二捕捉引物结合区;(ii)第二捕捉引物结合区的第一链与第二捕捉引物的第二捕捉引物100%互补;以及(iii)第二捕捉引物结合区包括第一链和第二链之间的至少一个核苷酸错配。第二双链靶多核苷酸区可以包含第一捕捉引物结合区。
试剂盒可以包含(a)包含特征的基底,其中所述特征包括(i)多个第一捕捉引物;和(ii)多个第二捕捉引物;和(b)第一靶多核苷酸,其包含第一双链靶多核苷酸区,其中(i)第一双链靶多核苷酸区包含第二捕捉引物结合区;(ii)第二捕捉引物结合区的第一链与第二捕捉引物的第二捕捉引物100%互补;以及(iii)第二捕捉引物结合区包括第一链和第二链之间的至少一个核苷酸错配;和(c)包含第二双链靶多核苷酸区的第二靶多核苷酸区。第二双链靶多核苷酸区可以包含第一捕捉引物结合区。
本文中公开的试剂盒可以包含基底,如图2中描绘。如图2中所示,试剂盒可以包含基底(201),其包含(a)多个第一捕捉引物(202,203,204);(b)多个第二捕捉引物(205,206,207);(c)靶多核苷酸(208);(d)靶分子(209);和(e)多个扩增子(210,211,212,213,214)。
本文中公开的试剂盒可以包含基底,如图5中描绘。如图5中所示,试剂盒可以包含基底(501),其包含(a)第一特征(502),所述第一特征包含(i)第一多个第一捕捉引物(504,505,506);(ii)第一多个第二捕捉引物(507,508,509);(iii)第一靶多核苷酸(510);(iv)第一靶分子(511);和(v)第一多个扩增子(512,513,514,515,516);和(b)第二特征(503),所述第二特征包含(i)第二多个第一捕捉引物(520,521,522);(ii)第二多个第二捕捉引物(523,524,525);(iii)第二靶多核苷酸(526);(iv)第二靶分子(527);和(v)第二多个扩增子(528,529,530,531,532)。
图8a-b中例示了本文中公开的试剂盒的例示性组分。如图8a中所示,试剂盒可以包含(a)基底(801),其包含(i)多个第一捕捉引物(802,803,804);和(ii)多个第二捕捉引物(805,806,807);和(b)靶多核苷酸(808)。如图8b中所示,试剂盒可以进一步包含一个或多个另外的靶多核苷酸(809)、扩增子(810)、靶分子(811)或其组合。
本文中公开的任何试剂盒的靶多核苷酸可以进一步包含一个或多个本文中公开的靶多核苷酸区。例如,靶多核苷酸可以进一步包含第二靶多核苷酸区,其包含第一捕捉引物结合域。第一捕捉引物结合区可以与多个第一捕捉引物的第一捕捉引物杂交。在另一个实例中,靶多核苷酸可以进一步包含另外的靶多核苷酸区,其包含靶区域。靶多核苷酸可以包含一个或多个另外的靶多核苷酸区,其包含条形码、引物结合区、接头区、衔接头区域或其组合。
本文中公开的任何试剂盒的靶多核苷酸可以是基底的部分。例如,靶多核苷酸可以附着于基底的第二捕捉引物。或者,本文中公开的任何试剂盒的靶多核苷酸可以与基底分开。例如,试剂盒可以包含含有基底的第一容器和含有靶多核苷酸的第二容器。
本文中公开的试剂盒可以进一步包含靶分子。靶分子可以是本文中公开的任何靶分子。例如,靶分子可以是纳米孔。靶分子可以附着于靶多核苷酸。靶分子可以是基底的部分。例如,靶分子可以附着于靶多核苷酸,其附着于基底的第一捕捉引物或第二捕捉引物。或者或另外,靶分子不附着于靶多核苷酸.例如,试剂盒可以包含含有靶多核苷酸的第一容器和含有靶分子的第二容器。可以给靶分子提供基底。例如,试剂盒可以包含含有基底和靶分子的第一容器和包含靶多核苷酸的第二容器。或者,试剂盒可以包含含有基底、靶多核苷酸和靶分子的第一容器。
试剂盒可以进一步包含多个扩增子。多个扩增子可以是基底的部分。例如,多个扩增子可以附着于多个第一引物、多个第二引物、或其组合。扩增子可以是靶多核苷酸的拷贝。
本文中公开的任何试剂盒的基底可以包含两个或更多个特征。
应当理解,本文提供的本发明的定义中也包括实质上不影响本发明的各种实施方案的活性的修饰。因此,以下实施例旨在说明而不是限制本发明。
实施例
使用错配的捕捉引物结合区的动力学排除扩增
该实施例显示错配的捕捉引物结合区防止在错配的靶多核苷酸末端的重组酶聚合酶扩增(rpa)。
为了证实捕捉引物结合区和捕捉引物之间的错配碱基对可以阻止rpa反应,使用商业试剂盒twistdx根据制造商的用法说明,在rpa反应中采用图9所示的靶多核苷酸和捕捉引物。简言之,靶多核苷酸采用侧翼有称为标准(std)或错配(msm)的捕捉引物区的约500bpphix靶区域。通过设计,引物组p5-std/p7-std与靶多核苷酸phix-std中的捕捉引物结合区互补,并且p5-msm/p7-msm与靶多核苷酸phix-msm中的捕捉引物结合区互补。p5-std/p7-std具有与模板phix-msm错配的3bp,而p5-msm/p7-msm与模板phix-std具有3bp错配。
将含有phix靶分子5e-16mol的phix靶物(13.2ul)与2.4μl10μm匹配或错配引物混合,然后用twistdx再水合(rehybdration)缓冲液29.5μl添加。将上述溶液转移到twistdx反应团粒并通过移液管混合。通过添加2.5μl280mm乙酸镁开始反应,并使其反应8至10分钟。通过pcr产物纯化过程停止反应进行凝胶分析。
通过kea反应,通过凝胶电泳(2%e-gel电泳,lifetechnologies)分离扩增子,并且结果示于图10中。简言之,与互补捕捉引物-捕捉引物结合区组合,例如p5-msm/p7-msm加上phix-msm的rpa反应导致扩增子形成的良好产率。然而,在rpa反应中错配的捕捉引物-捕捉引物结合区组合没有产生或导致500bp扩增子产物的低产率。
这些结果证实,错配设计可以有效地停止靶多核苷酸错配末端的rpa反应。
在本申请中,各种出版物已经在括号内提及。这些出版物的全部内容(包括genbank和gi号出版物)在此通过引用并入本申请中,以便更充分地描述本发明所属领域的状态。
虽然已经参照所公开的实施方案描述了本发明,但是本领域技术人员将容易地理解,上面详述的具体实施例和研究仅仅是对本发明的说明。应当理解,在不脱离本发明的精神的情况下,可以进行各种修改。因此,本发明仅由权利要求书限定。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于荧光PCR检测ESR1基因突变的引物及探针的制造方法与工艺
- 一种用于检测乳制品中荧光假单胞菌的分子标记及其应用的制造方法与工艺
- 一种用于检测水产品中副溶血弧菌的分子标记及其应用的制造方法与工艺
- 一种用于检测草莓灰霉病菌的分子标记及其应用的制造方法与工艺
- 一种用于检测B族链球菌四环素耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测粪肠球菌庆大霉素耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测奶牛乳腺炎性金黄色葡萄球菌青霉素耐药基因的分子标记及其应用的制造方法与工艺
- 与甘蓝叶片表皮毛有无紧密相关的分子标记及其应用的制造方法与工艺
- 检测黄杉大小蠹的引物、试剂盒及检测方法与流程
- 一种用于紫斑牡丹与中原牡丹的分子鉴定方法与流程